A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ביו-ריאקטור רב-שלבי להערכת היכולת הדלקתית וההתחדשותית של ביו-חומרים תחת זרימה ומתיחות
* These authors contributed equally
In This Article
Summary
מטרת הפרוטוקול הזה היא לבצע תרבות משותפת דינמית של מקרופאגים אנושיים ומיופיברובלסטים בפיגומי אלקטרו-ספון צינוריים כדי לחקור התחדשות רקמות מונחית חומרים, באמצעות ביו-ריאה המאפשרת ניתוק של לחץ גיסת ומתיחות מחזוריות.
Abstract
השימוש בביו-חומרים הניתנים למיחזור כדי לגרום להתחדשות ישירות בגוף הוא אסטרטגיה אטרקטיבית מנקודת מבט תרגומית. חומרים כאלה גורמים לתגובה דלקתית עם ההשתלה, שהיא המניע לספיגה מחדש של החומר והתחדשות של רקמה חדשה. אסטרטגיה זו, הידועה גם בשם הנדסת רקמות situ, הוא נרדף כדי להשיג תחליפי לב וכלי דם כגון שתלים וסקולריים מהונדסים רקמות. הן התהליכים הדלקתיים והן התהליכים המתחדשים נקבעים על ידי רמזים ביומכניים מקומיים על הפיגומים (כלומר, מתח מתיחה וגיסת). כאן, אנו מתארים בפירוט את השימוש בביורומטר שפותח בהתאמה אישית המאפשר באופן ייחודי ניתוק של מתח מתיחה וגימה על פיגום צינורי. זה מאפשר הערכה שיטתית ומתוקננת של היכולת הדלקתית וההתחדשותית של פיגומים צינוריים בהשפעת עומסים מכניים מבוקרים היטב, אשר אנו מדגימים על בסיס ניסוי דינמי של תרבות משותפת באמצעות מקרופאגים אנושיים ומיופיברובלסטים. הצעדים המעשיים העיקריים בגישה זו – בנייתו והקמתו של הביו-רהקטור, הכנת הפיגומים וזריעת התאים, היישום והתחזוקה של זרימת המתיחה וההגשה וקצירת הדגימה לניתוח – נדונים בפירוט.
Introduction
הנדסת רקמות לב וכלי דם (TE) נרדפת כאפשרות טיפול חלופית לתותבות הלב וכלי הדם הקבועות הנמצאות בשימוש כיום (למשל, שתלי כלי דם, תחליפי שסתום לב), שהן תת-אופטימליות עבור קבוצות גדולות שלחולים 1,2,3,4. יישומים מבוקשים רבים כוללים שתלים וסקולריים מהונדסים רקמה (TEVGs)5,6 ושסתומי לב (TEHVs)7,8. לרוב, מתודולוגיות TE לב וכלי דם לעשות שימוש ביו-חומרים הניתנים למיחזור (טבעי או סינתטי) המשמשים פיגום מאלף עבור הרקמה החדשה להיווצר. היווצרות של רקמה חדשה יכולה להיות מהונדסת לחלוטין במבחנה, על ידי זריעת הפיגומים עם תאים ו culturing ב bioreactor לפני ההשתלה (במבחנה TE)9,10,11, או ישירות במקום, שבו הפיגומים הסינתטי מושתל ללא פולחן מראש על מנת לגרום להיווצרות של רקמה חדשה ישירות בגוף (במקום TE)12,13,14. הן במבחנה והן בגישות TE לב וכלי דם במקום, התחדשות תפקודית מוצלחת תלויה באופן דומיננטי הן בתגובה החיסונית המארחת למבנה המושתל והן בטעינה ביומכנית מתאימה.
החשיבות של טעינה ביומכנית עבור TE לב וכלי דם הוא מוכר היטב15. במקרה של שתלים לב וכלי דם, התאים המאכלסים את הפיגומים חשופים למתיחות מחזוריות וללחצי גיסת המתעוררים כתוצאה מהסביבה המודינמית. מחקרים רבים דיווחו על ההשפעה הממריצת של מתיחה (מחזורית) על היווצרות רכיבי מטריצה, כגון קולגן16,17,18,19, גליקוזאמינוגליקאנים (GAGs)20, ואלסטין21,22, על ידי סוגי תאים שונים. לדוגמה, הואנג ואח ' הוכיח כי מתיחה biaxial העלה את התצהיר ואת הארגון של קולגן ואלסטין במבחנה TEVGs באמצעות bioreactor כלי דם23. בעוד הדגש טמון בדרך כלל על מתיחה כמו עומס דומיננטי, מחקרים אלה לעתים קרובות לעשות שימוש ביו-קטרקטורים מונחה זרימה שבו המדגם חשוף גם לזרימת גיסת. למרות מעט יחסית ידוע על ההשפעה המבודדת של לחצי גיזה על היווצרות רקמות ודלקת בתלת ממד, כמה נתונים זמינים. לדוגמה, Hinderer et al. ו Eoh ואח ' הוכיח כי זרימת הגלד, בנוסף מיקרו פיגומים 3D, היה חשוב להיווצרות של אלסטין בוגר על ידי תאי שריר חלקים כלי דם אנושיים במערכת מודל במבחנה24,25. בסך הכל, ממצאים אלה ממחישים את הרלוונטיות של מתיחות מחזוריות ומתח גיסת עבור TE לב וכלי דם.
גורם חשוב נוסף להצלחה או לכישלון של שתלי TE הוא התגובה החיסונית של הפונדקאי לשתל המושתל26. זה חשוב במיוחד עבור חומרים מונעים באסטרטגיות TE situ, אשר למעשה מסתמכים על התגובה הדלקתית החריפה לפיגומים כדי להתחיל את התהליכים הבאים של זרם הסלולר היווצרות רקמות אנדוגני ושיפוץ27. המקרופאג ' הוא יוזם קריטי שלהתחדשות רקמותפונקציונלית, אשר הוכח על ידי מחקרים מרובים 28,29,30. מקביל לריפוי פצעים, התחדשות הרקמה נשלטת על ידי איתות פרקרינית בין מקרופאגים ותאים המייצרים רקמות כגון פיברובלסטים ומיופיברובלסטים31,32,33. בנוסף לתיאום תצהיר רקמות חדש, מקרופאגים מעורבים בספיגה פעילה של חומר פיגומיםזרים 34,35. ככזה, תגובת המקרופאג' במבחנה לביו-חומרים זוהתה כפרמטר חזוי להצלחת in vivo של שתלים36,37,38.
תגובת המקרופאג' לפיגומים מושתלים תלויה בתכונות עיצוב פיגומים כגון הרכב חומרים ומיקרו מבנה35,39,40. בנוסף לתכונות הפיגומים, תגובת המקרופאג' לפיגומים וההצלבה שלהם עם מיופיברובלסטים מושפעת גם מעומסים המודינמיים. לדוגמה, מתיחה מחזורית הוצגה כמאפנן חשוב של פנוטיפ מקרופאג'41,42,43,44 והפרשת ציטוקינים43,44,45,46 בפיגומי אלקטרוזופון תלת-ממדיים. באמצעות מערכת תרבית משותפת של מקרופאגים ותאי שריר חלקים וסקולריים, Battiston et al. הוכיח כי נוכחות של מקרופאגים הובילה לרמות גבוהות יותר של אלסטין ו GAGs וכי רמות מתונות של מתיחה מחזורית (1.07-1.10) עוררו את התצהיר של קולגן אני ואלסטין47. בעבודות קודמות, הוכחנו כי מתח גיזה הוא דטרמיננטה חשובה לגיוס מונוציטים לתוך פיגומי אלקטרו-ספון תלת מימדיים48,49, וכי הן מתח גיסת ומתיחה מחזורית משפיעות על האיתות הפרקריני בין מונוציטים אנושיים ותאי סטרומה מזנכימליים50. Fahy et al. הראה כי זרימת הגלד הגדילה את הפרשת ציטוקינים פרו דלקתיים על ידי מונוציטים אנושיים51.
יחד, הראיות לעיל מראות כי הבנה נאותה ושליטה על עומסים hemodynamic הוא חיוני עבור TE לב וכלי דם, וכי חשוב לשקול את התגובה הדלקתית כדי להשיג זאת. ביו-רקטורים רבים תוארו בעבר עבור במבחנה52,53,54,55,56,57,58 או ex vivo59,60,61 תרבות של רקמות לב וכלי דם. עם זאת, כל המערכות הללו נועדו לחקות את תנאי הטעינה ההמודינמית הפיזיולוגיים ככל האפשר. אמנם זה בעל ערך רב לצורך יצירת רקמות לב וכלי דם במבחנה או שמירה על תרביות ex vivo, מערכות כאלה אינן מאפשרות מחקרים שיטתיים לתוך ההשפעות האישיות של רמזים בודדים. הסיבה לכך היא היישום של מתח מחזורי ומתח גיסת אלה מונע על ידי אותה זרימה בלחץ, אשר באופן מהותי מקשר אותם. בעוד מיקרו-מערכות המאפשרות מניפולציה מכנית רב-מדומה מדויקת תוארו עבור מצעים דו-ממדיים62 או 3D הגדרות הידרוג'ל63,64, הגדרות כאלה אינן מאפשרות שילוב של פיגומים ביו-חומריים תלת-חומריים אלסטומרים.
כאן, אנו מציגים את היישום של מערכת bioreactor צינורית המאפשרת באופן ייחודי ניתוק של מתח גיסת ומתיחה מחזורית ומסייעת לחקור באופן מכני את ההשפעות האישיות והמשולבים שלהם. מערכת זו מאפשרת בדיקה של מגוון רחב של שתלי כלי דם מהונדסים רקמה (למשל, מקור סינתטי או טבעי, מיקרו-ארכיטקטורה שונה, נקבוביות שונות). כדי לנתק ביעילות את היישום של מתח הגיה ומתיחה, מושגי המפתח שבהם משתמש הביו-ריאקטור הם (1) הפרדה של השליטה בלחץ הגיסה ומתיחה באמצעות מערכות משאבה נפרדות ו-(2) גירוי של הפיגומים באופן 'מבפנים החוצה' עם ממדים מונעים חישובית. הזרימה מוחלת על פני השטח החיצוניים של הפיגומים הצינוריים באמצעות משאבת זרימה, ואילו מתיחה היקפית של הפיגומים מושרה על ידי הרחבת צינור סיליקון שעליו מותקן הפיגומים באמצעות משאבת מאמץ נפרדת. הממדים של צינור הסיליקון וצינור הזכוכית המכיל את המבנה נבחרים בקפידה ומאומתים באמצעות סימולציות דינמיקה של נוזלים חישוביים, כדי להבטיח כי לחץ הגיזה על הפיגומים (עקב זרימה) והמתיחת ההיקפית (עקב הרחבת הצינור) אינם משפיעים באופן משמעותי זה על זה. לעיצוב מבפנים החוצה זה יש כמה רציונלים מעשיים. אם המתיחה מוחלת על ידי לחץ הנוזלים הזוהרים (בדומה לטעינה פיזיולוגית), היא דורשת מטבעה שעיצוב המדגם יהיה נטול דליפות. בנוסף, הלחץ הנדרש כדי למתוח את המדגם ייקבע לחלוטין על ידי נוקשות המדגם, אשר עשוי להשתנות בין דגימות בתוך מדגם לאורך זמן, מה שמקשה על השליטה במתיחה. ביו-ריקטור זה מרכיב את השתל המהונדס על הרקמה סביב צינור סיליקון ומאפשר ליישום מתח גזיזת קיר (WSS) על הקיר החיצוני של השתל ולוחץ על השתל מבפנים. בדרך זו, תנאי טעינה שווים בין דגימות ובתוך דגימות לאורך זמן ניתן להבטיח, יתר על כן, הדגימות מותר להיות דולף, כמקובל עבור פיגומים כלי דם נקבובי19. ביו-ריאקטור מבפנים החוצה זה מיועד במיוחד למחקרים שיטתיים על ההשפעות של גיזום ו/או מתיחה, ולא ההנדסה של כלי דם דמוי יליד במבחנה, שעבורו תצורות ביו-ריאקטור כלי דם מסורתיות מתאימות יותר. ראה איור 1A-B עבור ציורי העיצוב של הביו-ריאקטור, ואת הטבלה המתאימה 1 לתיאור פונקציונלי ורציונל מאחורי המרכיבים העיקריים של הביו-ריאקטור.
השימוש bioreactor הוא הודגם על בסיס סדרה של מחקרים אחרונים על ידי הקבוצה שלנו שבו חקרנו את ההשפעות הפרט והשילוב של מתח גזוז ומתיחה מחזורית על דלקת היווצרות רקמות פיגומי אלקטרו-ספון resorbable עבור רקמת לב וכלי דם במקום19,43,44. כדי לכך, השתמשנו במקרופלגות אנושיות ובמיאופיברובלסטים במונו או בתרבות משותפת כדי לדמות את השלבים השונים של מפל ההתחדשות במקום. הוכחנו כי הפרשת ציטוקינים על ידי מקרופאגים אנושיים מושפעת באופן מובהק הן על ידי מתח מתיחה מחזורית והן על ידי לחץ גיסת, המשפיעים על תצהיר המטריצה וארגון על ידי מיופיברובלסטים אנושיים בפיגומים אלה, הן באמצעות איתות פרקרין והן על מגע ישיר19,43,44. ראוי לציין, מחקרים אלה גילו כי במקרה של יישום משולב של מתח גיסת ומתיחה, ההשפעות על היווצרות רקמות ודלקת נשלטים על ידי אחד משני העומסים, או שיש השפעות סינרגטיות של שני העומסים. ממצאים אלה ממחישים את הרלוונטיות של ניתוק שני העומסים כדי להבין טוב יותר את תרומת הסביבה המכנית בתהליכי TE. הבנה זו יכולה להיות מיושמת כדי לייעל באופן שיטתי את הפרמטרים של עיצוב פיגומים במשטרי טעינה המונמיים רלוונטיים. בנוסף, הנתונים המכניסטיים מסביבות מבוקרות כגון עשויים לשמש קלט עבור מודלים מספריים המפותחים כדי לחזות את מהלך שיפוץ רקמת situ, כפי שדווח לאחרונה עבור TEVGs65 או TEHVs66, כדי לשפר עוד יותר את יכולת החיזוי.
Protocol
במחקרים המתוארים בפרוטוקול זה, מקרופאגים אנושיים ראשוניים מבודדים מעילי דם היקפיים ומיופיברובלסטים אנושיים מבודדים מן הווריד saphenous לאחר ניתוח עובר כלילי שימשו44. מעילי באפי התקבלו ממתנדבים בריאים, אנונימיים שסיפקו הסכמה מדעת בכתב, שאושרה על ידי ועדת האתיקה הרפואית המוסדית של Sanquin Research. השימוש בתאי וינה סאפנה אנושיים (HVSCs) היה בהתאם ל"שימוש משני תקין בקוד ברקמה האנושית" שפותח על ידי הפדרציה של חברות רפואיות (FMWV) בהולנד.
1. הכנות כלליות ופעולות נדרשות לפני הקמת הביו-ריאקטור
הערה: לקבלת פרטים על פרוטוקולי הבידוד והפולחן המתאימים, עיין בעבודה מוקדמת יותר19,43,44. כל החישובים בפרוטוקול ניתנים כדוגמאות לניסוי תרבות משותפת עם מונוציטים ומיופיברובלסטים, המושרשים ב-8 פיגומים טעונים בהודינמיקה ו-2 פקדים סטטיים (n=10).
- התחל בידוד תאים ותרבית תאים. צפיפות הזריעה של הדגימות המתרבתות המשותפות של מונוציטים ומיופיברבלסטים (עם יחס זריעה של 2:1) הן 30 × 106 מונוציטים/ס"מ3 ו-15 × 106 מיופיברובלסטים/ס"מ3,בהתאמה.
הערה: לחומר האלקטרו-ספון יש נקבוביות גבוהה (>90%). כדי להעריך את המספר הנדרש של תאים לשתל, נפח הפיגומים מחושב עם הנוסחה לנפח של גליל חלול: π*(עובי)2 *אורך≈ 0.04 ס"מ3. הכמות הכוללת של תאים לשתל היא 1.2 × 106 מונוציטים ו 0.6 × 106 מיופיברובלסטים. עבור 10 דגימות, לפחות 12 × 106 מונוציטים ו 6 × 106 myofibroblasts נדרשים; התחל עם עד ~ 10-15% תאים נוספים כדי להסביר שגיאות pipetting אפשריות. - Degas המדיום תרבית התא שישמש לניסויים מעורבים bioreactor.
- הכן את המדיום לתרבויות משותפות, המורכב מ- RPMI-1640:aDMEM (1:1), בתוספת סרום בקר עוברי 10%, 1% פניצילין-סטרפטומיצין ו- 0.5% L-גלוטמין.
- מניחים את המדיום למשך הלילה (O/N) באינקובטור בבקבוק תרבית תאים עם מכסה מסנן לדגה.
- החלף את מכסה המסנן במכסה הדוק לאוויר ואחסן ב- 4 °C (70 °F).
- רגע לפני השימוש, להוסיף 0.25 מ"ג / מ"ל L-חומצה אסקורבית 2-פוספט (ויטמין C) למדיום.
הערה: עבור חישובים, כמות המדיום הנדרש לכל תא תרבות זרימה היא 50 מ"ל. רענן את המדיום שלוש פעמים בשבוע; מדיום ישן 25 מ"ל מוחלף על ידי 25 מ"ל בינוני טרי. עבור 10 דגימות; לאחר זריעה, נדרש מדיום טרי של 500 מ"ל, ועל כל שינוי בינוני עוקב, נעשה שימוש במדיום טרי של 250 מ"ל. תמיד להכין בינוני טרי, במיוחד, ויטמין C צריך להתווסף רק לפני שינוי המדיום.
- הכן פיגומי אלקטרו-ספון איזוטרופיים (קוטר זוהר 3 מ"מ, עובי קיר של 200 מיקרומטר) כמתואר על ידי ואן האפטן ואח '19 (איור 1G-I). בקצרה, פיגומי פוליפקולקטון בי-סוריה (PCL-BU) צינוריים מיוצרים על ידי אלקטרוספין מפתרונות כלורופורם-פולימר 15% (w/w). פתרונות הפולימר הם אלקטרו-ספון בטמפרטורת החדר ו-30% לחות יחסית, בקצב זרימה של 40 μL/min, מרחק של 16 ס"מ מהיעד הגלילי המסתובב (Ø 3 מ"מ, 500 סל"ד), ומתח יישומי של 16 קילוואט על הזרבובית האלקטרו-ספינינג ו-1 כ"ס ביעד.
הערה: למרות שתלים PCL-BU שימשו לניסויים אלה, מגוון רחב של שתלים מהונדסים רקמה אלסטומית ניתן להרכיב ביו-ריקטור זה (למשל, ממקור סינתטי או טבעי שונה, microarchitecture שונה, נקבוביות שונות)- הסר את פיגומי האלקטרו-ספון מהגברת.
- לעשות חור קטן בכובע של צינור 15 מ"ל כדי "להחזיק" את המנדרל במרכז ולמנוע ממנו לגעת בקיר הצינור.
- מניחים את המנדרל עם פיגום האלקטרו-ספון בצינור הבז וממלאים אותו במים דה-יוניים.
- להקפיא את הצינורות O / N ב -20 °C (50 °F).
- מניחים את הצינורות בטמפרטורת החדר (RT) ושולפים את המנדרלים לאחר מספר דקות, ומשאירים את השתלים האלקטרו-ספון בקרח.
- תן לקרח להפשיר לחלוטין, הסר את צינור האלקטרו-ספון מהמים המופשרים, ו'נתלה' להתייבש אנכית למשך מספר שעות. ודאו שהפיגומים לא 'מתמוטטים' תחת משקלם.
- פיגומים יבשים תחת ואקום O/N.
- תמונה מדגם קטן של השתלים אלקטרו-ספון באמצעות סריקת מיקרוסקופיית אלקטרונים (SEM) כדי להעריך את המיקרו מבנים שלהם (למשל, מורפולוגיה סיבים, קוטר סיבים). השתלים במחקרים לדוגמה יש כיוון סיבים איזוטרופיים וקוטר סיבים של 5 מיקרומטר(איור 1H–I).
- הסר את פיגומי האלקטרו-ספון מהגברת.
- יום אחד לפני תחילת הניסוי, הניחו את המאגר ההידראולי מלא במים דה-יונים באינקובטור. סגור את כל שמונת החיבורים לתאי תרבות הזרימה עם כובעי לוהר לבנים. התחבר למערכת האוויר הדחוסה והכנס חיישן לחץ. הפעל את משאבת המתח (ראה שלב 5.6) O/N כדי לאפשר הרחבה קטנה של מפוח הטפלון.
הערה: ודא שכל החומרים והציוד הדרושים מנוקים ו/או משועבדים אוטומטית (ראה טבלת חומרים, עמודת הערות/תיאור שעבורה מותר להשתמש אוטומטית בחומרים), בהתאם לפרוטוקול היצרן או כמתואר בשלבים 7.3-7.6. - ודא תנאי עבודה סטריליים למשך שארית הפרוטוקול.
- ביצוע שלבים 2-5.3 (הגדרת המערכת), שלב 6.3 (שינוי בינוני) ושלבים 7.1-7.2 (קציר מבני כלי דם) בארון זרימה למינאר סטרילי.
- מניחים חומרים שאינם נחוצים ישירות לשלבים הבאים במנות פטרי סגורות כדי לשמור על הכל נקי ככל האפשר.
- משטחי חומר נקיים או יבשים באופן קבוע על ידי השריית רקמת נייר עם 70% אתנול, ומנגבים את המשטחים של רכיבי הביו-ריאקטור וארון הזרימה למינארי.
2. הקמת הביו-ריאקטור
הערה: בצע את שלב 2 בארון זרימה למינארי.
- חותכים את פיגומי האלקטרו-ספון לצינורות באורך של כ-25 מ"מ, ומתעדים אותם לפני השימוש (למשל, צילום לאורך, שוקלים באיזון את המסה הראשונית).
- לטהר את פיגומי אלקטרו-מפון.
- מניחים את פיגומי האלקטרו-ספון מוטים בצלחת באר או צלחת פטרי, עם פתח אחד הפונה למקור האור האולטרה סגול (UV), כדי לאפשר לאור UV (253.7 ננומטר) להאיר את החלק הפנימי של הפיגומים.
- לחשוף את פיגומי אלקטרו-ספון לאור UV במשך 5 דקות.
- סובבו את כל הפיגומים וחזרו על תאורת ה-UV לפתיחה השנייה.
הערה: לאחר שלב זה, רק לגעת פיגום אלקטרו-ספלון בעת הצורך. תמיד להשתמש פינצטה נקייה או כפפות נקיות. - קח את צינורות הזכוכית של תאי תרבות הזרימה המאוחסנים ב -70%, לשטוף את צינורות הזכוכית במים אולטרה-תפומיים, יבש, ומניחים בצלחת פטרי גדולה וסגורה.
הערה: השלבים הבאים, במיוחד שלבים 2.3-2.5, מבוצעים באופן אידיאלי על ידי שני ניסויים.
- הר את פיגומי האלקטרו-ספון על צינורות הסיליקון.
- חבר את התפר 5-0 נוטה לקצה אחד של צינורות הסיליקון על ידי לקיחת התפר דרך צד אחד של הצינור ומחוץ לצד השני, משאיר שני תפרים מתוחים מנוגדים המשתרעים על פני החלק הצולב של הצינורות. הפוך קשר קטן משני צידי הצינור תוך דחיסת הצינור על מוקד הקשרים ולהשאיר כ 10 ס"מ של חוט על שני הקשרים. הפוך קשר שלישי בסוף שני חוטים 10 ס"מ שנותרו.
- חותכים את מחט התפר ואת כל החוטים החופשיים שעלולים להתבלט ולפגוע בחלק הפנימי של פיגום האלקטרו-ספון. חותכים את הקצוות של צינורות הסיליקון לצורה משולשת כדי לסייע במשיכת צינורות הסיליקון דרך פיגום האלקטרו-ספון.
- טובלים את פיגום האלקטרו-ספון ב-30% אתנול (זה משמש כצעד טיהור נוסף ומסייע בהזזת פיגום האלקטרו-ספון מעל צינורות הסיליקון) ומניחים את פיגום האלקטרו-ספון מעל חוט ה-10 ס"מ החינמי. הנסיין A מותח את צינורות הסיליקון על ידי משיכה עדינה הן על צינורות הסיליקון והן על הקשר של חוט התפר 10 ס"מ, בעוד הנסיין B מחליק בעדינות את פיגום האלקטרו-ספון מעל צינורות הסיליקון באמצעות פינצטה עם קצה פנימי חלק כדי למנוע פגיעה בפיגומים.
- שחררו לאט את המתיחה על צינורות הסיליקון, ובמקביל חלקו את פיגום האלקטרו-ספון עם פינצטה. טובלים את פיגום האלקטרו-ספון על צינורות הסיליקון במים אולטרה-תותים פעמיים.
הערה: ייתכן כי כמה קמטום של פיגום אלקטרו-ספון מתרחשת. מקומט זה ייעלם במהלך המתיחה מראש מיושם ממש לפני תיקון הפיגומים לצינורות הלחץ בשלב 2.5.3. - חזור על שלבים 2.3.2 ו- 2.3.3 עבור פיגומי האלקטרו-ספון האחרים. בהתאם לאורך צינורות הסיליקון, פיגומים אלקטרו-ספון מרובים יכולים להיות מותקנים על אותו צינורות סיליקון.
- כאשר כל פיגומי האלקטרו-ספון מותקנים על צינורות הסיליקון, חותכים את צינורות הסיליקון סביב הפיגומים, כולם באותו אורך (5.5 ס"מ); בצד אחד, קרוב לסוף פיגום האלקטרו-ספון, בצד השני, משאיר ~ 2-3 ס"מ של צינורות סיליקון חינם.
- חבר את התפר 5-0 נוטה לקצה אחד של צינורות הסיליקון על ידי לקיחת התפר דרך צד אחד של הצינור ומחוץ לצד השני, משאיר שני תפרים מתוחים מנוגדים המשתרעים על פני החלק הצולב של הצינורות. הפוך קשר קטן משני צידי הצינור תוך דחיסת הצינור על מוקד הקשרים ולהשאיר כ 10 ס"מ של חוט על שני הקשרים. הפוך קשר שלישי בסוף שני חוטים 10 ס"מ שנותרו.
- בנו את התא התחתון של תא תרבות הזרימה (איור 1A–B).
- קח את החלק העליון של התא התחתון המכיל את שקע הזרימה, וסגור את שקע הזרימה עם תקע Luer זכר.
- לדחוף את צינור הלחץ עם חורים דרך התא התחתון, ומניחים O-טבעת סיליקון סביב הקצה התחתון של צינור הלחץ כדי למנוע דליפה. בורג החלק התחתון של התא התחתון לחלק העליון של התא התחתון כדי לאבטח את צינור הלחץ. ודא כי החריץ החרוט התחתון של צינור הלחץ הוא כ 3-5 מ"מ מעל קצה התותב מתאם של התא התחתון; זה מאוחר יותר "להחזיק" את הקשר הדוק של חוט התפר, תיקון פיגום אלקטרו-ספון מעל צינורות הסיליקון.
הערה: אם צינור הלחץ ניתן לתמרן בקלות למעלה ולמטה, הוא מציין כי התא התחתון אינו מאובטח היטב. חזור על שלב 2.4.2 כדי למנוע דליפה בשלבים מאוחרים יותר (איור 2D).
- אבטחו את צינורות הסיליקון עם פיגום האלקטרו-ספון לצינור הלחץ.
- משוך את צינור הסיליקון עם פיגום אלקטרו-ספון מעל צינור הלחץ.
- הפוך קשר עם חוט התפר בקצה התחתון של פיגום אלקטרו-ספון במיקום החריץ החרוט על צינור הלחץ. צור קשר שני בצד הנגדי כדי לאבטח היטב את צינורות הסיליקון עם שתל האלקטרו-ספון.
זהירות: זהו צעד קריטי. ודא כי הקשר בדיוק "נופל" לתוך החריץ חרוט של צינור הלחץ כדי למנוע דליפת מים מן המאגר ההידראולי לתאי תרבות הזרימה. אם לא בטוח, נסו להדק את חוט התפר במספר עמדות, מעל או מתחת למיקום הצפוי של החריץ, כדי להבטיח שהקשרים הסופיים נמצאים בדיוק בחריץ החרוט(איור 2A). - מניחים את מהדק המספריים בקצה העליון של צינור הסיליקון, ולמתוח את צינורות הסיליקון כלפי מעלה (זה יבדוק ישירות את הקשר הראשון, אם אפשר להזיז את צינורות הסיליקון עם פיגום האלקטרו-ספון מעל צינור הלחץ, הוא לא היה מהודק מספיק טוב). עם כוח המשיכה, צינורות הסיליקון נמתחים מראש. כדי להבטיח שצינורות הסיליקון עקביים בין הדגימות השונות, חברו סרגל להידוק המספריים. משכו את מהדק המספריים כלפי מעלה עד שהקצה התחתון של הסרגל מגיע לגובה הקצה התחתון של הפיגומים.
הערה: חשוב לשמור על טרום מתיחה בכל מדגם בערך אותו (~ 5%) משתי סיבות: (1) אם צינורות סיליקון הוא מתוח מראש, זה יגרום התרחבות הומוגנית יותר לאורך המדגם בעת לחיצה; (2) טרום המתיחה תשפיע על המאפיינים המכניים של הסיליקון, ולכן זה צריך להיות זהה על פני כל הדגימות כדי להבטיח תנאי מתיחה שווים בין הדגימות. - הסר קמטים בפיגום האלקטרו-ספון על ידי משיכה עדינה של פיגום האלקטרו-ספון. שוב, לעשות שני קשרים משני הצדדים עם חוט תפר בקצה העליון של הפיגומים במיקום של החריץ החרוט העליון על צינור הלחץ.
- שחררו את מהדק המספריים, וחתכו את עודף צינורות הסיליקון בסכין, והותירו 20%-30% מחוט הבורג מכוסה בצינורות סיליקון, כדי למנוע דליפה כאשר חרוט האף מותקן על חוט הבורג.
הערה: חזור על שלבים 2.4 ו- 2.5 עבור כל הדגימות הדינמיות. - עבור דגימות הבקרה הסטטית, אבטחו את פיגום האלקטרו-ספון המותקן על צינורות הסיליקון על צינורות לחץ ללא חורים. צינורות אלה ניתן לשמור בנפרד בצינור 15 מ"ל עד זריעה (שלב 4) ואין צורך להרכיב בתאי תא תרבות הזרימה.
- לטהר את תאי תרבות הזרימה שנבנו חלקית עם פיגום אלקטרו-ספון על ידי חשיפתו לאור UV במשך 10 דקות. להפוך את תאי תרבות הזרימה עם פיגומי אלקטרו-ספון לצד השני, ולחזור על חשיפה לאור UV במשך 10 דקות.
- בורג קונוסים האף על חוט הבורג של צינורות הלחץ עם חורים עבור הדגימות הדינמיות.
- ודאו שהקצה העליון של צינורות הסיליקון מתאים לקונוס האף כדי למנוע דליפה בשלבים מאוחרים יותר. אם יש יותר מדי צינורות סיליקון, לחתוך את עודף הצינורות משם עם סכין.
- מניחים את תאי תרבות הזרימה שנבנו חלקית בצלחת פטרי גדולה, ומכוונים את חרוט האף לכיוון מקור האור UV. החל תאורת UV במשך 5 דקות.
- בנייה מלאה של תא תרבות הזרימה עם צינור הזכוכית והתא העליון של תא תרבות הזרימה (איור 1A-B).
- הרטיבו מראש את פיגומי האלקטרו-ספון על ידי טבילת צינור הלחץ עם צינורות הסיליקון ופיגומי האלקטרו-ספון ב-30% אתנול, ולאחר מכן טבילה במים אולטרה-טורפים פעמיים.
- מניחים את צינור הזכוכית מעל צינור הלחץ, ודוחפים בעדינות בתא התחתון ומאבטחים אותו בעדינות.
- קחו את התא העליון המכיל את פתח הזרימה, הניחו טבעת O מסיליקון, מחליק הזרימה ואת תוחבי המתאם בסדר הנכון (איור 1A–B),והנחו מעל הקצה הפתוח של צינור הזכוכית ואבטחו אותו בעדינות.
- בורג כובע Luer לבן על זרם של התא העליון.
- הסר את תקע Luer זכר משקע הזרימה של התא התחתון, ולנקות את פני השטח סביבו עם רקמת נייר ספוג אתנול.
- מניחים מזרק עם 10 מ"ל של מים אולטרה-סבר בשקע הזרימה, פתחו את כובע הלואר הלבן בתא העליון ומלאו את התא במים אולטרה-סבר. סגור שוב את כובע הלואר הלבן, הסר את המזרק, נקה שוב עם אתנול, וסגור את שקע הזרימה עם תקע Luer זכר.
הערה: חזור על שלבים 2.6-2.8 עבור כל תאי תרבות הזרימה. - עבור פקדים סטטיים, להוסיף 10 מ"ל של מים אולטרה-תול לצינורות 15 מ"ל מחזיק את הדגימות רכוב על צינורות הלחץ ללא חורים.
- מקם את כל תאי תרבות הזרימה באינקובטור. החלף את המים האולטרה-תותביים במדיום תרבית יום אחד לפני זריעת התא באותו אופן המתואר בשלבים 2.8.5 ו- 2.8.6 (הקפד לאסוף את המים האולטרה-ספוגים 'הישנים' עם רקמת נייר ספוגה באתנול המונחת ישירות על שקע הזרימה).
[הפרוטוקול יכול להיות מושהה כאן]
3. הכנות להתקנת משאבת הזרימה
הערה: בצע את שלב 3 בארון זרימה למינארי.
- לאסוף את כל חומרי הגדרת המשאבה ולהתכונן לשימוש.
הערה: הנסיינים מופנים לפרוטוקול היצרן לתיאור מפורט של הגדרת המשאבה, היחידות הנוזליות והצינורות הבינוניים דרך השסתומים של היחידה הנוזלית.- הגדר את המשאבה לקיבולת של 200 מ"ר.
- בורג מחזיקי המאגר עבור מאגרים 60 מ"ל ליחידות הנוזלים.
- נקו את מסנני אוויר הגומי שמיש מחדש עם רקמת נייר ספוגה באתנול, ודאו שמסנן האוויר נשאר יבש.
- מניחים את מאגרי 60 מ"ל במחזיקי המאגר, ומניחים את הצינורות הבינוניים הסטנדרטיים דרך שסתומי היחידה הנוזלית. חברו את הצינורות הבינוניים בקוטר פנימי גדול יותר עם מצמדי מנעול לוקר ללולאה סגורה.
- מהדקים את הצינור הבינוני עם קליפ צינור, ישירות מתחת למאגרים.
- מלא את המאגרים עם 25 מ"ל של בינוני תרבות לכל 60 מ"ל מאגר. שחררו את מהדק הצינור, ותנו למדיום להיכנס לצינורות.
- סוגרים את המאגרים הבינוניים עם מסנני אוויר הגומי, ומניחים את מערך משאבת הזרימה באינקובטור עד לשלב 4.
4. זריעת תאים באמצעות פיברין כמנשא תא
הערה: בצע את שלב 4 בארון זרימה למינארי.
- הכן את ג'ל הפיברין לשלב זריעת התא. לפרטים, ראה מול ואח' 67 עבור ג'ל פיברין, פתרון פיברינוגן צריך להיות ריכוז סופי של 10 מ"ג / מ"ל (נכון לטוהר של מלאי החלבון), ואת פתרון תרומבין צריך להיות ריכוז סופי של 10 U / mL.
- להפשיר פיברינוגן ל RT, לפני שקילה ~ 50 מ"ג (מספיק עבור 10 דגימות) במיכל פלסטיק עם מכסה אדום.
- הוסף תרבית התא בינוני כדי להכין את פתרון פיברינוגן (בריכוז של 10 מ"ג / מ"ל, נכון לטוהר של מלאי החלבון). מערבבים היטב ומסננים כדי לעקר את פתרון הפיברינוגן עם מסנן מזרק 0.2 מיקרומטר לתוך צינור סטרילי 15 מ"ל. שמור את פתרון פיברינוגן מסונן על קרח.
הערה: הימנע מהכנת פתרון פיברינוגן זמן רב מדי מראש, אחרת הפיברינוגן עלול לקריש באופן ספונטני. - להפשיר תרומבין ולעשות פתרון תרומבין (בריכוז של 10 U / mL) בתרבית התא בינוני ומניח על קרח. הכן 20 μL תרומבין + פתרון תאים לכל דגימה. עבור n = 10 דגימות, 200 μL יש צורך; לכן, להכין פתרון תרומבין 250 μL כדי להסביר שגיאות pipetting אפשריות.
- לאסוף ולספור את התאים מבקבוקי התרבות. מערבבים את התאים ביחס ובכמות הרצויים (1.2 × 106 מונוציטים ו-0.6 × 106 מיופיברובלסטים לפיגומים). ודא שיש מספיק תאים עבור דגימות n+1 לתיקון עבור שגיאות pipetting. צנטריפוגה ב 350 × גרם במשך 10 דקות ב RT. הסר את supernatant.
- הפוך תערובת של התאים המושעים תרומבין.
- עבור כל דגימה, השתמש 20 μL של פתרון תרומבין. לקבלת n = 10 דגימות, להוסיף 200 μL תרומבין לכדור התא ולערבב. למדוד את הנפח של השעיית התא (תאים + תרומבין), ולחשב כיצד לחלק באופן שווה על כל 10 פיגומים (למשל, אם התרומבין + השעיית התא יש נפח של 260 μL, כל דגימת אלקטרו-ספון תקבל 260 μL / 10 דגימות = 26 μL תרומבין + השעיית תא).
- כמו זריעת הפיגומים מבוצע בשני שלבים, להכין שני צינורות מיקרופוגה 1.5 מ"ל שיחזיק חצי מתלה התא עבור כל פיגום (בחישוב לדוגמה של השלב הקודם: להכין שני צינורות עם 13 μL של תרומבין + השעיית תא). מניחים על קרח.
הערה: השלבים הבאים, במיוחד שלב 4.4, מבוצעים באופן אידיאלי על ידי שני ניסויים.
- יבשו את פיגומי האלקטרו-ספון הרטובים מראש עם ואקום כדי להתכונן לזריעת תאים.
- חברו צינור פסטר מזכוכית למערכת הוואקום של ארון הזרימה למינארי, והכניסו בצינור ריק של 50 מ"ל לאחסון זמני סטרילי.
- קח את תאי תרבות הזרימה מהאינקובטור, הסר את תקע הלואר הזכר משקע הזרימה, והסר את המדיום לאחר פתיחת כובע הלואר הלבן והנחת רקמת נייר ספוגה באתנול מול שקע הזרימה.
- הורידו את התא העליון ואת צינור הזכוכית, ומניחים בצלחת פטרי סטרילית לאחסון זמני.
- מניחים את צינור פסטר הוואקום על פיגום האלקטרו-ספון, ומסירים כמה שיותר בינוני.
אזהרה: שואב אבק לייבש את פיגום אלקטרו-ספלון בעדינות רבה. במקום תנועה ליניארית הלוך ושוב מעל הפיגומים, הנח את צינור הוואקום במספר מיקומים. מהדקים את צינורות הוואקום על גבי הצינור של פסטר בין האצבעות לשליטה טובה יותר. - מערבבים את פתרון הפיברינוגן ביחס של 1:1 עם השעיית תרומבין + תאים (למשל, מערבבים 13 μL של פיברינוגן עם 13 μL של תרומבין + השעיית תאים). כדי לוודא כי הפיברין פולימר בפיגומים ולא בצינור microfuge, pipet פיברינוגן, להפוך את גלגל הצינור עבור "נפח נוסף" של תרומבין + השעיית התא, וצינור למעלה ולמטה פעם אחת בצינור microfuge עם מתלה תא לערבב.
- באופן הומוגני ישירות לטפטף את הפתרון על פני כל אורכו של פיגום אלקטרו-ספון. מומלץ כי Experimenter A מטפטף את תערובת הפיברין, בעוד הנסיין B מחזיק את התא התחתון עם פיגום אלקטרו-ספון רכוב על צינור הלחץ.
- לאחר הפיברין עם התאים מטפטף על פיגום אלקטרו-ספון, Experimenter B מזיז לאט את הפיגומים, משמאל לימין ולמעלה ולמטה, כדי לחלק את התאים באופן שווה על הפיגומים.
- חזור על שלב 4.4.5 - 4.4.7 בצד השני של פיגום האלקטרו-ספון.
- הר את תא תרבות הזרימה שוב על ידי הצבה זהירה של צינור הזכוכית (למנוע דבק פיברין וקרישת בצד הפנימי של צינור הזכוכית), ולדחוף בחזרה את התא העליון של תא תרבות הזרימה. מניחים ישירות את המבנה המוזרע ללא תמיסת מלח בינונית או פוספט (PBS) בתא תרבות הזרימה באינקובטור.
- חזור על שלבים 4.4.1–4.4.9 עבור כל הדגימות הדינמיות. עבור דגימות סטטיות רכוב צינורות לחץ ללא חורים, זרע על פי שלבים 4.4.1-4.4.8, ומניחים בצינור 15 מ"ל לאחר מכן.
- תן פיברין פילמור במשך 60 דקות באינקובטור.
[הפרוטוקול יכול להיות מושהה כאן במשך 30-60 דקות.]
- לאחר פילמור, מלא את תאי תרבות הזרימה (דגימות דינמיות) או את צינורות 15 מ"ל (דגימות סטטיות) עם בינוני.
5. צימוד של מערכות הביו-ריאקטור ומשאבת הזרימה לפני תחילת הניסוי
הערה: בצע את השלבים 5.1-5.3 בארון זרימה למינארי.
- קח את המגש הנושא את תאי תרבות הזרימה ואת היחידות הנוזליות עם מאגרים בינוניים מלאים וצינורות בינוניים מחוברים בתוך ארונות הזרימה למינאר.
- מקם את תאי תרבות הזרימה בבסיס הביו-ריאקטור עבור קבוצות הניסוי העמוסות במתיחות מחזוריות ועם עומסים המודינמיים משולבים(איור 1E).
- הטה את תא תרבות הזרימה הפוך, ומלא את צינור הלחץ מלמטה במים אולטרה-תפותיים באמצעות מזרק עם צינורות דקים (זה יכול להיות מכל סוג שהוא, כל עוד הוא גמיש ודק, בניסוי זה, חוט קוטר פנימי באורך 10 ס"מ, 0.15 מ"מ היה מחובר למחט).
- מניחים את הצינורות הדקים בתוך צינור הלחץ, ובעוד צינור הלחץ מלא במים אולטרה-סבר על ידי דחיפת המים בהדרגה אל מחוץ למזרק, הוציאו את החוט מצינור הלחץ בו זמנית, כדי לוודא שאין בועות אוויר בתוך צינור הלחץ.
- הנח את תא תרבות הזרימה על אחד משמונת חוטי הברגים בבסיס הביו-ריאלקטור. הנח טבעת O מסיליקון בין בסיס הביו-ריאקטור למחבר הלואר הלבן כדי למנוע דליפה אפשרית, והידק את מחבר הלואר הלבן מהתא התחתון.
- חזור על שלבים 5.2.2 ו- 5.2.3 עבור כל הדגימות הנמתחות מחזורית.
- חבר את תאי תרבות הזרימה לכל קבוצות הניסוי, למעט השליטה הסטטית, למערכת משאבת הזרימה.
- מניחים קליפ צינור על הצינור הבינוני. הסר את כובע Luer הלבן המכסה את זרם הזרימה של התא העליון של תא תרבות הזרימה. הסר את מצמד Luer הנשי של הצינורות הבינוניים, וחבר את הצינורות הבינוניים בצד אחד עם זרם הזרימה בתא העליון, ואת הצד השני של הצינורות הבינוניים עם שקע זרימה בתא התחתון.
- חזור על שלב 5.3.1 עבור כל תאי תרבות הזרימה. בשלב זה, הביו-ריאקטור ותאי תרבות הזרימה מלאים במדיום ומחוברים למערכות הזרימה.
- עבור דגימות הבקרה הסטטית, מקם את הדגימות אנכית בבקבוק תרבית תאים עם מכסה מסנן באמצעות מהדק המספריים. ממלאים את בקבוקון תרבית התאים במדיום ומניחים באינקובטור.
- מעבירים את ההתקנה המלאה מארון הזרימה למינארי לאינקובטור, ומחברים את היחידות הנוזליות לצינורות לחץ האוויר והכבל החשמלי.
- הפעל את התוכנה ואתחל את משאבות הזרימה. התחל את הזרימה הבינונית עבור הדגימות אחת אחת.
- בדוק אם השסתומים של היחידה הנוזלית לוחצים.
- הסר את מהדק הצינור מן הצינור הבינוני.
- התחל את משאבת הזרימה עם 100 מ"ר וזמן מיתוג של 10.
- בדוק בקפידה את כיוון הזרימה עבור דליפת בועות אוויר או אפשריות. ניתן להסיר בועות אוויר לכודות על ידי הפיכת תא תרבות הזרימה.
הערה: ודאו שהרמות הבינוניות במאגרים הבינוניים מאוזנות, כדי למנוע שאיבה של אוויר למערכת ובועות אוויר בתאי תרבות הזרימה, ולא לאפשר למאגרים להתייבש(איור 2C). - חזור על שלב 5.5 עבור כל היחידות הנוזליות אחת אחת.
- אתחל את משאבת המתח.
- חבר את המשאבה המופעילה הפנאומטית דרך פתח האוויר על הגליל הפנאומטי לאוויר הדחוס. חברו את שקע האוויר התחתון עם הצינורות הכחולים לאוויר בחוץ(איור 1F).
- פתח תוכנת LabVIEW, הפעל את סקריפט LabVIEW ומערכת יישומים לחץ אוויר דחוס, כפי שתואר על ידי ואן Kelle ואח'68, להיכנס עקירה ותדירות (להתחיל בתדר נמוך של 0.2 הרץ). השהה את המשאבה כאשר מפוח הטפלון נמצא ברמה הנמוכה ביותר שלו.
- הנח את חיישן הלחץ בכניסת חיישן הלחץ על המאגר ההידראולי.
- שנה את הגדרות המשאבה להגדרות הרצויות (עבור 1.5 Pa, השתמש ב- 150 מ"ר, זמן מיתוג של 10).
- התחל את משאבת המתח והפעל את ההגדרה המועדפת (למשל, 0.5 הרץ, מתיחה של 1.05).
6. ניסוי ריצה במשך מספר ימים; ניטור גיהה ומתיחה במהלך תרבות והחלפה בינונית
- חשב את ה-WSS בקיר הפיגומים.
- הקלט את גודל הזרימה כל יומיים (עיין במדריך של יצרן משאבת הזרימה לקבלת פרטים). בקיצור, לבחון את השינוי ברמות הנוזל (ב- mL) במאגרים הבינוניים בין המעבר של מאגר היחידה הנוזלית עבור 10 s. לבצע לפחות חמש מדידות, לחשב את הערך הממוצע, ולהכפיל ב 6 כדי לקבל את קצב הזרימה Q ב mL / min.
- הזרימה מתוארת על ידי זרימת Poiseuille דרך ערוץ טבעתי. בהנחה שתרבית בינונית כנוזל ניוטוני, חשב את ה- WSS בקיר הפיגומים, r1, לפי משוואה 1.
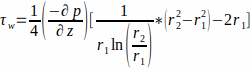 (1)
(1)
כאשר WSS τw בקיר הפיגומים (r1;כאן r1 = 1.7 מ"מ), הנובע מזרימת מצב יציבה, נקבע על ידי p הלחץ המופעל והרדיוס הפנימי של צינור הזכוכית r2 (כאן r2 = 2.3 מ"מ). שיפוע הלחץ בכיוון צירי נחשב אחיד בין כניסת הזרימה לשקע הזרימה, והוא ניתן על-ידי משוואה 2 (איור 1J).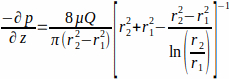 (2)
(2)
עם μ הצמיגות הדינמית (כאן צמיגות בינונית נחשב קבוע, μ = 0.7 × 10-3 Pa∙s ב 37 °C (C) ו Q קצב הזרימה המוחל.
- לפקח על המתיחה מוחל על הפיגומים כל יומיים.
- מניחים רקע כהה מאחורי תא תרבות הזרימה כדי להגביר את הניגוד בין הפיגומים לרקע. מקם את מנורות תאורת ה- LED, המצביעות לכיוון הפיגומים, כדי לסייע בהדמיה של הפיגומים.
- קח צילומי זמן לשגות של הפיגומים בתדר של 30 הרץ עבור 6 s (כלומר, 3 מחזורי מתיחה) עם מצלמה במהירות גבוהה.
הערה: תדירות הקלטה נמוכה יותר עשויה להספיק אם המצלמה מאפשרת זאת. עם זאת, התדירות המינימלית הנדרשת לא נקבעה. - קבעו ידנית את הקוטר המינימלי והמקסימלי של הפיגומים מהתמונות.
- חשב את הקוטר החיצוני המינימלי והמקסימום של פיגום האלקטרו-ספון כדי לחשב את המתיחות המרביות לפי משוואה 3.
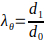 (3)
(3)
כאשר המתיחה ההיקפית (λθ) ניתנת על ידי היחס בין הקוטר החיצוני של הפיגומים, d1,לקוטרו ההתחלתי, ד0.
- תקן לאידוי בינוני ורענן בינוני שלוש פעמים בשבוע.
- עצור ופרק את הכבלים עבור מערכות הזרימה ומשאבת המתח.
- מניחים מהדקי צינור על הצינור הבינוני.
- קבע כמה בינוני התאדה בהתבסס על סימני המחוון של אמצעי האחסון במאגרים הבינוניים.
- מעבירים את המגש עם הביו-ריאה והיחידות הנוזליות לארון הזרימה למינארי.
- הסר את מסנני אוויר הגומי של המאגרים הבינוניים; מוסיפים מים אולטרה-טחון אוטומטיים כדי לפצות על הנפח המתאדה של בינוני. סוגרים שוב את המאגרים הבינוניים, ומתחברים שוב למשאבה כדי לערבב את המדיום עם המים האולטרה-תיבול.
- חזור על שלבים 6.3.1–6.3.5. הסר את מסנני אוויר גומי שוב, להוציא 25 מ"ל של בינוני תרבות, ולהסתובב למטה ב 300 × גרם במשך 5 דקות ב RT.
- לאסוף 1.5 מ"ל supernatant, ולאחסן ב -30 °C לניתוח של פרופילי הפרשה (לניתוח עם חיסון הקשורים לאנזים (ELISA)).
- לאסוף את הנפח הרצוי של supernatant עבור מחקרי איתות paracrine, באמצעות supernatant כמו בינוני מותנה43.
- יש להוסיף 25 מ"ל של בינוני טרי למאגרים הבינוניים.
- מניחים מסנני אוויר גומי בחזרה על המאגרים הבינוניים.
- מניחים את ההתקנה המלאה בחזרה באינקובטור; חברו את כל הכבלים וצינורות האוויר למשאבה ומשאבת המתח. שחררו את מהדקי הצינור וחזרו על שלבים 5.4-5.8.
- בדוק אם חרוזי ייבוש סיליקה בבקבוקי הייבוש המחוברים למשאבה לחים (מראה לבן), והחליפו בחרוזי סיליקה יבשים במידת הצורך (מראה כתום).
7. סיום ניסוי, איסוף דוגמאות וניקוי ואחסון ציוד
- ביום האחרון של הניסוי, נכון לאידוי בינוני כמתואר בשלבים 6.3.1-6.3.5, וקוצר את הדגימות אחד אחד.
- כדי לקצור את הדגימות אחד אחד, משאבת הזרימה ומשאבת המתח צריכים להיות מושהים מספר פעמים. מניחים קליפ צינור על צינורות בינוניים. עצור זמנית את משאבת הזרימה ואת משאבת המתח. נתק תא תרבות זרימה אחד מבסיס הביו-ריאלקטור; להחליף על ידי כובע Luer לבן על בסיס bioreactor. קח את תא תרבות הזרימה והיחידה הנוזלית לארון הזרימה למינאר. התחל את משאבת הזרימה ואת משאבת המתח שוב כדי להחיל את העומס המודינמי על הדגימות האחרות עד הקציר.
- לאסוף מדיום מן המאגרים הבינוניים לניתוח ייצור ציטוקינים paracrine באמצעות ELISA.
- יחידות זרימה מניתקות ומבנה צינורי קציר. סעיף על פי ערכת החיתוך הרצויה. חלקים של המבנה ניתן לאחסן ב 4 °C (לאחר 15 דקות קיבעון ב 3.7% פורמלדהיד ו 3 x 5 דקות כביסה PBS) או -30 °C (לאחר הצמד הקפאה בחנקן נוזלי) עד ניתוח נוסף.
- נקה את רכיבי הביו-רה-קטור והמשאבה. בנוסף, שיטת הניקוי המומלצת לפריט מוזכרת בטבלת החומרים.
- נקה את מסנני אוויר הגומי עם 70% אתנול. היזהר מאוד לא להטות את המסנן הפנימי!
- לאסוף את כל הרכיבים הנפרדים: צינורות בינוניים, מאגרים בינוניים, צינורות זכוכית, תקעים Luer זכר ומנעולי Luer הנשי, כובעי Luer לבן, צינורות לחץ, גביעי האף, סיליקון O-טבעות, תותבות מתאם, מחליקי זרימה (למעט משאבות, יחידות נוזלים, מסנני אוויר גומי, בסיס bioreactor), ולשטוף במי ברז זורמים.
- מניחים את O/N ב-0.1% נתרן דודצילספט במים דה-יונים.
הערה: אין להשתמש במים אולטרה-טעם מכיוון שהחלקים עשויים להחליד. - יש לשטוף במי ברז ובסבון לשטיפת כלים.
- לטבול במים deionized, ואחריו 70% אתנול פעמיים, ואחריו מים deionized.
- מניחים את כל החומרים בנפרד על רקמות נייר ולתת להם להתייבש. השתמש באוויר לחוץ כדי לייבש צינורות.
- נקו את כל החומרים שאינם ניתנים להפעלה אוטומטית עם רקמת נייר ספוגה ב-70% אתנול. זה כולל את מסנן אוויר הגומי (יש לזכור כי מסנן האוויר צריך להישאר יבש) ואת בסיס bioreactor (מפוח טפלון וצילינדר פנאומטי).
- תכלול אוטומטית את רכיבי התא הנוזלי (כולל טבעת הסיליקון), הצינורות הבינוניים, המאגרים הבינוניים (ללא מסנן אוויר הגומי), תקעים זכרים של לואר ומצמדי לואר נשיים, כובעי Luer לבנים, מהדקי צינור וציוד סטנדרטי (למשל, פינצטה, מספריים מהדקים)
- לשימוש נוח במהלך הניסויים הבאים, שלב את הרכיבים הנפרדים עבור תא נוזלי אחד שלם בקופסה הניתנת להפעלה אוטומטית.
- הסר מים מהמאגר ההידראולי. נקי עם 70% אתנול, ואחריו מים דה-יוניים. תן לזה להתייבש. יש למלא במים דה-יאון וכמה טיפות של חומר חיטוי לשימור אמבט מים.
- לאחסן את צינורות הזכוכית לתא תרבות הזרימה ב 70% אתנול.
- מניחים את חרוזי ייבוש סיליקה לחים (מראה לבן) בתנור O /N ב 120 °C כדי לאפשר להם להתייבש (מראה כתום), ולאחסן בקבוקון אוויר הדוק.
תוצאות
bioreactor זה פותח כדי לחקור את ההשפעות הפרטניות והמשולבים של מתח גיסת ומתיחות מחזוריות על צמיחת רקמת כלי הדם ושיפוץ פיגומים ביו-חומרים תלת-ממדיים. העיצוב של הביו-ריאקטור מאפשר פולחן של עד שמונה מבני כלי דם בתנאי טעינה שונים(איור 1A). מבני כלי הדם ממוקמים בתא תרבות זרימה (
Discussion
הביו-ריאקטור המתואר כאן מאפשר הערכה שיטתית של תרומתו של האדם וההשפעות המשולבות של לחץ גזוז ומתיחות מחזוריות על דלקת והתחדשות רקמות בפיגומים צינוריים הניתנים לשחזור. גישה זו מאפשרת גם לבצע מגוון רחב של ניתוחים על מבנים וסקולריים, כפי שמדגים בסעיף התוצאות הייצוגיות. תוצאות אלה מראות את ההש...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך כלכלית על ידי ZonMw כחלק מתוכנית LSH 2Treat (436001003) וקרן הכליות ההולנדית (14a2d507). N.A.K. מכיר בתמיכת מועצת המחקר האירופית (851960). אנו מכירים בהכרת תודה בתוכנית הכבידה "התחדשות מונעת חומרים", במימון הארגון ההולנדי למחקר מדעי (024.003.013).
Materials
| Name | Company | Catalog Number | Comments |
| advanced Dulbecco’s modified EagleMedium (aDMEM) | Gibco | 12491-015 | cell culture medium for fibroblasts |
| Aqua Stabil | Julabo | 8940012 | prevent microorganism growth in bioreactor-hydraulic reservoir |
| Bovine fibrinogen | Sigma | F8630 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Bovine thrombin | Sigma | T4648 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Centrifuge | Eppendorf | 5804 | to spin down cells and conditioned medium |
| Clamp scissor - "kelly forceps" | Almedic | P-422 | clamp the silicone tubing and apply pre-stretch to the scaffold so the scaffold can be sutured into the engraved groove (autoclave at step 1, step 7) |
| CO2 cell culture incubators | Sanyo | MCO-170AIC-PE | for cell culturing |
| Compressed air reservoir | Festo | CRVZS-5 | smoothing air pressure fluctuations and create time delays for pressure build-up |
| Custom Matlab script to calculate the maximum stretches | Matlab | R2017. The Mathworks, Natick, MA | calculate the minimum and maximum outer diameter of the electrospun scaffold |
| Data acquisition board | National Instruments | BNC-2090 | data processing in between amplifier system and computer |
| Ethanol | VWR | VWRK4096-9005 | to keep sterile working conditions |
| Fetal bovine calf serum (FBS) | Greiner | 758087 | cell culture medium supplement; serum-supplement |
| Flow culture chamber compartments, consisting of a pressure conduit with engraved grooves and small holes to apply pressure on silicone tubing, a screw thread, nose cone, top compartment with flow inlet and bottom compartment flow outlet, adapter bushing | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | flow culture chamber compartments (autoclave at step 1, step 7) |
| Glass Pasteur pipet | Assistant | HE40567002 | apply vacuum on electrospun scaffold (autoclave at step 1) |
| Glass tubes of the flow culture chamber | Custon made, Equipment & Prototype Center, Eindhoven University of Technology | n.a. | part of the flow culture chamber (clean and store in 70% ethanol, at step 1 and 7) |
| GlutaMax | Gibco | 35050061 | cell culture medium amino acid supplement, minimizes ammonia build-up |
| High speed camera | MotionScope | M-5 | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| High speed camera lens - Micro-NIKKOR 55mm f/2.8 - lens | Nikon | JAA616AB | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| Hose clip | ibidi GmbH | 10821 | block medium flow (autoclave at step 1, step 7) |
| Hydraulic reservoir with 8 screw threads for 8 flow culture chambers | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to apply pressure to the silicone mounted constructs (clean outside with a paper tissue with 70% ethanol, rinse reservoir with 70% ethanol followed by demi water, at step 1 and 7) |
| Ibidi pump system (8x) including ibidi pump, PumpControl software, fluidic unit, perfusion set (medium tubing), air pressure tubing, drying bottles with orange silica beads | ibidi GmbH | 10902 | set up used to control the flow in the flow culture chambers. Note 1: the ibidi pumps were modified by the manufacturer to enable 200 mbar capacity. Note 2: can be replaced by pump system of other manufacturer, as long as same flow regimes can be applied. |
| Knives (no.10 sterile blades, individual foil pack) and scalpel handle (stainless steel, individually wrapped) | Swann Morton | 0301; 0933 | to cut the silicone tubing in the correct size for the scaffold and to cut the suture material |
| LabVIEW Software | National Instruments | version 2018 | to control the stretch applied to the scaffolds |
| Laminar flow biosafety cabinet with UV light | Labconco | 302310001 | to ensure sterile working conditions. The UV is used to decontaminate everything that cannot be autoclaved, or touched after autoclaving |
| Large and small petri dishes | Greiner | 664-160 | for sterile working conditions |
| L-ascorbic acid 2-phosphate (vitamin C) | Sigma | A8960 | cell culture medium supplement, important for collagen production |
| LED light cold source KL2500 | Zeiss | Schott AG | to aid in visualization for the time lapse of the scaffolds during monitoring of the stretch |
| Luer (female and male) locks and connectors, white luer caps | ibidi GmbH | various, see (https://ibidi.com/26-flow-accessories) | to close or connect parts of the bioreactor and the ibidi pump (autoclave at step 1, step 7) |
| Measuring amplifier (PICAS) | PEEKEL instruments B.V. | n.a. | to amplify the signal from the pressure sensor and feedback to LabView |
| Medium reservoir (large syringes 60 mL) and reservoir holders | ibidi GmbH | 10974 | medium reservoir (autoclave at step 1, step 7) |
| Medium tubing with 4.25 mm outer diameter and 1 mm inner diameter | Rubber BV | 1805 | to allow for a larger flow rate, the ibidi medium tubing with larger diameter is used. Note: the part of medium tubing guided through the fluidic unit valves are the same as the default ibidi medium tubing |
| Motion Studio Software | Idtvision | 2.15.00 | to make the high speed time lapse images for stretch monitoring |
| Needle (19G) | BD Microlance | 301700 | together with thin flexible tubing used to fill the hydraulic reservoir with ultrapure water without adding air bubbles |
| Needle driver | Adson | 2429218 | to handle the needle of the nylon suture through the silicone tube (autoclave at step 1, step 7) |
| Paper tissues | Kleenex | 38044001 | for cleaning of the equipment with 70% ethanol |
| Parafilm | Sigma | P7793-1EA | quick fix if leakage occurs |
| Penicillin/streptomycin (P/S) | Lonza | DE17-602E | cell culture medium supplement; prevent bacterial contamination |
| Phosphate Buffered Saline (PBS) | Sigma | P4417-100TAB | for storage and washing steps (autoclave at step 1) |
| Plastic containers (60 mL) with red screw caps | Greiner | 206202 | to prepare the fibrinogen solution |
| Pneumatic cylinder | Festo | AEVC-20-10-I-P | to actuate the Teflon bellow (clean with a paper tissue with 70% ethanol at step 1 and 7) |
| Polycaprolactone bisurea (PCL-BU) tubular scaffolds (3 mm inner diameter, 200 µm wall thickness, 20 mm length) | SyMO-Chem, Eindhoven, The Netherlands | n.a. | produced using electrospinning from 15% (w/w) chloroform (Sigma; 372978) polymer solutions. See Van Haaften et al Tissue Engineering Part C (2018) for more details |
| Pressure conduit without holes (for static control) | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to mount electrospun tubes on silicon tubing (autoclave at step 1, step 7) |
| Pressure sensor and transducer | BD | TC-XX and P 10 EZ | the air pressure going to the pneumatic actuated pump is raised until it reaches the set pressure |
| Proportional air pressure control valve and pressure sensor | Festo | MPPES-3-1/8-2-010, 159596 | provides compressed air to the pneumatic actuated pump |
| Roswell Park Memorial Institute 1640 (RPMI-1640) | Gibco | A1049101 | cell culture medium for monocyte/macrophage |
| Safe lock Eppendorf tubes (1.5 mL) | Eppendorf | 30120086 | multiple applications (autoclave at step 1) |
| Sodium dodecyl sulfate solution 20% | Sigma | 5030 | Used to clean materials, at a concentration of 0.1%. |
| Silicone O-rings | Technirub | 1250S | to prevent leakage (autoclave at step 1, step 7) |
| Silicone tubing (2.8 mm outer diameter, 400 um wall thickness) | Rubber BV | 1805 | to mount the electrospun tubes on the pressure conduits (autoclave at step 1) |
| Sterile tube (15 mL) | Falcon | 352095 | multiple applications |
| Suture, 5-0 prolene with pre-attached taper point needle | Ethicon, Johnson&Johnson | EH7404H | Prolene suture wire 5-0 (75cm length, TF taper point needle, 1/2 circle, 13 mm needle length) |
| Syringe (24 mL) | B. Braun Melsungen AG | 2057932 | to add the ultrapure water or medium to the hydraulic reservoir or flow culture chamber |
| Syringe filter (0.2 µm) | Satorius | 17597-K | to filter the fibrinogen solution |
| T150 cell culture flask with filter cap | Nunc | 178983 | to degas culture medium |
| T75 Cell culture flask with filter cap | Nunc | 156499 | to culture static control samples |
| Teflon bellow | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to load the hydraulic reservoir (clean outside with a paper tissue with 70% ethanol at step 1 and 7) |
| Tray (stainless steel) | PolarWare | 15-248 | for easy transport of the fluidic culture chambers and the bioreactor from incubator to laminar flow cabinet and back (clean with a paper tissue with 70% ethanol before and after use) |
| Tweezers | Wironit | 4910 | sterile handling of individual parts (autoclave at step 1 and 7) |
| Ultrapure water | Stakpure | Omniapure UV 18200002 | to correct for medium evaporation, mixed with aqua stabil mixed and used as hydraulic fluid. (autoclave ultrapure water at step 1) |
| UV light | Philips | TUV 30W/G30 T8 | for decontamination of grafts and bioreactor parts before seeding |
References
- Chlupác, J., Filová, E., Bacáková, L. Blood vessel replacement: 50 years of development and tissue engineering paradigms in vascular surgery. Physiological Research. 58, 119-139 (2009).
- Huygens, S. A., et al. Bioprosthetic aortic valve replacement in elderly patients: Meta-analysis and microsimulation. The Journal of Thoracic and Cardiovascular Surgery. 157 (6), 2189-2197 (2019).
- Huygens, S. A., et al. Contemporary outcomes after surgical aortic valve replacement with bioprostheses and allografts: a systematic review and meta-analysis. European Journal of Cardio-Thoracic Surgery. 50 (4), 605-616 (2016).
- Loh, S. A., et al. Mid- and long-term results of the treatment of infrainguinal arterial occlusive disease with precuffed expanded polytetrafluoroethylene grafts compared with vein grafts. Annals of Vascular Surgery. 27 (2), 208-217 (2013).
- Tara, S., et al. Vessel bioengineering. Circulation Journal. 78 (1), 12-19 (2014).
- Huang, A. H., Niklason, L. E. Engineering of arteries in vitro. Cellular and Molecular Life Sciences. 71 (11), 2103-2118 (2014).
- Bouten, C. V. C., Smits, A. I. P. M., Baaijens, F. P. T. Can we grow valves inside the heart? Perspective on material-based in situ heart valve tissue engineering. Frontiers in Cardiovascular Medicine. 5, 54 (2018).
- Fioretta, E. S., et al. Next-generation tissue-engineered heart valves with repair, remodelling and regeneration capacity. Nature Reviews Cardiology. , (2020).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Science Translational Medicine. 11 (485), (2019).
- Gutowski, P., et al. Arterial reconstruction with human bioengineered acellular blood vessels in patients with peripheral arterial disease. Journal of Vascular Surgery. , (2020).
- Syedain, Z., et al. Tissue engineering of acellular vascular grafts capable of somatic growth in young lambs. Nature Communications. 7 (12951), 12951 (2016).
- Sugiura, T., et al. Tissue-engineered vascular grafts in children with congenital heart disease: intermediate term follow-up. Seminars in Thoracic and Cardiovascular Surgery. 30 (2), 175-179 (2018).
- Kluin, J., et al. In situ heart valve tissue engineering using a bioresorbable elastomeric implant - material design to 12 months follow-up in sheep. Biomaterials. 125, 101-117 (2017).
- Fioretta, E. S., et al. Differential leaflet remodeling of bone marrow cell pre-seeded versus nonseeded bioresorbable transcatheter pulmonary valve replacements. JACC. Basic to Translational Science. 5 (1), 15-31 (2020).
- Van Haaften, E. E., Bouten, C. V. C., Kurniawan, N. A. Vascular mechanobiology: towards control of. Cells. , 1-24 (2017).
- De Jonge, N., et al. Matrix production and organization by endothelial colony forming cells in mechanically strained engineered tissue constructs. PLoS ONE. 8 (9), 73161 (2013).
- Schmidt, J. B., Chen, K., Tranquillo, R. T. Effects of intermittent and incremental cyclic stretch on ERK signaling and collagen production in engineered tissue. Cellular and Molecular Bioengineering. 9 (1), 55-64 (2016).
- Luo, J., et al. Tissue-engineered vascular grafts with advanced mechanical strength from human iPSCs. Cell Stem Cell. 26 (2), 251-261 (2020).
- Van Haaften, E. E., et al. Decoupling the effect of shear stress and stretch on tissue growth and remodeling in a vascular graft. Tissue Engineering Part C: Methods. 24 (7), 418-429 (2018).
- Gupta, V., Tseng, H., Lawrence, B. D., Jane Grande-Allen, K. Effect of cyclic mechanical strain on glycosaminoglycan and proteoglycan synthesis by heart valve cells. Acta Biomaterialia. 5 (2), 531-540 (2009).
- Lin, S., Mequanint, K. Bioreactor-induced mesenchymal progenitor cell differentiation and elastic fiber assembly in engineered vascular tissues. Acta Biomaterialia. 59, 200-209 (2017).
- Venkataraman, L., Bashur, C. A., Ramamurthi, A. Impact of cyclic stretch on induced elastogenesis within collagenous conduits. Tissue Engineering. Part A. 20 (9-10), 1403-1415 (2014).
- Huang, A. H., et al. Biaxial stretch improves elastic fiber maturation, collagen arrangement, and mechanical properties in engineered arteries. Tissue Engineering Part C Methods. 22 (6), 524-533 (2016).
- Hinderer, S., et al. In vitro elastogenesis: instructing human vascular smooth muscle cells to generate an elastic fiber-containing extracellular matrix scaffold. Biomedical Materials. 10 (3), 034102 (2015).
- Eoh, J. H., et al. Enhanced elastin synthesis and maturation in human vascular smooth muscle tissue derived from induced-pluripotent stem cells. Acta Biomaterialia. 52, 49-59 (2017).
- Smits, A. I. P. M., Bouten, C. V. C. Tissue engineering meets immunoengineering: Prospective on personalized in situ tissue engineering strategies. Current Opinion in Biomedical Engineering. 6, 17-26 (2018).
- Wissing, T. B., Bonito, V., Bouten, C. V. C., Smits, A. I. P. M. Biomaterial-driven in situ cardiovascular tissue engineering-a multi-disciplinary perspective. npj Regenerative Medicine. 2 (1), 18 (2017).
- Hibino, N., et al. A critical role for macrophages in neovessel formation and the development of stenosis in tissue-engineered vascular grafts. The FASEB Journal. 25 (12), 4253-4263 (2011).
- Godwin, J. W., Pinto, A. R., Rosenthal, N. A. Macrophages are required for adult salamander limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9415-9420 (2013).
- Godwin, J. W., Debuque, R., Salimova, E., Rosenthal, N. A. Heart regeneration in the salamander relies on macrophage-mediated control of fibroblast activation and the extracellular landscape. npj Regenerative Medicine. 2 (1), 22 (2017).
- McBane, J. E., Cai, K., Labow, R. S., Santerre, J. P. Co-culturing monocytes with smooth muscle cells improves cell distribution within a degradable polyurethane scaffold and reduces inflammatory cytokines. Acta Biomaterialia. 8 (2), 488-501 (2012).
- Battiston, K. G., Ouyang, B., Labow, R. S., Simmons, C. A., Santerre, J. P. Monocyte/macrophage cytokine activity regulates vascular smooth muscle cell function within a degradable polyurethane scaffold. Acta Biomaterialia. 10 (3), 1146-1155 (2014).
- Ploeger, D. T., et al. Cell plasticity in wound healing: paracrine factors of M1/ M2 polarized macrophages influence the phenotypical state of dermal fibroblasts. Cell Communication and Signaling. 11 (1), 29 (2013).
- McBane, J. E., Santerre, J. P., Labow, R. S. The interaction between hydrolytic and oxidative pathways in macrophage-mediated polyurethane degradation. Journal of Biomedical Materials Research. Part A. 82 (4), 984-994 (2007).
- Wissing, T. B., et al. Macrophage-driven biomaterial degradation depends on scaffold microarchitecture. Frontiers in Bioengineering and Biotechnology. 7, 87 (2019).
- Wolf, M. T., Vodovotz, Y., Tottey, S., Brown, B. N., Badylak, S. F. Predicting in vivo responses to biomaterials via combined in vitro and in silico analysis. Tissue Engineering Part C: Methods. 21 (2), 148-159 (2015).
- Grotenhuis, N., Bayon, Y., Lange, J. F., Van Osch, G. J. V. M., Bastiaansen-Jenniskens, Y. M. A culture model to analyze the acute biomaterial-dependent reaction of human primary macrophages. Biochemical and Biophysical Research Communications. 433 (1), 115-120 (2013).
- Jannasch, M., et al. A comparative multi-parametric in vitro model identifies the power of test conditions to predict the fibrotic tendency of a biomaterial. Scientific Reports. 7 (1), 1689 (2017).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- McWhorter, F. Y., Davis, C. T., Liu, W. F. Physical and mechanical regulation of macrophage phenotype and function. Cellular and Molecular Life Sciences. 72 (7), 1303-1316 (2014).
- Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Strain-dependent modulation of macrophage polarization within scaffolds. Biomaterials. 35 (18), 4919-4928 (2014).
- Dziki, J. L., et al. The effect of mechanical loading upon extracellular matrix bioscaffold-mediated skeletal muscle remodeling. Tissue Engineering. Part A. 24 (1-2), 34-46 (2018).
- Wissing, T. B., et al. Hemodynamic loads distinctively impact the secretory profile of biomaterial-activated macrophages - implications for in situ vascular tissue engineering. Biomaterials Science. 8 (1), 132-147 (2020).
- Van Haaften, E. E., Wissing, T. B., Kurniawan, N. A., Smits, A. I. P. M., Bouten, C. V. C. Human in vitro model mimicking material-driven vascular regeneration reveals how cyclic stretch and shear stress differentially modulate inflammation and matrix deposition. Advanced Biosystems. 4 (6), 1900249 (2020).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Bonito, V., de Kort, B. J., Bouten, C. V. C., Smits, A. I. P. M. Cyclic strain affects macrophage cytokine secretion and extracellular matrix turnover in electrospun scaffolds. Tissue Engineering Part A. 25 (17-18), 1310-1325 (2019).
- Battiston, K. G., Labow, R. S., Simmons, C. A., Santerre, J. P. Immunomodulatory polymeric scaffold enhances extracellular matrix production in cell co-cultures under dynamic mechanical stimulation. Acta Biomaterialia. 24, 74-86 (2015).
- Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. A mesofluidics-based test platform for systematic development of scaffolds for in situ cardiovascular tissue engineering. Tissue Engineering Part C: Methods. 18 (6), 475-485 (2012).
- Smits, A. I. P. M., Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. T. Shear flow affects selective monocyte recruitment into MCP-1-loaded scaffolds. Journal of Cellular and Molecular Medicine. 18 (11), 2176-2188 (2014).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Fahy, N., Menzel, U., Alini, M., Stoddart, M. J. Shear and dynamic compression modulates the inflammatory phenotype of human monocytes in vitro. Frontiers in Immunology. 10, 383 (2019).
- Pennings, I., et al. Layer-specific cell differentiation in bi-layered vascular grafts under flow perfusion. Biofabrication. 12 (1), 015009 (2019).
- Wang, J., et al. Ex vivo blood vessel bioreactor for analysis of the biodegradation of magnesium stent models with and without vessel wall integration. Acta Biomater. 50, 546-555 (2017).
- Huang, A. H., et al. Design and use of a novel bioreactor for regeneration of biaxially stretched tissue-engineered vessels. Tissue Engineering. Part C, Methods. 21 (8), 841-851 (2015).
- Huang, A. H., Niklason, L. E. Engineering biological-based vascular grafts using a pulsatile bioreactor. Journal of Visualized Experiments. (52), e2646 (2011).
- Bono, N., et al. A Dual-mode bioreactor system for tissue engineered vascular models. Annals of Biomedical Engineering. 45 (6), 1496-1510 (2017).
- Wolf, F., et al. VascuTrainer: a mobile and disposable bioreactor system for the conditioning of tissue-engineered vascular grafts. Annals of Biomedical Engineering. 46 (4), 616-626 (2018).
- Ramaswamy, S., et al. A novel bioreactor for mechanobiological studies of engineered heart valve tissue formation under pulmonary arterial physiological flow conditions. Journal of Biomechanical Engineering. 136 (12), 121009 (2014).
- Piola, M., et al. A compact and automated ex vivo vessel culture system for the pulsatile pressure conditioning of human saphenous veins. Journal of Tissue Engineering and Regenerative Medicine. 10 (3), 204-215 (2016).
- Vanerio, N., Stijnen, M., de Mol, B. A. J. M., Kock, L. M. An innovative ex vivo vascular bioreactor as comprehensive tool to study the behavior of native blood vessels under physiologically relevant conditions. Journal of Engineering and Science in Medical Diagnostics and Therapy. 2 (4), (2019).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplantation. 27 (9), 1375-1389 (2018).
- Sinha, R., et al. A medium throughput device to study the effects of combinations of surface strains and fluid-flow shear stresses on cells. Lab on a Chip. 15 (2), 429-439 (2015).
- Beca, B. M., Sun, Y., Wong, E., Moraes, C., Simmons, C. A. Dynamic bioreactors with integrated microfabricated devices for mechanobiological screening. Tissue Engineering Part C: Methods. 25 (10), 581-592 (2019).
- Liu, H., Usprech, J., Sun, Y., Simmons, C. A. A microfabricated platform with hydrogel arrays for 3D mechanical stimulation of cells. Acta Biomaterialia. 34, 113-124 (2016).
- Szafron, J. M., Ramachandra, A. B., Breuer, C. K., Marsden, A. L., Humphrey, J. D. Optimization of tissue-engineered vascular graft design using computational modeling. Tissue Engineering Part C: Methods. 25 (10), 561-570 (2019).
- Emmert, M. Y., et al. Computational modeling guides tissue-engineered heart valve design for long-term in vivo performance in a translational sheep model. Science Translational Medicine. 10 (440), (2018).
- Mol, A., et al. Fibrin as a cell carrier in cardiovascular tissue engineering applications. Biomaterials. 26 (16), 3113-3121 (2005).
- van Kelle, M. A. J., et al. A Bioreactor to identify the driving mechanical stimuli of tissue growth and remodeling. Tissue Engineering Part C: Methods. 23 (6), (2017).
- van den Broek, C. N., et al. Medium with blood-analog mechanical properties for cardiovascular tissue culturing. Biorheology. 45 (6), 651-661 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved