Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Akış ve Esneme Altında Biyomalzemelerin Enflamatuar ve Rejeneratif Kapasitesini Değerlendirmek için Çok İşaretli Bir Biyoreaktör
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokolün amacı, kesme stresi ve döngüsel esnemenin birleşmesini sağlayan bir biyoreaktör kullanarak, malzeme güdümlü doku yenilenmesini araştırmak için tübüler elektrospun iskelelerinde insan makrofajları ve miyofibroblastların dinamik bir ortak kültürünü yürütmektir.
Özet
Resorbe edilebilir biyomalzemelerin doğrudan vücutta yenilenmeyi teşvik etmek için kullanılması, çevirisel açıdan çekici bir stratejidir. Bu tür malzemeler implantasyon üzerine enflamatuar bir yanıta neden olur, bu da malzemenin daha sonra emilmesinin ve yeni dokunun yenilenmesinin sürücüsüdür. Yerinde doku mühendisliği olarak da bilinen bu strateji, doku mühendisliği vasküler greftler gibi kardiyovasküler yedekler elde etmek için izlenmiştir. Hem enflamatuar hem de rejeneratif süreçler, iskeledeki lokal biyomekanik ipuçları (yani, esneme ve kesme stresi) ile belirlenir. Burada, borulu bir iskelede streç ve kesme stresinin ayrıştırılmasını benzersiz bir şekilde sağlayan özel olarak geliştirilmiş bir biyoreaktörün kullanımını ayrıntılı olarak açıklıyoruz. Bu, insan makrofajları ve miyofibroblastları kullanarak dinamik bir ortak kültür deneyine dayanarak gösterdiğimiz iyi kontrol edilmiş mekanik yüklerin etkisi altında tübüler iskelelerin enflamatuar ve rejeneratif kapasitesinin sistematik ve standart olarak değerlendirilmesine izin verir. Bu yaklaşımdaki temel pratik adımlar (biyoreaktörün inşası ve kurulması, iskelelerin ve hücre tohumlamanın hazırlanması, streç ve kesme akışının uygulanması ve bakımı ve analiz için numune hasadı) ayrıntılı olarak ele alınmıştır.
Giriş
Kardiyovasküler doku mühendisliği (TE),1,2,3,4hastalarının büyük kohortları için yetersiz olan şu anda kullanılan kalıcı kardiyovasküler protezlere (örneğin, vasküler greftler, kalp kapak değiştirmeleri) alternatif bir tedavi seçeneği olarak takip edilmektedir. Çok aranan uygulamalar arasında doku mühendisliği yapılmış vasküler greftler (TEVG'ler) 5,6 ve kalp kapakçıkları (TEHV' ler)7,8bulunur. Çoğu zaman, kardiyovasküler TE metodolojileri, oluşacak yeni doku için öğretici bir iskele görevi gören yeniden sıralanabilir biyomalzemelerden (doğal veya sentetik) yararlanır. Yeni doku oluşumu tamamen in vitro olarak mühendislik yapılabilir, implantasyondan önce bir biyoreaktörde (in vitro TE) 9,10,11veya doğrudan in situ, sentetik iskelenin doğrudan vücutta yeni doku oluşumunu teşvik etmek için ön kültleme yapılmadan implante edildiği hücreli ve kültlü iskeleyi tohumlayarak (yerinde TE)12,13,14. Hem in vitro hem de in situ kardiyovasküler TE yaklaşımları için, başarılı fonksiyonel rejenerasyon baskın olarak hem implante yapıya konak immün yanıtına hem de uygun biyomekanik yüklemeye bağlıdır.
Kardiyovasküler TE için biyomekanik yüklemenin önemi iyi kabul edilir15. Kardiyovasküler implantlarda, iskeleyi dolduran hücreler hemodinamik ortamın bir sonucu olarak ortaya çıkan döngüsel esneme ve kesme streslerine maruz kalır. Çok sayıda çalışma, (döngüsel) esnemenin kollajen16 , 17 , 18,19,glikozaminoglisekanlar (GAG) 20 ve elastin21,22gibi matris bileşenlerinin oluşumu üzerindeki uyarıcı etkisini çeşitli hücre tiplerine göre bildirmektedir. Örneğin, Huang ve ark. biaksiyel streç bir vasküler biyoreaktör kullanarak in vitro TEVGs kollajen ve elastin birikimini ve organizasyonununu yükselttini göstermiştir23. Vurgu tipik olarak baskın yük olarak esnemeye dayansa da, bu çalışmalar genellikle numunenin kesme akışına da maruz kaldığı akış tahrikli biyoreaktörlerden yararlanır. Kesme gerilmelerinin 3D doku oluşumu ve iltihaplanma üzerindeki izole etkisi hakkında nispeten az şey bilinmesine rağmen, bazı veriler mevcuttur. Örneğin, Hinderer ve ark. ve Eoh ve arkadaşları, 3D iskele mikro yapısına ek olarak, in vitro model sistemde insan damar düz kas hücreleri tarafından olgun elastin oluşumu için önemli olduğunu göstermiştir24,25. Bu bulgular, kardiyovasküler TE için hem döngüsel esneme hem de kesme stresinin alaka düzeyini göstermektedir.
TE implantlarının başarısı veya başarısızlığı için bir diğer önemli belirleyici, konağın implante grefte immün yanıtıdır26. Bu, hücresel akın ve endojen doku oluşumu ve yeniden şekillendirme27sonraki süreçlerini başlatmak için iskeleye akut enflamatuar yanıta dayanan malzeme odaklı in situ TE stratejileri için özellikle önemlidir. Makrofaj,28,29,30gibi birden fazla çalışma ile gösterilen fonksiyonel doku yenilenmesinin kritik bir başlatıcısıdır. Yara iyileşmesine benzer şekilde, dokunun yenilenmesi makrofajlar ve fibroblastlar ve miyofibroblastlar31, 32,33 gibi doku üreten hücreler arasında parakrin sinyal ile yönetilir. Yeni doku birikimini koordine ederek, makrofajlar yabancı iskele malzemesi34,35'inaktif resorpsiyonunda yer almaktadır. Bu nedenle, bir biyomalzeme in vitro makrofaj yanıtı, implantların in vivo başarısı için tahmine dayalı bir parametre olarak tanımlanmıştır36,37,38.
İmplante edilmiş bir iskeleye makrofaj yanıtı, malzeme bileşimi ve mikroyapı35, 39,40gibi iskele tasarım özelliklerine bağlıdır. İskele özelliklerine ek olarak, bir iskeleye makrofaj tepkisi ve myofibroblasts ile çapraz konuşmaları da hemodinamik yüklerden etkilenmiştir. Örneğin, döngüsel streç makrofaj fenotip41 , 42,43,44ve sitokinlerinsalgılanması önemli bir modülatör olarak gösterilmiştir43,44,45,46 3D elektrospun iskelelerde. Makrofajlar ve vasküler düz kas hücrelerinden oluşan bir ortak kültür sistemi kullanan Battiston ve arkadaşları, makrofajların varlığının elastin ve GAG seviyelerinin artmasına yol açtığını ve orta derecede döngüsel esneme seviyelerinin (1.07-1.10) kollajen I ve elastin47'ninbirikmesini uyardığını göstermiştir. Önceki çalışmalarda, kesme stresinin 3D elektrospun iskeleleri48,49'a monosit alımı için önemli bir belirleyici olduğunu ve hem kesme stresinin hem de döngüsel esnemenin insan monositleri ve mezenkimal stromal hücreler arasındaki parakrin sinyali etkilediğini gösterdik50. Fahy ve arkadaşları, kesme akışının insan monositleri tarafından pro-enflamatuar sitokinlerin salgısını artırdığını göstermiştir51.
Birlikte ele alındığında, yukarıdaki kanıtlar hemodinamik yükler üzerinde yeterli bir anlayış ve kontrolün kardiyovasküler TE için çok önemli olduğunu ve bunu başarmak için enflamatuar yanıtın göz önünde bulundurulmasının önemli olduğunu göstermektedir. Daha önce in vitro52 , 53 , 54 ,55,56,57,58veya ex vivo59,60 ,61kardiyovasküler doku kültürü için çok sayıda biyoreaktör tanımlanmıştır. Bununla birlikte, tüm bu sistemler fizyolojik hemodinamik yükleme koşullarını mümkün olduğunca taklit etmek için tasarlanmıştır. Bu, kardiyovasküler dokuların in vitro olarak oluşturulması veya ex vivo kültürlerinin korunması amacıyla son derece değerli olsa da, bu tür sistemler bireysel ipuçlarının bireysel etkilerine sistematik çalışmalara izin vermez. Bunun nedeni, bu biyoreaktörlerde hem döngüsel esneme hem de kesme stresinin uygulanmasının, özünde onları bağlayan aynı basınçlı akış tarafından yönlendirilmesidir. Doğru çok işaretli mekanik manipülasyona izin veren mikrosistemler 2D substratlar62 veya 3D hidrojel kurulumları63,64için açıklanmış olsada,bu tür kurulumlar elastomerik 3D biyomalzeme iskelelerinin birleştirilmesine izin vermez.
Burada, kesme stresi ve döngüsel esnemenin ayrışmasını benzersiz bir şekilde sağlayan ve bireysel ve kombine etkilerini mekanistik olarak araştırmaya yardımcı olan bir tübüler biyoreaktör sisteminin uygulanmasını sunuyoruz. Bu sistem, çok çeşitli doku mühendisliği vasküler greftlerin (örneğin sentetik veya doğal kökenli, farklı mikro mimari, çeşitli gözeneklilikler) testine izin verir. Kesme gerilme ve germe uygulamasını etkili bir şekilde ayrıştırmak için, biyoreaktörün kullandığı temel kavramlar (1) ayrı pompa sistemleri kullanılarak kesme stresi ve esneme kontrolünün ayrılması ve (2) iskelelerin hesaplama odaklı boyutlara sahip 'içten dışa' bir şekilde uyarılmasıdır. Akış, borulu iskelenin dış yüzeyine bir akış pompası kullanılarak uygulanırken, iskelenin çevresel gerilmesi, iskelenin ayrı bir gerinim pompası kullanılarak monte edildiği silikon bir tüp genişletilerek indüklenmiştir. Silikon tüpün boyutları ve yapıyı içeren cam tüp, iskeledeki kesme stresinin (akış nedeniyle) ve çevresel germenin (tüp genişlemesi nedeniyle) birbirini önemli ölçüde etkilememesini sağlamak için hesaplamalı akışkan dinamiği simülasyonları kullanılarak özenle seçilir ve doğrulanır. Bu içten dışa tasarımın birkaç pratik mantığı vardır. Streç, ışık sıvısı basıncı (fizyolojik yüklemeye benzer) tarafından uygulanırsa, doğal olarak numune tasarımının sızdırmaz olmasını gerektirir. Ek olarak, numuneyi germek için gereken basınç, numuneler arasında ve zaman içinde bir numune içinde değişebilen numune sertliği tarafından tamamen belirlenir ve bu da esnemeyi kontrol etmeyi zorlaştırır. Bu biyoreaktör, doku mühendisliği yapılan grefti silikon bir tüpün etrafına monte eder ve greftin dış duvarında duvar kesme stresi (WSS) uygulamasına izin verir ve grefti içeriden basınçlandırır. Bu şekilde, numuneler arasında ve zaman içinde numuneler içinde eşit yükleme koşulları sağlanabilir ve dahası, gözenekli vasküler iskelelerde yaygın olduğu gibi numunelerin sızdırılmasına izin verilir19. Bu içten dışa biyoreaktör, geleneksel vasküler biyoreaktör kurulumlarının daha uygun olduğu doğal benzeri bir kan damarı in vitro mühendisliği yerine, kesme ve/ veya esnemenin etkileri üzerine sistematik çalışmalar için özel olarak tasarlanmıştır. Biyoreaktör tasarım çizimleri için Şekil 1A–B'ye ve biyoreaktörün ana bileşenlerinin arkasında işlevsel bir açıklama ve rasyonellik için ilgili Tablo 1'e bakın.
Biyoreaktör kullanımı, grubumuz tarafından, yerinde kardiyovasküler doku için resorbable elektrospun iskelelerinde kesme stresi ve döngüsel streçlerin iltihaplanma ve doku oluşumu üzerindeki bireysel ve kombine etkilerini araştırdığımız bir dizi yeni çalışmaya dayanarak gösterilmiştir19,43,44. Bu amaçla, in situ rejeneratif çağlayanın çeşitli aşamalarını simüle etmek için mono veya ortak kültürde insan makrofajları ve miyofibroblastları kullandık. İnsan makrofajları tarafından sitokin salgılamanın hem döngüsel streç hem de kesme stresinden belirgin bir şekilde etkilendiğini, bu iskelelerdeki insan miofibroblastları tarafından matris birikimini ve organizasyonunu etkilediğini, hem parakrin sinyalizasyon hem de doğrudan temas yoluyla19,43,44. Özellikle, bu çalışmalar, kesme stresi ve esnemenin kombine uygulanması durumunda, doku oluşumu ve iltihabı üzerindeki etkilerin ya iki yüklerden birinin hakim olduğunu ya da her iki yükün sinerjik etkilerinin olduğunu ortaya koydu. Bu bulgular, mekanik ortamın TE proseslerine olan katkısını daha iyi anlamak için her iki yükün ayrıştırmasının alaka düzeyini göstermektedir. Bu anlayış, ilgili hemodinamik yükleme rejimlerinde iskele tasarım parametrelerini sistematik olarak optimize etmek için uygulanabilir. Buna ek olarak, bu tür iyi kontrol edilen ortamlardan elde edilen mekanistik veriler, yakın zamanda TEVG 65 veya TEHV66 için bildirildiği gibi, yerinde doku tadilatının seyrini tahmin etmek için geliştirilen sayısal modeller için girdi görevi görebilirsiniz.
Protokol
Bu protokolde açıklanan çalışmalarda periferik kan buffy coats'dan izole edilmiş primer insan makrofajları ve koroner by-pass ameliyatından sonra saphenous damardan izole edilmiş insan miyofibroblastlarıkullanılmıştır 44. Buffy paltolar, Sanquin Araştırma Kurumsal Tıbbi Etik Komitesi tarafından onaylanan yazılı bilgilendirilmiş onay sağlayan sağlıklı, anonimleştirilmiş gönüllülerden elde edildi. İnsan vena saphena hücrelerinin (HCSC) kullanımı, Hollanda'daki Tıp Toplulukları Federasyonu (FMWV) tarafından geliştirilen "İnsan Dokusunun Kod Uygun İkincil Kullanımına" uygundu.
1. Biyoreaktör Kurmadan Önce Genel Hazırlıklar ve Gerekli Eylemler
NOT: İlgili izolasyon ve kült protokoller hakkında ayrıntılı bilgi için lütfen önceki çalışma19,43,44'e bakın. Protokoldeki tüm hesaplamalar, 8 hemodinamik yüklü iskele ve 2 statik kontrolde tohumlanmış monositler ve miofibroblastlarla ortak kültür deneyi için örnek olarak verilmiştir (n=10).
- Hücre yalıtımı ve hücre kültürünü başlatın. Monositlerin ve miyofibroblastların ortak kültürlü örnekleri için tohumlama yoğunlukları (tohumlama oranı 2:1 olan) sırasıyla 30 ×10 6 monosit/cm3 ve 15 × 106 miyofibroblast/cm3'tür.
NOT: Elektrospun malzemesi yüksek gözenekliliğe sahiptir (%>90). Greft başına gerekli hücre sayısını tahmin etmek için, iskelenin hacmi içi boş bir silindirin hacmi formülü ile hesaplanır: π*(kalınlık)2* uzunluk ≈ 0.04 cm3. Greft başına toplam hücre miktarı 1.2 × 106 monosit ve 0.6 × 106 miyofibroblasttır. 10 örnek için en az 12 × 106 monosit ve 6 × 106 miyofibroblast gereklidir; olası pipetleme hatalarını hesaba katmak için ~%10-15'e kadar daha fazla hücre ile başlayın. - Biyoreaktör ile ilgili deneyler için kullanılacak hücre kültürü ortamını degas.
- Ortamı% 10 fetal sığır serumu,% 1 penisilin-streptomisinin ve% 0.5 L-glutamin ile desteklenmiş RPMI-1640:aDMEM (1:1) oluşan ortak kültürler için hazırlayın.
- Ortamı geceleme (O/N) bir hücre kültürü şişesine filtre kapağı ile gazdan arındırıcıya yerleştirin.
- Filtre kapağını hava geçirmez bir kapakla değiştirin ve 4 °C'de saklayın.
- Kullanmadan hemen önce, ortama 0,25 mg/mL L-askorbik asit 2-fosfat (C vitamini) ekleyin.
NOT: Hesaplamalar için akış kültürü odası başına gereken ortam miktarı 50 mL'dir. Ortamı haftada üç kez yenileyin; 25 mL eski ortam, 25 mL taze ortam ile değiştirilir. 10 örnek için; tohumlamadan sonra, toplam 500 mL taze ortam gereklidir ve sonraki her orta değişiklik için toplam 250 mL taze ortam kullanılır. Her zaman orta taze hazırlayın, özellikle ortamı değiştirmeden hemen önce C vitamini eklenmelidir.
- Van Haaften ve ark. 19 (Şekil 1G–I)tarafından açıklandığı gibi izotropik elektrospun iskeleleri(3 mm parlak çap, 200 μm duvar kalınlığı)hazırlayın. Kısacası, tübüler polikrolektoz bisurea (PCL-BU) iskeleler% 15 (w/ w) kloroform-polimer çözeltilerinden elektrospinning ile üretilir. Polimer çözeltileri oda sıcaklığında elektrospun ve %30 bağıl nemde, 40 μL/dk debide, dönen silindirik hedefe (Ø 3 mm, 500 rpm) 16 cm mesafede ve elektrospinning nozülde 16 kV ve hedefte -1 kV uygulamalı voltajdır.
NOT: Bu deneyler için PCL-BU greftleri kullanılsa da, bu biyoreaktöre çok çeşitli elastomerik doku mühendisliği greftler monte edilebilir (örneğin, farklı sentetik veya doğal kökenli, farklı mikro mimarisi, farklı gözeneklilikler)- Elektrospun iskelelerini mandrelden çıkarın.
- Mandrel'i merkezde 'tutmak' ve tüpün duvarına dokunmasını önlemek için 15 mL'lik bir tüpün kapağında küçük bir delik açın.
- Mandrel'i elektrospun iskelesi ile şahin tüpüne yerleştirin ve deiyonize suyla doldurun.
- Tüpleri -20 °C'de dondurun.
- Tüpleri oda sıcaklığına (RT) yerleştirin ve birkaç dakika sonra mandrelleri dışarı çekin, elektrospun greftlerini buzda bırakın.
- Buzun tamamen çözülmesine izin verin, elektrospun tüpünü çözülmüş sudan çıkarın ve birkaç saat boyunca dikey olarak kurumaya 'asın'. İskelelerin kendi ağırlıkları altında 'çökmemesine' dikkat edin.
- Vakumlu ameliyathane altında kuru iskeleler.
- Mikroyapılarını (örneğin, fiber morfolojisi, lif çapı) değerlendirmek için taramalı elektron mikroskopisi (SEM) kullanarak elektrospun greftlerinin küçük bir örneğini görüntüleyin. Örnek çalışmalardaki greftler izotropik lif yönelimine ve 5 μm lif çapına sahiptir(Şekil 1H–I).
- Elektrospun iskelelerini mandrelden çıkarın.
- Deneye başlamadan bir gün önce, deiyonize su ile dolu hidrolik rezervuarı inkübatöre yerleştirin. Akış kültürü odaları için sekiz bağlantının tümlerini beyaz Luer kapaklarıyla kapatın. Basınçlı hava sistemine bağlanın ve basınç sensörini takın. Teflon körüklerinin küçük bir genişlemesine izin vermek için gerinim pompasını çalıştırın (bkz. adım 5.6) O/N.
NOT: Gerekli tüm malzeme ve ekipmanlarıntemizlendiğini ve/veya otomatik olarak kapatıldığını unutmayın (bkz. Malzeme Tablosu , Yorumlar/Açıklama sütununa bakın), malzemelerin otomatik olarak kapatılmasına izin verilir), üreticinin protokolüne göre veya 7.3–7.6 adımlarında açıklandığı gibi. - Protokolün geri kalanı için steril çalışma koşullarından emin olun.
- Steril bir laminar akış kabininde 2-5.3 (sistemi kurma), adım 6.3 (orta değişiklik) ve 7.1-7.2 adımlarını (vasküler yapıların hasadı) gerçekleştirin.
- Her şeyi mümkün olduğunca temiz tutmak için sonraki adımlar için doğrudan gerekli olmayan malzemeleri kapalı Petri kaplarına yerleştirin.
- %70 etanol içeren bir kağıt mendili ıslatarak malzeme yüzeylerini düzenli olarak temizleyin veya kurulayın ve biyoreaktör bileşenlerinin ve laminar akış kabininin yüzeylerini silin.
2. Biyoreaktörün Kurulması
NOT: Laminer akış kabininde 2.
- Elektrospun iskelelerini yaklaşık 25 mm uzunluğunda tüpler halinde kesin ve kullanmadan önce belgeleyin (örneğin, uzunluk için fotoğraf, ilk kütle için terazi ile tartın).
- Elektrospun iskelelerini arındırın.
- Elektrospun iskelelerini, UV ışığının (253,7 nm) iskelelerin içini aydınlatmasını sağlamak için ultraviyole (UV) ışık kaynağına bakan bir açıklıkla bir kuyu plakasına veya Petri kabına yerleştirin.
- Elektrospun iskelelerini 5 dakika boyunca UV ışığına maruz bırak.
- Tüm iskeleleri çevirin ve diğer açıklık için UV aydınlatmasını tekrarlayın.
NOT: Bu adımdan sonra, elektrospun iskeleye sadece gerektiğinde dokunun. Her zaman temiz cımbız veya temiz eldiven kullanın. - % 70 oranında depolanan akış kültürü odalarının cam tüplerini alın, cam tüpleri ultra saf suda yıkayın, kurutun ve büyük, kapalı bir Petri kabına yerleştirin.
NOT: Aşağıdaki adımlar, özellikle 2.3–2.5 adımları, iki deneyci tarafından ideal olarak gerçekleştirilir.
- Elektrospun iskelelerini silikon boruya monte edin.
- 5-0 prolene sütürünü silikon borunun bir ucuna takın, dikişi tüpün bir tarafından geçirip diğerinden çıkararak, borunun kesitini kapsayan iki zıt gergin dikiş bırakın. Tüpü düğümlerin çekirgesinde sıkıştırırken tüpün her iki tarafına küçük bir düğüm yapın ve her iki düğümde de yaklaşık 10 cm tel bırakın. İki 10 cm sol telin sonunda üçüncü bir düğüm yapın.
- Dikiş iğnesini ve dışarı çıkıp elektrospun iskelesinin içine zarar verebilecek tüm serbest iplikleri kesin. Silikon borunun kenarlarını üçgen şeklinde keserek silikon borunun elektrospun iskeleden çekilmesine yardımcı olur.
- Elektrospun iskelesini% 30 etanol içine batırın (bu ekstra dekontaminasyon adımı görevi görür ve elektrospun iskelesini silikon borunun üzerine kaydırarak yardımcı olur) ve elektrospun iskelesini serbest 10 cm telin üzerine yerleştirin. Experimenter A, hem silikon boruyu hem de 10 cm'lik dikiş telinin düğümünü hafifçe çekerek silikon boruyu uzatırken, deneyci B, elektrospun iskelesini, iskelelerin zarar vermesini önlemek için pürüzsüz bir iç uçlu cımbız kullanarak silikon borunun üzerine hafifçe kaydırır.
- Elektrospun iskelesini cımbızla aynı anda pürüzsüzleştirirken silikon boru üzerindeki streçleri yavaşça serbest bırakın. Elektrospun iskelesini silikon boruya iki kez ultra saf suya batırın.
NOT: Elektrospun iskelesinin bir miktar buruşukluğu meydana gelebilir. Bu buruşma, 2.5.3 adımında iskeleleri basınç kanallarına sabitlemeden hemen önce uygulanan ön streç sırasında kaybolacaktır. - Diğer elektrospun iskeleleri için 2.3.2 ve 2.3.3 adımlarını yineleyin. Silikon borunun uzunluğuna bağlı olarak, aynı silikon boruya birden fazla elektrospun iskelesi monte edilebilir.
- Tüm elektrospun iskeleleri silikon boruya monte edildiğinde, silikon boruyu iskelelerin etrafına, hepsi aynı uzunluğa (5,5 cm) kesin; bir tarafta, elektrospun iskelesinin ucuna yakın, diğer tarafta ~ 2-3 cm serbest silikon boru bırakarak.
- 5-0 prolene sütürünü silikon borunun bir ucuna takın, dikişi tüpün bir tarafından geçirip diğerinden çıkararak, borunun kesitini kapsayan iki zıt gergin dikiş bırakın. Tüpü düğümlerin çekirgesinde sıkıştırırken tüpün her iki tarafına küçük bir düğüm yapın ve her iki düğümde de yaklaşık 10 cm tel bırakın. İki 10 cm sol telin sonunda üçüncü bir düğüm yapın.
- Akış kültürü odasının alt bölmesini inşa edin(Şekil 1A–B).
- Akış çıkışını içeren alt bölmenin üst kısmını alın ve akış çıkışını erkek bir Luer fişi ile kapatın.
- Basınç kanalını delikli olarak alt bölmeden geçirin ve sızıntıyı önlemek için basınç kanalının alt ucuna silikon bir O-halka yerleştirin. Basınç kanalını sabitlemek için alt bölmenin alt kısmını alt bölmenin üst kısmına vidaleyin. Basınç kanalının alt oyma oluğunun, alt bölmenin adaptör burçlarının kenarından yaklaşık 3-5 mm yukarıda olduğundan emin olun; bu daha sonra dikiş telinin sıkı düğümünü 'tutacak', elektrospun iskelesini silikon borunun üzerine sabitleyecektir.
NOT: Basınç kanalı kolayca yukarı ve aşağı manevra yapılabiliyorsa, alt bölmenin iyi sabitlenmemiş olduğunu gösterir. Daha sonraki aşamalarda sızıntıyı önlemek için 2.4.2 adımlarını yineleyin (Şekil 2D).
- Silikon boruyu elektrospun iskelesi ile basınç kanalına sabitleyin.
- Silikon tüpü elektrospun iskelesi ile basınç kanalının üzerine çekin.
- Basınç kanalı üzerindeki oyma oluğun bulunduğu yerde elektrospun iskelesinin alt ucundaki dikiş teli ile bir düğüm yapın. Silikon boruyu elektrospun grefti ile sıkıca sabitlemek için karşı tarafta ikinci bir düğüm yapın.
DİkKAT: Bu kritik bir adımdır. Suyun hidrolik rezervuardan akış kültürü odalarına sızmasını önlemek için düğümün basınç kanalının oyulmuş oluğuna tam olarak 'düştüğünden' emin olun. Emin değilseniz, son düğümlerin tam olarak oyma oluğunda olduğundan emin olmak için dikiş telini oluğun beklenen yerinin üstünde veya altında birkaç pozisyonda sıkmaya çalışın (Şekil 2A). - Makas kelepçesini silikon tüpün üst ucuna yerleştirin ve silikon boruyu yukarı doğru uzatın (bu doğrudan ilk düğümü test edecektir, eğer elektrospun iskelesi ile silikon boruyu basınç kanalının üzerine taşımak mümkünse, yeterince iyi sıkılaşmamıştır). Çekme kuvveti ile silikon boru önceden gerilir. Silikon borunun farklı numuneler arasında tutarlı olduğundan emin olmak için makas kelepçesine bir cetvel takın. Cetvelin alt ucu iskelenin alt ucunun yüksekliğine ulaşana kadar makas kelepçesini yukarı doğru çekin.
NOT: Her numunedeki ön streç yaklaşık olarak aynı (~%5) iki nedenden dolayı önemlidir: (1) silikon boru önceden gerilmişse, basınçlandırıldığında numunenin uzunluğu boyunca daha homojen genişlemeye neden olur; (2) ön streç silikonun mekanik özelliklerini etkileyecektir, bu nedenle numuneler arasında eşit esneme koşulları sağlamak için tüm numunelerde aynı olmalıdır. - Elektrospun iskelesini hafifçe çekerek elektrospun iskeleslerindeki kırışıklıkları giderin. Yine, basınç kanalı üzerindeki üst oyma oluğun bulunduğu yerde iskelenin üst ucunda bir dikiş teli ile her iki taraftan iki düğüm yapın.
- Makas kelepçesini bırakın ve burun konisi vida ipliğine monte edildiğinde sızıntıyı önlemek için silikon borunun fazlalığını bir bıçakla kesin ve vida ipliğinin% 20-30'unu silikon boru ile kaplı bırakın.
NOT: Tüm dinamik örnekler için 2.4 ve 2.5 adımlarını yineleyin. - Statik kontrol numuneleri için silikon boruya monte edilen elektrospun iskelesini deliksiz basınç kanallarında sabitleyin. Bu kanallar tohumlanana kadar 15 mL'lik bir tüpte ayrı ayrı tutulabilir (adım 4) ve akış kültürü odası bölmelerine monte edilmesi gerekmez.
- Kısmen inşa edilmiş akış kültürü odalarını 10 dakika boyunca UV ışığına maruz bırakarak elektrospun iskelesi ile arındırın. Elektrospun iskeleli akış kültürü odalarını diğer tarafa çevirin ve UV ışığına maruz kalmayı 10 dakika boyunca tekrarlayın.
- Burun konilerini, dinamik numuneler için delikli basınç kanallarının vida ipliğine vidaleyin.
- Silikon borunun üst ucunun burun konisine sığmasını sağlayarak daha sonraki aşamalarda sızıntıyı önleyin. Çok fazla silikon boru varsa, boru fazlalığını bir bıçakla kesin.
- Kısmen inşa edilmiş akış kültürü odalarını büyük bir Petri kabına yerleştirin ve burun konisini UV ışık kaynağına doğru yönlendirin. 5 dakika boyunca UV aydınlatma uygulayın.
- Akış kültürü odasının cam tüpü ve akış kültürü odasının üst bölmesi ile akış kültürü odasının komple inşası (Şekil 1A–B).
- Basınç kanalını silikon boru ve elektrospun iskelesi ile % 30 etanol içine batırarak elektrospun iskelelerini önceden ıslatın, ardından iki kez ultra saf suya daldırın.
- Cam tüpü basınç kanalının üzerine yerleştirin ve alt bölmeye hafifçe itin ve hafifçe sabitleyin.
- Akış girişini içeren üst bölmeyi alın, silikon bir O-halkası, akış düzleştiricisi ve adaptör burçlarını doğru sırayla (Şekil 1A–B)yerleştirin ve cam tüpün açık ucuna yerleştirin ve hafifçe sabitleyin.
- Üst bölmenin akış girişine beyaz bir Luer kapağı vidala.
- Erkek Luer fişini alt bölmenin akış çıkışından çıkarın ve etrafındaki yüzeyi etanolle ıslatılmış bir kağıt mendille temizleyin.
- Akış çıkışına 10 mL ultra saf su ile bir şırınna yerleştirin, üst bölmedeki beyaz Luer kapağını açın ve odayı ultra saf suyla doldurun. Beyaz Luer kapağını tekrar kapatın, şırınnayı çıkarın, etanol ile tekrar temizleyin ve akış çıkışını erkek bir Luer fişi ile kapatın.
NOT: Tüm akış kültürü odaları için 2.6–2.8 adımlarını yineleyin. - Statik kontroller için, basınç kanallarına monte edilen numuneleri deliksiz tutan 15 mL'lik tüplere 10 mL ultra saf su ekleyin.
- Tüm akış kültürü odalarını inkübatöre yerleştirin. Hücre tohumlamadan bir gün önce ultra saf suyu, 2.8.5 ve 2.8.6 adımlarında açıklandığı gibi kültür ortamıyla değiştirin ('eski' ultra saf suyu doğrudan akış çıkışına yerleştirilmiş etanol kaplı bir kağıt mendille topladığından emin olun).
[Protokol burada duraklatılabilir]
3. Akış pompası kurulumu için hazırlıklar
NOT: Laminer akış kabininde 3.
- Tüm pompa kurulum malzemelerini toplayın ve kullanıma hazırlanın.
NOT: Deneyciler, pompayı, akışkan üniteleri ve orta boruyu akışkan ünitenin valflerinden kurmanın ayrıntılı bir açıklaması için üreticinin protokolüne başvurulur.- Pompayı 200 mbar kapasiteye ayarlayın.
- Rezervuar tutucularını 60 mL rezervuarlar için akışkan ünitelere vidala.
- Yeniden kullanılabilir kauçuk hava filtrelerini etanol içine batırılmış bir kağıt mendille temizleyin, hava filtresinin kuru kaldığından emin olun.
- 60 mL rezervuarları rezervuar tutucularına yerleştirin ve standart orta boruyu akışkan ünitenin valflerinden yerleştirin. Orta boruyu dişi Luer kilit bağlayıcıları ile daha büyük bir iç çapa bağlayın.
- Orta boruyu rezervuarların hemen altında bir hortum klipsi ile sıkıştırın.
- Rezervuarları 60 mL rezervuar başına 25 mL kültür ortamı ile doldurun. Hortum klipsini bırakın ve ortamın boruya girmesine izin verin.
- Orta rezervuarları kauçuk hava filtreleriyle kapatın ve akış pompası kurulumunu 4.
4. Fibrin'i Hücre Taşıyıcısı Olarak Kullanan Hücre Tohumlama
NOT: Laminer akış kabininde 4.
- Hücre tohumlama adımı için fibrin jelini hazırlayın. Ayrıntılar için bkz. Mol ve ark.67 Fibrin jeli için fibrinojen çözeltisi 10 mg/mL'lik son konsantrasyona sahip olmalıdır (protein stoğunun saflığı için doğru) ve trombin çözeltisi 10 U/mL'lik son konsantrasyona sahip olmalıdır.
- Kırmızı kapaklı plastik bir kapta ~50 mg (10 numune için yeterli) tartmadan önce fibrinojeni RT'ye çözün.
- Fibrinojen çözeltisini hazırlamak için hücre kültürü ortamı ekleyin (protein stoğunun saflığı için doğru olan 10 mg / mL konsantrasyonda). İyice karıştırın ve fibrinojen çözeltisini 0,2 μm şırıng filtresi ile sterilize etmek için steril 15 mL tüpe filtreleyin. Filtrelenmiş fibrinojen çözeltisini buzda tutun.
NOT: Fibrinojen çözeltisini çok önceden hazırlamaktan kaçının, aksi takdirde fibrinojen kendiliğinden pıhtılaşabilir. - Trombini çözün ve hücre kültürü ortamında ve buzun üzerine yerleştirin bir trombin çözeltisi (10 U/mL konsantrasyonunda) yapın. Numune başına 20 μL trombin + hücre çözeltisi hazırlayın. n=10 numuneler için 200 μL gereklidir; bu nedenle, olası pipetleme hatalarını hesaba katmak için 250 μL trombin çözeltisi hazırlayın.
- Kültür şişelerindeki hücreleri toplayın ve sayın. Hücreleri istenen oran ve miktarda karıştırın (1,2 × 106 monosit ve 0,6 × iskele başına10 6 miyofibroblast). Pipetleme hatalarını düzeltmek için n+1 örnekleri için yeterli hücre olduğundan emin olun. RT'de 10 dakika boyunca 350 × g'da santrifüj.
- Askıya alınan hücrelerin ve trombinin bir karışımını yapın.
- Her numune için 20 μL trombin çözeltisi kullanın. n=10 numuneler için hücre peletine 200 μL trombin ekleyin ve karıştırın. Hücre süspansiyonunun (hücreler + trombin) hacmini ölçün ve 10 iskelenin tümüne eşit olarak nasıl bölüneceğini hesaplayın (örneğin, trombin + hücre süspansiyonu 260 μL hacme sahipse, her elektrospun örneği 260 μL / 10 örnek = 26 μL trombin + hücre süspansiyonu alacaktır).
- İskelelerin tohumlanması iki adımda gerçekleştirilirken, her iskele için hücre süspansiyonunun yarısını tutacak iki adet 1,5 mL mikrobuge tüpü hazırlayın (önceki adımın örnek hesaplamasında: 13 μL trombin + hücre süspansiyonu ile iki tüp hazırlayın). Buzun üzerine koy.
NOT: Aşağıdaki adımlar, özellikle adım 4.4, ideal olarak iki deneyci tarafından gerçekleştirilir.
- Hücre tohumlamaya hazırlanmak için önceden ıslatılmış elektrospun iskelelerini vakumla kurulayın.
- Laminar akış kabininin vakum sistemine bir cam Pasteur pipet bağlayın ve steril geçici depolama için boş bir 50 mL tüpe yerleştirin.
- Akış kültürü odalarını inkübatörden alın, erkek Luer fişini akış çıkışından çıkarın ve beyaz Luer kapağını açtıktan ve akış çıkışının önüne etanol batırılmış bir kağıt mendil yerleştirdikten sonra ortamı çıkarın.
- Üst bölmeyi ve cam tüpü çıkar ve geçici depolama için steril bir Petri kabına yerleştirin.
- Vakum Pasteur pipetini elektrospun iskelesine yerleştirin ve mümkün olduğunca fazla ortam çıkarın.
DİkKAT: Elektrospun iskelesini çok nazikçe vakumlayın. İskele üzerinde ileri geri doğrusal bir hareket yerine, vakum pipetini birden fazla yere yerleştirin. Daha iyi kontrol için pasteur pipetinin üstündeki vakum borusunu parmakların arasına sıkıştırın. - Fibrinojen çözeltisini trombin + hücre süspansiyonu ile 1:1 oranında karıştırın (örneğin, 13 μL fibrinojeni 13 μL trombin + hücre süspansiyonu ile karıştırın). Fibrin polimerize olduğundan emin olmak için mikrofuge tüpünde değil, iskelede boru, fibrinojen boru, trombin + hücre süspansiyonunun 'ekstra hacmi' için pipet tekerleğini çevirin ve karıştırmak için hücre süspansiyonu ile mikrop tüpünde bir kez yukarı ve aşağı borulayın.
- Çözeltiyi elektrospun iskelesinin tam uzunluğu boyunca doğrudan homojen bir şekilde damlatın. Experimenter A'nın fibrin karışımını damlatması, deneyci B'nin ise alt bölmeyi basınç kanalına monte edilmiş elektrospun iskelesi ile tutması önerilir.
- Hücrelerle birlikte fibrin elektrospun iskelesinin üzerine damlatıldıktan sonra, Deneyci B, hücreleri iskele üzerinde eşit olarak bölmek için iskeleyi yavaşça soldan sağa ve yukarı ve aşağı hareket ettirer.
- Elektrospun iskelesinin diğer tarafındaki 4.4.5 - 4.4.7 adımını yineleyin.
- Cam tüpü dikkatlice yerleştirerek akış kültürü odasını tekrar monte edin (cam tüpün iç tarafına fibrin yapışmasını ve pıhtılaşmasını önleyin) ve akış kültürü odasının üst bölmesini geri itin. Tohumlu yapıyı, herhangi bir orta veya fosfat tamponlu salin (PBS) olmadan doğrudan inkübatördeki akış kültürü odasına yerleştirin.
- Tüm dinamik örnekler için 4.4.1–4.4.9 adımlarını yineleyin. Deliksiz basınç kanallarına monte edilen statik numuneler için, 4.4.1–4.4.8 adımlarına göre tohumlayın ve daha sonra 15 mL'lik bir tüpe yerleştirin.
- Fibrin inkübatörde 60 dakika polimerize olsun.
[Protokol burada 30-60 dakika duraklatılabilir.]
- Polimerizasyondan sonra, akış kültürü odalarını (dinamik numuneler) veya 15 mL tüpleri (statik numuneler) orta ile doldurun.
5. Deneye başlamadan önce biyoreaktör ve akış pompası sistemlerinin bağlantısı
NOT: Laminer akış kabininde 5.1–5.3 adımlarını uygulayın.
- Akış kültürü odalarını ve akışkan üniteleri taşıyan tepsiyi, laminar akış kabinlerinin içine doldurulmuş orta rezervuarlar ve bağlı orta borularla alın.
- Akış kültürü odalarını döngüsel streç ve kombine hemodinamik yüklerle dolu deney grupları için biyoreaktör tabanına yerleştirin (Şekil 1E).
- Akış kültürü odasını baş aşağı eğin ve basınç kanalını ince borulu bir şırınga kullanarak ultra saf suyla doldurun (bu, esnek ve ince olduğu sürece her türlü olabilir, bu deneyde iğneye 10 cm uzunluğunda, 0,15 mm iç çaplı bir tel tutturuldu).
- İnce boruyu basınç kanalının içine yerleştirin ve basınç kanalı, suyu şırınnadan kademeli olarak iterek ultra saf suyla doldurulurken, basınç kanalının içinde hava kabarcıkları olmadığından emin olmak için teli basınç kanalının içinden aynı anda çekin.
- Akış kültürü haznesini biyoreaktör tabanındaki sekiz vida ipliğinden birine yerleştirin. Olası sızıntıyı önlemek için biyoreaktör tabanı ile beyaz Luer konektörü arasına silikon bir O-halka yerleştirin ve beyaz Luer konektörünü alt bölmeden sıkın.
- Döngüsel olarak gerilmiş tüm numuneler için 5.2.2 ve 5.2.3 adımlarını yineleyin.
- Statik kontrol hariç tüm deney grupları için akış kültürü odalarını akış pompası sistemine bağlayın.
- Orta boruya bir hortum klipsi yerleştirin. Akış kültürü odasının üst bölmesinin akış girişini kaplayan beyaz Luer kapağını çıkarın. Orta borunun dişi Luer bağlayıcısını çıkarın ve bir taraftaki orta boruyu üst bölmedeki akış girişiyle, orta borunun diğer tarafını ise alt bölmedeki akış çıkışıyla bağlayın.
- Tüm akış kültürü odaları için 5.3.1 adımlarını yineleyin. Bu noktada biyoreaktör ve akış kültürü odaları orta ile doldurularak akış sistemlerine bağlanmaktadır.
- Statik kontrol numuneleri için, makas kelepçesini kullanarak numuneleri filtre kapaklı bir hücre kültürü şişesine dikey olarak yerleştirin. Hücre kültürü şişesini orta ile doldurun ve inkübatöre yerleştirin.
- Tüm kurulumu laminer akış kabininden inkübatöre aktarın ve akışkan üniteleri hava basıncı tüpüne ve elektrik kablosuna bağlayın.
- Yazılımı başlatın ve akış pompalarını başlatın. Numuneler için orta akışı tek tek başlatın.
- Akışkan ünitenin vanalarının tıkırdayıp tıklama olmadığını kontrol edin.
- Hortum kelepçesini orta borudan çıkarın.
- Akış pompasını 100 mbar ve 10 s anahtarlama süresi ile başlatın.
- Olası sızıntı veya hava kabarcıkları için akış yönünü dikkatlice kontrol edin. Herhangi bir tuzaklı hava kabarcıkları, akış kültürü odasını ters çevirerek çıkarılabilir.
NOT: Akış kültürü odalarındaki sisteme ve hava kabarcıklarına hava emilmesini önlemek ve rezervuarların kuru çalışmasına izin vermemek için orta rezervuarlardaki orta seviyelerin dengeli olduğundan emin olun (Şekil 2C). - Tüm akışkan üniteler için 5.5.
- Gerinim pompasını başlatın.
- Pnömatik aktüer pompayı pnömatik silindir üzerindeki hava girişi aracılığıyla basınçlı havaya bağlayın. Alt hava çıkışını hava çıkışı için mavi boruya bağlayın (Şekil 1F).
- LabVIEW yazılımını açın, Van Kelle ve ark.68tarafından açıklandığı gibi LabVIEW komut dosyasını ve basınçlı hava basıncı uygulama sistemini çalıştırın, yer değiştirme ve frekans girin (0,2 Hz'lik düşük frekansla başlayın). Teflon körük en düşük seviyedeyken pompayı duraklatın.
- Basınç sensörini hidrolik hazne üzerindeki basınç sensörü girişine yerleştirin.
- Pompa ayarlarını istediğiniz ayarlara değiştirin (1,5 Pa için 150 mbar, 10 s anahtarlama süresi kullanın).
- Gerinim pompasını çalıştırın ve tercih edilen ayarı uygulayın (örneğin, 0,5 Hz, 1,05 streç).
6. Deneyi Birden Fazla Gün Boyunca Çalıştırmak; Kültür ve Orta Değişim Sırasında Makas ve Esnemenin İzlenmesi
- İskele duvarındaki WSS'i hesaplayın.
- Akış büyüklüğünü her gün kaydedin (ayrıntılar için akış pompası üreticisinin el kitabına bakın). Kısacası, 10 sn boyunca akışkan birim rezervuarının geçişi arasındaki orta rezervuarlardaki sıvı seviyelerindeki (mL olarak) değişimi gözlemleyin. ML/dak'ta Q akış hızını elde etmek için en az beş ölçüm gerçekleştirin, ortalama değeri hesaplayın ve 6 ile çarpın.
- Akış, bir açıksal kanaldan geçen bir Poiseuille akışı ile tanımlanır. Kültür ortamını Newton sıvısı olarak varsayarsak, iskele duvarındaki WSS'yi hesaplayın, r1, Denklem 1 ile.
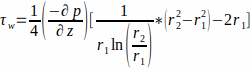 (1)
(1)
burada WSS iskeleduvarında ( r1; burada r1 =1.7 mm), sabit bir durum akışından kaynaklanan, uygulanan basınç p ve cam tüpün iç yarıçapı r2 (burada r2 = 2.3 mm) ile belirlenir. Eksenel yöndeki basınç gradyanı, akış girişi ve akış çıkışı arasında tekdüze olduğu varsayılır ve Denklem 2 (Şekil 1J)ile verilir.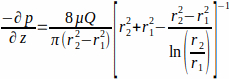 (2)
(2)
dinamik viskozite μ (burada orta viskozite sabit kabul edildi, μ = 0.7 × 37 °C'de 10-3 Pa¹ s) ve Q uygulanan akış hızı.
- İskelelere her gün uygulanan esnemeyi izleyin.
- İskele ile arka plan arasındaki kontrastı artırmak için akış kültürü odasının arkasına koyu bir arka plan yerleştirin. İskelenin görselleştirilmesine yardımcı olmak için LED ışık lambalarını iskeleye doğru konumlandırın.
- Yüksek hızlı kamera ile 6 s (yani 3 streç döngüsü) için 30 Hz frekansta iskelenin hızlandırılmış fotoğraflarını çekin.
NOT: Kamera izin verirse daha düşük bir kayıt frekansı yeterli olabilir. Ancak, minimum gerekli frekans belirlenmedi. - Görüntülerden iskelenin minimum ve maksimum çapını manuel olarak belirleyin.
- Denklem 3'e göre maksimum esnemeyi hesaplamak için elektrospun iskelesinin minimum ve maksimum dış çapını hesaplayın.
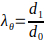 (3)
(3)
burada çevresel streç (φφ) iskelenin dış çapı, d1ve başlangıç çapı, d0arasındaki oran ile verilir.
- Orta buharlaşma için doğru ve haftada üç kez orta yenileme.
- Akış sistemleri ve gerinim pompası için kabloları durdurun ve ayırın.
- Hortum klipslerini orta boruya yerleştirin.
- Orta rezervuarlardaki hacim göstergesi işaretlerine göre ne kadar ortamın buharlaştığını belirleyin.
- Tepsiyi biyoreaktör ve akışkan ünitelerle laminer akış kabinine aktarın.
- Orta rezervuarların kauçuk hava filtrelerini çıkarın; buharlaştırılmış ortam hacmini telafi etmek için otomatik kapatılmış ultra saf su ekleyin. Orta rezervuarları tekrar kapatın ve ortamı ultra saf suyla karıştırmak için pompaya tekrar bağlayın.
- 6.3.1–6.3.5 adımlarını yineleyin. Kauçuk hava filtrelerini tekrar çıkarın, 25 mL kültür ortamını çıkarın ve RT'de 5 dakika boyunca 300 × g'da aşağı doğru döndürün.
- 1,5 mL süpernatant toplayın ve salgı profillerinin analizi için -30 °C'de saklayın (enzime bağlı immünosorbent test (ELISA) ile analiz için).
- Süpernatantı şartlandırılmış orta43olarak kullanarak, parakrin sinyal çalışmaları için istenen süpernatant hacmini toplayın.
- Orta rezervuarlara 25 mL taze orta ekleyin.
- Kauçuk hava filtrelerini orta rezervuarlara geri yerleştirin.
- Kurulumun tamamını inkübatöre geri yerleştirin; tüm kabloları ve hava tüplerini pompaya ve gerinim pompasına bağlayın. Hortum klipslerini bırakın ve 5.4–5.8 adımlarını tekrarlayın.
- Pompaya bağlı kurutma şişelerindeki silika kurutma boncuklarının nemli olup olmadığını kontrol edin (beyaz görünüm) ve gerekirse kuru silika boncuklarla değiştirin (turuncu görünüm).
7. Deney, Numune Toplama ve Ekipman Temizleme ve Depolamayı Sonlandırma
- Deneyin son gününde, 6.3.1–6.3.5 adımlarında açıklandığı gibi orta buharlaşma için doğru ve numuneleri tek tek toplayın.
- Numuneleri tek tek toplamak için akış pompasının ve gerinim pompasının birkaç kez duraklatılması gerekir. Orta boruya bir hortum klipsi yerleştirin. Akış pompasını ve gerinim pompasını geçici olarak durdurun. Bir akış kültürü odasını biyoreaktör tabanından ayırın; biyoreaktör tabanında beyaz bir Luer kapağı ile değiştirin. Akış kültürü odasını ve akışkan üniteyi laminar akış kabinine alın. Hemodinamik yükü hasat olana kadar diğer numunelere uygulamak için akış pompasını ve gerinim pompasını tekrar çalıştırın.
- ELISA aracılığıyla parakrin sitokin üretim analizi için orta rezervuarlardan orta toplayın.
- Akış ünitelerini ayır ve boru şeklindeki yapıyı hasat edin. İstenilen kesme şemasına göre bölüm. Yapının parçaları 4 °C'de (%3,7 formaldehitte 15 dk fiksasyon ve PBS'de 3 x 5 dk yıkamadan sonra) veya -30 °C'de (sıvı nitrojende çıtçıt dondurarak) bir sonraki analize kadar saklanabilir.
- Biyoreaktör ve pompa bileşenlerini temizleyin. Ayrıca, madde başına tavsiye edilen temizleme yöntemi Malzeme Tablosunda belirtilmiştir.
- Kauçuk hava filtrelerini % 70 etanol ile temizleyin. İç filtreyi nemlendirmemeye çok dikkat edin!
- Tüm ayrı bileşenleri toplayın: orta borular, orta rezervuarlar, cam borular, erkek Luer fişleri ve dişi Luer kilitleri, beyaz Luer kapakları, basınç kanalları, burun konileri, silikon O-halkaları, adaptör burçları, akış düzleştiriciler (pompalar, akışkan üniteler, kauçuk hava filtreleri, biyoreaktör tabanı hariç) ve akan musluk suyunda durulayın.
- O/N'yi deiyonize suya% 0.1 sodyum dodecylsulfate yerleştirin.
NOT: Parçalar paslanabileceğinden ultra saf su kullanmayın. - Musluk suyu ve bulaşık sabunu ile durulayın.
- İyonize suya daldırın, ardından iki kez% 70 etanol, ardından deiyonize su.
- Tüm malzemeleri kağıt mendillere ayrı ayrı yerleştirin ve kurumasına izin verin. Boruları kurutmak için basınçlı hava kullanın.
- Otoklavlanamaz tüm malzemeleri% 70 etanol içine batırılmış bir kağıt mendille temizleyin. Bu, kauçuk hava filtresini (hava filtresinin kuru kalması gerektiğini unutmayın) ve biyoreaktör tabanını (Teflon körük ve pnömatik silindir) içerir.
- Akışkan odanın bileşenlerini (silikon O-ring dahil), orta boruyu, orta rezervuarları (kauçuk hava filtresi olmadan), erkek Luer fişlerini ve dişi Luer bağlayıcılarını, beyaz Luer kapaklarını, hortum klipslerini ve standart ekipmanı (örneğin, cımbız, sıkma makası) otoklavlayın
- Sonraki denemeler sırasında rahat kullanım için, bir tam akışkan oda için ayrı bileşenleri otomatik kapatılabilir bir kutuda birleştirin.
- Suyu hidrolik rezervuardan çıkarın. % 70 etanol ile temizleyin, ardından deiyonize su. Bırakın kurusun. İyonize su ve birkaç damla su banyosu koruyucu dezenfektan ile doldurun.
- Akış kültürü odası için cam tüpleri% 70 etanolde saklayın.
- Nemli silika kurutma boncuklarını (beyaz görünüm) 120 °C'de fırınA yerleştirin ve kurumasını (turuncu görünüm) ve hava geçirmez bir şişede saklayın.
Sonuçlar
Bu biyoreaktör, 3D biyomalzeme iskelelerinde kesme stresi ve döngüsel esnemenin vasküler doku büyümesi ve yeniden şekillendirilmesi üzerindeki bireysel ve kombine etkilerini incelemek için geliştirilmiştir. Biyoreaktörün tasarımı, çeşitli yükleme koşullarında sekiz vasküler yapının kült örüldürülmesine izin verir (Şekil 1A). Vasküler yapılar, hem çevresel streç hem de WSS'nin bağımsız olarak kontrol edilebildiği bir akış kültürü odasına
Tartışmalar
Burada açıklanan biyoreaktör, borulu rezonanslı iskelelerde kesme stresi ve döngüsel esnemenin iltihaplanma ve doku yenilenmesi üzerindeki bireysel ve kombine etkilerinin sistematik olarak değerlendirilmesini sağlar. Bu yaklaşım aynı zamanda temsili sonuçlar bölümünde de örneklendirildiği gibi damar yapıları üzerinde çok çeşitli analizler yapılmasına olanak sağlamaktadır. Bu sonuçlar, farklı hemodinamik yükleme rejimlerinin (yani, farklı kesme ve esneme kombinasyonlarının) TEVG yapısın...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma, LSH 2Treat programının (436001003) ve Hollanda Böbrek Vakfı'nın (14a2d507) bir parçası olarak ZonMw tarafından finansal olarak desteklenmektedir. N.A.K. Avrupa Araştırma Konseyi'nin (851960) desteğini kabul eder. Hollanda Bilimsel Araştırma Örgütü (024.003.013) tarafından finanse edilen YerÇekim Programı "Materyal Odaklı Rejenerasyon"u minnetle kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| advanced Dulbecco’s modified EagleMedium (aDMEM) | Gibco | 12491-015 | cell culture medium for fibroblasts |
| Aqua Stabil | Julabo | 8940012 | prevent microorganism growth in bioreactor-hydraulic reservoir |
| Bovine fibrinogen | Sigma | F8630 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Bovine thrombin | Sigma | T4648 | to prepare fibrinogen gel to seed the cells on the electrospun scaffold |
| Centrifuge | Eppendorf | 5804 | to spin down cells and conditioned medium |
| Clamp scissor - "kelly forceps" | Almedic | P-422 | clamp the silicone tubing and apply pre-stretch to the scaffold so the scaffold can be sutured into the engraved groove (autoclave at step 1, step 7) |
| CO2 cell culture incubators | Sanyo | MCO-170AIC-PE | for cell culturing |
| Compressed air reservoir | Festo | CRVZS-5 | smoothing air pressure fluctuations and create time delays for pressure build-up |
| Custom Matlab script to calculate the maximum stretches | Matlab | R2017. The Mathworks, Natick, MA | calculate the minimum and maximum outer diameter of the electrospun scaffold |
| Data acquisition board | National Instruments | BNC-2090 | data processing in between amplifier system and computer |
| Ethanol | VWR | VWRK4096-9005 | to keep sterile working conditions |
| Fetal bovine calf serum (FBS) | Greiner | 758087 | cell culture medium supplement; serum-supplement |
| Flow culture chamber compartments, consisting of a pressure conduit with engraved grooves and small holes to apply pressure on silicone tubing, a screw thread, nose cone, top compartment with flow inlet and bottom compartment flow outlet, adapter bushing | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | flow culture chamber compartments (autoclave at step 1, step 7) |
| Glass Pasteur pipet | Assistant | HE40567002 | apply vacuum on electrospun scaffold (autoclave at step 1) |
| Glass tubes of the flow culture chamber | Custon made, Equipment & Prototype Center, Eindhoven University of Technology | n.a. | part of the flow culture chamber (clean and store in 70% ethanol, at step 1 and 7) |
| GlutaMax | Gibco | 35050061 | cell culture medium amino acid supplement, minimizes ammonia build-up |
| High speed camera | MotionScope | M-5 | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| High speed camera lens - Micro-NIKKOR 55mm f/2.8 - lens | Nikon | JAA616AB | to monitor the stretch during culture; time-lapse photographs of the scaffolds are captured at a frequency of 30 Hz for 6 sec (i.e. 3 stretch cycles) |
| Hose clip | ibidi GmbH | 10821 | block medium flow (autoclave at step 1, step 7) |
| Hydraulic reservoir with 8 screw threads for 8 flow culture chambers | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to apply pressure to the silicone mounted constructs (clean outside with a paper tissue with 70% ethanol, rinse reservoir with 70% ethanol followed by demi water, at step 1 and 7) |
| Ibidi pump system (8x) including ibidi pump, PumpControl software, fluidic unit, perfusion set (medium tubing), air pressure tubing, drying bottles with orange silica beads | ibidi GmbH | 10902 | set up used to control the flow in the flow culture chambers. Note 1: the ibidi pumps were modified by the manufacturer to enable 200 mbar capacity. Note 2: can be replaced by pump system of other manufacturer, as long as same flow regimes can be applied. |
| Knives (no.10 sterile blades, individual foil pack) and scalpel handle (stainless steel, individually wrapped) | Swann Morton | 0301; 0933 | to cut the silicone tubing in the correct size for the scaffold and to cut the suture material |
| LabVIEW Software | National Instruments | version 2018 | to control the stretch applied to the scaffolds |
| Laminar flow biosafety cabinet with UV light | Labconco | 302310001 | to ensure sterile working conditions. The UV is used to decontaminate everything that cannot be autoclaved, or touched after autoclaving |
| Large and small petri dishes | Greiner | 664-160 | for sterile working conditions |
| L-ascorbic acid 2-phosphate (vitamin C) | Sigma | A8960 | cell culture medium supplement, important for collagen production |
| LED light cold source KL2500 | Zeiss | Schott AG | to aid in visualization for the time lapse of the scaffolds during monitoring of the stretch |
| Luer (female and male) locks and connectors, white luer caps | ibidi GmbH | various, see (https://ibidi.com/26-flow-accessories) | to close or connect parts of the bioreactor and the ibidi pump (autoclave at step 1, step 7) |
| Measuring amplifier (PICAS) | PEEKEL instruments B.V. | n.a. | to amplify the signal from the pressure sensor and feedback to LabView |
| Medium reservoir (large syringes 60 mL) and reservoir holders | ibidi GmbH | 10974 | medium reservoir (autoclave at step 1, step 7) |
| Medium tubing with 4.25 mm outer diameter and 1 mm inner diameter | Rubber BV | 1805 | to allow for a larger flow rate, the ibidi medium tubing with larger diameter is used. Note: the part of medium tubing guided through the fluidic unit valves are the same as the default ibidi medium tubing |
| Motion Studio Software | Idtvision | 2.15.00 | to make the high speed time lapse images for stretch monitoring |
| Needle (19G) | BD Microlance | 301700 | together with thin flexible tubing used to fill the hydraulic reservoir with ultrapure water without adding air bubbles |
| Needle driver | Adson | 2429218 | to handle the needle of the nylon suture through the silicone tube (autoclave at step 1, step 7) |
| Paper tissues | Kleenex | 38044001 | for cleaning of the equipment with 70% ethanol |
| Parafilm | Sigma | P7793-1EA | quick fix if leakage occurs |
| Penicillin/streptomycin (P/S) | Lonza | DE17-602E | cell culture medium supplement; prevent bacterial contamination |
| Phosphate Buffered Saline (PBS) | Sigma | P4417-100TAB | for storage and washing steps (autoclave at step 1) |
| Plastic containers (60 mL) with red screw caps | Greiner | 206202 | to prepare the fibrinogen solution |
| Pneumatic cylinder | Festo | AEVC-20-10-I-P | to actuate the Teflon bellow (clean with a paper tissue with 70% ethanol at step 1 and 7) |
| Polycaprolactone bisurea (PCL-BU) tubular scaffolds (3 mm inner diameter, 200 µm wall thickness, 20 mm length) | SyMO-Chem, Eindhoven, The Netherlands | n.a. | produced using electrospinning from 15% (w/w) chloroform (Sigma; 372978) polymer solutions. See Van Haaften et al Tissue Engineering Part C (2018) for more details |
| Pressure conduit without holes (for static control) | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to mount electrospun tubes on silicon tubing (autoclave at step 1, step 7) |
| Pressure sensor and transducer | BD | TC-XX and P 10 EZ | the air pressure going to the pneumatic actuated pump is raised until it reaches the set pressure |
| Proportional air pressure control valve and pressure sensor | Festo | MPPES-3-1/8-2-010, 159596 | provides compressed air to the pneumatic actuated pump |
| Roswell Park Memorial Institute 1640 (RPMI-1640) | Gibco | A1049101 | cell culture medium for monocyte/macrophage |
| Safe lock Eppendorf tubes (1.5 mL) | Eppendorf | 30120086 | multiple applications (autoclave at step 1) |
| Sodium dodecyl sulfate solution 20% | Sigma | 5030 | Used to clean materials, at a concentration of 0.1%. |
| Silicone O-rings | Technirub | 1250S | to prevent leakage (autoclave at step 1, step 7) |
| Silicone tubing (2.8 mm outer diameter, 400 um wall thickness) | Rubber BV | 1805 | to mount the electrospun tubes on the pressure conduits (autoclave at step 1) |
| Sterile tube (15 mL) | Falcon | 352095 | multiple applications |
| Suture, 5-0 prolene with pre-attached taper point needle | Ethicon, Johnson&Johnson | EH7404H | Prolene suture wire 5-0 (75cm length, TF taper point needle, 1/2 circle, 13 mm needle length) |
| Syringe (24 mL) | B. Braun Melsungen AG | 2057932 | to add the ultrapure water or medium to the hydraulic reservoir or flow culture chamber |
| Syringe filter (0.2 µm) | Satorius | 17597-K | to filter the fibrinogen solution |
| T150 cell culture flask with filter cap | Nunc | 178983 | to degas culture medium |
| T75 Cell culture flask with filter cap | Nunc | 156499 | to culture static control samples |
| Teflon bellow | Custom made, Department of Biomedical Engineering, Eindhoven University of Technology | n.a. | to load the hydraulic reservoir (clean outside with a paper tissue with 70% ethanol at step 1 and 7) |
| Tray (stainless steel) | PolarWare | 15-248 | for easy transport of the fluidic culture chambers and the bioreactor from incubator to laminar flow cabinet and back (clean with a paper tissue with 70% ethanol before and after use) |
| Tweezers | Wironit | 4910 | sterile handling of individual parts (autoclave at step 1 and 7) |
| Ultrapure water | Stakpure | Omniapure UV 18200002 | to correct for medium evaporation, mixed with aqua stabil mixed and used as hydraulic fluid. (autoclave ultrapure water at step 1) |
| UV light | Philips | TUV 30W/G30 T8 | for decontamination of grafts and bioreactor parts before seeding |
Referanslar
- Chlupác, J., Filová, E., Bacáková, L. Blood vessel replacement: 50 years of development and tissue engineering paradigms in vascular surgery. Physiological Research. 58, 119-139 (2009).
- Huygens, S. A., et al. Bioprosthetic aortic valve replacement in elderly patients: Meta-analysis and microsimulation. The Journal of Thoracic and Cardiovascular Surgery. 157 (6), 2189-2197 (2019).
- Huygens, S. A., et al. Contemporary outcomes after surgical aortic valve replacement with bioprostheses and allografts: a systematic review and meta-analysis. European Journal of Cardio-Thoracic Surgery. 50 (4), 605-616 (2016).
- Loh, S. A., et al. Mid- and long-term results of the treatment of infrainguinal arterial occlusive disease with precuffed expanded polytetrafluoroethylene grafts compared with vein grafts. Annals of Vascular Surgery. 27 (2), 208-217 (2013).
- Tara, S., et al. Vessel bioengineering. Circulation Journal. 78 (1), 12-19 (2014).
- Huang, A. H., Niklason, L. E. Engineering of arteries in vitro. Cellular and Molecular Life Sciences. 71 (11), 2103-2118 (2014).
- Bouten, C. V. C., Smits, A. I. P. M., Baaijens, F. P. T. Can we grow valves inside the heart? Perspective on material-based in situ heart valve tissue engineering. Frontiers in Cardiovascular Medicine. 5, 54 (2018).
- Fioretta, E. S., et al. Next-generation tissue-engineered heart valves with repair, remodelling and regeneration capacity. Nature Reviews Cardiology. , (2020).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Science Translational Medicine. 11 (485), (2019).
- Gutowski, P., et al. Arterial reconstruction with human bioengineered acellular blood vessels in patients with peripheral arterial disease. Journal of Vascular Surgery. , (2020).
- Syedain, Z., et al. Tissue engineering of acellular vascular grafts capable of somatic growth in young lambs. Nature Communications. 7 (12951), 12951 (2016).
- Sugiura, T., et al. Tissue-engineered vascular grafts in children with congenital heart disease: intermediate term follow-up. Seminars in Thoracic and Cardiovascular Surgery. 30 (2), 175-179 (2018).
- Kluin, J., et al. In situ heart valve tissue engineering using a bioresorbable elastomeric implant - material design to 12 months follow-up in sheep. Biomaterials. 125, 101-117 (2017).
- Fioretta, E. S., et al. Differential leaflet remodeling of bone marrow cell pre-seeded versus nonseeded bioresorbable transcatheter pulmonary valve replacements. JACC. Basic to Translational Science. 5 (1), 15-31 (2020).
- Van Haaften, E. E., Bouten, C. V. C., Kurniawan, N. A. Vascular mechanobiology: towards control of. Cells. , 1-24 (2017).
- De Jonge, N., et al. Matrix production and organization by endothelial colony forming cells in mechanically strained engineered tissue constructs. PLoS ONE. 8 (9), 73161 (2013).
- Schmidt, J. B., Chen, K., Tranquillo, R. T. Effects of intermittent and incremental cyclic stretch on ERK signaling and collagen production in engineered tissue. Cellular and Molecular Bioengineering. 9 (1), 55-64 (2016).
- Luo, J., et al. Tissue-engineered vascular grafts with advanced mechanical strength from human iPSCs. Cell Stem Cell. 26 (2), 251-261 (2020).
- Van Haaften, E. E., et al. Decoupling the effect of shear stress and stretch on tissue growth and remodeling in a vascular graft. Tissue Engineering Part C: Methods. 24 (7), 418-429 (2018).
- Gupta, V., Tseng, H., Lawrence, B. D., Jane Grande-Allen, K. Effect of cyclic mechanical strain on glycosaminoglycan and proteoglycan synthesis by heart valve cells. Acta Biomaterialia. 5 (2), 531-540 (2009).
- Lin, S., Mequanint, K. Bioreactor-induced mesenchymal progenitor cell differentiation and elastic fiber assembly in engineered vascular tissues. Acta Biomaterialia. 59, 200-209 (2017).
- Venkataraman, L., Bashur, C. A., Ramamurthi, A. Impact of cyclic stretch on induced elastogenesis within collagenous conduits. Tissue Engineering. Part A. 20 (9-10), 1403-1415 (2014).
- Huang, A. H., et al. Biaxial stretch improves elastic fiber maturation, collagen arrangement, and mechanical properties in engineered arteries. Tissue Engineering Part C Methods. 22 (6), 524-533 (2016).
- Hinderer, S., et al. In vitro elastogenesis: instructing human vascular smooth muscle cells to generate an elastic fiber-containing extracellular matrix scaffold. Biomedical Materials. 10 (3), 034102 (2015).
- Eoh, J. H., et al. Enhanced elastin synthesis and maturation in human vascular smooth muscle tissue derived from induced-pluripotent stem cells. Acta Biomaterialia. 52, 49-59 (2017).
- Smits, A. I. P. M., Bouten, C. V. C. Tissue engineering meets immunoengineering: Prospective on personalized in situ tissue engineering strategies. Current Opinion in Biomedical Engineering. 6, 17-26 (2018).
- Wissing, T. B., Bonito, V., Bouten, C. V. C., Smits, A. I. P. M. Biomaterial-driven in situ cardiovascular tissue engineering-a multi-disciplinary perspective. npj Regenerative Medicine. 2 (1), 18 (2017).
- Hibino, N., et al. A critical role for macrophages in neovessel formation and the development of stenosis in tissue-engineered vascular grafts. The FASEB Journal. 25 (12), 4253-4263 (2011).
- Godwin, J. W., Pinto, A. R., Rosenthal, N. A. Macrophages are required for adult salamander limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9415-9420 (2013).
- Godwin, J. W., Debuque, R., Salimova, E., Rosenthal, N. A. Heart regeneration in the salamander relies on macrophage-mediated control of fibroblast activation and the extracellular landscape. npj Regenerative Medicine. 2 (1), 22 (2017).
- McBane, J. E., Cai, K., Labow, R. S., Santerre, J. P. Co-culturing monocytes with smooth muscle cells improves cell distribution within a degradable polyurethane scaffold and reduces inflammatory cytokines. Acta Biomaterialia. 8 (2), 488-501 (2012).
- Battiston, K. G., Ouyang, B., Labow, R. S., Simmons, C. A., Santerre, J. P. Monocyte/macrophage cytokine activity regulates vascular smooth muscle cell function within a degradable polyurethane scaffold. Acta Biomaterialia. 10 (3), 1146-1155 (2014).
- Ploeger, D. T., et al. Cell plasticity in wound healing: paracrine factors of M1/ M2 polarized macrophages influence the phenotypical state of dermal fibroblasts. Cell Communication and Signaling. 11 (1), 29 (2013).
- McBane, J. E., Santerre, J. P., Labow, R. S. The interaction between hydrolytic and oxidative pathways in macrophage-mediated polyurethane degradation. Journal of Biomedical Materials Research. Part A. 82 (4), 984-994 (2007).
- Wissing, T. B., et al. Macrophage-driven biomaterial degradation depends on scaffold microarchitecture. Frontiers in Bioengineering and Biotechnology. 7, 87 (2019).
- Wolf, M. T., Vodovotz, Y., Tottey, S., Brown, B. N., Badylak, S. F. Predicting in vivo responses to biomaterials via combined in vitro and in silico analysis. Tissue Engineering Part C: Methods. 21 (2), 148-159 (2015).
- Grotenhuis, N., Bayon, Y., Lange, J. F., Van Osch, G. J. V. M., Bastiaansen-Jenniskens, Y. M. A culture model to analyze the acute biomaterial-dependent reaction of human primary macrophages. Biochemical and Biophysical Research Communications. 433 (1), 115-120 (2013).
- Jannasch, M., et al. A comparative multi-parametric in vitro model identifies the power of test conditions to predict the fibrotic tendency of a biomaterial. Scientific Reports. 7 (1), 1689 (2017).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- McWhorter, F. Y., Davis, C. T., Liu, W. F. Physical and mechanical regulation of macrophage phenotype and function. Cellular and Molecular Life Sciences. 72 (7), 1303-1316 (2014).
- Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Strain-dependent modulation of macrophage polarization within scaffolds. Biomaterials. 35 (18), 4919-4928 (2014).
- Dziki, J. L., et al. The effect of mechanical loading upon extracellular matrix bioscaffold-mediated skeletal muscle remodeling. Tissue Engineering. Part A. 24 (1-2), 34-46 (2018).
- Wissing, T. B., et al. Hemodynamic loads distinctively impact the secretory profile of biomaterial-activated macrophages - implications for in situ vascular tissue engineering. Biomaterials Science. 8 (1), 132-147 (2020).
- Van Haaften, E. E., Wissing, T. B., Kurniawan, N. A., Smits, A. I. P. M., Bouten, C. V. C. Human in vitro model mimicking material-driven vascular regeneration reveals how cyclic stretch and shear stress differentially modulate inflammation and matrix deposition. Advanced Biosystems. 4 (6), 1900249 (2020).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Bonito, V., de Kort, B. J., Bouten, C. V. C., Smits, A. I. P. M. Cyclic strain affects macrophage cytokine secretion and extracellular matrix turnover in electrospun scaffolds. Tissue Engineering Part A. 25 (17-18), 1310-1325 (2019).
- Battiston, K. G., Labow, R. S., Simmons, C. A., Santerre, J. P. Immunomodulatory polymeric scaffold enhances extracellular matrix production in cell co-cultures under dynamic mechanical stimulation. Acta Biomaterialia. 24, 74-86 (2015).
- Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. A mesofluidics-based test platform for systematic development of scaffolds for in situ cardiovascular tissue engineering. Tissue Engineering Part C: Methods. 18 (6), 475-485 (2012).
- Smits, A. I. P. M., Ballotta, V., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. T. Shear flow affects selective monocyte recruitment into MCP-1-loaded scaffolds. Journal of Cellular and Molecular Medicine. 18 (11), 2176-2188 (2014).
- Ballotta, V., Smits, A. I. P. M., Driessen-Mol, A., Bouten, C. V. C., Baaijens, F. P. T. Synergistic protein secretion by mesenchymal stromal cells seeded in 3D scaffolds and circulating leukocytes in physiological flow. Biomaterials. 35 (33), 9100-9113 (2014).
- Fahy, N., Menzel, U., Alini, M., Stoddart, M. J. Shear and dynamic compression modulates the inflammatory phenotype of human monocytes in vitro. Frontiers in Immunology. 10, 383 (2019).
- Pennings, I., et al. Layer-specific cell differentiation in bi-layered vascular grafts under flow perfusion. Biofabrication. 12 (1), 015009 (2019).
- Wang, J., et al. Ex vivo blood vessel bioreactor for analysis of the biodegradation of magnesium stent models with and without vessel wall integration. Acta Biomater. 50, 546-555 (2017).
- Huang, A. H., et al. Design and use of a novel bioreactor for regeneration of biaxially stretched tissue-engineered vessels. Tissue Engineering. Part C, Methods. 21 (8), 841-851 (2015).
- Huang, A. H., Niklason, L. E. Engineering biological-based vascular grafts using a pulsatile bioreactor. Journal of Visualized Experiments. (52), e2646 (2011).
- Bono, N., et al. A Dual-mode bioreactor system for tissue engineered vascular models. Annals of Biomedical Engineering. 45 (6), 1496-1510 (2017).
- Wolf, F., et al. VascuTrainer: a mobile and disposable bioreactor system for the conditioning of tissue-engineered vascular grafts. Annals of Biomedical Engineering. 46 (4), 616-626 (2018).
- Ramaswamy, S., et al. A novel bioreactor for mechanobiological studies of engineered heart valve tissue formation under pulmonary arterial physiological flow conditions. Journal of Biomechanical Engineering. 136 (12), 121009 (2014).
- Piola, M., et al. A compact and automated ex vivo vessel culture system for the pulsatile pressure conditioning of human saphenous veins. Journal of Tissue Engineering and Regenerative Medicine. 10 (3), 204-215 (2016).
- Vanerio, N., Stijnen, M., de Mol, B. A. J. M., Kock, L. M. An innovative ex vivo vascular bioreactor as comprehensive tool to study the behavior of native blood vessels under physiologically relevant conditions. Journal of Engineering and Science in Medical Diagnostics and Therapy. 2 (4), (2019).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplantation. 27 (9), 1375-1389 (2018).
- Sinha, R., et al. A medium throughput device to study the effects of combinations of surface strains and fluid-flow shear stresses on cells. Lab on a Chip. 15 (2), 429-439 (2015).
- Beca, B. M., Sun, Y., Wong, E., Moraes, C., Simmons, C. A. Dynamic bioreactors with integrated microfabricated devices for mechanobiological screening. Tissue Engineering Part C: Methods. 25 (10), 581-592 (2019).
- Liu, H., Usprech, J., Sun, Y., Simmons, C. A. A microfabricated platform with hydrogel arrays for 3D mechanical stimulation of cells. Acta Biomaterialia. 34, 113-124 (2016).
- Szafron, J. M., Ramachandra, A. B., Breuer, C. K., Marsden, A. L., Humphrey, J. D. Optimization of tissue-engineered vascular graft design using computational modeling. Tissue Engineering Part C: Methods. 25 (10), 561-570 (2019).
- Emmert, M. Y., et al. Computational modeling guides tissue-engineered heart valve design for long-term in vivo performance in a translational sheep model. Science Translational Medicine. 10 (440), (2018).
- Mol, A., et al. Fibrin as a cell carrier in cardiovascular tissue engineering applications. Biomaterials. 26 (16), 3113-3121 (2005).
- van Kelle, M. A. J., et al. A Bioreactor to identify the driving mechanical stimuli of tissue growth and remodeling. Tissue Engineering Part C: Methods. 23 (6), (2017).
- van den Broek, C. N., et al. Medium with blood-analog mechanical properties for cardiovascular tissue culturing. Biorheology. 45 (6), 651-661 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır