Method Article
从多萨尔海马的急性切片准备全细胞记录和神经元重建在成人小鼠的登特陀螺
摘要
我们提出了一个协议,准备从小鼠的单体中间海马的急性切片。我们将这种横向制剂与日冕切片在录音质量和记录神经元形态特征的保存方面进行比较。
摘要
虽然海马的一般结构沿其纵向轴相似,但最近的研究表明,在分子、解剖学和功能标准方面存在显著差异,表明海马沿着其玫瑰花环向不同的子回路划分。由于差异连通性和功能,最根本的区别是多面体和心室海马,它们分别优先参与空间和情感处理。因此,在体内关于空间记忆形成的工作侧重于正角海马。
相比之下,电生理体外记录在中腹海马上被优先执行,主要受切片生存能力和电路完整性等因素的驱动。为了使体内空间处理数据与体外数据直接相关,我们调整了以前的分割方法,从正交中海马体中获取高度可行的横向脑切片,用于长期记录凹痕陀螺仪中的主要细胞和内皮。由于在成年小鼠中经常分析空间行为,我们结合了这种横向切片程序和使用保护性解决方案来增强成熟动物脑组织的生存能力。我们用这种方法治疗大约3个月大的小鼠。该方法提供了一个很好的替代冠状动脉制备,这是经常用于体外研究的多骨海马。我们比较了这两种制剂在录音质量和保存记录神经元的形态特征方面。
引言
海马在学习和记忆、空间导航和情感的不同方面起着关键作用,因此被广泛研究。海马的基本电路,俗称"三叠纪电路",是横轴的拉梅拉尔网络,主要沿纵轴1保存。海马对各种认知和情感行为的贡献可能来自于这种基本电路沿着多发轴与其他几个大脑区域2,3的不同连接。然而,除了有经验的和发泡的连通性之外,越来越多的研究指出海马的隔膜-时轴的进一步差异。这些差异涉及内部结构和连通性,以及基因表达模式和神经元形态4,5,6,7,8的差异。
考虑到基本电路存在这种差异,根据所处理的问题选择要调查的特定海马子电路是合理的。例如,如果问题涉及空间处理中涉及的神经元机制,则多端而不是腹海马是值得关注的,尽管由于海马内部纵向连接9、10、11,两者在体内不能独立行动。沿着这些路线,不仅必须考虑纵轴沿线的差异,而且需要注意尽可能保持局部和远距离电路。为了保持光纤路径和连接性,大脑被分割的角度是必不可少的。
文献中报告的第一种方法是,首先从大脑中分离海马,然后使用组织斩波器12和颤音13制作横向切片(垂直于纵向轴)。后来的生理学家更倾向于从整个脑块中获取切片,以保存与海马体相连的相邻大脑结构。对于这些块准备,已经开发了不同的分区角度与海马,如日冕切片准备14或水平切片准备名为 HEC 切片,以保持海马体-内皮层连接15,16,17.
在后一种准备中,在沿着玫瑰花轴的水平平面上,用0°或12°的角度切开腹叶,形成方块的基座。然后从大脑的腹膜表面收集切片,从而主要允许收获中腹海马区。这种方法已成为最流行的选择生理研究,可以可靠地执行后,几个已公布的协议18,19,20。
然而,如果研究兴趣涉及空间学习的具体方面,底片海马可能是更合适的研究区域,为这个海马区找到类似质量的切片程序是有用的。很少有协议,专注于非常罗斯特拉极,已经开发,可以满足这一需求21,22。
相反,在此协议中,我们描述了从正角中间海马中获取可行的横向切片的方法,该切片使用先前描述的水平制剂18、19(图 1A& B)的分节角度。我们通过将此制剂中的电生理记录和形态重建与日冕片中的电生理记录和形态重建进行比较,来证明此协议的质量。此协议特别适合与成年小鼠的解剖和行为实验相结合(在我们的情况下,三个月大)。
研究方案
所有涉及实验动物的程序均符合德国动物福利法,并经基尔大学道德委员会批准。帕瓦尔布明-克雷(Pvalb-IRES-Cre)小鼠23(杰克逊实验室,存储库编号008069)被维持为异质菌群或与Ai9 Cre记者小鼠24(杰克逊实验室,存储库编号007909)。使用了P40-P90之间的雌雄小鼠。在标准组屋条件下,老鼠维持在12小时的光暗循环中,并获提供食物及水。
1. 准备解决方案
注:使用超纯水(UPW)(电阻在25°C 18.2 MΩ厘米)为每个实验日准备新鲜解决方案。解决方案可在 4 °C 下存储最多一天。镁和钙溶液可作为 100 万库存溶液单独存储。所有工作解决方案都必须用碳水化合物饱和(95% O2:5% CO2),才能在使用前和使用期间进行最佳的氧合和 pH 维护。
- 准备切割解决方案 (每鼠标 500 mL) (以 mM 表示): 92 NMDG, 2.5 KCl, 1.25 NaH2PO4,30 NaHCO3,20 HEPES, 25 葡萄糖, 5 纳 - 阿斯科酸盐, 4 纳 - 皮鲁韦特, 0.5 Cacl2+2H2O, 和 10 MgSO4+7H2O. 滴酸盐到 pH 7.4 下化学罩与 4-5 毫升 16% 盐酸之前添加二价 cations.这将避免MGSO4的降水。
注:KCl 和 NaH2PO4 可在 4°C 下作为 10 倍解决方案存储。 我们制作两批切割溶液。一个在录音的前一天(储存在冰柜里过夜,以产生碎冰),一个在录制当天。 - 准备存储解决方案 (每鼠标 250 mL) (在 mM): 92 纳克尔, 2.5 KCl, 1.25 NaH2PO4,30 纳科3,20 HEPES, 25 葡萄糖, 5 纳 - 阿斯科酸盐, 4 纳 - 皮鲁韦特, 2 卡克莱2+ 2h2O, 和 2 Mgso4+7h2O. 滴定到 ph 7.3 - 7.4 与 1 N Naoh 。
注:纳克、KCl和NaH2PO4 可在4°C下作为10倍溶液储存。 - 准备ACSF录制(在mM): 122 纳克, 2.5 KCl, 1.25 纳赫2PO4,24 纳赫科3,12.5 葡萄糖, 2 CaCl2+2 H2O, 和 2 MgSO4+7H2O, 2 纳阿斯科酸盐, 4 纳-皮鲁瓦特.滴定 ph 到 7.3 - 7.4 与 1 N Naoh 。
注:纳克、KCl和NaH2PO4 可在4°C的10倍库存溶液中组合。
2. 准备用于切片的长凳
- 在冰上准备一个烧杯(150毫升)和两个玻璃培养皿(直径10厘米),并填补他们与新鲜的切割解决方案。使用碳水化合物冒泡装置(穿孔管或连接到碳水化合物系统的气石)保持溶液含氧。
注:烧杯中的溶液将用于注水,而培养皿将在切割过程中使用。 - 为手术台配备不锈钢刀片、圆尖钳子、细尖钳、大剪刀、小剪刀、大金属铲、薄金属铲、刷子、振动板和蓝亚诺丙烯酸酯胶水或毒性较小的n-丁基酯青霉素胶粘合剂。将不锈钢刀片和一张滤纸浸入冰上一个玻璃培养皿中。这个培养皿将用于切割大脑。在塑料培养皿的底部画三条平行线,将这道菜放在靠近手术器械的位置。
- 根据已公布的协议25,为跨卡输液做好准备。
- 准备振动,在刀片支架上安装一个新的刀片,并设置切割参数(刀片的角度从水平平面17°,叶片振荡振荡振幅1.5毫米,刀片向前运动速度在约2毫米分钟-1,振荡频率90赫兹,部分厚度350μm)。用冰冷切割溶液填充振动托盘,使其保持恒定的氧分。
注意:我们将第一批切割溶液制成的碎冰添加到冷却的新鲜切割溶液中,以降低温度。切片时注意将冰从刀片中分离。 - 在恒定的氧气下准备一个装满切割溶液的孵化室。将室内置于预热水浴(35°C)中。
注:在爱德华兹和康纳斯(1992)26中可以找到孵化室的一个例子。 - 准备一个装满存储解决方案的切片储藏室,并将其保存在室温下和恒定的氧气下。如果组织表达荧光蛋白或光激活蛋白,建议将腔室保持在黑暗中,例如,在盒子内。
注:具有多个独立油井的储藏室可用于区分海马体的多孔轴线沿线的切片水平。可建造定制房间(图 1D)。从 81 倍低温小瓶存储盒中取出一块小瓶间隔网格,并将底部粘在尼龙网上。将 5mL 移液器塑料尖端的上三分之一插入此网格的中心,使其在底部伸出约 3 厘米。这个塑料尖端作为网格的支架,后来拿着空气管进行氧化。将带支架的网格插入一个圆环塑料盒(例如注射器过滤器的包装),使其不会倾斜或摆动。该水库将容纳250mL的存储解决方案。
3. 海马片的制备
- 使用机罩下方的异氟(约0.5 mL)将鼠标麻醉在箱室中。让鼠标休息,直到呼吸缓慢和规律(约2-3分钟)。测试脚趾捏没有疼痛反应。
- 按照已公布的协议25、27,从冰上烧杯中使用25mL的碳酸切割溶液进行转心输液。建议这一步骤快速冷却大脑,以快速减缓神经元新陈代谢。
- 使用大剪刀斩首动物,并将头部放入含有切割溶液的冰上冷却的培养皿中。
- 用细剪刀打开皮肤,露出头骨。将小横向切口切入前人巨无霸两侧的头骨底部。然后沿着下垂缝合线切开,从前兆开始,直到到达嗅灯泡上方的鼻前缝合。在下垂切口时拉起剪刀,以避免底层脑组织的损伤。
注意:将头部浸入切割溶液中有助于清除血液中的头部,并降低温度。 - 使用圆尖钳子拉起平底骨来暴露大脑。注意抓住和删除的脑膜了。如果离开,它们可以在提取过程中损害大脑。
- 用小铲子轻轻地把大脑挖出来放进第二道培养皿里。
- 使用预冷刀片沿着纵向裂缝将大脑切成两半。
- 使用大铲子将一个半球从切割溶液中抬出并提升到塑料培养皿上。半球位于其内层表面,将平行线与一条平行线对齐,以参考 图 1B中显示的第二次切割。
- 执行第二次切割在半球的腹腔部分定位刀片平行线,以获得表面,这是后来用于粘入大脑到标本持有人(见下一步),如 图1B所示。将半球返回到玻璃培养皿的含氧切割液中,并在第二个半球执行相同的程序。
- 使用粘合剂将刚切割的腹侧粘在振动标本支架上。将几滴切割溶液放入半球,以凝固胶水,并将标本持有人移入振动托盘。这样,切片将进行从底片到腹海马。
- 删除最初的一两个非横向切片(图 1C,ii-iii),直到感兴趣的区域变得可见,然后开始收集切片。
注:非横向但可用,健康的切片可以从切片程序开始时从端海马获得(图1C,ii-iii)。收集每片大约需要3-4分钟。通过从底片而不是心室海马开始切割,我们节省了大约10分钟,这提高了底片的可行性。 - 使用塑料移液器(切开尖端的窄端)将每片切片转移到孵化室(在 35 °C 下包含切割溶液),并让它休息 12 分钟。温暖切割液的短暂恢复期大大减少了最初的神经元肿胀,如Ting等人(2014)28日报道。然后使用刷子将切片转移到存储室(包含 RT 的存储解决方案),并让它休息到实验开始。
4. 全细胞记录和生物细胞素填充
注:全细胞贴片夹录音的描述仅简化为有助于获得良好生物细胞素填充的关键步骤,通常适用于ACSF中的神经元。有关电生理记录程序的详情,可于29日、30日咨询其他几项规程。
- 根据要记录的参数选择合适的细胞内解决方案。例如,对于当前的夹子测量,可以使用基于葡萄糖酸钾的溶液(在 mM 中):135 K-葡萄糖酸盐、3 KCl、10 HEPES、0.2 EGTA、10 磷三酯-Na2、4MGATP、0.3 Na2-GTP。将pH调整为7.3与1M KOH。一旦添加3-5毫克/mL生物细胞素,渗透度应在285-290 mOsmol/kg左右。
注:为了在录制过程中监测神经元的形状,可将 1 mM 亚历克萨氟氢化物的 0.3-0.5 μL 添加到细胞内溶液中。在这种情况下,请记住生物细胞素的启示,以匹配亚历克萨染料的颜色与荧光探头耦合链球菌丁。 - 准备厚壁毛细血管≤1微米尖端直径和3-5 MΩ电阻的贴片夹电极。
- 在 RT 或 35-37 °C 下以 2.5-3 mL/min 的速度启动贴片夹设置的注水系统,并使用 U 形锚固定腔室中的切片。
- 识别感兴趣的大脑区域,并选择一个健康的神经元,其体瘤在切片表面以下至少 30-50μm。
注:健康神经元的表面光滑,膜边界略有对比。不健康的神经元的似乎缩小,高度对比或肿胀和半透明。 - 使用细胞内溶液装载玻璃移液器,直到覆盖 AgCl 电极的尖端。将移液器移入录音室的溶液中,施加轻正压力以保持玻璃电极的尖端清晰。
注意:如果溶液中含有Alexa染料,则压力可以通过视觉上调节从尖端释放的荧光溶液的量进行控制。最小的压力可以避免细胞周围组织的染色。 - 从斜角接近细胞,在形成千兆密封时,在索马表面的前三分之一内建立接触。释放压力,缓慢移动保持潜力到-65 mV,并应用轻轻吸口,以促进千兆密封形成。
- 要建立全细胞配置,应用强而短的吸力来打破膜。如果神经元具有比 50 mV 更去极化的膜潜力,如果保持电流超过 100 pA,或者访问阻力超过 30 MΩ,则丢弃记录。
- 录音后(建议足够填充索马塔和树突至少15分钟:对于加注复杂轴突长达1小时,可能需要31分钟)小心地取出电极。为此,将保持电位设置为 0 mV,并尝试通过缓慢地将移液器向与方法相反的方向缩回移液器来重新形成千兆密封,例如获得外部修补程序配置。
注:在细胞内溶液中存在Alexa染料有助于在视觉引导下从神经元表面去除移液器。如果细胞核与移液器尖端没有接触,则快速改造密封的方法是将移液器对角线拉出组织,并高速向上拉。如果膜核或部分膜位于尖端内,则存在打破等离子膜的危险。在这种情况下,轻微的正压力应用和横向运动会有所帮助。 - 注意单元格的位置和切片的方向。固定后,可以在荧光显微镜下检查切片的确切方向和填充细胞的完整性。
5. 免疫、图像采集和形态重建
- 录制后,将切片转移到 24 井板中,在 0.1 M 磷酸盐缓冲盐水 (PBS) 中将其固定在副醛 (PFA) 中 4%。根据所使用的主要抗体的灵敏度,在RT或4°C下过夜孵育60分钟。切片可以存储在 0.1 M PBS 和 0.02% NaN3中。
警告:PFA是有毒的。在引擎盖下使用。 - 根据既定协议32,33,在记录后一周内进行免疫污染和生物细胞素的揭示。
注:我们使用避免重新分割切片的程序来保持突起和轴突过程的完整性。然而,这个程序需要更长的潜伏时间,因为抗体需要渗透到组织中。我们建议在进行实验之前测试抗体最佳渗透到组织的时间。 - 使用具有 Z 堆栈和瓷砖扫描功能的公用显微镜获取图像。
- 使用斐济图像J34进行形态重建。
注:可使用 Bio 格式 插件导入多个图像文件格式。我们建议使用简单的新瑞特跟踪器 (STN) 插件35 用于树突和轴突的重建。https://imagej.net/SNT 和 http://snyderlab.com/2016/05/25/tracing-neurons-using-fiji-imagej/ 提供简单明了的教程。包含跟踪数据 (.traces) 的文件(如果保存未压缩),可以转换为文本文件,然后使用 Matlab 或其他软件打开以进行文本数据处理。
结果
在此协议中,我们描述了如何从海马的底盘中间部分(图1A)中准备急性海马切片。该协议是特别适合实验,调查涉及空间学习的机制,可以结合行为工作或病毒标记或操纵策略在底片海马35。将此处描述的分体程序应用于注射与克依赖性 GFP 表示腺相关病毒 (AAV-FLEX-GFP) 的动物,这些动物在不同的布雷格玛坐标 AP-1.94 mm, ML±0.5-2毫米,深度-1.25-2.25毫米,瞄准海马形成36 的不同区域,我们能够获得至少三个包含感染区域的横向切片(图1A 浅绿色在海马3D模型上)。此外,几个非横向但健康的切片可以从多脊髓海马(图1C)的更罗氏部分获得。
为了证明我们切片的质量和可行性,我们记录了颗粒细胞的基本电生理和形态参数,以及Pvalb-IRES-Cre凹痕陀螺中标记的帕瓦尔布明阳性(PV+)内歇性:Ai9转基因小鼠(7-12周大),并将这些小鼠与使用标准协议获得的同一区域日冕切片的记录进行比较。
在红外差差干扰对比度 (IR-DIC) 显微镜下进行目视检查后,我们已经注意到横向和日冕切片之间的明显差异。虽然日冕片中主要细胞层的神经元经常出现粗糙和显示强烈对比的轮廓,但横向切片中的神经元大多表面光滑,只有轻微对比边界,表明细胞活力更好(图2A)。日冕和横向切片之间细胞存活率的这些差异的原因可能在于剖面平面与纤维带的方向。由于这些在日冕部分不平行,轴突和树突将被切断。根据这一假设,我们发现在切片中,颗粒细胞层和hilus的表面平面在日冕中表现出比横向切片更大的不连续性(表面平面的步数大小:41.40 ± 3.28 μm 对 25.60 ± 2.94 μm, 平均± SEM, 未选修 T 测试 P = 0.023), 表明日冕切片中的组织断开程度更大 (图 2B)。这意味着,用于贴片夹录音的合适细胞只能在冠状切片颗粒细胞层的较深平面上找到,这反过来又会降低贴片夹录音的吞吐量。事实上,在我们的横向切片中密封形成的平均时间比日冕切片(颗粒细胞:12.64±1.50 s) 更快, n=11 在日冕与 8.40 ± 0.75 s, n=14 在横向切片, 平均± SEM, P= 0.0335 曼恩惠特尼测试;PV+ 内皮: 31.11 ± 2.60 s, n=9 在日冕与 22.00 ± 2.18, n=7 在横向切片, 平均± SEM, P= 0.0283 曼恩惠特尼测试) (图 2C).作为细胞完整性和健康的代名电,我们随后记录了颗粒细胞和PV®内皮的休息膜电位(RMP),这些细胞在冠状体与日冕细胞和PV+内歇基的极化程度显著提高。 横向切片(颗粒细胞:-62.55 ± 3.54 mV,日冕与- 71.06 ± 2.31 mV,n=14 在横向切片中,均值± SEM,P=0.0455 曼-惠特尼测试;PV+ 内窥:-52.75 ± 1.66 mV,日冕为 n=7,± 2.25 mV,n=6 在横向切片中平均± SEM,P= 0.0271 曼恩惠特尼测试) (图 2D)。这些数据表明,在横向与日冕切片制备中,健康神经元的数量更高。事实上,对可接受的RMP(颗粒细胞的-55 mV;PV+内皮细胞的45mV)的截止率高于横向切片(39.67±8.37%,n=3实验会话与 23.00 ± 3.85%, n=4 实验会话) (图 2E).此外,从记录的颗粒细胞的神经元形态重建表明,如预期的那样,在横向切片(图3A,B)中为颗粒细胞取回完整的轴突植物化的机会要好得多。此外,在横向切片中对PV+内皮的形态重建允许描绘广泛的轴突和树突树突,包括树突脊柱35(图3C)等小细节的可视化。
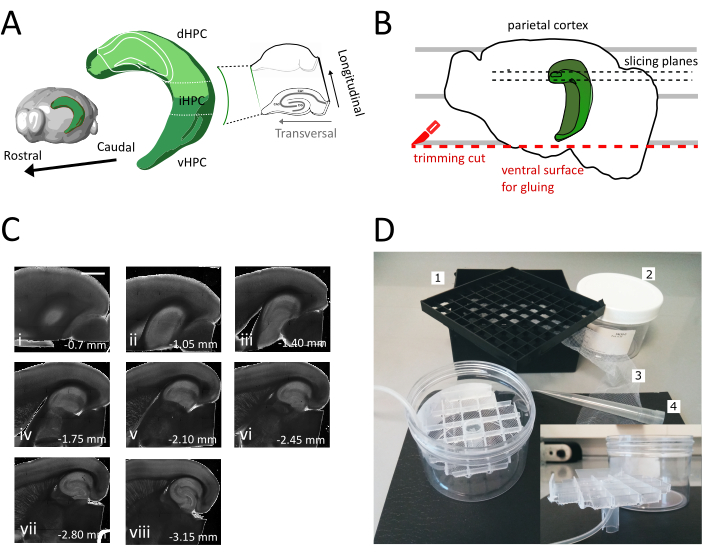
图1:从正中海马中获取切片的剖面程序的插图。(A)海马形成的三维表示,显示其在大脑中的空间方向(从脑探索者,艾伦研究所修改)37。根据东等人(2009年)7,表示海马的多萨尔、中间和室室分裂(dHPC、iHPC、vHPC)。将切片的正中海马部分以浅绿色表示。右侧的插图显示参考轴的方向。(B) 大脑半球的卡通,描绘了皮层皮层与培养皿上的平行线的对齐。红点线指示在哪里执行修剪切口(协议中的点 3.9),以创建将半球粘附到标本持有人的表面。黑色虚线表示收集切片的位置。(C) 在此过程后获得的海马切片的明亮场图像系列。从皮亚尔表面看,经管到心室:(一)0.70毫米,(二)1.05毫米,(三)1.40毫米,(四)1.75毫米,(五)2.10毫米,(六)2.45毫米(七)2.80毫米,(八)3.15毫米。缩放条=1毫米(D)储物室的照片及其组装所需的材料。1. 从 81 倍低温小瓶存储盒中发出的 Vial 隔音器网格, 2.赛林德里克塑料盒。3. 尼龙网,4.移液器提示。插入。网格和管架的横向视图插入到圆环盒中。请点击这里查看此数字的较大版本。

图2:与日冕切片相比,横向切片的可行性有所增强。 (A) DIC-IR显微图,显示横向和日冕切片中神经元索马塔的健康(黑箭头)和不健康(白箭)示例。希尔希卢斯,gcl=颗粒细胞层,毫升=分子层。刻度条 = 50μm (B) 两个分节过程都会在颗粒细胞层表面和 hilus 之间产生一步(箭头表示)。该步骤的高度表明组织断开的程度,在横向部分明显低于日冕(n=5横向和n=5日冕片,平均±SEM,P=0.0238曼恩惠特尼测试)。(C) 颗粒细胞中千兆-欧姆密封形成的时间(横向细胞中为14个细胞,日冕细胞为11个:平均±SEM、P= 0.0355、曼恩-惠特尼测试)和PV+INs(横向的7个细胞,日冕切片中的n=9个细胞,平均±SEM,P=0.0283曼恩-惠特尼测试)切片。(D) 修补细胞的休息膜电位 (RMP) (分别为 n = 14 和 n=11 颗粒细胞)。平均±SEM,P=0.0455曼恩惠特尼测试。n=7 PV+ IN 和 n=10 PV+ IN,P= 0.0271 曼恩-惠特尼测试)。(E) 实验会话中废弃细胞的百分比(日冕切片的 n=3 会话,横向切片的 n=4,平均±SEM)。 请点击这里查看此数字的较大版本。
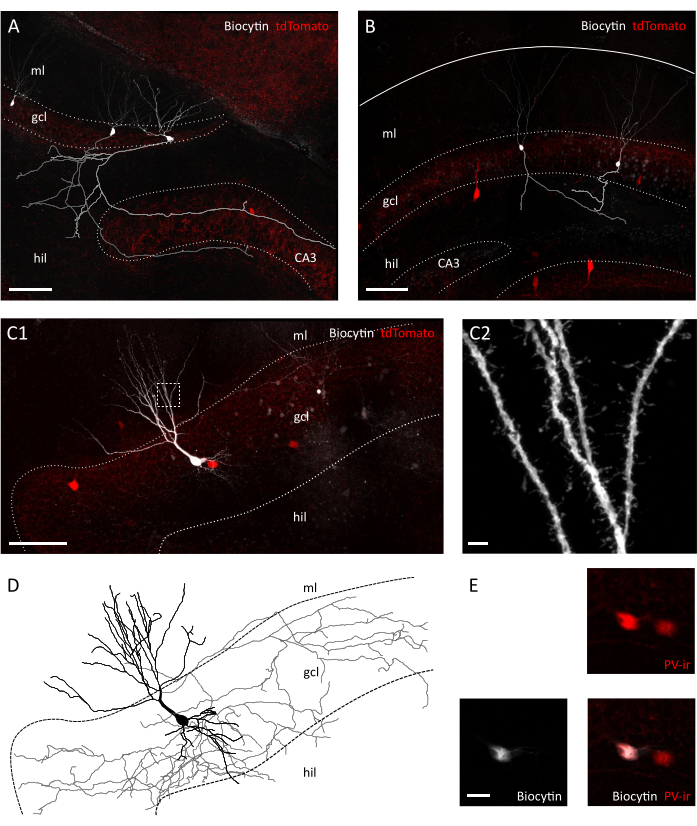
图3:横切片中颗粒细胞和内科细胞的形态保存。共生图像显示生物细胞在横向切片(A)和 Pvalb-IRES-Cre 的日冕片(B)中填充颗粒细胞:Ai9转基因小鼠。各自的轴突已重建为灰色和浅灰色。请注意制剂之间轴轴长度和复杂性的差异。比例尺栏=100μm.(C1 )康福卡图像显示生物辛素填充的tdTomato阳性自相残杀。希尔希卢斯,gcl=颗粒细胞层,毫升=分子层。缩放条=50μm (C2) C1 盒装区域的放大倍率,显示突起脊柱。比例尺栏=2 μm(D) 生物细胞素的轴突和树突的形态重建填充在 C1 中(灰色的轴突,索马和黑色树突)。(E) 特写 C1 中描绘的细胞的 somata,显示生物细胞素和帕瓦尔布明免疫活性 (PVir) 的同位素。缩放条=20μm。请单击此处查看此数字的较大版本。
讨论
鼻孔海马主要通过行为实验、解剖追踪和区域特异性操作,对海马在空间学习和导航中的作用进行了广泛的研究。为了将切片-电-生理查询与这些技术相结合,我们组装了一个协议,该方案使用与海马体中腹区域的修改水平切片类似的切片角度,但使用倒切片顺序从多斯-中间区域获取早期切片。这种方法减少了切片和收集海马的底片区域所需的时间,从而提高了切片的可行性。
使用这种方法,我们能够定期从皮拉尔表面检索约3片每半球的底片海马区域1.4毫米-2.4毫米之间,如图1C所示。虽然通过这个程序不可能从海马体的隔膜极获得横向切片,但可以从隔膜极(图1C ii,iii)收集每个半球另外两个可行的非横向切片。如果海马的隔膜极是主要的研究重点,其他协议,允许收集横向切片,特别是从海马体的隔膜极,可能更适合21,32。空间导航和学习行为实验最好在神经元连接完全发达的成熟小鼠身上进行。因此,我们优化了将切片程序应用于成年动物的大脑(此处显示为三个月大的小鼠),它们比有弹性的幼鼠准备对压力更敏感。为此,我们结合了几个策略,以减少大脑在提取和将切片放入含氧ACSF之间的时间所暴露的缺氧压力。保护性切割解决方案是基于NMDG的ACSF 25,27,28与低Na+和Ca2+,但高Mg 2+,以减少兴奋中毒损害和细胞肿胀由于NMDA受体的激活。此外,HEPES 提供稳定的缓冲和化合物,如坏血酸酯和苯丙酸酯可降低氧化应激。采用冷氧保护切割液的转心输液利用了为大脑提供极其密集的毛细管网络,快速、均匀地减少代谢需求和谷氨酸引起的脑组织兴奋中毒。随后,斩首后几乎所有步骤都在冷却和含氧溶液中执行,以在整个过程中将新陈代谢和缺氧控制在最低限度。其他策略,以减少脑损伤在切片存在,并可能同样有效38。为了证明我们的准备质量,我们将其与冠状切片制剂进行比较,后者通常用于记录从正名海马。即使日冕片可用于在凹痕陀螺中获得良好的贴片夹记录,但不健康和断开的神经元数量高于横向切片。此外,轴突和树突的完整性在横切片中保存得更完好。事实上,颗粒细胞轴突(图3A)的完整性,运行正交海马的纵向轴作为横向切片平面1的指标。
对于修补神经元的填充,我们建议电极电阻在 3 到 5 MΩ 之间。尖端直径约 1μm,可在录制过程中实现良好的密封电阻,并在电极缩力时实现良好的密封性。最关键的细节是避免将部分索马或细胞核吸入移液器。因此,我们建议尽可能在细胞内溶液中包括 Alexa 染料。染料允许在录制和重新密封期间监控细胞形状。此外,它允许在固定后评估修补细胞的完整性,这样可以节省免疫组织化学时间,在填充不成功的情况下。由于亚历克萨染料的淬火时间长,我们建议尽可能短的固定。
对于后续的免疫染色,我们使用不需要重新切片的协议。我们建议在固定后一周内进行染色。切片在冰箱里停留的时间越长,组织退化的几率就越高。如果无法避免长时间存储,我们建议将 PBS 中的 NaN3 浓度提高到 0.05%,并每周刷新一次。整个切片的免疫化意味着具有原辅抗体的潜伏时间增加。通常,为了揭示生物细胞素,在4°C下一夜孵育就足够了,但如果与其他蛋白质的染色结合,整个染色过程可以持续更长的时间。渗透阻断和抗体孵化需要单独优化。通常,对于原发性抗体,两天就足够了,而一天可以足够二次抗体。我们建议增加洗涤步骤的持续时间以及更长的抗体孵化,以避免背景的增加。
在此协议中,我们提出了一个切片方法,以获得横向或几乎横向海马切片保存成人组织的神经元生存能力,以及恢复修补神经元的形态学和神经化学特性的实用方法。这种方法可以很容易地执行,以匹配电生理结果与解剖和行为研究的重点是海马的中间多部分。
披露声明
作者没有什么可透露的。
致谢
我们感谢克斯汀·克罗嫩比特和迪迪埃·格雷梅勒的技术援助。我们感谢翁贝托莫雷利在图形软件和马蒂亚斯霍普的视频制作和视频编辑的帮助。我们实验室的工作得到了德国福松斯格梅因沙夫特 (DFG) FOR2143、SFB 1461(项目 ID 434434223)和 GRK2154 的支持,医学研究理事会授予 G1100546/2 和基尔大学。
材料
| Name | Company | Catalog Number | Comments |
| 1mL syringes Omnifix-F | Braun melsungen AG | 9161406V | |
| 24 multiwells | SARSTEDT | 8,33,922 | |
| 81x criogenic vial storage box | Fisherscientific | 15-350-107B | storage chamber |
| Alexa Hydrazide dye | Invitrogen | A10436 | |
| Big scissor | Fine science tool | 14010-15 | graefe forceps |
| Biocytin | IRIS biotech. | LS3510.0250 | |
| Borosilicate Glass capillaries | Science products | GB150TF-10 | storage chamber |
| Brush 5 | Leonhardy | 241 | Micro double spatula, L 150 mm, blade width 4 mm |
| Calcium chloride dihydrate | Roth | 5239.2 | aCSF solution |
| Carbon steel microtome blade | feather | C35 | |
| Chloridric acid | Roth | K025.1 | |
| Confocal microscope | Zeiss | LSM880 | with Airyscan |
| Cyanoacrylate glue | UHU | 509141 | |
| Cyanoacrylate glue, n-butyl-ester VetBond | 3M | ||
| EGTA | Roth | 3054.1 | |
| Fiji ImageJ | fiji.sc | ||
| Filter paper 113A | ROTILABO Roth | AP180.1 | |
| Fine tip tweezer | Dumont | 0245fo | |
| Glass becker (150 ml) | ROTILABO Roth | X690.1 | incubation chamber and dissection |
| Glass Petri dishes (10 cm dia.) | ROTILABO Roth | 0690.1 | |
| Glucose | Roth | X997.2 | aCSF solution |
| Heated water bath | Grant Instruments Ltd | SUB14 | |
| HEPES | Roth | 9105.4 | aCSF solution |
| Isofluoran | baxter | 5239.2 | Anesthetic |
| Large spatula | Roth | E286.1 | |
| Magnesium Sulfate heptahydrate | Roth | 8793.2 | aCSF solution |
| Mg-ATP | Sigma Aldrich | A9187 | |
| Microfil | World precision instruments | MF34G | |
| Na2-GTP | Sigma Aldrich | 51120 | |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF solution |
| Normal goat serum | Sigma Aldrich | 566380 | |
| Nylon mesh kit | Warner Instruments | 64-0198 | incubation chamber and storage chamber |
| Paraformaldeyde | Sigma Aldrich | P6148 | |
| Phosphate buffered saline 10X | Panbiotech | P04-53500 | |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | |
| Pipette puller | Sutter instrument | P-2000 | |
| Pipette tips | SARSTEDT | 7,07,62,211 | incubation chamber |
| Plastic box for syringe filters | SUPELCO | 54135-U | storage chamber |
| Potassium Chloride | Roth | 6781.3 | aCSF solution |
| Potassium Gluconate | Roth | P1847 | |
| Probenbecker becker (100 ml) | ROTILABO Roth | HT85.1 | incubation chamber |
| Rounded tip tweezers | Fine science tool | 11051-10 | |
| Sainless steel blade | Gillette | Vibratome | |
| Small scissor | Fine science tool | 14010-10 | mayo scissor straight |
| Sodium Ascorbate | Roth | 3149.2 | aCSF solution |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium Bicarbonate | Roth | 6885.1 | aCSF solution |
| Sodium Chloride | Roth | 3957.1 | aCSF solution |
| Sodium Hydroxide | Roth | K021.1 | |
| Sodium Phosphate monobasicdihydrat | Roth | K300.1 | aCSF solution |
| Sodium Pyruvate | Roth | 8793.2 | aCSF solution |
| Streptavidin conjiugated Alexa 488 | Invitogen | s11223 | |
| Thin spatula | Roth | E286.1 | Double spatula, L 150 mm, blade width 9 mm |
| Transfer pipette | Sarstedt | 861171 | |
| Triton x100 | Roth | 3051.1 | |
| Vibratome | Thermoscientific | Microm HM650V | |
| Filter device for ultrapure water | Merck-Millipore | Milli-Q IQ 7000 |
参考文献
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65 (1), 7-19 (2010).
- David, A., Pierre, L. Hippocampal Neuroanatomy. The Hippocampus Book. , 37-114 (2006).
- Dong, H. W., Swanson, L. W., Chen, L., Fanselow, M. S., Toga, A. W. Genomic-anatomic evidence for distinct functional domains in hippocampal field CA1. Proceedings of the National Academy of Sciences of the United States of America. 106 (28), 11794-11799 (2009).
- Royer, S., Sirota, A., Patel, J., Buzsaki, G. Distinct representations and theta dynamics in dorsal and ventral hippocampus. Journal of Neuroscience. 30 (5), 1777-1787 (2010).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Foggetti, A., Baccini, G., Arnold, P., Schiffelholz, T., Wulff, P. Spiny and Non-spiny Parvalbumin-Positive Hippocampal Interneurons Show Different Plastic Properties. Cell Rep. 27 (13), 3725-3732 (2019).
- Cembrowski, M. S., Spruston, N. Heterogeneity within classical cell types is the rule: lessons from hippocampal pyramidal neurons. Nature Reviews Neuroscience. 20 (4), 193-204 (2019).
- Moser, M. B., Moser, E. I., Forrest, E., Andersen, P., Morris, R. G. Spatial learning with a minislab in the dorsal hippocampus. Proceedings of the National Academy of Sciences of the United States of America. 92 (21), 9697-9701 (1995).
- Pothuizen, H. H., Zhang, W. N., Jongen-Relo, A. L., Feldon, J., Yee, B. K. Dissociation of function between the dorsal and the ventral hippocampus in spatial learning abilities of the rat: a within-subject, within-task comparison of reference and working spatial memory. European Journal of Neuroscience. 19 (3), 705-712 (2004).
- Fredes, F., et al. Ventro-dorsal Hippocampal Pathway Gates Novelty-Induced Contextual Memory Formation. Current Biology. 31 (1), 25-38 (2021).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Andersen, P. Long-lasting facilitation of synaptic transmission. Ciba Foundation Symposium. (58), 87-108 (1977).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. Journal of Neurophysiology. 67 (5), 1346-1358 (1992).
- Walther, H., Lambert, J. D., Jones, R. S., Heinemann, U., Hamon, B. Epileptiform activity in combined slices of the hippocampus, subiculum and entorhinal cortex during perfusion with low magnesium medium. Neurosci Lett. 69 (2), 156-161 (1986).
- Rafiq, A., DeLorenzo, R. J., Coulter, D. A. Generation and propagation of epileptiform discharges in a combined entorhinal cortex/hippocampal slice. Journal of Neurophysiology. 70 (5), 1962-1974 (1993).
- Leutgeb, J. K., Frey, J. U., Behnisch, T. LTP in cultured hippocampal-entorhinal cortex slices from young adult (P25-30) rats. Journal of Neuroscience Methods. 130 (1), 19-32 (2003).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature Protocols. 1 (3), 1235-1247 (2006).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording Synaptic Plasticity in Acute Hippocampal Slices Maintained in a Small-volume Recycling-, Perfusion-, and Submersion-type Chamber System. Journal of Visualized Experiments. (131), e55936 (2018).
- Dougherty, K. A., Islam, T., Johnston, D. Intrinsic excitability of CA1 pyramidal neurones from the rat dorsal and ventral hippocampus. Journal of Physiology. 590 (22), 5707-5722 (2012).
- Tidball, P., et al. Differential ability of the dorsal and ventral rat hippocampus to exhibit group I metabotropic glutamate receptor-dependent synaptic and intrinsic plasticity. Brain and Neuroscience Advances. 1 (1), (2017).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159 (2005).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), e53825 (2018).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Archives. 414 (5), 600-612 (1989).
- Djurisic, M. Minimizing Hypoxia in Hippocampal Slices from Adult and Aging Mice. Journal of Visualized Experiments. (161), e61377 (2020).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. P. Acute Brain Slice Methods for Adult and Aging Animals: Application of Targeted Patch Clamp Analysis and Optogenetics. Patch-Clamp Methods and Protocols, 2nd Edition. 1183, 221-242 (2014).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments. (91), e51706 (2014).
- Norenberg, A., Hu, H., Vida, I., Bartos, M., Jonas, P. Distinct nonuniform cable properties optimize rapid and efficient activation of fast-spiking GABAergic interneurons. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 894-899 (2010).
- Swietek, B., Gupta, A., Proddutur, A., Santhakumar, V. Immunostaining of Biocytin-filled and Processed Sections for Neurochemical Markers. Journal of Visualized Experiments. (118), e54880 (2016).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nature Protocols. 1 (4), 1977-1986 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Longair, M. H., Baker, D. A., Armstrong, J. D. Simple Neurite Tracer: open source software for reconstruction, visualization and analysis of neuronal processes. Bioinformatics. 27 (17), 2453-2454 (2011).
- Murray, A. J., et al. Parvalbumin-positive CA1 interneurons are required for spatial working but not for reference memory. Nature Neuroscience. 14 (3), 297-299 (2011).
- Otis, T. S., Staley, K. J., Mody, I. Perpetual inhibitory activity in mammalian brain slices generated by spontaneous GABA release. Brain Research. 545 (1-2), 142-150 (1991).
- Varela, C., Llano, D. A., Theyel, B. B. An introduction to in vitro slice approaches for the study of neuronal circuitry. Neuromethods. 67, 103-125 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。