Method Article
성인 마우스의 덴테이트 자이루스에서 전신 기록 및 신경 재건을위한 등산 해마에서 급성 슬라이스의 준비
요약
우리는 마우스의 등간 중간 해마에서 급성 슬라이스를 준비하는 프로토콜을 제시한다. 우리는 기록의 품질과 기록 된 뉴런의 형태학적 특징의 보존 측면에서 관상 슬라이스와이 트랜스 버사제 준비를 비교합니다.
초록
해마의 일반적인 건축은 세로축을 따라 유사하지만, 최근 연구는 분자, 해부학 및 기능 적 기준에 눈에 띄는 차이를 밝혀 로스트로 - caudal 정도에 따라 다른 하위 회로로 분열을 제안. 차등 연결성과 기능 으로 인해 가장 근본적인 구별은 각각 공간 및 정서적 처리에 우선적으로 관여하는 등쪽과 복부 해마 사이에 이루어집니다. 따라서, 공간 기억 형성에 관한 생체 내 작업은 등해마에 초점을 맞추고 있다.
대조적으로, 체외 내 기록은 주로 슬라이스 생존력과 회로 무결성과 같은 요인에 의해 동기를 부여, 중간 복부 해마에 우선적으로 수행되었습니다. 생체 내 데이터와 공간 처리에 대한 생체 내 데이터의 직접적인 상관관계를 허용하기 위해 우리는 덴테이트 자이러스에서 주요 세포 및 인터뉴런의 장기 기록을 위해 등쪽 중간 해마에서 매우 실행 가능한 횡방향 뇌 조각을 얻기 위해 이전 단면 방법을 조정했습니다. 공간 적 행동은 성인 마우스에서 일상적으로 분석되기 때문에, 우리는 성숙한 동물에서 뇌 조직의 생존력을 향상시키기 위해 보호 솔루션의 사용과이 트랜스 버사클 슬라이스 절차를 결합했다. 우리는 대략 3 달의 생쥐를 위해 이 접근을 이용합니다. 이 방법은 등대 해마에 대한 체외 연구에 자주 사용되는 관상 제제에 대한 좋은 대안을 제공합니다. 우리는 기록된 뉴런의 형태학적 특징의 기록과 보존의 질 측면에서 이 두 가지 제제를 비교합니다.
서문
해마는 학습과 기억, 공간 탐색뿐만 아니라 감정의 다른 측면에서 중추적 인 역할에 대한 광범위하게 연구되고있다. 일반적으로 "삼중 회로"라고 불리는 해마의 기본 회로는 경도 축1을따라 크게 보존되는 횡축의 라멜라 네트워크입니다. 다양한 인지 및 정서적 행동에 해마의 기여는 가능성이이 기본 회로가 여러 다른 뇌 영역과 등소 벤탈 축을 따라 만드는 다양한 연결에서 발생2,3. 그러나, 해마의 세막-측두엽축을 따라 더 많은 차이를 가리키는 연구의 증가수는, 그러나, 구체및 efferent 연결을 넘어. 이러한 차이는 내부 아키텍처 및 연결성뿐만 아니라 유전자 발현 패턴 및 뉴런 형태4,5,6,7,8의차이에 관한 것이다.
기본 회로에서 이러한 차이의 존재를 고려, 해결되는 질문에 따라 조사 할 특정 해마 하위 회로를 선택하는 것이 합리적이다. 예를 들어 질문이 공간 처리에 관여하는 뉴런 메커니즘에 관한 경우, 두 가지가 해마 내 세로연결성 9,10,11로인해 생체 내에서 독립적으로 작용하지 는 않지만, 복부 해마보다는 등쪽이 흥미로하다. 이러한 라인을 따라 세로축을 따른 차이는 고려해야 할 뿐만 아니라 가능한 한 국소 및 장거리 회로를 보존하기 위해서는 주의가 필요합니다. 섬유 경로의 보존과 연결을 위해서는 뇌가 절제되는 각도가 필수적입니다.
문헌에서 보고된 첫 번째 방법은 시험 회로를 먼저 뇌로부터 분리한 다음 조직헬기(12)와 진동토메(13)를 사용하여 횡방향 슬라이스(세로축에 수직)를 만들었다. 나중에 생리학자들은 해마에 연결된 인접한 뇌 구조를 보존하기 위해 전체 뇌 블록에서 조각을 얻는 것을 선호했습니다. 이러한 블록 제제를 위해, 해마에 대하여 상이한 단면각이 개발되었다, 관상 슬라이스 준비등 (14 또는 해마 내경 피질 연결을 보존하기위한 HEC 슬라이스라는 수평 슬라이스 준비15,16,17.
후자의 준비에서 정수리 엽은 블록의 베이스를 형성하기 위해 로스트로 -caudal 축을 따라 수평 평면에 대하여 0 ° 또는 12 °의 각도로 절단된다. 슬라이스는 뇌의 복부 표면에서 시작하여 수집되므로 주로 중간 복부 해마 부위의 수확을 허용합니다. 이 방법은 생리학적 연구에서 가장 인기있는 선택이되었으며 여러 개의 출판 된프로토콜(18,19,20)에따라 안정적으로 수행 될 수 있습니다.
그러나, 연구 관심 공간 학습의 특정 측면에 관한 경우, 등쪽 해마는 조사의 더 적합한 영역이 될 수 있으며,이 해마 지역에 대한 유사한 품질의 슬라이스 절차를 찾는 것이 유용 할 것이다. 매우 장막 극에 초점을 맞춘 몇 가지 프로토콜은이 수요를 만족시킬 수있는 개발되었습니다 21,22.
이 프로토콜에서, 대신, 우리는 이전에 수평 제제에 대해 설명된 단면 각을 사용하는 등쪽 중간 해마로부터 실행 가능한 횡방향 조각을 얻는접근법을설명한다(도1A & B). 우리는 관상 동맥 조각에서 얻은 것과이 준비에서 전기 생리학적 기록 및 형태 학적 재구성을 비교하여이 프로토콜의 품질을 보여줍니다. 이 프로토콜은 성인 마우스의 해부학 적 및 행동 실험과의 조합에 특히 적합합니다 (우리의 경우 3 개월).
프로토콜
실험 동물과 관련된 모든 절차는 독일 동물 복지법에 따라 있었으며 키엘 대학의 윤리위원회의 승인을 받았습니다. 파르팔알민-Cre(Pvalb-IRES-Cre)마우스(23)(잭슨 연구소, 저장소 번호 008069)는 이종고우스 콜로니로 유지되거나 Ai9 Cre 기자마우스(24)(잭슨 연구소, 저장소 번호 007909)와 교차하였다. P40-P90 사이의 암컷과 수컷 마우스가 사용되었다. 마우스는 표준 그룹 하우징 조건하에서 12h 의 밝은 어두운 주기에서 유지되었고 음식과 물 광고 리비툼을제공하였다.
1. 솔루션 준비
참고: 초순수(UPW)(25°C 18.2 MΩcm의 저항)를 사용하여 모든 실험일에 신선한 솔루션을 준비하십시오. 용액은 최대 1일 동안 4°C로 저장될 수 있다. 마그네슘과 칼슘 솔루션은 1M 스톡 솔루션으로 별도로 보관할 수 있습니다. 모든 작업 솔루션은 사용 전과 사용 중에 최적의 산소 및 pH 유지 보수를 위해 카보겐(95% O2:5%CO2)으로포화되어야 합니다.
- 절삭 액(마우스당 500mL)(mM)을 준비: 92 NMDG, 2.5 KCl, 1.25 NaH2PO4,30 NaHCO3,20 HEPES, 25 포도당, 5 Na-ascorbate, 4 Na-pyruvate, 0.5 CaCl2·2H2O, 및 10 MgSO4·7H2O. Titrate 에 pH 7.4 의 화학 적 후드 4-5 m0 이것은 MgSO4의강수량을 피할 것입니다.
참고: KCl 및 NaH2PO4는 4°C에서 10x 솔루션으로 저장할 수 있습니다. 우리는 절단 솔루션의 두 개의 개별 배치를 합니다. 녹음 전날(밤에 냉동실에 보관하여 분쇄된 얼음을 생산함) 및 녹음 당일 1개. - 저장 솔루션 준비(마우스당 250mL) (mM): 92 NaCl, 2.5 KCl, 1.25 NaH2PO4,30 NaHCO3,20 HEPES, 25 포도당, 5 Na-ascorbate, 4 Na-pyruvate, 2 CaCl2·2H2O, 및 2 MgSO4·7H2O. Titrate to pH 7.3-7.4 1 N NaOH.
참고: NaCl, KCl 및 NaH2PO4는 4°C에서 10x 용액으로 비축할 수 있습니다. - 기록용 ACSF 준비(mM): 122 NaCl, 2.5 KCl, 1.25 NaH2PO4,24 NaHCO3,12.5 포도당, 2 CaCl2·2H2O, 2 MgSO·47H2O, 2 Na-ascorbate, 4 나피루바테. Titrate pH 에 7.3-7.4 와 1 N NaOH.
참고: NaCl, KCl 및 NaH2PO4를 4°C의 10배 스톡 솔루션에 결합할 수 있습니다.
2. 슬라이스벤치 준비
- 비커(150mL)와 유리 페트리 접시 2개(직경 10cm)를 얼음 위에 준비하고 신선한 절단 용액으로 채웁니다. 카보겐 버블링 장치(천공 튜브 또는 카보겐 시스템에 연결된 공기 석)로 용액을 산소화상태로 유지하십시오.
참고: 비커의 용액은 관류에 사용되며 Petri 요리는 절단 절차 중에 사용됩니다. - 수술 벤치에스테인 스틸 블레이드, 둥근 팁 핀셋, 미세 팁 핀셋, 큰 가위, 작은 가위, 대형 금속 주걱, 얇은 금속 주걱, 브러시, 진동판 및 시아노아크레이트 접착제 또는 독성이 적은 N-butyl-ester cyacrya 스테인리스 스틸 블레이드와 얼음 에 유리 페트리 접시 중 하나에 필터 종이 조각을 병합. 이 페트리는 뇌를 자르는 데 사용됩니다. 플라스틱 페트리 접시의 바닥에 세 개의 평행선을 그리고 수술 기구에 가까운이 접시를 배치합니다.
- 게시된프로토콜(25)에따라 트랜스 카DIAL 관류에 대한 설정을 준비한다.
- 진동을 준비하고 블레이드 홀더에 새 블레이드를 장착하고 절단 매개 변수를 설정합니다 (수평 평면 17 °에서 블레이드의 각도, 블레이드 진동 진폭 1.5mm, 블레이드 전방 이동 속도약 2mm~1,진동 주파수 90 Hz, 단층 두께 350 μm). 진동 트레이를 얼음 냉간 절단 용액으로 채우고 일정한 산소 공급 하에 보관하십시오.
참고: 냉각된 신선한 절단 솔루션에 첫 번째 절단 용액으로 만들어진 분쇄된 얼음을 추가하여 온도를 유지합니다. 슬라이스하는 동안 블레이드에서 얼음을 유지하기 위해주의를 기울이십시오. - 일정한 산소화 하에서 절삭 액으로 채워진 인큐베이션 챔버를 준비합니다. 챔버를 미리 데운 수조(35°C)에 놓습니다.
참고: 인큐베이션 챔버의 예는 에드워즈와 코너스 (1992)26에서찾을 수 있습니다. - 저장 솔루션으로 채워진 슬라이스 저장 챔버를 준비하고 실온과 일정한 산소 처리 하에 보관하십시오. 조직이 형광 단백질 또는 빛 활성화 된 opsin을 표현하는 경우, 예를 들어, 상자 내부, 어둠 속에서 챔버를 유지하는 것이 좋습니다.
참고: 여러 개의 독립적인 우물이 있는 저장 챔버는 해마의 등소 벤터랄 축을 따라 슬라이스의 수준을 구별하는 데 유용합니다. 맞춤형 챔버를 만들 수있습니다(그림 1D). 81x 극저온 바이알 저장 상자에서 바이알 스페이서 그리드 한 조각을 꺼내 바닥을 나일론 그물에 붙입니다. 5mL 파이펫 플라스틱 팁의 1/3을 이 그리드의 중앙에 삽입하여 하단에 약 3cm가 튀어나갑니다. 이 플라스틱 팁은 그리드의 스탠드 역할을하며 나중에 산소화를위한 공기 튜브를 보유하고 있습니다. 스탠드가 있는 그리드를 사이클린드 플라스틱 상자(예: 주사기 필터 포장)에 삽입하여 기울거나 흔들릴 수 없도록 합니다. 이 저장소는 250mL의 저장 솔루션을 보유합니다.
3. 해마 슬라이스 준비
- 후드 아래 이소플루란(약 0.5mL)을 사용하여 박스 챔버에서 마우스를 마취시화합니다. 호흡이 느리고 규칙적 일 때까지 마우스를 쉬게하십시오 (약 2-3 분). 발가락 핀치통증으로 통증 반응이 없는 지 테스트합니다.
- 공표된프로토콜(25,27)에이어 얼음 위에서 비커에서 25mL의 탄산 절단 용액을 사용하여 경전 관류를 수행한다. 이 단계는 빠르게 신경 대사를 느리게 하는 뇌를 냉각 하는 것이 좋습니다.
- 큰 가위를 사용하여 동물을 참수하고 절단 용액이 들어있는 얼음에 냉각 페트리 접시에 머리를 놓습니다.
- 미세 한 가위로 피부를 열어 두개골을 노출시합니다. 포라멘 매그넘의 양쪽에 있는 두개골 의 바닥에 작은 측면 절개를 만듭니다. 그런 다음 후각 전구 위의 나소 정면 봉합사에 도달 할 때까지 foramen 매그넘에서 시작하여 간구 봉합사를 따라 잘라. 근본적인 두뇌 조직의 손상을 피하기 위하여 처질 절단 도중 가위를 당깁니다.
참고: 절단 용액에 머리를 잠그면 혈액에서 지워지고 온도를 낮추는 데 도움이 됩니다. - 둥근 팁 트위저를 사용하여 정수리 뼈를 당겨 뇌를 노출하십시오. 수막도 잡으시고 제거하는 데 주의를 기울이십시오. 방치하면 추출 하는 동안 뇌를 손상시킬 수 있습니다.
- 작은 주걱을 사용하여 두 번째 페트리 접시에 뇌를 부드럽게 떠냅니다.
- 미리 차가운 블레이드를 사용하여 세로 균열을 따라 반으로 뇌를 잘라.
- 큰 주걱을 사용하여 절단 용액에서 한 반구를 들어 올리고 플라스틱 페트리 접시에 들어올립니다. 반구가 내측 표면에 누워있는 경우, 정수리 피질을 평행선 중 하나와 정렬하여 도 1B에표시된 바와 같이 두 번째 절단에 대한 참조를 갖습니다.
- 반구의 복부 부분에서 블레이드를 배치하여 표면을 얻기 위해 블레이드를 배치한 후, 나중에 도 1B에도시된 바와 같이 시편 홀더에 뇌를 붙이는 데 사용됩니다(다음 단계 참조). 유리 페트리 접시의 산소 절단 용액으로 반구를 반환하고 두 번째 반구에서 동일한 절차를 수행합니다.
- 접착제를 사용하여 새로 절단 된 복부 면으로 반구를 진동 시편 홀더에 붙입니다. 접착제를 고화시키고 시편 홀더를 진동 트레이로 이동시키기 위해 반구에 절단 용액 몇 방울을 넣습니다. 이렇게 하면 슬라이스가 등쪽에서 복부 해마로 진행됩니다.
- 관심 영역이 표시될 때까지 초기 하나 또는 두 개의 비-트랜스버슬라이스(그림1C,ii-iii)를제거한 다음 슬라이스 수집을 시작합니다.
참고: 비트랜스버럴하지만 사용 가능하지만, 건강한 슬라이스는 슬라이스 절차의 시작 부분에서 등쪽 해마로부터 얻을 수있다(도 1C,ii-iii). 각 슬라이스의 컬렉션은 약 3-4분이 필요합니다. 복부 해마 대신 등에서 절단을 시작하여 우리는 약 10 분을 절약하여 등갈 조각의 생존력을 향상시킵니다. - 플라스틱 파이펫(팁의 좁은 끝을 잘라내면) 각 슬라이스를 인큐베이션 챔버(35°C에서 절삭 액션 포함)로 옮기고 12분 동안 휴식을 취합니다. 따뜻한 절단 용액의 짧은 회복 기간은 초기 신경 부종을 크게 감소시키며, 팅 외(2014)28에보고된 바와 같이. 그런 다음 브러시를 사용하여 슬라이스를 저장 챔버(RT의 저장 솔루션 포함)로 옮기고 실험이 시작될 때까지 휴식을 취합니다.
4. 전세포 레코딩 및 생생물시틴 충전
참고: 전세포 패치 클램프 레코딩에 대한 설명은 좋은 바이오시틴 충전을 얻는 데 도움이 되며 일반적으로 ACSF의 뉴런에 적용되는 주요 단계로만 감소됩니다. 전기 생리학적 기록의 절차에 관한 자세한 내용은, 몇몇 다른 프로토콜은29,30을상담할 수 있다.
- 기록할 매개 변수에 따라 적절한 세포내 용액을 선택합니다. 예를 들어, 현재 클램프 측정의 경우, 글루코네이트 기반 용액(mM)을 사용할 수 있습니다(mM): 135 K-글루코네이트, 3 KCl, 10 HEPES, 0.2 EGTA, 10 인포크레아틴-나2,4 MgATP, 0.3 Na2-GTP. pH를 1M KOH로 7.3으로 조정합니다. osmolality 는 약 285-290 mOsmol/kg 한 번 3-5 mg/mL 바이오시틴이 첨가되어야 합니다.
참고: 레코딩 중에 뉴런의 모양을 모니터링하려면, 1mM 알렉사 플루오르 히드라지드의 0.3-0.5 μL/mL을 세포내 용액에 첨가할 수 있다. 이 경우, 알렉사 염료 색상과 연쇄상 구균에 결합된 형광 프로브와 일치하도록 생물학적 시틴 계시를 기억하십시오. - ≤1 μm 팁 직경의 패치 클램프 전극과 두꺼운 벽의 보로실리케이트 모세혈관에서 3-5 MΩ 저항을 준비합니다.
- RT 또는 35-37°C에서 2.5-3mL/분의 속도로 패치 클램프 설정의 관류 시스템을 시작하고 U자형 앵커로 챔버내슬라이스를 고정한다.
- 관심있는 뇌 영역을 식별하고 슬라이스의 표면 아래 적어도 30-50 μm 소마와 건강한 뉴런을 선택합니다.
참고: 건강한 뉴런의 소마는 매끄러운 표면을 가지고 있으며 멤브레인 테두리는 약간 대조됩니다. 건강에 해로운 뉴런의 소마는 수축되고 높게 대조되거나 부어 오르고 반투명하게 나타납니다. - AgCl 전극의 끝이 덮일 때까지 세포 내 용액으로 유리 파이펫을 적재합니다. 파이펫을 레코딩 챔버의 용액으로 이동하여 가벼운 양압을 적용하여 유리 전극의 끝을 지웁니다.
참고: 용액에 Alexa 염료가 포함된 경우 팁에서 방출되는 형광용의 양을 시각적으로 조정하는 압력을 제어할 수 있습니다. 최소한의 압력은 세포 주위조직의 염색을 피할 것입니다. - 경사 각도에서 세포에 접근하고 기가 씰을 형성 할 때 소마 표면의 첫 번째 1/3 내에서 접촉을 설정합니다. 압력을 방출하고, 보유 전위를 65mV로 천천히 이동하고 입으로 부드러운 흡입을 적용하여 기가 씰 형성을 용이하게 한다.
- 전체 세포 구성을 설정하려면 강력하고 간단한 흡입을 적용하여 멤브레인을 분해하십시오. 뉴런이 멤브레인 전위가-50mV보다 더 탈극화된 경우, 보유 전류가 100pA 이상으로 증가하거나 접근 저항이 30MΩ 을 초과하는 경우 기록을 폐기하십시오.
- 레코딩 후(소마타및 원생기의 충분한 충진을 위해 최소 15분 이상 권장; 복잡한 축축을 1시간까지 채우기 위해31분까지)전극을 조심스럽게 제거한다. 이를 위해 보유 잠재력을 0mV로 설정하고 외부 패치 구성을 얻는 것과 같은 접근 방식과 반대 방향으로 파이펫을 천천히 철회하여 기가 씰을 다시 형성하려고 시도합니다.
참고: 세포 내 솔루션에 Alexa 염료의 존재는 신경 표면에서 피펫을 시각적으로 유도하는 데 도움이됩니다. 세포의 핵이 파이펫 팁과 접촉하지 않으면, 씰을 개혁하는 빠른 방법은 파이펫을 조직에서 대각선및 위쪽으로 대각선으로 당기고 고속으로 위로 당겨지고 있다. 막의 핵 또는 일부가 팁 내에 있는 경우, 플라즈마 멤브레인을 파괴할 위험이 있다. 이 경우 약간의 양압 응용 프로그램과 측면 이동이 도움이 될 수 있습니다. - 셀의 위치와 슬라이스의 방향을 기록합니다. 고정 후 슬라이스의 정확한 방향과 채워진 세포의 무결성은 형광 현미경으로 확인할 수 있습니다.
5. 면역 염색, 이미지 수집 및 형태 학적 재구성
- 녹화 후, 0.1 M 인산염 완충식식염(PBS)에서 파포름데히드(PFA)에서 4%로 슬라이스를 24웰 플레이트로 옮킨다. 사용되는 1차 항체의 민감도에 따라 RT 또는 4°C에서 60분 동안 배양한다. 슬라이스는 0.1 M PBS 및 0.02% NaN3에저장할 수 있습니다.
주의: PFA는 독성이 있습니다. 후드 아래에 사용하십시오. - 확립된 프로토콜에 따라 기록 후 1주일 이내에 면역염색 및 생생물시틴 계시를 수행한다32,33.
참고: 우리는 수지상 및 축 축 과정의 무결성을 유지하기 위해 슬라이스의 재단면을 방지하는 절차를 사용합니다. 그러나, 이 절차는 항체가 조직에 침투할 필요가 있기 때문에 더 긴 잠복 시간을 요구합니다. 실험을 수행하기 전에 항체가 조직에 최적의 침투 시간을 테스트하는 것이 좋습니다. - Z 스택 및 타일 스캐닝 기능을 갖춘 공초점 현미경을 사용하여 이미지를 획득합니다.
- 피지 이미지를 사용하여 형태 학적 재구성을 수행J34.
참고: 바이오 포맷 플러그인을 사용하여 여러 이미지 파일 형식을 프로그램으로 가져올 수 있습니다. 우리는 민원과 축하의 재건을위한 간단한 Neurite 추적기 (STN) 플러그인35의 사용을 권장합니다. 간단하고 명확한 튜토리얼은 https://imagej.net/SNT http://snyderlab.com/2016/05/25/tracing-neurons-using-fiji-imagej/ 사용할 수 있습니다. 추적 데이터(.traces)가 포함된 파일은 압축되지 않은 저장된 경우 텍스트 파일로 변환하고 텍스트 데이터 처리를 위해 Matlab 또는 기타 소프트웨어로 열 수 있습니다.
결과
이 프로토콜에서 우리는 해마의 등간 중간 부분에서 급성 해마 조각을 준비하는 방법을 설명합니다(도 1A). 프로토콜은 공간 학습에 관여하는 메커니즘을 조사하는 실험에 특히 적합하며 등쪽해마(35)의행동 작용 또는 바이러스 라벨링 또는 조작 전략과 결합될 수 있다. 상이한 브레그마에서 Pvalb-IRES-Cre 마우스의 등쪽 해마로 아데노 관련 바이러스(AAV-FLEX-GFP)를 발현하는 Cre-의존하는 GFP를 주입한 동물에게 설명된 단면 절차를 적용하여 AP-1.94 mm를 조정합니다. ML ± 0.5-2 mm, 깊이-1.25-2.25 mm해 해마 형성36의 상이한 영역을 표적으로 하여 감염된 부위를 포함하는 적어도 3개의 트랜스버라클 슬라이스를 얻을 수 있었다(해마의 3D 모델에서1A 광녹색 착색). 또한, 여러 비트랜스버럴하지만 건강한 슬라이스는 등도 해마의 더 많은 장밋빛 부분으로부터 얻을 수있다(도 1C).
우리의 슬라이스의 품질과 생존가능성을 입증하기 위해 우리는 과립 세포의 기본 전기 생리학적 및 형태학적 매개 변수를 기록했으며, TdTomato 라벨이 부착된 Parvalbumin-positive(PV+) 인터뉴런은 Pvalb-IRES-Cre의 덴테이트 자이러스에서; Ai9 형질전환 마우스(7-12주)는 표준 프로토콜로 얻은 동일한 영역의 관상 동맥 조각에서 기록된 것과 비교하였다.
적외선 차동 간섭 콘트라스트(IR-DIC) 현미경으로 육안 검사를 받으면 이미 트랜스버라와 관상 슬라이스 사이의 명확한 차이점을 발견했습니다. 관상 동맥 조각에서 주요 세포 층의 뉴런은 종종 거칠게 나타나고 강하게 대조된 윤곽을 표시하는 반면, 트랜스버 슬라이스의 뉴런은 대부분 매끄러운 표면과 가볍게 대조된 테두리를 보였으며, 이는 더 나은 세포 활력을나타냅니다(그림 2A). 관상 동맥 과 트랜스 버타클 슬라이스 사이의 세포 생존가능성에 대한 이러한 차이의 이유는 섬유 지대에 대하여 단면 평면의 방향에 있을 수 있습니다. 이들은 관상 섹션에서 병렬로 되지 않기 때문에 축축과 원더라이트가 절단됩니다. 이 가정에 따라 우리는 슬라이스 내에서 과립 세포 층과 힐루스의 표면 평면이 대차 슬라이스 (표면 평면의 단계 크기 : 41.40 ± 3.28 μm 대 25.60 ± 2.94 μm, 평균 ± SEM, 페어링되지 않은 t-test P = 0.023)보다 큰 조직(2.023)을 제안합니다. 즉, 패치 클램프 레코딩에 적합한 셀은 관상 슬라이스에 대한 과립 세포 층의 깊은 평면에서만 발견되며, 이는 패치 클램프 기록의 처리량을 감소시킬 수 있습니다. 실제로, 우리의 transversal 슬라이스에서 형성을 밀봉하는 평균 시간은 관상 슬라이스 (과립 세포: 12.64± 1.50 s, n=11 관상 동맥 대 8.40 ± 0.75 s, n=14 transversal 슬라이스, 평균 ± SEM, P= 0.0335 Mann-휘트니 시험보다 더 빨랐습니다. PV+ 인터뉴런: 31.11 ± 2.60s, n=9 대 22.00 ± 2.18, n=7 트랜스버 슬라이스, 평균 ± SEM, P= 0.0283 Mann-Whitney 테스트)(그림 2C). 세포 무결성 및 건강을 위한 대리인으로서 우리는 과립 세포 및 PV+ 인터뉴런의 휴식 막 전위(RMP)를 기록했습니다. 관상 대 관상 에서 과립 세포와 PV+ 인터뉴런 모두에서 훨씬 더 탈극화된 (과립 세포:-62.55 ± 3.54 mV, n=11 관로나 대.-71.06 ± 2.31 mV, n=14 대 반적 슬라이스, 평균 ± SEM; PV+ 인터뉴런: -52.75 ± 1.66 mV, 관상 동맥 대 n=7 ± 2.25 mV, n=6 의 트랜스버 슬라이스 평균 ± SEM, P= 0.0271 Mann-Whitney 테스트)(그림 2D). 이 데이터는 관상 동맥 슬라이스 준비 대 transversal에 있는 건강한 뉴런의 더 높은 수를 건의합니다. 실제로, 허용 가능한 RMP에 대한 컷오프(-55 mV용 과립 세포;-45 mV PV+ 인터뉴런)의 도입으로 관상에서 제외된 세포의 비율이 트랜스버슬라이스(39.67 ± 8.37%, n=3.00 ± 3.85%, n=4)보다 높은 비율로 나타났다. 더욱이, 기록된 과립 세포로부터뉴런 형태학의 재구성은 예상된 기회로 트랜스버슬라이스에서 과립 세포에 대한 완전한 축소수절을 회수하는 것이 훨씬 낫다는 것을나타냈다(도 3A,B). 또한, 지반자 슬라이스에서 PV+ 인터뉴런의 형태학적 재구성은 수지상척추(35)와같은 작은 세부사항의 시각화를 포함하는 광범위한 축산 및 수지상 식소의 묘사를 허용했다(도 3C).
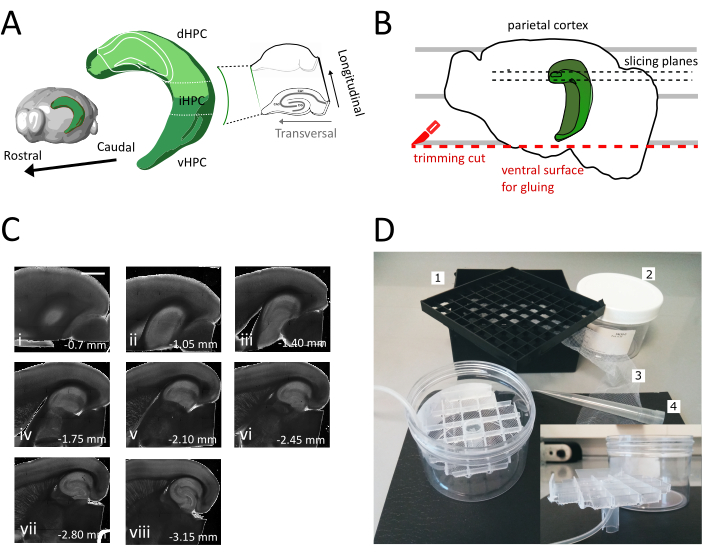
도 1: 등쪽 중간 해마로부터 슬라이스를 얻기 위한 단면 절차의 예시. (A)뇌의 공간 방향을 보여주는 해마 형성의 3차원 표현(뇌 익스플로러, 알렌 연구소에서 수정)37. 동일(2009)7에따르면 해마(dHPC, iHPC, vHPC)의 등산, 중급 및 복부 분열이 표시된다. 슬라이스 될 등간 중간 해마의 부분은 밝은 녹색으로 표시됩니다. 오른쪽의 시작에는 참조 축의 방향이 표시됩니다. (B)페트리 접시의 평행선과 정수리 피질의 정렬을 묘사한 뇌 반구의 만화. 빨간색 점선은 트리밍 컷(프로토콜의 점 3.9)을 수행하여 반구를 시편 홀더에 접착하기 위한 표면을 만드는 위치를 나타냅니다. 검은색 점선은 슬라이스가 수집되는 위치를 나타냅니다. (C)이 절차에 따라 얻어진 해마 슬라이스의 밝은 필드 이미지 시리즈. 피알 표면에서, 등쪽에서 복부까지: (i) 0.70 mm, (ii) 1.05 mm, (iii) 1.40 mm, (iv) 1.75 mm, (v) 2.10 mm, (vi) 2.45 mm (vii) 2.80 mm, (viii) 3.15 mm. 스케일 바 = 1mm.(D)저장 챔버의 사진 및 조립에 필요한 재료. 1. 81x 극저온 바이알 저장 상자에서 바이알 스페이서 그리드, 2. 실린드릭 플라스틱 상자. 3. 나일론 그물, 4. 파이펫 팁. 삽입하다. 격자 및 튜브 홀더의 측면 보기는 실린린드릭 상자에 삽입합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 트랜스버라클 슬라이스는 관상 슬라이스에 비해 향상된 슬라이스 생존력을 보여줍니다. (A)DIC-IR 현미경은 트랜스버및 관상 동맥 슬라이스에서 신경 소마타의 건강한 (검은 화살표) 및 건강에 해로운 (흰색 화살표) 예를 보여주는. Hil=hilus, gcl=과립 세포 층, ml= 분자 층. 스케일 바 = 50 μm.(b)두 단면 절차는 과립 세포 층과 힐루스의 표면 사이의 단계를 생성합니다(화살표 헤드로 표시). 단계의 높이는 조직 단절의 정도를 나타내며 관상 (n =5 트랜스버및 n = 5 관상 동맥 슬라이스, Mean±SEM, P = 0.0238 Mann-Whitney 테스트)보다 트랜스버라이체 섹션에서 현저히 낮습니다. (C)과립 세포에서 기가옴 씰 형성의 시간 (n=14 세포 대위, n=11 세포 관상 동맥; 평균±SEM, P= 0.0355, Mann-Whitney 테스트) 및 PV+ IN(대회체의 n=7 세포, 관상 슬라이스의 n=9 세포, 평균±SEM, P= 0.0283 Mann-Whitney 테스트) 슬라이스. (D)세포의 휴식 막 전위(RMP)는 패치 (각각, n = 14 및 n = 11 과립 세포) 평균±SEM, P=0.0455 Mann-Whitney 테스트. n=7 PV+ IN 및 n=10 PV+ INs, P= 0.0271 Mann-Whitney 테스트). (E)실험 세션 내에서 버려진 셀의 백분율(관상 슬라이스가 있는 n=3 세션, 대반슬라이스가 있는 n=4, Mean±SEM). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
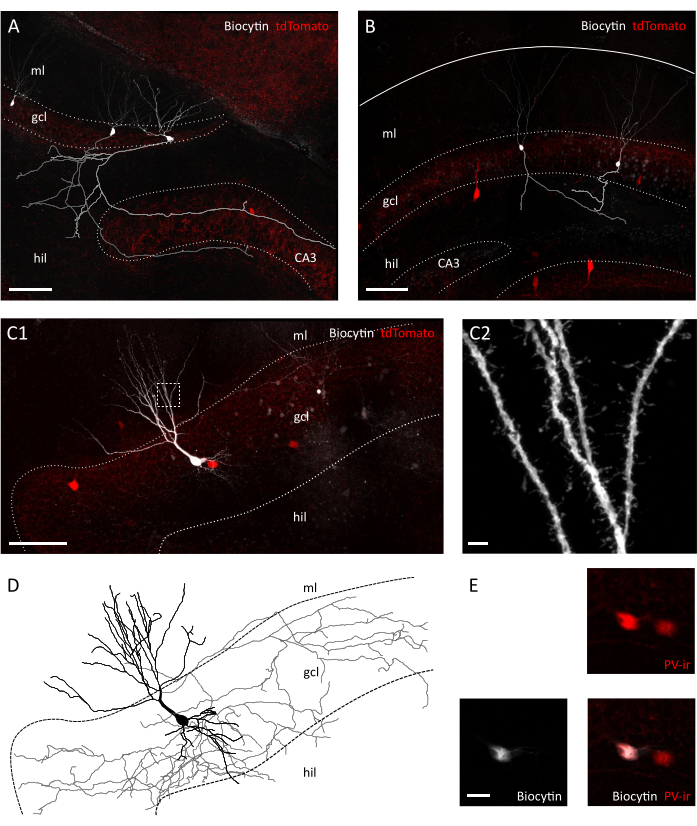
그림 3: 과립 세포및 인터뉴런의 형태학적 보존. 생물학적 세포가 채워진 과립 세포를 나타내는 공초점 이미지(A)및 Pvalb-IRES-Cre의 관상 슬라이스(B)에서; Ai9 형질전환 마우스. 각 축축은 회색과 밝은 회색으로 재구성되었습니다. 축 사 길이와 준비 사이의 복잡성의 차이에 유의하십시오. 스케일 바=100 μm.(C1)공초점 이미지는 생물시로 채워진 tdTomato 양성 인터뉴런을 나타낸다. Hil=hilus, gcl=과립 세포 층, ml= 분자 층. 스케일 바=50 μm.(C2)C1의 박스 면적배율, 수지상 척추를 나타낸다. 스케일 바=2 μm(D)C1에서 채워진 생시틴의 축축및 원점의 형태학적 재구성(회색, 소마 및 하원위검). (E)바이오시틴 및 파르살부민 면역 반응성(PVir)의 공동국화를 보여주는 C1에 묘사된 세포의 소마타를 클로즈업한다. 배율 막대=20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
등지해는 주로 행동 실험, 해부학 추적 및 지역 별 조작을 통해 공간 학습 및 탐색에 대한 역할에 대해 광범위하게 연구되었습니다. 이러한 기술과 슬라이스-전기 생리학적 문의를 결합하기 위해, 우리는 해마의 중간 복부 영역에 대한 변형 된 수평 슬라이스와 유사한 각도의 단면을 사용하는 프로토콜을 조립했지만, 등간 중간 영역에서 초기 조각을 얻기 위해 반전 된 슬라이스 순서를 사용합니다. 이 방법은 해마의 등쪽 영역을 슬라이스하고 수집하는 데 필요한 시간을 줄여 슬라이스 생존가능성을 향상시킵니다.
이 방법을 사용하여, 우리는 도 1C에도시된 바와 같이, 피알 표면에서 1.4mm-2.4 mm 사이의 등쪽 해마 영역의 반구 당 약 3개의 조각을 일상적으로 검색할 수 있다. 이 절차로 해마의 매우 중격극으로부터 트랜스버라클 슬라이스를 얻을 수는 없지만, 격막 극으로부터 반구당 약 2개의 추가 가능한 비트랜스베르사 슬라이스를 수집할 수있다(도 1C ii,iii). 해마의 중격 극이 주요 연구 초점인 경우, 특히 해마의 매우 중격극에서 트랜스버 슬라이스의 수집을 허용하는 다른 프로토콜은21,32에더 적합할 수 있다. 공간 탐색 및 학습에 대한 행동 실험은 완전히 발달된 뉴런 연결을 가진 성숙한 마우스에서 수행하는 것이 바람직하다. 따라서, 우리는 탄력있는 청소년 준비보다 스트레스에 더 민감한 성인 동물의 뇌 (3 개월 된 마우스에 대해 여기에 표시)에 응용 프로그램에 대한 우리의 슬라이스 절차를 최적화했습니다. 이를 위해 우리는 뇌가 추출과 산소 ACSF에 슬라이스의 배치 사이의 시간에 노출되는 저산소 스트레스를 감소시키는 몇 가지 전략을 결합했습니다. 보호 절삭 액은 NMDG 기반 ACSF25,27,28 낮은 Na + 및 Ca 2 + 하지만 높은 Mg2+ NMDA 수용 체의 활성화로 인해 발독 손상 및 세포 부종을 줄이기 위해. 또한 HEPES는 안정적인 버퍼링을 제공하며 아스코르바테 및 피루바테와 같은 화합물은 산화 스트레스를 줄입니다. 차갑고 산소화 된 보호 절단 솔루션과 트랜스 카심 관류는 뇌조직에 신진 대사 수요와 글루타민산 유발 흥분을 신속하고 균질적으로 감소시키기 위해 뇌를 공급하는 매우 조밀한 모세관 네트워크를 활용합니다. 그 후 참수 다음 거의 모든 단계는 전체 절차 동안 최소한의 신진 대사와 산소 부족을 유지하기 위해 냉각 및 산소 솔루션 내에서 수행됩니다. 슬라이스 중 뇌 손상을 줄이기 위한 다른 전략이 존재하며38도똑같이 유효할 수 있습니다. 우리의 준비의 품질을 보여주기 위해, 우리는 일반적으로 등대 해마에서 기록하는 데 사용되는 관상 슬라이스 준비와 비교합니다. 관상 슬라이스는 덴테이트 자이러스에서 좋은 패치 클램프 레코딩을 얻기 위해 사용될 수 있지만, 건강에 해로운 및 연결이 끊긴 뉴런의 수는 트랜스버라이 슬라이스보다 높습니다. 또한 축축및 수지상 식소의 무결성은 대차 슬라이스에 더 잘 보존됩니다. 실제로 해마의 세로 축으로 직교를 실행하는 과립 세포 축축(도3A)의무결성은 트랜스버슬 슬라이스 평면1의지표역할을 한다.
패치 된 뉴런의 충전을 위해, 우리는 3과 5 MΩ 사이의 전극 저항을 제안한다. 약 1 μm의 끝의 직경은 기록 중에 좋은 밀봉 저항을 달성하고 전극 회수 시 재밀봉할 수 있습니다. 가장 중요한 세부 사항은 피펫으로 소마 또는 핵의 부분의 흡입을 방지하는 것입니다. 이러한 이유로, 가능 하면 세포 내 용액에 알렉사 염료를 포함 하는 것이 좋습니다. 염료를 사용하면 기록 및 재 밀봉 중에 셀 모양을 모니터링 할 수 있습니다. 더욱이, 그것은 실패 한 충전재의 경우 면역 히스토레이션 시간을 절약 할 수있는 고정 후 패치 된 세포의 무결성을 평가 할 수 있습니다. 때문에 알렉사 염료는 긴 고정 시간으로 담금질, 우리는 가능한 경우 짧은 고정을 제안한다.
후속 면역 스테인링의 경우 슬라이스의 다시 단면이 필요하지 않은 프로토콜을 사용합니다. 고정 후 1주일 이내에 염색하는 것이 좋습니다. 슬라이스가 냉장고에 오래 남아 있는 경우 조직 분해 가능성이 높아지어집니다. 긴 저장 공간을 피할 수 없는 경우 PBS의 NaN3 농도를 0.05%로 늘리고 매주 새로 고치는 것이 좋습니다. 전체 슬라이스의 면역 염색은 1 차 및 이차 항체를 가진 잠복시간이 증가한다는 것을 의미합니다. 일반적으로, 바이오시틴을 드러내기 위해 4°C에서 하룻밤 잠복이 충분하지만, 다른 단백질에 대한 염색과 결합하면 전체 염색 절차가 훨씬 더 오래 지속될 수 있습니다. 투과성 차단 및 항체 배큐어는 개별적으로 최적화되어야 합니다. 일반적으로, 1 차적인 항체를 위해, 1일은 이차를 위해 충분할 수 있는 동안 2일 은 충분합니다. 배경의 증가를 피하기 위해 더 긴 항체 배양과 함께 세척 단계의 지속 시간을 늘리는 것이 좋습니다.
이 프로토콜에서 우리는 성조직의 신경 생존력을 보존하는 트랜스베르사 또는 거의 횡단 해마 슬라이스를 얻기 위한 슬라이스 방법과 패치 된 뉴런의 형태와 신경 화학적 정체성을 복구하는 실용적인 접근법을 제시했습니다. 이 방법은 해마의 중간 등쪽 부분에 초점을 맞춘 해부학 및 행동 연구와 전기 생리적 결과를 일치시키기 위해 쉽게 수행 될 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
커스틴 크로넨비터와 디디에 그레멜에게 기술 지원을 해 주셔서 감사합니다. 우리는 비디오 그래피, 비디오 편집에 대한 그래픽 소프트웨어와 마티아스 홉과 도움을 움베르토 모렐리 감사합니다. 우리의 실험실에서 작업은 도이치 포충스게마인샤프트 (DFG) FOR2143, SFB 1461 (프로젝트 ID 434434223) 및 GRK2154, 의학 연구 위원회 보조금 G1100546/2 및 킬 대학에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 1mL syringes Omnifix-F | Braun melsungen AG | 9161406V | |
| 24 multiwells | SARSTEDT | 8,33,922 | |
| 81x criogenic vial storage box | Fisherscientific | 15-350-107B | storage chamber |
| Alexa Hydrazide dye | Invitrogen | A10436 | |
| Big scissor | Fine science tool | 14010-15 | graefe forceps |
| Biocytin | IRIS biotech. | LS3510.0250 | |
| Borosilicate Glass capillaries | Science products | GB150TF-10 | storage chamber |
| Brush 5 | Leonhardy | 241 | Micro double spatula, L 150 mm, blade width 4 mm |
| Calcium chloride dihydrate | Roth | 5239.2 | aCSF solution |
| Carbon steel microtome blade | feather | C35 | |
| Chloridric acid | Roth | K025.1 | |
| Confocal microscope | Zeiss | LSM880 | with Airyscan |
| Cyanoacrylate glue | UHU | 509141 | |
| Cyanoacrylate glue, n-butyl-ester VetBond | 3M | ||
| EGTA | Roth | 3054.1 | |
| Fiji ImageJ | fiji.sc | ||
| Filter paper 113A | ROTILABO Roth | AP180.1 | |
| Fine tip tweezer | Dumont | 0245fo | |
| Glass becker (150 ml) | ROTILABO Roth | X690.1 | incubation chamber and dissection |
| Glass Petri dishes (10 cm dia.) | ROTILABO Roth | 0690.1 | |
| Glucose | Roth | X997.2 | aCSF solution |
| Heated water bath | Grant Instruments Ltd | SUB14 | |
| HEPES | Roth | 9105.4 | aCSF solution |
| Isofluoran | baxter | 5239.2 | Anesthetic |
| Large spatula | Roth | E286.1 | |
| Magnesium Sulfate heptahydrate | Roth | 8793.2 | aCSF solution |
| Mg-ATP | Sigma Aldrich | A9187 | |
| Microfil | World precision instruments | MF34G | |
| Na2-GTP | Sigma Aldrich | 51120 | |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF solution |
| Normal goat serum | Sigma Aldrich | 566380 | |
| Nylon mesh kit | Warner Instruments | 64-0198 | incubation chamber and storage chamber |
| Paraformaldeyde | Sigma Aldrich | P6148 | |
| Phosphate buffered saline 10X | Panbiotech | P04-53500 | |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | |
| Pipette puller | Sutter instrument | P-2000 | |
| Pipette tips | SARSTEDT | 7,07,62,211 | incubation chamber |
| Plastic box for syringe filters | SUPELCO | 54135-U | storage chamber |
| Potassium Chloride | Roth | 6781.3 | aCSF solution |
| Potassium Gluconate | Roth | P1847 | |
| Probenbecker becker (100 ml) | ROTILABO Roth | HT85.1 | incubation chamber |
| Rounded tip tweezers | Fine science tool | 11051-10 | |
| Sainless steel blade | Gillette | Vibratome | |
| Small scissor | Fine science tool | 14010-10 | mayo scissor straight |
| Sodium Ascorbate | Roth | 3149.2 | aCSF solution |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium Bicarbonate | Roth | 6885.1 | aCSF solution |
| Sodium Chloride | Roth | 3957.1 | aCSF solution |
| Sodium Hydroxide | Roth | K021.1 | |
| Sodium Phosphate monobasicdihydrat | Roth | K300.1 | aCSF solution |
| Sodium Pyruvate | Roth | 8793.2 | aCSF solution |
| Streptavidin conjiugated Alexa 488 | Invitogen | s11223 | |
| Thin spatula | Roth | E286.1 | Double spatula, L 150 mm, blade width 9 mm |
| Transfer pipette | Sarstedt | 861171 | |
| Triton x100 | Roth | 3051.1 | |
| Vibratome | Thermoscientific | Microm HM650V | |
| Filter device for ultrapure water | Merck-Millipore | Milli-Q IQ 7000 |
참고문헌
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65 (1), 7-19 (2010).
- David, A., Pierre, L. Hippocampal Neuroanatomy. The Hippocampus Book. , 37-114 (2006).
- Dong, H. W., Swanson, L. W., Chen, L., Fanselow, M. S., Toga, A. W. Genomic-anatomic evidence for distinct functional domains in hippocampal field CA1. Proceedings of the National Academy of Sciences of the United States of America. 106 (28), 11794-11799 (2009).
- Royer, S., Sirota, A., Patel, J., Buzsaki, G. Distinct representations and theta dynamics in dorsal and ventral hippocampus. Journal of Neuroscience. 30 (5), 1777-1787 (2010).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Foggetti, A., Baccini, G., Arnold, P., Schiffelholz, T., Wulff, P. Spiny and Non-spiny Parvalbumin-Positive Hippocampal Interneurons Show Different Plastic Properties. Cell Rep. 27 (13), 3725-3732 (2019).
- Cembrowski, M. S., Spruston, N. Heterogeneity within classical cell types is the rule: lessons from hippocampal pyramidal neurons. Nature Reviews Neuroscience. 20 (4), 193-204 (2019).
- Moser, M. B., Moser, E. I., Forrest, E., Andersen, P., Morris, R. G. Spatial learning with a minislab in the dorsal hippocampus. Proceedings of the National Academy of Sciences of the United States of America. 92 (21), 9697-9701 (1995).
- Pothuizen, H. H., Zhang, W. N., Jongen-Relo, A. L., Feldon, J., Yee, B. K. Dissociation of function between the dorsal and the ventral hippocampus in spatial learning abilities of the rat: a within-subject, within-task comparison of reference and working spatial memory. European Journal of Neuroscience. 19 (3), 705-712 (2004).
- Fredes, F., et al. Ventro-dorsal Hippocampal Pathway Gates Novelty-Induced Contextual Memory Formation. Current Biology. 31 (1), 25-38 (2021).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Andersen, P. Long-lasting facilitation of synaptic transmission. Ciba Foundation Symposium. (58), 87-108 (1977).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. Journal of Neurophysiology. 67 (5), 1346-1358 (1992).
- Walther, H., Lambert, J. D., Jones, R. S., Heinemann, U., Hamon, B. Epileptiform activity in combined slices of the hippocampus, subiculum and entorhinal cortex during perfusion with low magnesium medium. Neurosci Lett. 69 (2), 156-161 (1986).
- Rafiq, A., DeLorenzo, R. J., Coulter, D. A. Generation and propagation of epileptiform discharges in a combined entorhinal cortex/hippocampal slice. Journal of Neurophysiology. 70 (5), 1962-1974 (1993).
- Leutgeb, J. K., Frey, J. U., Behnisch, T. LTP in cultured hippocampal-entorhinal cortex slices from young adult (P25-30) rats. Journal of Neuroscience Methods. 130 (1), 19-32 (2003).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature Protocols. 1 (3), 1235-1247 (2006).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording Synaptic Plasticity in Acute Hippocampal Slices Maintained in a Small-volume Recycling-, Perfusion-, and Submersion-type Chamber System. Journal of Visualized Experiments. (131), e55936 (2018).
- Dougherty, K. A., Islam, T., Johnston, D. Intrinsic excitability of CA1 pyramidal neurones from the rat dorsal and ventral hippocampus. Journal of Physiology. 590 (22), 5707-5722 (2012).
- Tidball, P., et al. Differential ability of the dorsal and ventral rat hippocampus to exhibit group I metabotropic glutamate receptor-dependent synaptic and intrinsic plasticity. Brain and Neuroscience Advances. 1 (1), (2017).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159 (2005).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), e53825 (2018).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Archives. 414 (5), 600-612 (1989).
- Djurisic, M. Minimizing Hypoxia in Hippocampal Slices from Adult and Aging Mice. Journal of Visualized Experiments. (161), e61377 (2020).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. P. Acute Brain Slice Methods for Adult and Aging Animals: Application of Targeted Patch Clamp Analysis and Optogenetics. Patch-Clamp Methods and Protocols, 2nd Edition. 1183, 221-242 (2014).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments. (91), e51706 (2014).
- Norenberg, A., Hu, H., Vida, I., Bartos, M., Jonas, P. Distinct nonuniform cable properties optimize rapid and efficient activation of fast-spiking GABAergic interneurons. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 894-899 (2010).
- Swietek, B., Gupta, A., Proddutur, A., Santhakumar, V. Immunostaining of Biocytin-filled and Processed Sections for Neurochemical Markers. Journal of Visualized Experiments. (118), e54880 (2016).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nature Protocols. 1 (4), 1977-1986 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Longair, M. H., Baker, D. A., Armstrong, J. D. Simple Neurite Tracer: open source software for reconstruction, visualization and analysis of neuronal processes. Bioinformatics. 27 (17), 2453-2454 (2011).
- Murray, A. J., et al. Parvalbumin-positive CA1 interneurons are required for spatial working but not for reference memory. Nature Neuroscience. 14 (3), 297-299 (2011).
- Otis, T. S., Staley, K. J., Mody, I. Perpetual inhibitory activity in mammalian brain slices generated by spontaneous GABA release. Brain Research. 545 (1-2), 142-150 (1991).
- Varela, C., Llano, D. A., Theyel, B. B. An introduction to in vitro slice approaches for the study of neuronal circuitry. Neuromethods. 67, 103-125 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유