Method Article
Подготовка острых ломтиков из спинного гиппокампа для записи целых клеток и нейрональной реконструкции в Дентате Извилина взрослых мышей
В этой статье
Резюме
Представляем протокол по подготовке острых ломтиков спинного и промежуточного гиппокампа мышей. Мы сравниваем этот поперечный препарат с корональной нарезкой с точки зрения качества записей и сохранения морфологических особенностей записанных нейронов.
Аннотация
Хотя общая архитектура гиппокампа схожа по продольной оси, недавние исследования выявили значительные различия в молекулярных, анатомических и функциональных критериях, предполагающих разделение на различные подзамыки вдоль его ростро-каудальной степени. Благодаря дифференциальной связи и функции проводится самое фундаментальное различие между спинным и желудочковый гиппокамп, которые преимущественно участвуют в пространственной и эмоциональной обработке, соответственно. Соответственно, работа in vivo относительно формирования пространственной памяти была сосредоточена на спинной гиппокампе.
В отличие от этого, электрофизионые записи in vitro были преимущественно выполнены на промежуточно-вентальный гиппокамп, в значительной степени мотивированы такими факторами, как жизнеспособность ломтика и целостность цепи. Для того, чтобы обеспечить прямую корреляцию данных in vivo о пространственной обработке данными in vitro, мы адаптировали предыдущие методы сечения для получения высоко жизнеспособных поперечных срезов мозга из спинно-промежуточного гиппокампа для длительных записей основных клеток и интернейронов в извилины дентата. Поскольку пространственное поведение регулярно анализируется у взрослых мышей, мы объединили эту поперечную процедуру нарезки с использованием защитных решений для повышения жизнеспособности тканей мозга у зрелых животных. Мы используем этот подход для мышей около 3 месяцев. Метод предлагает хорошую альтернативу корональному препарату, который часто используется для исследований in vitro на спинной гиппокампе. Мы сравниваем эти два препарата с точки зрения качества записей и сохранения морфологических особенностей записанных нейронов.
Введение
Гиппокамп был широко изучен за его ключевую роль в различных аспектах обучения и памяти, пространственной навигации, а также эмоции. Основной схемой гиппокампа, обычно называемой «трисинаптической цепью», является ламеллярная сеть в поперечной оси, которая в значительной степени сохраняется вдольпродольной оси 1. Вклад гиппокампа в различные когнитивные и эмоциональные поведения, вероятно, возникает из различных связей, что эта основная схема делает вдоль спинной оси с несколькими другимиобластями мозга 2,3. Помимо афферентных и эфферентных подключения, однако, все большее число исследований указывают на дальнейшие различия вдоль септо-временной оси гиппокампа. Такие различия касаются внутренней архитектуры и подключения, а также различий в моделях экспрессии генови нейрональной морфологии 4,5,6,7,8.
Учитывая наличие таких различий в основных схемах, разумно выбрать конкретные гиппокампа подзарядки, которые будут исследованы в соответствии с вопросами, которые рассматриваются. Если, например, вопрос касается нейронных механизмов, участвующих в пространственной обработке, спинной, а не брюшнойгиппокамппредставляет интерес, хотя два не действуют независимо in vivo из-за внутригиппокампа продольной связи9,10,11. В этом направлении необходимо учитывать не только различия вдоль продольной оси, но и заботиться о сохранении как можно более локальных и дальних схем. Для сохранения волоконных путей и подключения угол, под которым мозг будет секционные имеет важное значение.
Первый метод сообщил в литературе, чтобы включить trysinaptic цепи сначала изолированы гиппокампа из мозга, а затем сделал поперечные ломтики (перпендикулярно продольных осей) с помощьюткани измельчитель 12 и вибром13. Позже физиологи предпочитали получать ломтики от всего блока мозга, чтобы сохранить также соседние структуры мозга, связанные с гиппокампом. Для этих блоков подготовки, различные углы сечения в отношении гиппокампа были разработаны, такие как короналсрез подготовки 14 или горизонтальной подготовки ломтик называется HEC ломтик для сохранения гиппокампа-энторинальной корысоединения 15,16,17.
В последней подготовке теменной доли разрезают с углом 0 "или 12" по отношению к горизонтальной плоскости вдоль розтро-каудальной оси, чтобы сформировать основание блока. Фрагменты затем собираются, начиная с брюшной поверхности мозга, что позволяет в основном урожай промежуточного брюшного гиппокампа области. Этот метод стал самым популярным выбором для физиологических исследований и может быть надежно выполнен после несколькихопубликованных протоколов 18,19,20.
Однако, если интерес исследования касается конкретных аспектов пространственного обучения, спинной гиппокамп может быть более подходящим регионом исследования, и было бы полезно найти нарезки процедуры аналогичного качества для этого гиппокампа области. Немногие протоколы, которые сосредоточены на самом ростральном полюсе, были разработаны, которые могут удовлетворить этот спрос 21,22.
В этом протоколе, вместо этого, мы описываем подход к получению жизнеспособных поперечных ломтиков от спинно-промежуточного гиппокампа, который использует угол сечения, ранееописанный для горизонтальныхпрепаратов 18 ,19 ( Рисунок 1Aи B). Мы демонстрируем качество этого протокола, сравнивая электрофизиологические записи и морфологические реконструкции в этом препарате с теми, которые получены в корональных ломтиках. Этот протокол особенно подходит для сочетания с анатомическими и поведенческими экспериментами у взрослых мышей (три месяца в нашем случае).
протокол
Все процедуры с участием экспериментальных животных были в соответствии с немецким Законом о защите животных и одобрены комитетом по этике университета Киля. Parvalbumin-Cre (Pvalb-IRES-Cre)мыши 23 (Джексон лаборатории, Хранилище номер 008069) были сохранены в качестве гетерозиготных колоний или пересекли с Ai9 Creрепортер мышей 24 (Джексон лаборатории, хранилище номер 007909). Были использованы самки и мыши мужского пола между P40-P90. Мыши были сохранены в 12-ч светло-темный цикл в стандартных условиях группового жилья и были обеспечены продовольствием и водой объявление libitum.
1. Подготовка решений
ПРИМЕЧАНИЕ: Подготовьте свежие растворы для каждого экспериментального дня с использованием ультрачистой воды (UPW) (резисторивность при 25 градусов по Цельсию 18,2 МЗсм). Растворы могут храниться при 4 градусах Цельсия в течение максимум одного дня. Магний и кальций растворы могут храниться отдельно, как 1 М фондовых решений. Все рабочие решения должны быть насыщены карбогеном (95% O2:5% CO 2 ) дляоптимальнойоксигенации и обслуживания рН до и во время использования.
- Подготовь решение для резки (500 мл на мышь) (в mM): 92 NMDG, 2.5 KCl, 1.252PO4, 30 NaHCO3, 20 HEPES, 25 глюкозы, 5 Na-ascorbate, 4 Na-pyruvate, 0.5 CaCl2'2H2O, и 10 MgSO4 7H2O. Титрат рН 7,4 под химическим капотом с 4-5 мл 16% соляной кислоты, прежде чем добавить дивалентные катионы. Это позволит избежать осадков MgSO4.
ПРИМЕЧАНИЕ: KCl и2PO4 могут храниться в качестве 10x решений при 4 градусах Цельсия. Мы делаем две отдельные партии режущей раствора. Один за день до записи (хранится в морозильной камере в течение ночи для производства дробленого льда) и один в день записи. - Подготовка решения для хранения (250 мл на мышь) (в mM): 92 NaCl, 2.5 KCl, 1.252PO4, 30 NaHCO3, 20 HEPES, 25 глюкозы, 5 Na-ascorbate, 4 Na-pyruvate, 2 CaCl2No2H2O, и 2 MgSO4 7H2O. Titrate к pH 7.3-7.4 с 1 N NaOH.
ПРИМЕЧАНИЕ: NaCl, KCl и2PO4 могут быть снабжены в качестве 10x решения при 4 градусов по Цельсию. - Подготовка ACSF для записи (в mM): 122 NaCl, 2,5 KCl, 1.252PO4, 24 NaHCO3, 12,5 глюкозы, 2 CaCl2 2H2O, и 2 MgSO4 No7H2O, 2 Na-ascorbate, 4 Na-pyruvate. Титрат рН до 7,3-7,4 с 1 N NaOH.
ПРИМЕЧАНИЕ: NaCl, KCl и2PO4 могут быть объединены в 10x фондовый раствор при 4 градусов по Цельсию.
2. Подготовка скамейки для нарезки
- Приготовьте на льду стакан (150 мл) и две стеклянные чашки Петри (диаметр 10 см) и заполните их свежим раствором для резки. Держите раствор кислородом с карбогеном восходящей устройство (перфорированная трубка или воздушный камень подключен к карбогенной системы).
ПРИМЕЧАНИЕ: Раствор в стакане будет использоваться для перфузии, в то время как чашки Петри будут использоваться во время процедуры резки. - Оборудуйте хирургическое покрытие лезвием из нержавеющей стали, закругленным кончиком пинцета, мелким кончиком пинцета, большими ножницами, большим металлическим шпателем, тонким металлическим шпателем, кистью, пластиной вибромы и клеем цианоакрилата или менее токсичным клеем n-butyl-ester cyanoacrylate. Immerge лезвие из нержавеющей стали и кусок фильтровальной бумаги в одном из стеклянных чашек Петри на льду. Этот Петри будет использоваться для разреза мозга. Нарисуйте три параллельные линии на дно пластиковой чашки Петри и распоимить эту тарелку близко к хирургическим инструментам.
- Подготовь настройку для транскардиальной перфузии в соответствии с опубликованнымипротоколами 25.
- Подготовь виброму, накренив новое лезвие на держатель лезвия и установите параметры для резки (угол лезвия из горизонтальной плоскости 17 ", амплитуля колебаний лезвия 1,5 мм, скорость движения лезвия вперед около 2 мммин -1, частота колебаний 90 Гц, толщина секции 350 мкм). Заполните вибромный лоток ледяным раствором для резки и держите его под постоянной оксигенацией.
ПРИМЕЧАНИЕ: Мы добавляем дробленый лед, сделанный из первой партии раствора для резки, в охлажденный свежий раствор для резки, чтобы поддерживать температуру. Обратите внимание, чтобы держать лед от лезвия во время нарезки. - Подготовь инкубационный камеру, наполненную режущей раствором при постоянной оксигенации. Поместите камеру в предварительно разогретую водяную баню (35 градусов по Цельсию).
ПРИМЕЧАНИЕ: Пример инкубационой камеры можно найти в Эдвардс и Коннерт (1992)26. - Подготовьте камеру хранения ломтика заполненную с разрешением хранения и держите ее на комнатной температуре и под постоянн оксигенацией. В случае, если ткань выражает флуоресцентный белок или светоактивный опсин, рекомендуется держать камеру в темноте, например, внутри коробки.
ПРИМЕЧАНИЕ: камера хранения с несколькими независимыми скважинами полезна для различения уровня ломтиков вдоль спинной оси Гиппокампа. Индивидуальная камера может быть построена(рисунок 1D). Возьмите кусок флакона spacer сетки из 81x криогенных флакон хранения коробки и клей дно на нейлоновой сети. Вставьте верхнюю треть пластикового наконечника пипетки 5mL в центр этой сетки, так что он торчит около 3 см в нижней части. Этот пластиковый наконечник служит стендом сетки, а затем удерживает воздушные трубки для оксигенации. Вставьте сетку с ее стендом в цилиндрическую пластиковую коробку (например, упаковку шприц-фильтров), чтобы она не кипячалась или колебалась. В этом резервуаре будет храниться 250 мл раствора для хранения.
3. Приготовление ломтиков гиппокампа
- Обезболивать мышь в коробочковой камере с помощью изофлюрана (около 0,5 мл) под капотом. Оставьте мышь отдыхать до тех пор, пока дыхание не будет медленным и регулярным (около 2-3 минут). Тест на отсутствие болевые реакции с щипать ногой.
- Выполните транскардиальное перфузии с использованием 25 мл газированного раствора резки из стакана на льду послеопубликованных протоколов 25,27. Этот шаг рекомендуется быстро охладить мозг, чтобы быстро замедлить метаболизм нейронов.
- Обезглавите животное с помощью больших ножниц и поместите голову в охлажденую чашку Петри на льду, содержащем режущую раствор.
- Откройте кожу мелкими ножницами, чтобы разоблачить череп. Сделайте небольшие боковые разрезы в основание черепа по обе стороны от foramen magnum. Затем вырезать вдоль sagittal шва, начиная с foramen magnum до достижения насо-фронтальный шов над обонятельной лампы. Поднимите ножницы во время сагиттального разреза, чтобы избежать повреждения ткани головного мозга.
ПРИМЕЧАНИЕ: Сохранение головы погруженной в раствор резки помогает очистить его от крови и держит температуру вниз. - Используйте закругленный кончик пинцета, чтобы подтянуть теменные кости, чтобы разоблачить мозг. Обратите внимание, чтобы достать и удалить meninges тоже. Если оставить, они могут повредить мозг во время извлечения.
- Используйте небольшой шпатель, чтобы аккуратно вычерпыть мозг во вторую чашку Петри.
- Разрежьте мозг пополам вдоль продольной трещины с помощью предварительно охлажденного лезвия.
- Используйте большой шпатель, чтобы поднять одно полушарие из режущей раствора и на пластиковую чашку Петри. С полушария, лежащего на медиальной поверхности, выровнять теменной коры с одной из параллельных линий, чтобы иметь ссылку на второй разрез, как показано на рисунке 1B.
- Выполните второй разрез в брюшной части полушария позиционирования лезвия параллельно линиям для получения поверхности, которая позже используется для склеивания мозга на держатель образца (см. следующий шаг), как показано на рисунке 1B. Верните полушарие в кислородный раствор стеклянной чашки Петри и выполните ту же процедуру на втором полушарии.
- Клей полушарий со свежесрезанной брюшной стороны на виброма-образец держатель с помощью клея. Положите несколько капель режущей раствора на полушария, чтобы затвердеть клей и переместить держатель образца в вибромный лоток. Таким образом, нарезка будет проходить от спинного до брюшного гиппокампа.
- Удалите начальные один или два не поперечных среза(рисунок 1C,ii-iii) до техпор,пока область интереса не станет видимой, а затем начните собирать ломтики.
ПРИМЕЧАНИЕ: Не поперечные, но полезные, здоровые ломтики могут быть получены из спинного гиппокампа в начале процедурынарезки (рисунок 1C,ii-iii). Сбор каждого ломтика требует около 3-4 мин. Начав резку из спинного вместо брюшного гиппокампа, мы экономим около 10 минут, что повышает жизнеспособность спинных ломтиков. - С пластиковой пипеткой (отрежьте узкий конец кончика) перенесите каждый кусочек в инкубационую камеру (содержащую раствор резки при 35 градусов по Цельсию) и дайте ему отдохнуть в течение 12 минут. Краткий период восстановления в теплом растворе резки значительно уменьшает первоначальный отек нейронов, как сообщается в Ting et al. (2014)28. Затем с помощью кисти перенесите кусочек в камеру хранения (содержащую решение для хранения на RT) и дайте ему отдохнуть до начала эксперимента.
4. Запись целых клеток и биоцитин заполнения
ПРИМЕЧАНИЕ: Описание цельноклеточной записи патч-зажима сводится здесь только к ключевым шагам, которые помогают получить хорошую биоцитин заполнения и, как правило, применимы к нейронам в ACSF. Для получения подробной информации о процедурах электрофизиологических записей, несколько других протоколовможно проконсультироваться 29,30.
- Выберите соответствующее внутриклеточное решение в соответствии с параметрами, которые должны быть записаны. Например, для текущих измерений зажима можно использовать раствор на основе глюконата калия (в mM): 135 K-Глюконат, 3 KCl, 10 HEPES, 0.2 EGTA, 10 фосфокреатин-Na2, 4 MgATP, 0.3 Na2-GTP. Отрегулируйте рН до 7,3 с 1 M KOH. Осмолальность должна быть около 285-290 мосмол/кг после добавления биоцитина 3-5 мг/мл.
ПРИМЕЧАНИЕ: Для мониторинга формы нейрона во время записи, 0,3-0,5 МКЛ / мл 1 мМ Alexa Fluor Hydrazide могут быть добавлены к внутриклеточному раствору. В этом случае, помните для биоцитина откровение, чтобы соответствовать цвету красителя Alexa с флуоресцентным зондом в сочетании со стрептавидином. - Подготовка патч-зажим электроды диаметром ≤1 мкм и 3-5 МЗ сопротивление от толстостенных борозиликат капилляров.
- Запустите перфузионную систему установки патч-зажима со скоростью 2,5-3 мл/мин на RT или 35-37 градусов по Цельсию и закрейте ломтик в камере U-образным якорем.
- Определите область мозга, представляющие интерес, и выберите здоровый нейрон с сомой по крайней мере 30-50 мкм ниже поверхности ломтика.
ПРИМЕЧАНИЕ: Сома здорового нейрона имеет гладкую поверхность, а границы мембраны слегка контрастируют. Сома нездорового нейрона кажется сжатой и сильно контрастной или опухшей и полупрозрачной. - Загрузите стеклянную пипетку внутриклеточным раствором до тех пор, пока кончик электрода AgCl не будет покрыт. Переместите пипетку в раствор камеры записи, применяя свето-положительное давление, чтобы очистить кончик стеклянного электрода.
ПРИМЕЧАНИЕ: Если раствор содержит краситель Alexa, давление можно контролировать визуально, регулируя количество флуоресцентного раствора, выпущенного из кончика. Минимальное давление позволит избежать окрашивания тканей вокруг клетки. - Подойди к клетке под наклонным углом и установите контакт в пределах первой трети поверхности сомы при формировании гига-печати. Отпустите давление, медленно двигайтесь удерживая потенциал до 65 мВ и нанесите нежный всасывание через рот, чтобы облегчить образование гига-уплотнения.
- Чтобы установить конфигурацию цельных клеток, нанесите сильный и короткий всасывание, чтобы сломать мембрану. Откажитесь от записи, если нейрон имеет мембранный потенциал, более деполяризованный, чем-50 мВ, если ток холдинга увеличивается выше 100 pA или если сопротивление доступа увеличивается за 30 МЗ.
- После записи (для достаточного заполнения сомата и дендритов рекомендуется не менее 15 мин; для заполнения сложных аксонов до одного часаможет потребоваться 31)аккуратно удалите электрод. С этой целью установите потенциал холдинга до 0 мВ и попытайтесь вновь сформировать гига-печать, медленно убирая пипетку в противоположном от подхода направлении, например, чтобы получить внешнюю конфигурацию патча.
ПРИМЕЧАНИЕ: Наличие красителя Alexa во внутриклеточных растворах помогает визуально управляемому удалению пипетки с поверхности нейронов. Если ядро клетки не соединяется с кончиком пипетки, быстрый метод реформирования уплотнения вытаскивает пипетку из ткани по диагонали и вверх на высокой скорости. Если ядро или часть мембраны находится в пределах кончика, существует опасность разрушения плазменной мембраны. В этом случае может помочь небольшое положительное применение давления и боковое движение. - Обратите внимание на положение ячейки и ориентацию ломтика. После фиксации точную ориентацию ломтика и целостность заполненной клетки можно проверить под флуоресцентным микроскопом.
5. Иммуностиминг, приобретение изображений и морфологическая реконструкция
- После записи, передача ломтиков в 24-хорошо пластины, чтобы исправить его в параформальдегид (PFA) 4% в 0,1 М фосфат-буферный солевой раствор (PBS). Инкубация в течение 60 мин на RT или на ночь при 4 градусов по Цельсию, в соответствии с чувствительностью основных антител, используемых. Кусочки могут храниться в 0,1 М PBS и 0,02% NaN3.
ВНИМАНИЕ: PFA является токсичным. Используйте под капотом. - Выполните иммуностимы и биоцитин откровение в течение одной недели после записи в соответствии сустановленными протоколами 32,33.
ПРИМЕЧАНИЕ: Мы используем процедуру, которая позволяет избежать повторного сечения ломтика, чтобы сохранить целостность дендритных и аксональных процессов. Тем не менее, эта процедура требует более длительного инкубации раз, как антитела должны проникать в ткани. Мы предлагаем проверить время оптимального проникновения антител в ткани перед выполнением эксперимента. - Приобретайте изображения с помощью конфокального микроскопа с функцией сканирования и сканирования плитки.
- Выполните морфологическую реконструкцию с помощью изображения ФиджиJ34.
ПРИМЕЧАНИЕ: Несколько форматов файлов изображений могут быть импортированы в программу с помощью плагина Bio-format. Мы рекомендуем использовать плагин Simple Neurite Tracer (STN)35 для реконструкции дендритов и аксона. Простой и ясный учебник доступен на https://imagej.net/SNT и http://snyderlab.com/2016/05/25/tracing-neurons-using-fiji-imagej/. Файл, содержащий данные отслеживания (.traces), если сохранены не сжаты, может быть преобразован в текстовый файл и открыт с Matlab или другим программным обеспечением для обработки текстовых данных.
Результаты
В этом протоколе мы описываем, как подготовить острые ломтики гиппокампа из спинной-промежуточной части гиппокампа(рисунок 1A). Протокол особенно подходит для экспериментов, которые исследуют механизмы, участвующие в пространственном обучении и могут быть объединены с поведенческой работы или вирусной маркировки или манипуляции стратегии в спиннойгиппокамп 35. Применяя описанную здесь процедуру секции к животным, введенным с cre-зависимым GFP, выражают адено-ассоциированный вирус (AAV-FLEX-GFP) в спинной гиппокамп мышей Pvalb-IRES-Cre в различных координатах Bregma AP-1.94 мм, ML ± 0,5-2 мм, глубина-1,25-2,25 мм для целевой различных областяхгиппокампа формирования 36 мы смогли получить по крайней мере три поперечных ломтиков, содержащих зараженных регионов(рисунок 1A светло-зеленая окраска на 3D-модели гиппокампа). Кроме того, несколько не поперечных, но здоровых ломтиков могут быть получены из более ростральных частей спинного гиппокампа(рисунок 1C).
Чтобы продемонстрировать качество и жизнеспособность наших ломтиков, мы зафиксировали основные электрофизиологические и морфологические параметры гранулированных клеток и интернейроны с маркировкой tdTomato Parvalbumin-positive (PV) в дентатной извилине Pvalb-IRES-Cre; Ай9 трансгенных мышей (7-12 недель) и сравнил их с записями из корональных ломтиков той же области, полученных со стандартным протоколом.
При визуальном осмотре под инфракрасным дифференциально-интерференционным контрастом (IR-DIC) микроскопом мы уже заметили явные различия между поперечной и корональной ломтиками. В то время как нейроны основного слоя клеток в корональных ломтиках часто казались грубыми и отображали сильно контрастные очертания, нейроны в поперечном срезе в основном показывали гладкие поверхности и только слегка контрастные границы, что свидетельствует о лучшей клеточнойжизнеспособности (рисунок 2A). Причина этих различий в жизнеспособности клеток между корональными и поперечными ломтиками может лежать в ориентации секционной плоскости по отношению к волокнам. Поскольку они не параллельны в корональных секциях, аксоны и дендриты будут разорваны. В соответствии с этим предположением, мы обнаружили, что в пределах ломтиков поверхностные плоскости слоя гранулы клеток и hilus показали большую разрывность в короне, чем поперечный срез (размер шага в поверхностных плоскостях: 41,40 ± 3,28 мкм против 25,60 ± 2,94 мкм, Среднее ± SEM, Неспаренные t-test P 0.023), предлагая большую степень отключения ткани в корональной срезе(рисунок 2B). Это означает, что подходящие клетки для записи патч-зажима будут найдены только в более глубоких плоскостях слоя гранулы клеток для корональных ломтиков, что, в свою очередь, может уменьшить пропускную способность записей патч-зажима. Действительно, среднее время для уплотнения образования в нашем поперечном ломтике было более быстрым, чем для корональных ломтиков (гранулевых клеток: 12,64± 1,50 с, n-11 в корональных против 8,40 ± 0,75 с, n-14 в поперечных ломтиках, Средний ± SEM, ПЗ 0,0335 Манн-Уитни тест; Интернейроны ПВЗ: 31,11 ± 2,60 с, n-9 в корональных против 22,00 ± 2,18, n-7 в поперечных ломтиках, средний ± SEM, ПЗ 0,0283 Манн-Уитни тест) (Рисунок 2C). В качестве прокси для целостности клеток и здоровья мы затем записали потенциалы покоя мембраны (RMP) гранул клеток и ПВЗ интернейронов, которые были значительно более деполяризованы как в грануле клеток и ПВЗ интернейроны в коронал против. поперечные ломтики (гранулевые клетки:-62.55 ± 3.54 mV, n'11 в корональных против-71.06 ± 2.31 mV, n'14 в поперечных ломтиках, Средний ± SEM, P'0.0455 Mann-Whitney test; Интернейроны ПВЗ:-52.75 ± 1,66 мВ, n-7 в корональных против-59,36 ± 2,25 мВ, n-6 в поперечных срезах Средний ± SEM,, ПЗ 0,0271 Манн-Уитни тест) (Рисунок 2D). Эти данные свидетельствуют о большем количестве здоровых нейронов в поперечном против коронального среза подготовки. Действительно, введение отрезка для приемлемого RMP (-55 мВ для гранульных клеток;-45 мВ для интернейронов ПВЗ) привело к более высокому проценту исключенных клеток в коронале, чем в поперечных срезах (39,67 ± 8,37%, n'3 экспериментальных сессий против. 23.00 ± 3.85%, n'4 экспериментальных сессий) (Рисунок 2E). Кроме того, реконструкция нейрональной морфологии из записанных гранул клеток показали, что, как и ожидалось, шансы были гораздо лучше, чтобы получить полную аксональной беседки для гранул клеток в поперечном срезе(рисунок 3A,B). Кроме того, морфологическая реконструкция интернейронов ПВЗ в поперечных срезах позволила изобразить обширные аксональные и дендритные беседки, включая визуализацию мелких деталей, таких как дендритные шипы35(рисунок 3C).
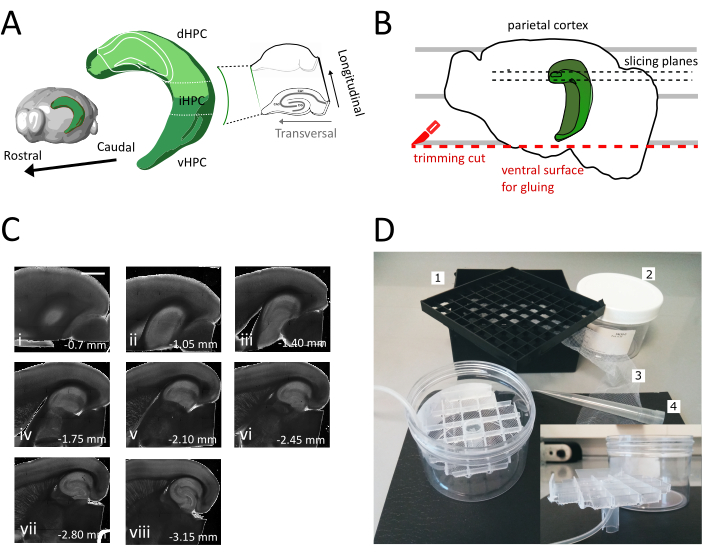
Рисунок 1: Иллюстрация процедуры секционирования для получения ломтиков спинно-промежуточного гиппокампа.(A)Трехмерное представление образования гиппокампа, показывающее его пространственную ориентацию в головном мозге (изменено из Brain Explorer, Институт Аллена)37. Дорсальные, промежуточные и брюшной отделы гиппокампа (dHPC, iHPC, vHPC) указаны, в соответствии с Dong et al. (2009)7. Часть спинного-промежуточного гиппокампа, которая будет нарезана, показана светло-зеленым цветом. Вставка справа показывает ориентацию эталонных осей. (B)Мультфильм полушария мозга, изображающий выравнивание теменной коры с параллельными линиями на чашке Петри. Красная пунктирная линия указывает, где выполнить обрезку разреза (точка 3.9 в протоколе), чтобы создать поверхность для склеивания полушария на держатель образца. Черные пунктирные линии указывают, где собираются ломтики. (C) Яркие поля изображения серии гиппокампа ломтики, полученные после этой процедуры. От поверхности пиала, спинной до брюшной: i) 0,70 мм, (ii) 1,05 мм, (iii) 1,40 мм, (iv) 1,75 мм, (v) 2,10 мм, (vi) 2,45 мм (vii) 2,80 мм, (viii) 3,15 мм. Масштабная планка 1 мм.(D)Фото камеры хранения и материала, необходимого для его сборки. 1. Vial spacer сетки из 81x криогенных флакон хранения коробки, 2. Цилиндрическая пластиковая коробка. 3. Нейлоновая сетка, 4. Пипетт чаевые. вкладка. Боковой вид сетки и трубки-держателя для вставки в цилиндрическую коробку. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Поперечный срез показывает повышенную жизнеспособность ломтика по сравнению с ломтиком коронала. (A) микрографы DIC-IR, показывающие здоровые (черные стрелки) и нездоровые (белые стрелки) примеры нейрональной сомата в поперечных и корональных ломтиках. Хилехилус, слой клеток гклю гранул, молекулярный слой мл. Шкала бар No 50 мкм. (B) Обе процедуры секционирования производят шаг между поверхностью слоя гранулы ячейки и хилус (указывается стрелками головки). Высота шага свидетельствует о степени отключения тканей и значительно ниже в поперечных секциях, чем в корональных (n'5 поперечных и n'5 корональных ломтиков, средний±SEM, P±0.0238 Манн-Уитни тест). (C)Время формирования гига-ом уплотнения в гранулированных клетках (n-14 клеток в поперечных, n'11 клеток коронала; Средние±SEM, ПЗ 0,0355, Манн-Уитни тест) и ПВЗ INs (n'7 клеток в поперечных, n'9 клеток в корональных ломтиков, средний±SEM, P 0,0283 Манн-Уитни тест) ломтиками. (D) Потенциал мембраны отдыха (RMP) клеток, исправленных (соответственно, n' 14 и n'11 гранул. Средний±SEM, тест Пз 0,0455 Манн-Уитни. N-7 PV- INs и n'10 PV- INs, тест 0,0271 Манн-Уитни). (E)Процент отбрасываемых клеток в рамках экспериментальной сессии, (n'3 сеансов с корональным ломтиком, n-4 с поперечным ломтиком, средний±SEM). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
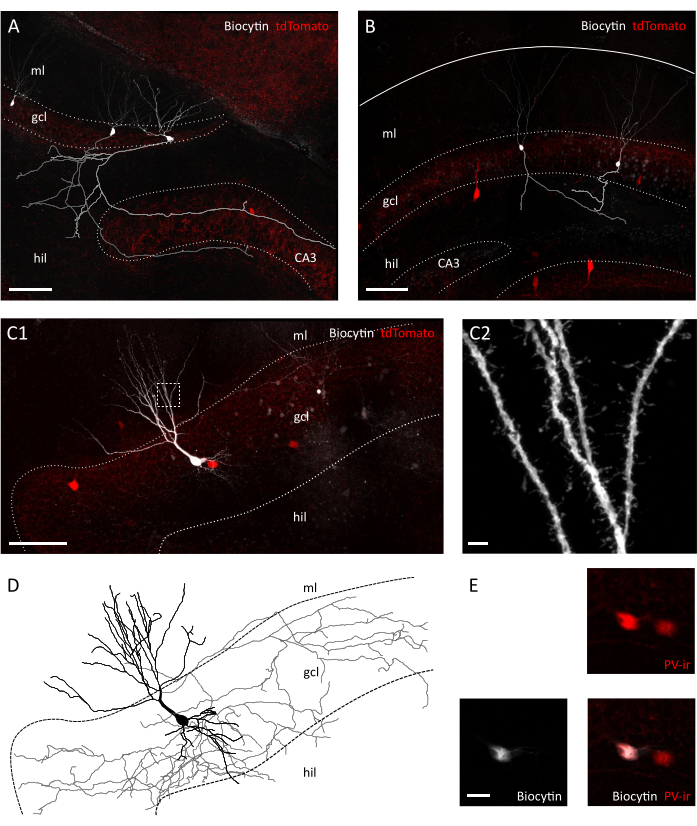
Рисунок 3: Морфологическое сохранение гранулных клеток и интернейронов в поперечном срезе. Конфокальные изображения, показывающие биоцитин заполненные гранулы клеток в поперечномсрезе( A ) и в корональныхломтиков( B ) из Pvalb-IRES-Cre; Ай9 трансгенных мышей. Соответствующие аксоны были реконструированы серым и светло-серым цветом. Обратите внимание на разницу в длине аксона и сложности между препаратами. Масштабная бар-100 мкм. (C1) Конфокальные изображения, показывающие биоситинов заполненные tdTomato-положительный интернейрон. Хилехилус, слои клеток гклю гранулы, молекулярный слой млз. Масштабная планка 50 мкм. (C2) Увеличение коробчатой области в C1, показывающее дендритные шипы. Масштабная бар-2 мкм(D)Морфологическая реконструкция аксонов и дендритов биоцитина, наполненного интернейроном в С1 (аксон серого цвета, сома и дендриты в черном). (E) Крупным планом сомата клеток, изображенных в C1 показаны колокализации биоцитина и парвалбумина-иммунореактивности (PVir). Масштабная планка 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть более широкую версию этой цифры.
Обсуждение
Спинной гиппокамп был широко изучен за его роль в пространственном обучении и навигации в основном с помощью поведенческих экспериментов, анатомических трассировки и специфических для региона манипуляций. Чтобы объединить срез-электро-физиологические запросы с этими методами, мы собрали протокол, который использует аналогичный угол секционирования, как модифицированная горизонтальная нарезка для промежуточной вентальной области гиппокампа, но использует перевернутый порядок нарезки для получения ранних ломтиков из спинной промежуточной области. Такой подход сокращает время, необходимое для нарезки и сбора спинной области гиппокампа, тем самым повышая жизнеспособность ломтиков.
Используя этот метод, мы можем регулярно получать около трех ломтиков в полушарии спинного гиппокампа области между 1,4 мм-2,4 мм от поверхности пиала, как показано на рисунке 1C. Хотя это не возможно с помощью этой процедуры, чтобы получить поперечные ломтики от самого полюса перегородки гиппокампа, можно собрать около двух дополнительных жизнеспособных не поперечных ломтиков в полушарии от полюса перегородки (Рисунок 1C ii,iii). Если септальный полюс гиппокампа является основным направлением исследований, другие протоколы, которые позволяют сбор поперечных ломтиков, особенно с самого полюса перегородки гиппокампа, может быть лучше подходит21,32. Поведенческие эксперименты по пространственной навигации и обучению предпочтительно проводятся у зрелых мышей с полностью развитой нейрональной связью. Следовательно, мы оптимизировали нашу процедуру нарезки для применения к мозгу взрослых животных (показано здесь в течение трех месяцев мышей), которые более чувствительны к стрессу, чем устойчивый препарат для несовершеннолетних. С этой целью мы объединили несколько стратегий, которые уменьшают гипоксический стресс мозга подвергается в период между извлечением и размещением ломтиков в кислородом ACSF. Защитное решение резки является NMDG основе ACSF25,27,28 с низким Наз и Ca2 ", но высокий Mg2", чтобы уменьшить возбудимые повреждения и отек клеток из-за активации NMDA рецепторов. Кроме того, HEPES обеспечивает стабильную буферизации и соединений, таких как аскорбат и пируват уменьшить окислительный стресс. Транскардиальная перфузия с охлажденным и оксигенированным защитным режущей раствором использует чрезвычайно плотную капиллярную сеть, снабжающая мозг быстро и однородно снижает метаболический спрос и глутамат-индуцированную возбудимость в тканях мозга. Впоследствии почти все шаги после обезглавливания выполняются в охлажденных и оксигенированных растворов, чтобы сохранить метаболизм и лишение кислорода до минимума в течение всей процедуры. Другие стратегии для уменьшения повреждения мозга во время нарезки существуют и могут быть одинаково действительны38. Чтобы продемонстрировать качество нашего препарата, мы сравниваем его с препаратом коронального ломтика, который обычно используется для записи из спинного гиппокампа. Несмотря на то, что корональные ломтики могут быть использованы для получения хорошей записи патч-зажима в зубной извилины, количество нездоровых и отключенных нейронов выше, чем в поперечном срезе. Кроме того, целостность аксональных и дендритных беседок лучше сохраняется в поперечном срезе. На самом деле целостность гранулы клеточных аксонов(рисунок 3A), которые работают ортогонал к продольной оси гиппокампа служит индикатором поперечной нарезки плоскости1.
Для заполнения исправленных нейронов, мы предлагаем сопротивление электрода между 3 и 5 МЗ. Диаметр кончика около 1 мкм, позволяет выполнение хорошего сопротивления уплотнения во время записи и хорошее повторное уплотнение на электрод опровержение. Наиболее важной деталью является, чтобы избежать всасывания частей сомы или ядра в пипетку. По этой причине мы предлагаем включить краситель Alexa во внутриклеточный раствор, когда это возможно. Краситель позволяет контролировать форму клетки во время записи и повторного уплотнения. Кроме того, это позволяет оценить целостность исправленной клетки после фиксации, что может сэкономить время иммуногистохимии, в случаях неудачных пломбы. Из-за Alexa красители утоляются с длинным временем фиксации, мы предлагаем короткую фиксацию, если это возможно.
Для последующего иммуностимтирования мы используем протокол, который не требует повторного сечения ломтика. Мы предлагаем сделать окрашивание в течение одной недели после фиксации. Чем дольше ломтики остаются в холодильнике, тем выше вероятность деградации тканей. Если длительного хранения не избежать, мы предлагаем увеличить концентрацию NaN3 в PBS до 0,05% и обновлять ее еженедельно. Иммуностепенирование всего ломтика означает, что инкубационые времена с первичными и вторичными антителами увеличиваются. Как правило, для выявления биоцитина достаточно одной ночной инкубации при 4 градусов по Цельсию, но если в сочетании с окрашиванием других белков, вся процедура окрашивания может длиться гораздо дольше. Перемеабилизация блокировки и анти-тела инкубации должны быть оптимизированы индивидуально. Как правило, для первичного антитела, два дня достаточно, а один день может быть достаточно для вторичного. Мы рекомендуем увеличить продолжительность мытья шагов вместе с более длительными инкубациями антител, чтобы избежать увеличения фона.
В этом протоколе мы представили метод нарезки для получения поперечных или почти поперечных ломтиков гиппокампа сохранения нейронной жизнеспособности взрослой ткани и практический подход к восстановлению морфологии и нейрохимической идентичности исправленных нейронов. Этот метод может быть легко выполнен в матче электро-физиологических результатов с анатомическими и поведенческими исследованиями упором на промежуточно-спинной части гиппокампа.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Мы благодарим Керстин Кроненбиттер и Дидье Гремель за техническую помощь. Мы благодарим Умберто Морелли за помощь в графическом программном обеспечении и Матиаса Хоппе за видеосъемку и редактирование видео. Работа в нашей лаборатории была поддержана Deutsche Forschungsgemeinschaft (DFG) FOR2143, SFB 1461 (Проект-ID 434434223) и GRK2154, Совет медицинских исследований грант G1100546/2 и Кил университета.
Материалы
| Name | Company | Catalog Number | Comments |
| 1mL syringes Omnifix-F | Braun melsungen AG | 9161406V | |
| 24 multiwells | SARSTEDT | 8,33,922 | |
| 81x criogenic vial storage box | Fisherscientific | 15-350-107B | storage chamber |
| Alexa Hydrazide dye | Invitrogen | A10436 | |
| Big scissor | Fine science tool | 14010-15 | graefe forceps |
| Biocytin | IRIS biotech. | LS3510.0250 | |
| Borosilicate Glass capillaries | Science products | GB150TF-10 | storage chamber |
| Brush 5 | Leonhardy | 241 | Micro double spatula, L 150 mm, blade width 4 mm |
| Calcium chloride dihydrate | Roth | 5239.2 | aCSF solution |
| Carbon steel microtome blade | feather | C35 | |
| Chloridric acid | Roth | K025.1 | |
| Confocal microscope | Zeiss | LSM880 | with Airyscan |
| Cyanoacrylate glue | UHU | 509141 | |
| Cyanoacrylate glue, n-butyl-ester VetBond | 3M | ||
| EGTA | Roth | 3054.1 | |
| Fiji ImageJ | fiji.sc | ||
| Filter paper 113A | ROTILABO Roth | AP180.1 | |
| Fine tip tweezer | Dumont | 0245fo | |
| Glass becker (150 ml) | ROTILABO Roth | X690.1 | incubation chamber and dissection |
| Glass Petri dishes (10 cm dia.) | ROTILABO Roth | 0690.1 | |
| Glucose | Roth | X997.2 | aCSF solution |
| Heated water bath | Grant Instruments Ltd | SUB14 | |
| HEPES | Roth | 9105.4 | aCSF solution |
| Isofluoran | baxter | 5239.2 | Anesthetic |
| Large spatula | Roth | E286.1 | |
| Magnesium Sulfate heptahydrate | Roth | 8793.2 | aCSF solution |
| Mg-ATP | Sigma Aldrich | A9187 | |
| Microfil | World precision instruments | MF34G | |
| Na2-GTP | Sigma Aldrich | 51120 | |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF solution |
| Normal goat serum | Sigma Aldrich | 566380 | |
| Nylon mesh kit | Warner Instruments | 64-0198 | incubation chamber and storage chamber |
| Paraformaldeyde | Sigma Aldrich | P6148 | |
| Phosphate buffered saline 10X | Panbiotech | P04-53500 | |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | |
| Pipette puller | Sutter instrument | P-2000 | |
| Pipette tips | SARSTEDT | 7,07,62,211 | incubation chamber |
| Plastic box for syringe filters | SUPELCO | 54135-U | storage chamber |
| Potassium Chloride | Roth | 6781.3 | aCSF solution |
| Potassium Gluconate | Roth | P1847 | |
| Probenbecker becker (100 ml) | ROTILABO Roth | HT85.1 | incubation chamber |
| Rounded tip tweezers | Fine science tool | 11051-10 | |
| Sainless steel blade | Gillette | Vibratome | |
| Small scissor | Fine science tool | 14010-10 | mayo scissor straight |
| Sodium Ascorbate | Roth | 3149.2 | aCSF solution |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium Bicarbonate | Roth | 6885.1 | aCSF solution |
| Sodium Chloride | Roth | 3957.1 | aCSF solution |
| Sodium Hydroxide | Roth | K021.1 | |
| Sodium Phosphate monobasicdihydrat | Roth | K300.1 | aCSF solution |
| Sodium Pyruvate | Roth | 8793.2 | aCSF solution |
| Streptavidin conjiugated Alexa 488 | Invitogen | s11223 | |
| Thin spatula | Roth | E286.1 | Double spatula, L 150 mm, blade width 9 mm |
| Transfer pipette | Sarstedt | 861171 | |
| Triton x100 | Roth | 3051.1 | |
| Vibratome | Thermoscientific | Microm HM650V | |
| Filter device for ultrapure water | Merck-Millipore | Milli-Q IQ 7000 |
Ссылки
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65 (1), 7-19 (2010).
- David, A., Pierre, L. Hippocampal Neuroanatomy. The Hippocampus Book. , 37-114 (2006).
- Dong, H. W., Swanson, L. W., Chen, L., Fanselow, M. S., Toga, A. W. Genomic-anatomic evidence for distinct functional domains in hippocampal field CA1. Proceedings of the National Academy of Sciences of the United States of America. 106 (28), 11794-11799 (2009).
- Royer, S., Sirota, A., Patel, J., Buzsaki, G. Distinct representations and theta dynamics in dorsal and ventral hippocampus. Journal of Neuroscience. 30 (5), 1777-1787 (2010).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Foggetti, A., Baccini, G., Arnold, P., Schiffelholz, T., Wulff, P. Spiny and Non-spiny Parvalbumin-Positive Hippocampal Interneurons Show Different Plastic Properties. Cell Rep. 27 (13), 3725-3732 (2019).
- Cembrowski, M. S., Spruston, N. Heterogeneity within classical cell types is the rule: lessons from hippocampal pyramidal neurons. Nature Reviews Neuroscience. 20 (4), 193-204 (2019).
- Moser, M. B., Moser, E. I., Forrest, E., Andersen, P., Morris, R. G. Spatial learning with a minislab in the dorsal hippocampus. Proceedings of the National Academy of Sciences of the United States of America. 92 (21), 9697-9701 (1995).
- Pothuizen, H. H., Zhang, W. N., Jongen-Relo, A. L., Feldon, J., Yee, B. K. Dissociation of function between the dorsal and the ventral hippocampus in spatial learning abilities of the rat: a within-subject, within-task comparison of reference and working spatial memory. European Journal of Neuroscience. 19 (3), 705-712 (2004).
- Fredes, F., et al. Ventro-dorsal Hippocampal Pathway Gates Novelty-Induced Contextual Memory Formation. Current Biology. 31 (1), 25-38 (2021).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Andersen, P. Long-lasting facilitation of synaptic transmission. Ciba Foundation Symposium. (58), 87-108 (1977).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. Journal of Neurophysiology. 67 (5), 1346-1358 (1992).
- Walther, H., Lambert, J. D., Jones, R. S., Heinemann, U., Hamon, B. Epileptiform activity in combined slices of the hippocampus, subiculum and entorhinal cortex during perfusion with low magnesium medium. Neurosci Lett. 69 (2), 156-161 (1986).
- Rafiq, A., DeLorenzo, R. J., Coulter, D. A. Generation and propagation of epileptiform discharges in a combined entorhinal cortex/hippocampal slice. Journal of Neurophysiology. 70 (5), 1962-1974 (1993).
- Leutgeb, J. K., Frey, J. U., Behnisch, T. LTP in cultured hippocampal-entorhinal cortex slices from young adult (P25-30) rats. Journal of Neuroscience Methods. 130 (1), 19-32 (2003).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature Protocols. 1 (3), 1235-1247 (2006).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording Synaptic Plasticity in Acute Hippocampal Slices Maintained in a Small-volume Recycling-, Perfusion-, and Submersion-type Chamber System. Journal of Visualized Experiments. (131), e55936 (2018).
- Dougherty, K. A., Islam, T., Johnston, D. Intrinsic excitability of CA1 pyramidal neurones from the rat dorsal and ventral hippocampus. Journal of Physiology. 590 (22), 5707-5722 (2012).
- Tidball, P., et al. Differential ability of the dorsal and ventral rat hippocampus to exhibit group I metabotropic glutamate receptor-dependent synaptic and intrinsic plasticity. Brain and Neuroscience Advances. 1 (1), (2017).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159 (2005).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), e53825 (2018).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Archives. 414 (5), 600-612 (1989).
- Djurisic, M. Minimizing Hypoxia in Hippocampal Slices from Adult and Aging Mice. Journal of Visualized Experiments. (161), e61377 (2020).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. P. Acute Brain Slice Methods for Adult and Aging Animals: Application of Targeted Patch Clamp Analysis and Optogenetics. Patch-Clamp Methods and Protocols, 2nd Edition. 1183, 221-242 (2014).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments. (91), e51706 (2014).
- Norenberg, A., Hu, H., Vida, I., Bartos, M., Jonas, P. Distinct nonuniform cable properties optimize rapid and efficient activation of fast-spiking GABAergic interneurons. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 894-899 (2010).
- Swietek, B., Gupta, A., Proddutur, A., Santhakumar, V. Immunostaining of Biocytin-filled and Processed Sections for Neurochemical Markers. Journal of Visualized Experiments. (118), e54880 (2016).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nature Protocols. 1 (4), 1977-1986 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Longair, M. H., Baker, D. A., Armstrong, J. D. Simple Neurite Tracer: open source software for reconstruction, visualization and analysis of neuronal processes. Bioinformatics. 27 (17), 2453-2454 (2011).
- Murray, A. J., et al. Parvalbumin-positive CA1 interneurons are required for spatial working but not for reference memory. Nature Neuroscience. 14 (3), 297-299 (2011).
- Otis, T. S., Staley, K. J., Mody, I. Perpetual inhibitory activity in mammalian brain slices generated by spontaneous GABA release. Brain Research. 545 (1-2), 142-150 (1991).
- Varela, C., Llano, D. A., Theyel, B. B. An introduction to in vitro slice approaches for the study of neuronal circuitry. Neuromethods. 67, 103-125 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены