Method Article
הכנת פרוסות חריפות מהיפוקמפוס הגבי להקלטה של תא שלם ושחזור עצבי בGyrus דנטאטה של עכברים בוגרים
In This Article
Summary
אנו מציגים פרוטוקול להכנת פרוסות חריפות מההיפוקמפוס הגבי-ביניים של עכברים. אנו משווים הכנה רוחבית זו עם חתך קורנל במונחים של איכות הקלטות ושמירה על תכונות מורפולוגיות של נוירונים מוקלטים.
Abstract
למרות שהארכיטקטורה הכללית של ההיפוקמפוס דומה לאורך ציר האורך שלו, מחקרים שנעשו לאחרונה חשפו הבדלים בולטים בקריטריונים מולקולריים, אנטומיים ותפקודיים המצביעים על חלוקה למעגלי משנה שונים לאורך היקפו הרוזטרו-קאודל. בשל קישוריות דיפרנציאלית ותפקוד ההבחנה הבסיסית ביותר נעשית בין הגב לבין ההיפוקמפוס הגחוני, אשר עדיפים על עיבוד מרחבי ורגשי, בהתאמה. בהתאם לכך, בעבודה vivo לגבי היווצרות זיכרון מרחבי התמקדה בהיפוקמפוס הגבי.
לעומת זאת, הקלטות במבחנה אלקטרו-פיזיולוגיות בוצעו באופן מועדף על היפוקמפוס בינוני-גחוני, המונע בעיקר על ידי גורמים כמו כדאיות פרוסה ושלמות מעגלים. כדי לאפשר מתאם ישיר של נתוני in vivo על עיבוד מרחבי עם נתוני in vitro התאמנו שיטות ניתוח קודמות כדי להשיג פרוסות מוח רוחביות מאוד קיימא מההיפוקמפוס הגבי-ביניים להקלטות ארוכות טווח של תאים ראשיים ואינטראורונים בג'ירואים המשועבדים. מכיוון שהתנהגות מרחבית מנותחת באופן שגרתי בעכברים בוגרים, שילבנו הליך חתך רוחבי זה עם שימוש בפתרונות הגנה כדי לשפר את הכדאיות של רקמת המוח מבעלי חיים בוגרים. אנו משתמשים בגישה זו עבור עכברים בני כ -3 חודשים. השיטה מציעה חלופה טובה להכנת קורנל אשר משמש לעתים קרובות למחקרים במבחנה על ההיפוקמפוס הגבי. אנו משווים את שתי ההכנות הללו מבחינת איכות ההקלטות ושימור תכונות מורפולוגיות של נוירונים מוקלטים.
Introduction
ההיפוקמפוס נחקר בהרחבה על תפקידו המרכזי בהיבטים שונים של למידה וזיכרון, ניווט מרחבי כמו גם רגש. המעגלים הבסיסיים של ההיפוקמפוס, המכונים בדרך כלל "המעגל הטריסינפטי", הם רשת לאמלרית בציר הרוחבי, אשר נשמרת במידה רבה לאורך ציר האורך1. התרומות של ההיפוקמפוס להתנהגויות קוגניטיביות ורגשיות שונות נובעות ככל הנראה מהקשרים המגוונים שמעגל בסיסי זה עושה לאורך הציר הגבי עם מספר אזורי מוח אחרים2,3. עם זאת, מעבר לקישוריות אפרנטית ואפרנטית, מספר גדל והולך של מחקרים מצביעים על הבדלים נוספים לאורך הציר הספטו-זמני של ההיפוקמפוס. הבדלים כאלה נוגעים לארכיטקטורה הפנימית ולקישוריות, כמו גם להבדלים בדפוסי ביטוי גנים ומורפולוגיה עצבית4,5,6,7,8.
בהתחשב בקיומם של הבדלים כאלה במעגלים הבסיסיים, סביר לבחור את תת המעגל ההיפוקמפוסי הספציפי שייחקר בהתאם לשאלות המטופלות. אם למשל השאלה נוגעת למנגנונים עצביים המעורבים בעיבוד מרחבי, הגב ולא ההיפוקמפוס הגחוני מעניין, אם כי השניים אינם פועלים באופן עצמאי ב vivo עקב קישוריות אורך תוך-היפוקמפוס9,10,11. לאורך קווים אלה יש לקחת בחשבון לא רק את ההבדלים לאורך ציר האורך, אלא גם טיפול נדרש כדי לשמר מעגלים מקומיים וארוכי טווח ככל האפשר. לשימור נתיבי הסיבים והקישוריות הזווית שבה המוח ייקטע היא חיונית.
השיטה הראשונה שדווחה בספרות לכלול את המעגל trysinaptic הראשון בודד את ההיפוקמפוס מהמוח ולאחר מכן עשה פרוסות רוחביות (בניצב לצירי האורך) באמצעות מסוקרקמה 12 ו vibratome13. פיזיולוגים מאוחרים יותר העדיפו להשיג פרוסות מבלוק מוח שלם כדי לשמר גם את מבני המוח הסמוכים המחוברים להיפוקמפוס. עבור הכנות בלוק אלה, זוויות חתך שונות ביחס ההיפוקמפוס פותחו, כגון הכנת פרוסת קורנל14 או הכנת פרוסה אופקית בשם HEC פרוסה לשימור חיבורי קליפת המוח ההיפוקמפוס-entorhinal15,16,17.
בהכנה האחרונה האונה הקודקודית נחתכת בזווית של 0° או 12 מעלות ביחס למישור האופקי לאורך ציר רוסטרו-קאודל כדי ליצור את בסיס הבלוק. לאחר מכן נאספים פרוסות החל מפני השטח הגחוניים של המוח, ובכך מאפשרים בעיקר את הקציר של אזור ההיפוקמפוס הבינוני-גחוני. שיטה זו הפכה לבחירה הפופולרית ביותר עבור מחקרים פיזיולוגיים והוא יכול להתבצע באופן אמין בעקבות מספר פרוטוקולים שפורסמו18,19,20.
עם זאת, אם העניין המחקרי נוגע להיבטים ספציפיים של למידה מרחבית, ההיפוקמפוס הגבי עשוי להיות האזור המתאים יותר לחקירה וזה יהיה שימושי למצוא הליך חתוך באיכות דומה עבור אזור היפוקמפוס זה. פרוטוקולים מעטים, המתמקדים בקוטב rostral מאוד, פותחו שיכול לספק דרישה זו 21,22.
בפרוטוקול זה, במקום זאת, אנו מתארים גישה להשגת פרוסות רוחביות בנות קיימא מההיפוקמפוס הגבי-בינוני המשתמש בזווית החתך שתוארה קודם לכן להכנות אופקיות18,19 (איור 1A& B). אנו מדגימים את איכות הפרוטוקול על ידי השוואת הקלטות אלקטרופיזיולוגיות ושחזורים מורפולוגיים בהכנה זו לאלה המתקבלים בפרוסות קורנל. פרוטוקול זה מתאים במיוחד לשילוב עם ניסויים אנטומיים והתנהגותיים בעכברים בוגרים (בני שלושה חודשים במקרה שלנו).
Protocol
כל ההליכים בהם היו מעורבים בעלי חיים ניסיוניים היו בהתאם לחוק הגרמני לרווחת בעלי חיים ואושרו על ידי ועדת האתיקה של אוניברסיטת קיל. Parvalbumin-Cre (Pvalb-IRES-Cre) עכברים23 (מעבדות ג'קסון, מאגר מספר 008069) נשמרו כמושבות heterozygous או חצו עם עכברי כתב Ai9 Cre24 (מעבדות ג'קסון, מאגר מספר 007909). נעשה שימוש בעכברים נקביים וזכריים בין P40-P90. עכברים נשמרו במחזור 12 שעות כהה בהיר בתנאי דיור קבוצתי סטנדרטיים סופקו עם מזון ומים מודעה libitum.
1. הכנת פתרונות
הערה: הכן פתרונות טריים לכל יום ניסיוני באמצעות מים אולטרה-דקים (UPW) (התנגדות ב-25 °C (70 °F 18.2 MΩcm). הפתרונות עשויים להיות מאוחסנים ב 4 °C (69 °F) לכל היותר יום אחד. פתרונות מגנזיום וסידן ניתן לאחסן בנפרד כמו 1 M מלאי פתרונות. כל פתרונות העבודה חייבים להיות רוויים בפרבוגן (95% O2:5% CO2) לחמצן אופטימלי ותחזוקת pH לפני השימוש ובמהלכו.
- הכן את פתרון החיתוך (500 מ"ל לעכבר) (ב- mM): 92 NMDG, 2.5 KCl, 1.25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 גלוקוז, 5 Na-ascorbate, 4 Na-פירובט, 0.5 CaCl2·2H2O, ו 10 MgSO4·7H2O. Titrate כדי pH 7.4 תחת מכסה המנוע כימי עם 4-5 מ"ל של 16% חומצה הידרוכלורית לפני הוספת cations divalent. זה ימנע את המשקעים של MgSO4.
הערה: ניתן לאחסן KCl ו- NaH2PO4 כפתרונות 10x ב- 4°C. אנחנו עושים שתי קבוצות בודדות של פתרון חיתוך. אחד יום לפני ההקלטה (מאוחסן במקפיא במשך הלילה כדי לייצר קרח כתוש) ואחד ביום ההקלטה. - הכן את פתרון האחסון (250 מ"ל לעכבר) (ב- mM): 92 NaCl, 2.5 KCl, 1.25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 גלוקוז, 5 Na-ascorbate, 4 Na-pyruvate, 2 CaCl2·2H2O, ו 2 MgSO4·7H2O. Titrate ל- pH 7.3-7.4 עם 1 NOH.
הערה: NaCl, KCl ו NaH2PO4 יכול להיות מצויד כפתרון 10x ב 4 מעלות צלזיוס. - הכן ACSF להקלטה (ב- mM): 122 NaCl, 2.5 KCl, 1.25 NaH2PO4, 24 NaHCO3, 12.5 גלוקוז, 2 CaCl2·2H2O, ו 2 MgSO4·7H2O, 2 Na-ascorbate, 4 Na-ascoruvate. טיטראט pH ל 7.3-7.4 עם 1 N NaOH.
הערה: ניתן לשלב NaCl, KCl ו- NaH2PO4 בפתרון מניית 10x ב- 4°C.
2. הכנת הספסל לחתך
- מכינים על הקרח (150 מל) ושתי מנות פטרי מזכוכית (בקוטר 10 סמ) וממלאים אותן בתמיסת החיתוך הטרי. שמור על הפתרון מחומצן עם מכשיר מבעבע קרבוגן (צינור מחורר או אבן אוויר מחובר למערכת קרבוגן).
הערה: הפתרון בכומתה ישמש לזלוף בעוד צלחות פטרי ישמשו במהלך הליך החיתוך. - לצייד את ספסל הניתוח עם להב נירוסטה, פינצטה קצה מעוגל, פינצטה קצה עדין, מספריים גדולים, מספריים קטנים, מרית מתכת גדולה, מרית מתכת דקה, מברשת, צלחת ויברטום ודבק cyanoacrylate או דבק ציאנואקרילאט פחות רעיל n-בוטיל-אסתר cyanoacrylate. אני ממעיט בלהב נירוסטה ופיסת נייר סינון באחת ממנות הפטרי מזכוכית על הקרח. הפטרי הזה ישמש כדי לחתוך את המוח. צייר שלושה קווים מקבילים על החלק התחתון של צלחת פטרי פלסטיק ומקם את המנה קרוב למכשירים הכירורגיים.
- הכינו את המערך לזלוף הטרנס-קרדיאלי על פי פרוטוקוליםשפורסמו 25.
- הכן את הוויברטום, הרכבה להב חדש על מחזיק הלהב ולהגדיר את הפרמטרים לחיתוך (זווית של הלהב ממישור אופקי 17 °, משרעת תנודות להב 1.5 מ"מ, להב קדימה מהירות התנועה בסביבות 2 מ"מ מינימום-1, תדרתנודה 90 הרץ, עובי קטע 350 מיקרומטר). ממלאים את מגש הוויברטום בתמיסת חיתוך קרה כקרח ושומרים עליו תחת חמצון מתמיד.
הערה: אנו מוסיפים את הקרח כתוש עשוי אצווה הראשונה של פתרון חיתוך לפתרון חיתוך טרי מקורר כדי לשמור על הטמפרטורה למטה. שים לב כדי לשמור על הקרח מהלהב תוך כדי החתכה. - הכינו תא דגירה מלא בתמיסת החיתוך תחת חמצון מתמיד. מניחים את התא באמבט מים מחומם מראש (35 מעלות צלזיוס).
הערה: דוגמה לתא הדגירה ניתן למצוא אדוארדס קונרת (1992)26. - הכינו תא אחסון פרוסה מלא בתמיסת האחסון ושמרו אותו בטמפרטורת החדר ותחת חמצון מתמיד. במקרה שהרקמה מבטאת חלבון פלואורסצנטי או אופסין המופעל באמצעות אור, מומלץ לשמור את התא בחושך, למשל, בתוך קופסה.
הערה: תא אחסון עם בארות עצמאיות מרובות שימושי כדי להבחין בין רמת הפרוסות לאורך הציר הגבי של ההיפוקמפוס. ניתן לבנות תא בהזמנה אישית (איור 1D). קח חתיכת רשת מרווח בקבוקון מתיבת אחסון בקבוקון קריוגני 81x ולהדביק את החלק התחתון על רשת ניילון. הכנס את שליש העליון של קצה פלסטיק פיפטה 5mL למרכז רשת זו, כך שהוא בולט על 3 ס"מ בתחתית. קצה פלסטיק זה משמש כמעמד של הרשת ומאוחר יותר מחזיק את צינורות האוויר עבור חמצון. הכנס את הרשת עם המעמד שלה לתוך קופסת פלסטיק גלילית (למשל, אריזה של מסנני מזרק) כך שהוא לא יכול להטות או להתנדנד. מאגר זה יחזיק 250 מ"ל של פתרון אחסון.
3. הכנת פרוסות היפוקמפוס
- יש למרדים את העכבר בתא קופסאות באמצעות isoflurane (כ-0.5 מ"ל) מתחת למכסה המנוע. השאירו את העכבר במנוחה עד שהנשימה איטית וקבועה (בערך 2-3 דקות). בדיקה להיעדר תגובות כאב עם צביטות בוהן.
- בצע זלוף טרנס-קרדיאלי באמצעות 25 מ"ל של פתרון חיתוך מוגז מהכומתה על הקרח בעקבות פרוטוקולים שפורסמו25,27. צעד זה מומלץ לקרר את המוח במהירות כדי להאט במהירות את חילוף החומרים העצבי.
- ערפו את ראש החיה בעזרת המספריים הגדולים והניחו את הראש בצלחת הפטרי מקוררת על קרח המכיל את תמיסת החיתוך.
- פתח את העור עם המספריים העדינים כדי לחשוף את הגולגולת. הפוך חתכים לרוחב קטנים לבסיס הגולגולת משני צידי מגנום foramen. ואז לחתוך לאורך תפר sagittal החל מגנום foramen עד להגיע לתפר האף הקדמי מעל הנורה חוש הריח. משוך את המספריים במהלך חתך קשתית כדי למנוע נזק של רקמת המוח הבסיסית.
הערה: שמירה על הראש שקוע בתמיסת החיתוך מסייעת לנקות אותו מהדם ושומרת על הטמפרטורה כלפי מטה. - השתמש בפינצטה קצה מעוגל למשוך את העצמות הקודקודיות כדי לחשוף את המוח. שימו לב להשיג ולהסיר גם את קרום הלב. אם נשאר, הם יכולים לגרום נזק למוח במהלך החילוץ.
- השתמש מרית קטנה בעדינות לגרוף את המוח לתוך צלחת פטרי השני.
- חותכים את המוח בחצאים לאורך סדק האורך באמצעות הלהב מראש מצונן.
- השתמש מרית גדולה להרים חצי כדור אחד מתוך פתרון חיתוך על צלחת פטרי פלסטיק. כאשר חצי הכדור מונח על פני השטח המדיאליים שלו, יישר את קליפת המוח הקודקודית עם אחד הקווים המקבילים כדי לקבל התייחסות לחיתוך השני כפי שמוצג באיור 1B.
- בצעו את החתך השני בחלק הגחוני של חצי הכדור הממקם את הלהב במקביל לקווים כדי להשיג את פני השטח, המשמש מאוחר יותר להדבקת המוח על מחזיק הדגימה (ראו השלב הבא), כפי שמוצג באיור 1B. להחזיר את ההמיספרה לתוך פתרון חיתוך מחומצן של צלחת פטרי זכוכית ולבצע את אותו הליך בחצי הכדור השני.
- הדבק את ההמיספרות עם הצד הגחוני החתוך טרי על מחזיק דגימת הוויברטום באמצעות הדבק. שים כמה טיפות של פתרון חיתוך על ההמיספרות כדי לחזק את הדבק ולהעביר את מחזיק הדגימה לתוך מגש ויברטום. בדרך זו ההחתכה תמשיך מהעמוד אל ההיפוקמפוס הגחוני.
- הסר את הפרוסה הראשונה שאינה רוחבית (איור 1C, ii-iii) עד שאזור העניין יהפוך לגלוי ולאחר מכן התחל לאסוף את הפרוסות.
הערה: פרוסות לא רוחביות אך שמיש, בריא ניתן להשיג מן ההיפוקמפוס הגב בתחילת הליך ההחתכה(איור 1C, ii-iii). האוסף של כל פרוסה דורש בערך 3 - 4 דקות. על ידי התחלת החיתוך מן הגב במקום היפוקמפוס הגחוני אנו חוסכים כ 10 דקות, אשר משפר את הכדאיות של פרוסות הגב. - עם פיפטה פלסטיק (לחתוך את הקצה הצר של הקצה) להעביר כל פרוסה לתוך תא הדגירה (המכיל פתרון חיתוך ב 35 מעלות צלזיוס) ולתת לו לנוח במשך 12 דקות. תקופת ההחלמה הקצרה בתמיסת חיתוך חם מפחיתה מאוד את הנפיחות העצבית הראשונית, כפי שדווח בטינג ואח '(2014)28. לאחר מכן באמצעות מברשת להעביר את הפרוסה לתוך תא האחסון (המכיל פתרון אחסון ב RT) ולתת לו לנוח עד תחילת הניסוי.
4. הקלטת תא שלם ומילוי ביוציטין
הערה: התיאור של הקלטת תיקון-מהדק של תא שלם מצטמצם כאן רק לשלבים מרכזיים המסייעים להשיג מילוי ביוציטין טוב והוא ישים בדרך כלל לנוירונים ב- ACSF. לקבלת פרטים לגבי ההליכים של הקלטות אלקטרופיזיולוגיות, ניתן להתייעץ עם מספר פרוטוקולים אחרים29,30.
- בחר פתרון תאי מתאים בהתאם לפרמטרים שיש לרשום. כדוגמה, עבור מדידות מהדק הנוכחי, פתרון מבוסס גלוקונאט אשלגן ניתן להשתמש (ב mM): 135 K-Gluconate, 3 KCl, 10 HEPES, 0.2 EGTA, 10 phosphocreatine-Na2, 4 MgATP, 0.3Na 2-GTP. כוונן את ה-pH ל-7.3 עם קו-ם אחד. osmolality צריך להיות סביב 285-290 mOsmol/kg פעם 3-5 מ"ג / מ"ל ביוציטין מתווסף.
הערה: כדי לפקח על הצורה של הנוירון במהלך ההקלטה, 0.3-0.5 μL / מ"ל של 1 מ"מ אלקסה פלואור הידראצייד ניתן להוסיף את הפתרון תאיים. במקרה זה, זכור לגילוי ביוציטין, כדי להתאים את צבע צבע אלקסה עם החללית פלואורסצנטית יחד עם סטרפטבידין. - הכינו אלקטרודות מלחציים בקוטר ≤1 מיקרומטר ועמידות של 3-5 MΩ מנחמי בורוסיליקט בעלי קירות עבים.
- הפעל את מערכת הזחילה של הגדרת מהדק התיקון במהירות של 2.5-3 מ"ל /min ב RT או 35-37 מעלות צלזיוס ולאבטח פרוסה בתא עם עוגן בצורת U.
- לזהות את אזור המוח של עניין ולבחור נוירון בריא עם סומה לפחות 30-50 מיקרומטר מתחת לפני השטח של הפרוסה.
הערה: לסומה של נוירון בריא יש משטח חלק, וגבולות הממברנה מנוגדים מעט. הסומה של נוירון לא בריא נראית מכווצת ומנוגדת מאוד או נפוחה ושקופה למחצה. - לטעון פיפטה זכוכית עם הפתרון תאיים עד קצה האלקטרודה AgCl מכוסה. להעביר את פיפטה לתוך הפתרון של תא ההקלטה, הפעלת לחץ חיובי אור כדי לשמור על ברור קצה אלקטרודה זכוכית.
הערה: אם הפתרון מכיל צבע Alexa, ניתן לשלוט בלחץ חזותית התאמת כמות הפתרון פלואורסצנטי שוחרר מהקצה. לחץ מינימלי ימנע את הכתמת הרקמה סביב התא. - התקרבו לתא מזווית אלכסונית ויצרו מגע בשליש הראשון של משטח הסומא בעת יצירת חותם הג'יגה. לשחרר את הלחץ, לאט להזיז את פוטנציאל החזקה ל-65 mV ולהחיל יניקה עדינה דרך הפה כדי להקל על היווצרות חותם ג'יגה.
- כדי לקבוע את תצורת התא כולו, להחיל יניקה חזקה וקצרה כדי לשבור את הממברנה. השלך את ההקלטה אם לנוירון יש פוטנציאל קרום יותר depolarized מ-50 mV, אם זרם ההחזקה גדל מעבר 100 pA או אם התנגדות הגישה עולה מעבר 30 MΩ.
- לאחר ההקלטה (למילוי מספיק של סומטה ודנדריטים לפחות 15 דקות מומלץ; למילוי של אקסונים מורכבים עד שעה אחת אולי נדרש31) להסיר בזהירות את האלקטרודה. לשם כך להגדיר את פוטנציאל ההחזקה ל 0 mV ולנסות ליצור מחדש חותם ג'יגה על ידי ביטול איטי של פיפטה בכיוון ההפוך מהגישה, כגון כדי להשיג תצורת תיקון חיצוני החוצה.
הערה: נוכחותו של צבע Alexa בפתרונות תאיים מסייע הסרה מונחית ויזואלית של פיפטה מפני השטח העצביים. אם הגרעין של התא אינו במגע עם קצה פיפטה, שיטה מהירה כדי לתקן את החותם הוא מושך את פיפטה מתוך הרקמה באלכסון ומעלה במהירות גבוהה. אם הגרעין או חלק מהממברנה שוכנים בתוך הקצה, קיימת סכנה של שבירת קרום הפלזמה. במקרה זה, יישום לחץ חיובי קל ותנועה לרוחב יכול לעזור. - שים לב למיקום התא ולכיוון הפרוסה. לאחר הקיבעון ניתן לבדוק את הכיוון המדויק של הפרוסה ואת שלמות התא המלא תחת מיקרוסקופ פלואורסצנטי.
5. חיסון, רכישת תמונה ושחזור מורפולוגי
- לאחר ההקלטה, להעביר את הפרוסות לתוך צלחת 24 באר כדי לתקן את זה paraformaldehyde (PFA) 4% ב 0.1 M פוספט אגירה מלוחים (PBS). דגירה במשך 60 דקות ב RT או לילה ב 4 מעלות צלזיוס, על פי הרגישות של הנוגדנים העיקריים המשמשים. ניתן לאחסן פרוסות ב-PBS של 0.1 מ' וב-0.02% ב-NaN3.
התראה: PFA הוא רעיל. השתמש מתחת למכסה המנוע. - בצע גילוי immunostaining וביוציטין בתוך שבוע של הקלטה על פי פרוטוקולים הוקמה32,33.
הערה: אנו משתמשים בהליך שנמנע מקטע מחדש של הפרוסה כדי לשמור על שלמות התהליכים הדנדריטיים והאקסונליים. עם זאת, הליך זה דורש זמני דגירה ארוכים יותר כמו נוגדנים צריכים לחדור לתוך הרקמה. אנו ממליצים לבדוק את הזמן לחדירה אופטימלית של נוגדנים לתוך הרקמה לפני ביצוע הניסוי. - רכוש תמונות באמצעות מיקרוסקופ קונפוקלי עם מחסנית Z ופונקציית סריקת אריחים.
- בצע שחזור מורפולוגי באמצעות פיג'י imageJ34.
הערה: ניתן לייבא מספר תבניות קובץ תמונה לתוכנית באמצעות תוסף ביו-פורמט. אנו ממליצים על השימוש תוסף מעקב נויריט פשוט (STN)35 לשחזור של דנדריטים ואקסון. ערכת לימוד פשוטה וברורה זמינה https://imagej.net/SNT http://snyderlab.com/2016/05/25/tracing-neurons-using-fiji-imagej/. ניתן להמיר את הקובץ המכיל את נתוני המעקב (.traces), אם נשמר ללא דחיסה, לקובץ טקסט ולפתיחה באמצעות Matlab או תוכנה אחרת לעיבוד נתוני טקסט.
תוצאות
בפרוטוקול זה אנו מתארים כיצד להכין פרוסות היפוקמפוס חריפות מהחלק הגבי-בינוני של ההיפוקמפוס(איור 1A). הפרוטוקול מתאים במיוחד לניסויים החוקרים מנגנונים המעורבים בלמידה מרחבית וניתן לשלבו עם עבודה התנהגותית או אסטרטגיות תיוג או מניפולציה ויראליות בהיפוקמפוס הגבי35. החלת הליך הניתוח המתואר כאן על בעלי החיים מוזרק עם GFP תלויי Cre המביעים וירוס הקשור לאדנו (AAV-FLEX-GFP) לתוך ההיפוקמפוס הגבי של עכברי Pvalb-IRES-Cre בקואורדינטות שונות של ברגמה AP-1.94 מ"מ, ML ± 0.5-2 מ"מ, עומק-1.25-2.25 מ"מ כדי למקד אזורים שונים של היווצרות ההיפוקמפוס36 הצלחנו להשיג לפחות שלוש פרוסות רוחביות המכילות את האזורים הנגועים(איור 1A צבע ירוק בהיר על דגם 3D של ההיפוקמפוס). בנוסף, ניתן להשיג מספר פרוסות לא רוחביות אך בריאות מהחלקים הרוטריאליים יותר של ההיפוקמפוס הגבי(איור 1C).
כדי להדגים את האיכות ואת הכדאיות של הפרוסות שלנו רשמנו פרמטרים אלקטרו-פיזיולוגיים ומורפולוגיים בסיסיים של תאי גרנול ו- tdTomato שכותרתו Parvalbumin חיובי (PV +) interneurons ב gyrus משקע של Pvalb-IRES-Cre; עכברים מהונדסים Ai9 (7-12 שבועות) והשוו אותם להקלטות מפרוסות קורנל מאותו אזור שהושגו בפרוטוקול סטנדרטי.
לאחר בדיקה ויזואלית תחת המיקרוסקופ אינפרא אדום דיפרנציאלי-הפרעה (IR-DIC), כבר שמנו לב להבדלים ברורים בין רוחבי שלנו לבין פרוסת הכתר. בעוד שתאי עצב בשכבת התא העיקרית בפרוסות קורנל נראו לעתים קרובות גסים ומוצגים קווי מתאר מנוגדים מאוד, נוירונים בפרוסה רוחבית הראו בעיקר משטחים חלקים ורק גבולות מנוגדים קלות, המעידים על חיוניות תאית טובה יותר (איור 2A). הסיבה להבדלים אלה בכדאיות התאים בין פרוסות קורונל לפרוסות רוחביות עשויה להימצא בכיוון של המישור המקטע ביחס לשטחי הסיבים. מכיוון שאלה אינם מקבילים בקטעי הקורונה, אקסונים ודנדריטים ינותק. בהתאם להנחה זו, מצאנו כי בתוך הפרוסות מישורי פני השטח של שכבת תאי גרנול והילוס הראו חוסר רציפות גדול יותר בקורונה מאשר הפרוסה הטרנסברסלית (גודל צעד במישורי פני השטח: 41.40 ± 3.28 מיקרומטר לעומת 25.60 ± 2.94 מיקרומטר, ממוצע ± SEM, T-test P = 0.023), מה שמרמז על מידה גדולה יותר של ניתוק רקמות בפרוסת הקורונל(איור 2B). משמעות הדבר היא כי תאים מתאימים להקלטות מלחציים תיקון יימצאו רק במישורים עמוקים יותר של שכבת תא הגרגר לפרוסות קורנל, אשר בתורו עשוי להפחית את התפוקה של הקלטות תיקון מהדק. ואכן, הזמן הממוצע לאטום היווצרות בפרוסה רוחבית שלנו היה מהיר יותר מאשר עבור פרוסות קורנל (תאי גרגר: 12.64± 1.50 s, n=11 בקורונה לעומת 8.40 ± 0.75 שניות, n=14 בפרוסות רוחביות, ממוצע ± SEM, P= 0.0335 מבחן מאן-וויטני; PV+ interneurons: 31.11 ± 2.60 s, n = 9 בקורונה לעומת 22.00 ± 2.18, n = 7 בפרוסות רוחביות, ממוצע ± SEM, P = 0.0283 מאן ויטני מבחן) (איור 2C). בתור פרוקסי עבור שלמות התא ובריאות לאחר מכן רשמנו את פוטנציאל קרום המנוחה (RMP) של תאי גרגר ו PV + interneurons, אשר היו depolarized באופן משמעותי יותר הן בתאי גרנול ו PV + interneurons ב coronal לעומת. פרוסות רוחביות (תאי גרנול:-62.55 ± 3.54 mV, n = 11 בקורונה לעומת-71.06 ± 2.31 mV, n = 14 בפרוסות רוחביות, ממוצע ± SEM, P = 0.0455 בדיקת מאן-ויטני; PV+ interneurons:-52.75 ± 1.66 mV, n = 7 בקורונה לעומת-59.36 ± 2.25 mV, n = 6 בפרוסות רוחביות ממוצע ± SEM,, P = 0.0271 מבחן מאן ויטני) (איור 2D). נתונים אלה מצביעים על מספר גבוה יותר של נוירונים בריאים בהכנה רוחבית לעומת פרוסת קורנל. ואכן, הקדמה של ניתוק עבור RMP מקובל ( -55 mV עבור תאי גרנול;-45 mV עבור PV + interneurons) הביא אחוז גבוה יותר של תאים מודרים בקורונה מאשר פרוסות רוחבי (39.67 ± 8.37 %, n = 3 מפגשים ניסיוניים לעומת. 23.00 ± 3.85 %, n=4 מפגשים ניסיוניים)(איור 2E). יתר על כן, שחזור של מורפולוגיה עצבית מתאי גרנול מוקלטים הצביע על כך שכסיכויים צפויים היו טובים בהרבה לאחזר ארבור אקסונלי מלא לתאי גרנול בפרוסה הטרנסברסלית(איור 3A, B). בנוסף, השחזור המורפולוגי של PV+ interneurons בפרוסות רוחביות איפשר תיאור של ארבורים אקסונליים ודנדריטיים נרחבים, כולל הדמיה של פרטים קטנים כגון קוצים דנדריטיים35(איור 3C).
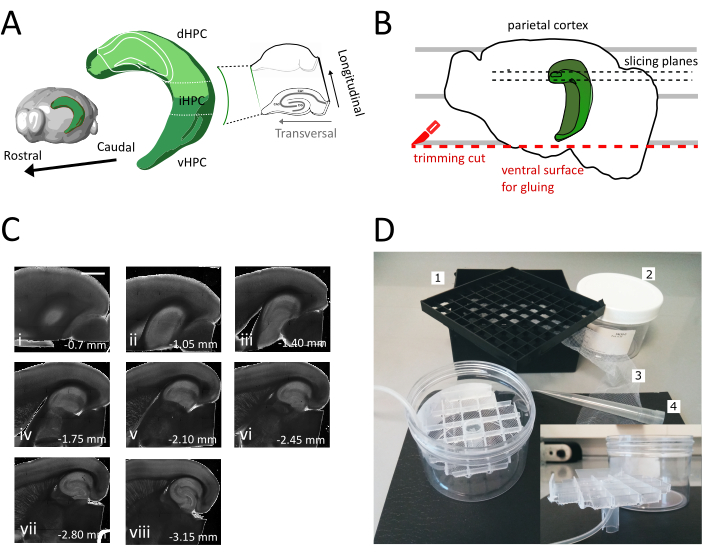
איור 1: איור של הליך הניתוח להשגת פרוסות מהיפוקמפוס הגבי-בינוני. (A) ייצוג תלת מימדי של היווצרות ההיפוקמפוס המציג את האוריינטציה המרחבית שלו במוח (שונה מסייר המוח, מכון אלן)37. חלוקות הגב, הביניים והגחומיות של ההיפוקמפוס (dHPC, iHPC, vHPC) מסומנות, על פי דונג ואח '(2009)7. החלק של היפוקמפוס גב-ביניים כי יהיה פרוס מצוין בירוק בהיר. הכניסה מימין מציגה את הכיוון של צירי ההפניה. (B) קריקטורה של חצי כדור מוח המתאר את היישור של קליפת המוח הקודקודית עם הקווים המקבילים על צלחת פטרי. הקו המקווקו האדום מציין היכן לבצע את חיתוך החיתוך (נקודה 3.9 בפרוטוקול) כדי ליצור את פני השטח להדבקת חצי הכדור על מחזיק הדגימה. הקווים המנוקדים השחורים מציינים היכן נאספות הפרוסות. (C) סדרת תמונות שדה בהיר של פרוסות היפוקמפוס שהושגו בעקבות הליך זה. מפני השטח הפיאליים, הגבי לגחוני: (i) 0.70 מ"מ, (ii) 1.05 מ"מ, (iii) 1.40 מ"מ, (iv) 1.75 מ"מ, (v) 2.10 מ"מ, (vi) 2.45 מ"מ (vii) 2.80 מ"מ, (viii) 3.15 מ"מ. סרגל קנה מידה = 1 מ"מ. (D) תמונה של תא האחסון והחומר הדרוש להרכבתו. 1. רשת מרווח בקבוקון מתיבת אחסון בקבוקון קריוגני 81x, 2. קופסת פלסטיק גלילית. 3. ניילון נטו, 4. טיפ לפיפט. כניסה פנימה. תצוגה רוחבית של הרשת ומחזיק הצינור להכנסה לתיבה הגלילית. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הפרוסה החצי-רוחבית מציגה יכולת קיום משופרת של פרוסות בהשוואה לפרוסת הקורונל. (A)מיקרוגרפים DIC-IR המציגים דוגמאות בריאות (חצים שחורים) ולא בריאים (חצים לבנים) של סומטה עצבית בפרוסות רוחביות וקורונאליות. Hil=הילוס, gcl=שכבת תאי גרנול, מיליליטר= שכבה מולקולרית. סרגל שינוי קנה מידה = 50 מיקרומטר. (B) שני הליכי הסעיף מייצרים צעד בין פני השטח של שכבת תא הגרגר לבין ההילוס (המצוין על ידי ראשי החצים). גובה הצעד מעיד על היקף ניתוק הרקמות והוא נמוך משמעותית בחלקים רוחביים מאשר בקורונה (n = 5 רוחבי ו- n = 5 פרוסות קורנל, ממוצע±SEM, P = 0.0238 מבחן מאן ויטני). (C)זמן היווצרות חותם ג'יגה-אוהם בתאי גרנול (n = 14 תאים רוחביים, n = 11 תאים קורנל; ממוצע±SEM, P = 0.0355, בדיקת מאן-ויטני) ו- PV + INs (n = 7 תאים בפרוסות רוחביות, n = 9 בפרוסות קורנל, ממוצע±SEM, P = 0.0283 מבחן מאן ויטני) פרוסות. (D) פוטנציאל קרום מנוחה (RMP) של תאים טלאים (בהתאמה, n = 14 ו n = 11 תאי גרנול. ממוצע±SEM, P = 0.0455 מבחן מאן ויטני. n=7 PV+ INS ו- n= 10 PV+ INs, P= 0.0271 מבחן מאן-ויטני). (ה)אחוז התאים שהושלכו בהפעלה ניסיונית (n = 3 מפגשים עם פרוסת קורנל, n = 4 עם פרוסה רוחבית, Mean±SEM). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
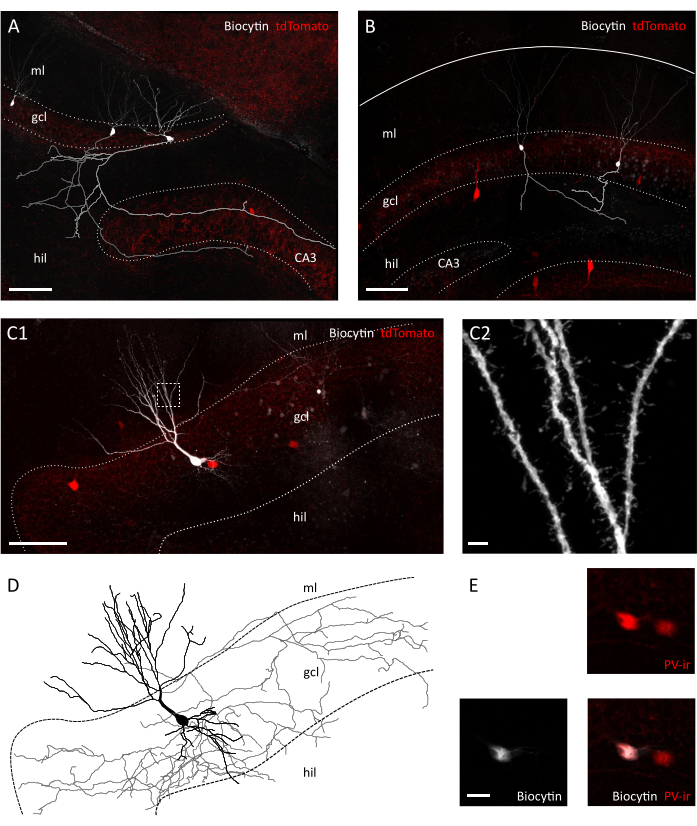
איור 3: שימור מורפולוגי של תאי גרגירים ואינטראורונים בפרוסה רוחבית. תמונות קונפוקליות המציגות תאי גרנול במילוי ביוציטין בפרוסה רוחבית (A) ובפרוסות קורנל(B)של Pvalb-IRES-Cre; עכברים מהונדסים Ai9. האקסונים בהתאמה שוחזרו באפור ואפור בהיר. שים לב להבדל באורך האקסון ובמורכבות בין ההכנות. סרגל קנה מידה = 100 מיקרומטר. (C1) תמונה Confocal מראה אינטרנציונלון tdTomato חיובי מלא biocityn. Hil=hilus, gcl=שכבות תאי גרנול, מיליליטר= שכבה מולקולרית. סרגל קנה מידה = 50 מיקרומטר. (C2) הגדלה של האזור התאגרף ב- C1, מראה קוצים דנדריטיים. סולם בר = 2 מיקרומטר (D) שחזור מורפולוגי של אקסונים ודנדריטים של אינטרנציונלון מילוי ביוציטין ב C1 (אקסון באפור, סומה ודנדריטים בשחור). (ה)תקריב של סומטה של התאים המתוארים ב- C1 מראה קולוקליזציה של ביוציטין ו Parvalbumin-אימונואקטיביות (PVir). סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
ההיפוקמפוס הגבי נחקר בהרחבה על תפקידו בלמידה מרחבית וניווט בעיקר באמצעות ניסויים התנהגותיים, מעקב אנטומי ומניפולציות ספציפיות לאזור. כדי לשלב בחינה פרוסה-אלקטרו-פיזיולוגית עם טכניקות אלה, הרכבנו פרוטוקול המשתמש בזווית דומה של חתך כמו חתך אופקי שונה עבור אזור ביניים-גחוני של ההיפוקמפוס, אך משתמש בסדר חתך הפוך כדי לקבל פרוסות מוקדמות מאזור הגב-ביניים. גישה זו מפחיתה את הזמן הנדרש כדי לחתוך ולאסוף את האזור הגבי של ההיפוקמפוס, ובכך לשפר את הכדאיות פרוסות.
בשיטה זו, אנו מסוגלים לאחזר באופן שגרתי כשלוש פרוסות לכל חצי כדור של אזור ההיפוקמפוס הגבי בין 1.4 מ"מ ל-2.4 מ"מ מפני השטח, כפי שמוצג באיור 1C. למרות שלא ניתן לבצע הליך זה כדי להשיג פרוסות רוחביות מהקוטב המחיצה מאוד של ההיפוקמפוס, ניתן לאסוף כשתי פרוסות נוספות שאינן רוחביות לכל חצי כדור מקוטב המחיצה(איור 1C ii,iii). אם הקוטב המחיצה של ההיפוקמפוס הוא מוקד המחקר העיקרי, פרוטוקולים אחרים, המאפשרים איסוף של פרוסות רוחביות, במיוחד מן הקוטב המחיצה מאוד של ההיפוקמפוס, עשוי להיות מתאים יותר21,32. ניסויים התנהגותיים על ניווט מרחבי ולמידה מבוצעים עדיף בעכברים בוגרים עם קישוריות עצבית מפותחת. כתוצאה מכך, יש לנו אופטימיזציה הליך ההחתכה שלנו עבור היישום למוחם של בעלי חיים בוגרים (מוצג כאן במשך שלושה חודשים עכברים), אשר רגישים יותר ללחץ מאשר הכנה לנוער גמיש. למטרה זו שילבנו מספר אסטרטגיות אשר להפחית את הלחץ היפוקסי המוח נחשף בזמן בין החילוץ ואת המיקום של פרוסות לתוך ACSF מחומצן. פתרון חיתוך מגן הוא ACSF מבוסס NMDG25,27,28 עם Na + נמוך Ca2 + אבל גבוה Mg2 + כדי להפחית נזק excitotoxic ונפיחות התא עקב הפעלה של קולטני NMDA. בנוסף, HEPES מספק אגירה יציבה ותרכובות כגון ascorbate ו פירובט להפחית מתח חמצוני. זלוף טרנס-קרדיאלי עם פתרון חיתוך מגן מצונן ומחומצן מנצל את הרשת נימי צפוף מאוד אספקת המוח במהירות הומוגנית להפחית את הביקוש המטבולי ואת excitotoxicity הנגרמת גלוטמט ברקמת המוח. לאחר מכן כמעט כל השלבים הבאים עריפת ראש מבוצעים בתוך פתרונות מקורר מחומצן כדי לשמור על חילוף החומרים וחוסר חמצן למינימום במהלך ההליך כולו. אסטרטגיות אחרות להפחתת נזק מוחי במהלך ההחתכה קיימות ועשויות להיות תקפות באותהמידה 38. כדי להדגים את איכות ההכנה שלנו, אנו משווים אותו להכנת פרוסת קורנל, אשר משמש בדרך כלל כדי להקליט מן ההיפוקמפוס הגבי. למרות שניתן להשתמש בפרוסות קורנל כדי להשיג הקלטה טובה של מלחציים במדבקה, מספר תאי העצב הלא בריאים והמנותקים גבוה יותר מאשר בפרוסה החצי-רוחבית. בנוסף, שלמות הארבוריזציות האקסונליות והדנדריטיות נשמרת טוב יותר בפרוסה רוחבית. למעשה, שלמותם של אקסונים של תאי גרנול(איור 3A),הפועלים אורתוגונליים לציר האורך של ההיפוקמפוס, משמשת כאינדיקטור למישור חתך רוחבי1.
למילוי נוירונים טלאים, אנו מציעים עמידות באלקטרודה בין 3 ל-5 MΩ. קוטר של קצה של כ 1 מיקרומטר, מאפשר הישג של עמידות חותם טוב במהלך ההקלטה ואיטום מחדש טוב על נסיגת אלקטרודה. הפרט המכריע ביותר הוא למנוע יניקה של חלקים של סומה או גרעין לתוך פיפטה. מסיבה זו, אנו מציעים לכלול צבע אלקסה בתמיסה תאית במידת האפשר. הצבע מאפשר ניטור צורת התא במהלך הקלטה ואיטום מחדש. יתר על כן, הוא מאפשר להעריך את שלמות התא טלאים לאחר קיבעון, אשר יכול לחסוך זמן immunohistochemistry, במקרים של סתימות לא מוצלח. בגלל צבעי אלקסה מרווה עם זמן קיבוע ארוך, אנו מציעים קיבעון קצר במידת האפשר.
עבור immunostaining הבאים, אנו משתמשים בפרוטוקול שאינו דורש חתך מחדש של הפרוסה. אנו ממליצים להפוך את הכתם בתוך שבוע לאחר הקיבעון. ככל שהפרוסות נשארות במקרר זמן רב יותר, כך גדל הסיכוי להשפלת רקמות. אם לא ניתן להימנע מאחסון ארוך, אנו ממליצים להגדיל את ריכוז NaN3 ב- PBS ל- 0.05% ולרענן אותו מדי שבוע. חיסון של הפרוסה כולה פירושו שזמנים הדגירה עם נוגדנים ראשוניים ומשניים להגדיל. בדרך כלל, לחשיפת ביוציטין, דגירה אחת לילה ב 4 מעלות צלזיוס מספיק, אבל אם בשילוב עם הכתמת חלבונים אחרים, כל הליך הכתמת יכול להימשך הרבה יותר זמן. חסימת חדירות ודגרת אנטי גוף צריך להיות אופטימיזציה בנפרד. בדרך כלל, עבור הנוגדן העיקרי, יומיים מספיקים בעוד יום אחד יכול להיות מספיק עבור המשני. אנו ממליצים להגדיל את משך שלבי הכביסה יחד עם דגירה נוגדנים ארוכה יותר, כדי למנוע את הגידול ברקע.
בפרוטוקול זה הצגנו שיטת חתך כדי להשיג פרוסות היפוקמפוס רוחבי או כמעט רוחבי המשמר את הכדאיות העצבית של רקמה בוגרת וגישה מעשית לשחזר את המורפולוגיה ואת הזהות הנוירוכימית של הנוירונים טלאים. שיטה זו יכולה להתבצע בקלות כדי להתאים תוצאות אלקטרו-פיזיולוגיות עם מחקרים אנטומיים והתנהגותיים המתמקדים בחלק הביניים-הגבי של ההיפוקמפוס.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לקרסטין קרוננביטר ודידייה גרמל על הסיוע הטכני. אנו מודים לאמברטו מורלי על הסיוע בתוכנה גרפית ובמתיאס הופה על צילום וידאו ועריכת וידאו. העבודה במעבדה שלנו נתמכה על ידי דויטשה Forschungsgemeinschaft (DFG) FOR2143, SFB 1461 (פרויקט מזהה 434434223) ו GRK2154, המועצה למחקר רפואי מענק G1100546/2 ואוניברסיטת קיל.
Materials
| Name | Company | Catalog Number | Comments |
| 1mL syringes Omnifix-F | Braun melsungen AG | 9161406V | |
| 24 multiwells | SARSTEDT | 8,33,922 | |
| 81x criogenic vial storage box | Fisherscientific | 15-350-107B | storage chamber |
| Alexa Hydrazide dye | Invitrogen | A10436 | |
| Big scissor | Fine science tool | 14010-15 | graefe forceps |
| Biocytin | IRIS biotech. | LS3510.0250 | |
| Borosilicate Glass capillaries | Science products | GB150TF-10 | storage chamber |
| Brush 5 | Leonhardy | 241 | Micro double spatula, L 150 mm, blade width 4 mm |
| Calcium chloride dihydrate | Roth | 5239.2 | aCSF solution |
| Carbon steel microtome blade | feather | C35 | |
| Chloridric acid | Roth | K025.1 | |
| Confocal microscope | Zeiss | LSM880 | with Airyscan |
| Cyanoacrylate glue | UHU | 509141 | |
| Cyanoacrylate glue, n-butyl-ester VetBond | 3M | ||
| EGTA | Roth | 3054.1 | |
| Fiji ImageJ | fiji.sc | ||
| Filter paper 113A | ROTILABO Roth | AP180.1 | |
| Fine tip tweezer | Dumont | 0245fo | |
| Glass becker (150 ml) | ROTILABO Roth | X690.1 | incubation chamber and dissection |
| Glass Petri dishes (10 cm dia.) | ROTILABO Roth | 0690.1 | |
| Glucose | Roth | X997.2 | aCSF solution |
| Heated water bath | Grant Instruments Ltd | SUB14 | |
| HEPES | Roth | 9105.4 | aCSF solution |
| Isofluoran | baxter | 5239.2 | Anesthetic |
| Large spatula | Roth | E286.1 | |
| Magnesium Sulfate heptahydrate | Roth | 8793.2 | aCSF solution |
| Mg-ATP | Sigma Aldrich | A9187 | |
| Microfil | World precision instruments | MF34G | |
| Na2-GTP | Sigma Aldrich | 51120 | |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF solution |
| Normal goat serum | Sigma Aldrich | 566380 | |
| Nylon mesh kit | Warner Instruments | 64-0198 | incubation chamber and storage chamber |
| Paraformaldeyde | Sigma Aldrich | P6148 | |
| Phosphate buffered saline 10X | Panbiotech | P04-53500 | |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | |
| Pipette puller | Sutter instrument | P-2000 | |
| Pipette tips | SARSTEDT | 7,07,62,211 | incubation chamber |
| Plastic box for syringe filters | SUPELCO | 54135-U | storage chamber |
| Potassium Chloride | Roth | 6781.3 | aCSF solution |
| Potassium Gluconate | Roth | P1847 | |
| Probenbecker becker (100 ml) | ROTILABO Roth | HT85.1 | incubation chamber |
| Rounded tip tweezers | Fine science tool | 11051-10 | |
| Sainless steel blade | Gillette | Vibratome | |
| Small scissor | Fine science tool | 14010-10 | mayo scissor straight |
| Sodium Ascorbate | Roth | 3149.2 | aCSF solution |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium Bicarbonate | Roth | 6885.1 | aCSF solution |
| Sodium Chloride | Roth | 3957.1 | aCSF solution |
| Sodium Hydroxide | Roth | K021.1 | |
| Sodium Phosphate monobasicdihydrat | Roth | K300.1 | aCSF solution |
| Sodium Pyruvate | Roth | 8793.2 | aCSF solution |
| Streptavidin conjiugated Alexa 488 | Invitogen | s11223 | |
| Thin spatula | Roth | E286.1 | Double spatula, L 150 mm, blade width 9 mm |
| Transfer pipette | Sarstedt | 861171 | |
| Triton x100 | Roth | 3051.1 | |
| Vibratome | Thermoscientific | Microm HM650V | |
| Filter device for ultrapure water | Merck-Millipore | Milli-Q IQ 7000 |
References
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65 (1), 7-19 (2010).
- David, A., Pierre, L. Hippocampal Neuroanatomy. The Hippocampus Book. , 37-114 (2006).
- Dong, H. W., Swanson, L. W., Chen, L., Fanselow, M. S., Toga, A. W. Genomic-anatomic evidence for distinct functional domains in hippocampal field CA1. Proceedings of the National Academy of Sciences of the United States of America. 106 (28), 11794-11799 (2009).
- Royer, S., Sirota, A., Patel, J., Buzsaki, G. Distinct representations and theta dynamics in dorsal and ventral hippocampus. Journal of Neuroscience. 30 (5), 1777-1787 (2010).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Foggetti, A., Baccini, G., Arnold, P., Schiffelholz, T., Wulff, P. Spiny and Non-spiny Parvalbumin-Positive Hippocampal Interneurons Show Different Plastic Properties. Cell Rep. 27 (13), 3725-3732 (2019).
- Cembrowski, M. S., Spruston, N. Heterogeneity within classical cell types is the rule: lessons from hippocampal pyramidal neurons. Nature Reviews Neuroscience. 20 (4), 193-204 (2019).
- Moser, M. B., Moser, E. I., Forrest, E., Andersen, P., Morris, R. G. Spatial learning with a minislab in the dorsal hippocampus. Proceedings of the National Academy of Sciences of the United States of America. 92 (21), 9697-9701 (1995).
- Pothuizen, H. H., Zhang, W. N., Jongen-Relo, A. L., Feldon, J., Yee, B. K. Dissociation of function between the dorsal and the ventral hippocampus in spatial learning abilities of the rat: a within-subject, within-task comparison of reference and working spatial memory. European Journal of Neuroscience. 19 (3), 705-712 (2004).
- Fredes, F., et al. Ventro-dorsal Hippocampal Pathway Gates Novelty-Induced Contextual Memory Formation. Current Biology. 31 (1), 25-38 (2021).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Andersen, P. Long-lasting facilitation of synaptic transmission. Ciba Foundation Symposium. (58), 87-108 (1977).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. Journal of Neurophysiology. 67 (5), 1346-1358 (1992).
- Walther, H., Lambert, J. D., Jones, R. S., Heinemann, U., Hamon, B. Epileptiform activity in combined slices of the hippocampus, subiculum and entorhinal cortex during perfusion with low magnesium medium. Neurosci Lett. 69 (2), 156-161 (1986).
- Rafiq, A., DeLorenzo, R. J., Coulter, D. A. Generation and propagation of epileptiform discharges in a combined entorhinal cortex/hippocampal slice. Journal of Neurophysiology. 70 (5), 1962-1974 (1993).
- Leutgeb, J. K., Frey, J. U., Behnisch, T. LTP in cultured hippocampal-entorhinal cortex slices from young adult (P25-30) rats. Journal of Neuroscience Methods. 130 (1), 19-32 (2003).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature Protocols. 1 (3), 1235-1247 (2006).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording Synaptic Plasticity in Acute Hippocampal Slices Maintained in a Small-volume Recycling-, Perfusion-, and Submersion-type Chamber System. Journal of Visualized Experiments. (131), e55936 (2018).
- Dougherty, K. A., Islam, T., Johnston, D. Intrinsic excitability of CA1 pyramidal neurones from the rat dorsal and ventral hippocampus. Journal of Physiology. 590 (22), 5707-5722 (2012).
- Tidball, P., et al. Differential ability of the dorsal and ventral rat hippocampus to exhibit group I metabotropic glutamate receptor-dependent synaptic and intrinsic plasticity. Brain and Neuroscience Advances. 1 (1), (2017).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159 (2005).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), e53825 (2018).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Archives. 414 (5), 600-612 (1989).
- Djurisic, M. Minimizing Hypoxia in Hippocampal Slices from Adult and Aging Mice. Journal of Visualized Experiments. (161), e61377 (2020).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. P. Acute Brain Slice Methods for Adult and Aging Animals: Application of Targeted Patch Clamp Analysis and Optogenetics. Patch-Clamp Methods and Protocols, 2nd Edition. 1183, 221-242 (2014).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments. (91), e51706 (2014).
- Norenberg, A., Hu, H., Vida, I., Bartos, M., Jonas, P. Distinct nonuniform cable properties optimize rapid and efficient activation of fast-spiking GABAergic interneurons. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 894-899 (2010).
- Swietek, B., Gupta, A., Proddutur, A., Santhakumar, V. Immunostaining of Biocytin-filled and Processed Sections for Neurochemical Markers. Journal of Visualized Experiments. (118), e54880 (2016).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nature Protocols. 1 (4), 1977-1986 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Longair, M. H., Baker, D. A., Armstrong, J. D. Simple Neurite Tracer: open source software for reconstruction, visualization and analysis of neuronal processes. Bioinformatics. 27 (17), 2453-2454 (2011).
- Murray, A. J., et al. Parvalbumin-positive CA1 interneurons are required for spatial working but not for reference memory. Nature Neuroscience. 14 (3), 297-299 (2011).
- Otis, T. S., Staley, K. J., Mody, I. Perpetual inhibitory activity in mammalian brain slices generated by spontaneous GABA release. Brain Research. 545 (1-2), 142-150 (1991).
- Varela, C., Llano, D. A., Theyel, B. B. An introduction to in vitro slice approaches for the study of neuronal circuitry. Neuromethods. 67, 103-125 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved