Method Article
Preparazione di fette acute dall'ippocampo dorsale per la registrazione a cellule intere e la ricostruzione neuronale nel giro dentato di topi adulti
In questo articolo
Riepilogo
Presentiamo un protocollo per preparare fette acute dall'ippocampo dorsale-intermedio dei topi. Confrontiamo questa preparazione trasversale con l'affezione coronale in termini di qualità delle registrazioni e conservazione delle caratteristiche morfologiche dei neuroni registrati.
Abstract
Sebbene l'architettura generale dell'ippocampo sia simile lungo il suo asse longitudinale, studi recenti hanno rivelato importanti differenze nei criteri molecolari, anatomici e funzionali suggerendo una divisione in diversi sottocircuiti lungo la sua estensione rostro-caudale. A causa della connettività differenziale e della funzione, la distinzione più fondamentale è fatta rispettivamente tra l'ippocampo dorsale e quello ventrale, che sono direttamente coinvolti nell'elaborazione spaziale ed emotiva. Di conseguenza, il lavoro in vivo riguardante la formazione della memoria spaziale si è concentrato sull'ippocampo dorsale.
Al contrario, le registrazioni elettrofisiche in vitro sono state eseguite preferenzialmente su ippocampo intermedio-ventrale, in gran parte motivato da fattori come la vitalità delle fette e l'integrità del circuito. Per consentire la correlazione diretta dei dati in vivo sull'elaborazione spaziale con i dati in vitro abbiamo adattato i precedenti metodi di sezionamento per ottenere fette cerebrali trasversali altamente vitali dall'ippocampo dorsale-intermedio per registrazioni a lungo termine di cellule principali e internauri nel giro dentato. Poiché il comportamento spaziale viene analizzato regolarmente nei topi adulti, abbiamo combinato questa procedura di affezione trasversale con l'uso di soluzioni protettive per migliorare la vitalità del tessuto cerebrale da animali maturi. Usiamo questo approccio per topi di circa 3 mesi di età. Il metodo offre una buona alternativa alla preparazione coronale che viene spesso utilizzata per studi in vitro sull'ippocampo dorsale. Confrontiamo questi due preparati in termini di qualità delle registrazioni e conservazione delle caratteristiche morfologiche dei neuroni registrati.
Introduzione
L'ippocampo è stato ampiamente studiato per il suo ruolo fondamentale in diversi aspetti dell'apprendimento e della memoria, della navigazione spaziale e delle emozioni. Il circuito di base dell'ippocampo, comunemente chiamato "circuito trisinaptico", è una rete lamellare nell'asse trasversale, che è in gran parte conservata lungo l'asse longitudinale1. I contributi dell'ippocampo a vari comportamenti cognitivi ed emotivi probabilmente deriva dalle diverse connessioni che questo circuito di base fa lungo l'asse dorsoventrale con diverse altre regionicerebrali 2,3. Al di là della connettivitàfferente ed efferente, tuttavia, un numero crescente di studi punta verso ulteriori differenze lungo l'asse setto-temporale dell'ippocampo. Tali differenze riguardano l'architettura interna e la connettività, nonché le differenze nei modelli di espressione genica e nella morfologia neuronale4,5,6,7,8.
Considerando l'esistenza di tali differenze nei circuiti di base, è ragionevole selezionare lo specifico sottocircuito ippocampale da indagare in base alle domande che vengono affrontate. Se ad esempio la domanda riguarda meccanismi neuronali coinvolti nell'elaborazione spaziale, l'ippocampo dorsale piuttosto che ventrale è di interesse, anche se i due non agiscono inmodo indipendente in vivo a causa della connettività longitudinale intra-ippocampale9,10,11. In questo senso non solo devono essere prese in considerazione le differenze lungo l'asse longitudinale, ma occorre anche fare attenzione a preservare nel miglior modo possibile i circuiti locali e a lungo raggio. Per la conservazione dei percorsi delle fibre e la connettività è essenziale l'angolo in cui il cervello verrà sessato.
Il primo metodo riportato in letteratura per includere il circuito trysinattico ha prima isolato l'ippocampo dal cervello e poi fatto fette trasversali (perpendicolari agli assi longitudinali) utilizzando un elicotterotissutale 12 e un vibratomo13. I fisiologi successivi preferivano ottenere fette da un intero blocco cerebrale per preservare anche le strutture cerebrali adiacenti collegate all'ippocampo. Per queste preparazioni a blocchi sono stati sviluppati diversi angoli di sezionamento rispetto all'ippocampo, come una preparazione della fetta coronale14 o una preparazione orizzontale della fetta chiamata fetta HEC per preservare le connessioni della corteccia ippocampale-entorinale15,16,17.
In quest'ultima preparazione il lobo parietale viene tagliato con un angolo di 0° o 12° rispetto al piano orizzontale lungo l'asse rostro-caudale per formare la base del blocco. Le fette vengono quindi raccolte a partire dalla superficie ventrale del cervello, consentendo così principalmente il raccolto della regione ippocampale intermedio-ventrale. Questo metodo è diventato la scelta più popolare per gli studi fisiologici e può essere eseguito in modo affidabile seguendo diversiprotocolli pubblicati 18,19,20.
Tuttavia, se l'interesse della ricerca riguarda aspetti specifici dell'apprendimento spaziale, l'ippocampo dorsale può essere la regione di indagine più adatta e sarebbe utile trovare una procedura di affezione di qualità simile per questa regione ippocampale. Sono stati sviluppati pochi protocolli, che si concentrano sul polo rostrale, in grado di soddisfare questa domanda 21,22.
In questo protocollo, invece, descriviamo un approccio per ottenere fette trasversali praticabili dall'ippocampo dorsale-intermedio che utilizza l'angolo di sessaturaprecedentemente descritto per i preparati orizzontali 18,19 (Figura 1A&B). Dimostriamo la qualità di questo protocollo confrontando registrazioni elettrofisiotiche e ricostruzioni morfologiche in questa preparazione con quelle ottenute in fette coronali. Questo protocollo è particolarmente adatto per la combinazione con esperimenti anatomici e comportamentali in topi adulti (tre mesi nel nostro caso).
Protocollo
Tutte le procedure riguardanti animali da esperimento erano conformi alla legge tedesca sul benessere degli animali e approvate dal comitato etico dell'università di Kiel. I topi Parvalbumin-Cre (Pvalb-IRES-Cre)23 (laboratori Jackson, repository numero 008069) sono stati mantenuti come colonie eterozigoti o incrociati con topi reporter Ai9 Cre24 (laboratori Jackson, repository numero 007909). Sono stati utilizzati topi femmine e maschi tra P40-P90. I topi sono stati mantenuti in un ciclo di buio chiaro di 12 ore in condizioni standard di alloggiamento di gruppo e sono stati forniti di cibo e acqua ad libitum.
1. Preparazione di soluzioni
NOTA: Preparare soluzioni fresche per ogni giorno sperimentale utilizzando acqua ultrapura (UPW) (resistività a 25 °C 18,2 MΩcm). Le soluzioni possono essere conservate a 4 °C per un massimo di un giorno. Le soluzioni in magnesio e calcio possono essere conservate separatamente come soluzioni stock da 1 M. Tutte le soluzioni di lavoro devono essere sature di carbogeno (95% O2:5% CO2) per una ossigenazione ottimale e una manutenzione del pH prima e durante l'uso.
- Preparare la soluzione di taglio (500 mL per mouse) (in mM): 92 NMDG, 2,5 KCl, 1,25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 glucosio, 5 Na-ascorbato, 4 Na-piruvato, 0,5 CaCl2·2H2O e 10 MgSO4·7H2O. Titolare a pH 7,4 sotto una cappa chimica con 4-5 mL di acido cloridrico al 16% prima di aggiungere le formazioni divalenti. Ciò eviterà la precipitazione di MgSO4.
NOTA: KCl e NaH2PO4 possono essere conservati come soluzioni 10x a 4°C. Facciamo due singoli lotti di soluzione di taglio. Uno il giorno prima della registrazione (conservato in un congelatore durante la notte per produrre ghiaccio tritato) e uno il giorno della registrazione. - Preparare la soluzione di stoccaggio (250 mL per mouse) (in mM): 92 NaCl, 2,5 KCl, 1.25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 glucosio, 5 Na-ascorbate, 4 Na-piruvato, 2 CaCl2·2H2O e 2 MgSO4·7H2O. Titrate a pH 7.3-7.4 con 1 N NaOH.
NOTA: NaCl, KCl e NaH2PO4 possono essere stoccati come soluzione 10x a 4 °C. - Preparare ACSF per la registrazione (in mM): 122 NaCl, 2,5 KCl, 1,25 NaH2PO4, 24 NaHCO3, 12,5 glucosio, 2 CaCl2·2H2O e 2 MgSO4·7H2O, 2 Na-ascorbate, 4 Na-pyruvate. Titolare pH a 7.3-7.4 con 1 N NaOH.
NOTA: NaCl, KCl e NaH2PO4 possono essere combinati in una soluzione stock 10x a 4°C.
2. Preparazione del banco per l'affezione
- Preparare sul ghiaccio un bicchiere (150 mL) e due piastre di Petri in vetro (diametro 10 cm) e riempirle con la soluzione di taglio fresco. Mantenere la soluzione ossigenata con un dispositivo di gorgogliamento carbogeno (un tubo perforato o una pietra d'aria collegata al sistema carbogeno).
NOTA: La soluzione nel becher verrà utilizzata per la perfusione mentre le piastre di Petri verranno utilizzate durante la procedura di taglio. - Dotare il banco di chirurgia di una lama in acciaio inossidabile, pinzette a punta arrotondata, pinzette a punta fine, grandi forbici, piccole forbici, una grande spatola metallica, una sottile spatola metallica, una spazzola, la piastra vibratoma e la colla cianoacrilato o l'adesivo cianoacrilato n-butil-estere meno tossico. Immergere una lama in acciaio inossidabile e un pezzo di carta da filtro in una delle piastre di Petri di vetro sul ghiaccio. Questo Petri sarà usato per tagliare il cervello. Disegna tre linee parallele sul fondo di una piastra di Petri di plastica e posiziona questa piastra vicino agli strumenti chirurgici.
- Preparare l'insieme per la perfusione trans-cardiale secondo i protocollipubblicati 25.
- Preparare il vibratomo, montando una nuova lama sul portalame e impostare i parametri per il taglio (angolo della lama dal piano orizzontale 17°, ampiezza di oscillazione della lama 1,5 mm, velocità di movimento della lama in avanti a circa 2 mm min-1,frequenza di oscillazione 90 Hz, spessore della sezione 350 μm). Riempire il vassoio del vibratomo con una soluzione di taglio ghiacciato e tenerlo sotto costante ossigenazione.
NOTA: Aggiungiamo il ghiaccio tritato prodotto dal primo lotto di soluzione di taglio alla soluzione di taglio fresco raffreddato per mantenere bassa la temperatura. Prestare attenzione per tenere il ghiaccio lontano dalla lama durante l'affettamento. - Preparare una camera di incubazione riempita con la soluzione di taglio sotto ossigenazione costante. Posizionare la camera in un bagno d'acqua preri riscaldato (35 °C).
NOTA: Un esempio per la camera di incubazione può essere trovato in Edwards e Konnerth (1992)26. - Preparare una camera di stoccaggio a fette riempita con la soluzione di stoccaggio e mantenerla a temperatura ambiente e sotto ossigenazione costante. Nel caso in cui il tessuto esprima una proteina fluorescente o un'opsina attivata dalla luce, è consigliabile mantenere la camera al buio, ad esempio, all'interno di una scatola.
NOTA: una camera di stoccaggio con più pozzi indipendenti è utile per distinguere il livello delle fette lungo l'asse dorsoventrale dell'Ippocampo. È possibile costruire una camera su misura(Figura 1D). Prendi un pezzo di griglia del distanziale del flaconcino da una scatola di stoccaggio criogenica 81x e incolla il fondo su una rete di nylon. Inserire il terzo superiore di una punta in plastica pipetta da 5 mL al centro di questa griglia, in modo che si attacchi per circa 3 cm nella parte inferiore. Questa punta in plastica funge da supporto della griglia e in seguito contiene i tubi dell'aria per l'ossigenazione. Inserire la griglia con il suo supporto in una scatola di plastica cilindrica (ad esempio, imballaggio di filtri per siringhe) in modo che non possa inclinarsi o oscillare. Questo serbatoio conterrà 250 mL di soluzione di stoccaggio.
3. Preparazione di fette ippocampali
- Anestetizzare il mouse in una camera a scatola usando isoflurane (circa 0,5 mL) sotto il cofano. Lasciare riposare il mouse fino a quando la respirazione è lenta e regolare (circa 2-3 minuti). Prova l'assenza di risposte al dolore con le dita dei piedi.
- Eseguire la perfusione trans-cardiale utilizzando 25 mL di soluzione di taglio gassata dal becher sul ghiaccio seguendoi protocolli pubblicati 25,27. Questo passaggio è raccomandato per raffreddare rapidamente il cervello per rallentare rapidamente il metabolismo neuronale.
- Decapitare l'animale usando le grandi forbici e posizionare la testa nella piastra di Petri raffreddata sul ghiaccio contenente la soluzione di taglio.
- Apri la pelle con le forbici fini per esporre il cranio. Fai piccole incisioni laterali nella base del cranio su entrambi i lati del foramen magnum. Quindi tagliare lungo la sutura sagittale a partire dal forame magnum fino a raggiungere la sutura naso-frontale sopra il bulbo olfattivo. Tirare su la forbice durante il taglio sagittale per evitare danni al tessuto cerebrale sottostante.
NOTA: Mantenere la testa immersa nella soluzione di taglio aiuta a liberarla dal sangue e mantiene bassa la temperatura. - Usa la pinzetta arrotondata per tirare su le ossa parietali per esporre il cervello. Prestare attenzione per entrare in possesso e rimuovere anche le meningi. Se lasciati, possono danneggiare il cervello durante l'estrazione.
- Usa la piccola spatola per raccogliere delicatamente il cervello nella seconda piastra di Petri.
- Tagliare il cervello a metà lungo la fessura longitudinale usando la lama pre-refrigerata.
- Utilizzare la grande spatola per sollevare un emisfero dalla soluzione di taglio e sulla piastra di Petri in plastica. Con l'emisfero che giace sulla sua superficie mediale, allineare la corteccia parietale a una delle linee parallele per avere un riferimento per il secondo taglio, come mostrato nella figura 1B.
- Eseguire il secondo taglio nella parte ventrale dell'emisfero posizionando la lama in parallelo alle linee per ottenere la superficie, che viene successivamente utilizzata per incollare il cervello sul supporto del campione (vedere il passaggio successivo), come mostrato nella figura 1B. Riportare l'emisfero nella soluzione di taglio ossigenata della piastra di petri in vetro ed eseguire la stessa procedura sul secondo emisfero.
- Incollare gli emisferi con il lato ventrale appena tagliato sul supporto del campione di vibratomo utilizzando l'adesivo. Mettere alcune gocce di soluzione di taglio sugli emisferi per solidificare la colla e spostare il supporto del campione nel vassoio del vibratomo. In questo modo l'affettamento procederà dalla dorsale all'ippocampo ventrale.
- Rimuovere le prime una o due sezioni non trasversali (Figura 1C, ii-iii) fino a quando l'area di interesse non diventa visibile, quindi iniziare a raccogliere le sezioni.
NOTA: Le fette non trasversali ma utilizzabili e sane possono essere ottenute dall'ippocampo dorsale all'inizio della procedura di affettare (Figura 1C, ii-iii). La raccolta di ogni fetta richiede circa 3-4 minuti. Iniziando il taglio dall'ippocampo dorsale anziché ventrale risparmiamo circa 10 minuti, il che migliora la vitalità delle fette dorsali. - Con una pipetta di plastica (tagliare l'estremità stretta della punta) trasferire ogni fetta nella camera di incubazione (contenente soluzione di taglio a 35 °C) e lasciarla riposare per 12 minuti. Il breve periodo di recupero in soluzione di taglio caldo riduce notevolmente il gonfioreneuronale iniziale, come riportato in Ting et al. Quindi l'utilizzo di un pennello trasferisce la fetta nella camera di stoccaggio (contenente la soluzione di archiviazione a RT) e lasciala riposare fino all'inizio dell'esperimento.
4. Registrazione a celle intere e riempimento della biocitina
NOTA: La descrizione della registrazione del patch-clamp a cellule intere è ridotta qui solo a passaggi chiave che aiutano ad ottenere un buon riempimento di biocitina ed è generalmente applicabile ai neuroni in ACSF. Per i dettagli relativi alle procedure delle registrazioni elettrofisiotiche, è possibile consultare diversialtri protocolli 29,30.
- Scegliere una soluzione intracellulare appropriata in base ai parametri da registrare. Ad esempio, per le misurazioni attuali del morsetto, è possibile utilizzare una soluzione a base di gluconato di potassio (in mM): 135 K-Gluconato, 3 KCl, 10 HEPES, 0,2 EGTA, 10 fosfocreatina-Na2, 4 MgATP, 0,3 Na2-GTP. Regolare il pH a 7,3 con 1 M KOH. L'osmolalità dovrebbe essere di circa 285-290 mOsmol/kg una volta aggiunti 3-5 mg/mL di biocitina.
NOTA: Per monitorare la forma del neurone durante la registrazione, è possibile aggiungere alla soluzione intracellulare 0,3-0,5 μL/mL di 1 mM Alexa Fluor Hydrazide. In questo caso, ricorda per la rivelazione della biocitina, per abbinare il colore del colorante Alexa con la sonda fluorescente accoppiata alla streptavidina. - Preparare elettrodi patch-clamp di ≤1 μm di diametro della punta e resistenza di 3-5 MΩ da capillari borosilicati a parete spessa.
- Avviare il sistema di perfusione della configurazione patch-clamp con una velocità di 2,5-3 mL/min a RT o 35-37 °C e fissare una fetta nella camera con un'ancora a forma di U.
- Identificare la regione cerebrale di interesse e scegliere un neurone sano con il soma di almeno 30-50 μm sotto la superficie della fetta.
NOTA: Il soma di un neurone sano ha una superficie liscia e i bordi della membrana sono leggermente contrastati. Il soma del neurone malsano appare ridotto e altamente contrastato o gonfio e semitrasparente. - Caricare una pipetta di vetro con la soluzione intracellulare fino a coprire la punta dell'elettrodo AgCl. Spostare la pipetta nella soluzione della camera di registrazione, applicando una leggera pressione positiva per mantenere chiara la punta dell'elettrodo di vetro.
NOTA: Se la soluzione contiene un colorante Alexa, la pressione può essere controllata regolando visivamente la quantità di soluzione fluorescente rilasciata dalla punta. Una pressione minima eviterebbe la colorazione del tessuto intorno alla cellula. - Avvicinati alla cellula da un angolo obliquo e stabilisci il contatto entro il primo terzo della superficie del soma quando formi il giga-sigillo. Rilasciare la pressione, spostare lentamente il potenziale di tenuta a-65 mV e applicare un'aspirazione delicata per bocca per facilitare la formazione di giga-tenuta.
- Per stabilire la configurazione a celle intere, applicare un'aspirazione forte e breve per rompere la membrana. Scartare la registrazione se il neurone ha un potenziale di membrana più depolarizzato di-50 mV, se la corrente di tenuta sta aumentando oltre 100 pA o se la resistenza all'accesso aumenta oltre i 30 MΩ.
- Dopo la registrazione (per un riempimento sufficiente di somata e dendriti si raccomandano almeno 15 minuti; per il riempimento di assoni complessi fino aun'ora forse richiesto 31) rimuoverecon cura l'elettrodo. A tal fine impostare il potenziale di tenuta su 0 mV e provare a riformare un giga-sigillante ritraendo lentamente la pipetta nella direzione opposta rispetto all'approccio, in modo da ottenere una configurazione di patch esterna.
NOTA: La presenza del colorante Alexa nelle soluzioni intracellulari aiuta la rimozione visivamente guidata della pipetta dalla superficie neuronale. Se il nucleo della cellula non è in contatto con la punta della pipetta, un metodo rapido per riformare la guarnizione sta estraendo la pipetta dal tessuto in diagonale e verso l'alto ad alta velocità. Se il nucleo o parte della membrana risiede all'interno della punta, c'è il pericolo di rompere la membrana plasmatica. In questo caso, una leggera applicazione di pressione positiva e un movimento laterale possono aiutare. - Si noti la posizione della cella e l'orientamento della sezione. Dopo la fissazione l'orientamento esatto della fetta e l'integrità della cella riempita possono essere controllati al microscopio fluorescente.
5. Immunostaining, acquisizione di immagini e ricostruzione morfologica
- Dopo la registrazione, trasferire le fette in una piastra da 24 po 'per fissarla in paraformaldeide (PFA) 4% in soluzione salina tamponata da fosfati 0,1 M (PBS). Incubare per 60 minuti a RT o durante la notte a 4 °C, in base alla sensibilità degli anticorpi primari utilizzati. Le sezioni possono essere conservate in 0,1 M PBS e 0,02% NaN3.
ATTENZIONE: PFA è tossico. Usa sotto il cofano. - Eseguire l'immunostaining e la rivelazione della biocitina entro una settimana dalla registrazione secondo i protocollistabiliti 32,33.
NOTA: Utilizziamo una procedura che evita la risezione della fetta per preservare l'integrità dei processi dendritici e assonali. Tuttavia, questa procedura richiede tempi di incubazione più lunghi in quanto gli anticorpi devono penetrare nel tessuto. Suggeriamo di testare il tempo per una penetrazione ottimale degli anticorpi nel tessuto prima di eseguire l'esperimento. - Acquisire immagini utilizzando un microscopio confocale con funzione Z-stack e tile-scanning.
- Eseguire la ricostruzione morfologica utilizzando l'immagine FijiJ34.
NOTA: diversi formati di file di immagine possono essere importati nel programma utilizzando il plug-in in formato Bio. Si consiglia l'utilizzo del plugin35 Simple Neurite Tracer (STN) per la ricostruzione dei dendriti e dell'assone. Un tutorial semplice e chiaro è disponibile su https://imagej.net/SNT e http://snyderlab.com/2016/05/25/tracing-neurons-using-fiji-imagej/. Il file contenente i dati di tracciatura(.traces), se salvato non compresso, può essere convertito in un file di testo e aperto con Matlab o altro software per l'elaborazione dei dati di testo.
Risultati
In questo protocollo descriviamo come preparare fette ippocampali acute dalla parte dorsale-intermedia dell'ippocampo (Figura 1A). Il protocollo è particolarmente adatto per esperimenti che indagano i meccanismi coinvolti nell'apprendimento spaziale e possono essere combinati con lavori comportamentali o strategie di etichettatura o manipolazione virale nell'ippocampo dorsale35. Applicando la procedura di sessatura qui descritta agli animali iniettati con GFP cre-dipendente che esprime virus adeno-associato (AAV-FLEX-GFP) nell'ippocampo dorsale dei topi Pvalb-IRES-Cre a diverse coordinate bregma AP-1,94 mm, ML ± 0,5-2 mm, profondità-1,25-2,25 mm per colpire diverse regioni della formazione ippocampale36 siamo riusciti ad ottenere almeno tre fette trasversali contenenti le regioni infette(Figura 1A colorazione verde chiaro sul modello 3D dell'ippocampo). Inoltre, diverse fette non trasversali ma sane possono essere ottenute dalle parti più rostrali dell'ippocampo dorsale (Figura 1C).
Per dimostrare la qualità e la vitalità delle nostre fette abbiamo registrato parametri elettrofisivi e morfologici di base delle cellule granuli e degli internauri parvalbumina-positivi (PV+) etichettati con tdTomato nel giro dentato di Pvalb-IRES-Cre; Topi transgenici Ai9 (7-12 settimane di età) e confrontati con registrazioni da fette coronali della stessa regione ottenute con un protocollo standard.
Al momento dell'ispezione visiva al microscopio IR-DIC (Differential-Interference Contrast), abbiamo già notato chiare differenze tra la nostra fetta trasversale e la fetta coronale. Mentre i neuroni dello strato cellulare principale nelle fette coronali spesso apparivano grossolani e mostravano contorni fortemente contrastanti, i neuroni nella fetta trasversale mostravano principalmente superfici lisce e solo bordi leggermente contrastati, indicativi di una migliore vitalità cellulare (Figura 2A). La ragione di queste differenze nella vitalità cellulare tra fette coronali e trasversali può risiedere nell'orientamento del piano di sezionamento rispetto ai tratti di fibra. Poiché questi non sono in parallelo nelle sezioni coronali, gli assoni e i dendriti saranno recisi. In linea con questa ipotesi, abbiamo scoperto che all'interno delle fette i piani superficiali dello strato cellulare granulo e dell'ilo mostravano una maggiore discontinuità nel coronale rispetto alla fetta trasversale (dimensione del passo nei piani di superficie: 41,40 ± 3,28 μm vs 25,60 ± 2,94 μm, Media ± SEM, test T non accoppiato P = 0,023), suggerendo un grado maggiore di disconnessione dei tessuti nella fetta coronale (Figura 2B). Ciò significa che le celle adatte per le registrazioni patch-clamp si trovano solo su piani più profondi dello strato di cellule granuli per fette coronali, il che a sua volta può ridurre la velocità effettiva delle registrazioni patch-clamp. Infatti, il tempo medio per sigillare la formazione nella nostra fetta trasversale è stato più rapido che per le fette coronali (cellule granuli: 12,64± 1,50 s, n=11 in coronale contro 8,40 ± 0,75 s, n=14 in fette trasversali, media ± SEM, P= 0,0335 test Mann-Whitney; Internatori PV+: 31,11 ± 2,60 s, n=9 in coronale contro 22,00 ± 2,18, n=7 in fette trasversali, media ± SEM, P= 0,0283 test Mann-Whitney) (Figura 2C). Come proxy per l'integrità e la salute delle cellule abbiamo quindi registrato i potenziali della membrana a riposo (RMP) delle cellule granuli e degli internaurioni PV +, che erano significativamente più depolarizzati sia nelle cellule granuli che negli internauri PV + in coronale vs. fette trasversali (celle granuli:-62,55 ± 3,54 mV, n=11 in coronale vs.-71,06 ± 2,31 mV, n=14 in fette trasversali, media ± SEM, P=0,0455 test Mann-Whitney; Internatori PV+:-52,75 ± 1,66 mV, n=7 in coronale vs.-59,36 ± 2,25 mV, n=6 in fette trasversali Media ± SEM,, P= 0,0271 Test Mann-Whitney) (Figura 2D). Questi dati suggeriscono un numero maggiore di neuroni sani nella preparazione trasversale rispetto alla fetta coronale. In effetti, l'introduzione di un cut-off per l'RMP accettabile (-55 mV per le cellule granuli;-45 mV per gli internauroni PV+) ha comportato una percentuale più elevata di cellule escluse in coronale rispetto alle fette trasversali (39,67 ± 8,37 %, n=3 sessioni sperimentali vs. 23,00 ± 3,85 %, n=4 sessioni sperimentali)(figura 2E). Inoltre, la ricostruzione della morfologia neuronale dalle cellule granuli registrate ha indicato che, come previsto, le possibilità erano molto migliori per recuperare un arborizzazione assonale completo per le cellule granuli nella fetta trasversale (Figura 3A, B). Inoltre, la ricostruzione morfologica degli internauri PV+ nelle fette trasversali ha permesso la rappresentazione di ampie arborizzazioni assonali e dendritiche tra cui la visualizzazione di piccoli dettagli come le spine dendritiche35(Figura 3C).
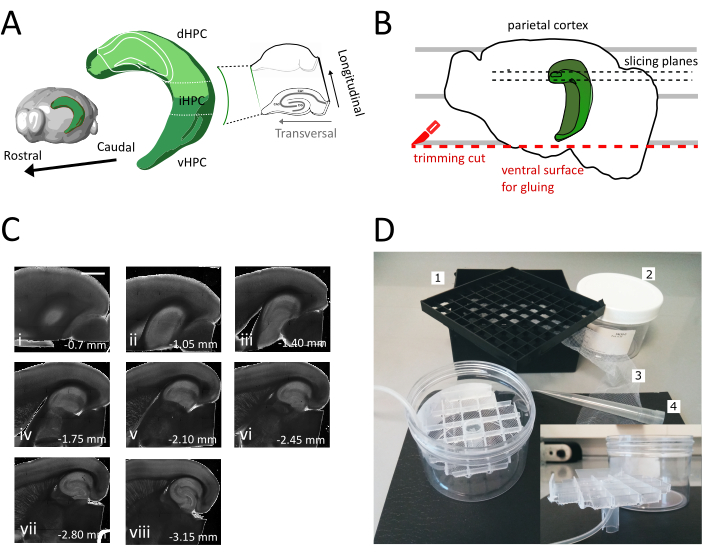
Figura 1: Illustrazione della procedura di sezionamento per ottenere fette dall'ippocampo dorsale-intermedio. (A) Rappresentazione tridimensionale della formazione ippocampale che mostra il suo orientamento spaziale nel cervello (modificato da Esploratore cerebrale, Allen Institute)37. Le divisioni dorsali, intermedie e ventrali dell'ippocampo (dHPC, iHPC, vHPC) sonoindicate, secondo Dong et al. La parte dell'ippocampo dorsale-intermedio che verrà affettata è indicata in verde chiaro. L'interno a destra mostra l'orientamento degli assi di riferimento. (B) Cartone animato di un emisfero cerebrale raffigurante l'allineamento della corteccia parietale con le linee parallele sulla piastra di Petri. La linea tratteggiata rossa indica dove eseguire il taglio di rifilatura (punto 3.9 nel protocollo) per creare la superficie per l'incollaggio dell'emisfero sul supporto del campione. Le linee tratteggiate nere indicano dove vengono raccolte le fette. (C) Serie di immagini a campo brillante di fette ippocampali ottenute a seguito di questa procedura. Dalla superficie piale, dorsale a ventrale: (i) 0,70 mm, (ii) 1,05 mm, (iii) 1,40 mm, (iv) 1,75 mm, (v) 2,10 mm, (vi) 2,45 mm (vii) 2,80 mm, (viii) 3,15 mm. Barra di scala= 1 mm. (D) Foto della camera di stoccaggio e del materiale necessario per il suo assemblaggio. 1. Griglia del distanziale del flaconcino da una scatola di stoccaggio criogenica 81x del flaconcino, 2. Scatola di plastica cilindrica. 3. Rete di nylon, 4. Punta pipetta. inserire. Vista laterale della griglia e del portatubi da inserire nella scatola cilindrica. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: La fetta trasversale mostra una maggiore vitalità della fetta rispetto alla fetta coronale. (A) Micrografie DIC-IR che mostrano esempi sani (frecce nere) e malsani (frecce bianche) di somi neuronali in fette trasversali e coronali. Hil=hilus, gcl=strato di cellule granuli, ml= strato molecolare. Barra di scala = 50 μm. (B) Entrambe le procedure di sezionalità producono un passo tra la superficie dello strato di cellule granuli e l'ilo (indicato dalle punte di freccia). L'altezza del passo è indicativa dell'estensione della disconnessione dei tessuti ed è significativamente inferiore nelle sezioni trasversali che in coronale (n=5 fette trasversali e n=5 fette coronali, Mean±SEM, P=0.0238 Mann-Whitney test). (C) Tempo di formazione di foche giga-ohm nelle cellule granuli (n=14 cellule in trasversali, n=11 cellule coronali; Fette media±SEM, P= 0,0355, test Mann-Whitney) e PV+ (n=7 celle in trasversali, n=9 celle in fette coronali, Mean±SEM, P= 0,0283 test Mann-Whitney). (D) Potenziale di membrana a riposo (RMP) di cellule patchate (rispettivamente, n= 14 e n=11 celle granuliche. Test ±SEM, P=0,0455 Mann-Whitney. n=7 IN PV+ e n=10 IN PV+, P= 0,0271 Test Mann-Whitney). (E) Percentuale di celle scartate all'interno di una sessione sperimentale (n=3 sessioni con fetta coronale, n=4 con sezione trasversale, Mean±SEM). Clicca qui per visualizzare una versione più grande di questa figura.
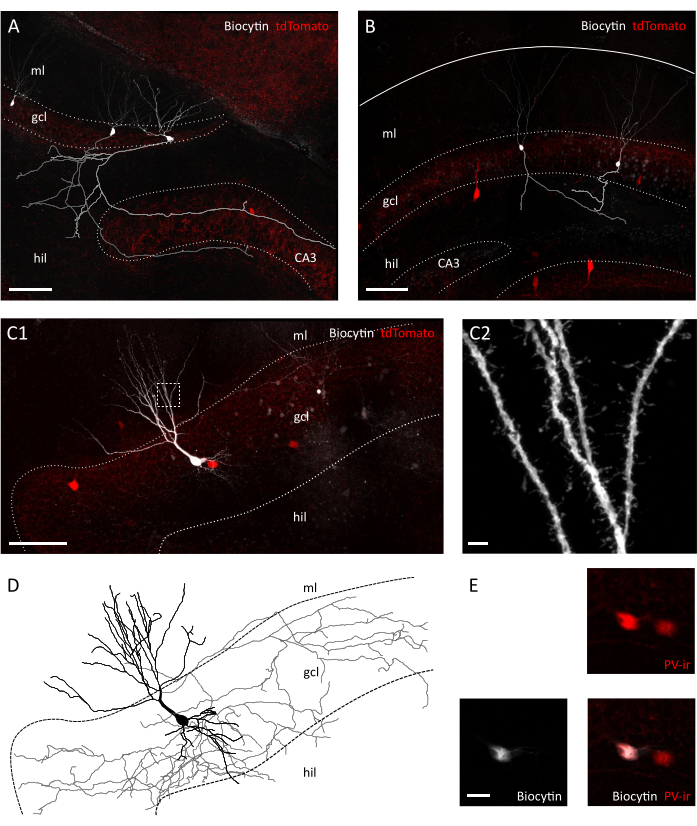
Figura 3: Conservazione morfologica delle cellule granuli e degli internanti nella fetta trasversale. Immagini confocali che mostrano cellule granuli riempite di biocitina in una fetta trasversale (A) e in una fetta coronale (B) di Pvalb-IRES-Cre; Topi transgenici Ai9. I rispettivi assoni sono stati ricostruiti in grigio e grigio chiaro. Si noti la differenza di lunghezza dell'assone e complessità tra i preparati. Scale bar=100 μm. (C1) Immagine confocale che mostra un interno positivo al pomodoro pieno di biocityn. Hil=hilus, gcl=strati di cellule granuli, ml= strato molecolare. Scale bar=50 μm. (C2) Ingrandimento dell'area in scatola in C1, che mostra spine dendritiche. Scale bar=2 μm (D) Ricostruzione morfologica di assoni e dendriti dell'internauron riempito di biocitina in C1 (assone in grigio, soma e dendriti in nero). (E) Primo primo dei somi delle cellule raffigurate in C1 che mostrano la colocalizzazione della biocitina e della parvalbumina-immunoreattività (PVir). Scale bar=20 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
L'ippocampo dorsale è stato ampiamente studiato per il suo ruolo nell'apprendimento spaziale e nella navigazione principalmente attraverso esperimenti comportamentali, tracciamento anatomico e manipolazioni specifiche della regione. Per combinare le richieste elettrofisifiche a fette con queste tecniche, abbiamo assemblato un protocollo che utilizza un angolo di sezionamento simile a quello dell'affettamento orizzontale modificato per la regione intermedio-ventrale dell'ippocampo, ma utilizza un ordine di affezione invertito per ottenere fette precoci dalla regione dorsale-intermedia. Questo approccio riduce il tempo necessario per affettare e raccogliere la regione dorsale dell'ippocampo, migliorando così la vitalità delle fette.
Utilizzando questo metodo, siamo in grado di recuperare regolarmente circa tre fette per emisfero della regione ippocampale dorsale tra 1,4 mm e 2,4 mm dalla superficie piale, come mostrato nella Figura 1C. Sebbene non sia possibile con questa procedura ottenere fette trasversali dal polo molto setto dell'ippocampo, è possibile raccogliere circa due fette aggiuntive non trasversali praticabili per emisfero dal polo setto(Figura 1C ii,iii). Se il polo setto dell'ippocampo è il principale obiettivo di ricerca, altri protocolli, che consentono la raccolta di fette trasversali, specialmente dal polo molto setto dell'ippocampo, possono essere più adatti21,32. Gli esperimenti comportamentali sulla navigazione spaziale e sull'apprendimento sono preferibilmente effettuati in topi maturi con connettività neuronale completamente sviluppata. Di conseguenza, abbiamo ottimizzato la nostra procedura di affezione per l'applicazione al cervello di animali adulti (mostrati qui per topi di tre mesi), che sono più sensibili allo stress rispetto alla preparazione giovanile resiliente. A tal fine abbiamo combinato diverse strategie che riducono lo stress ipossico a cui il cervello è esposto nel tempo tra l'estrazione e il posizionamento delle fette nell'ACSF ossigenato. La soluzione di taglio protettivo è un ACSF25 , 27,28 con Na+ basso e Ca2+ ma mg2+ alto per ridurre i danni eccitotossici e il gonfiore cellulare dovuto all'attivazione dei recettori NMDA. Inoltre, l'HEPES fornisce una tamponatura stabile e composti come il ascorbato e il piruvato riducono lo stress ossidativo. La perfusione trans-cardiale con la soluzione protettiva di taglio refrigerata e ossigenata sfrutta la rete capillare estremamente densa che fornisce al cervello per ridurre rapidamente e in modo omogeneo la domanda metabolica e l'eccitotossicità indotta dal glutammato nel tessuto cerebrale. Successivamente quasi tutti i passaggi successivi alla decapitazione vengono eseguiti all'interno delle soluzioni raffreddate e ossigenate per mantenere il metabolismo e la privazione di ossigeno al minimo durante l'intera procedura. Esistono altre strategie per ridurre i danni cerebrali durante l'affezione e possono essereugualmente valide 38. Per dimostrare la qualità della nostra preparazione, la confrontiamo con una preparazione di fette coronali, che è comunemente usata per registrare dall'ippocampo dorsale. Anche se le fette coronali possono essere utilizzate per ottenere una buona registrazione patch-clamp nel giro dentato, il numero di neuroni malsani e scollegati è più alto che nella fetta trasversale. Inoltre, l'integrità delle arborizzazioni assonali e dendritiche è meglio preservata nella fetta trasversale. È un dato di fatto che l'integrità degli assoni cellulari granuli (Figura 3A), che corrono ortogonali all'asse longitudinale dell'ippocampo funge da indicatore di un piano trasversale di affettamento1.
Per il riempimento dei neuroni patchati, suggeriamo una resistenza agli elettrodi compresa tra 3 e 5 MΩ. Un diametro della punta di circa 1 μm, consente il raggiungimento di una buona resistenza alla tenuta durante la registrazione e una buona risigillazione alla retrazione dell'elettrodo. Il dettaglio più cruciale è quello di evitare l'aspirazione di parti del soma o del nucleo nella pipetta. Per questo motivo, suggeriamo di includere un colorante Alexa nella soluzione intracellulare quando possibile. Il colorante consente di monitorare la forma della cella durante la registrazione e la risigillatura. Inoltre, consente di valutare l'integrità della cellula patchata dopo la fissazione, che può risparmiare tempo di immunoistochimica, in caso di otturazioni non riusciti. A causa di Alexa i coloranti vengono spenti con un lungo tempo di fissazione, suggeriamo una breve fissazione, se possibile.
Per l'immunosocienza successiva, utilizziamo un protocollo che non richiede la risezione della fetta. Si consiglia di effettuare la colorazione entro una settimana dalla fissazione. Più a lungo le fette rimangono in frigo, maggiore è la probabilità di degradazione dei tessuti. Se non è possibile evitare un lungo stoccaggio, suggeriamo di aumentare la concentrazione di NaN3 nel PBS allo 0,05% e di aggiornarla settimanalmente. L'immunosocinazione dell'intera fetta significa che i tempi di incubazione con anticorpi primari e secondari aumentano. Di solito, per rivelare la biocitina, è sufficiente un'incubazione notturna a 4 °C, ma se combinata con la colorazione per altre proteine, l'intera procedura di colorazione può durare molto più a lungo. Il blocco della permeabilità e l'incubazione anti-corpo devono essere ottimizzati individualmente. Di solito, per l'anticorpo primario, due giorni sono sufficienti mentre un giorno può essere sufficiente per il secondario. Si consiglia di aumentare la durata delle fasi di lavaggio insieme a incubazioni anticorpali più lunghe per evitare l'aumento dello sfondo.
In questo protocollo abbiamo presentato un metodo di affettare per ottenere fette ippocampali trasversali o quasi trasversali preservando la vitalità neuronale del tessuto adulto e un approccio pratico per recuperare la morfologia e l'identità neurochimica dei neuroni patchati. Questo metodo può essere facilmente eseguito per abbinare i risultati elettrofisiologici con studi anatomici e comportamentali incentrati sulla parte intermedio-dorsale dell'ippocampo.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Kerstin Kronenbitter e Didier Gremelle per l'assistenza tecnica. Ringraziamo Umberto Morelli per l'assistenza con software grafico e Mathias Hoppe per la videografia e il video-editing. Il lavoro nel nostro laboratorio è stato supportato dalla Deutsche Forschungsgemeinschaft (DFG) FOR2143, SFB 1461 (Project-ID 434434223) e GRK2154, il Medical Research Council grant G1100546/2 e Kiel University.
Materiali
| Name | Company | Catalog Number | Comments |
| 1mL syringes Omnifix-F | Braun melsungen AG | 9161406V | |
| 24 multiwells | SARSTEDT | 8,33,922 | |
| 81x criogenic vial storage box | Fisherscientific | 15-350-107B | storage chamber |
| Alexa Hydrazide dye | Invitrogen | A10436 | |
| Big scissor | Fine science tool | 14010-15 | graefe forceps |
| Biocytin | IRIS biotech. | LS3510.0250 | |
| Borosilicate Glass capillaries | Science products | GB150TF-10 | storage chamber |
| Brush 5 | Leonhardy | 241 | Micro double spatula, L 150 mm, blade width 4 mm |
| Calcium chloride dihydrate | Roth | 5239.2 | aCSF solution |
| Carbon steel microtome blade | feather | C35 | |
| Chloridric acid | Roth | K025.1 | |
| Confocal microscope | Zeiss | LSM880 | with Airyscan |
| Cyanoacrylate glue | UHU | 509141 | |
| Cyanoacrylate glue, n-butyl-ester VetBond | 3M | ||
| EGTA | Roth | 3054.1 | |
| Fiji ImageJ | fiji.sc | ||
| Filter paper 113A | ROTILABO Roth | AP180.1 | |
| Fine tip tweezer | Dumont | 0245fo | |
| Glass becker (150 ml) | ROTILABO Roth | X690.1 | incubation chamber and dissection |
| Glass Petri dishes (10 cm dia.) | ROTILABO Roth | 0690.1 | |
| Glucose | Roth | X997.2 | aCSF solution |
| Heated water bath | Grant Instruments Ltd | SUB14 | |
| HEPES | Roth | 9105.4 | aCSF solution |
| Isofluoran | baxter | 5239.2 | Anesthetic |
| Large spatula | Roth | E286.1 | |
| Magnesium Sulfate heptahydrate | Roth | 8793.2 | aCSF solution |
| Mg-ATP | Sigma Aldrich | A9187 | |
| Microfil | World precision instruments | MF34G | |
| Na2-GTP | Sigma Aldrich | 51120 | |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF solution |
| Normal goat serum | Sigma Aldrich | 566380 | |
| Nylon mesh kit | Warner Instruments | 64-0198 | incubation chamber and storage chamber |
| Paraformaldeyde | Sigma Aldrich | P6148 | |
| Phosphate buffered saline 10X | Panbiotech | P04-53500 | |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | |
| Pipette puller | Sutter instrument | P-2000 | |
| Pipette tips | SARSTEDT | 7,07,62,211 | incubation chamber |
| Plastic box for syringe filters | SUPELCO | 54135-U | storage chamber |
| Potassium Chloride | Roth | 6781.3 | aCSF solution |
| Potassium Gluconate | Roth | P1847 | |
| Probenbecker becker (100 ml) | ROTILABO Roth | HT85.1 | incubation chamber |
| Rounded tip tweezers | Fine science tool | 11051-10 | |
| Sainless steel blade | Gillette | Vibratome | |
| Small scissor | Fine science tool | 14010-10 | mayo scissor straight |
| Sodium Ascorbate | Roth | 3149.2 | aCSF solution |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium Bicarbonate | Roth | 6885.1 | aCSF solution |
| Sodium Chloride | Roth | 3957.1 | aCSF solution |
| Sodium Hydroxide | Roth | K021.1 | |
| Sodium Phosphate monobasicdihydrat | Roth | K300.1 | aCSF solution |
| Sodium Pyruvate | Roth | 8793.2 | aCSF solution |
| Streptavidin conjiugated Alexa 488 | Invitogen | s11223 | |
| Thin spatula | Roth | E286.1 | Double spatula, L 150 mm, blade width 9 mm |
| Transfer pipette | Sarstedt | 861171 | |
| Triton x100 | Roth | 3051.1 | |
| Vibratome | Thermoscientific | Microm HM650V | |
| Filter device for ultrapure water | Merck-Millipore | Milli-Q IQ 7000 |
Riferimenti
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65 (1), 7-19 (2010).
- David, A., Pierre, L. Hippocampal Neuroanatomy. The Hippocampus Book. , 37-114 (2006).
- Dong, H. W., Swanson, L. W., Chen, L., Fanselow, M. S., Toga, A. W. Genomic-anatomic evidence for distinct functional domains in hippocampal field CA1. Proceedings of the National Academy of Sciences of the United States of America. 106 (28), 11794-11799 (2009).
- Royer, S., Sirota, A., Patel, J., Buzsaki, G. Distinct representations and theta dynamics in dorsal and ventral hippocampus. Journal of Neuroscience. 30 (5), 1777-1787 (2010).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Foggetti, A., Baccini, G., Arnold, P., Schiffelholz, T., Wulff, P. Spiny and Non-spiny Parvalbumin-Positive Hippocampal Interneurons Show Different Plastic Properties. Cell Rep. 27 (13), 3725-3732 (2019).
- Cembrowski, M. S., Spruston, N. Heterogeneity within classical cell types is the rule: lessons from hippocampal pyramidal neurons. Nature Reviews Neuroscience. 20 (4), 193-204 (2019).
- Moser, M. B., Moser, E. I., Forrest, E., Andersen, P., Morris, R. G. Spatial learning with a minislab in the dorsal hippocampus. Proceedings of the National Academy of Sciences of the United States of America. 92 (21), 9697-9701 (1995).
- Pothuizen, H. H., Zhang, W. N., Jongen-Relo, A. L., Feldon, J., Yee, B. K. Dissociation of function between the dorsal and the ventral hippocampus in spatial learning abilities of the rat: a within-subject, within-task comparison of reference and working spatial memory. European Journal of Neuroscience. 19 (3), 705-712 (2004).
- Fredes, F., et al. Ventro-dorsal Hippocampal Pathway Gates Novelty-Induced Contextual Memory Formation. Current Biology. 31 (1), 25-38 (2021).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Andersen, P. Long-lasting facilitation of synaptic transmission. Ciba Foundation Symposium. (58), 87-108 (1977).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. Journal of Neurophysiology. 67 (5), 1346-1358 (1992).
- Walther, H., Lambert, J. D., Jones, R. S., Heinemann, U., Hamon, B. Epileptiform activity in combined slices of the hippocampus, subiculum and entorhinal cortex during perfusion with low magnesium medium. Neurosci Lett. 69 (2), 156-161 (1986).
- Rafiq, A., DeLorenzo, R. J., Coulter, D. A. Generation and propagation of epileptiform discharges in a combined entorhinal cortex/hippocampal slice. Journal of Neurophysiology. 70 (5), 1962-1974 (1993).
- Leutgeb, J. K., Frey, J. U., Behnisch, T. LTP in cultured hippocampal-entorhinal cortex slices from young adult (P25-30) rats. Journal of Neuroscience Methods. 130 (1), 19-32 (2003).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature Protocols. 1 (3), 1235-1247 (2006).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording Synaptic Plasticity in Acute Hippocampal Slices Maintained in a Small-volume Recycling-, Perfusion-, and Submersion-type Chamber System. Journal of Visualized Experiments. (131), e55936 (2018).
- Dougherty, K. A., Islam, T., Johnston, D. Intrinsic excitability of CA1 pyramidal neurones from the rat dorsal and ventral hippocampus. Journal of Physiology. 590 (22), 5707-5722 (2012).
- Tidball, P., et al. Differential ability of the dorsal and ventral rat hippocampus to exhibit group I metabotropic glutamate receptor-dependent synaptic and intrinsic plasticity. Brain and Neuroscience Advances. 1 (1), (2017).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159 (2005).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), e53825 (2018).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Archives. 414 (5), 600-612 (1989).
- Djurisic, M. Minimizing Hypoxia in Hippocampal Slices from Adult and Aging Mice. Journal of Visualized Experiments. (161), e61377 (2020).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. P. Acute Brain Slice Methods for Adult and Aging Animals: Application of Targeted Patch Clamp Analysis and Optogenetics. Patch-Clamp Methods and Protocols, 2nd Edition. 1183, 221-242 (2014).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments. (91), e51706 (2014).
- Norenberg, A., Hu, H., Vida, I., Bartos, M., Jonas, P. Distinct nonuniform cable properties optimize rapid and efficient activation of fast-spiking GABAergic interneurons. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 894-899 (2010).
- Swietek, B., Gupta, A., Proddutur, A., Santhakumar, V. Immunostaining of Biocytin-filled and Processed Sections for Neurochemical Markers. Journal of Visualized Experiments. (118), e54880 (2016).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nature Protocols. 1 (4), 1977-1986 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Longair, M. H., Baker, D. A., Armstrong, J. D. Simple Neurite Tracer: open source software for reconstruction, visualization and analysis of neuronal processes. Bioinformatics. 27 (17), 2453-2454 (2011).
- Murray, A. J., et al. Parvalbumin-positive CA1 interneurons are required for spatial working but not for reference memory. Nature Neuroscience. 14 (3), 297-299 (2011).
- Otis, T. S., Staley, K. J., Mody, I. Perpetual inhibitory activity in mammalian brain slices generated by spontaneous GABA release. Brain Research. 545 (1-2), 142-150 (1991).
- Varela, C., Llano, D. A., Theyel, B. B. An introduction to in vitro slice approaches for the study of neuronal circuitry. Neuromethods. 67, 103-125 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon