Method Article
Preparação de fatias agudas do hipocampo dorsal para gravação de células inteiras e reconstrução neuronal no giro dentado de camundongos adultos
Neste Artigo
Resumo
Apresentamos um protocolo para preparar fatias agudas do hipocampo dorsal-intermediário de camundongos. Comparamos esta preparação transversal com o corte coronal em termos de qualidade de gravações e preservação de características morfológicas de neurônios registrados.
Resumo
Embora a arquitetura geral do hipocampo seja semelhante ao longo de seu eixo longitudinal, estudos recentes revelaram diferenças proeminentes nos critérios moleculares, anatômicos e funcionais sugerindo uma divisão em diferentes sub-circuitos ao longo de sua extensão rostro-caudal. Devido à conectividade diferencial e à função, a distinção mais fundamental é feita entre o hipocampo dorsal e o hipocampo ventral, que estão preferencialmente envolvidos no processamento espacial e emocional, respectivamente. Assim, o trabalho in vivo em relação à formação da memória espacial tem focado no hipocampo dorsal.
Em contraste, gravações eletro-fisiológicas in vitro têm sido realizadas preferencialmente no hipocampo inter-ventral, em grande parte motivado por fatores como viabilidade de fatias e integridade do circuito. Para permitir a correlação direta dos dados in vivo sobre o processamento espacial com dados in vitro, adaptamos métodos de secção anteriores para obter fatias cerebrais transversais altamente viáveis do hipocampo dorsal-intermediário para gravações de longo prazo de células principais e interneurônios no giro dentado. Como o comportamento espacial é rotineiramente analisado em camundongos adultos, combinamos este procedimento de corte transversal com o uso de soluções protetoras para aumentar a viabilidade do tecido cerebral de animais maduros. Usamos essa abordagem para camundongos de cerca de 3 meses de idade. O método oferece uma boa alternativa à preparação coronal que é frequentemente usada para estudos in vitro no hipocampo dorsal. Comparamos essas duas preparações em termos de qualidade de gravações e preservação de características morfológicas de neurônios registrados.
Introdução
O hipocampo tem sido estudado extensivamente por seu papel fundamental em diferentes aspectos da aprendizagem e memória, navegação espacial e emoção. O circuito básico do hipocampo, comumente chamado de "circuito trissinápico", é uma rede lamelar no eixo transversal, que é amplamente preservada ao longo do eixo longitudinal1. As contribuições do hipocampo para diversos comportamentos cognitivos e emocionais provavelmente surgem das diversas conexões que este circuito básico faz ao longo do eixo dorsoventral com várias outras regiões cerebrais2,3. Além da conectividade diferente e eferente, no entanto, um número crescente de estudos aponta para novas diferenças ao longo do eixo septo-temporal do hipocampo. Tais diferenças dizem respeito à arquitetura interna e conectividade, bem como diferenças nos padrões de expressão genética e morfologia neuronal4,5,6,7,8.
Considerando a existência de tais diferenças nos circuitos básicos, é razoável selecionar o subsal hipocampal específico a ser investigado de acordo com as questões que são abordadas. Se, por exemplo, a questão diz respeito aos mecanismos neuronais envolvidos no processamento espacial, o hipocampo dorsal e não o hipocampo ventral é de interesse, embora os dois não atuem de forma independente in vivo devido à conectividade longitudinal intra-hipocampal9,10,11. Nesse sentido, não apenas as diferenças ao longo do eixo longitudinal devem ser consideradas, mas também é necessário cuidado para preservar os circuitos locais e de longo alcance possível. Para a preservação dos caminhos de fibras e conectividade o ângulo em que o cérebro será seccionado é essencial.
O primeiro método relatado na literatura para incluir o circuito trysinaptic primeiro isolou o hipocampo do cérebro e, em seguida, fez fatias transversais (perpendiculares aos eixos longitudinais) usando um helicóptero de tecido12 e um vibratome13. Fisiologistas posteriores preferiram obter fatias de um bloco cerebral inteiro para preservar também as estruturas cerebrais adjacentes ligadas ao hipocampo. Para estas preparações de blocos, foram desenvolvidos diferentes ângulos de secção em relação ao hipocampo, como uma preparação de fatia coronal14 ou uma preparação de fatia horizontal chamada fatia HEC para preservar as conexões do córtex hipocampal-entorhinal15,16,17.
Nesta última preparação, o lobo parietal é cortado com um ângulo de 0° ou 12° em relação ao plano horizontal ao longo do eixo rostro-caudal para formar a base do bloco. As fatias são então coletadas a partir da superfície ventral do cérebro, permitindo, assim, principalmente a colheita da região hipocampal hipocampal inter-ventral. Este método tornou-se a escolha mais popular para estudos fisiológicos e pode ser realizado de forma confiável após vários protocolos publicados18,19,20.
No entanto, se o interesse da pesquisa diz respeito a aspectos específicos da aprendizagem espacial, o hipocampo dorsal pode ser a região de investigação mais adequada e seria útil encontrar um procedimento de corte de qualidade semelhante para esta região hipocampal. Poucos protocolos, que se concentram no polo rostral, foram desenvolvidos que podem satisfazer essa demanda 21,22.
Neste protocolo, em vez disso, descrevemos uma abordagem para obter fatias transversais viáveis do hipocampo dorsal-intermediário que utiliza o ângulo de secção descrito anteriormente para preparações horizontais18,19 ( Figura1A&B). Demonstramos a qualidade deste protocolo comparando gravações eletrofisiológicas e reconstruções morfológicas nesta preparação às obtidas em fatias coronais. Este protocolo é particularmente adequado para a combinação com experimentos anatômicos e comportamentais em camundongos adultos (três meses de idade em nosso caso).
Protocolo
Todos os procedimentos envolvendo animais experimentais estavam de acordo com a Lei alemã de Bem-Estar Animal e aprovados pelo comitê de ética da Universidade de Kiel. Parvalbumin-Cre (Pvalb-IRES-Cre) os ratos23 (laboratórios Jackson, Repositório número 008069) foram mantidos como colônias heterozidas ou cruzados com os ratos ai9 Cre reporter24 (laboratórios Jackson, Repositório número 007909). Foram utilizados camundongos femininos e machos entre P40-P90. Os camundongos foram mantidos em um ciclo claro-escuro de 12 h sob condições padrão de habitação do grupo e foram fornecidos com alimentos e ad libitumde água .
1. Preparação de soluções
NOTA: Prepare soluções frescas para cada dia experimental usando água ultrauso (UPW) (resistividade a 25 °C 18,2 MΩcm). As soluções podem ser armazenadas a 4 °C por um dia. As soluções de magnésio e cálcio podem ser armazenadas separadamente como soluções de estoque de 1 M. Todas as soluções de trabalho devem ser saturadas com carbogen (95% O2:5% CO2) para oxigenação ideal e manutenção de pH antes e durante o uso.
- Prepare a solução de corte (500 mL por mouse) (em mM): 92 NMDG, 2,5 KCl, 1.25 NaH2PO4,30 NaHCO3,20 HEPES, 25 glicose, 5 Na-ascorbate, 4 Na-pyruate, 0,5 CaCl2·2H2O, e 10 MgSO4·7H2O. Titrate a pH 7.4 sob uma capa química com 4-5 mL de ácido clorídrico de 16% antes de adicionar os cálas divalent. Isso evitará a precipitação de MgSO4.
NOTA: KCl e NaH2PO4 podem ser armazenados como soluções de 10x a 4°C. Fazemos dois lotes individuais de solução de corte. Um no dia anterior à gravação (armazenado em um freezer durante a noite para produzir gelo esmagado) e outro no dia da gravação. - Prepare a solução de armazenamento (250 mL por mouse) (em mM): 92 NaCl, 2,5 KCl, 1.25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 glicose, 5 Na-ascorbate, 4 Na-pyruate, 2 CaCl2·2H2O, e 2 MgSO4·7H2O. Titrate to pH 7.3-7.4 with 1 N Naoh.
NOTA: NaCl, KCl e NaH2PO4 podem ser estocados como solução de 10x a 4 °C. - Prepare ACSF para gravação (em mM): 122 NaCl, 2.5 KCl, 1.25 NaH2PO4, 24 NaHCO3, 12,5 glicose, 2 CaCl2·2H2O, e 2 MgSO4·7H2O, 2 Na-ascorbate, 4 Na-pyruvate. Titrate pH para 7.3-7.4 com 1 N NaOH.
NOTA: NaCl, KCl e NaH2PO4 podem ser combinados em uma solução de estoque de 10x a 4°C.
2. Preparação do banco para fatiamento
- Prepare no gelo um béquer (150 mL) e duas placas de vidro Petri (10 cm de diâmetro) e encha-as com a solução de corte fresco. Mantenha a solução oxigenada com um dispositivo borbulhante de carbogen (um tubo perfurado ou uma pedra de ar conectada ao sistema carbogen).
NOTA: A solução no béquer será usada para a perfusão, enquanto as placas de Petri serão usadas durante o procedimento de corte. - Equipar o banco de cirurgia com uma lâmina de aço inoxidável, pinças de ponta arredondada, pinças finas, tesoura grande, uma tesoura grande, uma espátula de metal grande, uma espátula de metal fino, um pincel, a placa de vibratome e a cola cianoacrilato ou o adesivo cianoacrilato n-butil-ér menos tóxico. Produz uma lâmina de aço inoxidável e um pedaço de papel filtro em uma das placas de vidro de Petri no gelo. Este Petri será usado para cortar o cérebro. Desenhe três linhas paralelas no fundo de uma placa de Petri de plástico e posicione esta placa perto dos instrumentos cirúrgicos.
- Prepare a configuração para a perfusão trans-cardíaca de acordo com os protocolos publicados25.
- Prepare o vibratome, montando uma nova lâmina no porta-lâmina e defina os parâmetros para o corte (ângulo da lâmina do plano horizontal 17°, amplitude de oscilação da lâmina 1,5 mm, velocidade de movimento da lâmina para a frente em torno de 2 mm min-1, frequência de oscilação 90 Hz, espessura da seção 350 μm). Encha a bandeja de vibratome com solução de corte gelada e mantenha-a sob constante oxigenação.
NOTA: Adicionamos o gelo triturado feito do primeiro lote de solução de corte à solução de corte fresco resfriado para manter a temperatura baixa. Preste atenção para manter o gelo longe da lâmina enquanto corta. - Prepare uma câmara de incubação cheia de solução de corte sob constante oxigenação. Coloque a câmara em um banho de água pré-aquecido (35 °C).
NOTA: Um exemplo para a câmara de incubação pode ser encontrado em Edwards e Konnerth (1992)26. - Prepare uma câmara de armazenamento de fatias cheia com a solução de armazenamento e mantenha-a em temperatura ambiente e sob constante oxigenação. Caso o tecido expresse uma proteína fluorescente ou uma opsina ativada pela luz, é recomendável manter a câmara no escuro, por exemplo, dentro de uma caixa.
NOTA: uma câmara de armazenamento com vários poços independentes é útil para distinguir o nível das fatias ao longo do eixo dorsoventral do Hipocampo. Uma câmara personalizada pode ser construída(Figura 1D). Pegue um pedaço de grade espaçadora de frasco de uma caixa de armazenamento de frasco criogênico de 81x e cole a parte inferior em uma rede de nylon. Insira o terço superior de uma ponta de plástico pipeta de 5mL no centro desta grade, de modo que ele se destaque cerca de 3 cm na parte inferior. Esta ponta plástica serve como suporte da grade e, posteriormente, segura a tubulação de ar para oxigenação. Insira a grade com seu suporte em uma caixa de plástico cilídrico (por exemplo, embalagem de filtros de seringa) para que ela não possa inclinar ou oscilar. Este reservatório terá 250 mL de solução de armazenamento.
3. Preparação de fatias hipocampais
- Anestesiar o rato em uma câmara de caixa usando isoflurane (cerca de 0,5 mL) sob o capô. Deixe o mouse descansando até que a respiração esteja lenta e regular (cerca de 2-3 minutos). Teste para a ausência de respostas de dor com pitadas de dedo do pé.
- Realize a perfusão transmoral utilizando 25 mL de solução de corte carbonada do béquer no gelo seguindo os protocolos publicados25,27. Este passo é recomendado para esfriar rapidamente o cérebro para retardar rapidamente o metabolismo neuronal.
- Decapite o animal usando a tesoura grande e coloque a cabeça na placa de Petri resfriada no gelo contendo a solução de corte.
- Abra a pele com a tesoura fina para expor o crânio. Faça pequenas incisões laterais na base do crânio em ambos os lados do foien magnum. Em seguida, corte ao longo da sutura sagital começando no foramen magnum até chegar à sutura naso-frontal acima da lâmpada olfativa. Puxe a tesoura durante o corte sagital para evitar danos ao tecido cerebral subjacente.
NOTA: Manter a cabeça submersa na solução de corte ajuda a limpá-la do sangue e mantém a temperatura baixa. - Use a pinça arredondada para puxar os ossos parietal para expor o cérebro. Preste atenção para se apossar e remover as meninges também. Se for deixado, podem danificar o cérebro durante a extração.
- Use a espátula pequena para colher suavemente o cérebro na segunda placa de Petri.
- Corte o cérebro em metades ao longo da fissura longitudinal usando a lâmina pré-refrigerada.
- Use a espátula grande para levantar um hemisfério da solução de corte e para a placa de petri de plástico. Com o hemisfério deitado em sua superfície medial, alinhe o córtex parietal com uma das linhas paralelas para ter uma referência para o segundo corte, como mostrado na Figura 1B.
- Realize o segundo corte na parte ventral do hemisfério posicionando a lâmina em paralelo às linhas para obter a superfície, que mais tarde é usada para colar o cérebro no suporte da amostra (ver próximo passo), como mostrado na Figura 1B. Retorne o hemisfério para a solução de corte oxigenado da placa de petri de vidro e realize o mesmo procedimento no segundo hemisfério.
- Cole os hemisférios com o lado ventral recém-cortado no suporte da amostra vibratome usando o adesivo. Coloque algumas gotas de solução de corte nos hemisférios para solidificar a cola e mover o suporte do espécime para dentro da bandeja de vibratome. Desta forma, o corte seguirá do dorsal para o hipocampo ventral.
- Remova as primeiras uma ou duas fatias não transversais(Figura 1C,ii-iii) até que a região de interesse se torne visível e, em seguida, comece a coletar as fatias.
NOTA: Fatias não transversais, mas utilizáveis e saudáveis podem ser obtidas a partir do hipocampo dorsal no início do procedimento de corte(Figura 1C, ii-iii). A coleção de cada fatia requer cerca de 3-4 min. Iniciando o corte do dorsal em vez do hipocampo ventral economizamos cerca de 10 minutos, o que melhora a viabilidade das fatias dorsais. - Com uma pipeta de plástico (corte a extremidade estreita da ponta) transfira cada fatia para dentro da câmara de incubação (contendo solução de corte a 35 °C) e deixe descansar por 12 minutos. O breve período de recuperação na solução de corte quente reduz consideravelmente o inchaço neuronal inicial, conforme relatado em Ting et al. (2014)28. Em seguida, use uma escova transfira a fatia para a câmara de armazenamento (contendo solução de armazenamento no RT) e deixe descansar até o início do experimento.
4. Gravação de células inteiras e enchimento de biocitada
NOTA: A descrição do registro de grampo de remendo de células inteiras é reduzida aqui apenas para passos-chave que ajudam a obter um bom preenchimento de biocitina e é geralmente aplicável aos neurônios em ACSF. Para mais detalhes sobre os procedimentos de gravações eletrofisiológicas, vários outros protocolos podem ser consultados29,30.
- Escolha uma solução intracelular apropriada de acordo com os parâmetros a serem registrados. Como exemplo, para as medidas atuais do grampo, uma solução à base de gluconato de potássio pode ser usada (em mM): 135 K-Gluconato, 3 KCl, 10 HEPES, 0.2 EGTA, 10 fosfocreatine-Na2, 4 MgATP, 0.3 Na2-GTP. Ajuste o pH para 7,3 com 1 M KOH. A osmolalidade deve ser em torno de 285-290 mOsmol/kg uma vez que 3-5 mg/mL biocytin é adicionado.
NOTA: Para monitorar a forma do neurônio durante a gravação, 0,3-0,5 μL/mL de 1 mM Alexa Fluor Hydrazide pode ser adicionado à solução intracelular. Neste caso, lembre-se para a revelação da biocittina, para combinar a cor de corante Alexa com a sonda fluorescente acoplada ao streptavidin. - Prepare eletrodos de grampo de remendo de ≤ 1 μm de diâmetro da ponta e resistência de 3-5 MΩ de capilares de borossilicato de paredes grossas.
- Inicie o sistema de perfusão da configuração do patch-clamp com uma velocidade de 2,5-3 mL/min em RT ou 35-37 °C e fixe uma fatia na câmara com uma âncora em forma de U.
- Identifique a região do cérebro de interesse e escolha um neurônio saudável com a soma pelo menos 30-50 μm abaixo da superfície da fatia.
NOTA: A soma de um neurônio saudável tem uma superfície lisa, e as bordas da membrana são ligeiramente contrastadas. A soma do neurônio insalubre parece encolhida e altamente contrastada ou inchada e semi-transparente. - Carregue uma pipeta de vidro com a solução intracelular até que a ponta do eletrodo AgCl esteja coberta. Mova a pipeta para a solução da câmara de gravação, aplicando uma pressão positiva leve para manter clara a ponta do eletrodo de vidro.
NOTA: Se a solução contiver um corante Alexa, a pressão pode ser controlada ajustando visualmente a quantidade de solução fluorescente liberada da ponta. Pressão mínima evitaria a coloração do tecido ao redor da célula. - Aproxime-se da célula a partir de um ângulo oblíquo e estabeleça contato dentro do primeiro terço da superfície soma ao formar o selo giga. Solte a pressão, mova lentamente o potencial de retenção para-65 mV e aplique uma sucção suave pela boca para facilitar a formação de giga-seal.
- Para estabelecer a configuração de células inteiras, aplique sucção forte e breve para quebrar a membrana. Descarte a gravação se o neurônio tiver um potencial de membrana mais despolarizado do que 50 mV, se a corrente de retenção estiver aumentando além de 100 pA ou se a resistência ao acesso aumentar além de 30 MΩ.
- Após a gravação (para enchimento suficiente de somata e dendritos pelo menos 15 min; para o enchimento de axônios complexos até uma hora talvez necessário31) remova cuidadosamente o eletrodo. Para este final, defina o potencial de retenção para 0 mV e tente reeirme um selo giga, retraindo lentamente a pipeta na direção oposta à abordagem, como obter uma configuração de patch externo.
NOTA: A presença do corante Alexa nas soluções intracelulares ajuda a remoção visualmente guiada da pipeta da superfície neuronal. Se o núcleo da célula não estiver em contato com a ponta da pipeta, um método rápido para reformar o selo é puxar a pipeta para fora do tecido na diagonal e para cima em alta velocidade. Se o núcleo ou parte da membrana reside dentro da ponta, há o perigo de quebrar a membrana plasmática. Neste caso, uma leve aplicação de pressão positiva e movimento lateral podem ajudar. - Observe a posição da célula e a orientação da fatia. Após a fixação, a orientação exata da fatia e a integridade da célula preenchida podem ser verificadas sob um microscópio fluorescente.
5. Imunostaining, aquisição de imagens e reconstrução morfológica
- Após a gravação, transfira as fatias em uma placa de 24 poços para corrigi-la em paraformaldeído (PFA) 4% em 0,1 M de soro fisco tamponado de fosfato (PBS). Incubar por 60 min em RT ou durante a noite a 4 °C, de acordo com a sensibilidade dos anticorpos primários utilizados. As fatias podem ser armazenadas em PBS de 0,1 M e 0,02% naN3.
ATENÇÃO: A PFA é tóxica. Use debaixo do capô. - Realizar imunostaining e biocitação em uma semana de gravação de acordo com os protocolos estabelecidos32,33.
NOTA: Utilizamos um procedimento que evita a ressarção da fatia para preservar a integridade dos processos dendráticos e axonais. No entanto, este procedimento requer tempos de incubação mais longos, pois os anticorpos precisam penetrar no tecido. Sugerimos testar o tempo para a penetração ideal de anticorpos no tecido antes de realizar o experimento. - Adquira imagens usando um microscópio confocal com função de z-stack e escaneamento de telhas.
- Realizar reconstrução morfológica usando imagem FijiJ34.
NOTA: Vários formatos de arquivo de imagem podem ser importados para o programa usando o plugin de formato Bio. Recomendamos o uso do plugin Simples Neurite Tracer (STN)35 para a reconstrução dos dendritos e do axônio. Um tutorial simples e claro está disponível em https://imagej.net/SNT e http://snyderlab.com/2016/05/25/tracing-neurons-using-fiji-imagej/. O arquivo contendo os dados de rastreamento (.traces), se salvo não compactado, pode ser convertido em um arquivo de texto e aberto com o Matlab ou outro software para processamento de dados de texto.
Resultados
Neste protocolo descrevemos como preparar fatias hipocampais agudas da parte dorsal-intermediária do hipocampo (Figura 1A). O protocolo é particularmente adequado para experimentos que investigam mecanismos envolvidos na aprendizagem espacial e podem ser combinados com trabalho comportamental ou estratégias de rotulagem ou manipulação viral no hipocampo dorsal35. Aplicando o procedimento de secção descrito aqui aos animais injetados com GFP dependente de Cre expressando vírus associado ao Adeno (AAV-FLEX-GFP) no hipocampo dorsal de camundongos Pvalb-IRES-Cre em diferentes coordenadas Bregma AP-1,94 mm, ML ± 0,5-2 mm, profundidade-1,25-2,25 mm para atingir diferentes regiões da formação hipocampal36 conseguimos obter pelo menos três fatias transversais contendo as regiões infectadas (Figura 1A coloração verde clara no modelo 3D do hipocampo). Além disso, várias fatias não transversais, mas saudáveis, podem ser obtidas a partir das partes mais rostrais do hipocampo dorsal(Figura 1C).
Para demonstrar a qualidade e a viabilidade de nossas fatias, registramos parâmetros eletrofisiológicos e morfológicos básicos das células de granulo e interneurônios parvalbumin-positivos (PV+) no giro dentonato do Pvalb-IRES-Cre; Camundongos transgênicos Ai9 (7-12 semanas de idade) e compararam-nos com registros de fatias coronais da mesma região obtidas com um protocolo padrão.
Após inspeção visual sob o microscópio de contraste de interferência diferencial infravermelhado (IR-DIC), já notamos diferenças claras entre a nossa transversal e a fatia coronal. Enquanto os neurônios da camada celular principal em fatias coronais frequentemente apareciam grosseiro e apresentavam contornos fortemente contrastados, os neurônios na fatia transversal apresentavam principalmente superfícies lisas e apenas bordas levemente contrastadas, indicando uma melhor vitalidade celular(Figura 2A). A razão para essas diferenças na viabilidade celular entre as fatias coronais e transversais pode estar na orientação do plano de secção em relação aos tratos de fibra. Como estes não estão em paralelo nas seções coronais, axônios e dendritos serão cortados. De acordo com essa suposição, descobrimos que dentro das fatias os planos superficiais da camada celular de granulo e do hilus apresentaram maior descontinuidade no coronal do que a fatia transversal (tamanho do passo em planos superficiais: 41,40 ± 3,28 μm vs 25,60 ± 2,94 μm, ± médios SEM, Teste T Não Pago P = 0,023), sugerindo maior grau de desconexão tecidual na fatia coronal(Figura 2B). Isso significa que as células adequadas para gravações de grampos só serão encontradas em planos mais profundos da camada celular do grânulo para fatias coronais, o que, por sua vez, pode reduzir o rendimento de gravações de grampos de remendo. De fato, o tempo médio para selar a formação em nossa fatia transversal foi mais rápido do que para fatias coronais (células de granulo: 12,64± 1,50 s, n=11 em coronal vs. 8,40 ± 0,75 s, n=14 em fatias transversais, Teste médio ± SEM, P= 0,0335 Mann-Whitney; Interneurons PV+: 31,11 ± 2,60 s, n=9 em coronal vs. 22,00 ± 2,18, n=7 em fatias transversais, Média ± SEM, P= 0,0283 Mann-Whitney teste) (Figura 2C). Como proxy para integridade e saúde celular, registramos então os potenciais de membrana de repouso (RMP) de células de grânulo e interneurônios PV+, que foram significativamente mais despolarizados em ambas as células de grânulo e interneurons PV+ em coronal vs. fatias transversais (células de granulo:-62,55 ± 3,54 mV, n=11 em coronal vs.-71,06 ± 2,31 mV, n=14 em fatias transversais, teste de ± SEM, P=0,0455 Mann-Whitney; Interneurons PV+:-52,75 ± 1,66 mV, n=7 em coronal vs.-59,36 ± 2,25 mV, n=6 em fatias transversais Média ± SEM,, P= 0,0271 Teste Mann-Whitney) (Figura 2D). Esses dados sugerem um maior número de neurônios saudáveis na preparação transversal versus a fatia coronal. De fato, a introdução de um corte para o RMP aceitável (-55 mV para células de grânulo;-45 mV para interneurons PV+) resultou em uma maior porcentagem de células excluídas em coronal do que em fatias transversais (39,67 ± 8,37 %, n=3 sessões experimentais vs. 23,00 ± 3,85 %, n=4 sessões experimentais) (Figura 2E). Além disso, a reconstrução da morfologia neuronal a partir de células de grânulos registradas indicou que, como as chances esperadas eram muito melhores para recuperar uma arborização axonal completa para células de grânulo na fatia transversal(Figura 3A, B). Além disso, a reconstrução morfológica de interneurônios PV+ em fatias transversais permitiu a representação de extensas arborizações axonas e dendríticas, incluindo a visualização de pequenos detalhes, como as espinhas dendríticas35(Figura 3C).
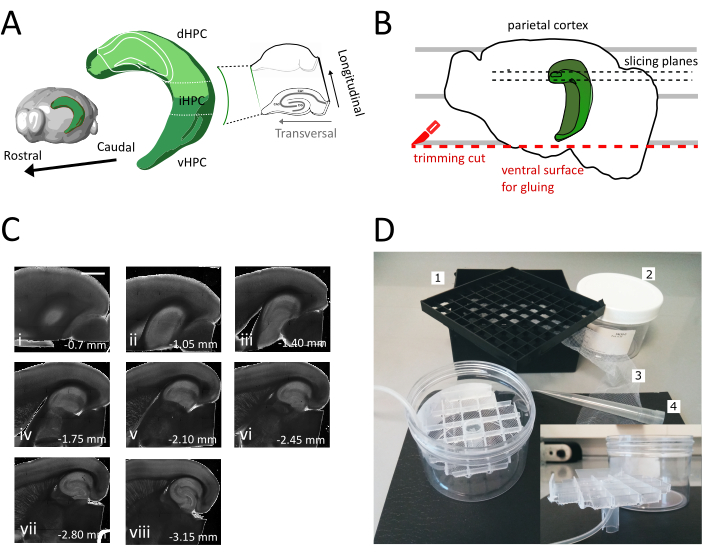
Figura 1: Ilustração do procedimento de secção para obtenção de fatias do hipocampo dorsal-intermediário. (A) Representação tridimensional da formação hipocampal mostrando sua orientação espacial no cérebro (modificada do Brain Explorer, Instituto Allen)37. As divisões dorsal, intermediária e ventral do hipocampo (dHPC, iHPC, vHPC) são indicadas, segundo Dong et al. (2009)7. A parte do hipocampo dorsal-intermediário que será fatiada é indicada em verde claro. O inset à direita mostra a orientação dos eixos de referência. (B) Desenho animado de um hemisfério cerebral retratando o alinhamento do córtex parietal com as linhas paralelas na placa de Petri. A linha pontilhada vermelha indica onde realizar o corte de corte (ponto 3.9 no protocolo) para criar a superfície para colar o hemisfério no suporte da amostra. As linhas pontilhadas pretas indicam onde as fatias são coletadas. (C) Série de imagens de campo brilhante de fatias hipocampais obtidas após este procedimento. Da superfície pial, dorsal ao ventral: (i) 0,70 mm, (ii) 1,05 mm, (iii) 1,40 mm, (iv) 1,75 mm, (v) 2,10 mm, (vi) 2,45 mm (vii) 2,80 mm, (viii) 3,15 mm. Barra de escala= 1 mm. (D) Foto da câmara de armazenamento e do material necessário para sua montagem. 1. Grade espaçadora de frasco de uma caixa de armazenamento de frasco criogênico de 81x, 2. Caixa de plástico cylindric. 3. Rede de nylon, 4. Ponta pipeta. inserir. Vista lateral da grade e do suporte do tubo para inserir na caixa cílídrica. Clique aqui para ver uma versão maior desta figura.

Figura 2: A fatia transversal mostra maior viabilidade da fatia em comparação com a fatia coronal. (A) Micrografias DIC-IR mostrando exemplos saudáveis (setas pretas) e insalubres (setas brancas) de somata neuronal em fatias transversais e coronais. Hil=hilus, camada celular gcl=granule, ml= camada molecular. Barra de escala = 50 μm. (B) Ambos os procedimentos de secção produzem um passo entre a superfície da camada celular do grânulo e o hilus (indicado por pontas de seta). A altura do passo é indicativa da extensão da desconexão tecidual e é significativamente menor em seções transversais do que em coronal (n=5 transversal e n=5 coronal slices, Mean±SEM, P=0,0238 Mann-Whitney test). (C) Tempo de formação de vedação giga-ohm em células de granulo (n=14 células em transversais, n=11 células coronal; Média±SEM, P= 0,0355, teste Mann-Whitney) e INs PV+ (n=7 células em células transversais, n=9 em fatias coronais, média±SEM, P= 0,0283 Mann-Whitney) (D) Potencial de membrana de repouso (RMP) de células corrigidas (respectivamente, n= 14 e n=11 células de grânulo. Teste médio±SEM, P=0,0455 Mann-Whitney. n=7 PV+ INs e n=10 PV+ INs, P= 0,0271 Teste Mann-Whitney). (E) Percentual de células descartadas em uma sessão experimental, (n=3 sessões com fatia coronal, n=4 com fatia transversal, Média±SEM). Clique aqui para ver uma versão maior desta figura.
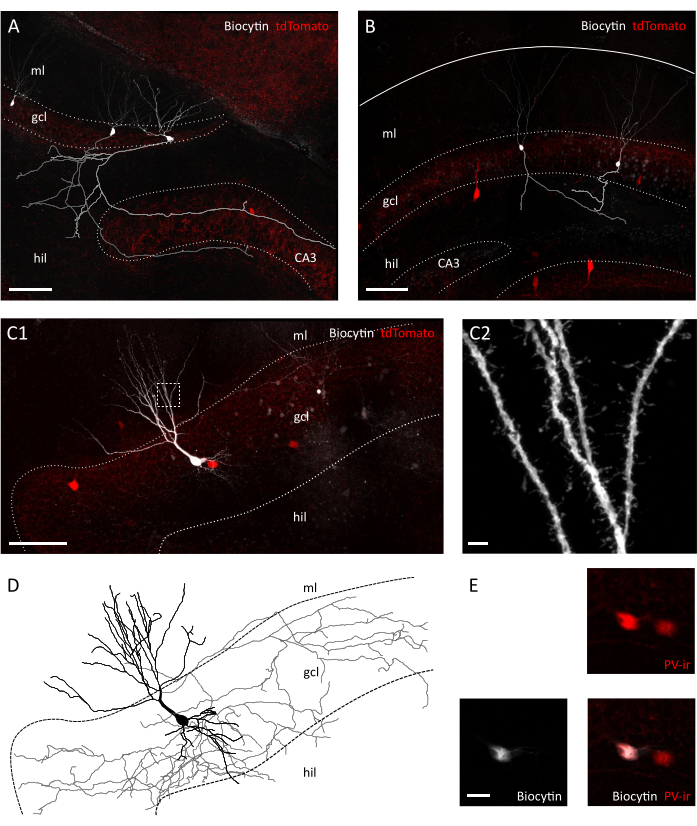
Figura 3: Preservação morfológica de células de grânulo e interneurônios na fatia transversal. Imagens confocal mostrando células de grânulo preenchidas com biocitina em uma fatia transversal (A) e em fatias coronais(B) de Pvalb-IRES-Cre; Camundongos transgênicos Ai9. Os respectivos axônios foram reconstruídos em cinza e cinza claro. Observe a diferença no comprimento do axônio e complexidade entre os preparos. Escala bar=100 μm. (C1) Imagem confocal mostrando um interneuron tdTomato-positivo cheio de biocidades. Hil=hilus, camadas celulares gcl=granule, ml= camada molecular. Escamas bar=50 μm. (C2) Ampliação da área encaixotada em C1, apresentando colunas dendríticas. Escala bar=2 μm(D) Reconstrução morfológica de axônios e dendritos do interneuron preenchido com biocitina em C1 (axônio em cinza, soma e dendritos em preto). (E) Close-up da somata das células retratadas em C1 mostrando colocalização da biocite e parvalbumin-imunoreatividade (PVir). Escala barra=20 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
O hipocampo dorsal tem sido extensivamente estudado por seu papel na aprendizagem espacial e navegação principalmente através de experimentos comportamentais, rastreamento anatômico e manipulações específicas da região. Para combinar inquéritos eletro-fisiológicos fatiados com essas técnicas, montamos um protocolo que usa um ângulo semelhante de secção como o corte horizontal modificado para a região interardens do hipocampo, mas usa uma ordem de corte invertida para obter fatias iniciais da região dorsal-intermediária. Essa abordagem reduz o tempo necessário para cortar e coletar a região dorsal do hipocampo, aumentando assim a viabilidade das fatias.
Usando este método, somos capazes de recuperar rotineiramente cerca de três fatias por hemisfério da região hipocampal dorsal entre 1,4 mm-2,4 mm da superfície do pial, como mostra a Figura 1C. Embora não seja possível, com este procedimento, obter fatias transversais do polo muito septo do hipocampo, é possível coletar cerca de duas fatias não transversais viáveis adicionais por hemisfério do polo septo (Figura 1C ii,iii). Se o polo septo do hipocampo for o foco principal da pesquisa, outros protocolos, que permitem a coleta de fatias transversais, especialmente do polo septo do hipocampo, podem ser mais adequados21,32. Experimentos comportamentais sobre navegação espacial e aprendizagem são realizados preferencialmente em camundongos maduros com conectividade neuronal totalmente desenvolvida. Consequentemente, otimizamos nosso procedimento de corte para a aplicação aos cérebros de animais adultos (mostrados aqui por três meses de idade), que são mais sensíveis ao estresse do que a preparação juvenil resiliente. Para isso, combinamos várias estratégias que reduzem o estresse hipóxico a que o cérebro está exposto no tempo entre a extração e a colocação das fatias no ACSF oxigenado. A solução de corte protetor é um ACSF25,27,28 baseado em NMDG com baixo Na+ e Ca2+ mas mg2+ alto para reduzir danos excitotóxicos e inchaço celular devido à ativação de receptores NMDA. Além disso, o HEPES fornece tampão estável e compostos como aspabas e piruvato reduzem o estresse oxidativo. A perfusão trans-cardíaca com a solução de corte protetora resfriada e oxigenada aproveita a rede capilar extremamente densa que fornece ao cérebro para reduzir rapidamente e homogêneamente a demanda metabólica e a excitotoxicidade induzida pelo glutamato no tecido cerebral. Posteriormente, quase todas as etapas após a decapitação são realizadas dentro das soluções resfriadas e oxigenadas para manter o metabolismo e a privação de oxigênio ao mínimo durante todo o procedimento. Existem outras estratégias para reduzir os danos cerebrais durante o corte e podem ser igualmente válidas38. Para demonstrar a qualidade de nossa preparação, comparamos com uma preparação de fatia coronal, que é comumente usada para gravar a partir do hipocampo dorsal. Embora as fatias coronais possam ser usadas para obter uma boa gravação de grampo de remendo no giro dentado, o número de neurônios insalubres e desconectados é maior do que na fatia transversal. Além disso, a integridade das arborizações axonanas e dendríticas é melhor preservada na fatia transversal. De fato, a integridade dos axônios celulares de grânulo(Figura 3A),que correm ortogonais até o eixo longitudinal do hipocampo serve como um indicador de um plano de corte transversal1.
Para o enchimento de neurônios remendados, sugerimos uma resistência eletrodo entre 3 e 5 MΩ. Um diâmetro da ponta de cerca de 1 μm, permite a realização de uma boa resistência ao selo durante a gravação e boa re-vedação após a retração do eletrodo. O detalhe mais crucial é evitar a sucção de partes da soma ou núcleo na pipeta. Por essa razão, sugerimos incluir um corante Alexa na solução intracelular quando possível. O corante permite monitorar a forma da célula durante a gravação e re-vedação. Além disso, permite avaliar a integridade da célula remendada após a fixação, o que pode economizar tempo de imunohistoquímica, em casos de obturações mal sucedidas. Por causa dos corantes Alexa são extintos com longo tempo de fixação, sugerimos fixação curta, se possível.
Para imunossuagem subsequente, usamos um protocolo que não requer a re-secção da fatia. Sugerimos fazer a coloração dentro de uma semana após a fixação. Quanto mais tempo as fatias permanecerem na geladeira, maior a chance de degradação tecidual. Se um armazenamento longo não puder ser evitado, sugerimos aumentar a concentração de NaN3 no PBS para 0,05% e atualizá-lo semanalmente. A imunossuagem de toda a fatia significa que os tempos de incubação com anticorpos primários e secundários aumentam. Normalmente, para revelar a biocittina, uma incubação noturna a 4 °C é suficiente, mas se combinada com a coloração para outras proteínas, todo o procedimento de coloração pode durar muito mais tempo. O bloqueio de permeabilização e a incubação anti-corpo precisam ser otimizados individualmente. Normalmente, para o anticorpo primário, dois dias são suficientes, enquanto um dia pode ser suficiente para o secundário. Recomendamos aumentar a duração das etapas de lavagem juntamente com incubações de anticorpos mais longas para evitar o aumento do fundo.
Neste protocolo apresentamos um método de corte para obter fatias hipocampais transversais ou quase transversais preservando a viabilidade neuronal do tecido adulto e uma abordagem prática para recuperar a morfologia e a identidade neuroquímica dos neurônios remendados. Este método pode ser facilmente realizado para combinar resultados eletrofisiológicos com estudos anatômicos e comportamentais com foco na parte intersa dorsal do hipocampo.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a Kerstin Kronenbitter e Didier Gremelle pela assistência técnica. Agradecemos a Umberto Morelli pela ajuda com software gráfico e Mathias Hoppe pela videografia e edição de vídeo. O trabalho em nosso laboratório foi apoiado pela Deutsche Forschungsgemeinschaft (DFG) FOR2143, SFB 1461 (Project-ID 434434223) e GRK2154, o Conselho de Pesquisa Médica concede G1100546/2 e a Universidade kiel.
Materiais
| Name | Company | Catalog Number | Comments |
| 1mL syringes Omnifix-F | Braun melsungen AG | 9161406V | |
| 24 multiwells | SARSTEDT | 8,33,922 | |
| 81x criogenic vial storage box | Fisherscientific | 15-350-107B | storage chamber |
| Alexa Hydrazide dye | Invitrogen | A10436 | |
| Big scissor | Fine science tool | 14010-15 | graefe forceps |
| Biocytin | IRIS biotech. | LS3510.0250 | |
| Borosilicate Glass capillaries | Science products | GB150TF-10 | storage chamber |
| Brush 5 | Leonhardy | 241 | Micro double spatula, L 150 mm, blade width 4 mm |
| Calcium chloride dihydrate | Roth | 5239.2 | aCSF solution |
| Carbon steel microtome blade | feather | C35 | |
| Chloridric acid | Roth | K025.1 | |
| Confocal microscope | Zeiss | LSM880 | with Airyscan |
| Cyanoacrylate glue | UHU | 509141 | |
| Cyanoacrylate glue, n-butyl-ester VetBond | 3M | ||
| EGTA | Roth | 3054.1 | |
| Fiji ImageJ | fiji.sc | ||
| Filter paper 113A | ROTILABO Roth | AP180.1 | |
| Fine tip tweezer | Dumont | 0245fo | |
| Glass becker (150 ml) | ROTILABO Roth | X690.1 | incubation chamber and dissection |
| Glass Petri dishes (10 cm dia.) | ROTILABO Roth | 0690.1 | |
| Glucose | Roth | X997.2 | aCSF solution |
| Heated water bath | Grant Instruments Ltd | SUB14 | |
| HEPES | Roth | 9105.4 | aCSF solution |
| Isofluoran | baxter | 5239.2 | Anesthetic |
| Large spatula | Roth | E286.1 | |
| Magnesium Sulfate heptahydrate | Roth | 8793.2 | aCSF solution |
| Mg-ATP | Sigma Aldrich | A9187 | |
| Microfil | World precision instruments | MF34G | |
| Na2-GTP | Sigma Aldrich | 51120 | |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF solution |
| Normal goat serum | Sigma Aldrich | 566380 | |
| Nylon mesh kit | Warner Instruments | 64-0198 | incubation chamber and storage chamber |
| Paraformaldeyde | Sigma Aldrich | P6148 | |
| Phosphate buffered saline 10X | Panbiotech | P04-53500 | |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | |
| Pipette puller | Sutter instrument | P-2000 | |
| Pipette tips | SARSTEDT | 7,07,62,211 | incubation chamber |
| Plastic box for syringe filters | SUPELCO | 54135-U | storage chamber |
| Potassium Chloride | Roth | 6781.3 | aCSF solution |
| Potassium Gluconate | Roth | P1847 | |
| Probenbecker becker (100 ml) | ROTILABO Roth | HT85.1 | incubation chamber |
| Rounded tip tweezers | Fine science tool | 11051-10 | |
| Sainless steel blade | Gillette | Vibratome | |
| Small scissor | Fine science tool | 14010-10 | mayo scissor straight |
| Sodium Ascorbate | Roth | 3149.2 | aCSF solution |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium Bicarbonate | Roth | 6885.1 | aCSF solution |
| Sodium Chloride | Roth | 3957.1 | aCSF solution |
| Sodium Hydroxide | Roth | K021.1 | |
| Sodium Phosphate monobasicdihydrat | Roth | K300.1 | aCSF solution |
| Sodium Pyruvate | Roth | 8793.2 | aCSF solution |
| Streptavidin conjiugated Alexa 488 | Invitogen | s11223 | |
| Thin spatula | Roth | E286.1 | Double spatula, L 150 mm, blade width 9 mm |
| Transfer pipette | Sarstedt | 861171 | |
| Triton x100 | Roth | 3051.1 | |
| Vibratome | Thermoscientific | Microm HM650V | |
| Filter device for ultrapure water | Merck-Millipore | Milli-Q IQ 7000 |
Referências
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65 (1), 7-19 (2010).
- David, A., Pierre, L. Hippocampal Neuroanatomy. The Hippocampus Book. , 37-114 (2006).
- Dong, H. W., Swanson, L. W., Chen, L., Fanselow, M. S., Toga, A. W. Genomic-anatomic evidence for distinct functional domains in hippocampal field CA1. Proceedings of the National Academy of Sciences of the United States of America. 106 (28), 11794-11799 (2009).
- Royer, S., Sirota, A., Patel, J., Buzsaki, G. Distinct representations and theta dynamics in dorsal and ventral hippocampus. Journal of Neuroscience. 30 (5), 1777-1787 (2010).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Foggetti, A., Baccini, G., Arnold, P., Schiffelholz, T., Wulff, P. Spiny and Non-spiny Parvalbumin-Positive Hippocampal Interneurons Show Different Plastic Properties. Cell Rep. 27 (13), 3725-3732 (2019).
- Cembrowski, M. S., Spruston, N. Heterogeneity within classical cell types is the rule: lessons from hippocampal pyramidal neurons. Nature Reviews Neuroscience. 20 (4), 193-204 (2019).
- Moser, M. B., Moser, E. I., Forrest, E., Andersen, P., Morris, R. G. Spatial learning with a minislab in the dorsal hippocampus. Proceedings of the National Academy of Sciences of the United States of America. 92 (21), 9697-9701 (1995).
- Pothuizen, H. H., Zhang, W. N., Jongen-Relo, A. L., Feldon, J., Yee, B. K. Dissociation of function between the dorsal and the ventral hippocampus in spatial learning abilities of the rat: a within-subject, within-task comparison of reference and working spatial memory. European Journal of Neuroscience. 19 (3), 705-712 (2004).
- Fredes, F., et al. Ventro-dorsal Hippocampal Pathway Gates Novelty-Induced Contextual Memory Formation. Current Biology. 31 (1), 25-38 (2021).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Andersen, P. Long-lasting facilitation of synaptic transmission. Ciba Foundation Symposium. (58), 87-108 (1977).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. Journal of Neurophysiology. 67 (5), 1346-1358 (1992).
- Walther, H., Lambert, J. D., Jones, R. S., Heinemann, U., Hamon, B. Epileptiform activity in combined slices of the hippocampus, subiculum and entorhinal cortex during perfusion with low magnesium medium. Neurosci Lett. 69 (2), 156-161 (1986).
- Rafiq, A., DeLorenzo, R. J., Coulter, D. A. Generation and propagation of epileptiform discharges in a combined entorhinal cortex/hippocampal slice. Journal of Neurophysiology. 70 (5), 1962-1974 (1993).
- Leutgeb, J. K., Frey, J. U., Behnisch, T. LTP in cultured hippocampal-entorhinal cortex slices from young adult (P25-30) rats. Journal of Neuroscience Methods. 130 (1), 19-32 (2003).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature Protocols. 1 (3), 1235-1247 (2006).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording Synaptic Plasticity in Acute Hippocampal Slices Maintained in a Small-volume Recycling-, Perfusion-, and Submersion-type Chamber System. Journal of Visualized Experiments. (131), e55936 (2018).
- Dougherty, K. A., Islam, T., Johnston, D. Intrinsic excitability of CA1 pyramidal neurones from the rat dorsal and ventral hippocampus. Journal of Physiology. 590 (22), 5707-5722 (2012).
- Tidball, P., et al. Differential ability of the dorsal and ventral rat hippocampus to exhibit group I metabotropic glutamate receptor-dependent synaptic and intrinsic plasticity. Brain and Neuroscience Advances. 1 (1), (2017).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159 (2005).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), e53825 (2018).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Archives. 414 (5), 600-612 (1989).
- Djurisic, M. Minimizing Hypoxia in Hippocampal Slices from Adult and Aging Mice. Journal of Visualized Experiments. (161), e61377 (2020).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. P. Acute Brain Slice Methods for Adult and Aging Animals: Application of Targeted Patch Clamp Analysis and Optogenetics. Patch-Clamp Methods and Protocols, 2nd Edition. 1183, 221-242 (2014).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments. (91), e51706 (2014).
- Norenberg, A., Hu, H., Vida, I., Bartos, M., Jonas, P. Distinct nonuniform cable properties optimize rapid and efficient activation of fast-spiking GABAergic interneurons. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 894-899 (2010).
- Swietek, B., Gupta, A., Proddutur, A., Santhakumar, V. Immunostaining of Biocytin-filled and Processed Sections for Neurochemical Markers. Journal of Visualized Experiments. (118), e54880 (2016).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nature Protocols. 1 (4), 1977-1986 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Longair, M. H., Baker, D. A., Armstrong, J. D. Simple Neurite Tracer: open source software for reconstruction, visualization and analysis of neuronal processes. Bioinformatics. 27 (17), 2453-2454 (2011).
- Murray, A. J., et al. Parvalbumin-positive CA1 interneurons are required for spatial working but not for reference memory. Nature Neuroscience. 14 (3), 297-299 (2011).
- Otis, T. S., Staley, K. J., Mody, I. Perpetual inhibitory activity in mammalian brain slices generated by spontaneous GABA release. Brain Research. 545 (1-2), 142-150 (1991).
- Varela, C., Llano, D. A., Theyel, B. B. An introduction to in vitro slice approaches for the study of neuronal circuitry. Neuromethods. 67, 103-125 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados