Method Article
Preparación de rodajas agudas del hipocampo dorsal para la grabación de células enteras y la reconstrucción neuronal en el dentate gyrus de ratones adultos
En este artículo
Resumen
Presentamos un protocolo para preparar rodajas agudas del hipocampo dorsal-intermedio de ratones. Comparamos esta preparación transversal con el corte coronal en términos de calidad de las grabaciones y preservación de las características morfológicas de las neuronas grabadas.
Resumen
Aunque la arquitectura general del hipocampo es similar a lo largo de su eje longitudinal, estudios recientes han revelado diferencias prominentes en criterios moleculares, anatómicos y funcionales que sugieren una división en diferentes subcircuitos a lo largo de su extensión rostro-caudal. Debido a la conectividad diferencial y la función se hace la distinción más fundamental entre el dorsal y el hipocampo ventral, que están participando preferentemente en el procesamiento espacial y emocional, respectivamente. En consecuencia, el trabajo in vivo sobre la formación de la memoria espacial se ha centrado en el hipocampo dorsal.
Por el contrario, las grabaciones in vitro electrofisiológicas se han realizado preferentemente en hipocampo interventral, motivado en gran medida por factores como la viabilidad de las rebanadas y la integridad del circuito. Para permitir la correlación directa de datos in vivo sobre el procesamiento espacial con datos in vitro hemos adaptado métodos de seccionamiento anteriores para obtener rodajas cerebrales transversales altamente viables del hipocampo dorsal-intermedio para grabaciones a largo plazo de células principales e interneurones en el giro desánido. A medida que el comportamiento espacial se analiza rutinariamente en ratones adultos, hemos combinado este procedimiento de corte transversal con el uso de soluciones protectoras para mejorar la viabilidad del tejido cerebral de animales maduros. Utilizamos este enfoque para ratones de aproximadamente 3 meses de edad. El método ofrece una buena alternativa a la preparación coronal que se utiliza con frecuencia para estudios in vitro sobre hipocampo dorsal. Comparamos estos dos preparados en términos de calidad de grabaciones y preservación de características morfológicas de las neuronas grabadas.
Introducción
El hipocampo ha sido estudiado extensamente por su papel fundamental en diferentes aspectos del aprendizaje y la memoria, la navegación espacial, así como la emoción. Los circuitos básicos del hipocampo, comúnmente llamado el "circuito trisintáptico", es una red lamelar en el eje transversal, que se conserva en gran medida a lo largo del eje longitudinal1. Las contribuciones del hipocampo a diversos comportamientos cognitivos y emocionales probablemente surgen de las diversas conexiones que este circuito básico hace a lo largo del eje dorsoventral con varias otras regiones cerebrales2,3. Sin embargo, más allá de la conectividad aferente y efervescencia, un número creciente de estudios apuntan a nuevas diferencias a lo largo del eje septo-temporal del hipocampo. Tales diferencias se refieren a la arquitectura interna y la conectividad, así como las diferencias en los patrones de expresión génica y morfología neuronal4,5,6,7,8.
Teniendo en cuenta la existencia de tales diferencias en los circuitos básicos, es razonable seleccionar el subcircuito hipocampal específico que se investigará de acuerdo con las preguntas que se abordan. Si, por ejemplo, la pregunta se refiere a los mecanismos neuronales implicados en el procesamiento espacial, el dorsal en lugar del hipocampo ventral es de interés, aunque los dos no actúan in vivo de forma independiente debido a la conectividad longitudinal intrapótamo9,10,11. En esta línea no sólo hay que tener en cuenta las diferencias a lo largo del eje longitudinal, sino que también se requiere cuidado para preservar tanto los circuitos locales como los de largo alcance. Para la preservación de las trayectorias de fibra y la conectividad el ángulo en el que se seccionará el cerebro es esencial.
El primer método reportado en la literatura para incluir el circuito trysinaptic primero aisló el hipocampo del cerebro y luego hizo rodajas transversales (perpendiculares a los ejes longitudinales) utilizando un helicóptero de tejido12 y un vibratome13. Los fisiólogos posteriores prefirieron obtener rodajas de todo un bloque cerebral para preservar también las estructuras cerebrales adyacentes conectadas al hipocampo. Para estos preparados de bloques, se han desarrollado diferentes ángulos de sección con respecto al hipocampo, como una preparación de rodajas coronales14 o una preparación de rodajas horizontales llamada rebanada HEC para preservar las conexiones de corteza hipocampal-entorrinal15,16,17.
En esta última preparación se corta el lóbulo parietal con un ángulo de 0° o 12° con respecto al plano horizontal a lo largo del eje rostro-caudal para formar la base del bloque. A continuación, se recogen rodajas a partir de la superficie ventral del cerebro, permitiendo principalmente la cosecha de la región hipocampal intermedio-ventral. Este método se ha convertido en la opción más popular para los estudios fisiológicos y se puede realizar de forma fiable siguiendo varios protocolos publicados18,19,20.
Sin embargo, si el interés de la investigación se refiere a aspectos específicos del aprendizaje espacial, el hipocampo dorsal puede ser la región de investigación más adecuada y sería útil encontrar un procedimiento de corte de calidad similar para esta región del hipocampo. Se han desarrollado pocos protocolos, que se centran en el polo rostral mismo, que pueden satisfacer esta demanda 21,22.
En este protocolo, en cambio, describimos un enfoque para obtener rodajas transversales viables del hipocampo dorsal-intermedio que utiliza el ángulo de sección descrito previamente para preparaciones horizontales18,19 (Figura 1A& B). Demostramos la calidad de este protocolo comparando las grabaciones electrofisiológicas y las reconstrucciones morfológicas en esta preparación con las obtenidas en rodajas coronales. Este protocolo es particularmente adecuado para la combinación con experimentos anatómicos y conductuales en ratones adultos (tres meses de edad en nuestro caso).
Protocolo
Todos los procedimientos relativos a los animales experimentales se ajustaban a la Ley alemana de bienestar animal y fueron aprobados por el comité de ética de la universidad de Kiel. Parvalbumin-Cre (Pvalb-IRES-Cre) ratones23 (laboratorios Jackson, repositorio número 008069) se mantuvieron como colonias heterocigótidas o cruzaron con ratones reporteros Ai9 Cre24 (laboratorios Jackson, número de repositorio 007909). Se utilizaron ratones hembras y machos entre P40-P90. Los ratones se mantuvieron en un ciclo de 12 horas de oscuridad claro en condiciones estándar de vivienda grupal y se les proporcionó alimentos y agua ad libitum.
1. Preparación de soluciones
NOTA: Preparar soluciones frescas para cada día experimental utilizando agua ultrapura (UPW) (resistividad a 25 °C 18.2 MΩcm). Las soluciones pueden almacenarse a 4 °C durante un máximo de un día. Las soluciones de magnesio y calcio se pueden almacenar por separado como soluciones de stock de 1 M. Todas las soluciones de trabajo deben estar saturadas de carbógeno (95% O2:5% CO2)para una oxigenación óptima y mantenimiento del pH antes y durante el uso.
- Preparar la solución de corte (500 ml por ratón) (en mM): 92 NMDG, 2,5 KCl, 1,25 NaH2PO4,30 NaHCO3,20 HEPES, 25 glucosa, 5 Na-ascorbate, 4 Na-pyruvate, 0,5 CaCl2·2H2O, y 10 MgSO4·7H2O. Titrato a pH 7,4 bajo una capucha química con 4-5 ml de ácido clorhídrico al 16% antes de añadir las divalentes. Esto evitará la precipitación de MgSO4.
NOTA: KCl y NaH2PO4 se pueden almacenar como soluciones 10x a 4°C. Hacemos dos lotes individuales de solución de corte. Uno el día antes de la grabación (almacenado en un congelador durante la noche para producir hielo triturado) y otro el día de la grabación. - Preparar la solución de almacenamiento (250 ml por ratón) (en mM): 92 NaCl, 2,5 KCl, 1.25 NaH2PO4,30 NaHCO3,20 HEPES, 25 glucosa, 5 Na-ascorbate, 4 Na-pyruvate, 2 CaCl2·2H2O, y 2 MgSO4·7H2O. Titrate a pH 7.3-7.4 con 1 N NaOH.
NOTA: NaCl, KCl y NaH2PO4 se pueden almacenar como solución 10x a 4 °C. - Preparar ACSF para la grabación (en mM): 122 NaCl, 2,5 KCl, 1,25 NaH2PO4,24 NaHCO3,12,5 glucosa, 2 CaCl2·2H2O, y 2 MgSO4·7H2O, 2 Na-ascorbate, 4 Na-pyruvate. Titrate pH a 7.3-7.4 con 1 N NaOH.
NOTA: NaCl, KCl y NaH2PO4 se pueden combinar en una solución de stock de 10x a 4°C.
2. Preparación del banco para el corte
- Preparar sobre hielo un vaso de precipitados (150 ml) y dos platos de cristal de Petri (10 cm de diámetro) y llenarlos con la solución de corte fresco. Mantenga la solución oxigenada con un dispositivo burbujeante de carbógenos (un tubo perforado o una piedra de aire conectada al sistema carbógeno).
NOTA: La solución en el vaso de precipitados se utilizará para la perfusión, mientras que las placas De Petri se utilizarán durante el procedimiento de corte. - Equipe el banco de cirugía con una hoja de acero inoxidable, pinzas de punta redondeada, pinzas de punta fina, tijeras grandes, tijeras pequeñas, una espátula de metal grande, una espátula de metal delgada, un cepillo, la placa de vibratome y pegamento de cianoacrilato o el adhesivo de cianoacrilato n-butilo-éster menos tóxico. Hierve una hoja de acero inoxidable y un trozo de papel filtrante en una de las placas de cristal de Petri sobre hielo. Este Petri será usado para cortar el cerebro. Dibuje tres líneas paralelas en la parte inferior de una placa de plástico Petri y coloque este plato cerca de los instrumentos quirúrgicos.
- Preparar la configuración para la perfusión transcardial de acuerdo con los protocolospublicados 25.
- Preparar el vibratome, montar una nueva hoja en el soporte de la hoja y establecer los parámetros para el corte (ángulo de la hoja desde plano horizontal 17°, amplitud de oscilación de la hoja 1,5 mm, velocidad de movimiento hacia adelante de la hoja en alrededor de 2 mm min-1,Frecuencia de oscilación 90 Hz, espesor de sección 350 μm). Llene la bandeja de vibratome con solución de corte helado y manténgala bajo oxigenación constante.
NOTA: Añadimos el hielo triturado hecho desde el primer lote de solución de corte a la solución de corte fresco enfriado para mantener la temperatura baja. Preste atención para mantener el hielo de la hoja mientras corta. - Prepare una cámara de incubación llena con la solución de corte bajo oxigenación constante. Coloque la cámara en un baño de agua pre-calentado (35 °C).
NOTA: Un ejemplo para la cámara de incubación se puede encontrar en Edwards y Konnerth (1992)26. - Prepare una cámara de almacenamiento en rodajas llena con la solución de almacenamiento y guárdala a temperatura ambiente y bajo una oxigenación constante. En caso de que el tejido exprese una proteína fluorescente o una opsina activada por la luz, es recomendable mantener la cámara en la oscuridad, por ejemplo, dentro de una caja.
NOTA: una cámara de almacenamiento con múltiples pozos independientes es útil para distinguir el nivel de las rodajas a lo largo del eje dorsoventral del Hipocampo. Se puede construir una cámara hecha a medida (Figura 1D). Tome un pedazo de rejilla del espaciador del vial de una caja de almacenamiento de viales criogénicos de 81x y pegue la parte inferior en una red de nylon. Inserte el tercio superior de una punta de plástico de pipeta de 5 ml en el centro de esta cuadrícula, de modo que sobresala unos 3 cm en la parte inferior. Esta punta de plástico sirve como soporte de la red y más tarde sostiene el tubo de aire para la oxigenación. Inserte la rejilla con su soporte en una caja de plástico cilíndrico (por ejemplo, embalaje de filtros de jeringa) para que no pueda inclinarse ni tambalearse. Este depósito tendrá 250 ml de solución de almacenamiento.
3. Preparación de rodajas de hipocampo
- Anestesia el ratón en una cámara de caja usando isoflurano (unos 0,5 ml) bajo el capó. Deje el ratón descansando hasta que la respiración sea lenta y regular (aproximadamente 2-3 minutos). Prueba la ausencia de respuestas al dolor con pellizcos en los dedos de los dedos de
- Realizar perfusión transcardial utilizando 25 ml de solución de corte carbonatado del vaso de precipitados sobre hielo siguiendo los protocolos publicados25,27. Este paso se recomienda enfriar el cerebro rápidamente para ralentizar rápidamente el metabolismo neuronal.
- Decapita al animal usando las tijeras grandes y coloca la cabeza en la placa petri enfriada sobre hielo que contiene la solución de corte.
- Abra la piel con las tijeras finas para exponer el cráneo. Hacer pequeñas incisiones laterales en la base del cráneo a ambos lados de la magnum de caparaña. A continuación, corte a lo largo de la sutura sagital comenzando en la magnum de los anteomen hasta llegar a la sutura naso-frontal por encima de la bombilla olfativa. Levante la tijera durante el corte sagital para evitar el daño del tejido cerebral subyacente.
NOTA: Mantener la cabeza sumergida en la solución de corte ayuda a limpiarla de la sangre y mantiene la temperatura baja. - Usa la pinza de punta redondeada para levantar los huesos parietales para exponer el cerebro. Presta atención para agarrar y quitar las meninges también. Si se quedan, pueden dañar el cerebro durante la extracción.
- Usa la pequeña espátula para sacar suavemente el cerebro en la segunda placa de Petri.
- Corta el cerebro en mitades a lo largo de la fisura longitudinal usando la hoja pre-enfriada.
- Utilice la espátula grande para levantar un hemisferio de la solución de corte y en la placa de plástico Petri. Con el hemisferio tendido en su superficie medial, alinee la corteza parietal con una de las líneas paralelas para tener una referencia para el segundo corte como se muestra en la Figura 1B.
- Realice el segundo corte en la parte ventral del hemisferio colocando la hoja en paralelo a las líneas para obtener la superficie, que más tarde se utiliza para pegar el cerebro en el soporte de la muestra (ver siguiente paso), como se muestra en la Figura 1B. Vuelva al hemisferio en la solución de corte oxigenada de la placa de petri de vidrio y realice el mismo procedimiento en el segundo hemisferio.
- Pega los hemisferios con el lado ventral recién cortado en el soporte de la muestra de vibratome usando el adhesivo. Coloque unas gotas de solución de corte en los hemisferios para solidificar el pegamento y mover el soporte de la muestra a la bandeja de vibratome. De esta manera el corte procederá del dorsal al hipocampo ventral.
- Quite el uno o dos sectores no transversales iniciales (Figura 1C, ii-iii) hasta que la región de interés se haga visible y, a continuación, comience a recopilar los sectores.
NOTA: Las rebanadas no transversales pero utilizables y saludables se pueden obtener del hipocampo dorsal al comienzo del procedimiento de corte (Figura 1C,ii-iii). La colección de cada sector requiere aproximadamente 3-4 min. Al iniciar el corte desde el dorsal en lugar del hipocampo ventral ahorramos unos 10 minutos, lo que mejora la viabilidad de las rodajas dorsales. - Con una pipeta de plástico (cortar el extremo estrecho de la punta) transferir cada rebanada a la cámara de incubación (que contiene solución de corte a 35 °C) y dejar reposar durante 12 minutos. El breve período de recuperación en solución de corte caliente reduce en gran medida la hinchazón neuronal inicial, como se informa en Ting et al. (2014)28. A continuación, con un pincel, transfiera el sector a la cámara de almacenamiento (que contiene la solución de almacenamiento en RT) y déjelo reposar hasta el inicio del experimento.
4. Grabación integral y llenado de biocytina
NOTA: La descripción de la grabación de abrazadera de parches de celda completa se reduce aquí sólo a pasos clave que ayudan a obtener un buen llenado de biocytina y generalmente es aplicable a las neuronas en ACSF. Para obtener más información sobre los procedimientos de las grabaciones electrofisiológicas, se pueden consultar varios otros protocolos29,30.
- Elija una solución intracelular adecuada de acuerdo con los parámetros que se deben registrar. Como ejemplo, para las mediciones actuales de la abrazadera, se puede utilizar una solución a base de gluconato de potasio (en mM): 135 K-Gluconato, 3 KCl, 10 HEPES, 0.2 EGTA, 10 fosfocreatina-Na2,4 MgATP, 0.3 Na2-GTP. Ajuste el pH a 7,3 con 1 M KOH. La osmolalidad debe ser de alrededor de 285-290 mOsmol/kg una vez que se agregue biocytina de 3-5 mg/ml.
NOTA: Para monitorear la forma de la neurona durante la grabación, se pueden añadir 0,3-0,5 μL/ml de hidróxido fluorado Alexa de 1 mM a la solución intracelular. En este caso, recuerde por revelación de biocytina, para que coincida con el color del tinte Alexa con la sonda fluorescente acoplada a streptavidin. - Prepare electrodos de sujeción de parches de ≤1 diámetro de punta de μm y resistencia de 3-5 MΩ de capilares de borosilicato de paredes gruesas.
- Inicie el sistema de perfusión de la configuración de la abrazadera de parches con una velocidad de 2,5-3 ml/min a RT o 35-37 °C y asegure una rebanada en la cámara con un anclaje en forma de U.
- Identificar la región cerebral de interés y elegir una neurona saludable con el soma al menos 30-50 μm por debajo de la superficie de la rebanada.
NOTA: El soma de una neurona sana tiene una superficie lisa, y los bordes de la membrana están ligeramente contrastados. El soma de la neurona poco saludable parece encogido y altamente contrastado o hinchado y semitransparente. - Cargue una pipeta de vidrio con la solución intracelular hasta que se cubra la punta del electrodo AgCl. Mueva la pipeta a la solución de la cámara de grabación, aplicando una presión positiva ligera para mantener clara la punta del electrodo de vidrio.
NOTA: Si la solución contiene un tinte Alexa, la presión se puede controlar ajustando visualmente la cantidad de solución fluorescente liberada de la punta. La presión mínima evitaría la tinción del tejido alrededor de la célula. - Acérquese a la célula desde un ángulo oblicuo y establezca contacto dentro del primer tercio de la superficie del soma al formar el sello giga. Libere la presión, mueva lentamente el potencial de retención a -65 mV y aplique una suave succión por vía oral para facilitar la formación giga-seal.
- Para establecer la configuración de toda la célula, aplique una succión fuerte y breve para romper la membrana. Deseche la grabación si la neurona tiene un potencial de membrana más despolarizado que-50 mV, si la corriente de retención está aumentando más allá de 100 pA o si la resistencia al acceso aumenta más allá de 30 MΩ.
- Después de la grabación (para el llenado suficiente de somatas y dendritas se recomiendan al menos 15 minutos; para el llenado de axones complejos hasta una hora tal vez requerido31)retire cuidadosamente el electrodo. Con este fin, establezca el potencial de retención en 0 mV e intente volver a formar un sello giga retirando lentamente la pipeta en la dirección opuesta a la aproximación, como para obtener una configuración de parche exterior.
NOTA: La presencia del tinte Alexa en las soluciones intracelulares ayuda a la eliminación guiada visualmente de la pipeta de la superficie neuronal. Si el núcleo de la célula no está en contacto con la punta de la pipeta, un método rápido para reformar el sello es sacar la pipeta del tejido diagonalmente y hacia arriba a alta velocidad. Si el núcleo o parte de la membrana reside dentro de la punta, existe el peligro de romper la membrana plasmática. En este caso, una ligera aplicación de presión positiva y movimiento lateral pueden ayudar. - Tenga en cuenta la posición de la celda y la orientación del sector. Después de la fijación, la orientación exacta del sector y la integridad de la celda rellena se pueden comprobar bajo un microscopio fluorescente.
5. Inmunodetención, adquisición de imágenes y reconstrucción morfológica
- Después de la grabación, transfiera las rodajas a una placa de 24 pozos para fijarla en paraformaldehído (PFA) 4% en solución salina amortiguada por fosfato de 0,1 M (PBS). Incubar durante 60 minutos en RT o durante la noche a 4 °C, de acuerdo con la sensibilidad de los anticuerpos primarios utilizados. Los sectores se pueden almacenar en 0,1 M PBS y 0,02% NaN3.
PRECAUCIÓN: La PFA es tóxica. Úsalo debajo del capó. - Realizar la inmunostaining y la revelación de biocytina dentro de una semana después de la grabación de acuerdo con los protocolos establecidos32,33.
NOTA: Utilizamos un procedimiento que evita la re-sección del sector para preservar la integridad de los procesos dendríticos y axoales. Sin embargo, este procedimiento requiere tiempos de incubación más largos, ya que los anticuerpos necesitan penetrar en el tejido. Sugerimos probar el tiempo para una penetración óptima de anticuerpos en el tejido antes de realizar el experimento. - Adquiera imágenes utilizando un microscopio confocal con función de pila Z y escaneo de teselas.
- Realizar la reconstrucción morfológica utilizando la imagen de FijiJ34.
NOTA: Varios formatos de archivo de imagen se pueden importar al programa utilizando el plugin de formato bio. Recomendamos el uso del plugin Simple Neurite Tracer (STN)35 para la reconstrucción de los dendritas y el axón. Un tutorial simple y claro está disponible en https://imagej.net/SNT y http://snyderlab.com/2016/05/25/tracing-neurons-using-fiji-imagej/. El archivo que contiene los datos de seguimiento(.traces), si se guarda sin comprimir, se puede convertir en un archivo de texto y abrirse con Matlab u otro software para el procesamiento de datos de texto.
Resultados
En este protocolo describimos cómo preparar rodajas agudas de hipocampo de la parte dorsal-intermedia del hipocampo(Figura 1A). El protocolo es particularmente adecuado para experimentos que investigan mecanismos involucrados en el aprendizaje espacial y se pueden combinar con trabajo conductual o estrategias virales de etiquetado o manipulación en el hipocampo dorsal35. Aplicando el procedimiento de seccionamiento descrito aquí a los animales inyectados con GFP dependiente de Cre que expresa el virus asociado al adeno (AAV-FLEX-GFP) en el hipocampo dorsal de ratones Pvalb-IRES-Cre en diferentes coordenadas Bregma AP-1,94 mm, ML ± 0,5-2 mm, profundidad-1,25-2,25 mm para dirigirse a diferentes regiones de la formación del hipocampo36 pudimos obtener al menos tres rebanadas transversales que contienen las regiones infectadas(Figura 1A coloración verde claro en el modelo 3D del hipocampo). Además, se pueden obtener varias rebanadas no transversales pero saludables de las partes más rostrales del hipocampo dorsal(Figura 1C).
Para demostrar la calidad y viabilidad de nuestras rebanadas hemos registrado parámetros electro-fisiológicos y morfológicos básicos de células gránulos y interneurones parvalbumin positivos (PV+) etiquetados con tdTomato en el giro desánido de Pvalb-IRES-Cre; Ratones transgénicos Ai9 (7-12 semanas de edad) y los comparó con las grabaciones de rodajas coronales de la misma región obtenidas con un protocolo estándar.
Tras la inspección visual bajo el microscopio de contraste de interferencia diferencial infrarroja (IR-DIC), ya notamos claras diferencias entre nuestra rebanada transversal y la coronal. Mientras que las neuronas de la capa celular principal en rodajas coronales a menudo parecían gruesas y mostraban contornos fuertemente contrastados, las neuronas en la rebanada transversal mostraban principalmente superficies lisas y sólo bordes ligeramente contrastados, indicativos de una mejor vitalidad celular(Figura 2A). La razón de estas diferencias en la viabilidad celular entre las rodajas coronales y transversales puede estar en la orientación del plano de sección con respecto a los tractos de fibra. Como estos no están en paralelo en las secciones coronales, axones y dendritas serán cortados. En línea con esta suposición, encontramos que dentro de las rodajas los planos superficiales de la capa de células gránulos y el hilus mostraron una mayor discontinuidad en el coronal que la rebanada transversal (tamaño del paso en planos de superficie: 41.40 ± 3.28 μm vs 25.60 ± 2.94 μm, Media ± SEM, T-test P = 0,023), lo que sugiere un mayor grado de desconexión tisular en la rebanada coronal (Figura 2B). Esto significa que las células adecuadas para las grabaciones de abrazaderas de parches solo se encontrarán en planos más profundos de la capa de células de gránulos para rodajas coronales, lo que a su vez puede reducir el rendimiento de las grabaciones de abrazaderas de parches. De hecho, el tiempo promedio para sellar la formación en nuestra rebanada transversal fue más rápido que para las rodajas coronales (células de gránulos: 12.64± 1.50 s, n=11 en coronal frente a 8.40 ± 0.75 s, n=14 en rodajas transversales, Media ± SEM, P= 0.0335 Mann-Whitney test; Interneurons PV+: 31.11 ± 2.60 s, n=9 en coronal contra 22.00 ± 2.18, n=7 en rodajas transversales, Media ± SEM, P= 0.0283 Mann-Whitney test) (Figura 2C). Como representante de la integridad celular y la salud, entonces registramos los potenciales de membrana en reposo (RMP) de las células gránulos y los interneurones PV+, que fueron significativamente más despolartizados tanto en las células gránulo como en los interneurones PV+ en coronal frente a. rodajas transversales (células de gránulo:-62.55 ± 3.54 mV, n=11 en coronal vs.-71.06 ± 2.31 mV, n=14 en rodajas transversales, Media ± SEM, P=0.0455 Prueba Mann-Whitney; Interneurons PV+:-52.75 ± 1.66 mV, n=7 en coronal vs.-59.36 ± 2.25 mV, n=6 en rebanadas transversales Mean ± SEM,, P= 0.0271 Mann-Whitney test) (Figura 2D). Estos datos sugieren un mayor número de neuronas saludables en la transversal frente a la preparación de la rebanada coronal. De hecho, la introducción de un corte para el RMP aceptable (-55 mV para células de gránulo;-45 mV para interneurones PV+) resultó en un mayor porcentaje de células excluidas en coronal que en rodajas transversales (39,67 ± 8,37 %, n=3 sesiones experimentales vs. 23.00 ± 3.85 %, n=4 sesiones experimentales) (Figura 2E). Además, la reconstrucción de la morfología neuronal a partir de células gránulos registradas indicó que, como se esperaba, era mucho mejor recuperar una arborización axonal completa para las células gránulos en la rebanada transversal(Figura 3A,B). Además, la reconstrucción morfológica de los interneurones PV+ en rodajas transversales permitió la representación de extensas arborizaciones axoales y dendríticas, incluida la visualización de pequeños detalles como espinas dendríticas35(Figura 3C).
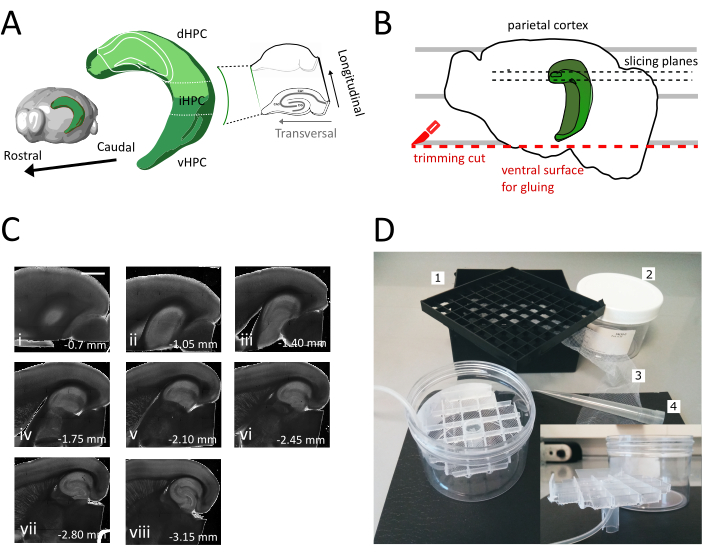
Figura 1: Ilustración del procedimiento de seccionamiento para obtener rodajas de hipocampo dorsal-intermedio. (A) Representación tridimensional de la formación del hipocampo mostrando su orientación espacial en el cerebro (modificada desde Brain Explorer, Instituto Allen)37. Se indican divisiones dorsales, intermedias y ventrales del hipocampo (dHPC, iHPC, vHPC), según Dong et al. (2009)7. La parte del hipocampo dorsal-intermedio que se cortará está indicada en verde claro. El inserto a la derecha muestra la orientación de los ejes de referencia. B) Caricatura de un hemisferio cerebral que representa la alineación de la corteza parietal con las líneas paralelas en la placa de Petri. La línea punteada roja indica dónde realizar el corte de recorte (punto 3.9 en el protocolo) para crear la superficie para pegar el hemisferio en el soporte de la muestra. Las líneas punteadas negras indican dónde se recogen los sectores. (C) Serie de imágenes de campo brillante de rodajas de hipocampo obtenidas después de este procedimiento. Desde la superficie del pial, dorsal a ventral: (i) 0,70 mm, (ii) 1,05 mm, (iii) 1,40 mm, (iv) 1,75 mm, (v) 2,10 mm, vi) 2,45 mm (vii) 2,80 mm, (viii) 3,15 mm. Barra de escala= 1 mm. (D) Foto de la cámara de almacenamiento y el material necesario para su ensamblaje. 1. Rejilla del espaciador vial de una caja de almacenamiento de viales criogénicos de 81x, 2. Caja de plástico cilíndrico. 3. Red de nylon, 4. Punta de pipeta. intercalación. Vista lateral de la rejilla y del soporte del tubo para insertar en la caja cilíndrica. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: El sector transversal muestra una mayor viabilidad del sector en comparación con la rebanada coronal. (A) Micrografías DIC-IR que muestran ejemplos saludables (flechas negras) e insalubres (flechas blancas) de somatas neuronales en rodajas transversales y coronales. Hil=hilus, gcl=capa celular de gránulo, ml= capa molecular. Barra de escala = 50 μm. (B) Ambos procedimientos de seccionamiento producen un paso entre la superficie de la capa de celda del gránulo y el hilus (indicado por las cabezas de flecha). La altura del paso es indicativa de la extensión de la desconexión del tejido y es significativamente menor en secciones transversales que en la prueba coronal (n=5 transversal y n=5 rodajas coronales, Media±SEM, P=0.0238 Prueba Mann-Whitney). (C) Tiempo de formación de sellos giga-ohmios en células de gránulo (n=14 células en transversal, n=11 células coronales; Media±SEM, P= 0,0355, prueba Mann-Whitney) e INs PV+ (n=7 células en sectores transversales, n=9 células en rodajas coronales, Media±SEM, P= 0,0283 Mann-Whitney test). (D) Potencial de membrana en reposo (RMP) de células parcheadas (respectivamente, n= 14 y n=11 células gránulos. Prueba mann-whitney media±SEM, P=0.0455. n=7 PV+ INs y n=10 PV+ INs, P= 0.0271 Prueba Mann-Whitney). (E) Porcentaje de celdas desechadas dentro de una sesión experimental, (n=3 sesiones con sector coronal, n=4 con sector transversal, Media±SEM). Haga clic aquí para ver una versión más grande de esta figura.
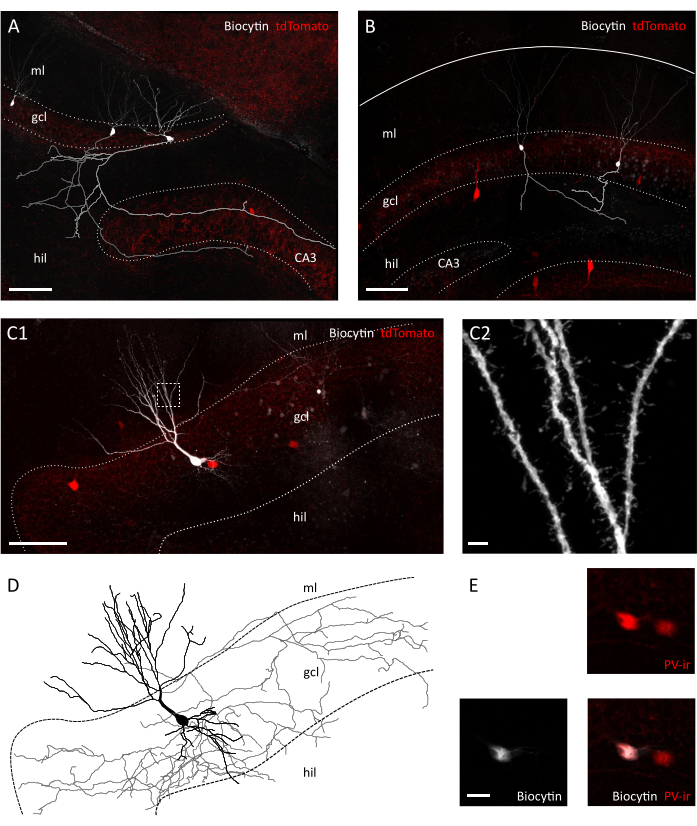
Figura 3: Preservación morfológica de células gránulos e interneurones en la rebanada transversal. Imágenes confocales que muestran células de gránulo rellenas de biocytina en una rebanada transversal(A)y en rodajas coronales(B)de Pvalb-IRES-Cre; Ratones transgénicos Ai9. Los respectivos axones han sido reconstruidos en gris y gris claro. Tenga en cuenta la diferencia en la longitud del axón y la complejidad entre los preparativos. Escala bar=100 μm. (C1) Imagen confocal que muestra un interneuron tdTomato positivo lleno de biocityn. Hil=hilus, gcl=capas de células gránulos, ml= capa molecular. Escala bar=50 μm. (C2) Ampliación del área en caja en C1, mostrando espinas dendríticas. Escala bar=2 μm (D) Reconstrucción morfológica de axones y dendritas del interneuron lleno de biocytina en C1 (axón en gris, soma y dendritas en negro). (E) Primer plano de los somatas de las células representadas en C1 que muestran la colocación de biocytina y parvalbumin-inmunoreactividad (PVir). Escala bar=20 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El hipocampo dorsal ha sido ampliamente estudiado por su papel en el aprendizaje espacial y la navegación principalmente a través de experimentos conductuales, trazado anatómico y manipulaciones específicas de la región. Para combinar las indagaciones electro-fisiológicas en rodajas con estas técnicas, hemos montado un protocolo que utiliza un ángulo similar de seccionamiento como el corte horizontal modificado para la región intermedio-ventral del hipocampo, pero utiliza una orden de corte invertido para obtener rebanadas tempranas de la región dorsal-intermedia. Este enfoque reduce el tiempo necesario para cortar y recoger la región dorsal del hipocampo, mejorando así la viabilidad de las rebanadas.
Usando este método, somos capaces de recuperar rutinariamente alrededor de tres rebanadas por hemisferio de la región del hipocampo dorsal entre 1,4 mm-2,4 mm de la superficie del pial, como se muestra en la Figura 1C. Aunque no es posible con este procedimiento obtener rodajas transversales del polo muy septal del hipocampo, es posible recoger alrededor de dos rebanadas no transversales viables adicionales por hemisferio del polo septal(Figura 1C ii,iii). Si el polo septal del hipocampo es el foco de investigación principal, otros protocolos, que permiten la recolección de rodajas transversales, especialmente desde el polo septal del hipocampo, pueden ser más adecuados21,32. Los experimentos conductuales sobre navegación espacial y aprendizaje se llevan a cabo preferentemente en ratones maduros con conectividad neuronal totalmente desarrollada. En consecuencia, hemos optimizado nuestro procedimiento de corte para la aplicación al cerebro de animales adultos (mostrados aquí para ratones de tres meses de edad), que son más sensibles al estrés que la preparación juvenil resistente. Con este fin hemos combinado varias estrategias que reducen el estrés hipoxico al que el cerebro está expuesto en el tiempo entre la extracción y la colocación de las rodajas en el ACSF oxigenado. La solución de corte protectora es un ACSF a base de NMDG25,27,28 con bajo Na + y Ca2 + pero alto Mg2 + para reducir el daño excitotóxico y la hinchazón celular debido a la activación de los receptores NMDA. Además, HEPES proporciona amortiguación estable y compuestos como el ascorbato y el piruvato reducen el estrés oxidativo. La perfusión transcardial con la solución de corte protector refrigerada y oxigenada aprovecha la red capilar extremadamente densa que suministra al cerebro para reducir rápida y homogéneamente la demanda metabólica y la excitotoxicidad inducida por glutamato en el tejido cerebral. Posteriormente, casi todos los pasos posteriores a la decapitación se realizan dentro de las soluciones enfriadas y oxigenadas para mantener el metabolismo y la privación de oxígeno al mínimo durante todo el procedimiento. Existen otras estrategias para reducir el daño cerebral durante el corte y pueden ser igualmente válidas38. Para demostrar la calidad de nuestra preparación, la comparamos con una preparación de rodajas coronales, que se utiliza comúnmente para grabar desde el hipocampo dorsal. A pesar de que las rodajas coronales se pueden utilizar para obtener una buena grabación de sujeción de parches en el giro dentario, el número de neuronas insalubres y desconectadas es mayor que en la rebanada transversal. Además, la integridad de las arborizaciones axonales y dendríticas se conserva mejor en la rebanada transversal. De hecho, la integridad de los axones de células gránulos(Figura 3A),que corren ortogonales hasta el eje longitudinal del hipocampo, sirve como indicador de un plano transversal de corte1.
Para el llenado de neuronas parcheadas, sugerimos una resistencia al electrodo entre 3 y 5 MΩ. Un diámetro de la punta de aproximadamente 1 μm, permite la realización de una buena resistencia al sello durante la grabación y un buen re-sellado en la retracción del electrodo. El detalle más crucial es evitar la succión de partes del soma o núcleo en la pipeta. Por esta razón, sugerimos incluir un tinte Alexa en la solución intracelular cuando sea posible. El tinte permite monitorear la forma de la célula durante el registro y el re-sellado. Además, permite evaluar la integridad de la célula parcheada después de la fijación, lo que puede ahorrar tiempo de inmunohistoquímica, en casos de rellenos infructuosos. Debido a que los tintes Alexa se apagan con un largo tiempo de fijación, sugerimos una fijación corta si es posible.
Para el inmunostaining posterior, utilizamos un protocolo que no requiere la re-sección del sector. Sugerimos hacer la tinción dentro de una semana después de la fijación. Cuanto más tiempo permanezcan las rodajas en la nevera, mayor será la probabilidad de degradación del tejido. Si no se puede evitar un almacenamiento largo, sugerimos aumentar la concentración de NaN3 en el PBS al 0,05% y actualizarlo semanalmente. La inmunodetención de toda la rebanada significa que los tiempos de incubación con anticuerpos primarios y secundarios aumentan. Por lo general, para revelar biocytina, una incubación nocturna a 4 °C es suficiente, pero si se combina con la tinción de otras proteínas, todo el procedimiento de tinción puede durar mucho más tiempo. El bloqueo de permeabilización y la incubación anti-cuerpo deben optimizarse individualmente. Por lo general, para el anticuerpo primario, dos días son suficientes, mientras que un día puede ser suficiente para el secundario. Recomendamos aumentar la duración de los pasos de lavado junto con incubaciones de anticuerpos más largas para evitar el aumento de antecedentes.
En este protocolo hemos presentado un método de corte para obtener rodajas de hipocampo transversales o casi transversales preservando la viabilidad neuronal del tejido adulto y un enfoque práctico para recuperar la morfología y la identidad neuroquímica de las neuronas parcheadas. Este método se puede realizar fácilmente para que coincida con los resultados electrofisiológicos con estudios anatómicos y conductuales centrados en la parte intermedio-dorsal del hipocampo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Kerstin Kronenbitter y Didier Gremelle, por asistencia técnica. Agradecemos a Umberto Morelli por su ayuda con software gráfico y Mathias Hoppe para la videografía y la edición de vídeo. El trabajo en nuestro laboratorio fue apoyado por el Deutsche Forschungsgemeinschaft (DFG) FOR2143, SFB 1461 (Project-ID 434434223) y GRK2154, la beca G1100546/2 del Consejo de Investigación Médica y la Universidad de Kiel.
Materiales
| Name | Company | Catalog Number | Comments |
| 1mL syringes Omnifix-F | Braun melsungen AG | 9161406V | |
| 24 multiwells | SARSTEDT | 8,33,922 | |
| 81x criogenic vial storage box | Fisherscientific | 15-350-107B | storage chamber |
| Alexa Hydrazide dye | Invitrogen | A10436 | |
| Big scissor | Fine science tool | 14010-15 | graefe forceps |
| Biocytin | IRIS biotech. | LS3510.0250 | |
| Borosilicate Glass capillaries | Science products | GB150TF-10 | storage chamber |
| Brush 5 | Leonhardy | 241 | Micro double spatula, L 150 mm, blade width 4 mm |
| Calcium chloride dihydrate | Roth | 5239.2 | aCSF solution |
| Carbon steel microtome blade | feather | C35 | |
| Chloridric acid | Roth | K025.1 | |
| Confocal microscope | Zeiss | LSM880 | with Airyscan |
| Cyanoacrylate glue | UHU | 509141 | |
| Cyanoacrylate glue, n-butyl-ester VetBond | 3M | ||
| EGTA | Roth | 3054.1 | |
| Fiji ImageJ | fiji.sc | ||
| Filter paper 113A | ROTILABO Roth | AP180.1 | |
| Fine tip tweezer | Dumont | 0245fo | |
| Glass becker (150 ml) | ROTILABO Roth | X690.1 | incubation chamber and dissection |
| Glass Petri dishes (10 cm dia.) | ROTILABO Roth | 0690.1 | |
| Glucose | Roth | X997.2 | aCSF solution |
| Heated water bath | Grant Instruments Ltd | SUB14 | |
| HEPES | Roth | 9105.4 | aCSF solution |
| Isofluoran | baxter | 5239.2 | Anesthetic |
| Large spatula | Roth | E286.1 | |
| Magnesium Sulfate heptahydrate | Roth | 8793.2 | aCSF solution |
| Mg-ATP | Sigma Aldrich | A9187 | |
| Microfil | World precision instruments | MF34G | |
| Na2-GTP | Sigma Aldrich | 51120 | |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF solution |
| Normal goat serum | Sigma Aldrich | 566380 | |
| Nylon mesh kit | Warner Instruments | 64-0198 | incubation chamber and storage chamber |
| Paraformaldeyde | Sigma Aldrich | P6148 | |
| Phosphate buffered saline 10X | Panbiotech | P04-53500 | |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | |
| Pipette puller | Sutter instrument | P-2000 | |
| Pipette tips | SARSTEDT | 7,07,62,211 | incubation chamber |
| Plastic box for syringe filters | SUPELCO | 54135-U | storage chamber |
| Potassium Chloride | Roth | 6781.3 | aCSF solution |
| Potassium Gluconate | Roth | P1847 | |
| Probenbecker becker (100 ml) | ROTILABO Roth | HT85.1 | incubation chamber |
| Rounded tip tweezers | Fine science tool | 11051-10 | |
| Sainless steel blade | Gillette | Vibratome | |
| Small scissor | Fine science tool | 14010-10 | mayo scissor straight |
| Sodium Ascorbate | Roth | 3149.2 | aCSF solution |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium Bicarbonate | Roth | 6885.1 | aCSF solution |
| Sodium Chloride | Roth | 3957.1 | aCSF solution |
| Sodium Hydroxide | Roth | K021.1 | |
| Sodium Phosphate monobasicdihydrat | Roth | K300.1 | aCSF solution |
| Sodium Pyruvate | Roth | 8793.2 | aCSF solution |
| Streptavidin conjiugated Alexa 488 | Invitogen | s11223 | |
| Thin spatula | Roth | E286.1 | Double spatula, L 150 mm, blade width 9 mm |
| Transfer pipette | Sarstedt | 861171 | |
| Triton x100 | Roth | 3051.1 | |
| Vibratome | Thermoscientific | Microm HM650V | |
| Filter device for ultrapure water | Merck-Millipore | Milli-Q IQ 7000 |
Referencias
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65 (1), 7-19 (2010).
- David, A., Pierre, L. Hippocampal Neuroanatomy. The Hippocampus Book. , 37-114 (2006).
- Dong, H. W., Swanson, L. W., Chen, L., Fanselow, M. S., Toga, A. W. Genomic-anatomic evidence for distinct functional domains in hippocampal field CA1. Proceedings of the National Academy of Sciences of the United States of America. 106 (28), 11794-11799 (2009).
- Royer, S., Sirota, A., Patel, J., Buzsaki, G. Distinct representations and theta dynamics in dorsal and ventral hippocampus. Journal of Neuroscience. 30 (5), 1777-1787 (2010).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Foggetti, A., Baccini, G., Arnold, P., Schiffelholz, T., Wulff, P. Spiny and Non-spiny Parvalbumin-Positive Hippocampal Interneurons Show Different Plastic Properties. Cell Rep. 27 (13), 3725-3732 (2019).
- Cembrowski, M. S., Spruston, N. Heterogeneity within classical cell types is the rule: lessons from hippocampal pyramidal neurons. Nature Reviews Neuroscience. 20 (4), 193-204 (2019).
- Moser, M. B., Moser, E. I., Forrest, E., Andersen, P., Morris, R. G. Spatial learning with a minislab in the dorsal hippocampus. Proceedings of the National Academy of Sciences of the United States of America. 92 (21), 9697-9701 (1995).
- Pothuizen, H. H., Zhang, W. N., Jongen-Relo, A. L., Feldon, J., Yee, B. K. Dissociation of function between the dorsal and the ventral hippocampus in spatial learning abilities of the rat: a within-subject, within-task comparison of reference and working spatial memory. European Journal of Neuroscience. 19 (3), 705-712 (2004).
- Fredes, F., et al. Ventro-dorsal Hippocampal Pathway Gates Novelty-Induced Contextual Memory Formation. Current Biology. 31 (1), 25-38 (2021).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Andersen, P. Long-lasting facilitation of synaptic transmission. Ciba Foundation Symposium. (58), 87-108 (1977).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. Journal of Neurophysiology. 67 (5), 1346-1358 (1992).
- Walther, H., Lambert, J. D., Jones, R. S., Heinemann, U., Hamon, B. Epileptiform activity in combined slices of the hippocampus, subiculum and entorhinal cortex during perfusion with low magnesium medium. Neurosci Lett. 69 (2), 156-161 (1986).
- Rafiq, A., DeLorenzo, R. J., Coulter, D. A. Generation and propagation of epileptiform discharges in a combined entorhinal cortex/hippocampal slice. Journal of Neurophysiology. 70 (5), 1962-1974 (1993).
- Leutgeb, J. K., Frey, J. U., Behnisch, T. LTP in cultured hippocampal-entorhinal cortex slices from young adult (P25-30) rats. Journal of Neuroscience Methods. 130 (1), 19-32 (2003).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature Protocols. 1 (3), 1235-1247 (2006).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording Synaptic Plasticity in Acute Hippocampal Slices Maintained in a Small-volume Recycling-, Perfusion-, and Submersion-type Chamber System. Journal of Visualized Experiments. (131), e55936 (2018).
- Dougherty, K. A., Islam, T., Johnston, D. Intrinsic excitability of CA1 pyramidal neurones from the rat dorsal and ventral hippocampus. Journal of Physiology. 590 (22), 5707-5722 (2012).
- Tidball, P., et al. Differential ability of the dorsal and ventral rat hippocampus to exhibit group I metabotropic glutamate receptor-dependent synaptic and intrinsic plasticity. Brain and Neuroscience Advances. 1 (1), (2017).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159 (2005).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), e53825 (2018).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Archives. 414 (5), 600-612 (1989).
- Djurisic, M. Minimizing Hypoxia in Hippocampal Slices from Adult and Aging Mice. Journal of Visualized Experiments. (161), e61377 (2020).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. P. Acute Brain Slice Methods for Adult and Aging Animals: Application of Targeted Patch Clamp Analysis and Optogenetics. Patch-Clamp Methods and Protocols, 2nd Edition. 1183, 221-242 (2014).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments. (91), e51706 (2014).
- Norenberg, A., Hu, H., Vida, I., Bartos, M., Jonas, P. Distinct nonuniform cable properties optimize rapid and efficient activation of fast-spiking GABAergic interneurons. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 894-899 (2010).
- Swietek, B., Gupta, A., Proddutur, A., Santhakumar, V. Immunostaining of Biocytin-filled and Processed Sections for Neurochemical Markers. Journal of Visualized Experiments. (118), e54880 (2016).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nature Protocols. 1 (4), 1977-1986 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Longair, M. H., Baker, D. A., Armstrong, J. D. Simple Neurite Tracer: open source software for reconstruction, visualization and analysis of neuronal processes. Bioinformatics. 27 (17), 2453-2454 (2011).
- Murray, A. J., et al. Parvalbumin-positive CA1 interneurons are required for spatial working but not for reference memory. Nature Neuroscience. 14 (3), 297-299 (2011).
- Otis, T. S., Staley, K. J., Mody, I. Perpetual inhibitory activity in mammalian brain slices generated by spontaneous GABA release. Brain Research. 545 (1-2), 142-150 (1991).
- Varela, C., Llano, D. A., Theyel, B. B. An introduction to in vitro slice approaches for the study of neuronal circuitry. Neuromethods. 67, 103-125 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados