Method Article
Vorbereitung von akuten Scheiben aus dem Dorsal Hippocampus für die Ganzzellaufnahme und neuronale Rekonstruktion im Dentate Gyrus von erwachsenen Mäusen
In diesem Artikel
Zusammenfassung
Wir stellen ein Protokoll zur Vorbereitung von Akutscheiben aus dem dorsal-zwischengeschalteten Hippocampus von Mäusen vor. Wir vergleichen dieses transversale Präparat mit koronalen Schnitten in Bezug auf die Qualität der Aufnahmen und die Erhaltung morphologischer Merkmale aufgezeichneter Neuronen.
Zusammenfassung
Obwohl die allgemeine Architektur des Hippocampus entlang seiner Längsachse ähnlich ist, haben neuere Studien prominente Unterschiede in molekularen, anatomischen und funktionellen Kriterien aufgedeckt, die auf eine Teilung in verschiedene Unterkreise entlang seiner rostro-kaudalen Ausdehnung hindeuten. Aufgrund der unterschiedlichen Konnektivität und Funktion wird die grundlegendste Unterscheidung zwischen dem dorsalen und dem ventralen Hippocampus getroffen, die bevorzugt an der räumlichen bzw. emotionalen Verarbeitung beteiligt sind. Dementsprechend konzentrierte sich die In-vivo-Arbeit zur räumlichen Gedächtnisbildung auf den dorsalen Hippocampus.
Im Gegensatz dazu wurden elektrophysiologische In-vitro-Aufnahmen bevorzugt auf dem mittelventralen Hippocampus durchgeführt, der hauptsächlich durch Faktoren wie die Lebensfähigkeit der Scheibe und die Schaltkreisintegrität motiviert ist. Um eine direkte Korrelation von In-vivo-Daten über die räumliche Verarbeitung mit In-vitro-Daten zu ermöglichen, haben wir frühere Schnittmethoden angepasst, um hochpraktikable transversale Hirnscheiben aus dem dorsal-zwischengeschalteten Hippocampus für Langzeitaufnahmen von Hauptzellen und Interneuronen im Dentate-Gyrus zu erhalten. Da räumliches Verhalten routinemäßig bei erwachsenen Mäusen analysiert wird, haben wir dieses transversale Schneidverfahren mit der Verwendung von Schutzlösungen kombiniert, um die Lebensfähigkeit von Hirngewebe von reifen Tieren zu verbessern. Wir verwenden diesen Ansatz für Mäuse von etwa 3 Monaten alt. Die Methode bietet eine gute Alternative zur koronalen Präparation, die häufig für In-vitro-Studien am dorsalen Hippocampus verwendet wird. Wir vergleichen diese beiden Präparate in Bezug auf die Qualität der Aufnahmen und die Erhaltung morphologischer Merkmale von aufgezeichneten Neuronen.
Einleitung
Der Hippocampus wurde ausgiebig auf seine zentrale Rolle in verschiedenen Aspekten des Lernens und Gedächtnisses, der räumlichen Navigation sowie der Emotion untersucht. Die Grundschaltung des Hippocampus, gemeinhin als "trisynaptische Schaltung" bezeichnet, ist ein lamellares Netzwerk in der Querachse, das weitgehend entlang der Längsachse1erhalten bleibt. Die Beiträge des Hippocampus zu verschiedenen kognitiven und emotionalen Verhaltensweisen ergeben sich wahrscheinlich aus den vielfältigen Verbindungen, die diese Grundschaltung entlang der dorsoventralen Achse mit mehreren anderen Hirnregionen2,3macht. Abgesehen von der affekten und effemittenten Konnektivität deuten jedoch immer mehr Studien auf weitere Unterschiede entlang der septo-temporalen Achse des Hippocampus hin. Solche Unterschiede betreffen die interne Architektur und Konnektivität sowie Unterschiede in Genexpressionsmustern und neuronaler Morphologie4,5,6,7,8.
In Anbetracht der Existenz solcher Unterschiede in der Grundschaltung ist es sinnvoll, den spezifischen Hippocampus-Unterkreis auszuwählen, der gemäß den angesprochenen Fragen untersucht werden soll. Wenn es zum Beispiel um neuronale Mechanismen geht, die an der räumlichen Verarbeitung beteiligt sind, ist der dorsale und nicht der ventrale Hippocampus von Interesse, obwohl die beiden aufgrund der intrahippocampalen Längskonnektivität9,10,11nicht unabhängig in vivo agieren. Dabei sind nicht nur die Unterschiede entlang der Längsachse zu berücksichtigen, sondern auch die Pflege ist erforderlich, um lokale und weiträumige Schaltungen so gut wie möglich zu erhalten. Für die Erhaltung der Faserpfade und konnektivitätsgebunden ist der Winkel, in dem das Gehirn geschnitten wird, unerlässlich.
Die erste Methode, die in der Literatur berichtet wurde, um den trysinaptischen Kreislauf einzubeziehen, isolierte zuerst den Hippocampus aus dem Gehirn und machte dann Querscheiben (senkrecht zu den Längsachsen) mit einem Gewebechopper12 und einem Vibratome13. Spätere Physiologen bevorzugten Scheiben aus einem ganzen Hirnblock, um auch die angrenzenden Gehirnstrukturen zu erhalten, die mit dem Hippocampus verbunden sind. Für diese Blockpräparate wurden verschiedene Schnittwinkel in Bezug auf den Hippocampus entwickelt, wie z.B. ein koronares Scheibenpräparat14 oder ein horizontales Scheibenpräparat namens HEC-Scheibe zur Erhaltung hippocampal-entorhinaler Kortexverbindungen15,16,17.
Bei der letztgenannten Präparation wird der parietale Lappen mit einem Winkel von 0° oder 12° in Bezug auf die horizontale Ebene entlang der rostro-kaudalen Achse geschnitten, um die Basis des Blocks zu bilden. Slices werden dann ausgehend von der ventralen Oberfläche des Gehirns gesammelt, wodurch hauptsächlich die Ernte der mittelventralen Hippocampusregion ermöglicht wird. Diese Methode ist die beliebteste Wahl für physiologische Studien geworden und kann zuverlässig nach mehreren veröffentlichten Protokollen durchgeführt werden18,19,20.
Wenn das Forschungsinteresse jedoch bestimmte Aspekte des räumlichen Lernens betrifft, könnte der dorsale Hippocampus die geeignetere Untersuchungsregion sein, und es wäre sinnvoll, ein Schneidverfahren von ähnlicher Qualität für diese Hippocampusregion zu finden. Es wurden nur wenige Protokolle entwickelt, die sich auf den rostralen Pol konzentrieren, die diese Nachfrage befriedigen können 21,22.
In diesem Protokoll beschreiben wir stattdessen einen Ansatz, um lebensfähige Querscheiben aus dem dorsal-zwischengeschalteten Hippocampus zu erhalten, der den zuvor beschriebenen Schnittwinkel für horizontale Präparate18,19 (Abbildung 1A&B) verwendet. Wir demonstrieren die Qualität dieses Protokolls, indem wir elektrophysiologische Aufnahmen und morphologische Rekonstruktionen in dieser Zubereitung mit denen vergleichen, die in koronalen Scheiben erhalten wurden. Dieses Protokoll eignet sich besonders für die Kombination mit anatomischen und Verhaltensexperimenten an erwachsenen Mäusen (in unserem Fall drei Monate alt).
Protokoll
Alle Verfahren mit Versuchstieren wurden nach dem Tierschutzgesetz durchgeführt und von der Ethikkommission der Universität kiel genehmigt. Parvalbumin-Cre (Pvalb-IRES-Cre) Mäuse23 (Jackson Laboratorien, Repository Nummer 008069) wurden als heterozygote Kolonien gepflegt oder mit Ai9 Cre Reportermäusen24 gekreuzt (Jackson Laboratorien, Repository-Nummer 007909). Es wurden weibliche und männliche Mäuse zwischen P40-P90 verwendet. Mäuse wurden in einem 12-h-Licht-Dunkel-Zyklus unter Standard-Gruppengehäusebedingungen gehalten und mit Nahrung und Wasser ad libitumversorgt.
1. Vorbereitung von Lösungen
HINWEIS: Bereiten Sie frische Lösungen für jeden versuchsweisen Tag mit Reinstwasser (UPW) (Widerstand bei 25 °C 18,2 m cm) vor. Die Lösungen können maximal einen Tag bei 4 °C gelagert werden. Magnesium- und Calciumlösungen können separat als 1 M Stammlösungen gelagert werden. Alle Arbeitslösungen müssen mit Carbogen (95% O2:5%CO2) gesättigt sein, um eine optimale Sauerstoffversorgung und pH-Wartung vor und während des Gebrauchs zu ermöglichen.
- Bereiten Sie die Schneidlösung (500 ml pro Maus) (in mM): 92 NMDG, 2.5 KCl, 1.25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 Glucose, 5 Na-Ascorbat, 4 Na-Pyruvat, 0,5 CaCl22 X2O und 10 MgSO47H2O. Titrat auf pH 7,4 unter einer chemischen Haube mit 4-5 ml 16% Salzsäure vor Zugabe der Divalente. Dadurch wird der Niederschlag von MgSO4vermieden.
HINWEIS: KCl und NaH2PO4 können als 10x Lösungen bei 4°C gelagert werden. Wir stellen zwei einzelne Chargen von Schneidlösungen. Eine am Tag vor der Aufnahme (in einem Gefrierschrank über Nacht gelagert, um zerkleinertes Eis zu produzieren) und eine am Tag der Aufnahme. - Vorbereiten der Speicherlösung (250 ml pro Maus) (in mM): 92 NaCl, 2.5 KCl, 1.25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 Glucose, 5 Na-Ascorbat, 4 Na-Pyruvat, 2 CaCl2'2H2O, und 2 MgSO4'7H2O. Titrate zu pH 7.3-7.4 mit 1 N NaOH.
HINWEIS: NaCl, KCl und NaH2PO4 können als 10-fache Lösung bei 4 °C gelagert werden. - ACSF für die Aufnahme vorbereiten (in mM): 122 NaCl, 2.5 KCl, 1.25 NaH2PO4, 24 NaHCO3, 12.5 Glukose, 2 CaCl2'2H2O, und 2 MgSO4'7H2O, 2 Na-Ascorbat, 4 Na-Pyruvat. Itrieren pH auf 7.3-7.4 mit 1 N NaOH.
HINWEIS: NaCl, KCl und NaH2PO4 können in einer 10-fachen Lagerlösung bei 4°C kombiniert werden.
2. Vorbereitung der Bank zum Schneiden
- Auf Eis ein Becherglas (150 ml) und zwei Glas-Petri-Schalen (10 cm Durchmesser) zubereiten und mit der frisch geschnittenen Lösung füllen. Bewahren Sie die Lösung mit sauerstoffhaltigen Vorrichtungen auf (ein perforiertes Rohr oder einen mit dem Carbogen-System verbundenen Luftstein).
HINWEIS: Die Lösung im Becher wird für die Perfusion verwendet, während die Petrischalen während des Schneidvorgangs verwendet werden. - Statten Sie die Operationsbank mit einer Edelstahlklinge, einer abgerundeten Spitzenpinzette, einer Feinspitzenpinzette, einer großen Schere, einer kleinen Schere, einem großen Metallspachtel, einem dünnen Metallspachtel, einer Bürste, der Vibratomplatte und dem Cyanoacrylatkleber oder dem weniger toxischen n-Butylester-Cyanoacrylatkleber aus. Tauchen Sie eine Edelstahlklinge und ein Stück Filterpapier in eine der glasigen Petrischalen auf Eis. Diese Petri wird verwendet, um das Gehirn zu schneiden. Zeichnen Sie drei parallele Linien auf den Boden einer Kunststoff-Petrischale und positionieren Sie diese Schale in der Nähe der chirurgischen Instrumente.
- Bereiten Sie die Einrichtung für die transkardiale Perfusion gemäß den veröffentlichten Protokollen25vor.
- Bereiten Sie das Vibratom vor, montieren Sie eine neue Klinge auf dem Klingenhalter und stellen Sie die Parameter für das Schneiden (Winkel der Klinge von der horizontalen Ebene 17°, Klingenschwingungsamplitude 1,5 mm, Blatt vorwärts Bewegungsgeschwindigkeit bei etwa 2 mm min-1, Schwingungsfrequenz 90 Hz, Schnittdicke 350 m). Füllen Sie das Vibramtablett mit eiskalter Schneidlösung und halten Sie es unter konstanter Sauerstoffversorgung.
HINWEIS: Wir fügen das zerkleinerte Eis aus der ersten Charge der Schneidlösung der gekühlten Frischschneidlösung hinzu, um die Temperatur niedrig zu halten. Achten Sie darauf, das Eis beim Schneiden von der Klinge fernzuhalten. - Bereiten Sie eine Inkubationskammer mit der Schneidlösung unter konstanter Sauerstoffversorgung gefüllt. Legen Sie die Kammer in ein vorgewärmtes Wasserbad (35 °C).
HINWEIS: Ein Beispiel für die Inkubationskammer finden Sie in Edwards und Konnerth (1992)26. - Bereiten Sie eine mit der Lagerlösung gefüllte Scheibenlagerkammer vor und halten Sie sie bei Raumtemperatur und konstanter Sauerstoffversorgung. Wenn das Gewebe ein fluoreszierendes Protein oder ein lichtaktiviertes Opsin ausdrückt, ist es empfehlenswert, die Kammer im Dunkeln zu halten, zum Beispiel in einer Box.
HINWEIS: Eine Lagerkammer mit mehreren unabhängigen Brunnen ist nützlich, um das Niveau der Scheiben entlang der dorsoventralen Achse des Hippocampus zu unterscheiden. Es kann eine maßgeschneiderte Kammer gebaut werden (Abbildung 1D). Nehmen Sie ein Stück Fläschchen-Abstandsgitter aus einer 81x kryogenen Fläschchenaufbewahrungsbox und kleben Sie den Boden auf ein Nylonnetz. Legen Sie das obere Drittel einer 5 ml Pipette Kunststoffspitze in die Mitte dieses Gitters, so dass es etwa 3 cm an der Unterseite herausragt. Diese Kunststoffspitze dient als Ständer des Gitters und hält später die Luftschläuche für die Sauerstoffversorgung. Setzen Sie das Gitter mit seinem Ständer in eine zylindrische Kunststoffbox (z. B. Verpackung von Spritzenfiltern) ein, damit es nicht kippen oder wackeln kann. Dieses Reservoir wird 250 ml Speicherlösung enthalten.
3. Zubereitung von Hippocampusscheiben
- Anästhetisieren Sie die Maus in einer Kastenkammer mit Isofluran (ca. 0,5 ml) unter der Haube. Lassen Sie die Maus ruhen, bis die Atmung langsam und normal ist (ca. 2-3 Minuten). Testen Sie auf das Fehlen von Schmerzreaktionen mit Zehenkneifen.
- Durchführung der transkardialen Perfusion mit 25 ml kohlensäurehaltiger Schneidlösung aus dem Becherbecher auf Eis nach den veröffentlichten Protokollen25,27. Dieser Schritt wird empfohlen, um das Gehirn schnell abzukühlen, um den neuronalen Stoffwechsel schnell zu verlangsamen.
- Enthaupten Sie das Tier mit der großen Schere und legen Sie den Kopf in die gekühlte Petrischale auf Eis, das die Schneidlösung enthält.
- Öffnen Sie die Haut mit der feinen Schere, um den Schädel freizulegen. Machen Sie kleine seitliche Einschnitte in die Basis des Schädels auf beiden Seiten des Foramen magnum. Dann entlang der sagittalen Naht schneiden, beginnend am Foramen magnum, bis die naso-frontale Naht über der Olfaktor-Lampe erreicht. Ziehen Sie die Schere während des sagittalen Schnitts hoch, um Schäden am darunter liegenden Hirngewebe zu vermeiden.
HINWEIS: Das Eintauchen des Kopfes in die Schneidlösung hilft, ihn aus dem Blut zu befreien und hält die Temperatur niedrig. - Verwenden Sie die abgerundete Spitzen-Pinzette, um die parietalen Knochen hochzuziehen, um das Gehirn freizulegen. Achten Sie darauf, zu greifen und entfernen Sie die Meninges zu. Wenn sie verlassen werden, können sie das Gehirn während der Extraktion schädigen.
- Verwenden Sie den kleinen Spachtel, um das Gehirn sanft in die zweite Petrischale auszuhöhlen.
- Schneiden Sie das Gehirn in Hälften entlang der Längsspalte mit der vorgekühlten Klinge.
- Verwenden Sie den großen Spachtel, um eine Hemisphäre aus der Schneidlösung auf die Petrischale aus Kunststoff zu heben. Wenn die Hemisphäre auf ihrer medialen Oberfläche liegt, richten Sie den parietalen Kortex an einer der parallelen Linien aus, um eine Referenz für den zweiten Schnitt zu haben, wie in Abbildung 1Bdargestellt.
- Führen Sie den zweiten Schnitt am ventralen Teil der Hemisphäre durch, indem Sie die Klinge parallel zu den Linien positionieren, um die Oberfläche zu erhalten, die später zum Kleben des Gehirns auf den Probenhalter verwendet wird (siehe nächster Schritt), wie in Abbildung 1Bdargestellt. Geben Sie die Hemisphäre in die sauerstoffreiche Schneidlösung der Glaspetrischale zurück und führen Sie das gleiche Verfahren auf der zweiten Hemisphäre durch.
- Kleben Sie die Halbkugeln mit der frisch geschnittenen ventralen Seite mit dem Klebstoff auf den Vibratome-Probenhalter. Legen Sie ein paar Tropfen Schneidlösung auf die Hemisphären, um den Kleber zu verfestigen und den Probenhalter in die Vibramschale zu bewegen. Auf diese Weise wird das Schneiden vom Dorsal zum ventralen Hippocampus verlaufen.
- Entfernen Sie die anfänglichen ein oder zwei nicht-transversale Slices (Abbildung 1C, ii-iii), bis der Interessenbereich sichtbar wird, und beginnen Sie dann mit dem Sammeln der Slices.
HINWEIS: Nicht-transversale, aber verwendbare, gesunde Scheiben können vom dorsalen Hippocampus zu Beginn des Schneidverfahrens erhalten werden (Abbildung 1C,ii-iii). Die Sammlung jeder Scheibe erfordert ca. 3-4 min. Durch den Beginn des Schneidens aus dem dorsalen statt ventralen Hippocampus sparen wir etwa 10 Minuten, was die Lebensfähigkeit von dorsalen Scheiben verbessert. - Mit einer Kunststoffpipette (das schmale Ende der Spitze abschneiden) jede Scheibe in die Inkubationskammer (mit Schneidlösung bei 35 °C) geben und 12 min ruhen lassen. Die kurze Erholungsphase in warm schneidenlösung stark reduziert anfängliche neuronale Schwellung, wie in Ting et al. berichtet (2014)28. Dann mit einem Pinsel die Scheibe in die Lagerkammer (mit Lagerungslösung bei RT) übertragen und bis zum Beginn des Experiments ruhen lassen.
4. Ganzzellaufnahme und Biocytinfüllung
HINWEIS: Die Beschreibung der Ganzzell-Patch-Clamp-Aufzeichnung wird hier nur auf schlüsselfertige Schritte reduziert, die helfen, eine gute Biozytinfüllung zu erhalten, und ist allgemein auf Neuronen in ACSF anwendbar. Für Einzelheiten über die Verfahren der elektrophysiologischen Aufzeichnungen können mehrere andere Protokolle konsultiert werden29,30.
- Wählen Sie eine geeignete intrazelluläre Lösung entsprechend den zu erfassenden Parametern aus. Als Beispiel kann für aktuelle Klemmmessungen eine Kaliumgluconat-basierte Lösung (in mM) verwendet werden: 135 K-Gluconat, 3 KCl, 10 HEPES, 0.2 EGTA, 10 Phosphokkreatin-Na2, 4 MgATP, 0.3 Na2-GTP. Stellen Sie den pH-Wert mit 1 M KOH auf 7,3 ein. Die Osmolalität sollte etwa 285-290 mOsmol/kg betragen, sobald 3-5 mg/ml Biocytin zugegeben wird.
ANMERKUNG: Um die Form des Neurons während der Aufnahme zu überwachen, können der intrazellulären Lösung 0,3-0,5 l/ml 1 mM Alexa Fluor Hydrazid zugesetzt werden. In diesem Fall, denken Sie an Biocytin Offenbarung, um die Alexa Farbstoff Farbe mit der fluoreszierenden Sonde gekoppelt an Streptavidin entsprechen. - Bereiten Sie Patch-Clamp-Elektroden mit ≤1 m Spitzendurchmesser und 3-5 M-Widerstand durch dickwandige Borosilikatkapillaren vor.
- Starten Sie das Perfusionssystem des Patch-Clamp-Setups mit einer Geschwindigkeit von 2,5-3 ml/min bei RT oder 35-37 °C und sichern Sie eine Scheibe in der Kammer mit einem U-förmigen Anker.
- Identifizieren Sie die von Interesse sindde Hirnregion und wählen Sie ein gesundes Neuron mit dem Soma mindestens 30-50 m unter der Oberfläche der Scheibe.
HINWEIS: Das Soma eines gesunden Neurons hat eine glatte Oberfläche, und die Membranränder sind leicht kontrastiert. Das Soma ungesunder Neuron erscheint geschrumpft und stark kontrastiert oder geschwollen und halbtransparent. - Laden Sie eine Glaspipette mit der intrazellulären Lösung, bis die Spitze der AgCl-Elektrode abgedeckt ist. Bewegen Sie die Pipette in die Lösung der Aufnahmekammer, indem Sie einen leichten positiven Druck anwenden, um die Spitze der Glaselektrode frei zu halten.
HINWEIS: Wenn die Lösung einen Alexa-Farbstoff enthält, kann der Druck visuell gesteuert werden, um die Menge der fluoreszierenden Lösung, die von der Spitze freigesetzt wird, anzupassen. Minimaler Druck würde die Färbung des Gewebes um die Zelle vermeiden. - Nähern Sie sich der Zelle aus einem schrägen Winkel und stellen Sie Kontakt innerhalb des ersten Drittels der Soma-Oberfläche auf, wenn Sie die Giga-Dichtung bilden. Lassen Sie den Druck los, bewegen Sie langsam das Haltepotential auf-65 mV und tragen Sie eine sanfte Absaugung durch den Mund auf, um die Giga-Dichtungsbildung zu erleichtern.
- Um die Ganzzellkonfiguration zu etablieren, wenden Sie eine starke und kurze Absaugung an, um die Membran zu brechen. Verwerfen Sie die Aufzeichnung, wenn das Neuron ein Membranpotential hat, das depolarisierter ist als 50 mV, wenn der Haltestrom über 100 pA ansteigt oder wenn der Zugriffswiderstand über 30 Mio. € steigt.
- Nach der Aufnahme (für ausreichende Füllung von Somata und Dendriten werden mindestens 15 min empfohlen; für das Befüllen komplexer Axone bis zu einer Stunde vielleicht erforderlich31) entfernen Sie vorsichtig die Elektrode. Setzen Sie zu diesem Zweck das Haltepotenzial auf 0 mV und versuchen Sie, eine Giga-Dichtung neu zu bilden, indem Sie die Pipette langsam in die entgegengesetzte Richtung des Ansatzes zurücknehmen, z. B. um eine Außen-Patch-Konfiguration zu erhalten.
HINWEIS: Das Vorhandensein des Alexa-Farbstoffs in den intrazellulären Lösungen hilft bei der visuell geführten Entfernung der Pipette von der neuronalen Oberfläche. Wenn der Zellkern nicht mit der Pipettenspitze in Berührung kommt, wird die Pipette mit hoher Geschwindigkeit schnell aus dem Gewebe gezogen. Wenn sich der Kern oder ein Teil der Membran innerhalb der Spitze befindet, besteht die Gefahr, dass die Plasmamembran bricht. In diesem Fall kann eine leichte Positivedruckanwendung und seitliche Bewegung helfen. - Beachten Sie die Position der Zelle und die Ausrichtung des Segments. Nach der Fixierung können die genaue Ausrichtung der Scheibe und die Integrität der gefüllten Zelle unter einem Fluoreszenzmikroskop überprüft werden.
5. Immunostainierung, Bildaufnahme und morphologische Rekonstruktion
- Nach der Aufnahme die Scheiben in eine 24-Well-Platte geben, um sie in Paraformaldehyd (PFA) 4% in 0,1 M Phosphat-gepufferter Kochsaline (PBS) zu fixieren. Inkubieren Sie für 60 min bei RT oder über Nacht bei 4 °C, entsprechend der Empfindlichkeit der verwendeten primären Antikörper. Slices können in 0,1 M PBS und 0,02% NaN3gespeichert werden.
VORSICHT: PFA ist giftig. Verwenden Sie unter der Haube. - Durchführung von Immunostainierung und Biocytin-Offenbarung innerhalb einer Woche nach der Aufnahme nach etablierten Protokollen32,33.
HINWEIS: Wir verwenden ein Verfahren, das eine erneute Schnitte des Slices vermeidet, um die Integrität dendritischer und axonaler Prozesse zu erhalten. Dieses Verfahren erfordert jedoch längere Inkubationszeiten, da Antikörper in das Gewebe eindringen müssen. Wir empfehlen, die Zeit für eine optimale Penetration von Antikörpern in das Gewebe zu testen, bevor das Experiment durchgeführt wird. - Erfassen Sie Bilder mit einem konfokalen Mikroskop mit Z-Stack und Kachel-Scan-Funktion.
- Führen Sie eine morphologische Rekonstruktion mit Fidschi-BildJ34durch.
HINWEIS: Mehrere Bilddateiformate können mit dem Bio-Format-Plugin in das Programm importiert werden. Wir empfehlen die Verwendung des Simple Neurite Tracer (STN) Plugins35 für die Rekonstruktion der Dendriten und des Axons. Ein einfaches und klares Tutorial ist auf https://imagej.net/SNT und http://snyderlab.com/2016/05/25/tracing-neurons-using-fiji-imagej/ verfügbar. Die Datei, die die Ablaufverfolgungsdaten(.traces) enthält, kann, wenn sie unkomprimiert gespeichert wird, in eine Textdatei konvertiert und mit Matlab oder einer anderen Software für die Textdatenverarbeitung geöffnet werden.
Ergebnisse
In diesem Protokoll beschreiben wir, wie man akute Hippocampus-Scheiben aus dem dorsal-mittleren Teil des Hippocampus zubereitet (Abbildung 1A). Das Protokoll eignet sich besonders für Experimente, die Mechanismen des räumlichen Lernens untersuchen und kann mit Verhaltensarbeit oder viralen Etikettierungs- oder Manipulationsstrategien im dorsalen Hippocampus35kombiniert werden. Anwendung des hier beschriebenen Schnittverfahrens auf die Tiere, die mit cre-abhängigem GFP-Exzessenadeno-assoziiertem Virus (AAV-FLEX-GFP) in den dorsalen Hippocampus von Pvalb-IRES-Cre-Mäusen an verschiedenen Bregma-Koordinaten AP-1,94 mm injiziert wurden, ML ± 0,5-2 mm, Tiefe-1,25-2,25 mm, um verschiedene Regionen der Hippocampusbildung36 anzusprechen, konnten wir mindestens drei transversale Scheiben erhalten, die die infizierten Regionen enthalten(Abbildung 1A hellgrüne Färbung auf dem 3D-Modell des Hippocampus). Darüber hinaus können mehrere nicht-transversale, aber gesunde Scheiben aus den rostralen Teilen des dorsalen Hippocampus gewonnen werden (Abbildung 1C).
Um die Qualität und Lebensfähigkeit unserer Scheiben zu demonstrieren, haben wir grundlegende elektrophysiologische und morphologische Parameter von Granulatzellen und tdTomato-markierte Parvalbumin-positive (PV+) Interneurons im Dentate-Gyrus von Pvalb-IRES-Cre aufgezeichnet; Ai9 transgene Mäuse (7-12 Wochen alt) und verglichen diese mit Aufnahmen von koronalen Scheiben der gleichen Region mit einem Standardprotokoll erhalten.
Bei der Sichtprüfung unter dem Infrarot-Differential-Interferenz-Kontrastmikroskop (IR-DIC) haben wir bereits deutliche Unterschiede zwischen unserer Transversal- und der Koronalscheibe festgestellt. Während Die Neuronen der Hauptzellschicht in koronalen Scheiben oft grob und stark kontrastiert erschienen, zeigten Neuronen in der transversalen Scheibe meist glatte Oberflächen und nur leicht kontrastierte Ränder, was auf eine bessere zelluläre Vitalität hindeutet(Abbildung 2A). Der Grund für diese Unterschiede in der Zelllebensfähigkeit zwischen koronalen und transversalen Scheiben kann in der Ausrichtung der Schnittebene in Bezug auf die Fasertrakte liegen. Da diese in den koronalen Abschnitten nicht parallel sind, werden Axone und Dendriten getrennt. Im Einklang mit dieser Annahme Wir fanden heraus, dass innerhalb der Scheiben die Oberflächenebenen von Granulatzellschicht und Hilus eine größere Diskontinuität in der koronalen Alsklasse zeigten (Schrittgröße in Oberflächenebenen: 41,40 ± 3,28 m vs 25,60 ± 2,94 m, Mittelwert ± SEM, Unpaired t-Test P = 0,023), was auf einen größeren Grad an Gewebetrennung in der Koronascheibe hindeutet (Abbildung 2B). Das bedeutet, dass geeignete Zellen für Patch-Clamp-Aufnahmen nur auf tieferen Ebenen der Granulatzellschicht für koronale Scheiben gefunden werden, was wiederum den Durchsatz von Patch-Clamp-Aufnahmen reduzieren kann. Tatsächlich war die durchschnittliche Zeit zum Versiegeln der Bildung in unserer transversalen Scheibe schneller als bei koronalen Scheiben (Granulatzellen: 12,64± 1,50 s, n=11 in koronalen vs. 8,40 ± 0,75 s, n=14 in transversalen Scheiben, Mean ± SEM, P= 0,0335 Mann-Whitney-Test; PV+ interneurons: 31,11 ± 2,60 s, n=9 in koronal gegenüber 22,00 ± 2,18, n=7 in querförmigen Scheiben, Mean ± SEM, P= 0,0283 Mann-Whitney-Test) (Abbildung 2C). Als Proxy für Zellintegrität und Gesundheit haben wir dann die ruhenden Membranpotentiale (RMP) von Granulatzellen und PV+ Interneuronen, die sowohl in Granulatzellen als auch in PV+ Interneuronen in koronalen vs. transversalen Scheiben signifikant stärker depolarisiert waren (Granulatzellen:-62,55 ± 3,54 mV, n=11 in koronalen vs.-71.06 ± 2,31 mV, n=14 in transversalen Scheiben, Mean ± SEM, P=0.0455 Mann-Whitney-Test; PV+ interneurons:-52.75 ± 1.66 mV, n=7 in coronal vs.-59.36 ± 2.25 mV, n=6 in querförmigen Scheiben Mean ± SEM,, P= 0.0271 Mann-Whitney test) (Abbildung 2D). Diese Daten deuten auf eine höhere Anzahl von gesunden Neuronen in der transversalen im Vergleich zu der coronalen Scheibenvorbereitung. Tatsächlich führte die Einführung eines Cut-offs für den akzeptablen RMP (-55 mV für Granulatzellen;-45 mV für PV+ Interneurons) zu einem höheren Prozentsatz ausgeschlossener Zellen in koronalen Als in transversalen Scheiben (39,67 ± 8,37 %, n=3 experimentelle Sessions vs. 23,00 ± 3,85 %, n=4 experimentelle Sessions) (Abbildung 2E). Darüber hinaus zeigte die Rekonstruktion der neuronalen Morphologie aus aufgezeichneten Granulatzellen, dass die Chancen wie erwartet viel besser waren, eine vollständige axonale Arborisierung für Granulatzellen in der transversalen Scheibe abzurufen (Abbildung 3A,B). Darüber hinaus ermöglichte die morphologische Rekonstruktion von PV+ Interneuronen in transversalen Scheiben die Darstellung umfangreicher axonaler und dendritischer Arborisationen, einschließlich der Visualisierung kleiner Details wie dendritischer Stacheln35(Abbildung 3C).
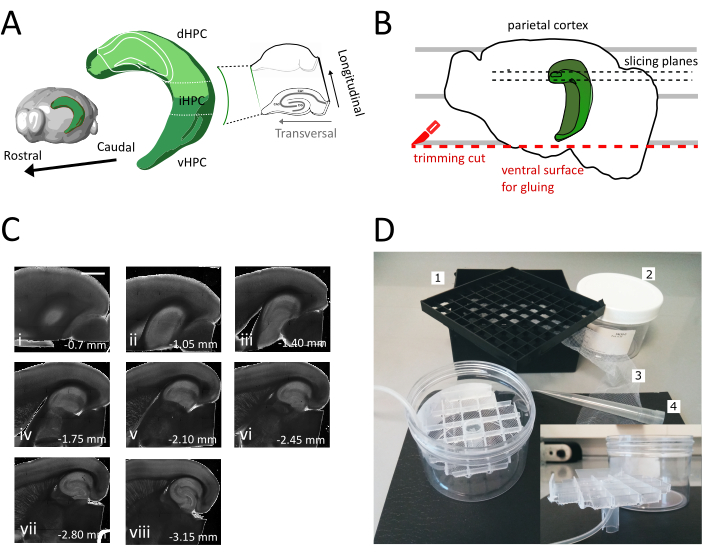
Abbildung 1: Abbildung des Schnittverfahrens zur Gewinnung von Scheiben aus demdorsalen Zwischenhippocampus. (A) Dreidimensionale Darstellung der Hippocampusbildung, die ihre räumliche Ausrichtung im Gehirn zeigt (modifiziert vom Brain Explorer, Allen Institute)37. Dorsale, mittlere und ventrale Teilungen des Hippocampus (dHPC, iHPC, vHPC) sind nach Dong et al. (2009)7indiziert. Der Teil des dorsalen Zwischen-Hippocampus, der in Scheiben geschnitten wird, ist hellgrün angegeben. Der Einset auf der rechten Seite zeigt die Ausrichtung der Referenzachsen. (B) Karikatur einer Gehirnhälfte, die die Ausrichtung des parietalen Kortex mit den parallelen Linien auf der Petrischale darstellt. Die rote gepunktete Linie gibt an, wo der Schnitt (Punkt 3.9 im Protokoll) durchgeführt werden soll, um die Oberfläche für die Verklebung der Halbkugel auf den Probenhalter zu erzeugen. Die schwarzen gepunkteten Linien geben an, wo Slices gesammelt werden. (C) Helle Feldbildserie von Hippocampus-Scheiben, die nach diesem Verfahren erhalten wurden. Von der pialen Oberfläche dorsal bis ventral: (i) 0,70 mm, (ii) 1,05 mm, (iii) 1,40 mm, (iv) 1,75 mm, (v) 2,10 mm, (vi) 2,45 mm (vii) 2,80 mm, (viii) 3,15 mm. Scale bar= 1 mm. (D) Foto der Lagerkammer und des Materials, das für die Montage benötigt wird. 1. Fläschchen-Spacer-Gitter aus einer 81x kryogenen Fläschchenaufbewahrungsbox, 2. Zylindrische Kunststoff-Box. 3. Nylonnetz, 4. Pipette Spitze. Inset. Seitliche Ansicht des Gitters und des Rohrhalters, um es in den zylindrischen Kasten einzufügen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Die transversale Scheibe zeigt eine verbesserte Schnittfähigkeit im Vergleich zur koronalen Scheibe. (A) DIC-IR-Mikrographen, die gesunde (schwarze Pfeile) und ungesunde (weiße Pfeile) Beispiele für neuronale Somata in transversalen und koronalen Scheiben zeigen. Hil=hilus, gcl=Granulatzellschicht, ml= Molekularschicht. Maßstabsbalken = 50 m (B) Beide Schnittverfahren erzeugen einen Schritt zwischen der Oberfläche der Granulatzellschicht und dem Hilus (angezeigt durch Pfeilspitzen). Die Höhe des Schritts ist bezeichnend für das Ausmaß der Gewebetrennung und ist in transversalen Abschnitten signifikant niedriger als bei koronalen (n=5 transversalen und n=5 koronalen Scheiben, Mean±SEM, P=0.0238 Mann-Whitney-Test). (C) Zeitpunkt der Giga-Ohm-Siegelbildung in Granulatzellen (n=14 Zellen in transversalen, n=11 Zellen koronal; Mean±SEM, P= 0.0355, Mann-Whitney test) und PV+ INs (n=7 Zellen in transversalen, n=9 Zellen in koronalen Scheiben, Mean±SEM, P= 0.0283 Mann-Whitney-Test) Scheiben. (D) Ruhendes Membranpotential (RMP) von geflickten Zellen (bzw. n= 14 bzw. n=11 Granulatzellen). Mean±SEM, P=0.0455 Mann-Whitney-Test. n=7 PV+ INs und n=10 PV+ INs, P= 0.0271 Mann-Whitney-Test). (E) Prozentsatz der verworfenen Zellen innerhalb einer experimentellen Sitzung, (n=3 Sitzungen mit koronalen Scheiben, n=4 mit transversaler Scheibe, Mean±SEM). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
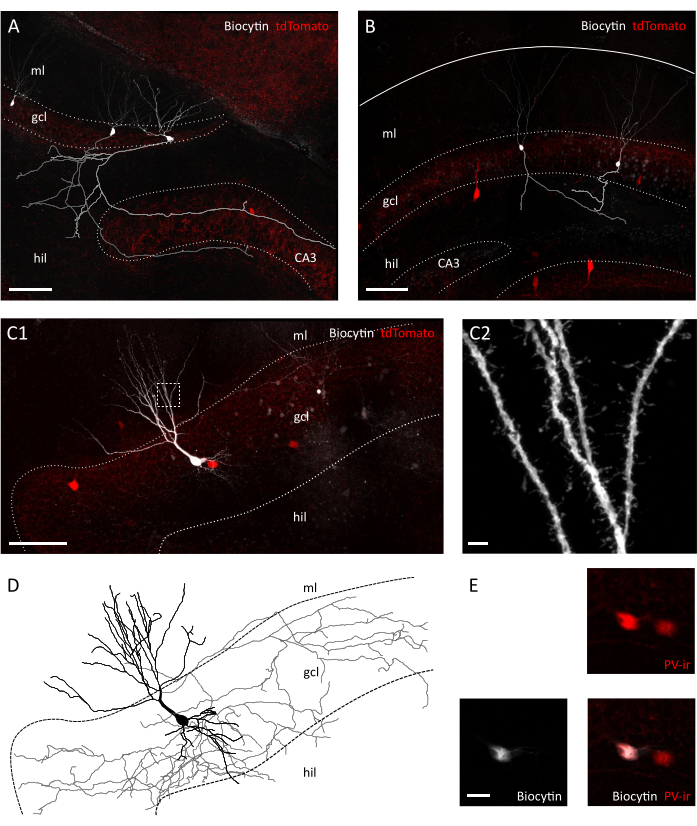
Abbildung 3: Morphologische Konservierung von Granulatzellen und Interneuronen in der transversalen Scheibe. Konfokale Bilder, die Biocytin gefüllte Granulatzellen in einer transversalen Scheibe (A) und in einer koronalen Scheibe (B) von Pvalb-IRES-Cre zeigen; Ai9 transgene Mäuse. Die jeweiligen Axone wurden in Grau und Hellgrau rekonstruiert. Beachten Sie den Unterschied in der Axonlänge und Komplexität zwischen den Präparaten. Skala bar=100 m. (C1) Konfokales Bild mit einem biocityn-gefüllten tdTomato-positiven Interneuron. Hil=hilus, gcl=Granulatzellschichten, ml= molekulare Schicht. Skala bar=50 m. (C2) Vergrößerung des Kastenbereichs in C1, zeigt dendritische Stacheln. Skala bar=2 m (D) Morphologische Rekonstruktion von Axonen und Dendriten des Biocytin gefüllten Interneurons in C1 (Axon in Grau, Soma und Dendriten in schwarz). (E) Nahaufnahme der Somata der in C1 dargestellten Zellen, die eine Kolokalisierung von Biocytin und Parvalbumin-Immunreaktivität (PVir) zeigen. Skala bar=20 'm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Der dorsale Hippocampus wurde ausgiebig auf seine Rolle beim räumlichen Lernen und der Navigation vor allem durch Verhaltensexperimente, anatomische Tracing und regionsspezifische Manipulationen untersucht. Um Slice-Elektro-physiologische Anfragen mit diesen Techniken zu kombinieren, haben wir ein Protokoll zusammengestellt, das einen ähnlichen Schnittwinkel wie das modifizierte horizontale Schneiden für den mittelventralen Bereich des Hippocampus verwendet, aber eine invertierte Schneidreihenfolge verwendet, um frühe Scheiben aus dem dorsal-zwischengeschalteten Bereich zu erhalten. Dieser Ansatz reduziert die Zeit, die benötigt wird, um die dorsale Region des Hippocampus zu schneiden und zu sammeln, wodurch die Lebensfähigkeit der Scheiben verbessert wird.
Mit dieser Methode sind wir in der Lage, routinemäßig etwa drei Scheiben pro Hemisphäre der dorsalen Hippocampusregion zwischen 1,4 mm-2,4 mm von der Pialoberfläche abzurufen, wie in abbildung 1Cdargestellt. Obwohl es mit diesem Verfahren nicht möglich ist, transversale Scheiben vom Septalpol des Hippocampus zu erhalten, ist es möglich, etwa zwei weitere lebensfähige nicht-transversale Scheiben pro Hemisphäre vom Septalpol zu sammeln (Abbildung 1C ii,iii). Wenn der Septalpol des Hippocampus der primäre Forschungsschwerpunkt ist, können andere Protokolle, die das Sammeln von transversalen Scheiben erlauben, insbesondere vom sehr septalen Pol des Hippocampus, besser geeignet sein21,32. Verhaltensexperimente zur räumlichen Navigation und zum Lernen werden vorzugsweise an reifen Mäusen mit voll entwickelter neuronaler Konnektivität durchgeführt. Daher haben wir unser Schneidverfahren für die Anwendung auf das Gehirn von erwachsenen Tieren (hier für drei Monate alte Mäuse gezeigt) optimiert, die empfindlicher auf Stress reagieren als die widerstandsfähige Juvenile-Präparation. Zu diesem Zweck haben wir mehrere Strategien kombiniert, die den hypoxischen Stress reduzieren, dem das Gehirn in der Zeit zwischen der Extraktion und der Platzierung der Scheiben in den sauerstoffhaltigen ACSF ausgesetzt ist. Die schützende Schneidlösung ist eine NMDG-basierte ACSF25,27,28 mit niedrigen Na+ und Ca2+ aber hohe Mg2+ zur Verringerung von exzitotoxischen Schäden und Zellschwellungen durch Aktivierung von NMDA-Rezeptoren. Darüber hinaus bietet HEPES eine stabile Pufferung und Verbindungen wie Ascorbat und Pyruvat reduzieren oxidativen Stress. Die transkardiale Perfusion mit der gekühlten und sauerstoffreichen Schutzschneidlösung nutzt das extrem dichte Kapillarnetz, das das Gehirn versorgt, um die stoffwechseltechnische Nachfrage und die Glutamat-induzierte Exzitotoxizität im Hirngewebe schnell und homogen zu reduzieren. Anschließend werden fast alle Schritte nach der Enthauptung innerhalb der gekühlten und sauerstoffhaltigen Lösungen durchgeführt, um den Stoffwechsel und sauerstoffhaltigen Mangel während des gesamten Eingriffs auf ein Minimum zu reduzieren. Andere Strategien zur Verringerung von Hirnschäden während des Schneidens existieren und können gleichermaßen gültig sein38. Um die Qualität unserer Zubereitung zu demonstrieren, vergleichen wir sie mit einem koronaren Scheibenpräparat, das häufig verwendet wird, um vom dorsalen Hippocampus aufzunehmen. Obwohl koronale Scheiben verwendet werden können, um eine gute Patch-Clamp-Aufnahme im Dentate-Gyrus zu erhalten, ist die Anzahl der ungesunden und getrennten Neuronen höher als in der transversalen Scheibe. Darüber hinaus ist die Integrität der axonalen und dendritischen Arborisationen besser in der transversalen Scheibe erhalten. Tatsächlich dient die Integrität von Granulatzellaxonen (Abbildung 3A), die orthogonal zur Längsachse des Hippocampus verlaufen, als Indikator für eine transversale Schnittebene1.
Für die Füllung von geflickten Neuronen schlagen wir eine Elektrodenresistenz zwischen 3 und 5 Mio. Euro vor. Ein Durchmesser der Spitze von ca. 1 m ermöglicht die Erreichung einer guten Dichtungsbeständigkeit während der Aufnahme und eine gute Wiederversiegelung beim Einziehen der Elektroden. Das wichtigste Detail ist, das Absaugen von Teilen des Soma oder Kerns in die Pipette zu vermeiden. Aus diesem Grund schlagen wir vor, einen Alexa-Farbstoff nach Möglichkeit in die intrazelluläre Lösung einzuschließen. Der Farbstoff ermöglicht die Überwachung der Zellform während der Aufzeichnung und Wiederversiegelung. Darüber hinaus ermöglicht es, die Integrität der geflickten Zelle nach der Fixierung zu beurteilen, was Immunhistochemie Zeit sparen kann, in Fällen von erfolglosen Füllungen. Wegen Alexa Farbstoffe werden mit langer Fixierungszeit abgeschreckt, wir empfehlen kurze Fixierung, wenn möglich.
Für die nachfolgende Immunfärbung verwenden wir ein Protokoll, das keine Neusektion der Scheibe erfordert. Wir empfehlen, die Färbung innerhalb einer Woche nach der Fixierung zu machen. Je länger die Scheiben im Kühlschrank verbleiben, desto höher ist die Wahrscheinlichkeit eines Gewebeabbaus. Wenn eine lange Lagerung nicht vermieden werden kann, empfehlen wir, die NaN3-Konzentration im PBS auf 0,05% zu erhöhen und sie wöchentlich zu aktualisieren. Die Immunostainierung der gesamten Scheibe bedeutet, dass die Inkubationszeiten mit primären und sekundären Antikörpern zunehmen. Normalerweise reicht für die Enthüllung von Biocytin eine nächtliche Inkubation bei 4 °C aus, aber in Kombination mit der Färbung für andere Proteine kann das gesamte Färbeverfahren viel länger dauern. Permeabilisationsblockierung und Antikörper-Inkubation müssen individuell optimiert werden. In der Regel sind für den primären Antikörper zwei Tage ausreichend, während ein Tag für den sekundären ausreichen kann. Wir empfehlen, die Dauer der Waschschritte zusammen mit längeren Antikörper-Inkubationen zu erhöhen, um eine Zunahme des Hintergrunds zu vermeiden.
In diesem Protokoll haben wir eine Schneidmethode vorgestellt, um transversale oder fast transversale Hippocampusscheiben zu erhalten, die die neuronale Lebensfähigkeit von erwachsenem Gewebe erhalten, und einen praktischen Ansatz zur Wiederherstellung der Morphologie und der neurochemischen Identität der geflickten Neuronen. Diese Methode kann leicht durchgeführt werden, um elektrophysiologische Ergebnisse mit anatomischen und Verhaltensstudien abzugleichen, die sich auf den mitteldorsalen Teil des Hippocampus konzentrieren.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Kerstin Kronenbitter und Didier Gremelle für die technische Unterstützung. Wir danken Umberto Morelli für die Unterstützung mit Grafiksoftware und Mathias Hoppe für Die Videographie und Videobearbeitung. Die Arbeit in unserem Labor wurde unterstützt von der Deutschen Forschungsgemeinschaft (DFG) FOR2143, SFB 1461 (Projekt-ID 434434223) und GRK2154, dem Medical Research Council Grant G1100546/2 und der Universität Kiel.
Materialien
| Name | Company | Catalog Number | Comments |
| 1mL syringes Omnifix-F | Braun melsungen AG | 9161406V | |
| 24 multiwells | SARSTEDT | 8,33,922 | |
| 81x criogenic vial storage box | Fisherscientific | 15-350-107B | storage chamber |
| Alexa Hydrazide dye | Invitrogen | A10436 | |
| Big scissor | Fine science tool | 14010-15 | graefe forceps |
| Biocytin | IRIS biotech. | LS3510.0250 | |
| Borosilicate Glass capillaries | Science products | GB150TF-10 | storage chamber |
| Brush 5 | Leonhardy | 241 | Micro double spatula, L 150 mm, blade width 4 mm |
| Calcium chloride dihydrate | Roth | 5239.2 | aCSF solution |
| Carbon steel microtome blade | feather | C35 | |
| Chloridric acid | Roth | K025.1 | |
| Confocal microscope | Zeiss | LSM880 | with Airyscan |
| Cyanoacrylate glue | UHU | 509141 | |
| Cyanoacrylate glue, n-butyl-ester VetBond | 3M | ||
| EGTA | Roth | 3054.1 | |
| Fiji ImageJ | fiji.sc | ||
| Filter paper 113A | ROTILABO Roth | AP180.1 | |
| Fine tip tweezer | Dumont | 0245fo | |
| Glass becker (150 ml) | ROTILABO Roth | X690.1 | incubation chamber and dissection |
| Glass Petri dishes (10 cm dia.) | ROTILABO Roth | 0690.1 | |
| Glucose | Roth | X997.2 | aCSF solution |
| Heated water bath | Grant Instruments Ltd | SUB14 | |
| HEPES | Roth | 9105.4 | aCSF solution |
| Isofluoran | baxter | 5239.2 | Anesthetic |
| Large spatula | Roth | E286.1 | |
| Magnesium Sulfate heptahydrate | Roth | 8793.2 | aCSF solution |
| Mg-ATP | Sigma Aldrich | A9187 | |
| Microfil | World precision instruments | MF34G | |
| Na2-GTP | Sigma Aldrich | 51120 | |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF solution |
| Normal goat serum | Sigma Aldrich | 566380 | |
| Nylon mesh kit | Warner Instruments | 64-0198 | incubation chamber and storage chamber |
| Paraformaldeyde | Sigma Aldrich | P6148 | |
| Phosphate buffered saline 10X | Panbiotech | P04-53500 | |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | |
| Pipette puller | Sutter instrument | P-2000 | |
| Pipette tips | SARSTEDT | 7,07,62,211 | incubation chamber |
| Plastic box for syringe filters | SUPELCO | 54135-U | storage chamber |
| Potassium Chloride | Roth | 6781.3 | aCSF solution |
| Potassium Gluconate | Roth | P1847 | |
| Probenbecker becker (100 ml) | ROTILABO Roth | HT85.1 | incubation chamber |
| Rounded tip tweezers | Fine science tool | 11051-10 | |
| Sainless steel blade | Gillette | Vibratome | |
| Small scissor | Fine science tool | 14010-10 | mayo scissor straight |
| Sodium Ascorbate | Roth | 3149.2 | aCSF solution |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium Bicarbonate | Roth | 6885.1 | aCSF solution |
| Sodium Chloride | Roth | 3957.1 | aCSF solution |
| Sodium Hydroxide | Roth | K021.1 | |
| Sodium Phosphate monobasicdihydrat | Roth | K300.1 | aCSF solution |
| Sodium Pyruvate | Roth | 8793.2 | aCSF solution |
| Streptavidin conjiugated Alexa 488 | Invitogen | s11223 | |
| Thin spatula | Roth | E286.1 | Double spatula, L 150 mm, blade width 9 mm |
| Transfer pipette | Sarstedt | 861171 | |
| Triton x100 | Roth | 3051.1 | |
| Vibratome | Thermoscientific | Microm HM650V | |
| Filter device for ultrapure water | Merck-Millipore | Milli-Q IQ 7000 |
Referenzen
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65 (1), 7-19 (2010).
- David, A., Pierre, L. Hippocampal Neuroanatomy. The Hippocampus Book. , 37-114 (2006).
- Dong, H. W., Swanson, L. W., Chen, L., Fanselow, M. S., Toga, A. W. Genomic-anatomic evidence for distinct functional domains in hippocampal field CA1. Proceedings of the National Academy of Sciences of the United States of America. 106 (28), 11794-11799 (2009).
- Royer, S., Sirota, A., Patel, J., Buzsaki, G. Distinct representations and theta dynamics in dorsal and ventral hippocampus. Journal of Neuroscience. 30 (5), 1777-1787 (2010).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Foggetti, A., Baccini, G., Arnold, P., Schiffelholz, T., Wulff, P. Spiny and Non-spiny Parvalbumin-Positive Hippocampal Interneurons Show Different Plastic Properties. Cell Rep. 27 (13), 3725-3732 (2019).
- Cembrowski, M. S., Spruston, N. Heterogeneity within classical cell types is the rule: lessons from hippocampal pyramidal neurons. Nature Reviews Neuroscience. 20 (4), 193-204 (2019).
- Moser, M. B., Moser, E. I., Forrest, E., Andersen, P., Morris, R. G. Spatial learning with a minislab in the dorsal hippocampus. Proceedings of the National Academy of Sciences of the United States of America. 92 (21), 9697-9701 (1995).
- Pothuizen, H. H., Zhang, W. N., Jongen-Relo, A. L., Feldon, J., Yee, B. K. Dissociation of function between the dorsal and the ventral hippocampus in spatial learning abilities of the rat: a within-subject, within-task comparison of reference and working spatial memory. European Journal of Neuroscience. 19 (3), 705-712 (2004).
- Fredes, F., et al. Ventro-dorsal Hippocampal Pathway Gates Novelty-Induced Contextual Memory Formation. Current Biology. 31 (1), 25-38 (2021).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Andersen, P. Long-lasting facilitation of synaptic transmission. Ciba Foundation Symposium. (58), 87-108 (1977).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. Journal of Neurophysiology. 67 (5), 1346-1358 (1992).
- Walther, H., Lambert, J. D., Jones, R. S., Heinemann, U., Hamon, B. Epileptiform activity in combined slices of the hippocampus, subiculum and entorhinal cortex during perfusion with low magnesium medium. Neurosci Lett. 69 (2), 156-161 (1986).
- Rafiq, A., DeLorenzo, R. J., Coulter, D. A. Generation and propagation of epileptiform discharges in a combined entorhinal cortex/hippocampal slice. Journal of Neurophysiology. 70 (5), 1962-1974 (1993).
- Leutgeb, J. K., Frey, J. U., Behnisch, T. LTP in cultured hippocampal-entorhinal cortex slices from young adult (P25-30) rats. Journal of Neuroscience Methods. 130 (1), 19-32 (2003).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature Protocols. 1 (3), 1235-1247 (2006).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording Synaptic Plasticity in Acute Hippocampal Slices Maintained in a Small-volume Recycling-, Perfusion-, and Submersion-type Chamber System. Journal of Visualized Experiments. (131), e55936 (2018).
- Dougherty, K. A., Islam, T., Johnston, D. Intrinsic excitability of CA1 pyramidal neurones from the rat dorsal and ventral hippocampus. Journal of Physiology. 590 (22), 5707-5722 (2012).
- Tidball, P., et al. Differential ability of the dorsal and ventral rat hippocampus to exhibit group I metabotropic glutamate receptor-dependent synaptic and intrinsic plasticity. Brain and Neuroscience Advances. 1 (1), (2017).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159 (2005).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), e53825 (2018).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Archives. 414 (5), 600-612 (1989).
- Djurisic, M. Minimizing Hypoxia in Hippocampal Slices from Adult and Aging Mice. Journal of Visualized Experiments. (161), e61377 (2020).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. P. Acute Brain Slice Methods for Adult and Aging Animals: Application of Targeted Patch Clamp Analysis and Optogenetics. Patch-Clamp Methods and Protocols, 2nd Edition. 1183, 221-242 (2014).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments. (91), e51706 (2014).
- Norenberg, A., Hu, H., Vida, I., Bartos, M., Jonas, P. Distinct nonuniform cable properties optimize rapid and efficient activation of fast-spiking GABAergic interneurons. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 894-899 (2010).
- Swietek, B., Gupta, A., Proddutur, A., Santhakumar, V. Immunostaining of Biocytin-filled and Processed Sections for Neurochemical Markers. Journal of Visualized Experiments. (118), e54880 (2016).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nature Protocols. 1 (4), 1977-1986 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Longair, M. H., Baker, D. A., Armstrong, J. D. Simple Neurite Tracer: open source software for reconstruction, visualization and analysis of neuronal processes. Bioinformatics. 27 (17), 2453-2454 (2011).
- Murray, A. J., et al. Parvalbumin-positive CA1 interneurons are required for spatial working but not for reference memory. Nature Neuroscience. 14 (3), 297-299 (2011).
- Otis, T. S., Staley, K. J., Mody, I. Perpetual inhibitory activity in mammalian brain slices generated by spontaneous GABA release. Brain Research. 545 (1-2), 142-150 (1991).
- Varela, C., Llano, D. A., Theyel, B. B. An introduction to in vitro slice approaches for the study of neuronal circuitry. Neuromethods. 67, 103-125 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten