Method Article
成体マウスのデンテート・ジラスにおける全細胞記録と神経再建のための、逆海馬からの急性スライスの作製
要約
マウスの下-中間海馬からの急性スライスを調製するためのプロトコルを提示する。この横断的な準備を、記録の質と記録されたニューロンの形態学的特徴の保存の観点からコロナスライスと比較する。
要約
海馬の一般的なアーキテクチャは縦軸に沿って類似しているが、最近の研究では、そのロストロ-コーダルの範囲に沿って異なるサブ回路への分裂を示唆する分子、解剖学的および機能的基準の顕著な違いを明らかにした。差動性と機能のために、最も基本的な区別は、それぞれ空間的および感情的な処理に優先的に関与する側腹筋と腹側海馬の間で行われる。したがって、空間記憶形成に関するインビボ研究は、裏海馬に焦点を当てている。
対照的に、電気生理学的なインビトロ記録は、主にスライスの生存率および回路完全性などの要因によって動機づけられ、中側腹筋海馬で優先的に行われてきた。インビボデータとインビトロデータとの空間処理に関するin vivoデータの直接相関を可能にするために、デンテート回における主細胞およびインターニューロンの長期記録のために背部中間海馬から非常に生存可能な横断脳スライスを得るために以前の断面化方法を適応させた。成人マウスでは空間的挙動が日常的に分析されているため、この横断的なスライス手順と、成熟した動物からの脳組織の生存率を高める保護溶液の使用を組み合わせました。このアプローチは、約3ヶ月齢のマウスに使用します。この方法は、肛門海馬の体外試験に頻繁に使用されるコロナ製剤に代わる良い選択肢を提供する。記録の質と記録されたニューロンの形態学的特徴の保存という観点から、これら2つの準備を比較する。
概要
海馬は、学習と記憶、空間ナビゲーション、感情の異なる側面におけるその重要な役割のために広く研究されています。海馬の基本回路は、一般に「三シナプス回路」と呼ばれ、横軸の層状ネットワークであり、これは主に縦軸1に沿って保存される。様々な認知的および感情的行動への海馬の寄与は、この基本的な回路が他のいくつかの脳領域2、3とのドーソベントラ軸に沿って作る多様なつながりから生じる可能性が高い。しかし、信頼性の高い接続性を超えて、海馬の中隔時間軸に沿ったさらなる違いを指摘する研究が増えています。このような違いは、内部アーキテクチャと接続性、ならびに遺伝子発現パターンと神経形態の違い4、5、6、7、8に関する。
基本的な回路におけるこのような違いの存在を考慮すると、対処される質問に従って調査される特定の海馬サブ回路を選択することが合理的である。例えば、空間処理に関与する神経機構に関する質問の場合、腹側海馬ではなく後側が関心を持つが、海馬内縦方向接続性9、10、11のために2つは生体内で独立して作用しない。これらの線に沿って、長手方向軸に沿った違いだけでなく、可能な限り局所的および長距離回路を維持するためにも注意が必要です。繊維経路と接続性の保存には、脳が切り離される角度が不可欠です。
トリシナプス回路を含む文献で報告された最初の方法は、まず海馬を脳から単離し、次に組織チョッパー12とビブラートオーム13を用いて横切りスライス(縦軸に垂直)を作った。後の生理学者は、海馬に接続された隣接する脳構造も保存するために、脳ブロック全体からスライスを得ることを好んだ。これらのブロック調製物については、海馬に対する異なる断面角度が開発されている、コロナスライス調製14または海馬内皮質接続15、16、17を保存するためのHECスライスと名付けられた水平スライス調製物など。
後者の準備では、頭頂葉は、ブロックの基部を形成するために、ロストロ-コーダル軸に沿って水平面に対して0°または12°の角度で切断されます。その後、脳の腹側表面からスライスが採取され、主に中腹側海馬領域の収穫が可能になる。この方法は、生理学的研究のための最も一般的な選択肢となっており、いくつかの公表されたプロトコル18、19、20に従って確実に実行することができます。
しかし、研究の関心が空間学習の特定の側面に関する場合、裏海馬はより適切な調査領域であり、この海馬領域に対して同様の品質のスライス手順を見つけることが有用であろう。非常にロストラルポールに焦点を当てたいくつかのプロトコルは、この需要21、22を満たすことができる開発されています。
このプロトコルでは、代わりに、水平準備18、19のために前述した断面角度を使用する裏-中間海馬から実行可能な横切れスライスを得るためのアプローチを説明する(図1A&B)。我々は、この調製物における電気生理学的記録および形態学的再構成をコロナスライスで得られたものと比較することによって、このプロトコルの品質を実証する。このプロトコルは、特に、成体マウス(我々の場合は生後3ヶ月)における解剖学的および行動実験との組み合わせに適している。
プロトコル
実験動物に関するすべての手順は、ドイツ動物福祉法に従い、キール大学の倫理委員会によって承認されました。パルポンドビンクレ(Pvalb-IRES-Cre)マウス23( ジャクソン研究所、リポジトリ番号008069)は、ヘテロ接合コロニーとして維持されたか、またはAi9 Creレポーターマウス24( ジャクソン研究所、リポジトリ番号007909)と交差した。P40-P90の間に雌マウスと雄マウスを用いた。マウスは、標準的なグループの収容条件下で12時間の明暗サイクルで維持され、食物および水 のアドリビタムを提供された。
1. ソリューションの準備
注:超純水(UPW)(25°C 18.2 MΩcmの抵抗率)を使用して、実験日ごとに新鮮なソリューションを準備してください。この溶液は、最大1日4°Cで保存することができます。マグネシウムおよびカルシウム溶液は、1 Mストック溶液として別々に保存することができます。すべての作業ソリューションは、使用前および使用中に最適な酸素化およびpH維持のためにカルボーゲン(95%O2:5%CO2)で飽和する必要があります。
- 切断液(マウス1個あたり500 mL)(mM単位):92 NMDG、2.5 KCl、 1.25 NaH2PO4,30NaHCO3,20HEPES,25グルコース,5ナアスコルビン酸,4ナピルビン酸塩,0.5 CaCl2·2H2O,および10 MgSO47H2O. TitrateをpH 7.4に3.4%塩酸付加前にpH 7.4これにより MgSO4の沈殿を回避できます。
注:KClおよびNaH2PO4 は4°Cの10xの解決として貯えることができる。 我々は、切断溶液の2つの個々のバッチを作ります。1つは、録音の前日(砕いた氷を生成するために一晩冷凍庫に保存されている)と記録の日に1つ。 - ストレージソリューション(マウスあたり250 mL)(mM単位):92 NaCl、 2.5 KCl, 1.25 NaH2PO4,30 NaHCO3, 20 HEPES, 25 グルコース, 5 ナアスコルビン酸, 4 ナピルビン酸, 2 CaCl2·2H2O, および 2 MgSO4·7H2O. 1 N NaOH で pH 7.3-7.4 にチタリ酸.
注意:NaCl、KClおよびNaH2PO4 は4°Cの10xの解決として入荷することができる。 - 記録用ACSFを準備する(mMで):122 NaCl、2.5 KCl、1.25 NaH2PO4、24NaHCO 3、12.5グルコース、2 CaCl2·2H2O、および2 MgSO47H2O、2ナアスコルビン酸、4ナピルビン酸。1 N NaOH で 7.3-7.4 に pH を titrate pH.
注意:NaCl、KClおよびNaH2PO4 は4°Cの10xのストックの解決で結合することができる。
2. スライス用ベンチの準備
- 氷の上にビーカー(150 mL)と2つのガラスペトリ皿(直径10cm)を準備し、新鮮な切断溶液でそれらを埋めます。カルボーゲンバブリング装置(穿穿管またはカルボーゲンシステムに接続された空気石)で溶液を酸素化しておいてください。
注:ビーカーの溶液は、ペトリ皿は切断手順の間に使用される間、灌流のために使用されます。 - ステンレス鋼の刃、丸みを帯びた先端ピンセット、細かい先端ピンセット、大きなはさみ、小さいはさみ、大きな金属ヘラ、薄い金属ヘラ、ブラシ、ビブラードームプレートとシアノアクリレート接着剤または毒性の低いn-ブチルエステルシアノアクリル酸接着剤を手術ベンチに装備します。氷の上のガラスペトリ皿の一つにステンレス鋼の刃とフィルターペーパーの一部を差し込みます。このペトリは、脳を切断するために使用されます.プラスチックペトリ皿の底に3本の平行線を引き、この皿を手術器具の近くに置きます。
- 公開されたプロトコル25に従って心筋灌流用のセットアップを準備します。
- ビブラートメを準備し、ブレードホルダーに新しいブレードを取り付け、切断のパラメータ(水平面17°からのブレードの角度、ブレード発振振幅1.5mm、ブレード前方移動速度は約2mmmin-1、振動周波数は90Hz、断面厚は350μm)を設定します。ビブラートメトレーに氷冷切断液を充填し、一定の酸素化の下に保管します。
注:私たちは、温度を下げるために冷却された新鮮な切断ソリューションに切断液の最初のバッチから作られた砕いた氷を追加します。スライスしながら、ブレードから氷を保つために注意してください。 - 一定の酸素化の下で切断液で満たされたインキュベーションチャンバーを準備する。チャンバーを温める湯(35°C)に入れます。
注:インキュベーションチャンバーの例は、エドワーズとコナース(1992)26で見つけることができます。 - 貯蔵液で満たされたスライス貯蔵室を準備し、室温で、一定の酸素化の下でそれを保つ。組織が蛍光タンパク質または光活性化オプシンを発現する場合、例えば箱の中で、暗所にチャンバーを保つことが推奨される。
注:複数の独立したウェルを持つ貯蔵室は、海馬のドーソベントラ軸に沿ってスライスのレベルを区別するのに便利です。カスタムメイドのチャンバーを構築することができます(図1D)。81x極低温バイアル収納ボックスからバイアルスペーサーグリッドを取り、ナイロンネットに底を接着します。5mLピペットプラスチックチップの上部1/3をこのグリッドの中央に挿入し、底部に約3cm突き出るようにします。このプラスチック製の先端は、グリッドのスタンドとして機能し、後で酸素化のための空気管を保持します。傾けたりぐらついたりできないように、スタンドを持つグリッドを円筒形のプラスチックボックス(シリンジフィルターの包装など)に挿入します。この貯蔵所は貯蔵の解決の250 mLを握る。
3. 海馬スライスの準備
- ボンネットの下にあるイオブルラン(約0.5 mL)を使用して、箱室でマウスを麻酔します。呼吸が遅く規則的になるまで、マウスを休ませます (約 2~3 分)。つま先ピンチで痛みの応答がないのテスト。
- 25,27の公表されたプロトコルに続く氷上のビーカーから25mLの炭酸切断溶液を使用して心筋灌流を行う。このステップは、迅速に神経代謝を遅くするために急速に脳を冷却することをお勧めします.
- 大きなはさみを使用して動物の首を切り落とし、切断液を含む氷の上の冷却されたペトリ皿に頭を置きます。
- 頭蓋骨を露出させるために細かいはさみで皮膚を開きます。小さな側部切開を、頭蓋マグナムの両側の頭蓋骨の基部に入れさせる。次に、射手縫合糸に沿って、嗅球の上のナソ前頭縫合糸に達するまで、前門マグナムから始まる縫合糸に沿って切断する。下にある脳組織の損傷を避けるために矢頭切りの間にはさみを引き上げる。
注:切断溶液に頭を沈めたままにしておくことは、血液からそれをクリアするのに役立ち、温度を下げる。 - 丸みを帯びた先端のトゥイザーを使用して頭頂部骨を引き上げて脳を露出させます。あまりにも手に入れ、髄液を取り除くために注意を払います。残した場合、彼らは抽出中に脳に損傷を与えることができます。
- 小さなへらを使って脳を2番目のペトリ皿にそっとすくい取ります。
- 冷やされたブレードを使用して、縦方向の裂け目に沿って脳を半分にカットします。
- 大きなへらを使用して、切断液から1つの半球を持ち上げ、プラスチックペトリ皿に持ち上げます。半球が内側の表面に横たわっている場合、 図1Bに示すように、頭頂皮質を平行線の1つに合わせて、2番目のカットの基準を持たせる。
- 図1Bに示すように、半球の腹側部分で2回目の切削を行い、ブレードを平行に配置して表面を得て、後で脳を標本ホルダーに接着するために使用する(次のステップを参照)。ガラスシャーレの酸素切断溶液に半球を戻し、第2半球で同じ手順を実行します。
- 接着剤を使用してビブラートメ標本ホルダーに切りたての腹側で半球を接着します。切断液を半球に数滴入れて接着剤を固め、標本ホルダーをビブラートメトレーに移動します。このようにして、スライスは、側腹筋から腹側海馬に進みます。
- 最初の 1 つまたは 2 つの非トランスバーサル スライス (図1C、ii-iii)を削除して、対象領域が表示され、スライスの収集を開始します。
注:非トランスバーサルが使用できる、健康的なスライスは、スライス手順の開始時に、裏海馬から得ることができます(図1C、ii-iii)。各スライスのコレクションは約3〜4分必要です。腹側海馬の代わりに後側から切断を開始することで、約10分を節約し、後部スライスの生存率を向上させます。 - プラスチックピペット(先端の狭い端を切り取る)で、各スライスをインキュベーションチャンバー(35°Cの切断液を含む)に移し、12分間休ませます。温かい切断溶液の短い回復期間は、Ting et al. (2014)28.に報告されているように、初期神経腫脹を大幅に減少させる。次にブラシを使用して、スライスを貯蔵室(RTで貯蔵溶液を含む)に移し、実験を開始するまで休ませる。
4. 全細胞記録とバイオシチン充填
注: 全細胞パッチクランプ記録の説明は、良好なバイオシチン充填を得るのに役立つ主要なステップに限定され、一般にACSFのニューロンに適用可能です。電気生理学的記録の手順に関する詳細については、他のいくつかのプロトコルを参照してください29,30.
- 記録するパラメータに従って適切な細胞内溶液を選択します。一例として、現在のクランプ測定では、グルコン酸カリウムベースの溶液(mM)を使用することができます:135 K-グルコネート、3 KCl、10 HEPES、0.2 EGTA、10ホスホクレアチン-Na2、4MgATP、0.3 Na2-GTP。pHを1 M KOHで7.3に調整します。オスモルリティは、3-5 mg/mLバイオシチンが添加されると、約285〜290 mOsmol/kgでなければなりません。
メモ:記録中のニューロンの形状を監視するために、1 mMアレクサフルオールヒドラジドの0.3-0.5 μL/mLを細胞内溶液に加えることができます。この場合、バイオシチンの啓示のために覚えておき、アレクサ色素色をストレプトアビジンに結合した蛍光プローブと一致させる。 - 厚層のホウケイ酸毛細血管から≤1 μmの先端径および3-5 MΩ抵抗のパッチクランプ電極を準備します。
- RTまたは35-37 °Cで2.5-3 mL/minの速度でパッチクランプ設定の灌流システムを開始し、U字型のアンカーでチャンバー内のスライスを固定します。
- 関心のある脳領域を特定し、スライスの表面の下に少なくとも30〜50μmの相馬を持つ健康なニューロンを選択します。
注:健康なニューロンの相馬は滑らかな表面を持ち、膜の境界はわずかに対照的です。不健康なニューロンの相腫は、縮小して、非常にコントラストまたは腫れと半透明に見えます. - AgCl電極の先端が覆われるまで、細胞内溶液を用いてガラスピペットをロードします。ピペットを記録チャンバーの溶液に移動し、ガラス電極の先端をクリアしておくために光の正圧を適用します。
注:溶液にAlexa染料が含まれている場合、圧力を視覚的に制御して、チップから放出される蛍光溶液の量を調整することができます。最小限の圧力は、細胞の周りの組織の染色を回避します。 - 斜めの角度から細胞に近づき、ギガシールを形成する際に相馬面の最初の1/3以内に接触を確立します。圧力を解放し、保持電位を65mVにゆっくりと移動し、口による穏やかな吸引を施してギガシール形成を容易にする。
- 全細胞構成を確立するには、膜を破壊するために強く、短い吸引を適用する。保持電流が100pAを超えて増加している場合、またはアクセス抵抗が30MΩを超えて増加する場合、ニューロンが50mVより多く脱分極した膜電位を有する場合、記録を破棄する。
- 記録後(ソマタと樹状突起の十分な充填のために少なくとも15分が推奨されます;1時間までの複雑な軸索の充填には31が必要です)は、電極を慎重に取り外します。この端部には保持電位を0mVに設定し、外出パッチ構成を得るなど、アプローチとは反対の方向にピペットをゆっくりと引き込んでギガシールを再形成しよう。
注:細胞内溶液中のAlexa色素の存在は、神経細胞表面からのピペットの視覚的に導かれた除去を助ける。細胞の核がピペット先端と接触していない場合、シールを改定する迅速な方法は、ピペットを組織から対角線上および高速で上方に引き出す。もし、膜の核または一部が先端の中に存在する場合、原形質膜を破壊する危険性がある。この場合、わずかな正圧適用と横方向の動きが役立ちます。 - セルの位置とスライスの方向を確認します。固定後、スライスの正確な方向と充填された細胞の完全性を蛍光顕微鏡で確認することができます。
5. 免疫染色、画像取得、形態再構成
- 記録後、スライスを24ウェルプレートに移し、0.1Mリン酸緩衝生理食塩分(PBS)でパラホルムアルデヒド(PFA)4%に固定します。使用する一次抗体の感度に従って、RTで、または4°Cで一晩で60分間インキュベートする。スライスは0.1 M PBSと0.02%NaN3に保存することができます。
注意:PFAは有毒です。ボンネットの下で使用してください。 - 確立されたプロトコル32、33に従って記録の1週間以内に免疫染色およびバイオシチンの啓示を行う。
注: 樹状および軸索プロセスの完全性を維持するためにスライスの再切除を回避する手順を使用します。しかし、抗体が組織に浸透する必要があるため、この手順はより長いインキュベーション時間を必要とします。実験を行う前に、抗体を組織に最適に浸透させる時間をテストすることをお勧めします。 - Zスタックとタイルスキャン機能を備えた共焦点顕微鏡を使用して画像を取得します。
- フィジーの画像J34を使用して形態学的再建を行います。
注:いくつかの画像ファイル形式は、 バイオフォーマット プラグインを使用してプログラムにインポートすることができます。デンドライトと軸索の再構築には、単純な Neurite トレーサー (STN) プラグイン35 を使用することをお勧めします。シンプルで明確なチュートリアルは、https://imagej.net/SNT と http://snyderlab.com/2016/05/25/tracing-neurons-using-fiji-imagej/ で利用可能です。トレーシングデータ(.traces)を含むファイルは、圧縮されていない状態で保存されている場合、テキストファイルに変換し、Matlabまたは他のソフトウェアで開いてテキストデータ処理を行うことができます。
結果
このプロトコルでは、海馬の後部中間部分から急性海馬スライスを準備する方法を説明します(図1A)。このプロトコルは、空間学習に関与するメカニズムを調査する実験に特に適しており、舞下海馬35における行動作業またはウイルス標識または操作戦略と組み合わせることができる。ここで説明する断面化手順を、異なるブレグマ座標AP-1.94 mmのPvalb-IRES-Creマウスの側海馬にアデノ関連ウイルス(AAV-FLEX-GFP)を発現するクレ依存性GFPを注射した動物に適用し、 ML ± 0.5-2 mm、深さ-1.25-2.25 mm は、海馬形成36の異なる領域を標的とし、感染した領域を含む少なくとも 3 つの横切りスライスを得ることができました (図 1A海馬の 3D モデルの光緑色化)。さらに、いくつかの非横断的だが健康なスライスは、より多くの鼻海馬の一部から得ることができる(図1C)。
私たちのスライスの品質と生存率を実証するために、我々はPvalb-IRES-Creのデンテート回における顆粒細胞およびtdTomato標識パルブアルブミン陽性(PV+)インターニューロンの基本的な電気生理学的および形態学的パラメータを記録しました。Ai9トランスジェニックマウス(7〜12週齢)とこれらを、標準プロトコルで得られた同領域のコロナスライスからの記録と比較した。
赤外線差動干渉コントラスト(IR-DIC)顕微鏡で目視検査を行った結果、我々はすでに我々の横切りスライスとコロナスライスの間の明確な違いに気づいた。コロナスライス中の主細胞層のニューロンは、しばしば粗く見え、強く対照的な輪郭を示したのに対し、横切りスライスのニューロンは、主に滑らかな表面を示し、対照的な境界線のみを示し、より良い細胞活力を示す(図2A)。コロナルスライスとトランスバーサルスライス間の細胞生存率のこれらの差異の理由は、繊維路に対する断面面の向きにある可能性があります。これらはコロナセクションで並行してはならないので、軸索と樹状突起は切断されます。この仮定に沿って、スライス内の顆粒細胞層とヒルスの表面平面は、横断スライス(表面面のステップサイズ:41.40±3.28 μm対25.94μm)よりもコロナの不連続性 ±を示したことがわかりました。 平均±SEM、非対t検定P=0.023)は、コロナスライスにおける組織切断の大きな程度を示唆している(図2B)。これは、パッチクランプ記録に適したセルがコロナスライス用の顆粒電池層のより深い平面でのみ見つかることを意味し、パッチクランプ記録のスループットを低下させる可能性があります。確かに、私たちの横切りスライスの形成を封止する平均時間は、コロナスライス(顆粒細胞:12.64±1.50 s、コロナのn=11対8.40±0.75 s、n=14±のトランスバーサルスライス、平均±SEM、P= 0.0335マンホイットニーテスト;PV+ インターニューロン: 31.11 ± 2.60 s, n=9 コロナ対 22.00 ± 2.18, n=7 横のスライス, 平均± SEM, P= 0.0283 マン・ホイットニー検定) (図 2C)。細胞の完全性と健康の代理として、顆粒細胞およびPV+インターニューロンの静止膜電位(RMP)を記録し、 コロナとトランスバーサルスライスの顆粒細胞とPV+インターニューロンの両方で有意に脱分極された(顆粒細胞:-62.55±3.54 mV、n=11±2.31mV、n=14±のトランスルスライス、± 平均SEM、P=0.045ホイットニーPV+ インターニューロン:-52.75 ± 1.66 mV、コロナ対.-59.36 ± 2.25 mV、n=6 のトランスバーサルスライスの平均 ± SEM,P= 0.0271 マンホイットニー検定) (図 2D)。これらのデータは、コロナスライス調製とは逆セルの健康なニューロンの数が多いことを示唆しています。実際、許容可能なRMP(顆粒細胞の場合は-55 mV;-45 mV(PV+インターニューロン)の導入は、横断スライス(39.67±8.37%、n=3実験セッション対23.00 ±3.85%、n実験図)よりもコロナル中の除外細胞の割合が高い結果となった。さらに、記録された顆粒細胞からの神経形態の再構築は、予想通り、超大粒細胞の完全な軸索樹型を取り出す方がはるかに良いことを示した(図3A、B)。また、横切りスライスにおけるPV+インターニューロンの形態学的再構成により、樹状棘35などの小さな細部の可視化を含む広範な軸索および樹状樹状の樹型の描写が可能となった(図3C)。
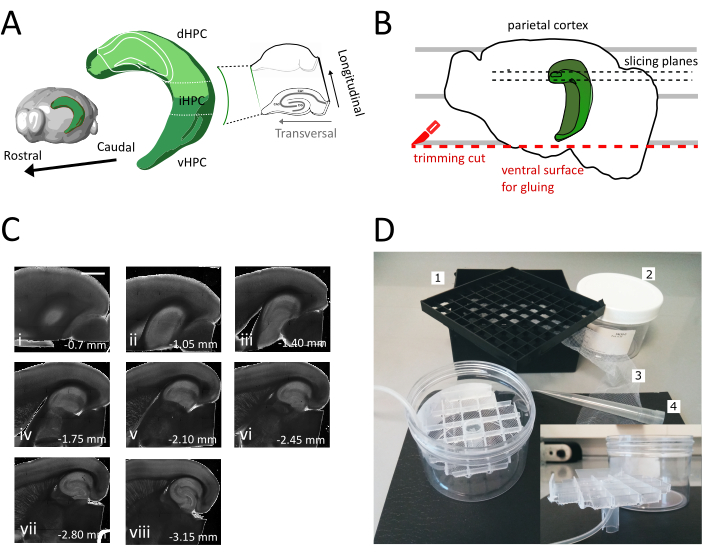
図1:裏中海馬からスライスを得るための断面化手順の図(A)脳内のその空間的指向を示す海馬形成の3次元表現(脳探検家、アレン研究所)37。Dong et al. (2009)7によれば、海馬の背部、中級および腹側の分裂(dHPC、iHPC、vHPC)が示されている。スライスされる後側中間海馬の部分は薄緑色で示されています。右側の差し込みは、参照軸の方向を示しています。(B) ペトリ皿の平行線と頭頂皮質の整列を描いた脳半球の漫画。赤い点線は、トリムカット(プロトコルのポイント3.9)を実行して、半球を標本ホルダーに接着するための表面を作成する場所を示します。黒い点線は、スライスが収集される場所を示します。(C)この手順に従って得られた海馬スライスの明視野画像シリーズ。海口面から、側側から腹側まで:(i)0.70mm、(ii)1.05mm、(iii)1.40mm、(iv)1.75mm、(v)2.10mm、(vi)2.45mm(vii)2.80mm、(viii)3.15mm。スケールバー=1mm(D)貯蔵室の写真とそのアセンブリに必要な材料。1.81x極低温バイアル収納ボックス、2からのバイアルスペーサーグリッド。円筒形のプラスチックボックス。3.ナイロンネット、4.ピペットチップ。はめ込み。円筒箱に挿入するグリッドとチューブホルダーの側面図。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:横切りスライスは、コロナスライスと比較して拡張されたスライスの生存率を示しています。 (A)DIC-IR顕微鏡写真は、横膜およびコロナスライスにおける神経ソマトンの健康(黒矢印)と不健康(白矢印)の例を示す。ヒル=ヒルス、gcl=顆粒細胞層、ml=分子層。スケールバー = 50 μm(B) 両方の断面化手順は、顆粒細胞層の表面とhilus(矢印の頭部で示される)の間のステップを生成します。ステップの高さは組織切断の程度を示し、コロナル(n =5横打およびn=5コロナスライス、平均±SEM、P=0.0238 Mann-Whitney検定)よりも横断的なセクションで有意に低い。(C) 顆粒細胞におけるギガオームシールの生成時間 (n=14 細胞の横、 n =11 細胞コロナ;平均±SEM、P= 0.0355、マンホイットニー検定)およびPV+ IN(トランスバーサルのn=7セル、コロナスライスのn=9セル、平均±SEM、P=0.0283マンホイットニー検定)スライス。(D) パッチを当てた細胞の静止膜電位(RMP)(それぞれ、n= 14およびn=11顆粒細胞)。平均±SEM、P=0.0455マンホイットニー検定。n =7 PV+ IN および n =10 PV+ IN、P= 0.0271 マン・ホイットニー検定)。(E) 実験セッション内で廃棄されたセルの割合 (コロナスライスを伴う n =3 セッション、横スライスを使用する n=4、平均±SEM) この図の大きなバージョンを表示するには、ここをクリックしてください。
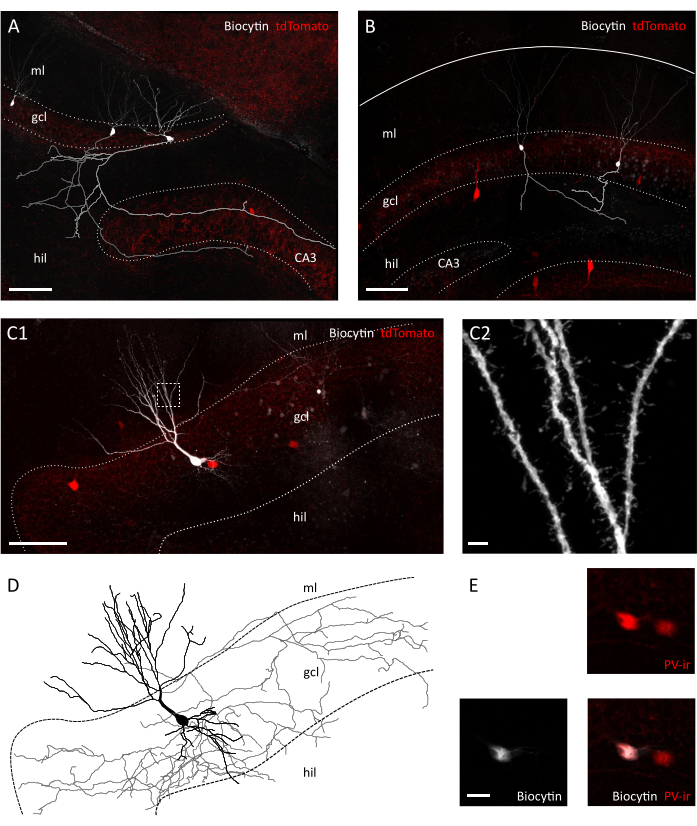
図3:横切りスライスにおける顆粒細胞およびインターニューロンの形態学的保存ビオシチン充填顆粒細胞を横切りスライス(A)とPvalb-IRES-Creのコロナスライス(B)で示す共焦点画像;Ai9トランスジェニックマウス。それぞれの軸索は灰色およびライトグレイで再構成された。準備の間の軸索の長さと複雑さの違いに注意してください。スケールバー=100μm(C1)バイオシティーン充填tdTomato陽性インターニューロンを示す共焦点像。ヒル=ヒルス、gcl=顆粒細胞層、ml=分子層。スケールバー=50μm(C2)樹状脊椎を示すC1の箱入り面積の拡大。スケールバー=2 μm(D)C1のバイオシチン充填インターニューロンの軸索および樹状突起の形態学的再構成(黒色の灰色、ソーマ、樹状突起の軸索)。(E) C1に描かれている細胞のソマトンのクローズアップは、バイオシチンとパルブアルブミン免疫反応性(PVir)の共局在化を示す。スケールバー=20 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
裏海馬は、主に行動実験、解剖学的トレース、および領域特異的操作を通じて、空間学習とナビゲーションにおけるその役割について広く研究されています。スライス・エレクトロ生理学的な問い合わせをこれらの技術と組み合わせるために、海馬の中間腹側領域の変更された水平スライスと同様の断面角度を使用するプロトコルを組み立てたが、反転スライス順序を使用してドーサル中間領域から早期スライスを得る。このアプローチは、海馬の後部領域をスライスして収集するために必要な時間を短縮し、したがってスライスの生存率を高める。
この方法を使用すると、図1Cに示すように、1.4mm~2.4mmの海馬領域の1球当たり約3枚のスライスを、pial表面から1.4mm~2.4mmの間で日常的に取り出すことができます。この手順では海馬の非常に中隔極から隔膜スライスを得ることは不可能であるが、半隔極から1半球当たり約2個の追加の実行可能な非横断スライスを収集することができる(図1C ii,iii)。海馬の中隔極が主要な研究焦点である場合、特に海馬の非常に中隔極からの横断スライスの収集を可能にする他のプロトコルは、21、32に適している可能性があります。空間ナビゲーションおよび学習に関する行動実験は、十分に発達した神経結合性を有する成熟したマウスで行うことが好ましい。その結果、我々は、弾力性のある若年性製剤よりもストレスに敏感である成動物(ここに3ヶ月生後のマウスのためにここに示す)の脳への適用のためのスライス手順を最適化しました。この目的のために、我々は、脳が抽出と酸素化されたACSFへのスライスの配置の間にさらされる低酸素ストレスを軽減するいくつかの戦略を組み合わせました。保護切断液は、NMDGベースのACSF25、27、28で、Na+およびCa2+が低いが、高いMg2+は、NMDA受容体の活性化による興奮性損傷および細胞腫脹を低減する。また、HEPESは安定した緩衝を提供し、アスコルビン酸やピルビン酸などの化合物は酸化ストレスを軽減します。冷やされた酸素保護切断溶液を用いた心筋灌流は、脳を供給する非常に高密度のキャピラリーネットワークを利用して、脳組織における代謝需要およびグルタメート誘発性興奮を迅速かつ均質に減少させる。その後、切断後のほぼすべてのステップは、全手順の間に代謝および酸素欠乏を最小限に抑えるために冷却され、酸素化された溶液内で行われる。スライス中の脳損傷を減らすための他の戦略が存在し、同様に有効である可能性があります38.私たちの準備の質を実証するために、我々は一般的に後部海馬から記録するために使用されるコロナスライス製剤と比較します。コロナスライスを使用して、デンテート回で良好なパッチクランプ記録を得ることができますが、不健康で切断されたニューロンの数は、横切りスライスよりも多くなります。さらに、軸索および樹状の樹状のアーボライゼーションの完全性は、より良い横のスライスで保存されます。実際のところ、海馬の縦軸に直交して走る顆粒細胞軸索(図3A)の完全性は、横断的なスライス面1の指標となる。
パッチを当てたニューロンの充填については、3~5MΩの電極抵抗を提案します。約1μmの先端の直径は、記録時の良好なシール抵抗と電極の引き込み時の良好な再シールの達成を可能にする。最も重要な詳細は、ピペットにソーマや核の部分の吸引を避けることです。そのため、可能な限り細胞内溶液にAlexa色素を含める方法を提案します。染料は記録および再シールの間に細胞の形を監視することを可能にする。さらに、フィリングに失敗した場合に免疫細胞化学の時間を節約できる固定後のパッチされた細胞の完全性を評価することを可能にする。Alexa染料は長い固定時間で消し止めるため、可能であれば短い固定を提案します。
その後の免疫染色では、スライスの再切除を必要としないプロトコルを使用します。固定後1週間以内に染色を行う方法をお勧めします。スライスが冷蔵庫に残る時間が長ければ長いほど、組織劣化の可能性が高くなります。長いストレージを避けられない場合は、PBSのNaN3濃度を0.05%に増やし、毎週リフレッシュすることをお勧めします。スライス全体の免疫染色は、一次および二次抗体とのインキュベーション時間が増加することを意味する。通常、バイオシチンを明らかにするために、4°Cで一晩インキュベーションで十分ですが、他のタンパク質の染色と組み合わせると、全体の染色手順がはるかに長く続くことができます。透過遮断と抗ボディインキュベーションは個別に最適化する必要があります。通常、一次抗体の場合、2日間で十分であり、1日は二次に十分です。背景の増加を避けるために、洗濯ステップの持続時間を長い抗体インキュベーションと一緒に増やすことをお勧めします。
このプロトコルでは、成人組織の神経細胞の生存率を維持する横またはほぼ横の海馬スライスを得るためのスライス法と、パッチを当てたニューロンの形態および神経化学的アイデンティティを回復するための実用的なアプローチを提示した。この方法は、海馬の中間-後ろ数部分に焦点を当てた解剖学的および行動研究と電気生理学的結果を一致させるために容易に行うことができる。
開示事項
著者らは開示するものは何もない。
謝辞
カースティン・クローネンビッターとディディエ・グレメルの技術支援に感謝します。私たちは、グラフィックソフトウェアとビデオ撮影のためのマティアスホッペの支援のためのウンベルト・モレリに感謝し、ビデオ編集。私たちの研究室での仕事は、ドイツフォルシュングスゲマイインシャフト(DFG)FOR2143、SFB 1461(プロジェクトID434434223)、GRK2154、医学研究評議会助成金G1100546/2とキール大学によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 1mL syringes Omnifix-F | Braun melsungen AG | 9161406V | |
| 24 multiwells | SARSTEDT | 8,33,922 | |
| 81x criogenic vial storage box | Fisherscientific | 15-350-107B | storage chamber |
| Alexa Hydrazide dye | Invitrogen | A10436 | |
| Big scissor | Fine science tool | 14010-15 | graefe forceps |
| Biocytin | IRIS biotech. | LS3510.0250 | |
| Borosilicate Glass capillaries | Science products | GB150TF-10 | storage chamber |
| Brush 5 | Leonhardy | 241 | Micro double spatula, L 150 mm, blade width 4 mm |
| Calcium chloride dihydrate | Roth | 5239.2 | aCSF solution |
| Carbon steel microtome blade | feather | C35 | |
| Chloridric acid | Roth | K025.1 | |
| Confocal microscope | Zeiss | LSM880 | with Airyscan |
| Cyanoacrylate glue | UHU | 509141 | |
| Cyanoacrylate glue, n-butyl-ester VetBond | 3M | ||
| EGTA | Roth | 3054.1 | |
| Fiji ImageJ | fiji.sc | ||
| Filter paper 113A | ROTILABO Roth | AP180.1 | |
| Fine tip tweezer | Dumont | 0245fo | |
| Glass becker (150 ml) | ROTILABO Roth | X690.1 | incubation chamber and dissection |
| Glass Petri dishes (10 cm dia.) | ROTILABO Roth | 0690.1 | |
| Glucose | Roth | X997.2 | aCSF solution |
| Heated water bath | Grant Instruments Ltd | SUB14 | |
| HEPES | Roth | 9105.4 | aCSF solution |
| Isofluoran | baxter | 5239.2 | Anesthetic |
| Large spatula | Roth | E286.1 | |
| Magnesium Sulfate heptahydrate | Roth | 8793.2 | aCSF solution |
| Mg-ATP | Sigma Aldrich | A9187 | |
| Microfil | World precision instruments | MF34G | |
| Na2-GTP | Sigma Aldrich | 51120 | |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF solution |
| Normal goat serum | Sigma Aldrich | 566380 | |
| Nylon mesh kit | Warner Instruments | 64-0198 | incubation chamber and storage chamber |
| Paraformaldeyde | Sigma Aldrich | P6148 | |
| Phosphate buffered saline 10X | Panbiotech | P04-53500 | |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | |
| Pipette puller | Sutter instrument | P-2000 | |
| Pipette tips | SARSTEDT | 7,07,62,211 | incubation chamber |
| Plastic box for syringe filters | SUPELCO | 54135-U | storage chamber |
| Potassium Chloride | Roth | 6781.3 | aCSF solution |
| Potassium Gluconate | Roth | P1847 | |
| Probenbecker becker (100 ml) | ROTILABO Roth | HT85.1 | incubation chamber |
| Rounded tip tweezers | Fine science tool | 11051-10 | |
| Sainless steel blade | Gillette | Vibratome | |
| Small scissor | Fine science tool | 14010-10 | mayo scissor straight |
| Sodium Ascorbate | Roth | 3149.2 | aCSF solution |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium Bicarbonate | Roth | 6885.1 | aCSF solution |
| Sodium Chloride | Roth | 3957.1 | aCSF solution |
| Sodium Hydroxide | Roth | K021.1 | |
| Sodium Phosphate monobasicdihydrat | Roth | K300.1 | aCSF solution |
| Sodium Pyruvate | Roth | 8793.2 | aCSF solution |
| Streptavidin conjiugated Alexa 488 | Invitogen | s11223 | |
| Thin spatula | Roth | E286.1 | Double spatula, L 150 mm, blade width 9 mm |
| Transfer pipette | Sarstedt | 861171 | |
| Triton x100 | Roth | 3051.1 | |
| Vibratome | Thermoscientific | Microm HM650V | |
| Filter device for ultrapure water | Merck-Millipore | Milli-Q IQ 7000 |
参考文献
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65 (1), 7-19 (2010).
- David, A., Pierre, L. Hippocampal Neuroanatomy. The Hippocampus Book. , 37-114 (2006).
- Dong, H. W., Swanson, L. W., Chen, L., Fanselow, M. S., Toga, A. W. Genomic-anatomic evidence for distinct functional domains in hippocampal field CA1. Proceedings of the National Academy of Sciences of the United States of America. 106 (28), 11794-11799 (2009).
- Royer, S., Sirota, A., Patel, J., Buzsaki, G. Distinct representations and theta dynamics in dorsal and ventral hippocampus. Journal of Neuroscience. 30 (5), 1777-1787 (2010).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Foggetti, A., Baccini, G., Arnold, P., Schiffelholz, T., Wulff, P. Spiny and Non-spiny Parvalbumin-Positive Hippocampal Interneurons Show Different Plastic Properties. Cell Rep. 27 (13), 3725-3732 (2019).
- Cembrowski, M. S., Spruston, N. Heterogeneity within classical cell types is the rule: lessons from hippocampal pyramidal neurons. Nature Reviews Neuroscience. 20 (4), 193-204 (2019).
- Moser, M. B., Moser, E. I., Forrest, E., Andersen, P., Morris, R. G. Spatial learning with a minislab in the dorsal hippocampus. Proceedings of the National Academy of Sciences of the United States of America. 92 (21), 9697-9701 (1995).
- Pothuizen, H. H., Zhang, W. N., Jongen-Relo, A. L., Feldon, J., Yee, B. K. Dissociation of function between the dorsal and the ventral hippocampus in spatial learning abilities of the rat: a within-subject, within-task comparison of reference and working spatial memory. European Journal of Neuroscience. 19 (3), 705-712 (2004).
- Fredes, F., et al. Ventro-dorsal Hippocampal Pathway Gates Novelty-Induced Contextual Memory Formation. Current Biology. 31 (1), 25-38 (2021).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Andersen, P. Long-lasting facilitation of synaptic transmission. Ciba Foundation Symposium. (58), 87-108 (1977).
- Staley, K. J., Otis, T. S., Mody, I. Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings. Journal of Neurophysiology. 67 (5), 1346-1358 (1992).
- Walther, H., Lambert, J. D., Jones, R. S., Heinemann, U., Hamon, B. Epileptiform activity in combined slices of the hippocampus, subiculum and entorhinal cortex during perfusion with low magnesium medium. Neurosci Lett. 69 (2), 156-161 (1986).
- Rafiq, A., DeLorenzo, R. J., Coulter, D. A. Generation and propagation of epileptiform discharges in a combined entorhinal cortex/hippocampal slice. Journal of Neurophysiology. 70 (5), 1962-1974 (1993).
- Leutgeb, J. K., Frey, J. U., Behnisch, T. LTP in cultured hippocampal-entorhinal cortex slices from young adult (P25-30) rats. Journal of Neuroscience Methods. 130 (1), 19-32 (2003).
- Davie, J. T., et al. Dendritic patch-clamp recording. Nature Protocols. 1 (3), 1235-1247 (2006).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording Synaptic Plasticity in Acute Hippocampal Slices Maintained in a Small-volume Recycling-, Perfusion-, and Submersion-type Chamber System. Journal of Visualized Experiments. (131), e55936 (2018).
- Dougherty, K. A., Islam, T., Johnston, D. Intrinsic excitability of CA1 pyramidal neurones from the rat dorsal and ventral hippocampus. Journal of Physiology. 590 (22), 5707-5722 (2012).
- Tidball, P., et al. Differential ability of the dorsal and ventral rat hippocampus to exhibit group I metabotropic glutamate receptor-dependent synaptic and intrinsic plasticity. Brain and Neuroscience Advances. 1 (1), (2017).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159 (2005).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), e53825 (2018).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Archives. 414 (5), 600-612 (1989).
- Djurisic, M. Minimizing Hypoxia in Hippocampal Slices from Adult and Aging Mice. Journal of Visualized Experiments. (161), e61377 (2020).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. P. Acute Brain Slice Methods for Adult and Aging Animals: Application of Targeted Patch Clamp Analysis and Optogenetics. Patch-Clamp Methods and Protocols, 2nd Edition. 1183, 221-242 (2014).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments. (91), e51706 (2014).
- Norenberg, A., Hu, H., Vida, I., Bartos, M., Jonas, P. Distinct nonuniform cable properties optimize rapid and efficient activation of fast-spiking GABAergic interneurons. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 894-899 (2010).
- Swietek, B., Gupta, A., Proddutur, A., Santhakumar, V. Immunostaining of Biocytin-filled and Processed Sections for Neurochemical Markers. Journal of Visualized Experiments. (118), e54880 (2016).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nature Protocols. 1 (4), 1977-1986 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Longair, M. H., Baker, D. A., Armstrong, J. D. Simple Neurite Tracer: open source software for reconstruction, visualization and analysis of neuronal processes. Bioinformatics. 27 (17), 2453-2454 (2011).
- Murray, A. J., et al. Parvalbumin-positive CA1 interneurons are required for spatial working but not for reference memory. Nature Neuroscience. 14 (3), 297-299 (2011).
- Otis, T. S., Staley, K. J., Mody, I. Perpetual inhibitory activity in mammalian brain slices generated by spontaneous GABA release. Brain Research. 545 (1-2), 142-150 (1991).
- Varela, C., Llano, D. A., Theyel, B. B. An introduction to in vitro slice approaches for the study of neuronal circuitry. Neuromethods. 67, 103-125 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved