Method Article
具有可移动XY阶段的平台孵化器:实现蛋白质细胞内快速光化学氧化的新平台
摘要
一种新的静态平台用于利用一种称为蛋白质细胞内快速光化学氧化(IC-FPOP)的蛋白质足迹技术,对原生细胞环境中的蛋白质结构和相互作用部位进行特征。
摘要
蛋白质的快速光化学氧化(FPOP)与质谱(MS)已成为结构蛋白质组学中一种宝贵的工具,将蛋白质相互作用、结构和蛋白质构象动力学作为溶剂可访问性的函数。近年来,FPOP(一种羟基基蛋白足印(HRPF)技术)的范围已扩大到活细胞培养中的蛋白质标签,为研究复杂细胞环境中的蛋白质相互作用提供了手段。细胞内蛋白质修饰可以深入了解配体诱导的结构变化或伴随蛋白质复合形成的构象变化,所有这些都在细胞环境中。蛋白质足迹利用惯常的基于流量的系统和248纳米KrF除菌激光通过过氧化氢的光解产生羟基基,需要20分钟的分析才能获得一个细胞样本。为了便于进行时间解决的FPOP实验,率先采用了基于6井板的IC-FPOP平台。在目前的系统中,单个激光脉冲照射整个井,从而截断FPOP实验时间框架,导致20秒的分析时间,减少60倍。这大大缩短了分析时间,使得以时间依赖的方式研究细胞机制(如生化信号级联、蛋白质折叠和微分实验(即无药物与药物结合)成为可能。这种名为"可移动XY阶段平台孵化器"(PIXY)的新仪器允许用户使用温度、CO2 和湿度控制的平台孵化器直接在光学台上执行细胞培养和 IC-FPOP。该平台还包括定位阶段、永久泵和用于激光束制导的镜面光学。对 PIXY 中的光学配置、流速、瞬态瞬变和 H2O2 浓度等 IC-FPOP 条件进行了优化和同行评审。系统所有组件的自动化将减少人工操作并增加吞吐量。
引言
蛋白质足迹技术可以揭示蛋白质组织的深刻信息。这些基于MS的基本结构生物学技术是质谱工具箱的组成部分。这些方法通过共价标记1、2、3、4来探测蛋白质的更高阶结构(HOS)和协同作用。蛋白质的快速光化学氧化 (FPOP) 使用羟基基氧化改变氨基酸的溶剂可访问侧链5,6 (表 1)。该方法利用248纳米的兴奋激光对过氧化氢(H 2 O2)进行光解,以产生羟基基。从理论上讲,20种氨基酸中,有19种可以氧化改性,而Gly是唯一的例外。然而,由于氨基酸与羟基基的抗反应率不同,实验中只观察到其中一部分的改性。尽管如此,该方法仍有分析蛋白质序列5的长度的潜力。FPOP 在微秒时间尺度上修改蛋白质,使其有助于研究与快速关闭速率的弱相互作用。溶剂可访问性在配体结合或蛋白质构象变化时发生变化,因此,该方法的威力在于比较多种状态下蛋白质的标签模式(即与配体绑定相比无配体)。因此,FPOP成功地识别了蛋白质-蛋白质和蛋白质-脂的相互作用位点和构象变化7、8、9、10的区域。FPOP方法已从纯化蛋白系统研究扩展到细胞内分析。细胞内FPOP(IC-FPOP)可以氧化地改变细胞中的一千多个蛋白质,从而在蛋白质组11、12之间提供结构信息。传统的IC-FPOP平台利用流系统将单个文件流过激光束。该系统的开发使单个细胞能够平等地暴露在激光照射下。这导致氧化标记的蛋白质数量增加了13倍。但是,流量系统的局限性是单个示例实验的长度,包括 10 分钟的辐照间隔,在此期间进行修改,并增加 10 分钟的洗涤周期。IC-FPOP 的时间限制使得它不适合研究短寿命蛋白质折叠中间体或生化信号级联中交互网络之间存在的变化。这种时间限制启发了配备更高吞吐量的新型 IC-FPOP 平台的设计。
为了准确测量原生细胞环境中的蛋白质高阶结构,新设计允许在激光平台上直接完成细胞培养,使IC-FPOP的吞吐量更高。此设置还允许最大限度地减少对蜂窝环境的扰动,与IC-FPOP相比,使用必须从基板中去除粘附细胞的流量。新平台允许IC-FPOP在无菌孵化系统中使用CO2 和温度控制的阶段顶室进行,同时利用配置的镜面光学进行激光束制导,XY运动的定位系统和用于化学交换的永久泵。进行IC-FPOP的新平台名为"可移动XY阶段平台孵化器"(PIXY)(图1)。在 PIXY 中,IC-FPOP 在平台孵化器室内六井板中生长的人体细胞上进行。对于此配置,激光束使用光束兼容的反射镜向下反射到板上,作为在 XY 平面中保持孵化器移动的定位阶段,因此激光束战略性地对齐,一次只照射一口井。验证研究表明,IC-FPOP在PIXY中的执行速度比在流动系统中快,并导致每蛋白质氨基酸的改性增加。这个新的IC-FPOP平台的开发将阐述从细胞实验13中可以获得的知识。
研究方案
1. 具有可移动 XY 阶段的平台孵化器组装
注:新平台包括孵化系统、定位阶段和控制器、围潜泵、248 nm KrF驱除激光器以及组装在帝国光学面包板上的光学反射镜。
- 组装孵化系统:温度单元、二氧化碳单位、加湿器、空气泵和触摸监测系统(图2A-E)。
注:制造商提供详细的装配说明。孵化系统必须稳定到5%的二氧化碳2,37°C和85%的湿度,然后再在孵化器内生长细胞。这些参数可能取决于细胞系。 - 组装定制的六井板孵化器、纳米定位驱动阶段和 XY 驱动阶段。前者分别拧入后者。
注:制造商提供的详细装配说明。 - 通过 RS-232 电缆将"雏菊链"序列中的四个永久泵连接起来,RS-232 到 USB 电缆连接到控制计算机。将 3.18 mm ID 聚合物管(例如 Tygon)连接到每个泵通道辊上的每个通道。
注:每个泵有四个滚筒。滚筒的方向和流速被手动操纵。 - 在每个 3.18 mm ID 聚合物管的末端插入 1/16" x 1/8" 连接器。将连接器的 1/16'末端插入 1.59 ID 聚合物管中,然后通过自定义端口将聚合物管插入孵化器中。将管的另一端放在在IC-FPOP实验期间注入的溶液中。
注意:对于灌注线,孵化器在外围有 36 个用于管线的定制端口,以容纳使用的所有试剂。 - 将一个 50 mm、248 nm、45° 兴奋激光线镜在运动镜安装内拧入面包板 10-11 网格点,从 248 nm 激光光圈进入面包板。将第二面镜子以 90° 角放置到孵化器另一侧的第一面。将第二面镜子向下倾斜约 45°,以便激光束引导到孵化器(图 2F-J)。
2. 通过集成软件实现系统的同步和初始自动化
- 安装控制驱动程序和泵所需的集成软件的最新版本。
- 参照泵手册,从"5"开始重命名泵并增加价值。命令可以使用集成软件中的 手动控制 子程序发送到泵系统。
注意:将泵设置为通道模式会自动将泵命名约定更改为与四个泵通道相对应的集 1、2、3 和 4。 - 打开集成软件程序,实现平台孵化器的自动化。
- 从标记 为泵的 Comport的连接下拉菜单中选择与泵系统 USB 电缆对应的相应 USB 组合设备名称(例如 COM4)。
- 单击脚本生成器按钮,为自动平台孵化器平台编辑/创建脚本。单击"保存脚本"以保存序列为文本文件(图 3A)。
注:脚本构建器具有用户界面,用于定义脚本,定义泵数、方向、速率、体积、管径、通道模式和定时延迟。 - 如果在编写脚本时需要通道模式,则脚本中的一步必须专用于更改插线模式的泵,并且必须将与泵通道相对应的以下步骤标记为泵 1-4。
注意:这可确保在平台孵化器脚本期间,没有两个泵可以同时处于通道模式,并且每个泵在命令发送到所需的通道后会切换回旧模式。 - 单击 "读取脚本" 按钮,并选择平台孵化器操作所需的相应脚本文件。
- 将运行序列按钮切换到开机位置(绿色)以运行脚本,然后单击START按钮(图 3B)。
3. 在平台孵化器中生长细胞
注意:细胞必须在实验前一天在细胞培养罩的无菌条件下放置在平台孵化器中。
- 将平台孵化器从纳米定位阶段拧开,并断开温度、气体和加湿器线路。在用70%乙醇喷洒孵化器后,将其放置在细胞培养罩中。
- 在转移前,在T-175到大约80-90%的对流中生长细胞。
注:术语"共和"用于测量细胞培养盘或烧瓶中细胞的数量/覆盖。 - 删除介质并用缓冲器冲洗。
- 使用使用制造商协议的尝试蛋白-EDTA分离细胞。
- 在8mL的介质中恢复并计数细胞。
- 种子纤维素/胶原蛋白14 涂层六井板,每口井中约 90-95 μL 的再消耗细胞。第二天,该体积将适合在每口井中实现 80-90% 的汇合(约 120 万个细胞)。
注:播种前必须涂上胶原蛋白。IC-FPOP 期间使用的试剂注入了快速流速。涂层板可确保细胞不会因输注试剂而过早分离。 - 将种子板放入平台孵化器中,并盖上石英盖。
注:在设计和开发过程中,玻璃孵化器盖改为石英,因此与紫外线激光兼容。 - 将平台孵化器重新更换并固定在纳米定位驱动阶段。重新连接温度、气体和加湿器线路。
- 让细胞在一夜之间生长成并存。
注:以下细胞培养步骤是可选的,用于人体细胞瞬时转染的实验。这些步骤评估细胞培养条件下的转染效率。 - 使用商用血脂转染试剂盒将含有奇美蛋白 GCaMP2 基因的质粒传输到 HEK 293 细胞中。
- 在两个六井板中的 HEK293T 细胞中执行 GCaMP2 的瞬态瞬变。
- 在平台孵化器中孵化一个六井板,在标准 CO2 孵化器中孵化第二个六井板。
- 使用荧光显微镜通过荧光成像比较每个板内的转染效率。
4. 制作淬当缓冲区和 H2O2
- 制作 100 mL 淬扑缓冲器,其中含有 125 m N-tert-丁基-α-苯硝基酮 (PBN) 和 125 mM N、N+-二甲基硫酸酯 (DMTU)。
注:DMTU和PBN是自由基拾荒者,是细胞渗透者。 - 稀释 H2O2 到 200 mM。每个样本需要 6 毫升的 H2O2 才能完全浸入每个井底部的细胞层。
注:淬火缓冲区在前一天制作,并储存在4°C过夜,不受光线照射。在实验当天稀释 H2O2。
5. 为IC-FPOP设置平台孵化器
注:平台孵化器必须在无菌条件下组装。将孵化器组装在无菌细胞培养罩中。
- 将平台孵化器从定位阶段拧开,并断开温度、气体和加湿器线路。
- 在用70%乙醇喷洒孵化器后,将其放置在细胞培养罩中。
- 从平台孵化器中取出六井板,固定板的原始盖子,并使用显微镜确认细胞的共性。
- 细胞结合确认后,用组合细胞替换六井板,回到细胞培养罩内的平台孵化器中。
- 通过嵌入式端口在每口井中插入三个预切(15 厘米)1.59 ID 聚合物管。将管子冲洗到井壁上,并配上自定义的 3D 打印环。
注:六个 33 毫米 PLA 灯丝 3D 打印环是定制的,旨在将管子固定在板壁上,而不会干扰细胞或妨碍激光脉冲。 - 用石英盖盖住平台孵化器。更换并固定定位系统上的舞台顶部孵化器。重新连接温度、气体和加湿器线路。
- 将 1.59 ID 聚合物管连接到 1/16x1/8"连接器的末端。
6. 在平台孵化器中执行IC-FPOP
- 为泵取款准备集成软件脚本。使用一个永久泵(泵 8)从所有六口井中完全去除细胞介质。
- 其他三个永久泵的每个通道的主要溶剂(泵 5-7)。将 H2O2 和淬热缓冲器注入各自的交替管中,直到试剂到达孵化器端口。
- 确认激光束由反射镜正确倾斜,并不受约束地到达孵化器。
注意:每当激光使用时,必须佩戴激光安全护目镜。在绞痛/对齐过程中,不要过早地照射细胞。对齐光束时,使用纸板完全覆盖石英盖。此外,使用六井板白纸上的打印轮廓进一步确认激光束击中每口井的中心。以最低频率和能量使用 连续 脉冲设置进行对齐。 - 使用外部传感器检查激光能量。在 50 Hz 和 27 kV 下使用 160 mJ 的单个激光脉冲。
注:以下步骤需要一个正时器。 - 确认光束对齐后,准备泵输液的集成软件脚本。
- 开始限时器,同时按集成软件泵脚本上的 "开始" 按钮。
- 以 35mL/min 将200mM H 2 O2 注入第一口井(在制时器上 6-10 秒标记)。
注意:泵开始注入之前有五秒钟的延迟。在触发脉冲之前,激光还需要七秒钟的时间。H 2O 2输液后,激光脉冲必须立即出现。 - 按激光软件上的 "开始" 按钮,在 5 秒标记下触发点时器上 11 秒标记的脉冲。
- 在激光脉冲后立即将 125 mM 淬扑溶液以 35 mL/min 注入第一口井中。手动移动定位阶段,使下一口井与激光束对齐。
- 重复上述步骤 6.5-6.9,直到每口井都经过处理。
注:IC-POP 以三个激光和三个非激光样品的技术三元体进行。一个加工的六井板作为一个生物复制品。 - 在细胞培养罩中,使用细胞刮刀将每个井中的细胞转移到单独的 15 mL 圆锥管中。离心机在1,200 x g下5分钟。
- 丢弃RIPA裂解缓冲器100μL中的超自然和再吸附细胞。
- 将细胞转移到单独的 1.2 mL 聚丙烯管中。
- 将所有样品在液氮中冷冻,并放在 -80 °C 冰柜中,直到使用。
注:协议可在此处暂停。
7. 蛋白质提取、纯化和蛋白质分析
- 在热块中将样品解冻并在 95 °C 下加热 5 分钟。
- 加热后,在冰上冷却5分钟。
- 在细胞中加入25个单位的核糖核酸,以降解单链、双链、线性和圆形DNA和RNA,并在温带室孵育15分钟。
- 离心机样品在 16,000 x g 下 10 分钟,在 4 °C。
- 收集超自然物并转移到干净的聚丙烯管中。
- 使用彩色蛋白质检测检查蛋白质浓度。
- 将 100 μg 的样品转移到干净的聚丙烯管中,并带上带细胞裂解缓冲器的 100 μL。
- 在 50 °C 下用 10 mM 二二醇 (DTT) 减少样品 45 分钟。
- 在室温下冷却样品10分钟。
- 在室温下用50m碘乙酰胺(IAA)烷基酸酯20分钟。
注意:保护 IAA 免受光线的照射 - 添加460微升预冷(-20°C)丙酮。漩涡样品,并放置在-20°C过夜。
注:协议可在此处暂停。 - 第二天,离心机样品在16,000 x g为10分钟,在4°C。
- 在不破坏蛋白质颗粒的情况下去除心肌。
- 加入 50 μL 的 90% 预冷 (-20 °C) 丙酮。漩涡样品混合和离心机在16,000 x g在4°C额外5分钟。
- 去除血小板,让样品干燥2-3分钟。
- 用10mM三叉戟缓冲器pH 8重新加入蛋白质颗粒。
- 在 40 μL 的 10 mM Tris 缓冲 pH 8 中重新添加 MS 级三氯丁酚 (20μg 库存),并在每个样品中添加 2.5μg 的 trypsin。
- 在 37 °C 的夜间孵化样品。
注:协议可在此处暂停。 - 使用彩色肽检测评估肽浓度。
- 用5%的预酸淬气样品。
- 将 10 μg 的样品转移到干净的聚丙烯管中。
- 使用真空离心机干燥样品,在水中用 20 μL 的 MS 级 0.1% 的贫酸 (FA) 进行再吸附。
- 将每个样品转移到带有预切开盖的自动采样瓶中进行清洁。
8. 高性能液相色谱-坦德姆质谱仪(LC-MS/MS)
- 要本地化 FPOP 修改,使用 LC-MS/MS 分析消化的细胞解析。
- 在水中使用 0.1% FA 的移动相 (A) 和在丙酮三酯 (ACN) (B) 中使用 0.1% FA 的移动相。
- 将 0.5μg 样品加载到 180 μm x 20 mm C18 (5 μm 和 100 é) 陷印柱上,用 99% (A) 和 1% (B) 清洗柱子 15 分钟。
- 使用 75 μm x 30 厘米 C18 (5μm 和 125 +) 分析列,使用流速为 0.300 μL/min 的 120 分钟,分别排出和单独消化肽。
- 运行LC梯度如下:0−1分钟,3%溶剂B:2−100分钟,10−45%B:100−110分钟,45-100%B:110−115分钟,100%B。
- 将列从 115-116 分钟重新修复为 3% (B),从 116-120 分钟重新保持 3% (B)。
- 用纳米电溅电流分析正离子模式下的蒸发肽。
- 以 60,000 的分辨率获得 M1 光谱,扫描范围为 375-1500。
- 将自动增益控制 (AGC) 目标设置为 5.0e5, 最大注射时间为 50 ms 和 5.0e4 强度阈值。
- 通过数据依赖采集 (DDA) 分离具有充电状态的前体离子 2-6,隔离窗口为 1.2 m/z,周期时间为 4 秒。
- 将 MS2 离子受制于高能碰撞分离 (HCD) (32% 的规范化能量)。
- 在 1 MS/MS 采集后 60 秒排除肽。
- 将 MS/MS 分辨率设置为 15,000,AGC 目标为 5.0e4, 最大注射时间为 35 ms。
9. 蛋白类发现者/数据处理
- 根据相关的 智人 蛋白质数据库和消化酶,在可用的自下而上的蛋白质组学分析软件上搜索串联原始数据文件。
- 设置蛋白质分析搜索参数。
- 将片段容差设置为 0.02 Da,将父离子耐受性设置为 10 ppm。
- 设置酶特异性,以尝试普辛,并允许一个错过的。
- 将质量范围设置为 375-1500 m/z。
- 在 95%(中)建立肽信心,在 99%(高)建立残留信心。
- 如果至少用 5% 的发现率 (FDR) 过滤器识别出两种不同的肽,则接受蛋白质。
- 设置碳混合甲基化为静态修饰和所有已知羟基侧链修改15,16作为动态修改。
- 文件完成搜索后,将输出序列、修改位置、蛋白质加入、频谱文件、前体丰度和保留时间信息存入电子数据库。
- 计算此等式中每个肽或残留物的修改程度:
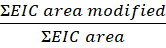
注:改性EIC区域为肽或残留物的提取离子色谱区(EIC),并经过氧化修改,EIC区域为相同肽或残留物的总面积,有氧化物修改后无氧化性修改。随着时间的推移,过氧化氢存在的蛋白质会氧化,导致背景氧化。为了计算修改的程度,修改后的肽的面积除以总面积。非辐照控制样本占背景氧化。从对照样本中减去对照样本的背景氧化,以识别 FPOP 修饰。
结果
为了确认平台孵化器条件足以在激光平台进行细胞培养,GCaMP2 暂时转入 HEK293T,并通过荧光成像(图 4A)评估了两个板的转染效率。GCaMP2 是一种钙感应荧光蛋白,用作基因编码的细胞内钙指示器。它是绿色荧光蛋白(GFP)和钙结合蛋白,卡尔莫杜林的融合。在用质粒prl-TK传输的HK 293细胞上进行了路西法酶检测,以量化转染效率(图4B)。结果表明,平台孵化器的性能超过了标准孵化器,转化效率提高了1.13倍,为最佳细胞培养环境提供了定量基准。
将流系统中标记的 HEK293T 细胞中的 FPOP 修饰与平台孵化器中标记的细胞进行比较,结果表明平台孵化器在修改的蛋白质数量(图 5)和这些蛋白质的总 FPOP 覆盖率方面都优于流系统。平台孵化器中获得的FPOP改性蛋白质数量约为1051种,比典型实验中获得的蛋白质数量多2.2倍。每个实验的两个生物复制品结合了修改。此外,PIXY 提供更高的吞吐量。
为了证明蛋白质的修改覆盖率较高的优势,IC-FPOP修饰在肽水平上进行了局部化,并量化了修改的程度,以区分375氨基酸蛋白Actin系统之间的结果差异。在流动系统中,检测到两个经过修改的肽,提供有限的结构信息(图6A)。然而,在平台孵化器中检测到跨越行为序列的五种修改肽。串联质谱表明,每个实验(图6B)中都对Pro322残留物进行了修改和检测。平台孵化器样品中修改的五个肽含有十二个改性残留物,而只有四个残留物与流动系统(图6C)一起修改。氧化覆盖率的提高为蛋白质提供了更多的结构信息。
埃斯皮诺等人展示了FPOP在C.elegans(一种人类疾病蠕虫模型17)内进行体内(IV-FPOP)的能力。虽然 IV-FPOP 也通过流系统执行,但 PIXY 系统经过了与蠕虫的兼容性测试。在20°C.LC.LC.MS/MS分析中,平台孵化器中每口井中孵育了约10,000只蠕虫−MS/MS分析显示,平台孵化器中IV-FPOP对792种蛋白质进行了改良,而与流系统修改的545种蛋白质相比(图7)。这些结果表明,除了二元细胞培养外,这种新方法还与研究其他生物系统(如C.elegans)相容。
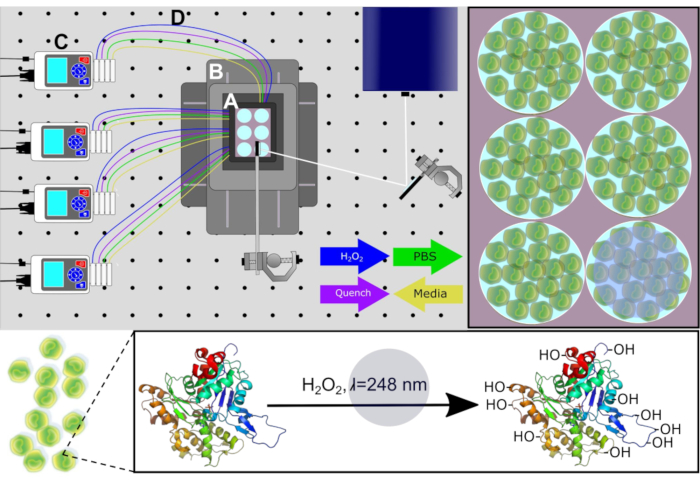
图1。PIXY 系统的示意图。系统组件:(A)舞台顶孵化器、(B)定位系统、(C)围场泵和(D)灌注线。在 H 2O 2和淬渠解决方案在计算的时间点注入之前,通过泵从每口井中去除细胞培养介质。辐照的激光路径以白色展示。经约翰逊、D. T.、蓬森-史密斯、B.、埃斯皮诺、J.A.、格森森、A.、琼斯、L.M许可,在具有可移动XY级的平台孵化器中实现蛋白质细胞内快速光化学氧化。分析化学,92(2),1691-1696 2019年。版权所有 2020 美国化学学会。请单击此处查看此图的较大版本。

图2。完全组装的PIXY系统。 (A) 触摸监测系统、(B)二氧化碳装置、(C)温度单元、(D)空气泵、(E)加湿器、(F)光学反射镜、(G)平台孵化器、(H)定位阶段、(I)248nm KrF驱虫器激光器和(J)围场泵。 请单击此处查看此图的较大版本。
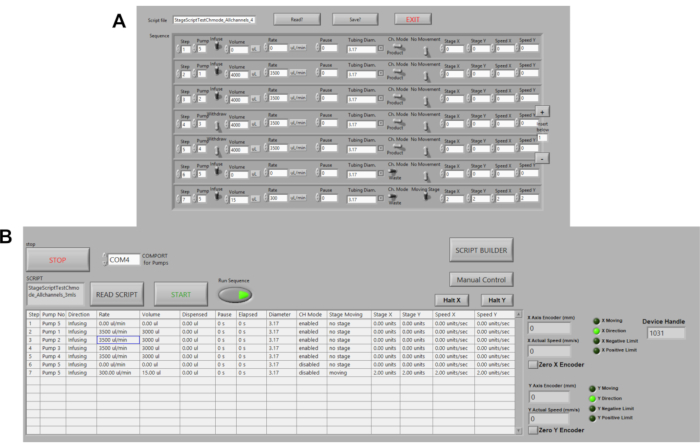
图3。永久泵的自动化。 (A) 实验室视图中的示例命令脚本。命令选项包括音量、流速、暂停、流向。速度、舞台距离和位置目前正在自动化。(B) 拉布维尤的脚本阅读器。在这里,命令脚本上传,然后运行序列和 START 按下启动泵。 请单击此处查看此图的较大版本。
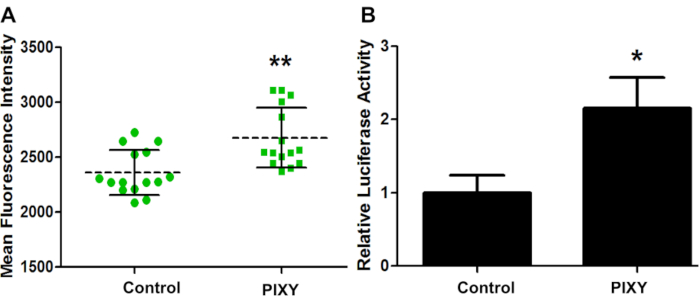
图4。HEK细胞传输效率。 (A) 标准孵化器 (控制) 和舞台顶孵化器 (PIXY) 之间的 GCaMP2 转染比较的平均荧光强度。点和正方形表示在采取措施的井中的每个点。(B) 通过不同的向量质粒(pRL-TK)对传染效率进行量化和验证。P值<0.005。经约翰逊、D. T.、蓬森-史密斯、B.、埃斯皮诺、J.A.、格森森、A.、琼斯、L.M许可,在具有可移动XY级的平台孵化器中实现蛋白质细胞内快速光化学氧化。分析化学,92(2),1691-1696 2019年。版权所有 2020 美国化学学会。 请单击此处查看此图的较大版本。
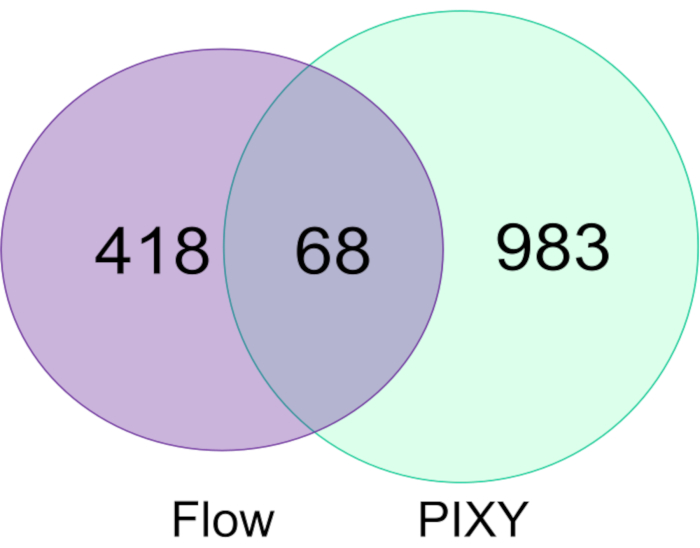
图5。比较单细胞流动系统和PIXY中修改的蛋白质。 在流动系统(紫色)和PIXY(绿色)中修改的蛋白质维恩图。经约翰逊、D. T.、蓬森-史密斯、B.、埃斯皮诺、J.A.、格森森、A.、琼斯、L.M许可,在具有可移动XY级的平台孵化器中实现蛋白质细胞内快速光化学氧化。分析化学,92(2),1691-1696 2019年。版权所有 2020 美国化学学会。 请单击此处查看此图的较大版本。
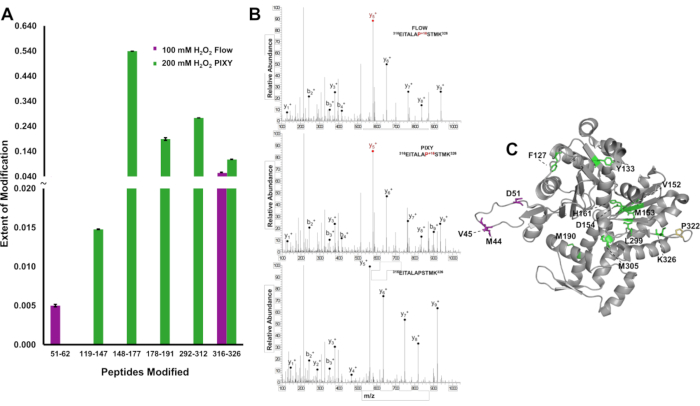
图6。IC-FPOP 修改的本地化。系统之间的IC-FPOP修改比较。 (A) 从流动系统(紫色)与平台孵化器(绿色)在作用区内氧化修改肽的条形图。(B) 在两个系统中均具有修改的蛋白 (肽 316-326) 和未经修改的肽 (C) FPOP 修改后的行为残留物 (PDB: 6ZXJ, 链 A 平台孵化器中的 11 个修改残留物(绿色)、流系统中的 3 个修改残留物(紫色)、1 个重叠的修改残留物(黄色)。经约翰逊、D. T.、蓬森-史密斯、B.、埃斯皮诺、J.A.、格森森、A.、琼斯、L.M许可,在具有可移动XY级的平台孵化器中实现蛋白质细胞内快速光化学氧化。分析化学,92(2),1691-1696 2019年。版权所有 2020 美国化学学会。 请单击此处查看此图的较大版本。
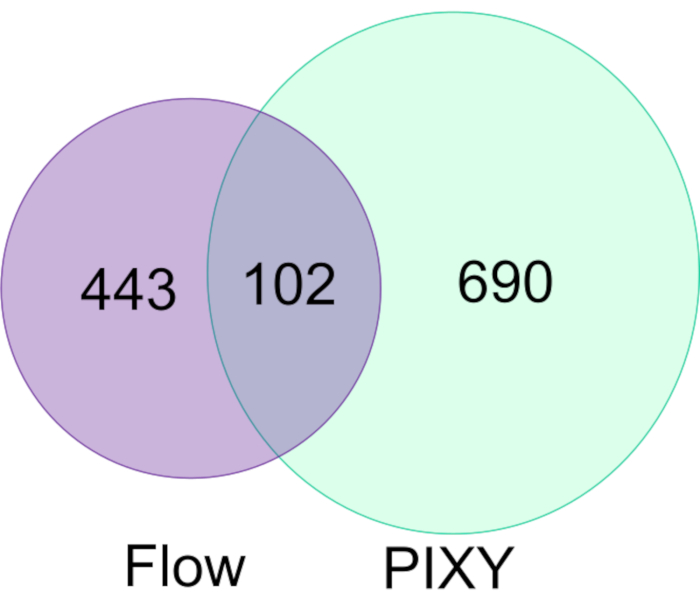
图7。按流量与PIXY比较 C.电子人 中的FPOP改性蛋白。 与流系统相比,使用 PIXY 的氧化改性蛋白质增加了 1.5 倍。经约翰逊、D. T.、蓬森-史密斯、B.、埃斯皮诺、J.A.、格森森、A.、琼斯、L.M许可,在具有可移动XY级的平台孵化器中实现蛋白质细胞内快速光化学氧化。分析化学,92(2),1691-1696 2019年。版权所有 2020 美国化学学会。 请单击此处查看此图的较大版本。
表1。工作流程修改分布和大换档(Da).请点击这里下载此表。
讨论
蛋白质在活细胞中执行大部分工作。鉴于这一重要性,需要详细的数据蛋白质功能和细胞环境中的更高阶结构(HOS),以加深对较大复合体的复杂性和细胞酶反应的理解,而不是纯化系统。为此,采用了一种羟基基蛋白足印(HRFP)方法,名为细胞内快速光化学蛋白质氧化(IC-FPOP)。大多数FPOP研究 都是在 相对纯净的蛋白质系统中进行的体外研究,这与影响结合相互作用和蛋白质构象动力学的拥挤的分子环境形成鲜明对比。因此,体 外 实验18 的发现与在实际细胞环境中获得的发现之间存在鸿沟。为了弥合 体外 FPOP实验理想化条件与细胞复杂性质之间的差距,开发了基于细胞-FPOP的新型自动化六井板平台。这种新型的FPOP技术能够识别和描述这些分子物种,并在健康和疾病状态中追踪它们的动态分子相互作用。此新平台称为具有可移动 XY 阶段 (PIXY) 的平台孵化器。
FPOP 已成功用于描述蛋白组内的结构信息。然而,每种生物技术都有一定的局限性,需要进一步改进。在激光光解过程中需要特定的试剂,并有效淬灭未经反应的水解基。消化肽的分离可能需要大量的时间才能最大限度地利用结构信息。在MS后数据分析1中,这些丰富的信息也可能需要广泛的量化。平台孵化器,包括激光平台细胞培养和IC-FPOP所需的外围机械,成本高,对于一些实验室来说可能不可行。随着进展的继续,强大的软件和分析工具应进一步推进技术:其中一些在这项研究中进行了展示。目前在这个平台孵化器的研究已经在HK293T细胞和 C.电子根进行。IC-FPOP方法已被证明与各种细胞系兼容,包括中国仓鼠卵巢(CHO)、维罗、MCF-7和MCF10-A细胞19。由于一般IC-FPOP方法可翻译为此静态平台,因此这些细胞系也应适合使用PIXY进行研究。
IC-FPOP 利用 H2O2氧化性地修改溶剂中容易获得的氨基酸侧链,然后进一步辨别可行细胞内的蛋白质相互作用、结构和代谢效应,这对提供生物环境具有重要意义。在IC-FPOP实验之前,必须确认H 2O 2添加后的细胞是可行的。细胞生存能力研究表明,在H2O2浓度高达200mM13的情况下,这些细胞是可行的。此外,在去除介质后,确保 H2O2在最终浓度为 200 mM 时直接注入细胞也很重要。如果不能完全去除细胞培养介质,会导致H2O2浓度的不同。与标准条件相比,将孵化时间增加到 10 秒,同时增加 H2O2浓度,导致 IC-FPOP 在平台孵化器中修改的蛋白质数量增加。在使用前必须使用主要的围网泵,以确保泵正常工作,液体被分散。否则可能导致管内气泡、H2O2的体积不足和/或淬当溶液体积不足。
可能出现的另一个问题是系统中不必要的延迟。这方面的一个例子是验证泵系统接收的命令的过程,这增加了使用集成软件的 1000 毫秒或更多毫秒顺序的重大延迟。这个问题可以通过在实验期间尽量减少与泵的通信和尽可能提前使用预设命令来解决。
今后,PIXY 的目标是生产一个全自动和集成的系统。除了围流泵外,激光脉冲的触发也将实现自动化。还将利用新的定位系统快速移动平台孵化器,以提高速度和准确性。系统的所有组件将继续使用集成软件进行编程,以进一步提高吞吐量。
披露声明
作者声明没有相互竞争的经济利益。
本文提出的研究与以下引用的专利申请相关联:
美国非临时专利申请号: 17/042,565
标题:"确定蛋白质折叠的设备和方法"
UMB 码头号码: LJ-2018-104 乌玛斯参考: UMA 18-059.
致谢
这项工作得到了NIH R01 GM128983-01的资助。
材料
| Name | Company | Catalog Number | Comments |
| Ismatec Reglo ICC Peristaltic Pumps | Cole-Palmer | 122270050 | |
| Kinematic Mirror Mount for Ø2" Optics | Thor Labs | ||
| 10X trypsin−EDTA | Corning | AB00490-00005 | |
| 50.0mm 248nm 45°, Excimer Laser Line Mirror | Edmond Optics | ||
| Acetone, HPLC Grade | Fisher Scientific | ||
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | ||
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 23275 | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| ACQUITY UPLC M-Class System | Waters | A53225 | |
| Afinia H480 3D Printer | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| air pump | OKOlabs | D12345 | |
| Aluminum Foil | Fisher Scientific | Stock #63-120 | |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | ||
| carbon dioxide unit | OKOlabs | MadMotor®-UHV | |
| Centrifuge | Eppendorf | ||
| connectors (Y PP 1/16” and 1/16x1/8”) | Cole-Palmer | 116891000 | |
| Delicate Task Wipers | Fisher Scientific | 022625501 | |
| Dithiothreiotol (DTT) | AmericanBio | ||
| DMSO, Anhydrous | Invitrogen | LS118-500 | |
| Dulbecco’s phosphate-buffered saline (DPBS) | Corning | SK-78001-82 | |
| EX350 excimer laser | GAM Laser | PI89900 | |
| Fetal bovine serum (FBS) | Corning | SK-12023-78 | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| HEK293T cells | Paul Shapiro Lab (University of Maryland Baltimore) | ||
| humidifier | OKOlabs | Nano-LPMW stage | |
| HV3-2 VALVE | Hamilton | BP152-500 | |
| Hydrogen Peroxide | Fisher Scientific | LS120-500 | |
| Iodoacetamide (IAA) | ACROS Organics | ||
| LABVIEW Professional 2018 | National Instruments | 86728 | |
| MadMotor Positioning system and controllers | Mad City Labs | W6-4 | |
| Methanol, LC/MS Grade | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Microcentrifuge | Thermo Scientific | H301-T Unit-BL-PLUS | |
| N,N′-Dimethylthiourea (DMTU) | ACROS Organics | ||
| Nanopositioinging stage | Mad City Labs | ||
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | ||
| OKO Touch Monitoring System | OKOlabs | ||
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | 7Z02936 | |
| PE50-C pyroelectric energy meter | Ophir Optronics | ||
| Penicillin-streptomycin | Corning | ||
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | ||
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | ||
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 75002436 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 06-666A | |
| pressure gauge | OKOlabs | OKO-AIR-PUMP-BL | |
| PTFE filter | OKOlabs | CO2-UNIT-BL | |
| Six 33 mm PLA filament rings | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| sterile incubator | OKOlabs | ||
| temperature unit | OKOlabs | OKO-TOUCH | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | A117-50 | |
| TiNKERcad | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| Tris Base | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| tubing (Tygon 3.18 and 1.59 ID) | Cole-Palmer | 177350250 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Water, LC/MS Grade | Fisher Scientific | 88702 | |
| 90058 | |||
| KM200 | |||
| 186007496 |
参考文献
- Johnson, D. T., Di Stefano, L. H., Jones, L. M. Fast photochemical oxidation of proteins (FPOP): A powerful mass spectrometry based structural proteomics tool. Journal of Biological Chemistry. 294 (32), 11969-11979 (2019).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemical Reviews. 120 (10), 4355-4454 (2019).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-883 (2019).
- Zhao, B., et al. Covalent Labeling with an α,β-Unsaturated Carbonyl Scaffold for Studying Protein Structure and Interactions by Mass Spectrometry. Analytical Chemistry. 92 (9), 6637-6644 (2020).
- Hambly, D. M., Gross, M. L. Laser Flash Photolysis of Hydrogen Peroxide to Oxidize Protein Solvent-Accessible Residues on the Microsecond Timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Li, K. S., Shi, L., Gross, M. L. Mass Spectrometry-Based Fast Photochemical Oxidation of Proteins (FPOP) for Higher Order Structure Characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Chea, E. E., Jones, L. M. Modifications generated by fast photochemical oxidation of proteins reflect the native conformations of proteins. Protein Science. 27 (6), 1047-1056 (2018).
- Hambly, D., Gross, M. Laser flash photochemical oxidation to locate heme binding and conformational changes in myoglobin. International Journal of Mass Spectrometry. 259 (1), 124-129 (2007).
- Yan, Y. Fast photochemical oxidation of proteins (FPOP) maps the epitope of EGFR binding to adnectin. Journal of the American Society for Mass Spectrometry. 25 (12), 2084-2092 (2014).
- Zhang, Y., Wecksler, A. T., Molina, P., Deperalta, G., Gross, M. L. Mapping the Binding Interface of VEGF and a Monoclonal Antibody Fab-1 Fragment with Fast Photochemical Oxidation of Proteins (FPOP) and Mass Spectrometry. Journal of the American Society for Mass Spectrometry. 28 (5), 850-858 (2017).
- Espino, J. A., Mali, V. S., Jones, L. M. In Cell Footprinting Coupled with Mass Spectrometry for the Structural Analysis of Proteins in Live Cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L. M. Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytical Chemistry. 92 (2), 1691-1696 (2019).
- Bangel-Ruland, N., et al. Cystic fibrosis transmembrane conductance regulator-mRNA delivery: a novel alternative for cystic fibrosis gene therapy. The Journal of Gene Medicine. 15 (11-12), 414-426 (2013).
- Gau, B. C., Chen, H., Zhang, Y., Gross, M. L. Sulfate Radical Anion as a New Reagent for Fast Photochemical Oxidation of Proteins. Analytical Chemistry. 82 (18), 7821-7827 (2010).
- Xu, G. C., et al. Hydroxyl Radical-Mediated Modification of Proteins as Probes for StructuralProteomics. Chemical Reviews. American Chemical Society. 107 (8), 3514-3543 (2007).
- Espino, J. A., Jones, L. M. Illuminating Biological Interactions with In Vivo Protein Footprinting. Analytical Chemistry. 9 (10), 6577-6584 (2019).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast Photochemical Oxidation of Protein Footprints Faster than Protein Unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Kaur, U., Johnson, D. T., Jones, L. M. Validation of the Applicability of In-Cell Fast Photochemical Oxidation of Proteins across Multiple Eukaryotic Cell Lines. Journal of the American Society for Mass Spectrometry. 31 (7), 1372-1379 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。