Method Article
Plattform-Inkubator mit beweglicher XY-Stufe: Eine neue Plattform zur Implementierung der in-Cell schnellen photochemischen Oxidation von Proteinen
In diesem Artikel
Zusammenfassung
Eine neue statische Plattform wird verwendet, um Proteinstruktur- und Interaktionsstellen in der nativen Zellumgebung zu charakterisieren, indem eine Protein-Footprinting-Technik verwendet wird, die als schnelle photochemische Oxidation von Proteinen (IC-FPOP) in der Zelle bezeichnet wird.
Zusammenfassung
Die schnelle photochemische Oxidation von Proteinen (FPOP) in Verbindung mit der Massenspektrometrie (MS) ist zu einem unschätzbaren Werkzeug in der strukturellen Proteomik geworden, um Proteinwechselwirkungen, Struktur und Proteinkonformationsdynamik in Abhängigkeit von der Zugänglichkeit von Lösungsmitteln zu überprüfen. In den letzten Jahren wurde der Anwendungsbereich von FPOP, einer Hydroxylradikal-Protein-Fußdruck-Technik (HRPF), auf die Proteinkennzeichnung in lebenden Zellkulturen ausgeweitet und bietet die Möglichkeit, Proteinwechselwirkungen in der verworrenen zellulären Umgebung zu untersuchen. In-Zell-Protein-Modifikationen können Einblicke in Liganden induzierte strukturelle Veränderungen oder Konformationsveränderungen geben, die mit der Proteinkomplexbildung einhergehen, und das alles im zellulären Kontext. Die Protein-Fußabdruckung wurde mit einem üblichen strömungsbasierten System und einem 248 nm KrF-Excimerlaser durchgeführt, um Hydroxylradikale über photolysewasserstoffperoxid zu ergeben, was eine 20-minütige Analyse für eine Zellprobe erfordert. Um zeitaufgelöste FPOP-Experimente zu ermöglichen, wurde der Einsatz einer neuen 6-Well-Platten-basierten IC-FPOP-Plattform als Pionierin entwickelt. Im aktuellen System bestrahlt ein einzelner Laserpuls einen ganzen Brunnen, was den experimentellen FPOP-Zeitrahmen abkürst, was zu einer 60-fachen Abnahme von 20 Sekunden Analysezeit führt. Diese stark verkürzte Analysezeit ermöglicht es, zelluläre Mechanismen wie biochemische Signalkaskaden, Proteinfaltung und Differentialexperimente (d.h. drogenfrei vs. drogengebunden) zeitabhängig zu erforschen. Diese neue Instrumentierung mit dem Titel Platform Incubator with Movable XY Stage (PIXY) ermöglicht es dem Anwender, Zellkultur und IC-FPOP direkt auf der optischen Bank mit einem Plattform-Inkubator mit Temperatur-,CO2- und Feuchtigkeitsregelung durchzuführen. Die Plattform umfasst auch eine Positionierungsstufe, peristaltische Pumpen und Spiegeloptik für die Laserstrahlführung. IC-FPOP-Bedingungen wie Optikkonfiguration, Durchflussraten, transiente Transfektionen und H2O2-Konzentration in PIXY wurden optimiert und peer-reviewed. Die Automatisierung aller Komponenten des Systems wird die menschliche Manipulation reduzieren und den Durchsatz erhöhen.
Einleitung
Protein-Fußabdruck-Techniken können tiefgreifende Informationen über die Organisation von Proteinen offenbaren. Diese wesentlichen strukturbiologischen MS-basierten Techniken sind Bestandteil der Toolbox der Massenspektrometrie. Diese Methoden untersuchen Protein-Strukturen höherer Ordnung (HOS) und Synergien über kovalente Kennzeichnung1,2,3,4. Die schnelle photochemische Oxidation von Proteinen (FPOP) verwendet Hydroxylradikale, um lösungsmittelfreie Seitenketten von Aminosäuren5,6 ( Tabelle1) oxidativ zu modifizieren. Das Verfahren verwendet einen Excimer-Laser bei 248 nm zur Photolyse von Wasserstoffperoxid (H2O2), um Hydroxylradikale zu erzeugen. Theoretisch können 19 der 20 Aminosäuren oxidativ modifiziert werden, wobei Gly die einsame Ausnahme ist. Aufgrund der unterschiedlichen Reaktivitätsraten von Aminosäuren mit Hydroxylradikalen wurde jedoch eine Veränderung nur einer Teilmenge dieser Experimente experimentell beobachtet. Dennoch hat die Methode das Potenzial für die Analyse über die Länge einer Proteinsequenz5. FPOP modifiziert Proteine auf der Mikrosekunden-Zeitskala, was es nützlich macht, schwache Wechselwirkungen mit schnellen Abschaltraten zu untersuchen. Die Lösemittel-Zugänglichkeit ändert sich bei Ligandenbindung oder einer Änderung der Proteinkonformation, so dass die Kraft des Verfahrens im Vergleich des Etikettiermusters eines Proteins in mehreren Zuständen liegt (d. h. ligaandfrei im Vergleich zu Ligandengebunden). Als Ergebnis ist es FPOP gelungen, Protein-Protein- und Protein-Ligand-Wechselwirkungsstellen und Regionen der Konformationsveränderung7,8,9,10zu identifizieren. Die FPOP-Methode wurde von der Untersuchung von gereinigten Proteinsystemen bis zur In-Zell-Analyse erweitert. In-Cell FPOP (IC-FPOP) kann oxidativ über tausend Proteine in Zellen modifizieren, um strukturelle Informationen über das Proteom11,12zu liefern. Die herkömmliche IC-FPOP-Plattform nutzt ein Durchflusssystem, um Zellen einzelne Dateien an dem Laserstrahl vorbei zu fließen. Die Entwicklung dieses Systems ermöglichte es einzelnen Zellen, die gleiche Exposition gegenüber Laserbestrahlung zu haben. Dies führte zu einem 13-fachen Anstieg der Anzahl oxidativ markierter Proteine12. Eine Einschränkung des Strömungssystems ist jedoch die Länge eines einzelnen Probenexperiments, bestehend aus einem 10-minütigen Bestrahlungsintervall, in dem die Modifikation stattfindet, und einem zusätzlichen 10-minütigen Waschzyklus. Die zeitlichen Zwänge von IC-FPOP machen es ungeeignet für die Untersuchung kurzlebiger Proteinfaltzwischenprodukte oder Veränderungen, die zwischen Interaktionsnetzwerken in biochemischen Signalkaskaden vorhanden sind. Diese zeitliche Begrenzung inspirierte das Design einer neuen IC-FPOP-Plattform mit höherem Durchsatz.
Um die Proteinstruktur in der nativen Zellumgebung genau zu messen, ermöglicht das neue Design die Zellkultur direkt an der Laserplattform, wodurch IC-FPOP einen hohen Durchsatz erreicht. Dieses Setup ermöglicht auch minimierte Störungen der zellulären Umgebung, im Gegensatz zu IC-FPOP mit Strömung, bei dem haftende Zellen aus dem Substrat entfernt werden müssen. Die neue Plattform ermöglicht IC-FPOP in einem sterilen Inkubationssystem mit einerCO2- und temperaturgesteuerten Bühnenoberkammer unter Verwendung konfigurierter Spiegeloptiken für die Laserstrahlführung, einem Positionierungssystem für XY-Bewegungen und peristaltischen Pumpen für den chemischen Austausch. Die neue Plattform zur Durchführung von IC-FPOP trägt den Titel Platform Incubator with Movable XY Stage (PIXY) (Abbildung 1). In PIXY wird IC-FPOP an menschlichen Zellen durchgeführt, die in Sechs-Well-Platten innerhalb der Plattform-Inkubatorkammer angebaut werden. Bei dieser Konfiguration wird der Laserstrahl mit strahlkompatiblen Spiegeln nach unten auf die Platte reflektiert, da eine Positionierstufe, die den Inkubator hält, in der XY-Ebene bewegt wird, so dass der Laserstrahl strategisch ausgerichtet ist, um nur einen Brunnen nach dem anderen zu bestrahlen. Validierungsstudien zeigen, dass IC-FPOP in PIXY schneller durchgeführt werden kann als im Strömungssystem und zu erhöhten Aminosäuremodifikationen pro Protein führt. Die Entwicklung dieser neuen IC-FPOP-Plattform wird das Wissen erklären, das aus zellulären Experimenten gewonnen werden kann13.
Protokoll
1. Montage des Plattform-Inkubators mit beweglicher XY-Stufe
HINWEIS: Die neue Plattform umfasst das Inkubationssystem, die Positionierstufe und Dieregler, die peristaltischen Pumpen, den 248 nm KrF Excimer-Laser und die optischen Spiegel, die auf einer optischen Empire-Brotplatte montiert sind.
- Montieren Sie das Inkubationssystem: Temperatureinheit, Kohlendioxideinheit, Luftbefeuchter, Luftpumpe und Touch-Monitoring-System (Abbildung 2A-E).
HINWEIS: Detaillierte Montageanleitungen werden vom Hersteller zur Verfügung gestellt. Das Inkubationssystem muss sich auf 5%CO2, 37 °C und 85% Luftfeuchtigkeit stabilisieren, bevor Zellen im Inkubator wachsen. Diese Parameter können von der Zelllinie abhängen. - Montieren Sie den benutzerdefinierten Sechs-Well-Platten-Inkubator, die Nanopositionierungs-Antriebsstufe und die XY-Antriebsstufe. Erstere schrauben in letztere bzw.
HINWEIS: Detaillierte Montageanleitung des Herstellers. - Schließen Sie die vier peristaltischen Pumpen in einer "Daisy Chain"-Sequenz über RS-232-Kabel mit einem RS-232-USB-Kabel an den Steuernden-Computer an. Schließen Sie 3,18 mm ID-Polymerschläuche (z. B. Tygon) an jeden Kanal jeder Pumpenkanalwalze an.
HINWEIS: Jede Pumpe hat vier Rollen. Richtung und Durchfluss der Walzen werden manuell manipuliert. - Legen Sie 1/16" x 1/8" Steckverbinder am Ende jedes 3,18 mm ID-Polymerrohrs ein. Legen Sie das 1/16'' Ende des Steckverbinders in 1.59 ID Polymerschläuche ein, und legen Sie den Polymerschlauch dann über benutzerdefinierte Anschlüsse in den Inkubator ein. Legen Sie das andere Ende der Röhre in die Lösung, die während des IC-FPOP-Experiments infundiert wird.
HINWEIS: Für die Perfusionsleitungen verfügt der Inkubator über 36 benutzerdefinierte Anschlüsse für Schlauchleitungen rund um die Peripherie, um alle verwendeten Reagenzien aufzunehmen. - Schrauben Sie einen 50 mm, 248 nm, 45° Excimer-Laserlinienspiegel in einer kinematischen Spiegelhalterung für die Optik von 2 000 m in die Steckbrett-Rasterpunkte 10-11 aus der 248 nm Laserblende. Platzieren Sie den zweiten Spiegel in einem 90°-Winkel zum ersten auf der anderen Seite des Inkubators. Winkeln Sie den zweiten Spiegel bei ca. 45° nach unten, um die Laserstrahlführung zum Inkubator zu erhalten (Abbildung 2F-J).
2. Synchronisation und Erstautomatisierung des Systems über Integrationssoftware
- Installieren Sie die neueste Version der Integrationssoftware, die zur Steuerung der Treiber und Pumpen erforderlich ist.
- Unter Bezugnahme auf das Pumpenhandbuch benennen Sie die Pumpen um, beginnend mit "5" und steigender Wert. Die Befehle können über das Unterprogramm Manuelle Steuerung in der Integrationssoftware an das Pumpensystem gesendet werden.
HINWEIS: Wenn Sie eine Pumpe in den Kanalmodus versetzen, wird die Benennungskonvention der Pumpe automatisch in das Set 1, 2, 3 und 4 geändert, was den vier Pumpenkanälen entspricht. - Öffnen Sie das Integrationssoftwareprogramm zur Automatisierung des Plattform-Inkubators.
- Wählen Sie den entsprechenden USB-Comport-Gerätenamen (z.B. COM4) entsprechend dem PUMPENsystem-USB-Kabel aus dem Anschluss-Dropdown-Menü comport für Pumpen.
- Klicken Sie auf die Schaltfläche Script Builder, um ein Skript für die automatisierte Plattform-Inkubatorplattform zu bearbeiten/zu erstellen. Klicken Sie auf Skript speichern, um die Sequenz als Textdatei zu speichern (Abbildung 3A).
HINWEIS: Der Skript-Generator verfügt über eine Benutzeroberfläche zum Definieren des Skripts mit Definitionen von Pumpennummer, Richtung, Rate, Volumen, Rohrdurchmesser, Kanalmodus und zeitgesteuerter Verzögerung. - Wenn der Kanalmodus bei der Erstellung des Skripts gewünscht wird, muss ein Schritt im Skript darauf ausgerichtet sein, die Pumpe in den Kanalmodus ein- und auszuwechseln, und die folgenden Schritte, die den Pumpenkanälen entsprechen, müssen als Pumpen 1-4 gekennzeichnet werden.
HINWEIS: Dadurch wird sichergestellt, dass sich während eines Plattform-Inkubatorskripts keine zwei Pumpen gleichzeitig im Kanalmodus befinden können und dass jede Pumpe wieder in den Legacy-Modus geschaltet wird, nachdem die Befehle an die benötigten Kanäle gesendet wurden. - Klicken Sie auf die Schaltfläche Skript lesen, und wählen Sie die entsprechende Skriptdatei aus, die für den Plattforminkubatorbetrieb gewünscht werden soll.
- Wechseln Sie die Schaltfläche Sequenz ausführen zur ON-Position (grün), um das Skript auszuführen, und klicken Sie dann auf die START-Schaltfläche (Abbildung 3B) .
3. Wachsen Sie Zellen im Plattform-Inkubator
HINWEIS: Zellen müssen am Tag vor dem Experimentieren unter sterilen Bedingungen in einer Zellkulturhaube im Plattform-Inkubator platziert werden.
- Lösen Sie den Plattform-Inkubator von der Nanopositionierungsstufe und trennen Sie die Temperatur-, Gas- und Luftbefeuchterleitungen. Nachdem Sie den Inkubator mit 70% Ethanol besprüht haben, legen Sie ihn in eine Zellkulturhaube.
- Wachsen Sie Zellen in einem T-175 auf etwa 80-90% Konfluenz vor der Übertragung.
HINWEIS: Der Begriff Konfluency wird als Maß für die Anzahl/Abdeckung der Zellen in einer Zellkulturschale oder einem Kolben verwendet. - Entfernen Sie die Medien und spülen Sie sie mit Puffer.
- Trennen Sie Zellen mit trypsin-EDTA mithilfe des Herstellerprotokolls.
- Resuspend ieren in 8 ml Medien und zählen Sie die Zellen.
- Samenfibronectin/Kollagen14 beschichtete Sechs-Brunnen-Platten mit ca. 90-95 l resuspendierten Zellen in jedem Brunnen. Dieses Volumen wird geeignet sein, um 80-90% Konfluenz (ca. 1,2 Millionen Zellen) in jedem Brunnen am nächsten Tag zu erreichen.
HINWEIS: Sechs-Well-Platten müssen vor der Aussaat mit Kollagen beschichtet werden. Die während des IC-FPOP verwendeten Reagenzien werden mit schnellen Durchflussraten infundiert. Beschichtete Platten stellen sicher, dass die Zellen nicht durch die Infusion von Reagenzien vorzeitig abgelöst werden. - Legen Sie die gesäte Platte in den Plattform-Inkubator und decken Sie sie mit dem Quarzdeckel ab.
HINWEIS: Während der Konstruktion und Entwicklung wurde ein Glas-Inkubatordeckel in Quarz geändert, so dass er mit dem ultravioletten Laserlicht kompatibel ist. - Ersetzen und sichern Sie den Plattform-Inkubator wieder auf der Nanopositionier-Antriebsbühne. Schließen Sie die Temperatur-, Gas- und Luftbefeuchterleitungen wieder an.
- Lassen Sie Zellen über Nacht zusammenwachsen.
HINWEIS: Die folgenden Zellkulturschritte sind optional und für Experimente gedacht, bei denen menschliche Zellen vorübergehend transfiziert werden. Diese Schritte bewerten die Transfektionseffizienz unter Zellkulturbedingungen. - Transfekt das Plasmid, das das Gen für das charische Protein GCaMP2 enthält, mit einem kommerziellen kationisch-lipid-Transfektionskit in HEK 293-Zellen.
- Führen Sie transiente Transfektionen von GCaMP2 in HEK293T-Zellen in zwei Sechs-Well-Platten durch.
- Inkubieren Sie eine Sechs-Well-Platte im Plattform-Inkubator und die zweite Sechs-Well-Platte in einem Standard-CO2-Inkubator.
- Vergleichen Sie die Transfektionseffizienz innerhalb jeder Platte durch Fluoreszenz-Bildgebung mit einem Fluoreszenzmikroskop.
4. Machen Sie Quench-Puffer und H2O2
- Machen Sie 100 ml Löschpuffer mit 125 mM N-tert-Butyl-α-Phenylnitron (PBN) und 125 mM N, N-Dimethylthiourea (DMTU).
HINWEIS: DMTU und PBN sind freie Radikalfänger und zelldurchlässig. - H2O2 bis 200 mM verdünnen. Jede Probe benötigt 6 ml H2O2, um die Zellschicht am Boden jedes Brunnens vollständig einzutauchen.
HINWEIS: Der Löschpuffer wird am Vortag hergestellt und über Nacht bei 4 °C gelagert, lichtgeschützt. Verdünnen Sie die H2O2 am Tag des Experiments.
5. Aufbau des Plattform-Inkubators für IC-FPOP
HINWEIS: Der Plattform-Inkubator muss unter sterilen Bedingungen montiert werden. Montieren Sie den Inkubator in einer sterilen Zellkulturhaube.
- Lösen Sie den Plattform-Inkubator von der Positionierstufe und trennen Sie die Temperatur-, Gas- und Luftbefeuchterleitungen.
- Nachdem Sie den Inkubator mit 70% Ethanol besprüht haben, legen Sie ihn in die Zellkulturhaube.
- Entfernen Sie die Sechs-Well-Platte aus dem Plattform-Inkubator, sichern Sie den ursprünglichen Deckel der Platte und bestätigen Sie die Zellkonfluenkation mit einem Mikroskop.
- Nachdem die Zellkonfluenz bestätigt wurde, ersetzen Sie die Sechs-Well-Platte durch konfluente Zellen zurück im Plattform-Inkubator innerhalb der Zellkulturhaube.
- Legen Sie drei vorgeschnittene (15 cm) 1,59 ID-Polymerrohre in jeden Brunnen über die eingebetteten Anschlüsse ein. Spülen Sie die Rohre an die Brunnenwände und halten Sie mit benutzerdefinierten 3D-gedruckten Ringen.
HINWEIS: Sechs 33-mm-PLA-Filament-3D-gedruckte Ringe wurden speziell entwickelt, um die Schläuche an den Wänden der Platte zu befestigen, ohne die Zellen zu stören oder dem Laserpuls in die Quere zu kommen. - Bedecken Sie den Plattform-Inkubator mit seinem Quarzdeckel. Ersetzen und sichern Sie den Bühnen-Top-Inkubator am Positionierungssystem. Schließen Sie die Temperatur-, Gas- und Luftbefeuchterleitungen wieder an.
- 1,59 ID Polymerschläuche an 1/16" Ende der 1/16x1/8" Steckverbinder anschließen.
6. Durchführung von IC-FPOP im Plattform-Inkubator
- Bereiten Sie ein Integrationssoftwareskript für die Pumpenentnahme vor. Verwenden Sie eine Peristaltikpumpe (Pumpe 8), um Zellmedien vollständig aus allen sechs Brunnen zu entfernen.
- Prime Lösungsmittel in jedem Kanal der anderen drei Peristaltikpumpen (Pumpen 5-7). H2O2 einstecken und in ihren jeweiligen Wechselrohren ablöschen, bis die Reagenzien die Inkubatorports erreichen.
- Bestätigen Sie, dass der Laserstrahl von den Spiegeln korrekt abgewinkelt wurde und den Inkubator ungehindert erreicht.
HINWEIS: Laserschutzbrillen müssen bei Gebrauch des Lasers getragen werden. Bestrahlen Sie die Zellen während des Angel-/Ausrichtungsprozesses nicht vorzeitig. Verwenden Sie Karton, um den Quarzdeckel vollständig zu bedecken, wenn Sie den Balken ausrichten. Verwenden Sie auch einen gedruckten Umriss auf weißem Papier einer Sechs-Well-Platte, um weiter zu bestätigen, dass der Laserstrahl die Mitte jedes Brunnens trifft. Verwenden Sie die Einstellung Kontinuierliche Pulseinstellung bei der niedrigsten Frequenz und Energie für die Ausrichtung. - Überprüfen Sie die Laserenergie mit einem externen Sensor. Verwenden Sie einen einzigen Laserpuls von 160 mJ bei 50 Hz und 27 kV.
HINWEIS: Für die folgenden Schritte wird ein Timer benötigt. - Bereiten Sie das Integrationssoftwareskript für die Pumpeninfusion vor, nachdem Sie die Strahlausrichtung bestätigt haben.
- Starten Sie den Timer und drücken Sie gleichzeitig die Starttaste auf dem Skript für die Integrationssoftware-Pumpe.
- 200 mM H2O2 bei 35 mL/min in den ersten Brunnen (6-10 Sekunden AufZeit).
HINWEIS: Es gibt eine Verzögerung von fünf Sekunden, bevor eine Pumpe zu infundieren beginnt. Es dauert auch sieben Sekunden, bis der Puls ausgelöst wird. Der Laserpuls muss unmittelbar nach der Infusion von H2O2 kommen. - Drücken Sie die Starttaste auf der Lasersoftware bei der 5-Sekunden-Markierung, um den Impuls bei der 11-Sekunden-Marke auf dem Timer auszulösen.
- 125 mM Löschlösung bei 35 ml/min in den ersten Brunnen unmittelbar nach dem Laserpuls einfließen lassen. Bewegen Sie die Positionierstufe manuell, um den nächsten Brunnen mit dem Laserstrahl auszurichten.
- Wiederholen Sie die obigen Schritte 6.5-6.9, bis jeder Brunnen verarbeitet wurde.
HINWEIS: IC-POP wird in technischer Auslaktemitliziertvon drei Laser- und drei Nichtlaserproben durchgeführt. Eine verarbeitete Sechs-Brunnen-Platte dient als eine biologische Replik. - In einer Zellkulturhaube, verwenden Sie einen Zellschaber, um die Zellen von jedem Brunnen in einzelne 15 ml konische Röhren zu übertragen. Zentrifugenzellen bei 1.200 x g für 5 Minuten.
- Entsorgen Sie den Überstand und setzen Sie die Zellen in 100 L RIPA-Lysepuffer wieder auf.
- Übertragen Sie Zellen in einzelne 1,2 ml Polypropylen-Rohre.
- Blitz einfrieren alle Proben in flüssigem Stickstoff und legen Sie in einem -80 °C Gefrierschrank bis zum Gebrauch.
HINWEIS: Das Protokoll kann hier angehalten werden.
7. Proteinextraktion, -reinigung und -proteolyse
- Die Proben auftauen und bei 95 °C in einem Wärmeblock 5 Minuten erhitzen.
- Nach dem Erhitzen 5 Minuten auf Eis abkühlen lassen.
- Fügen Sie 25 Einheiten Nuklease in das Zelllysat hinzu, um einsträngige, doppelsträngige, lineare und kreisförmige DNA und RNA zu degradieren und 15 Minuten lang bei raumgemäßem Raum zu brüten.
- Zentrifugenproben bei 16.000 x g für 10 Minuten bei 4 °C.
- Sammeln Sie den Überstand und übertragen Sie ihn in ein sauberes Polypropylenrohr.
- Überprüfen Sie die Proteinkonzentration mit einem kolorimetrischen Proteintest.
- Übertragen Sie 100 g Probe in ein sauberes Polypropylenrohr und bringen Sie mit Zelllysepuffer auf 100 l.
- Proben mit 10 mM Dithiothreitol (DTT) bei 50 °C 45 Minuten reduzieren.
- Proben bei Raumtemperatur 10 Minuten abkühlen.
- Alkylat mit 50 mM Iodoacetamid (IAA) bei Raumtemperatur für 20 Minuten.
HINWEIS: IAA vor Licht schützen - 460 L vorgekühltem Aceton (-20 °C) hinzufügen. Vortex-Proben und legen Sie bei -20 °C über Nacht.
HINWEIS: Das Protokoll kann hier angehalten werden. - Am nächsten Tag Zentrifugenproben bei 16.000 x g für 10 Minuten bei 4 °C.
- Entfernen Sie Aceton, ohne das Proteinpellet zu stören.
- Hinzufügen von 50 l 90% vorgekühltem (-20 °C) Aceton. Wirbelproben zu mischen und Zentrifugieren bei 16.000 x g für weitere 5 Minuten bei 4 °C.
- Aceton entfernen und Proben 2-3 Minuten trocknen lassen.
- Proteinpellet mit 10 mM Tris Puffer pH 8 resuspendieren.
- Ms-Grade-Trypsin (20 g-Bestand) in 40 l von 10 mM Tris-Puffer pH 8 wieder aufsetzen und jeder Probe 2,5 g Trypsin hinzufügen.
- Proben bei 37 °C über Nacht inkubieren.
HINWEIS: Das Protokoll kann hier angehalten werden. - Bewerten Sie die Peptidkonzentration mit einem farbmetrischen Peptid-Assay.
- Die Proben mit 5% Ameisensäure ablöschen.
- Übertragen Sie 10 g Probe in ein sauberes Polypropylenrohr.
- Trocknen Sie die Probe mit einer Vakuumzentrifuge und resuspendieren Sie mit 20 l MS-Gehalt 0,1% Ameisensäure (FA) in Wasser.
- Übertragen Sie jede Probe, um Autosampler-Fläschchen mit vorgeschlitzten Kappen zu reinigen.
8. Hochleistungs-Flüssigkeitschromatographie-Tandem-Massenspektrometrie (LC-MS/MS)
- Um FPOP-Änderungen zu lokalisieren, analysieren Sie das verdaute Zelllysat mithilfe der LC-MS/MS-Analyse.
- Verwenden Sie mobile Phasen von 0,1% FA in Wasser (A) und 0,1% FA in Acetonitril (ACN) (B).
- Die Probe wird auf eine 180 x 20 mm C18-Fangsäule (5 m und 100 ) geladen und 15 Minuten lang mit 99 % (A) und 1 % (B) gewaschen.
- Mit einer analytischen Säule von 75 x 30 cm C18 (5 m und 125 ) werden für 120 Minuten verdauliche Peptide mit einer Durchflussrate von 0,300 l/min elute und getrennt.
- LC-Gradient wie folgt laufen: 0 x 1 min, 3% Lösungsmittel B; 2 x 100 min, 10 x 45% B;100 x 110 min, 45-100% B; 110 bis 115 Min., 100 % B.
- Stellen Sie die Säule bei 3% (B) von 115-116 Minuten wieder her und halten Sie bei 3% (B) von 116-120 Minuten.
- Analysieren Sie eluierte Peptide im positiven Ionenmodus mit Nano-Elektrospray-Ionisierung.
- Erfassen Sie MS1-Spektren über einen m/z-Scanbereich von 375-1500 bei einer Auflösung von 60.000.
- Stellen Sie das Ziel der automatischen Verstärkungssteuerung (AGC) auf 5,0e5 mit einer maximalen Einspritzzeit von 50 ms und einem Intensitätsschwellenwert von 5,0 e4 ein.
- Isolieren Sie Vorläuferionen mit Ladungszuständen 2-6 über datenabhängige Erfassung (DDA) mit einem Isolationsfenster von 1,2 m/z und einer Zykluszeit von 4 Sekunden.
- Untersiere MS2-Ionen hochenergetischer Kollisionsdissoziation (HCD) (32% normalisierte Energie).
- Peptide nach 1 MS/MS-Erfassung für 60 Sekunden ausschließen.
- Stellen Sie die MS/MS-Auflösung auf 15.000 mit einem AGC-Ziel von 5,0e4 und einer maximalen Injektionszeit von 35 ms ein.
9. Proteome-Entdecker/Datenverarbeitung
- Durchsuchen Sie Tandem-Rohdatendateien auf der verfügbaren Bottom-up-Proteomik-Analysesoftware mit einer relevanten Homo sapiens-Proteindatenbank und einem Verdauungsenzym.
- Legen Sie die Suchparameter für die Proteinanalyse fest.
- Legen Sie die Fragmenttoleranz auf 0,02 Da und die übergeordnete Ionentoleranz auf 10 ppm fest.
- Setzen Sie die Enzymspezifität auf Trypsin und lassen Sie eine verpasste Spaltung zu.
- Massenbereich auf 375-1500 m/z einstellen.
- Etablieren Sie das Peptidvertrauen bei 95% (mittel) und das Rückstandsvertrauen bei 99% (hoch).
- Akzeptieren Sie Proteine, wenn mindestens zwei unterschiedliche Peptide mit dem FDR-Filter (5% Discovery Rate) identifiziert werden.
- Setzen Sie die Carbamidomethylierung als statische Modifikation und alle bekannten Hydroxylradikal-Seitenkettenmodifikationen15,16 als dynamische Modifikationen.
- Sobald die Suche, Exportsequenz, Änderungsspeicherorte, Proteinbeitritt, Spektrumdatei, Vorläufer-Fülle und Aufbewahrungszeitinformationen in einer elektronischen Datenbank abgeschlossen sind.
- Berechnen Sie den Grad der Modifikation pro Peptid oder Rückstand aus dieser Gleichung:
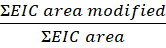
ANMERKUNG: Der EIC-Bereich ist der extrahierte Ionenchromatographiebereich (EIC) des Peptids oder Rückstands mit oxidativer Modifikation, und die EIC-Fläche ist die Gesamtfläche desselben Peptids oder Rückstands mit und ohne oxidative Modifikation. Im Laufe der Zeit wird Protein in Gegenwart von Wasserstoffperoxid oxidieren, was zu Hintergrundoxidationen führt. Um das Ausmaß der Veränderung zu berechnen, wird die Fläche des modifizierten Peptids durch die Gesamtfläche geteilt. Eine nicht bestrahlte Kontrollprobe berücksichtigt die Hintergrundoxidation. Die Hintergrundoxidation aus der Kontrollprobe wird von der laserbehandelten Probe subtrahiert, um eine FPOP-Modifikation zu identifizieren.
Ergebnisse
Um zu bestätigen, dass die Bedingungen des Plattforminkubators für die Zellkultur auf der Laserplattform ausreichen, wurde GCaMP2 vorübergehend in HEK293T transfiziert und die Transfektionseffizienz für beide Platten mittels Fluoreszenzbildgebung bewertet (Abbildung 4A). GCaMP2 ist ein Kalzium-Sensing-Fluoreszenzprotein, das als genetisch codierter intrazellulärer Kalziumindikator verwendet wird. Es ist eine Fusion von grünem fluoreszierendem Protein (GFP) und dem Calcium-bindenden Protein Calmodulin. Ein Luziferase-Assay wurde an HEK 293-Zellen durchgeführt, die mit Plasmid prl-TK transfiziert wurden, um die Transfektionseffizienz zu quantifizieren (Abbildung 4B). Diese Ergebnisse zeigen, dass der Plattform-Inkubator die Leistung des Standard-Inkubators übertraf, mit einer 1,13-fachen Steigerung der Transfektionseffizienz, was einen quantitativen Maßstab für eine optimale Zellkulturumgebung darstellt.
FPOP-Modifikationen in HEK293T-Zellen, die im Strömungssystem gekennzeichnet sind, wurden mit denen verglichen, die im Plattform-Inkubator gekennzeichnet sind, und zeigten, dass der Plattform-Inkubator das Durchflusssystem sowohl in der Anzahl der modifizierten Proteine (Abbildung 5) als auch in der gesamten FPOP-Abdeckung in diesen Proteinen übertrifft. Die Anzahl der fPOP modifizierten Proteine, die im Plattform-Inkubator erworben wurden, betrug etwa 1051, 2,2-mal mehr als in einem typischen Experiment. Die Modifikationen wurden zwischen zwei biologischen Repliken für jedes Experiment kombiniert. Darüber hinaus bietet PIXY einen höheren Durchsatz.
Um den Vorteil einer höheren Modifikationsabdeckung über ein Protein zu demonstrieren, wurden IC-FPOP-Modifikationen auf peptidebene lokalisiert und das Ausmaß der Modifikation quantifiziert, um Unterschiede in den Ergebnissen zwischen den Systemen für Actin, einem 375-Aminosäureprotein, zu unterscheiden. Im Strömungssystem wurden zwei modifizierte Peptide nachgewiesen, die nur begrenzte strukturelle Informationen liefern (Abbildung 6A). Im Plattform-Inkubator wurden jedoch fünf modifizierte Peptide nachgewiesen, die die Aktinsequenz überspannten. Tandem-Massenspektren zeigen an, dass Der Rückstand Pro322 in jedem Experiment modifiziert und nachgewiesen wurde (Abbildung 6B). Die fünf in den Plattform-Inkubatorproben modifizierten Peptide enthielten zwölf modifizierte Rückstände, während mit dem Strömungssystem nur vier Rückstände modifiziert wurden(Abbildung 6C). Die Erhöhung der Oxidationsabdeckung liefert mehr strukturelle Informationen über das Protein.
Espino et al. demonstrierten die Fähigkeit von FPOP in vivo (IV-FPOP) innerhalb von C. elegansdurchgeführt werden, ein Wurmmodell für menschliche Krankheitszustände17. Während IV-FPOP auch über ein Durchflusssystem durchgeführt wird, wurde das PIXY-System auf Kompatibilität mit den Würmern getestet. Etwa 10.000 Würmer wurden in jedem Brunnen im Plattform-Inkubator bei 20 °C inkubiert. Die LC-MS/MS-Analyse ergab, dass 792 Proteine durch IV-FPOP im Plattform-Inkubator modifiziert wurden, verglichen mit den 545 Proteinen, die mit dem Strömungssystem modifiziert wurden (Abbildung 7). Diese Ergebnisse zeigen, dass diese neue Methodik neben der 2D-Zellkultur auch mit der Untersuchung anderer biologischer Systeme wie C. eleganskompatibel ist.
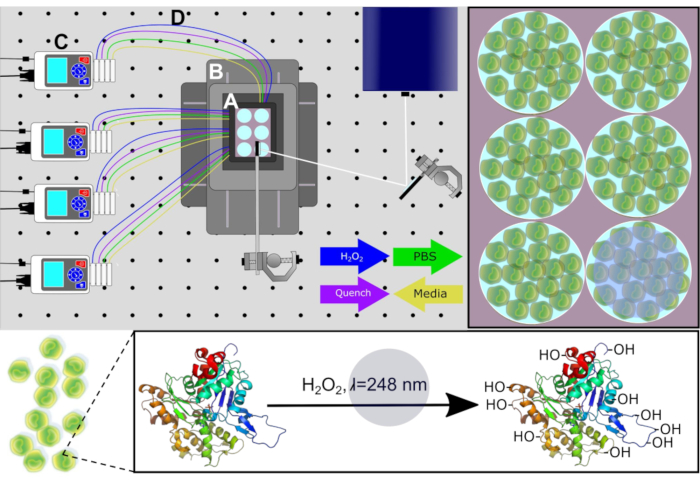
Abbildung 1. Schematic von PIXY System. Systemkomponenten: (A) Stage-Top-Inkubator, (B) Positionierungssystem , (C) Peristaltikpumpen und (D) Perfusionsleitungen. Zellkulturmedien werden aus jedem Brunnen über Pumpen entfernt, bevor H2O2 und Löschlösungen zu berechneten Zeitpunkten infundiert werden. Laserpfad für bestrahlung in weiß präsentiert. Nachdruck mit Genehmigung von Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytische Chemie, 92(2), 1691-1696 2019. Copyright 2020 American Chemical Society. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2. Vollständig montiertes PIXY-System. (A) Touch-Überwachungssystem, (B) Kohlendioxid-Einheit, (C) Temperatureinheit, (D) Luftpumpe, (E) Luftbefeuchter, (F) optische Spiegel, (G) Plattform-Inkubator, (H) Positionierungsstufe, (I) 248nm KrF Excimer-Laser und (J) peristaltische Pumpen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
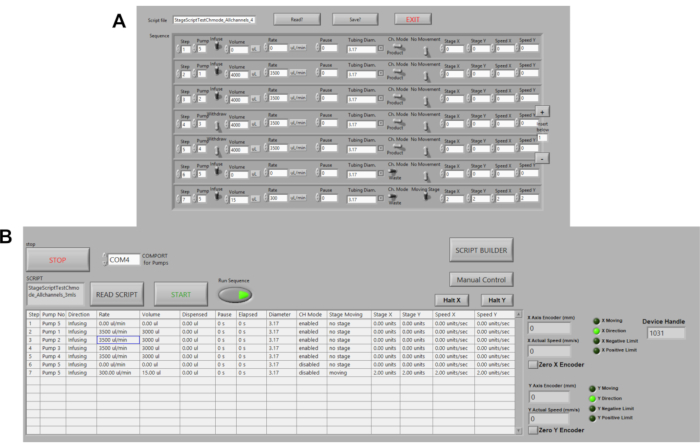
Abbildung 3. Automatisierung von Peristaltic Pumps. (A) Beispielbefehlsskript in LABVIEW. Zu den Befehlsoptionen gehören Volumen, Durchflussrate, Pausen, Strömungsrichtung. Geschwindigkeit, Etappenabstand und Standort werden derzeit automatisiert. (B) Skriptleser in LABVIEW. Hier werden Befehlsskripte hochgeladen, dann Run Sequence und START gedrückt, um Pumpen zu initiieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
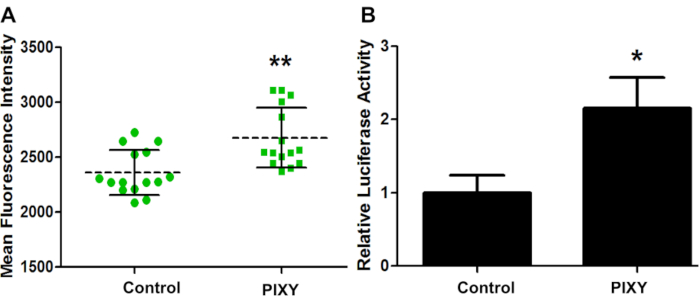
Abbildung 4. HEK-Zelltransfektionseffizienz. (A) Mittlere fluoreszierende Intensität des GCaMP2-Transfektionsvergleichs zwischen Standard-Inkubator (Control) und Stage-Top-Inkubator (PIXY). Punkte und Quadrate stellen jeden Punkt in einem Brunnen dar, in dem eine Maßnahme getroffen wurde. (B) Transfektionseffizienz quantitiert und validiert mit einem anderen Vektorplasmid, pRL-TK. P-Wert< 0,005. Nachdruck mit Genehmigung von Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytische Chemie, 92(2), 1691-1696 2019. Copyright 2020 American Chemical Society. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
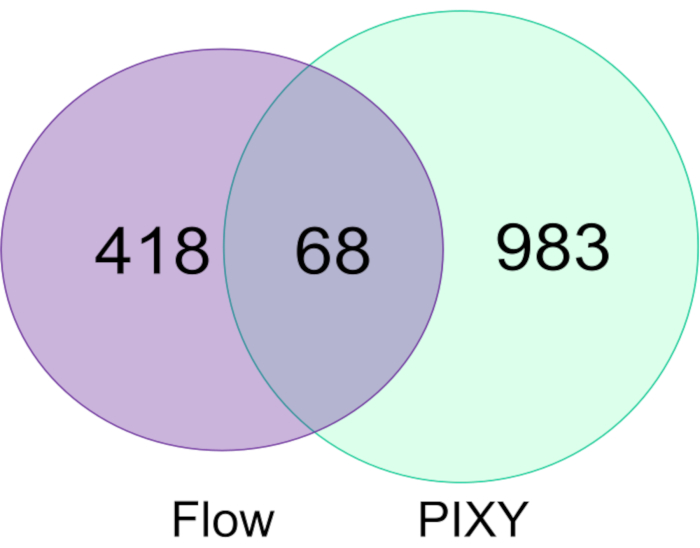
Abbildung 5. Vergleich von Proteinen, die im Einzelzell-Durchflusssystem modifiziert wurden, und PIXY. Venn-Diagramm von Proteinen, die mit Hilfe des Strömungssystems (lila) und in PIXY (grün) modifiziert wurden. Nachdruck mit Genehmigung von Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytische Chemie, 92(2), 1691-1696 2019. Copyright 2020 American Chemical Society. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
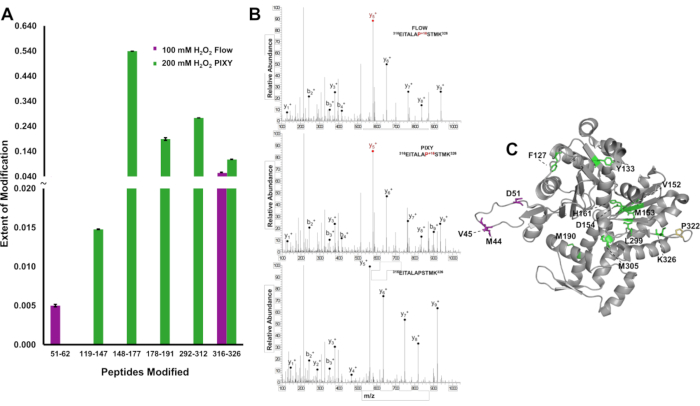
Abbildung 6. Lokalisierung von IC-FPOP-Modifikationen. Vergleich von IC-FPOP-Modifikationen zwischen Systemen. (A) Balkendiagramm oxidativ modifizierter Peptide innerhalb von Actin aus dem Strömungssystem (lila) vs. Plattform-Inkubator (grün). (B) Tandem-MS-Spektren von Actin (Peptid 316-326) mit modifiziertem Proline in beiden Systemen und unverändertem Aktinpeptid (C) FPOP modifizierte Aktinrückstände (PDB: 6ZXJ, Kette A 11 modifizierte Rückstände im Plattform-Inkubator (grün), 3 modifizierte Rückstände im Strömungssystem (lila), 1 überlappende modifizierte Rückstände (gelb). Nachdruck mit Genehmigung von Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytische Chemie, 92(2), 1691-1696 2019. Copyright 2020 American Chemical Society. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
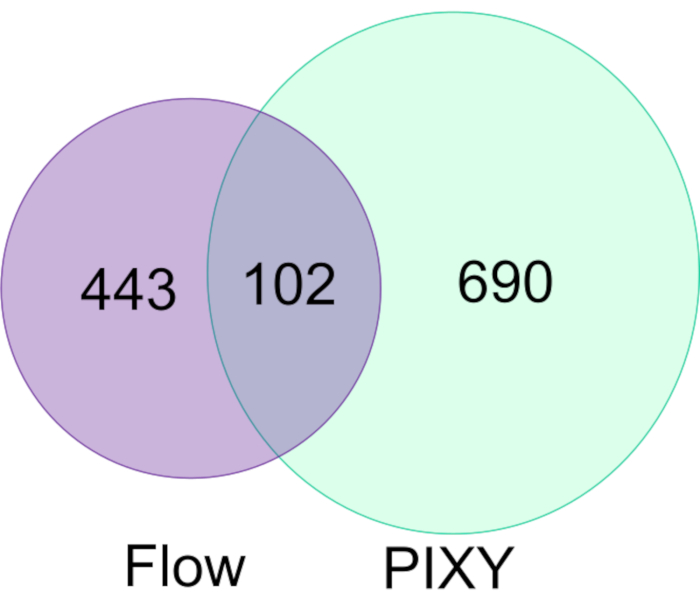
Abbildung 7. Vergleich von FPOP-modifizierten Proteinen in C. elegans nach Flow vs. PIXY. Es gibt eine 1,5-fache Zunahme von oxidativ modifizierten Proteinen mit PIXY im Vergleich zum Strömungssystem. Nachdruck mit Genehmigung von Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytische Chemie, 92(2), 1691-1696 2019. Copyright 2020 American Chemical Society. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1. Workflow-Änderungsverteilung und Massenverschiebungen (Da). Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Proteine leisten einen Großteil der Arbeit in lebenden Zellen. Angesichts dieser Bedeutung sind detaillierte Daten über die Proteinfunktion und die Struktur höherer Ordnung (HOS) in der zellulären Umgebung erforderlich, um das Verständnis der Feinheiten in größeren Komplexen und enzymatischen Reaktionen in Zellen im Gegensatz zu gereinigten Systemen zu vertiefen. Dazu wurde eine Hydroxylradikal-Protein-Fußdruck-Methode (HRFP) mit dem Titel In-Cell Fast Photochemical Oxidation of Proteins (IC-FPOP) eingeführt. Die meisten FPOP-Studien wurden in vitro in relativ reinen Proteinsystemen durchgeführt, was deutlich im Gegensatz zur überfüllten molekularen Umgebung steht, die Bindungswechselwirkungen und Proteinkonformationsdynamik beeinflusst. Infolgedessen gibt es eine Kluft zwischen den Ergebnissen aus In-vitro-Experimenten 18 und denen, die in einer tatsächlichen zellulären Umgebung erhalten würden. Um die Lücke zwischen den idealisierten Bedingungen eines In-vitro-FPOP-Experiments und der Komplexen Natur der Zelle zu überbrücken, wurde eine neue automatisierte Sechs-Well-Platten-basierte in Zell-FPOP-Plattform entwickelt. Diese neuartige FPOP-Technologie ist in der Lage, diese molekularen Arten zu identifizieren und zu charakterisieren und ihre dynamischen molekularen Wechselwirkungen sowohl in gesunden als auch in kranken Zuständen nachzuverfolgen. Diese neue Plattform heißt Platform Incubator mit Movable XY Stage (PIXY).
FPOP wurde erfolgreich eingesetzt, um die strukturellen Informationen innerhalb des Proteoms zu charakterisieren. Jede biologische Technik hat jedoch gewisse Einschränkungen, die weiter verbessert werden müssen. Bei der Laserphotolyse sind spezifische Reagenzien erforderlich und unreagierte Hydroxylradikale effizient abzulöschen. Die Trennung von verdauten Peptiden kann viel Zeit erfordern, um strukturelle Informationen zu maximieren. Diese Fülle an Informationen kann auch eine umfassende Quantifizierung während der Post-MS-Datenanalyseerfordern 1. Der Plattform-Inkubator, einschließlich der peripheren Maschinen, die für die Zellkultur und IC-FPOP auf der Laserplattform benötigt werden, hat hohe Kosten, die für einige Labore möglicherweise nicht machbar sind. Da die Fortschritte weiter voranschreiten, sollten robuste Software und Analysetools die Technik weiter voranbringen; davon in dieser Studie vorgestellt. Aktuelle Studien in diesem Plattform-Inkubator wurden an HEK293T-Zellen und in C. elegansdurchgeführt. Die IC-FPOP-Methode ist nachweislich mit einer Vielzahl von Zelllinien kompatibel, einschließlich chinesischer Hamster-Ovarial (CHO), Vero, MCF-7 und MCF10-A-Zellen19. Da die allgemeine IC-FPOP-Methode auf diese statische Plattform übersetzbar ist, sollten diese Zelllinien auch für Studien mit PIXY zugänglich sein.
IC-FPOP nutzt H2O2, um lösungsmittelfreie Seitenketten von Aminosäuren oxidativ zu modifizieren, um dann Proteinwechselwirkungen, Struktur und metabolische Effekte innerhalb lebensfähiger Zellen weiter zu erkennen, was für die Bereitstellung biologischer Kontexte von Bedeutung ist. Vor einem IC-FPOP-Experiment muss bestätigt werden, dass die Zellen nach H2O2-Zugabe lebensfähig sind. Zelllebensfähigkeitsstudien zeigten, dass die Zellen in Gegenwart vonH2O2-Konzentrationen bis zu 200 mM 13lebensfähig waren. Es ist auch wichtig sicherzustellen, dassH2O2 in einer Endkonzentration von 200 mM direkt auf Zellen infundiert wird, nachdem Medien entfernt wurden. Wenn Zellkulturmedien nicht vollständig entfernt werden, werden unterschiedliche Konzentrationen vonH2O2verursacht. Im Vergleich zu Standardbedingungen führte die Erhöhung der Inkubationszeit auf 10 Sekunden zusammen mit der Erhöhung der H2O2-Konzentration zu einer höheren Anzahl von Proteinen, die durch IC-FPOP im Plattform-Inkubator modifiziert wurden. Es ist zwingend erforderlich, peristaltische Pumpen vor dem Einsatz zu grundieren, um sicherzustellen, dass pumpen ordnungsgemäß funktioniert und Flüssigkeit verteilt wird. Andernfalls können Luftblasen in den Schläuchen, ein unzureichendes Volumen von H2O2 zum Eintauchen von Zellen und/oder ein unzureichendes Volumen der Abschrecklösung entstehen.
Ein weiteres Problem, das auftreten kann, sind unerwünschte Verzögerungen im System. Ein Beispiel hierfür ist der Prozess der Überprüfung empfangener Befehle für die Pumpensysteme, was mit der Integrationssoftware zu erheblichen Verzögerungen in der Größenordnung von 1000 oder mehr Millisekunden führt. Dieses Problem kann behoben werden, indem die Kommunikation mit den Pumpen während des Experiments minimiert wird und voreingestellte Befehle so weit wie möglich im Voraus verwendet werden.
Ziel von PIXY ist es, in Zukunft ein vollautomatisiertes und integriertes System zu produzieren. Neben den peristaltischen Pumpen wird auch die Auslösung des Laserpulses automatisiert. Ein neues Positionierungssystem wird auch für die schnelle Bewegung des Plattform-Inkubators verwendet werden, um Geschwindigkeit und Genauigkeit zu erhöhen. Alle Komponenten des Systems werden weiterhin mit der Integrationssoftware programmiert, um den Durchsatz weiter zu erhöhen.
Offenlegungen
Die Autoren erklären keine konkurrierenden finanziellen Interessen.
Die hierin vorgestellten Forschungsarbeiten sind mit der nachfolgend referenzierten Patentanmeldung verbunden:
Nummer der nicht vorläufigen Patentanmeldung in den USA: 17/042,565
Titel: "Gerät und Methode zur Bestimmung der Proteinfaltung"
UMB Docket Nummer: LJ-2018-104 UMass Ref: UMA 18-059.
Danksagungen
Diese Arbeit wurde durch einen Zuschuss des NIH R01 GM128983-01 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Ismatec Reglo ICC Peristaltic Pumps | Cole-Palmer | 122270050 | |
| Kinematic Mirror Mount for Ø2" Optics | Thor Labs | ||
| 10X trypsin−EDTA | Corning | AB00490-00005 | |
| 50.0mm 248nm 45°, Excimer Laser Line Mirror | Edmond Optics | ||
| Acetone, HPLC Grade | Fisher Scientific | ||
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | ||
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 23275 | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| ACQUITY UPLC M-Class System | Waters | A53225 | |
| Afinia H480 3D Printer | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| air pump | OKOlabs | D12345 | |
| Aluminum Foil | Fisher Scientific | Stock #63-120 | |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | ||
| carbon dioxide unit | OKOlabs | MadMotor®-UHV | |
| Centrifuge | Eppendorf | ||
| connectors (Y PP 1/16” and 1/16x1/8”) | Cole-Palmer | 116891000 | |
| Delicate Task Wipers | Fisher Scientific | 022625501 | |
| Dithiothreiotol (DTT) | AmericanBio | ||
| DMSO, Anhydrous | Invitrogen | LS118-500 | |
| Dulbecco’s phosphate-buffered saline (DPBS) | Corning | SK-78001-82 | |
| EX350 excimer laser | GAM Laser | PI89900 | |
| Fetal bovine serum (FBS) | Corning | SK-12023-78 | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| HEK293T cells | Paul Shapiro Lab (University of Maryland Baltimore) | ||
| humidifier | OKOlabs | Nano-LPMW stage | |
| HV3-2 VALVE | Hamilton | BP152-500 | |
| Hydrogen Peroxide | Fisher Scientific | LS120-500 | |
| Iodoacetamide (IAA) | ACROS Organics | ||
| LABVIEW Professional 2018 | National Instruments | 86728 | |
| MadMotor Positioning system and controllers | Mad City Labs | W6-4 | |
| Methanol, LC/MS Grade | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Microcentrifuge | Thermo Scientific | H301-T Unit-BL-PLUS | |
| N,N′-Dimethylthiourea (DMTU) | ACROS Organics | ||
| Nanopositioinging stage | Mad City Labs | ||
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | ||
| OKO Touch Monitoring System | OKOlabs | ||
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | 7Z02936 | |
| PE50-C pyroelectric energy meter | Ophir Optronics | ||
| Penicillin-streptomycin | Corning | ||
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | ||
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | ||
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 75002436 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 06-666A | |
| pressure gauge | OKOlabs | OKO-AIR-PUMP-BL | |
| PTFE filter | OKOlabs | CO2-UNIT-BL | |
| Six 33 mm PLA filament rings | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| sterile incubator | OKOlabs | ||
| temperature unit | OKOlabs | OKO-TOUCH | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | A117-50 | |
| TiNKERcad | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| Tris Base | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| tubing (Tygon 3.18 and 1.59 ID) | Cole-Palmer | 177350250 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Water, LC/MS Grade | Fisher Scientific | 88702 | |
| 90058 | |||
| KM200 | |||
| 186007496 |
Referenzen
- Johnson, D. T., Di Stefano, L. H., Jones, L. M. Fast photochemical oxidation of proteins (FPOP): A powerful mass spectrometry based structural proteomics tool. Journal of Biological Chemistry. 294 (32), 11969-11979 (2019).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemical Reviews. 120 (10), 4355-4454 (2019).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-883 (2019).
- Zhao, B., et al. Covalent Labeling with an α,β-Unsaturated Carbonyl Scaffold for Studying Protein Structure and Interactions by Mass Spectrometry. Analytical Chemistry. 92 (9), 6637-6644 (2020).
- Hambly, D. M., Gross, M. L. Laser Flash Photolysis of Hydrogen Peroxide to Oxidize Protein Solvent-Accessible Residues on the Microsecond Timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Li, K. S., Shi, L., Gross, M. L. Mass Spectrometry-Based Fast Photochemical Oxidation of Proteins (FPOP) for Higher Order Structure Characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Chea, E. E., Jones, L. M. Modifications generated by fast photochemical oxidation of proteins reflect the native conformations of proteins. Protein Science. 27 (6), 1047-1056 (2018).
- Hambly, D., Gross, M. Laser flash photochemical oxidation to locate heme binding and conformational changes in myoglobin. International Journal of Mass Spectrometry. 259 (1), 124-129 (2007).
- Yan, Y. Fast photochemical oxidation of proteins (FPOP) maps the epitope of EGFR binding to adnectin. Journal of the American Society for Mass Spectrometry. 25 (12), 2084-2092 (2014).
- Zhang, Y., Wecksler, A. T., Molina, P., Deperalta, G., Gross, M. L. Mapping the Binding Interface of VEGF and a Monoclonal Antibody Fab-1 Fragment with Fast Photochemical Oxidation of Proteins (FPOP) and Mass Spectrometry. Journal of the American Society for Mass Spectrometry. 28 (5), 850-858 (2017).
- Espino, J. A., Mali, V. S., Jones, L. M. In Cell Footprinting Coupled with Mass Spectrometry for the Structural Analysis of Proteins in Live Cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L. M. Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytical Chemistry. 92 (2), 1691-1696 (2019).
- Bangel-Ruland, N., et al. Cystic fibrosis transmembrane conductance regulator-mRNA delivery: a novel alternative for cystic fibrosis gene therapy. The Journal of Gene Medicine. 15 (11-12), 414-426 (2013).
- Gau, B. C., Chen, H., Zhang, Y., Gross, M. L. Sulfate Radical Anion as a New Reagent for Fast Photochemical Oxidation of Proteins. Analytical Chemistry. 82 (18), 7821-7827 (2010).
- Xu, G. C., et al. Hydroxyl Radical-Mediated Modification of Proteins as Probes for StructuralProteomics. Chemical Reviews. American Chemical Society. 107 (8), 3514-3543 (2007).
- Espino, J. A., Jones, L. M. Illuminating Biological Interactions with In Vivo Protein Footprinting. Analytical Chemistry. 9 (10), 6577-6584 (2019).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast Photochemical Oxidation of Protein Footprints Faster than Protein Unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Kaur, U., Johnson, D. T., Jones, L. M. Validation of the Applicability of In-Cell Fast Photochemical Oxidation of Proteins across Multiple Eukaryotic Cell Lines. Journal of the American Society for Mass Spectrometry. 31 (7), 1372-1379 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten