Method Article
Incubatore di piattaforme con stadio XY mobile: una nuova piattaforma per l'implementazione dell'ossidazione fotochimica veloce in cella delle proteine
In questo articolo
Riepilogo
Una nuova piattaforma statica viene utilizzata per caratterizzare la struttura proteica e i siti di interazione nell'ambiente delle cellule native utilizzando una tecnica di impronta proteica chiamata ossidazione fotochimica veloce in cella delle proteine (IC-FPOP).
Abstract
L'ossidazione fotochimica veloce delle proteine (FPOP) accoppiata con la spettrometria di massa (SM) è diventata uno strumento inestimabile nella proteomica strutturale per interrogare le interazioni proteiche, la struttura e la dinamica conformazionale delle proteine in funzione dell'accessibilità dei solventi. Negli ultimi anni, l'ambito della FPOP, una tecnica di stampa del piede proteico radicale idrossile (HRPF), è stato ampliato all'etichettatura proteica nelle colture di cellule vive, fornendo i mezzi per studiare le interazioni proteiche nell'ambiente cellulare contorto. Le modifiche delle proteine in cellule possono fornire informazioni sui cambiamenti strutturali indotti dal ligando o sui cambiamenti conformazionali che accompagnano la formazione di complessi proteici, il tutto all'interno del contesto cellulare. L'impronta proteica è stata realizzata utilizzando un consueto sistema basato sul flusso e un laser ad eccimeri KrF da 248 nm per produrre radicali idrossili tramite fotolisi del perossido di idrogeno, richiedendo 20 minuti di analisi per un campione di cellule. Per facilitare esperimenti FPOP risolti nel tempo, è stato introdotto l'uso di una nuova piattaforma IC-FPOP basata su piastre a 6 pozzi. Nel sistema attuale, un singolo impulso laser irradia un intero pozzo, che tronca il periodo di tempo sperimentale FPOP con conseguente 20 secondi di tempo di analisi, una diminuzione di 60 volte. Questo tempo di analisi notevolmente ridotto consente di ricercare meccanismi cellulari come cascate di segnalazione biochimica, piegatura delle proteine ed esperimenti differenziali (cioè senza farmaci vs legati al farmaco) in modo dipendente dal tempo. Questa nuova strumentazione, intitolata Platform Incubator with Movable XY Stage (PIXY), consente all'utente di eseguire la coltura cellulare e IC-FPOP direttamente sul banco ottico utilizzando un incubatore di piattaforme con controllo della temperatura, della CO2 e dell'umidità. La piattaforma include anche uno stadio di posizionamento, pompe peristaltiche e ottiche a specchio per la guida del raggio laser. Le condizioni IC-FPOP come la configurazione ottica, le portate, le transettorità transitori e la concentrazione di H2O2 in PIXY sono state ottimizzate e riviste tra pari. L'automazione di tutti i componenti del sistema ridurrà la manipolazione umana e aumenterà la velocità effettiva.
Introduzione
Le tecniche di impronta proteica possono rivelare informazioni profonde sull'organizzazione delle proteine. Queste tecniche essenziali basate sulla biologia strutturale ms sono una componente della cassetta degli attrezzi di spettrometria di massa. Questi metodi sondano la struttura di ordine superiore delle proteine (HOS) e la sinergia tramite l'etichettaturacovalente 1,2,3,4. L'ossidazione fotochimica rapida delle proteine (FPOP) impiega radicali idrossilici per modificare ossidativamente le catene laterali accessibili ai solventi degli amminoacidi5,6 (tabella 1). Il metodo utilizza un laser ad eccimeri a 248 nm per la fotolisi del perossido di idrogeno (H2O2) per generare radicali idrossilici. Teoricamente, 19 dei 20 amminoacidi possono essere modificati ossidativamente con Gly come unica eccezione. Tuttavia, a causa dei vari tassi di reattività degli amminoacidi con radicali idrossilici, la modifica di un solo sottoinsieme di questi è stata osservata sperimentalmente. Tuttavia, il metodo ha il potenziale di analisi sulla lunghezza di una sequenza proteica5. FPOP modifica le proteine sulla scala cronologica dei microsecondi, rendendola utile nello studio delle interazioni deboli con tassi di spegnimento rapidi. L'accessibilità del solvente cambia sul legame del ligando o su un cambiamento nella conformazione proteica, quindi, la potenza del metodo sta nel confronto del modello di etichettatura di una proteina in più stati (cioè senza ligandi rispetto al legante ligando). Di conseguenza, FPOP è riuscito a identificare siti di interazione proteina-proteina e proteina-ligando e regioni di cambiamento conformazionale7,8,9,10. Il metodo FPOP è stato esteso dallo studio dei sistemi proteici purificati all'analisi in cella. L'FPOP in-cell (IC-FPOP) può modificare ossidativamente oltre mille proteine nelle cellule per fornire informazioni strutturali attraverso il proteoma11,12. La piattaforma IC-FPOP convenzionale utilizza un sistema di flusso per scorrere le celle a singolo file oltre il raggio laser. Lo sviluppo di questo sistema ha permesso alle singole cellule di avere la stessa esposizione all'irradiazione laser. Ciò ha portato a un aumento di 13 volte del numero di proteine etichettate ossidativamente12. Tuttavia, una limitazione del sistema di flusso è la lunghezza di un singolo esperimento campione costituito da un intervallo di irradiazione di 10 minuti durante il quale avviene la modifica e da un ciclo di lavaggio aggiuntivo di 10 minuti. I vincoli di tempo dell'IC-FPOP lo rendono inadatto allo studio di intermedi di piegatura delle proteine di breve durata o cambiamenti che esistono tra le reti di interazione nelle cascate di segnalazione biochimica. Questa limitazione temporale ha ispirato il design di una nuova piattaforma IC-FPOP dotata di una maggiore produttività.
Per misurare con precisione la struttura di ordine superiore delle proteine nell'ambiente delle cellule native, il nuovo design consente di realizzare la coltura cellulare direttamente sulla piattaforma laser, il che consente all'IC-FPOP di essere ad alta produttività. Questa configurazione consente anche perturbazioni ridotte al minimo nell'ambiente cellulare, a differenza dell'IC-FPOP utilizzando il flusso in cui le cellule aderenti devono essere rimosse dal substrato. La nuova piattaforma consente a IC-FPOP di verificarsi in un sistema di incubazione sterile utilizzando una camera superiore a CO 2 e a temperatura controllatamentre si utilizzano ottiche a specchio configurate per la guida del raggio laser, un sistema di posizionamento per il movimento XY e pompe peristaltiche per lo scambio chimico. La nuova piattaforma per la conduzione di IC-FPOP si intitola Platform Incubator with Movable XY Stage (PIXY) (Figura 1). In PIXY, IC-FPOP viene effettuato su cellule umane coltivate in piastre a sei po porti all'interno della camera dell'incubatore della piattaforma. Per questa configurazione, il raggio laser viene riflesso verso il basso sulla piastra utilizzando specchi compatibili con il fascio come uno stadio di posizionamento che tiene l'incubatore viene spostato, nel piano XY, quindi il raggio laser è strategicamente allineato per irradiare solo un pozzo alla volta. Studi di convalida mostrano che IC-FPOP può essere eseguito più velocemente in PIXY che nel sistema di flusso e porta ad un aumento delle modifiche degli amminoacidi per proteina. Lo sviluppo di questa nuova piattaforma IC-FPOP esporrà le conoscenze che possono essere acquisite dagli esperimenti cellulari13.
Protocollo
1. Assemblaggio di incubatore di piattaforme con stadio XY mobile
NOTA: La nuova piattaforma comprende il sistema di incubazione, lo stadio di posizionamento e i controller, le pompe peristaltiche, il laser ad eccimeri KrF da 248 nm e gli specchi ottici assemblati su una breadboard ottica imperiale.
- Assemblare il sistema di incubazione: l'unità di temperatura, l'unità di anidride carbonica, l'umidificatore, la pompa dell'aria e il sistema di monitoraggio del tocco(Figura 2A-E).
NOTA: Istruzioni dettagliate di montaggio sono fornite dal produttore. Il sistema di incubazione deve stabilizzarsi al 5% di CO2,37 °C e all'85% di umidità prima di coltivare le cellule all'interno dell'incubatore. Questi parametri possono dipendere dalla linea cellulare. - Assemblare l'incubatore di piastre personalizzato a sei pozzi, lo stadio di azionamento del nanoposizionamento e lo stadio di azionamento XY. Il primo si avvita nel secondo, rispettivamente.
NOTA: Istruzioni dettagliate di montaggio fornite dal produttore. - Collegare le quattro pompe peristaltiche in una sequenza di "catena a margherita" tramite cavi RS-232, con un cavo RS-232-USB collegato al computer di controllo. Collegare tubi polimerici ID da 3,18 mm (ad esempio Tygon) a ogni canale su ogni rullo del canale della pompa.
NOTA: Ogni pompa ha quattro rulli. La direzione e la portata dei rulli vengono manipolate manualmente. - Inserire connettori da 1/16" x 1/8" alla fine di ogni tubo polimerico ID da 3,18 mm. Inserire l'estremità 1/16'' del connettore in tubi polimerici da 1,59 ID, quindi inserire il tubo polimerico nell'incubatore tramite porte personalizzate. Posizionare l'altra estremità del tubo nella soluzione che verrà infusa durante la sperimentazione IC-FPOP.
NOTA: Per le linee di perfusione, l'incubatore dispone di 36 porte personalizzate per linee di tubi in tutta la periferia per ospitare tutti i reagenti utilizzati. - Avvitare uno specchio a linea laser a 50 mm, 248 nm, 45° all'interno di un supporto cinematico a specchio per ottica Ø2" nella breadboard 10-11 punti griglia dall'apertura laser a 248 nm. Posizionare il secondo specchio con un angolo di 90° sul primo sull'altro lato dell'incubatore. Inclinare il secondo specchio verso il basso a circa 45° per la guida del raggio laser verso l'incubatore(Figura 2F-J).
2. Sincronizzazione e automazione iniziale del sistema tramite software di integrazione
- Installare l'ultima versione del software di integrazione necessario per controllare i driver e le pompe.
- Facendo riferimento al manuale della pompa, rinominare le pompe a partire da '5' e aumentando di valore. I comandi possono essere inviati al sistema di pompaggio utilizzando il sottoprogramma Controllo manuale nel software di integrazione.
NOTA: l'impostazione di una pompa in modalità canale cambia automaticamente la convenzione di denominazione della pompa nel set, 1, 2, 3 e 4, corrispondente ai quattro canali della pompa. - Aprire il programma software di integrazione per l'automazione dell'incubatore di piattaforme.
- Scegliere il nome del dispositivo comport USB appropriato (ad esempio COM4) corrispondente al cavo USB del sistema di pompaggio dal menu a discesa di connessione etichettato Comport per le pompe.
- Fare clic sul pulsante Generatore di script per modificare/creare uno script per la piattaforma di incubatore di piattaforme automatizzata. Fare clic su Salva script per salvare la sequenza come file di testo ( Figura3A).
NOTA: il generatore di script dispone di un'interfaccia utente per definire lo script con definizioni di numero di pompaggio, direzione, velocità, volume, diametro del tubo, modalità canale e ritardo tempo. - Se si desidera la modalità canale nella realizzazione dello script, è necessario che un passaggio dello script sia dedicato alla modifica della pompa in modalità in uscita e fuori canale e che i seguenti passaggi corrispondenti ai canali della pompa debbano essere etichettati come pompe 1-4.
NOTA: ciò garantisce che nessuna due pompe possano essere simultaneamente in modalità canale durante uno script dell'incubatore di piattaforme e che ogni pompa venga riviviata alla modalità legacy dopo che i comandi sono stati inviati ai canali necessari. - Fare clic sul pulsante Leggi script e scegliere il file di script appropriato desiderato per l'operazione dell'incubatore di piattaforme.
- Passare al pulsante Esegui sequenza nella posizione ON (verde) per eseguire lo script, quindi fare clic sul pulsante START (Figura 3B) .
3. Far crescere le cellule nell'incubatore di piattaforme
NOTA: Le cellule devono essere collocate nell'incubatore della piattaforma in condizioni sterili in una cappa di coltura cellulare il giorno prima della sperimentazione.
- Svitare l'incubatore di piattaforme dalla fase di nanoposizionamento e scollegare le linee di temperatura, gas e umidificatore. Dopo aver spruzzato l'incubatore con il 70% di etanolo, posizionarlo in un cappuccio di coltura cellulare.
- Far crescere le cellule in un T-175 fino a circa l'80-90% di confluenza prima del trasferimento.
NOTA: Il termine confluenza è usato come misura del numero/copertura delle cellule in un piatto di coltura cellulare o in un pallone. - Rimuovere i supporti e risciacquare con tampone.
- Scollegare le celle utilizzando trypsin-EDTA utilizzando il protocollo del produttore.
- Resopendi in 8 mL di supporto e conta le celle.
- Fibronectina/collagenedi semi 14 piastre rivestite a sei pozzole con circa 90-95 μL di cellule rimorsipate in ogni pozzo. Questo volume sarà appropriato per raggiungere l'80-90% di confluenza (~ 1,2 milioni di cellule) in ogni pozzo il giorno successivo.
NOTA: Le piastre a sei pozzi devono essere rivestite con collagene prima della semina. I reagenti utilizzati durante IC-FPOP sono infusi con portate veloci. Le piastre rivestite assicurano che le cellule non siano staccate prematuramente a causa dell'infusione di reagenti. - Posizionare la piastra seminata nell'incubatore della piattaforma e coprire con il coperchio al quarzo.
NOTA: Durante la progettazione e lo sviluppo, un coperchio dell'incubatore di vetro è stato cambiato in quarzo, quindi è compatibile con la luce laser ultravioletta. - Sostituire e fissare l'incubatore della piattaforma sullo stadio di azionamento del nanoposizionamento. Ricollegare le linee di temperatura, gas e umidificatore.
- Lascia che le cellule crescano fino alla confluenza durante la notte.
NOTA: I seguenti passaggi di coltura cellulare sono facoltativi e sono destinati a esperimenti in cui le cellule umane sono traslitta transitoriamente. Questi passaggi valutano l'efficienza della trasfezione in condizioni di coltura cellulare. - Trasfezionare il plasmide contenente il gene per la proteina chimerica GCaMP2 in cellule HEK 293 utilizzando un kit di trasfezione commerciale cationico-lipidico.
- Eseguire trasfettenze transitori di GCaMP2 in celle HEK293T in due piastre a sei pozzi.
- Incubare una piastra a sei po porsi nell'incubatore della piattaforma e la seconda piastra a sei porsi in un incubatore di CO2 standard.
- Confronta l'efficienza di trasfezione all'interno di ogni piastra mediante l'imaging a fluorescenza utilizzando un microscopio a fluorescenza.
4. Fare tampone di tempra e H2O2
- Fare 100 mL di tampone di tempra contenente 125 mM N-tert-Butil-α-fenilnitrone (PBN) e 125 mM N, N′-Dimetiltiourea (DMTU).
NOTA: DMTU e PBN sono spazzini a radicali liberi e sono permeabili alle cellule. - Diluire H2Oda 2 a 200 mM. Ogni campione richiede 6 mL di H2O2 per immergere completamente lo strato di cellule nella parte inferiore di ogni pozzo.
NOTA: Il tampone di tempra viene effettuato il giorno prima e conservato a 4 °C durante la notte, protetto dalla luce. Diluire l'H2O2 il giorno dell'esperimento.
5. Impostare l'incubatore di piattaforme per IC-FPOP
NOTA: L'incubatore della piattaforma deve essere assemblato in condizioni sterili. Assemblare l'incubatore in un cappuccio sterile per la coltura cellulare.
- Svitare l'incubatore della piattaforma dalla fase di posizionamento e scollegare le linee di temperatura, gas e umidificatore.
- Dopo aver spruzzato l'incubatore con il 70% di etanolo, posizionarlo nella cappa di coltura cellulare.
- Rimuovere la piastra a sei porri dall'incubatore della piattaforma, fissare il coperchio originale della piastra e confermare la confluenza cellulare utilizzando un microscopio.
- Dopo che la confluenza cellulare è stata confermata, sostituire la piastra a sei pozzi con celle confluenti nell'incubatore della piattaforma all'interno del cappuccio di coltura cellulare.
- Inserire tre tubi polimerici da 1,59 ID pretaglio (15 cm) in ogni pozzo tramite le porte incorporate. Lavare i tubi alle pareti del pozzo e tenere con anelli stampati in 3D personalizzati.
NOTA: Sei anelli stampati in 3D con filamento PLA da 33 mm sono stati progettati su misura per fissare i tubi alle pareti della piastra senza disturbare le cellule o intaccare l'impulso laser. - Coprire l'incubatore della piattaforma con il coperchio al quarzo. Sostituire e fissare l'incubatore superiore del palco sul sistema di posizionamento. Ricollegare le linee di temperatura, gas e umidificatore.
- Collegare tubi polimerici da 1,59 ID a 1/16" estremità dei connettori da 1/16x1/8".
6. Esecuzione di IC-FPOP nell'incubatore di piattaforme
- Preparare uno script software di integrazione per il prelievo della pompa. Utilizzare una pompa peristaltica (Pompa 8) per rimuovere completamente i supporti cellulari da tutti e sei i pozzi.
- Solventi primi in ogni canale delle altre tre pompe peristaltiche (Pompe 5-7). Infondere H2O2 e tempra buffer nei rispettivi tubi alternati fino a quando i reagenti non raggiungono le porte dell'incubatore.
- Verificare che il raggio laser sia stato angolato correttamente dagli specchi e raggiunga l'incubatore disinibito.
NOTA: Gli occhiali di sicurezza laser devono essere indossati ogni volta che il laser è in uso. Non irradiare prematuramente le cellule durante il processo di pesca/allineamento. Utilizzare il cartone per coprire completamente il coperchio al quarzo quando si allinea la trave. Inoltre, utilizzare un contorno stampato su carta bianca di una piastra a sei pompti per confermare ulteriormente che il raggio laser sta colpendo il centro di ogni pozzo. Utilizzare l'impostazione Impulso continuo alla frequenza e all'energia più basse per l'allineamento. - Controllare l'energia laser utilizzando un sensore esterno. Utilizzare un singolo impulso laser di 160 mJ a 50 Hz e 27 kV.
NOTA: è necessario un timer per i passaggi seguenti. - Preparare lo script del software di integrazione per l'infusione della pompa dopo aver confermato l'allineamento del fascio.
- Avviare il timer e premere contemporaneamente il pulsante Start sullo script della pompa software di integrazione.
- Infondere 200 mM H2O2 a 35 mL/min nel primo pozzo (6-10 secondi di segno sul timer).
NOTA: C'è un ritardo di cinque secondi prima che una pompa inizi a infondere. Ci vogliono anche sette secondi prima che l'impulso si attiva. L'impulso laser deve arrivare immediatamente dopo l'infusione di H2O2. - Premere il pulsante Start sul software laser al segno di 5 secondi per attivare l'impulso al segno di 11 secondi sul timer.
- Infondere una soluzione di tempra da 125 mM a 35 mL/min nel primo pozzo immediatamente dopo l'impulso laser. Spostare manualmente la fase di posizionamento per allineare il pozzo successivo con il raggio laser.
- Ripetere i passaggi precedenti 6.5-6.9 fino a quando ogni pozzo non è stato elaborato.
NOTA: IC-POP viene eseguito in triplice copia tecnica di tre campioni laser e tre non laser. Una piastra lavorata a sei pozzi funge da replica biologica. - In una cappa di coltura cellulare, utilizzare un raschietto per celle per trasferire le cellule da ogni pozzo in singoli tubi conici da 15 ml. Cellule di centrifuga a 1.200 x g per 5 minuti.
- Scartare le cellule supernatanti e resuspend in 100 μL di tampone di lisi RIPA.
- Trasferire le celle su singoli tubi in polipropilene da 1,2 ml.
- Flash congelare tutti i campioni in azoto liquido e posizionare in un congelatore a -80 °C fino all'uso.
NOTA: Il protocollo può essere messo in pausa qui.
7. Estrazione, purificazione e proteolisi proteica
- Scongelare i campioni e riscaldare a 95 °C in un blocco di calore per 5 minuti.
- Dopo il riscaldamento, raffreddare sul ghiaccio per 5 minuti.
- Aggiungere 25 unità di nucleasi al lisato cellulare per degradare il DNA e l'RNA mono-filamento, a doppio filamento, lineari e circolari e incubare a temperatura ambiente per 15 minuti.
- Campioni di centrifuga a 16.000 x g per 10 minuti a 4 °C.
- Raccogliere il supernatante e trasferirlo in un tubo di polipropilene pulito.
- Controllare la concentrazione proteica utilizzando un saggio proteico colorimetrico.
- Trasferire 100 μg di campione in un tubo di polipropilene pulito e portare a 100 μL con tampone di lisi cellulare.
- Ridurre i campioni con ditiothiothreitol (DTT) da 10 mM a 50 °C per 45 minuti.
- Raffreddare i campioni a temperatura ambiente per 10 minuti.
- Alchilato con iodoacetamide (IAA) da 50 mM a temperatura ambiente per 20 minuti.
NOTA: Proteggere l'AIA dalla luce - Aggiungere 460 μL di acetone prerimente refrigerato (-20 °C). Campioni di vortice e posizionare a -20 °C durante la notte.
NOTA: Il protocollo può essere messo in pausa qui. - Il giorno successivo, centrifugare campioni a 16.000 x g per 10 minuti a 4 °C.
- Rimuovere l'acetone senza interrompere il pellet proteico.
- Aggiungere 50 μL di acetone prerimente refrigerato (-20 °C) al 90%. Campioni di vortice da mescolare e centrifugare a 16.000 x g per altri 5 minuti a 4 °C.
- Rimuovere l'acetone e lasciare asciugare i campioni per 2-3 minuti.
- Pellet proteico resuspend con tampone Tris pH 8 da 10 mM.
- Resuspend MS grade trypsin (20 μg stock) in 40 μL di 10 mM Tris buffer pH 8 e aggiungere 2,5 μg di tripsidena ad ogni campione.
- Incubare campioni a 37 °C durante la notte.
NOTA: Il protocollo può essere messo in pausa qui. - Valutare la concentrazione di peptidi utilizzando un saggio peptidico colorimetrico.
- Tempra i campioni con il 5% di acido formico.
- Trasferire 10 μg di campione in un tubo di polipropilene pulito.
- Asciugare il campione utilizzando una centrifuga sottovuoto e resopend con 20 μL di MS grado 0,1% di acido formico (FA) in acqua.
- Trasferire ogni esempio in fiale di campionamento automatico con tappi pre-fessura.
8. Cromatografia liquida ad alte prestazioni-Spettrometria di massa tandem (LC-MS/MS)
- Per localizzare le modifiche FPOP, analizzare il lisato della cella digerita utilizzando l'analisi LC-MS/MS.
- Utilizzare fasi mobili dello 0,1% di FA in acqua (A) e dello 0,1% di FA in acetonitrile (ACN) (B).
- Caricare 0,5 μg di campione su una colonna di intrappolamento di 180 μm x 20 mm C18 (5 μm e 100 Å) e lavare la colonna con il 99% (A) e l'1% (B) per 15 minuti.
- Utilizzando una colonna analitica di 75 μm x 30 cm C18 (5 μm e 125 Å), elute e peptidi digeriti separati con una portata di 0,300 μL/min per 120 minuti.
- Eseguire il gradiente LC come segue: 0−1 min, 3% solvente B; 2−100 min, 10−45% B;100−110 min, 45-100% B; 110−115 min, 100% B.
- Ricondizionare la colonna al 3% (B) da 115-116 minuti e tenere al 3% (B) da 116-120 minuti.
- Analizza i peptidi eluiti in modalità ioni positivi con ionizzazione nano elettrospray.
- Acquisire spettri MS1 su un intervallo di scansione m/z di 375-1500 con una risoluzione di 60.000.
- Impostare il target di controllo automatico del guadagno (AGC) su 5.0e5 con un tempo massimo di iniezione di 50 ms e 5.0e4 soglia di intensità.
- Isolare gli ioni precursori con stati di carica 2-6 tramite acquisizione dipendente dai dati (DDA) con una finestra di isolamento di 1,2 m/z e un tempo di ciclo di 4 secondi.
- Sottosostire ioni MS2 alla dissociazione collisionale ad alta energia (HCD) (32% di energia normalizzata).
- Escludere i peptidi dopo 1 acquisizione MS/MS per 60 secondi.
- Impostare la risoluzione MS/MS su 15.000 con un obiettivo AGC di 5,0e4 e un tempo massimo di iniezione di 35 ms.
9. Scopritore proteoma/elaborazione dati
- Cerca file di dati grezzi tandem su software di analisi proteomica bottom-up disponibile su un database di proteine Homo sapiens pertinente e un enzima digest.
- Impostare i parametri di ricerca dell'analisi proteica.
- Impostate la tolleranza del frammento su 0,02 Da e la tolleranza ionia padre su 10 ppm.
- Impostare la specificità enzimatica sulla tripparina e consentire una scissione mancata.
- Impostare l'intervallo di massa su 375-1500 m/z.
- Stabilire la fiducia peptidica al 95% (medio) e la confidenza dei residui al 99% (alta).
- Accettare proteine se almeno due peptidi distinti sono identificati con il filtro del 5% del tasso di scoperta (FDR).
- Impostare la carbamidometilazione come modifica statica e tutte le modifiche note della catena laterale del radicale idrossile15,16 come modifiche dinamiche.
- Una volta terminati i file, esportare la sequenza, le posizioni di modifica, l'adesione alle proteine, il file dello spettro, l'abbondanza dei precursori e le informazioni sul tempo di conservazione in un database elettronico.
- Calcolare l'entità della modifica per peptide o residuo di questa equazione:
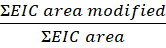
NOTA: L'area EIC modificata è l'area cromatografica ionica estratta (EIC) del peptide o residuo con una modifica ossidativa, e l'area EIC è l'area totale dello stesso peptide o residuo con e senza la modifica ossidativa. Nel corso del tempo, le proteine in presenza di perossido di idrogeno si ossidano, con conseguenti ossidazioni di fondo. Per calcolare l'entità della modifica, l'area del peptide modificato è divisa per l'area totale. Un campione di controllo non irradiato spiega l'ossidazione dello sfondo. L'ossidazione di fondo dal campione di controllo viene sottratta dal campione trattato al laser per identificare una modifica FPOP.
Risultati
Per confermare che le condizioni dell'incubatore di piattaforme sono sufficienti per la coltura cellulare sulla piattaforma laser, GCaMP2 è stato transiently trasfetto in HEK293T e l'efficienza di trasfezione per entrambe le piastre è stata valutata tramite imaging a fluorescenza (Figura 4A). GCaMP2 è una proteina fluorescente che rileva il calcio utilizzata come indicatore di calcio intracellulare geneticamente codificato. È una fusione di proteine fluorescenti verdi (GFP) e la proteina legante il calcio, la calmodulina. Un saggio di luciferasi è stato eseguito su cellule HEK 293 trasfette con prl-TK plasmide al fine di quantificare l'efficienza di trasfezione (Figura 4B). Questi risultati mostrano che l'incubatore di piattaforme ha superato le prestazioni dell'incubatore standard, con un aumento di 1,13 volte dell'efficienza di trasfezione, fornendo un benchmark quantitativo per un ambiente di coltura cellulare ottimale.
Le modifiche FPOP nelle cellule HEK293T etichettate nel sistema di flusso sono state confrontate con quelle etichettate nell'incubatore di piattaforme e hanno mostrato che l'incubatore di piattaforme supera il sistema di flusso sia nel numero di proteine modificate (Figura 5) che nella copertura FPOP totale in tali proteine. Il numero di proteine modificate FPOP acquisite nell'incubatore di piattaforme è stato di circa 1051, 2,2 volte superiore a quelle acquisite in un esperimento tipico. Le modifiche sono state combinate tra due repliche biologiche per ogni esperimento. Inoltre, PIXY offre una produttività più elevata.
Per dimostrare il vantaggio di una maggiore copertura di modifica attraverso una proteina, le modifiche IC-FPOP sono state localizzate a livello peptidico e l'entità della modifica è stata quantificata per distinguere le differenze nei risultati tra i sistemi per l'actina, una proteina amminoacidica 375. Nel sistema di flusso sono stati rilevati due peptidi modificati, fornendo informazioni strutturali limitate (Figura 6A). Tuttavia, nell'incubatore della piattaforma sono stati rilevati cinque peptidi modificati che coprono la sequenza di actina. Gli spettri di massa tandem indicano che il residuo Pro322 è stato modificato e rilevato in ogni esperimento (Figura 6B). I cinque peptidi modificati nei campioni dell'incubatore della piattaforma contenevano dodici residui modificati, mentre solo quattro residui sono stati modificati con il sistema di flusso(figura 6C). L'aumento della copertura di ossidazione fornisce maggiori informazioni strutturali in tutta la proteina.
ha dimostrato la capacità di FPOP di essere eseguita in vivo (IV-FPOP) all'interno di C. elegans, un modello di verme per gli stati di malattia umana17. Mentre IV-FPOP viene eseguito anche tramite un sistema di flusso, il sistema PIXY è stato testato per verificarsi la compatibilità con i worm. Circa 10.000 vermi sono stati incubati in ogni pozzo nell'incubatore della piattaforma a 20 °C. LC−MS/MS ha rivelato che 792 proteine sono state modificate da IV-FPOP nell'incubatore di piattaforme rispetto alle 545 proteine modificate con il sistema diflusso (Figura 7). Questi risultati dimostrano che oltre alla coltura cellulare 2D, questa nuova metodologia è compatibile anche con lo studio di altri sistemi biologici come C. elegans.
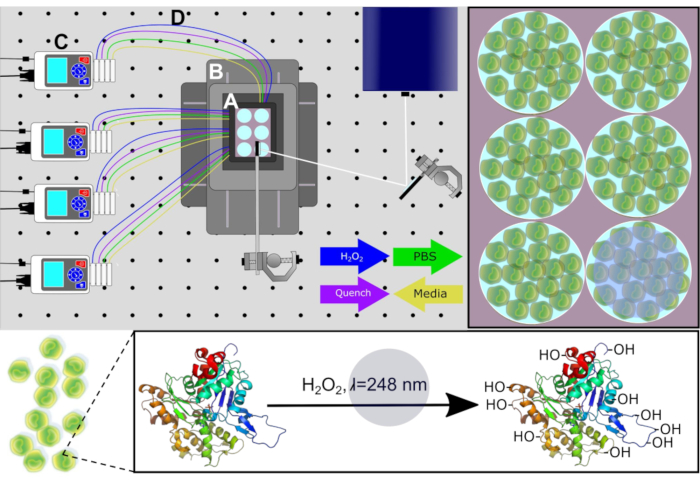
Figura 1. Schema del sistema PIXY. Componenti del sistema: incubatorestage-top ( A ), sistema di posizionamento (B), pompe peristaltiche (C) e linee di perfusione(D). I supporti di coltura cellulare vengono rimossi da ogni pozzo tramite pompe prima che le soluzioni H2O2 e quench siano infuse nei punti di tempo calcolati. Percorso laser per l'irradiazione mostrato in bianco. Ristampato con il permesso di Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Chimica analitica, 92(2), 1691-1696 2019. Copyright 2020 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2. Sistema PIXY completamente assemblato. (A) Sistema di monitoraggio tattile, (B) unità di anidride carbonica, (C) unità di temperatura, (D) pompa d'aria, (E) umidificatore, (F) specchi ottici, (G) incubatore di piattaforma, (H) stadio di posizionamento, (I) laser ad eccimeri KrF 248nm e pompe peristaltiche (J). Clicca qui per visualizzare una versione più grande di questa figura.
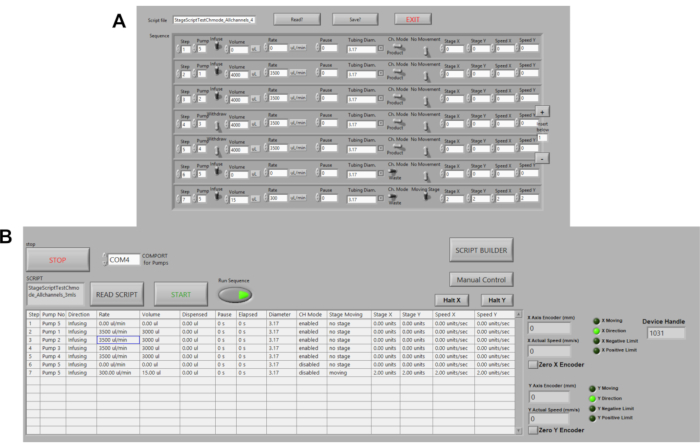
Figura 3. Automazione delle pompe peristaltiche. (A) Script di comando di esempio in LABVIEW. Le opzioni di comando includono volume, portata, pause, direzione del flusso. Velocità, distanza del palco e posizione sono attualmente automatizzati. (B) Lettore di script in LABVIEW. Qui, gli script di comando vengono caricati, quindi Run Sequence e START vengono premuti per avviare le pompe. Clicca qui per visualizzare una versione più grande di questa figura.
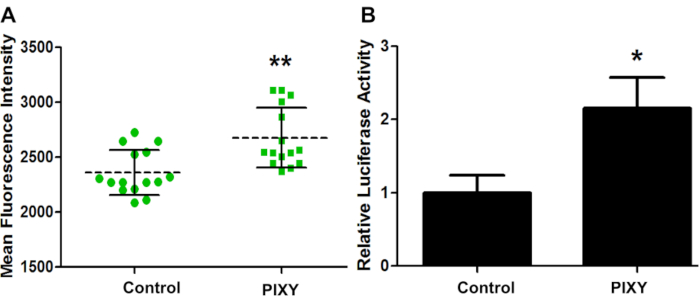
Figura 4. Efficienza di trasfezione cellulare HEK. (A) Intensità fluorescente media del confronto di trasfezione GCaMP2 tra incubatore standard (Controllo) e incubatore stage-top (PIXY). Punti e quadrati rappresentano ogni punto in un pozzo in cui è stata presa una misura. (B) Efficienza di trasfezione quantificata e convalidata con un diverso plasmide vettoriale, pRL-TK. Valore P< 0,005. Ristampato con il permesso di Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Chimica analitica, 92(2), 1691-1696 2019. Copyright 2020 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
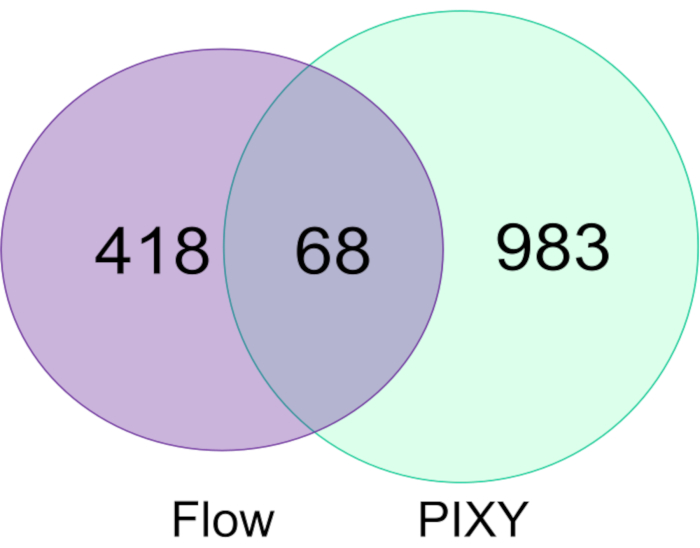
Figura 5. Confronto delle proteine modificate nel sistema di flusso a singola cellula e PIXY. Diagramma di Venn delle proteine modificate utilizzando nel sistema di flusso (viola) e in PIXY (verde). Ristampato con il permesso di Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Chimica analitica, 92(2), 1691-1696 2019. Copyright 2020 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
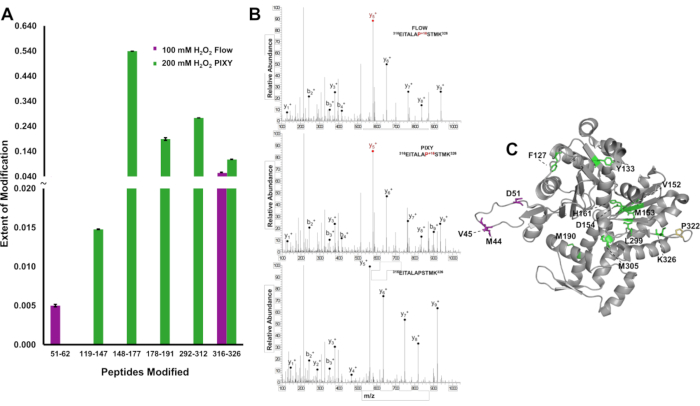
Figura 6. Localizzazione delle modifiche IC-FPOP. Confronto delle modifiche IC-FPOP tra sistemi. (A) Grafico a barre dei peptidi modificati ossidativamente all'interno dell'actina dal sistema di flusso (viola) rispetto all'incubatore di piattaforme (verde). (B) Spettri MS tandem di actina (peptide 316-326) con prolina modificata in entrambi i sistemi e peptide actino non modificato (C) Residui modificati di actina FPOP (PDB: 6ZXJ, catena A 11 residui modificati nell'incubatore di piattaforma (verde), 3 residui modificati nel sistema di flusso (viola), 1 residuo modificato sovrapposto (giallo). Ristampato con il permesso di Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Chimica analitica, 92(2), 1691-1696 2019. Copyright 2020 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
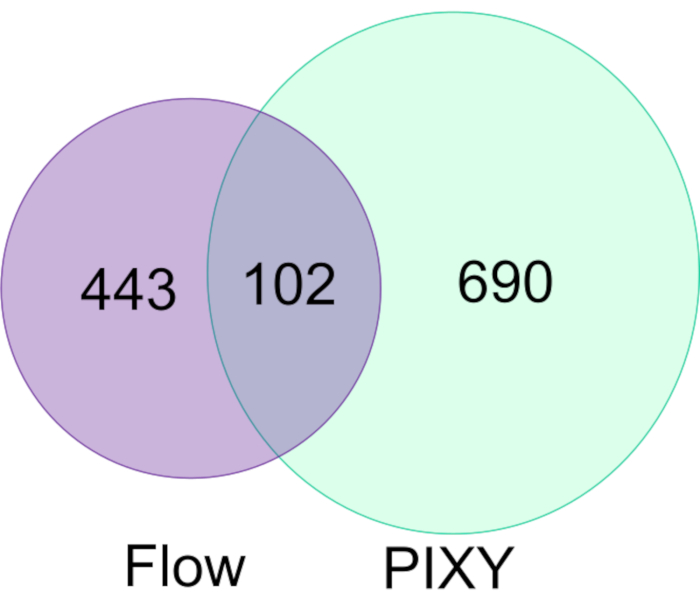
Figura 7. Confronto delle proteine modificate FPOP in C. elegans per flusso vs PIXY. C'è un aumento di 1,5 volte delle proteine modificate ossidativamente usando PIXY rispetto al sistema di flusso. Ristampato con il permesso di Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Chimica analitica, 92(2), 1691-1696 2019. Copyright 2020 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
La tabella 1. Distribuzione delle modifiche al flusso di lavoro e spostamenti di massa (Da) . Fare clic qui per scaricare questa tabella.
Discussione
Le proteine eseguono gran parte del lavoro nelle cellule viventi. Data questa importanza, sono necessari dati dettagliati sulla funzione proteica e sulla struttura di ordine superiore (HOS) nell'ambiente cellulare per approfondire la comprensione delle complessità in complessi più grandi e reazioni enzimatiche nelle cellule rispetto ai sistemi purificati. Per fare questo, è stato adottato un metodo di stampa a piedi proteica radicale idrossile (HRFP) intitolato In-Cell Fast Photochemical Oxidation of Proteins (IC-FPOP). La maggior parte degli studi FPOP sono stati effettuati in vitro in sistemi proteici relativamente puri, il che contrasta marcatamente con l'ambiente molecolare affollato che influisce sulle interazioni di legame e sulla dinamica conformazionale delle proteine. Di conseguenza, c'è un abisso tra i risultati degli esperimenti in vitro 18 e quelli che si oserebbe in un ambiente cellulare reale. Per colmare il divario tra le condizioni idealizzate di un esperimento FPOP in vitro e la natura complessa della cellula, è stata sviluppata una nuova piattaforma automatizzata a sei pozzi basata su piastre in cell-FPOP. Questa nuova tecnologia FPOP è in grado di identificare e caratterizzare queste specie molecolari e tracciare le loro interazioni molecolari dinamiche sia in stati sani che massati. Questa nuova piattaforma si chiama Platform Incubator con stadio Movable XY (PIXY).
FPOP è stato utilizzato con successo per caratterizzare le informazioni strutturali all'interno del proteoma. Tuttavia, ogni tecnica biologica ha alcune limitazioni che richiedono ulteriori miglioramenti. Durante la fotolisi laser sono necessari reagenti specifici per temprare in modo efficiente radicali idrossilici non reagenti. La separazione dei peptidi digeriti può richiedere grandi quantità di tempo per massimizzare le informazioni strutturali. Questa ricchezza di informazioni può anche richiedere un'ampia quantificazione durante l'analisi dei dati post-MS1. L'incubatore di piattaforme, compresi i macchinari periferici necessari per la coltura cellulare e IC-FPOP sulla piattaforma laser, ha un costo elevato che potrebbe non essere fattibile per alcuni laboratori. Man mano che si continuano a compiere progressi, software e strumenti di analisi robusti dovrebbero far avanzare ulteriormente la tecnica; alcuni dei quali sono esposti in questo studio. Studi attuali in questo incubatore di piattaforme sono stati eseguiti su cellule HEK293T e in C. elegans. Il metodo IC-FPOP ha dimostrato di essere compatibile con un'ampia varietà di linee cellulari tra cui ovaio di criceto cinese (CHO), Vero, MCF-7 e cellule MCF10-A19. Poiché il metodo IC-FPOP generale è traducibile in questa piattaforma statica, queste linee cellulari dovrebbero essere suscettibili di studio anche utilizzando PIXY.
IC-FPOP utilizza H2O2 per modificare ossidativamente catene laterali accessibili ai solventi di amminoacidi, per poi discernere ulteriormente le interazioni proteiche, la struttura e gli effetti metabolici all'interno di cellule vitali che è significativo nel fornire contesto biologico. È essenziale prima di un esperimento IC-FPOP confermare che le cellule sono vitali dopo l'aggiunta di H2O2. Studi di vitalità cellulare hanno dimostrato che le cellule erano vitali in presenza di concentrazioni di H2O2 fino a 200 mM 13. È anche importante assicurarsi che H2O2 venga infuso ad una concentrazione finale di 200 mM direttamente sulle cellule dopo la rimozione del supporto. La mancata rimozione completa dei mezzi di coltura cellulare causerà concentrazioni variabili di H2O2. Rispetto alle condizioni standard, l'aumento del tempo di incubazione a 10 secondi insieme all'aumento della concentrazione di H2O2 ha portato a un numero maggiore di proteine modificate da IC-FPOP nell'incubatore della piattaforma. È imperativo innescare pompe peristaltiche prima dell'uso per garantire che le pompe funzionino correttamente e che il liquido venga disperso. In caso di incapacità di farlo, le bolle d'aria nei tubi, il volume insufficiente di H2O2 per immergere le celle e/o il volume insufficiente di soluzione di tempra.
Un altro problema che può sorgere sono i ritardi indesiderati nel sistema. Un esempio di ciò è il processo di verifica dei comandi ricevuti per i sistemi di pompaggio che aggiunge ritardi significativi dell'ordine di 1000 o più millisecondi utilizzando il software di integrazione. Questo problema può essere risolto riducendo al minimo la comunicazione con le pompe durante l'esperimento e utilizzando comandi pre-impostati in anticipo il più possibile.
In futuro, l'obiettivo di PIXY è produrre un sistema completamente automatizzato e integrato. Oltre alle pompe peristaltiche, l'attivazione dell'impulso laser sarà automatizzata. Un nuovo sistema di posizionamento sarà utilizzato anche per il rapido movimento dell'incubatore di piattaforme per migliorare la velocità e la precisione. Tutti i componenti del sistema continueranno a essere programmati utilizzando il software di integrazione per aumentare ulteriormente la velocità effettiva.
Divulgazioni
Gli autori non dichiarano alcun interesse finanziario concorrente.
La ricerca qui presentata è associata alla seguente domanda di brevetto a cui si fa riferimento:
Numero di domanda di brevetto non provvisoria degli Stati Uniti: 17/042.565
Titolo: "Dispositivo e metodo per determinare la piegatura delle proteine"
Numero docket UMB: LJ-2018-104 UMass Ref: UMA 18-059.
Riconoscimenti
Questo lavoro è stato sostenuto da una sovvenzione del NIH R01 GM128983-01.
Materiali
| Name | Company | Catalog Number | Comments |
| Ismatec Reglo ICC Peristaltic Pumps | Cole-Palmer | 122270050 | |
| Kinematic Mirror Mount for Ø2" Optics | Thor Labs | ||
| 10X trypsin−EDTA | Corning | AB00490-00005 | |
| 50.0mm 248nm 45°, Excimer Laser Line Mirror | Edmond Optics | ||
| Acetone, HPLC Grade | Fisher Scientific | ||
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | ||
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 23275 | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| ACQUITY UPLC M-Class System | Waters | A53225 | |
| Afinia H480 3D Printer | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| air pump | OKOlabs | D12345 | |
| Aluminum Foil | Fisher Scientific | Stock #63-120 | |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | ||
| carbon dioxide unit | OKOlabs | MadMotor®-UHV | |
| Centrifuge | Eppendorf | ||
| connectors (Y PP 1/16” and 1/16x1/8”) | Cole-Palmer | 116891000 | |
| Delicate Task Wipers | Fisher Scientific | 022625501 | |
| Dithiothreiotol (DTT) | AmericanBio | ||
| DMSO, Anhydrous | Invitrogen | LS118-500 | |
| Dulbecco’s phosphate-buffered saline (DPBS) | Corning | SK-78001-82 | |
| EX350 excimer laser | GAM Laser | PI89900 | |
| Fetal bovine serum (FBS) | Corning | SK-12023-78 | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| HEK293T cells | Paul Shapiro Lab (University of Maryland Baltimore) | ||
| humidifier | OKOlabs | Nano-LPMW stage | |
| HV3-2 VALVE | Hamilton | BP152-500 | |
| Hydrogen Peroxide | Fisher Scientific | LS120-500 | |
| Iodoacetamide (IAA) | ACROS Organics | ||
| LABVIEW Professional 2018 | National Instruments | 86728 | |
| MadMotor Positioning system and controllers | Mad City Labs | W6-4 | |
| Methanol, LC/MS Grade | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Microcentrifuge | Thermo Scientific | H301-T Unit-BL-PLUS | |
| N,N′-Dimethylthiourea (DMTU) | ACROS Organics | ||
| Nanopositioinging stage | Mad City Labs | ||
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | ||
| OKO Touch Monitoring System | OKOlabs | ||
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | 7Z02936 | |
| PE50-C pyroelectric energy meter | Ophir Optronics | ||
| Penicillin-streptomycin | Corning | ||
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | ||
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | ||
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 75002436 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 06-666A | |
| pressure gauge | OKOlabs | OKO-AIR-PUMP-BL | |
| PTFE filter | OKOlabs | CO2-UNIT-BL | |
| Six 33 mm PLA filament rings | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| sterile incubator | OKOlabs | ||
| temperature unit | OKOlabs | OKO-TOUCH | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | A117-50 | |
| TiNKERcad | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| Tris Base | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| tubing (Tygon 3.18 and 1.59 ID) | Cole-Palmer | 177350250 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Water, LC/MS Grade | Fisher Scientific | 88702 | |
| 90058 | |||
| KM200 | |||
| 186007496 |
Riferimenti
- Johnson, D. T., Di Stefano, L. H., Jones, L. M. Fast photochemical oxidation of proteins (FPOP): A powerful mass spectrometry based structural proteomics tool. Journal of Biological Chemistry. 294 (32), 11969-11979 (2019).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemical Reviews. 120 (10), 4355-4454 (2019).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-883 (2019).
- Zhao, B., et al. Covalent Labeling with an α,β-Unsaturated Carbonyl Scaffold for Studying Protein Structure and Interactions by Mass Spectrometry. Analytical Chemistry. 92 (9), 6637-6644 (2020).
- Hambly, D. M., Gross, M. L. Laser Flash Photolysis of Hydrogen Peroxide to Oxidize Protein Solvent-Accessible Residues on the Microsecond Timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Li, K. S., Shi, L., Gross, M. L. Mass Spectrometry-Based Fast Photochemical Oxidation of Proteins (FPOP) for Higher Order Structure Characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Chea, E. E., Jones, L. M. Modifications generated by fast photochemical oxidation of proteins reflect the native conformations of proteins. Protein Science. 27 (6), 1047-1056 (2018).
- Hambly, D., Gross, M. Laser flash photochemical oxidation to locate heme binding and conformational changes in myoglobin. International Journal of Mass Spectrometry. 259 (1), 124-129 (2007).
- Yan, Y. Fast photochemical oxidation of proteins (FPOP) maps the epitope of EGFR binding to adnectin. Journal of the American Society for Mass Spectrometry. 25 (12), 2084-2092 (2014).
- Zhang, Y., Wecksler, A. T., Molina, P., Deperalta, G., Gross, M. L. Mapping the Binding Interface of VEGF and a Monoclonal Antibody Fab-1 Fragment with Fast Photochemical Oxidation of Proteins (FPOP) and Mass Spectrometry. Journal of the American Society for Mass Spectrometry. 28 (5), 850-858 (2017).
- Espino, J. A., Mali, V. S., Jones, L. M. In Cell Footprinting Coupled with Mass Spectrometry for the Structural Analysis of Proteins in Live Cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L. M. Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytical Chemistry. 92 (2), 1691-1696 (2019).
- Bangel-Ruland, N., et al. Cystic fibrosis transmembrane conductance regulator-mRNA delivery: a novel alternative for cystic fibrosis gene therapy. The Journal of Gene Medicine. 15 (11-12), 414-426 (2013).
- Gau, B. C., Chen, H., Zhang, Y., Gross, M. L. Sulfate Radical Anion as a New Reagent for Fast Photochemical Oxidation of Proteins. Analytical Chemistry. 82 (18), 7821-7827 (2010).
- Xu, G. C., et al. Hydroxyl Radical-Mediated Modification of Proteins as Probes for StructuralProteomics. Chemical Reviews. American Chemical Society. 107 (8), 3514-3543 (2007).
- Espino, J. A., Jones, L. M. Illuminating Biological Interactions with In Vivo Protein Footprinting. Analytical Chemistry. 9 (10), 6577-6584 (2019).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast Photochemical Oxidation of Protein Footprints Faster than Protein Unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Kaur, U., Johnson, D. T., Jones, L. M. Validation of the Applicability of In-Cell Fast Photochemical Oxidation of Proteins across Multiple Eukaryotic Cell Lines. Journal of the American Society for Mass Spectrometry. 31 (7), 1372-1379 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon