Method Article
Incubateur de plateformes avec Movable XY Stage: Une nouvelle plate-forme pour la mise en œuvre de l’oxydation photochimique rapide en cellule des protéines
Dans cet article
Résumé
Une nouvelle plate-forme statique est utilisée pour caractériser la structure protéique et les sites d’interaction dans l’environnement cellulaire indigène en utilisant une technique d’empreinte protéique appelée oxydation photochimique rapide des protéines (IC-FPOP).
Résumé
L’oxydation photochimique rapide des protéines (FPOP) couplée à la spectrométrie de masse (SEP) est devenue un outil précieux dans la protéomique structurale pour interroger les interactions protéiques, la structure et la dynamique conformationnelle des protéines en fonction de l’accessibilité des solvants. Ces dernières années, la portée de FPOP, une technique d’impression de pieds de protéine radicale hydroxyle (HRPF), a été étendue à l’étiquetage des protéines dans les cultures cellulaires vivantes, fournissant les moyens d’étudier les interactions protéiques dans l’environnement cellulaire alambiqué. Les modifications des protéines dans les cellules peuvent donner un aperçu des changements structurels induits par la ligand ou des changements conformationnels accompagnant la formation complexe protéique, le tout dans le contexte cellulaire. L’empreinte protéique a été réalisée à l’aide d’un système coutumier basé sur le débit et d’un laser excimère KrF de 248 nm pour produire des radicaux hydroxyles par photolyse de peroxyde d’hydrogène, nécessitant 20 minutes d’analyse pour un échantillon de cellules. Pour faciliter les expériences FPOP résolues dans le temps, l’utilisation d’une nouvelle plate-forme IC-FPOP à base de plaques à 6 puits a été lancée. Dans le système actuel, une seule impulsion laser irradère un puits entier, ce qui tronque le délai expérimental FPOP, ce qui entraîne 20 secondes de temps d’analyse, soit une diminution de 60 fois. Ce temps d’analyse considérablement réduit permet de rechercher des mécanismes cellulaires tels que des cascades biochimiques de signalisation, le pliage des protéines et des expériences différentielle (c.-à-d. sans drogue par rapport aux médicaments) d’une manière dépendante du temps. Cette nouvelle instrumentation, intitulée Platform Incubator with Movable XY Stage (PIXY), permet à l’utilisateur d’effectuer la culture cellulaire et IC-FPOP directement sur le banc optique à l’aide d’un incubateur de plate-forme avec la température, le CO2 et le contrôle de l’humidité. La plate-forme comprend également une étape de positionnement, des pompes périssaltiques et une optique miroir pour le guidage du faisceau laser. Les conditions IC-FPOP telles que la configuration optique, les débits, les pasfections transitoires et la concentration de H2O2 dans PIXY ont été optimisées et évaluées par les pairs. L’automatisation de tous les composants du système réduira la manipulation humaine et augmentera le débit.
Introduction
Les techniques d’empreinte protéique peuvent révéler des informations approfondies sur l’organisation des protéines. Ces techniques essentielles de biologie structurale basées sur la SP sont un composant de la boîte à outils de spectrométrie de masse. Ces méthodes sondent la structure des états supérieurs des protéines (HOS) et la synergie par l’étiquetage covalent1,2,3,4. L’oxydation photochimique rapide des protéines (FPOP) emploie des radicaux hydroxyles pour modifier oxydativement les chaînes latérales accessibles aux solvantsd’acides aminés 5,6 (tableau 1). La méthode utilise un laser excimère à 248 nm pour la photolyse du peroxyde d’hydrogène (H2O2) pour produire des radicaux hydroxyles. Théoriquement, 19 des 20 acides aminés peuvent être modifiés oxydativement avec Gly étant la seule exception. Cependant, en raison des taux variables de réactivité des acides aminés avec des radicaux hydroxyles, la modification d’un sous-ensemble seulement de ces derniers a été observée expérimentalement. Pourtant, la méthode a le potentiel d’analyse sur la longueur d’une séquence protéique5. FPOP modifie les protéines sur l’échelle de temps de microseconde, ce qui le rend utile dans l’étude des interactions faibles avec des taux de temps rapides. L’accessibilité des solvants change lors de la liaison ligand ou d’un changement dans la conformation des protéines, de sorte que la puissance de la méthode réside dans la comparaison du modèle d’étiquetage d’une protéine dans plusieurs états (c.-à-ligand-libre par rapport à ligand-bound). En conséquence, FPOP a réussi à identifier les sites d’interaction protéine-protéine et protéine-ligand et les régions de changement conformationnel7,8,9,10. La méthode FPOP a été étendue de l’étude des systèmes protéiques purifiés à l’analyse en cellule. Le FPOP in-cell (IC-FPOP) peut modifier oxydativement plus d’un millier de protéines dans les cellules pour fournir des informations structurelles à travers le protéome11,12. La plate-forme IC-FPOP conventionnelle utilise un système d’écoulement pour faire passer les cellules d’un seul fichier au-delà du faisceau laser. Le développement de ce système a permis aux cellules individuelles d’avoir une exposition égale à l’irradiation laser. Cela a conduit à une augmentation de 13 fois le nombre de protéines oxydativement étiquetées12. Toutefois, une limitation du système d’écoulement est la longueur d’une expérience d’échantillon unique composée d’un intervalle d’irradiation de 10 minutes au cours duquel la modification a lieu et d’un cycle de lavage supplémentaire de 10 minutes. Les contraintes de temps de l’IC-FPOP le rendent impropre à l’étude des intermédiaires de pliage des protéines de courte durée ou des changements qui existent entre les réseaux d’interaction dans les cascades biochimiques de signalisation. Cette limitation temporelle a inspiré la conception d’une nouvelle plate-forme IC-FPOP équipée d’un débit plus élevé.
Pour mesurer avec précision la structure des protéines de plus haut ordre dans l’environnement cellulaire indigène, la nouvelle conception permet d’accomplir la culture cellulaire directement à la plate-forme laser, ce qui permet à IC-FPOP d’être à haut débit. Cette configuration permet également de minimiser les perturbations de l’environnement cellulaire, contrairement à IC-FPOP en utilisant le flux où les cellules adhérentes doivent être retirées du substrat. La nouvelle plate-forme permet à IC-FPOP de se produire dans un système d’incubation stérile à l’aide d’un CO2 et d’une chambre supérieure à scène à température contrôlée tout en utilisant l’optique miroir configurée pour le guidage du faisceau laser, un système de positionnement pour le mouvement XY, et des pompes périssaltiques pour l’échange chimique. La nouvelle plate-forme de conduite d’IC-FPOP s’intitule Platform Incubator with Movable XY Stage (PIXY) (Figure 1). Dans PIXY, IC-FPOP est réalisé sur des cellules humaines cultivées en plaques de six puits dans la chambre d’incubateur de plate-forme. Pour cette configuration, le faisceau laser est réfléchi vers le bas sur la plaque en utilisant des miroirs compatibles faisceau comme une étape de positionnement qui détient l’incubateur est déplacé, dans le plan XY, de sorte que le faisceau laser est stratégiquement aligné pour irradier un seul puits à la fois. Les études de validation montrent que l’IC-FPOP peut être exécuté plus rapidement dans PIXY que dans le système de flux et conduit à des modifications accrues des acides aminés par protéine. Le développement de cette nouvelle plate-forme IC-FPOP exposera les connaissances qui peuvent être acquises à partir d’expériencescellulaires 13.
Protocole
1. Assemblage de l’incubateur de plate-forme avec l’étape mobile de XY
REMARQUE : La nouvelle plate-forme comprend le système d’incubation, l’étape de positionnement et les contrôleurs, les pompes périssaltiques, le laser excère KrF de 248 nm et les miroirs optiques assemblés sur une planche à pain optique impériale.
- Assembler le système d’incubation : l’unité de température, l’unité de dioxyde de carbone, l’humidificateur, la pompe à air et le système de surveillance tactile (figure 2A-E).
REMARQUE : Des instructions d’assemblage détaillées sont fournies par le fabricant. Le système d’incubation doit se stabiliser à 5% de CO2,37 °C et 85% d’humidité avant de cultiver des cellules dans l’incubateur. Ces paramètres peuvent dépendre de la lignée cellulaire. - Assemblez l’incubateur de plaques de six puits personnalisé, la scène d’entraînement au nanopositionnement et la scène d’entraînement XY. Le premier visse dans le second, respectivement.
REMARQUE : Instructions d’assemblage détaillées fournies par le fabricant. - Connectez les quatre pompes périssaltiques dans une séquence de « chaîne daisy » via des câbles RS-232, avec un câble RS-232 à câble USB relié à l’ordinateur de contrôle. Connectez le tube polymère ID de 3,18 mm (p. ex., Tygon) à chaque canal de chaque rouleau de canal de pompe.
REMARQUE : Chaque pompe a quatre rouleaux. La direction et le débit des rouleaux sont manipulés manuellement. - Insérez des connecteurs de 1/16 po x 1/8 po à l’extrémité de chaque tube polymère ID de 3,18 mm. Insérez l’extrémité 1/16'' du connecteur dans un tube en polymère 1,59 ID, puis insérez le tube en polymère dans l’incubateur via des ports personnalisés. Placez l’autre extrémité du tube dans la solution qui sera infusée lors de l’expérimentation IC-FPOP.
REMARQUE : Pour les lignes de perfusion, l’incubateur dispose de 36 ports personnalisés pour les lignes de tubes tout autour de la périphérie pour accueillir tous les reagents utilisés. - Vissez un miroir laser de 50 mm, 248 nm et 45° excimère dans une monture miroir cinématique pour optique Ø2 » dans la planche à pain 10-11 points de grille de l’ouverture laser de 248 nm. Placez le second miroir à un angle de 90° par rapport au premier de l’autre côté de l’incubateur. Inclinez le deuxième miroir vers le bas à environ 45° pour le guidage du faisceau laser vers l’incubateur (Figure 2F-J).
2. Synchronisation et automatisation initiale du système via un logiciel d’intégration
- Installez la dernière version du logiciel d’intégration nécessaire pour contrôler les pilotes et les pompes.
- Se référant au manuel de la pompe, renommer les pompes en commençant par « 5 » et en augmentant en valeur. Les commandes peuvent être envoyées au système de pompe à l’aide du sous-programme de contrôle manuel dans le logiciel d’intégration.
REMARQUE : La mise en mode canal d’une pompe modifie automatiquement la convention de nommage de la pompe dans l’ensemble, 1, 2, 3 et 4, correspondant aux quatre canaux de pompe. - Ouvrez le logiciel d’intégration pour l’automatisation de l’incubateur de plateformes.
- Choisissez le nom approprié de l’appareil usb comport (par exemple COM4) correspondant au câble USB du système de pompe à partir du menu de dropdown de connexion étiqueté Comport pour les pompes.
- Cliquez sur le bouton Script Builder pour modifier/créer un script pour la plate-forme d’incubateur de plateforme automatisée. Cliquez sur Enregistrer script pour enregistrer la séquence comme un fichier texte ( Figure3A).
REMARQUE : Le constructeur de scripts dispose d’une interface utilisateur pour définir le script avec des définitions du numéro de pompe, de la direction, du taux, du volume, du diamètre du tube, du mode canal et du délai expiré. - Si le mode canal est souhaité dans la fabrication du script, une étape du script doit être consacrée à la modification de la pompe en mode canal et hors canal, et les étapes suivantes correspondant aux canaux de pompe doivent être étiquetées comme pompes 1-4.
REMARQUE : Cela garantit qu’aucune pompe ne peut être simultanément en mode canal lors d’un script d’incubateur de plate-forme et que chaque pompe est remis en mode hérité après que les commandes ont été envoyées aux canaux nécessaires. - Cliquez sur le bouton Lire script et choisissez le fichier script approprié souhaité pour l’opération incubateur de la plate-forme.
- Passez le bouton Séquence d’exécuter à la position ON (vert) pour exécuter le script, puis cliquez sur le bouton START (Figure 3B).
3. Cultiver des cellules dans l’incubateur de plate-forme
REMARQUE : Les cellules doivent être placées dans l’incubateur de la plate-forme dans des conditions stériles dans une hotte de culture cellulaire la veille de l’expérimentation.
- Dévissez l’incubateur de plate-forme du stade de nanopositionnement et déconnectez les lignes de température, de gaz et d’humidificateur. Après avoir pulvérisé l’incubateur avec 70% d’éthanol, placez-le dans une hotte de culture cellulaire.
- Faire croître les cellules dans un T-175 à environ 80-90% confluent avant le transfert.
REMARQUE : Le terme confluency est utilisé comme mesure du nombre/couverture des cellules dans un plat de culture cellulaire ou un flacon. - Retirer les supports et rincer avec le tampon.
- Détachez les cellules à l’aide de trypsine-EDTA en utilisant le protocole du fabricant.
- Resuspendez dans 8 mL de médias et comptez les cellules.
- Graines fibronectine/collagène14 plaques enduites de six puits avec environ 90-95 μL de cellules résuspendées dans chaque puits. Ce volume sera approprié pour atteindre 80-90% confluency (~1.2 million de cellules) dans chaque puits le lendemain.
REMARQUE : Les plaques de six puits doivent être recouvertes de collagène avant l’ensemencement. Les réaccentrages utilisés pendant l’IC-FPOP sont infusés avec des débits rapides. Les plaques enduites assurent que les cellules ne sont pas détachées prématurément en raison de l’infusion de réhuits. - Placer la plaque ensemencée dans l’incubateur de la plate-forme et couvrir avec le couvercle en quartz.
REMARQUE : Au cours de la conception et du développement, un couvercle d’incubateur en verre a été changé en quartz, de sorte qu’il est compatible avec la lumière laser ultraviolette. - Replacez et fixez l’incubateur de plate-forme sur la scène de la commande de nanopositionnement. Reconnectez les lignes de température, de gaz et d’humidificateur.
- Laissez les cellules se développer à la confluence pendant la nuit.
REMARQUE : Les étapes suivantes de la culture cellulaire sont facultatives et sont destinées à des expériences dans lesquelles les cellules humaines sont transitoirement transfectées. Ces étapes évaluent l’efficacité de la transfection dans des conditions de culture cellulaire. - Transfecter le plasmide contenant le gène de la protéine chimérique GCaMP2 dans les cellules HEK 293 à l’aide d’un kit commercial de transfection cationique-lipide.
- Effectuer des pasfections transitoires de GCaMP2 dans les cellules HEK293T dans deux plaques de six puits.
- Incubez une plaque de six puits dans l’incubateur de plate-forme, et la deuxième plaque de six puits dans un incubateur standard de CO2.
- Comparez l’efficacité de la transfection dans chaque plaque par imagerie par fluorescence à l’aide d’un microscope à fluorescence.
4. Faire tampon étanche et H2O2
- Faire 100 mL de tampon étanche contenant 125 mM N-tert-Butyl-α-phenylnitrone (PBN) et 125 mM N, N′-Dimethylthiourea (DMTU).
REMARQUE : DMTU et PBN sont des charognards radicaux libres et sont perméables aux cellules. - Diluer H 2O2 à 200 mM. Chaque échantillon nécessite 6 mL de H2O2 pour plonger complètement la couche de cellules au fond de chaque puits.
REMARQUE : Le tampon d’étanchéation est fait la veille et stocké à 4 °C pendant la nuit, à l’abri de la lumière. Diluer le H2O2 le jour de l’expérience.
5. Mettre en place l’incubateur de plateformes pour IC-FPOP
REMARQUE : L’incubateur de plate-forme doit être assemblé dans des conditions stériles. Assembler l’incubateur dans une hotte stérile de culture cellulaire.
- Dévissez l’incubateur de la plate-forme du stade de positionnement et déconnectez les lignes de température, de gaz et d’humidificateur.
- Après avoir pulvérisé l’incubateur avec 70% d’éthanol, placez-le dans le capot de culture cellulaire.
- Retirez la plaque de six puits de l’incubateur de la plate-forme, fixez le couvercle d’origine de la plaque et confirmez la confluence cellulaire à l’aide d’un microscope.
- Après confirmation de la confluence cellulaire, remplacer la plaque de six puits par des cellules confluentes dans l’incubateur de la plate-forme à l’intérieur du capot de culture cellulaire.
- Insérez trois tubes polymères précoupés (15 cm) de 1,59 ID dans chaque puits via les ports intégrés. Rincer les tubes aux murs du puits et les tenir avec des anneaux imprimés 3D personnalisés.
REMARQUE : Six anneaux imprimés 3D en filament PLA de 33 mm ont été conçus sur mesure pour fixer le tube aux parois de la plaque sans déranger les cellules ou se mettre en travers de l’impulsion laser. - Couvrir l’incubateur de la plate-forme avec son couvercle en quartz. Remplacez et fixez l’incubateur supérieur de scène sur le système de positionnement. Reconnectez les lignes de température, de gaz et d’humidificateur.
- Connectez le tube polymère 1,59 ID à l’extrémité 1/16 » des connecteurs 1/16x1/8 ».
6. Exécution d’IC-FPOP dans l’incubateur de plate-forme
- Préparez un script logiciel d’intégration pour le retrait de la pompe. Utilisez une pompe périssaltique (pompe 8) pour retirer complètement les médias cellulaires des six puits.
- Solvants de premier choix dans chaque canal des trois autres pompes périssaltiques (pompes 5-7). Infuser H2O2 et étancher le tampon dans leurs tubes alternatifs respectifs jusqu’à ce que les réaménageurs atteignent les ports de l’incubateur.
- Confirmez que le faisceau laser a été incliné correctement par les miroirs et atteint l’incubateur décomplexé.
REMARQUE : Les lunettes de sécurité laser doivent être portées chaque fois que le laser est utilisé. N’irradiez pas prématurément les cellules pendant le processus de pêche à la ligne ou d’alignement. Utilisez du carton pour couvrir complètement le couvercle de quartz lors de l’alignement du faisceau. En outre, utilisez un contour imprimé sur le papier blanc d’une plaque de six puits pour confirmer davantage que le faisceau laser frappe le centre de chaque puits. Utilisez le réglage continu des impulsions à la fréquence et à l’énergie les plus basses pour l’alignement. - Vérifiez l’énergie laser à l’aide d’un capteur externe. Utilisez une seule impulsion laser de 160 mJ à 50 Hz et 27 kV.
REMARQUE : Une insurrœur est nécessaire pour les étapes suivantes. - Préparez le script logiciel d’intégration pour l’infusion de la pompe après confirmation de l’alignement du faisceau.
- Démarrez la mise à jour et appuyez sur le bouton Démarrer sur le script de la pompe logicielle d’intégration en même temps.
- Infuser 200 mM H2O2 à 35 mL/min dans le premier puits (marque de 6-10 secondes sur minuterie).
REMARQUE : Il y a un délai de cinq secondes avant qu’une pompe commence à infuser. Il faut également sept secondes au laser avant que l’impulsion ne soit déclenchée. L’impulsion laser doit venir immédiatement après l’infusionH 2O2. - Appuyez sur le bouton Démarrer sur le logiciel laser à la marque de 5 secondes pour déclencher l’impulsion à la marque de 11 secondes sur la mise à jour.
- Infuser la solution d’étanchéité de 125 mM à 35 mL/min dans le premier puits immédiatement après l’impulsion laser. Déplacez manuellement l’étape de positionnement pour aligner le puits suivant avec le faisceau laser.
- Répétez les étapes ci-dessus 6.5-6.9 jusqu’à ce que chaque puits ait été traité.
REMARQUE : IC-POP est effectué en triplicate technique de trois échantillons laser et de trois échantillons non laser. Une plaque traitée de six puits sert de réplique biologique. - Dans un capot de culture cellulaire, utilisez un grattoir cellulaire pour transférer les cellules de chaque puits dans des tubes coniques individuels de 15 mL. Cellules centrifugeuses à 1 200 x g pendant 5 minutes.
- Jetez les cellules supernatantes et résuspendantes dans 100 μL de tampon de lyse RIPA.
- Transférer les cellules vers des tubes individuels de polypropylène de 1,2 mL.
- Congelez tous les échantillons dans de l’azote liquide et placez-les dans un congélateur de -80 °C jusqu’à utilisation.
REMARQUE : Le protocole peut être mis en pause ici.
7. Extraction, purification et protéolyse de protéine
- Décongeler les échantillons et chauffer à 95 °C dans un bloc thermique pendant 5 minutes.
- Après le chauffage, laisser refroidir sur la glace pendant 5 minutes.
- Ajouter 25 unités de nucléase au lysate cellulaire pour dégrader l’ADN et l’ARN mono-échoués, à double brin, linéaires et circulaires et incuber dans une pièce tempérée pendant 15 minutes.
- Échantillons de centrifugeuses à 16 000 x g pendant 10 minutes à 4 °C.
- Recueillir le supernatant et transférer dans un tube de polypropylène propre.
- Vérifiez la concentration de protéines à l’aide d’un test de protéines colorimétriques.
- Transférer 100 μg d’échantillon dans un tube de polypropylène propre et porter à 100 μL avec tampon de lyse cellulaire.
- Réduire les échantillons avec 10 mM de dithiothreitol (TNT) à 50 °C pendant 45 minutes.
- Refroidir les échantillons à température ambiante pendant 10 minutes.
- Alkylate avec 50 mM d’iodoacétamide (IAA) à température ambiante pendant 20 minutes.
REMARQUE : Protégez l’AAI de la lumière - Ajouter 460 μL d’acétone pré-réfrigérée (-20 °C). Échantillons de vortex et placer à -20 °C pendant la nuit.
REMARQUE : Le protocole peut être mis en pause ici. - Le lendemain, des échantillons de centrifugeuses à 16 000 x g pendant 10 minutes à 4 °C.
- Retirer l’acétone sans perturber la pastille protéique.
- Ajouter 50 μL d’acétone pré-réfrigérée (-20 °C) pré-réfrigérée. Échantillons de vortex à mélanger et centrifugeuse à 16 000 x g pendant 5 minutes supplémentaires à 4 °C.
- Retirer l’acétone et laisser sécher les échantillons pendant 2 à 3 minutes.
- Resuspendez la pastille protéinée avec 10 mM tris tampon pH 8.
- Resuspendez la trypsine de qualité MS (20 μg de stock) dans 40 μL de 10 mM tris tampon pH 8 et ajoutez 2,5 μg de trypsine à chaque échantillon.
- Incuber des échantillons à 37 °C pendant la nuit.
REMARQUE : Le protocole peut être mis en pause ici. - Évaluer la concentration de peptide à l’aide d’un essai de peptide colorimétrique.
- Étanchez les échantillons avec 5% d’acide formique.
- Transférer 10 μg d’échantillon dans un tube de polypropylène propre.
- Séchez l’échantillon à l’aide d’une centrifugeuse sous vide et résuspendez avec 20 μL d’acide formique (FA) de qualité SP de 0,1 % dans l’eau.
- Transférez chaque échantillon sur des flacons d’autosampler propres avec des bouchons pré-fentes.
8. Chromatographie liquide haute performance-Spectrométrie de masse tandem (LC-MS/MS)
- Pour localisér les modifications FPOP, analysez le lysate cellulaire digéré à l’aide de l’analyse LC-MS/MS.
- Utiliser des phases mobiles de 0,1 % fa dans l’eau (A) et de 0,1 % fa en acétyltrile (ACN) (B).
- Chargez 0,5 μg d’échantillon sur une colonne de piégeage C18 (5 μm et 100 Å) de 180 μm x 20 mm (5 μm et 100 Å) et lavez la colonne avec 99 % (A) et 1 % (B) pendant 15 minutes.
- À l’aide d’une colonne analytique de 75 μm x 30 cm C18 (5 μm et 125 Å), de peptides digérés et séparés avec un débit de 0,300 μL/min pendant 120 minutes.
- Exécuter le gradient LC comme suit : 0−1 min, 3 % solvant B; 2−100 min, 10−45% B;100−110 min, 45-100% B; 110−115 min, 100% B.
- Reconditionner la colonne à 3% (B) de 115-116 minutes et tenir à 3% (B) de 116-120 minutes.
- Analyser les peptides éventrés en mode iion positif avec l’ionisation nano électrospray.
- Acquérir des spectres MS1 sur une plage de balayage m/z de 375-1500 à une résolution de 60 000.
- Réglez l’objectif de contrôle automatique du gain (AGC) à 5,0e5 avec un temps d’injection maximal de 50 ms et 5,0e4 seuil d’intensité.
- Isoler les ions précurseurs avec des états de charge 2-6 via l’acquisition dépendante des données (DDA) avec une fenêtre d’isolement de 1,2 m/z et un temps de cycle de 4 secondes.
- Soumettre les ions MS2 à la dissociation collisionnelle à haute énergie (HCD) (32 % d’énergie normalisée).
- Exclure les peptides après l’acquisition de 1 MS/MS pendant 60 secondes.
- Réglez la résolution MS/MS à 15 000 avec un objectif AGC de 5,0e4 et un temps d’injection maximum de 35 ms.
9. Découvreur/traitement de données Proteome
- Recherchez des fichiers de données brutes tandem sur un logiciel d’analyse protéomique ascendante disponible à partir d’une base de données de protéines Homo sapiens pertinente et digérer l’enzyme.
- Définissez les paramètres de recherche d’analyse des protéines.
- Réglez la tolérance aux fragments à 0,02 Da et la tolérance iration parentale à 10 ppm.
- Définir la spécificité enzymatique à la trypsine et permettre un clivage manqué.
- Réglez la portée de masse à 375-1500 m/z.
- Établir la confiance peptidique à 95 % (moyenne) et la confiance des résidus à 99 % (élevé).
- Acceptez les protéines si au moins deux peptides distincts sont identifiés avec le filtre de 5 % du taux de découverte (FDR).
- Réglez la carbamidomethylation comme une modification statique et toutes les modifications connues de la chaîne latérale radicale hydroxyle15,16 sous forme de modifications dynamiques.
- Une fois les fichiers terminés, la séquence d’exportation, les lieux de modification, l’accession aux protéines, le fichier spectre, l’abondance des précurseurs et les informations sur le temps de rétention vers une base de données électronique.
- Calculez l’étendue de la modification par peptide ou résidu de cette équation :
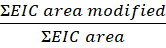
REMARQUE : La zone EIC modifiée est la zone chromatographique iration (EIC) extraite du peptide ou des résidus avec une modification oxydative, et la zone EIC est la zone totale du même peptide ou résidu avec et sans la modification oxydative. Au fil du temps, les protéines en présence de peroxyde d’hydrogène s’oxyderont, ce qui entraîne des oxydations de fond. Pour calculer l’étendue de la modification, la zone du peptide modifié est divisée par la superficie totale. Un échantillon de contrôle non irradié explique l’oxydation de fond. L’oxydation de fond de l’échantillon de contrôle est soustraite de l’échantillon traité au laser pour identifier une modification FPOP.
Résultats
Pour confirmer que les conditions de l’incubateur de plate-forme sont suffisantes pour la culture cellulaire à la plate-forme laser, GCaMP2 a été transitoirement transposé en HEK293T et l’efficacité de transfection pour les deux plaques a été évaluée par imagerie par fluorescence (figure 4A). GCaMP2 est une protéine fluorescente de détection de calcium utilisée comme indicateur de calcium intracellulaire génétiquement codé. Il s’agit d’une fusion de protéines fluorescentes vertes (GFP) et de la protéine liant le calcium, la calmoduline. Un essai de luciferase a été exécuté sur hek 293 cellules transfectées avec le prl-TK plasmide afin de quantifier l’efficacité de transfection (figure 4B). Ces résultats montrent que l’incubateur de plate-forme a dépassé les performances de l’incubateur standard, avec une augmentation de 1,13 fois l’efficacité de la transfection, fournissant une référence quantitative pour l’environnement optimal de culture cellulaire.
Les modifications FPOP dans les cellules HEK293T étiquetées dans le système d’écoulement ont été comparées à celles étiquetées dans l’incubateur de plate-forme et ont montré que l’incubateur de plate-forme surpasse le système de flux à la fois dans le nombre de protéines modifiées (figure 5) et la couverture totale FPOP dans ces protéines. Le nombre de protéines modifiées FPOP acquises dans l’incubateur de plate-forme était d’environ 1051, soit 2,2 fois plus que ceux acquis dans le cadre d’une expérience typique. Des modifications ont été combinées entre deux répliques biologiques pour chaque expérience. En outre, PIXY offre un débit plus élevé.
Pour démontrer l’avantage d’une couverture de modification plus élevée à travers une protéine, les modifications IC-FPOP ont été localisées sur le niveau de peptide et l’étendue de la modification a été quantifiée pour distinguer les différences dans les résultats entre les systèmes pour l’actine, une protéine d’acide aminé de 375. Dans le système d’écoulement, deux peptides modifiés ont été détectés, fournissant des renseignements structurels limités( figure 6A). Cependant, cinq peptides modifiés couvrant la séquence d’actine ont été détectés dans l’incubateur de plate-forme. Les spectres de masse tandem indiquent que les résidus Pro322 ont été modifiés et détectés dans chaque expérience( figure 6B). Les cinq peptides modifiés dans les échantillons de l’incubateur de la plate-forme contenaient douze résidus modifiés, tandis que seulement quatre résidus ont été modifiés avec le système d’écoulement (figure 6C). L’augmentation de la couverture d’oxydation fournit plus d’informations structurelles à travers la protéine.
Espino et coll. ont démontré la capacité de FPOP à être exécuté in vivo (IV-FPOP) au sein de C. elegans, un modèle de ver pour les états de maladie humaine17. Alors que IV-FPOP est également effectué via un système de flux, le système PIXY a été testé pour la compatibilité avec les vers. Environ 10 000 vers ont été incubés dans chaque puits de l’incubateur de plate-forme à 20 °C. LC−MS/MS analyse a révélé que 792 protéines ont été modifiées par IV-FPOP dans l’incubateur de plate-forme par rapport aux 545 protéines modifiées avec le système d’écoulement (figure 7). Ces résultats démontrent qu’en plus de la culture cellulaire 2D, cette nouvelle méthodologie est également compatible avec l’étude d’autres systèmes biologiques tels que C. elegans.
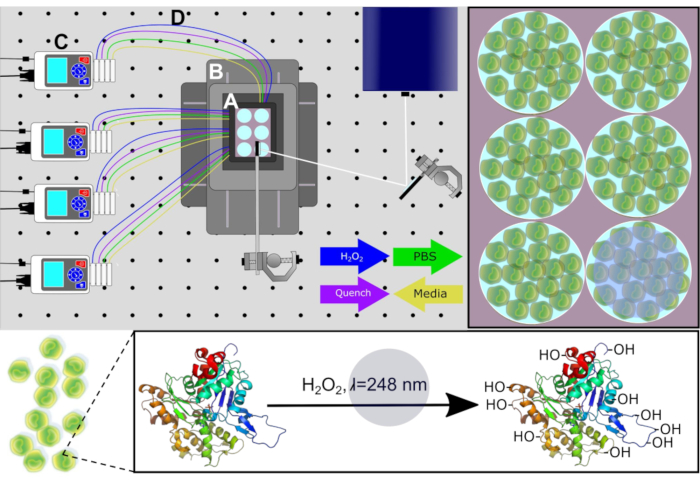
Figure 1. Schéma du système PIXY. Composants du système : (A) incubateur de dessus de scène, (B) système de positionnement , (C) pompes périssaltiques, et (D) lignes de perfusion. Les supports de culture cellulaire sont retirés de chaque puits par l’intermédiaire de pompes avant h2O2 et les solutions d’étanchéation sont infusées à des points de temps calculés. Chemin laser pour irradiation présenté en blanc. Réimprimé avec la permission de Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Chimie analytique, 92(2), 1691-1696 2019. Droit d’auteur 2020 American Chemical Society. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2. Système PIXY entièrement assemblé. (A) Système de surveillance tactile, (B) unité de dioxyde decarbone,( C ) unité de température, (D) pompe à air, (E) humidificateur, (F) miroirs optiques, (G) incubateur de plate-forme, (H) stade de positionnement, (I) 248nm KrF excimer laser, et (J) pompes périssaltiques. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
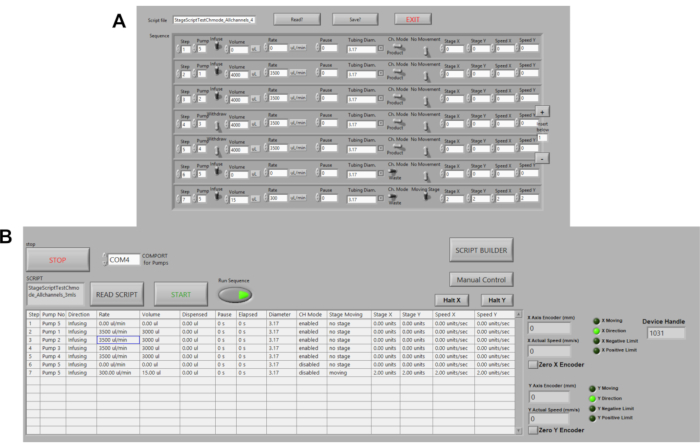
Figure 3. Automatisation des pompes périsaltiques. (A) Exemple de script de commande dans LABVIEW. Les options de commande incluent le volume, le débit, les pauses, la direction du flux. La vitesse, la distance de l’étape et l’emplacement sont actuellement automatisés. (B) Lecteur de script dans LABVIEW. Ici, les scripts de commande sont téléchargés puis exécuter la séquence et START sont pressés d’initier des pompes. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
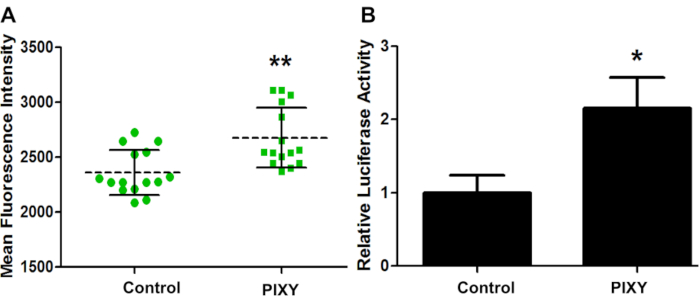
Figure 4. Efficacité de transfection de cellules HEK. (A) Intensité fluorescente moyenne de la comparaison de transfection GCaMP2 entre l’incubateur standard (Control) et l’incubateur de scène (PIXY). Les points et les carrés représentent chaque point dans un puits où une mesure a été prise. (B) Efficacité de transfection quantitée et validée avec un plasmide vecteur différent, pRL-TK. Valeur P< 0,005. Réimprimé avec la permission de Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Chimie analytique, 92(2), 1691-1696 2019. Droit d’auteur 2020 American Chemical Society. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
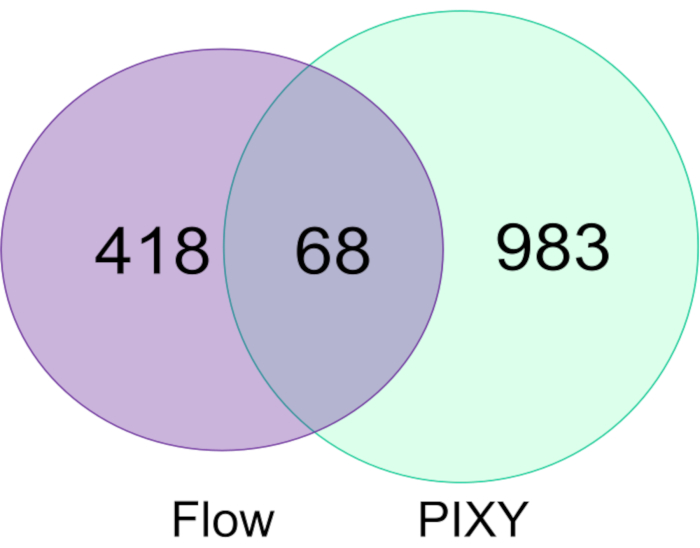
Figure 5. Comparaison des protéines modifiées dans le système d’écoulement cellulaire unique et PIXY. Diagramme venn de protéines modifiées à l’aide du système d’écoulement (violet) et dans PIXY (vert). Réimprimé avec la permission de Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Chimie analytique, 92(2), 1691-1696 2019. Droit d’auteur 2020 American Chemical Society. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
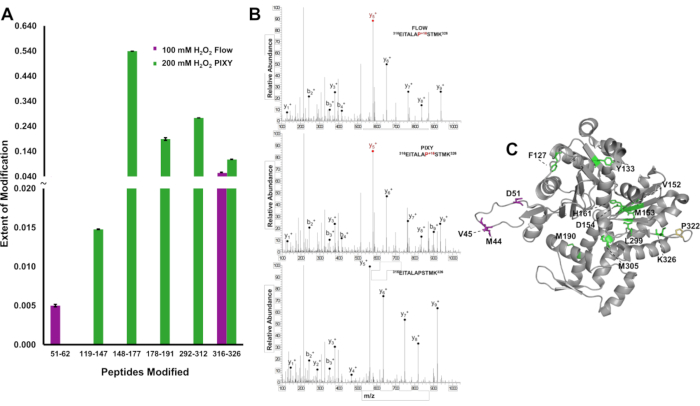
Figure 6. Localisation des modifications IC-FPOP. Comparaison des modifications IC-FPOP entre les systèmes. (A) Graphique à barres de peptides modifiés oxydatifs dans l’actine du système d’écoulement (violet) vs incubateur de plate-forme (vert). (B) Spectres tandem MS de l’actine (peptide 316-326) avec proline modifiée dans les deux systèmes et peptide d’actine non modifié (C) Résidus modifiés FPOP d’actine (PDB : 6ZXJ, chaîne A 11 résidus modifiés dans l’incubateur de plate-forme (vert), 3 résidus modifiés dans le système d’écoulement (violet), 1 résidu modifié se chevauchant (jaune). Réimprimé avec la permission de Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Chimie analytique, 92(2), 1691-1696 2019. Droit d’auteur 2020 American Chemical Society. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
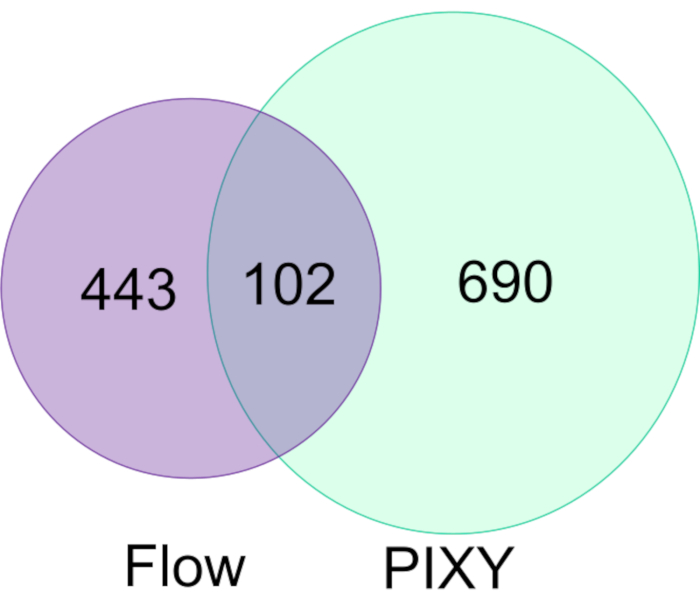
Figure 7. Comparaison des protéines modifiées FPOP dans C. elegans par flux vs PIXY. Il y a une augmentation de 1,5 fois des protéines oxydativement modifiées utilisant PIXY par rapport au système d’écoulement. Réimprimé avec la permission de Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Chimie analytique, 92(2), 1691-1696 2019. Droit d’auteur 2020 American Chemical Society. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Tableau 1. Distribution de modification de flux de travail et décalages de masse (Da). Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Les protéines effectuent une grande partie du travail dans les cellules vivantes. Compte tenu de cette importance, des données détaillées sur la fonction protéique et la structure de l’ordre supérieur (HOS) dans l’environnement cellulaire sont nécessaires pour approfondir la compréhension des subtilités dans les grands complexes et les réactions enzymatiques dans les cellules par opposition aux systèmes purifiés. Pour ce faire, une méthode d’impression de pieds de protéine radicale hydroxyle (HRFP) a été adoptée intitulée Oxydation photochimique rapide des protéines (IC-FPOP). La plupart des études FPOP ont été faites in vitro dans des systèmes protéiques relativement purs, ce qui contraste nettement avec l’environnement moléculaire surpeuplé qui affecte les interactions contraignantes et la dynamique conformationnelle des protéines. En conséquence, il y a un gouffre entre les résultats des expériences in vitro 18 et ceux qui seraient obtenus dans un environnement cellulaire réel. Pour combler le fossé entre les conditions idéalisées d’une expérience FPOP in vitro et la nature complexe de la cellule, une nouvelle plate-forme automatisée à six puits à base de plaques cellulaires-FPOP a été développée. Cette nouvelle technologie FPOP est capable d’identifier et de caractériser ces espèces moléculaires et de retracer leurs interactions moléculaires dynamiques dans des états sains et maladies. Cette nouvelle plate-forme s’appelle Platform Incubator avec Movable XY stage (PIXY).
FPOP a été utilisé avec succès pour caractériser l’information structurelle dans le protéome. Cependant, chaque technique biologique a certaines limites qui nécessitent une amélioration supplémentaire. Des réagencés spécifiques sont nécessaires lors de la photolyse laser et pour étancher efficacement les radicaux hydroxyles non réagis. La séparation des peptides digérés peut nécessiter de grandes quantités de temps pour maximiser l’information structurelle. Cette mine d’informations peut également nécessiter une quantitation approfondie lors de l’analyse des donnéespost-SP 1. L’incubateur de plate-forme, y compris les machines périphériques nécessaires à la culture cellulaire et IC-FPOP à la plate-forme laser, est livré avec un coût élevé qui peut ne pas être réalisable pour certains laboratoires. Au fur et à mesure que des progrès continuent d’être réalisés, des logiciels et des outils d’analyse robustes devraient faire progresser la technique; dont certains sont présentés dans cette étude. Des études actuelles dans cet incubateur de plate-forme ont été réalisées sur les cellules HEK293T et dans C. elegans. La méthode IC-FPOP s’est montrée compatible avec une grande variété de lignées cellulaires, y compris l’ovaire hamster chinois (CHO), Vero, MCF-7, et mcf10-A cellules19. Puisque la méthode générale d’IC-FPOP est traduisible à cette plate-forme statique, ces lignes cellulaires devraient être aimables pour l’étude utilisant PIXY aussi bien.
IC-FPOP utilise H2O2 pour modifier oxydativement les chaînes latérales accessibles aux solvants d’acides aminés, puis discerner davantage les interactions protéiques, la structure et les effets métaboliques dans les cellules viables, ce qui est important dans la fourniture de contexte biologique. Il est essentiel avant une expérience IC-FPOP de confirmer que les cellules sont viables après l’ajout de H2O2. Les études de viabilité cellulaire ont démontré que les cellules étaient viables en présence des concentrations de H2O2 jusqu’à 200 mM 13. Il est également important de s’assurer que H2O2 est infusé à une concentration finale de 200 mM directement sur les cellules après l’enlever des supports. L’omission d’enlever complètement les médias de culture cellulaire causera des concentrations variables de H2O2. Par rapport aux conditions standard, l’augmentation du temps d’incubation à 10 secondes ainsi que l’augmentation de la concentration de H2O2 ont conduit à un plus grand nombre de protéines modifiées par IC-FPOP dans l’incubateur de plate-forme. Il est impératif d’amorcer les pompes périssaltiques avant utilisation pour s’assurer que les pompes fonctionnent correctement et que le liquide est dispersé. Si vous ne le faites pas, vous risquez de provoquer des bulles d’air dans le tube, un volume insuffisant de H2O2 pour immerger les cellules et/ou un volume insuffisant de solution d’assaisons.
Un autre problème qui peut survenir est les retards indésirables dans le système. Un exemple de ceci est le processus de vérification des commandes reçues pour les systèmes de pompe qui ajoute des retards significatifs de l’ordre de 1000 millisecondes ou plus utilisant le logiciel d’intégration. Ce problème peut être résolu en minimisant autant que possible la communication avec les pompes pendant l’expérience et en utilisant des commandes prédéfigurées à l’avance.
À l’avenir, l’objectif de PIXY est de produire un système entièrement automatisé et intégré. En plus des pompes périssaltiques, le déclenchement de l’impulsion laser sera automatisé. Un nouveau système de positionnement sera également utilisé pour le mouvement rapide de l’incubateur de plate-forme afin d’améliorer la vitesse et la précision. Tous les composants du système continueront d’être programmés à l’aide du logiciel d’intégration afin d’augmenter encore le débit.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
La recherche présentée ci-dessous est associée à la demande de brevet ci-dessous référencée :
Numéro de demande de brevet non provisoire des États-Unis : 17/042 565
Titre: « Device and Method for Determining Protein Folding »
Numéro de dossier UMB: LJ-2018-104 UMass Réf: UMA 18-059.
Remerciements
Ces travaux ont été appuyés par une subvention des NIH R01 GM128983-01.
matériels
| Name | Company | Catalog Number | Comments |
| Ismatec Reglo ICC Peristaltic Pumps | Cole-Palmer | 122270050 | |
| Kinematic Mirror Mount for Ø2" Optics | Thor Labs | ||
| 10X trypsin−EDTA | Corning | AB00490-00005 | |
| 50.0mm 248nm 45°, Excimer Laser Line Mirror | Edmond Optics | ||
| Acetone, HPLC Grade | Fisher Scientific | ||
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | ||
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 23275 | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| ACQUITY UPLC M-Class System | Waters | A53225 | |
| Afinia H480 3D Printer | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| air pump | OKOlabs | D12345 | |
| Aluminum Foil | Fisher Scientific | Stock #63-120 | |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | ||
| carbon dioxide unit | OKOlabs | MadMotor®-UHV | |
| Centrifuge | Eppendorf | ||
| connectors (Y PP 1/16” and 1/16x1/8”) | Cole-Palmer | 116891000 | |
| Delicate Task Wipers | Fisher Scientific | 022625501 | |
| Dithiothreiotol (DTT) | AmericanBio | ||
| DMSO, Anhydrous | Invitrogen | LS118-500 | |
| Dulbecco’s phosphate-buffered saline (DPBS) | Corning | SK-78001-82 | |
| EX350 excimer laser | GAM Laser | PI89900 | |
| Fetal bovine serum (FBS) | Corning | SK-12023-78 | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| HEK293T cells | Paul Shapiro Lab (University of Maryland Baltimore) | ||
| humidifier | OKOlabs | Nano-LPMW stage | |
| HV3-2 VALVE | Hamilton | BP152-500 | |
| Hydrogen Peroxide | Fisher Scientific | LS120-500 | |
| Iodoacetamide (IAA) | ACROS Organics | ||
| LABVIEW Professional 2018 | National Instruments | 86728 | |
| MadMotor Positioning system and controllers | Mad City Labs | W6-4 | |
| Methanol, LC/MS Grade | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Microcentrifuge | Thermo Scientific | H301-T Unit-BL-PLUS | |
| N,N′-Dimethylthiourea (DMTU) | ACROS Organics | ||
| Nanopositioinging stage | Mad City Labs | ||
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | ||
| OKO Touch Monitoring System | OKOlabs | ||
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | 7Z02936 | |
| PE50-C pyroelectric energy meter | Ophir Optronics | ||
| Penicillin-streptomycin | Corning | ||
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | ||
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | ||
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 75002436 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 06-666A | |
| pressure gauge | OKOlabs | OKO-AIR-PUMP-BL | |
| PTFE filter | OKOlabs | CO2-UNIT-BL | |
| Six 33 mm PLA filament rings | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| sterile incubator | OKOlabs | ||
| temperature unit | OKOlabs | OKO-TOUCH | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | A117-50 | |
| TiNKERcad | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| Tris Base | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| tubing (Tygon 3.18 and 1.59 ID) | Cole-Palmer | 177350250 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Water, LC/MS Grade | Fisher Scientific | 88702 | |
| 90058 | |||
| KM200 | |||
| 186007496 |
Références
- Johnson, D. T., Di Stefano, L. H., Jones, L. M. Fast photochemical oxidation of proteins (FPOP): A powerful mass spectrometry based structural proteomics tool. Journal of Biological Chemistry. 294 (32), 11969-11979 (2019).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemical Reviews. 120 (10), 4355-4454 (2019).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-883 (2019).
- Zhao, B., et al. Covalent Labeling with an α,β-Unsaturated Carbonyl Scaffold for Studying Protein Structure and Interactions by Mass Spectrometry. Analytical Chemistry. 92 (9), 6637-6644 (2020).
- Hambly, D. M., Gross, M. L. Laser Flash Photolysis of Hydrogen Peroxide to Oxidize Protein Solvent-Accessible Residues on the Microsecond Timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Li, K. S., Shi, L., Gross, M. L. Mass Spectrometry-Based Fast Photochemical Oxidation of Proteins (FPOP) for Higher Order Structure Characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Chea, E. E., Jones, L. M. Modifications generated by fast photochemical oxidation of proteins reflect the native conformations of proteins. Protein Science. 27 (6), 1047-1056 (2018).
- Hambly, D., Gross, M. Laser flash photochemical oxidation to locate heme binding and conformational changes in myoglobin. International Journal of Mass Spectrometry. 259 (1), 124-129 (2007).
- Yan, Y. Fast photochemical oxidation of proteins (FPOP) maps the epitope of EGFR binding to adnectin. Journal of the American Society for Mass Spectrometry. 25 (12), 2084-2092 (2014).
- Zhang, Y., Wecksler, A. T., Molina, P., Deperalta, G., Gross, M. L. Mapping the Binding Interface of VEGF and a Monoclonal Antibody Fab-1 Fragment with Fast Photochemical Oxidation of Proteins (FPOP) and Mass Spectrometry. Journal of the American Society for Mass Spectrometry. 28 (5), 850-858 (2017).
- Espino, J. A., Mali, V. S., Jones, L. M. In Cell Footprinting Coupled with Mass Spectrometry for the Structural Analysis of Proteins in Live Cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L. M. Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytical Chemistry. 92 (2), 1691-1696 (2019).
- Bangel-Ruland, N., et al. Cystic fibrosis transmembrane conductance regulator-mRNA delivery: a novel alternative for cystic fibrosis gene therapy. The Journal of Gene Medicine. 15 (11-12), 414-426 (2013).
- Gau, B. C., Chen, H., Zhang, Y., Gross, M. L. Sulfate Radical Anion as a New Reagent for Fast Photochemical Oxidation of Proteins. Analytical Chemistry. 82 (18), 7821-7827 (2010).
- Xu, G. C., et al. Hydroxyl Radical-Mediated Modification of Proteins as Probes for StructuralProteomics. Chemical Reviews. American Chemical Society. 107 (8), 3514-3543 (2007).
- Espino, J. A., Jones, L. M. Illuminating Biological Interactions with In Vivo Protein Footprinting. Analytical Chemistry. 9 (10), 6577-6584 (2019).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast Photochemical Oxidation of Protein Footprints Faster than Protein Unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Kaur, U., Johnson, D. T., Jones, L. M. Validation of the Applicability of In-Cell Fast Photochemical Oxidation of Proteins across Multiple Eukaryotic Cell Lines. Journal of the American Society for Mass Spectrometry. 31 (7), 1372-1379 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon