Method Article
Hareketli XY Stage ile Platform İnkübatörü: Proteinlerin Hücre İçi Hızlı Fotokimyasal Oksidasyonunu Uygulamak İçin Yeni Bir Platform
Bu Makalede
Özet
Proteinlerin hücre içi hızlı fotokimyasal oksidasyonu (IC-FPOP) adı verilen bir protein ayak izi tekniği kullanılarak yerel hücre ortamındaki protein yapısını ve etkileşim alanlarını karakterize etmek için yeni bir statik platform kullanılır.
Özet
Proteinlerin hızlı fotokimyasal oksidasyonu (FPOP) kütle spektrometresi (MS) ile birleştiğinde, solvent erişilebilirliğinin bir işlevi olarak protein etkileşimlerini, yapısını ve protein konformasyon dinamiklerini sorgulamak için yapısal proteomikte paha biçilmez bir araç haline gelmiştir. Son yıllarda, bir hidroksil radikal protein ayak basımı (HRPF) tekniği olan FPOP'un kapsamı, canlı hücre kültürlerinde protein etiketlemeye genişletilerek, dolambaçlı hücresel ortamda protein etkileşimlerini incelemenin imkanı sağlanmıştır. Hücre içi protein modifikasyonları, hepsi hücresel bağlamda, protein kompleksi oluşumuna eşlik eden ligand indüklenmiş yapısal değişiklikler veya konformasyon değişiklikleri hakkında fikir verebilir. Protein ayak izi, bir hücre örneği için 20 dakikalık analiz gerektiren hidrojen peroksitin fotolizi yoluyla hidroksil radikalleri elde etmek için geleneksel akış tabanlı bir sistem ve 248 nm KrF ekscimer lazer kullanarak gerçekleştirildi. Zaman çözümlü FPOP deneylerini kolaylaştırmak için, 6 kuyu tabanlı yeni bir IC-FPOP platformunun kullanılmasına öncülük edildi. Mevcut sistemde, tek bir lazer darbesi tüm kuyuyu ışınlar, bu da FPOP deneysel zaman dilimini keserek 20 saniyelik analiz süresine, 60 kat azalmaya neden olan. Bu büyük ölçüde azaltılmış analiz süresi, biyokimyasal sinyal basamakları, protein katlama ve diferansiyel deneyler (yani, ilaçsız ve ilaca bağlı) gibi hücresel mekanizmaların zamana bağlı bir şekilde araştırılmasını mümkün kılar. Hareketli XY Stage (PIXY) ile Platform İnkübatörü başlıklı bu yeni enstrümantasyon, kullanıcının sıcaklık, CO2 ve nem kontrolüne sahip bir platform inkübatörü kullanarak hücre kültürünü ve IC-FPOP'u doğrudan optik tezgahta gerçekleştirmesini sağlar. Platform ayrıca lazer ışını yönlendirmesi için konumlandırma aşaması, peristaltik pompalar ve ayna optikleri içerir. PIXY'de optik konfigürasyonu, akış hızları, geçici transeksiyonlar ve H 2 O2 konsantrasyonu gibi IC-FPOP koşulları optimize edilmiş ve hakemli olarak incelenmiştir. Sistemin tüm bileşenlerinin otomasyonu insan manipülasyonu azaltacak ve verimi artıracaktır.
Giriş
Protein ayak izi teknikleri, proteinlerin organizasyonu hakkında derin bilgiler ortaya açabilir. Bu temel yapısal biyoloji MS tabanlı teknikler kütle spektrometresi araç kutusunun bir bileşenidir. Bu yöntemler protein yüksek sıra yapısını (HOS) ve sinerjiyi1,2, 3,4kovalent etiketlemesi ile araştırır. Proteinlerin hızlı fotokimyasal oksidasyonu (FPOP), amino asitlerin solventle erişilebilir yan zincirlerini oksidatif olarak değiştirmek için hidroksil radikalleri kullanmaktadır5,6 (Tablo 1). Yöntem, hidroksil radikalleri üretmek için hidrojen peroksitin fotolizi (H2 O 2)için248nm'de bir ekscimer lazer kullanır. Teorik olarak, 20 amino asidin 19'ı Gly yalnız istisnası olarak oksidatif olarak değiştirilebilir. Bununla birlikte, hidroksil radikalleri olan amino asitlerin değişen reaktivite oranları nedeniyle, bunların sadece bir alt kümesinin modifikasyonu deneysel olarak gözlenmiştir. Yine de, yöntem bir protein dizisinin uzunluğu üzerinde analiz potansiyeline sahiptir5. FPOP, mikrosaniye zaman ölçeğindeki proteinleri değiştirerek hızlı kapatma oranlarıyla zayıf etkileşimleri çalışmada yararlı hale getirir. Solvent erişilebilirliği ligand bağlama veya protein uyumundaki bir değişiklik üzerine değişir, bu nedenle yöntemin gücü, bir proteinin birden fazla durumda etiketleme deseninin (yani ligand-bound ile karşılaştırıldığında ligand içermeyen) karşılaştırılmasında yatır. Sonuç olarak, FPOP protein-protein ve protein-ligand etkileşim alanlarını ve konformasyonsal değişim bölgelerini belirlemede başarılı olmuştur7,8,9,10. FPOP yöntemi saflaştırılmış protein sistemlerinin çalışmasından hücre içi analize kadar genişletilmiştir. Hücre içi FPOP (IC-FPOP), proteom11,12arasında yapısal bilgi sağlamak için hücrelerdeki binden fazla proteini oksidatif olarak değiştirebilir. Geleneksel IC-FPOP platformu, hücreleri lazer ışınını tek bir dosyadan geçirmek için bir akış sistemi kullanır. Bu sistemin gelişimi, bireysel hücrelerin lazer ışınlanmasına eşit maruz kalmasına izin sağladı. Bu, oksidatif olarak etiketlenmiş proteinlerin sayısında 13 kat artışa yol açtı12. Bununla birlikte, akış sisteminin bir sınırlaması, değişikliğin gerçekleştiği 10 dakikalık ışınlama aralığından ve ek 10 dakikalık yıkama döngüsünden oluşan tek bir örnek deneyin uzunluğudur. IC-FPOP'un zaman kısıtlamaları, biyokimyasal sinyal basamaklarında kısa ömürlü protein katlama aralarını veya etkileşim ağları arasında var olan değişiklikleri incelemek için uygun değildir. Bu zamansal sınırlama, daha yüksek verimle donatılmış yeni bir IC-FPOP platformunun tasarımına ilham verdi.
Yerel hücre ortamında protein yüksek dereceli yapıyı doğru bir şekilde ölçmek için, yeni tasarım hücre kültürünün doğrudan lazer platformunda gerçekleştirilmesine izin verir ve bu da IC-FPOP'un yüksek verim olmasını sağlar. Bu kurulum ayrıca, yapıştırılan hücrelerin alt tabakadan çıkarılması gereken akışı kullanarak IC-FPOP'un aksine hücresel ortama en aza indirilmiş pertürbasyonlara izin verir. Yeni platform, IC-FPOP'un co2 ve sıcaklık kontrollü bir sahne üst odası kullanarak steril bir inkübasyon sisteminde gerçekleşmesine izin verirken, lazer ışını güdümü için yapılandırılmış ayna optikleri, XY hareketi için bir konumlandırma sistemi ve kimyasal değişim için peristaltik pompalar kullanır. IC-FPOP'u yürütmek için yeni platform Hareketli XY Stage (PIXY) ile Platform İnkübatörü(Şekil 1)olarak ad altındadır. PIXY'de IC-FPOP, platform inkübatör odası içinde altı kuyulu plakalarda yetiştirilen insan hücreleri üzerinde gerçekleştirilir. Bu yapılandırma için, lazer ışını, inkübatörün XY düzleminde hareket ettirilme aşaması olarak ışın uyumlu aynalar kullanılarak plakaya aşağı doğru yansıtılır, bu nedenle lazer ışını stratejik olarak aynı anda sadece bir kuyu ışınlamak için hizalanır. Doğrulama çalışmaları, IC-FPOP'un PIXY'de akış sistemine göre daha hızlı gerçekleştirilebileceğini ve protein başına amino asit modifikasyonlarının artmasına yol açtığını göstermektedir. Bu yeni IC-FPOP platformunun geliştirilmesi, hücresel deneylerden elde edilebilecek bilgileri ortaya çıkar13.
Protokol
1. Hareketli XY aşamasına sahip Platform İnkübatörü montajı
NOT: Yeni platformda kuluçka sistemi, konumlandırma aşaması ve kontrolörleri, peristaltik pompalar, 248 nm KrF excimer lazer ve imperial optik ekmek tahtasına monte edilmiş optik aynalar bulunmaktadır.
- Kuluçka sistemini monte edin: sıcaklık ünitesi, karbondioksit ünitesi, nemlendirici, hava pompası ve dokunmatik izleme sistemi (Şekil 2A-E).
NOT: Ayrıntılı montaj talimatları üretici tarafından sağlanmaktadır. Kuluçka sistemi, inkübatör içinde hücre büyütmeden önce% 5 CO2, 37 ° C ve% 85 neme stabilize edilmelidir. Bu parametreler hücre satırına bağlı olabilir. - Özel altı kuyu plakalı inkübatör, nanopozisyon tahrik aşaması ve XY tahrik aşamasını monte edin. Eski sırasıyla ikinci vidalar.
NOT: Üretici tarafından sağlanan ayrıntılı montaj talimatları. - Dört peristaltik pompayı RS-232 kabloları aracılığıyla bir "papatya zinciri" sırasına göre, kontrol eden bilgisayara bağlı bir RS-232 - USB kablosu ile bağlayın. 3,18 mm ID polimer boruları (örneğin, Tygon) her pompa kanalı silindirinde her kanala bağlayın.
NOT: Her pompanın dört silindiri vardır. Silindirlerin yönü ve akış hızı manuel olarak manipüle edilir. - Her 3,18 mm ID polimer tüpün sonuna 1/16" x 1/8" konektörler yerleştirin. Konektörün 1/16'' ucunu 1,59 ID polimer boruya yerleştirin, ardından polimer boruyu özel bağlantı noktaları aracılığıyla inkübatöre yerleştirin. Tüpün diğer ucunu IC-FPOP deneyi sırasında aşılanacak çözeltiye yerleştirin.
NOT: Perfüzyon hatları için inkübatör, kullanılan tüm reaktifleri karşılamak için çevrenin dört bir yanındaki boru hatları için 36 özel bağlantı noktasına sahiptir. - Ø2" optikler için kinematik ayna yuvası içinde bir adet 50 mm, 248 nm, 45° excimer lazer hattı aynasını 248 nm lazer diyaframından ekmek tahtasına 10-11 ızgara noktasına vidala. İkinci aynayı inkübatörün diğer tarafındaki ilkine 90° açıyla yerleştirin. İnkübatöre lazer ışını yönlendirmesi için ikinci aynayı yaklaşık 45° aşağı doğruaçılandır (Şekil 2F-J).
2. Entegrasyon yazılımı ile sistemin senkronizasyonu ve ilk otomasyonu
- Sürücüleri ve pompaları kontrol etmek için gereken entegrasyon yazılımının en son sürümünü yükleyin.
- Pompa kılavuzuna atıfta bulunarak, pompaları '5' ile başlayarak ve değeri artan şekilde yeniden adlandırın. Komutlar, entegrasyon yazılımındaki Manuel Kontrol alt programı kullanılarak pompa sistemine gönderilebilir.
NOT: Bir pompanın Kanal Modu'na ayarlanması, pompa adlandırma kuralını otomatik olarak dört pompa kanalına karşılık gelen 1, 2, 3 ve 4 olarak değiştirir. - Platform inkübatörünün otomasyonu için entegrasyon yazılım programını açın.
- Pompalar için Comport etiketli bağlantı açılır menüsünden pompa sistemi USB kablosuna karşılık gelen uygun USB bağlantı noktası aygıt adını (örneğin, COM4)seçin.
- Otomatik platform inkübatör platformu için bir komut dosyası düzenlemek/oluşturmak için Komut Dosyası Oluşturucu düğmesini tıklatın. Sırayı metin dosyası olarak kaydetmek için Komut Dosyasını Kaydet'i tıklatın (Şekil 3A).
NOT: Komut dosyası oluşturucu, komut dosyasını pompa numarası, yön, hız, hacim, boru çapı, kanal modu ve zamanlanmış gecikme tanımlarıyla tanımlamak için bir kullanıcı arayüzüne sahiptir. - Komut dosyasının yapımında kanal modu isteniyorsa, komut dosyasındaki bir adım pompayı kanal modu içinde ve dışında değiştirmeye ayrılmış olmalı ve pompa kanallarına karşılık gelen aşağıdaki adımlar pompa 1-4 olarak etiketlenmelidir.
NOT: Bu, bir platform inkübatör komut dosyası sırasında aynı anda iki pompanın kanal modunda olmamasını ve komutlar gerekli kanallara gönderildikten sonra her pompanın eski moda geri döndürülmesini sağlar. - Komut Dosyasını Oku düğmesini tıklatın ve platform inkübatör işlemi için istenen uygun komut dosyasını seçin.
- Komut dosyasını çalıştırmak için Sırayı Çalıştır düğmesini ON konumuna (yeşil) geçirin ve BAŞLAT düğmesini (Şekil 3B) tıklatın.
3. Platform inkübatördeki hücreleri büyütün
NOT: Hücreler, deneyden bir gün önce bir hücre kültürü başlığında steril koşullar altında platform inkübatörüne yerleştirilmelidir.
- Platform inkübatörunu nanopozisyon aşamasından sökün ve sıcaklık, gaz ve nemlendirici hatlarını çıkarın. İnkübatöre% 70 etanol püskürttükten sonra, bir hücre kültürü başlığına yerleştirin.
- T-175'teki hücreleri transferden önce yaklaşık% 80-90 izdiah eder.
NOT: Konfluens terimi, bir hücre kültürü çanağındaki veya mataradaki hücrelerin sayısının/kapsamının bir ölçüsü olarak kullanılır. - Ortamı çıkarın ve arabellekle durulayın.
- Trypsin-EDTA kullanarak hücreleri üreticinin protokolünü kullanarak ayırın.
- 8 mL ortama yeniden harcayın ve hücreleri sayın.
- Tohum fibronektin/ kollajen14 her kuyuda yaklaşık 90-95 μL resüspended hücre ile altı kuyu plakaları kaplanmıştır. Bu hacim, ertesi gün her kuyuda% 80-90 izdiah (~ 1.2 milyon hücre) elde etmek için uygun olacaktır.
NOT: Tohumlamadan önce altı kuyulu plakalar kolajen ile kaplanmalıdır. IC-FPOP sırasında kullanılan reaktifler hızlı akış hızları ile aşılanır. Kaplanmış plakalar, reaktiflerin infüzyonu nedeniyle hücrelerin zamanından önce ayrılmamasını sağlar. - Tohumlu plakayı platform inkübatöre yerleştirin ve kuvars kapağı ile örtün.
NOT: Tasarım ve geliştirme sırasında, bir cam inkübatör kapağı kuvars olarak değiştirildi, bu nedenle ultraviyole lazer ışığı ile uyumludur. - Platform inkübatörünü nanopozisyon tahrik aşamasına geri alın ve sabitleyin. Sıcaklık, gaz ve nemlendirici hatlarını yeniden bağlayın.
- Hücrelerin bir gecede konfluens olarak büyümesine izin verin.
NOT: Aşağıdaki hücre kültürü adımları isteğe bağlıdır ve insan hücrelerinin geçici olarak transkna olduğu denemeler için tasarlanmıştır. Bu adımlar hücre kültürü koşullarında transfeksiyon verimliliğini değerlendirir. - Chimeric protein GCaMP2 için geni içeren plazmidi ticari bir katyonik-lipid transfeksiyon kiti kullanarak HEK 293 hücrelerine transfect.
- HEK293T hücrelerinde iki altı kuyulu plakada geçici GCaMP2 transfections gerçekleştirin.
- Platform inkübatörde bir altı kuyu plakası ve standart bir CO2 inkübatöründe ikinci altı kuyu plakası inkübatör.
- Floresan mikroskobu kullanarak floresan görüntüleme ile her plakadaki transfeksiyon verimliliğini karşılaştırın.
4. Söndürme tamponu ve H2O2 yapın
- 125 mM N-tert-Butyl-α-fenilnitron (PBN) ve 125 mM N, N′-Dimetilthiourea (DMTU) içeren 100 mL söndürme tamponu yapın.
NOT: DMTU ve PBN serbest radikal leş yiyicidir ve hücre geçirgendir. - H2O2 ila 200 mM seyreltin. Her numune, her kuyunun altındaki hücre katmanını tamamen daldırmak için 6 mLH2 O2 gerektirir.
NOT: Söndürme tamponu bir gün önce yapılır ve gece boyunca 4 °C'de saklanır, ışıktan korunur. Deney günü H2O2'yi seyreltin.
5. IC-FPOP için platform inkübatörunu kurun
NOT: Platform inkübatörü steril koşullarda monte edilmelidir. İnkübatörü steril bir hücre kültürü kaputuna monte edin.
- Platform inkübatörunu konumlandırma aşamasından sökün ve sıcaklık, gaz ve nemlendirici hatlarını çıkarın.
- İnkübatöre% 70 etanol püskürttükten sonra, hücre kültürü başlığına yerleştirin.
- Altı kuyu plakasını platform inkübatörden çıkarın, plakanın orijinal kapağını sabitleyin ve mikroskop kullanarak hücre konflümanisini onaylayın.
- Hücre konfluensi onaylandıktan sonra, altı kuyu plakasını hücre kültürü kaputunun içindeki platform inkübatöründe birleştiği hücrelerle değiştirin.
- Gömülü bağlantı noktaları aracılığıyla her kuyuya üç ön kesim (15 cm) 1,59 ID polimer tüp yerleştirin. Tüpleri kuyu duvarlarına yıkayın ve özel 3D baskılı halkalarla tutun.
NOT: Altı adet 33 mm PLA filament 3D baskılı halka, hücreleri rahatsız etmeden veya lazer darbesinin önüne girmeden boruyu plakanın duvarlarına sabitlemek için özel olarak tasarlanmıştır. - Platform inkübatörü kuvars kapağı ile örtün. Konumlandırma sistemindeki sahne üstü inkübatörünü değiştirin ve sabitleyin. Sıcaklık, gaz ve nemlendirici hatlarını yeniden bağlayın.
- 1/16x1/8" konnektörlerin 1,59 ID polimer boru ucunu 1/16" uca bağlayın.
6. Platform inkübatörde IC-FPOP gerçekleştirme
- Pompa çekilmesi için bir entegrasyon yazılımı komut dosyası hazırlayın. Altı kuyudan da hücre medyasını tamamen çıkarmak için bir peristaltik pompa (Pompa 8) kullanın.
- Diğer üç peristaltik pompanın her kanalındaki asal çözücüler (Pompalar 5-7). H 2 O2'yi demleyin ve reaktifler inkübatör bağlantı noktalarına ulaşana kadar ilgili alternatif tüplerinde tamponu söndürün.
- Lazer ışının aynalar tarafından doğru açılı olduğunu ve inkübatöre sınır tanımayan bir şekilde ulaştığını onaylayın.
NOT: Lazer kullanımda olduğunda lazer güvenlik gözlükleri takılmalıdır. Oltalama/hizalama işlemi sırasında hücreleri zamanından önce ışınlamayın. Kirişi hizalarken kuvars kapağını tamamen örtmek için karton kullanın. Ayrıca, lazer ışınının her kuyunun ortasına çarptığını daha da onaylamak için altı kuyulu bir plakanın beyaz kağıdında basılı bir anahat kullanın. Hizalama için sürekli darbe ayarını en düşük frekansta ve enerjide kullanın. - Harici bir sensör kullanarak lazer enerjisini kontrol edin. 50 Hz ve 27 kV'da 160 mJ'lik tek bir lazer darbesi kullanın.
NOT: Aşağıdaki adımlar için bir zamanlayıcı gereklidir. - Işın hizalamasını onayladıktan sonra pompa infüzyonu için entegrasyon yazılımı komut dosyasını hazırlayın.
- Zamanlayıcıyı başlatın ve aynı anda tümleştirme yazılımı pompa komut dosyasındaki Başlat düğmesine basın.
- İlk kuyuya 35 mL/dk'da200mM H 2 O2 demleyin (zamanlayıcıda 6-10 saniye işareti).
NOT: Bir pompa demlenmeye başlamadan önce beş saniyelik bir gecikme vardır. Ayrıca lazerin nabzı tetiklenmesi yedi saniye sürer. Lazer darbesi H2O2 infüzyondan hemen sonra gelmelidir. - Zamanlayıcıdaki 11 saniyelik işarette darbeyi tetiklemek için lazer yazılımındaki Başlat düğmesine 5 saniye işaretinde basın.
- Lazer darbeden hemen sonra ilk kuyuya 35 mL/dk'da 125 mM söndürme çözeltisi demleyin. Bir sonraki kuyuyu lazer ışını ile hizalamak için konumlandırma aşamasını manuel olarak hareket ettirin.
- Yukarıdaki 6.5-6.9 adımlarını her kuyu işlenene kadar tekrarlayın.
NOT: IC-POP, üç lazer ve üç lazer dışı numunenin teknik triplicatesinde gerçekleştirilir. İşlenmiş altı kuyulu bir plaka bir biyolojik kopya görevi görür. - Bir hücre kültürü başlığında, hücreleri her kuyudan ayrı 15 mL konik tüplere aktarmak için bir hücre kazıyıcı kullanın. 5 dakika boyunca 1.200 x g'da santrifüj hücreleri.
- 100 μL RIPA liziz tamponunda süpernatant ve resuspend hücrelerini atın.
- Hücreleri tek tek 1,2 mL polipropilen tüplere aktarın.
- Tüm numuneleri sıvı nitrojen içinde flaşla dondurun ve kullanıma kadar -80 °C dondurucuya yerleştirin.
NOT: Protokol burada duraklatılabilir.
7. Protein ekstraksiyonu, saflaştırma ve proteoliz
- Numuneleri çözün ve 95 °C'de bir ısı bloğunda 5 dakika ısıtın.
- Isıtma sonrası buz üzerinde 5 dakika soğutun.
- Tek iplikli, çift telli, doğrusal ve dairesel DNA ve RNA'yı bozmak ve 15 dakika boyunca oda ılımanlığında kuluçkaya yatmak için hücre lisatine 25 birim çekirdek ekleyin.
- 4 °C'de 10 dakika boyunca 16.000 x g'da santrifüj örnekleri.
- Süpernatant toplayın ve temiz bir polipropilen tüpe aktarın.
- Kolorimetrik protein tahlili kullanarak protein konsantrasyonuna bakın.
- 100 μg numuneyi temiz bir polipropilen tüpe aktarın ve hücre liziz tamponu ile 100 μL'ye getirin.
- 50 °C'de 10 mM dithiothreitol (DTT) ile numuneleri 45 dakika azaltın.
- Numuneleri 10 dakika boyunca oda sıcaklığında soğutin.
- 20 dakika boyunca oda sıcaklığında 50 mM iodoasetamid (IAA) ile alkilat.
NOT: IAA'yı ışıktan koruyun - 460 μL önceden soğutulmuş (-20 °C) aseton ekleyin. Girdap örnekleri ve bir gecede -20 °C'ye yerleştirin.
NOT: Protokol burada duraklatılabilir. - Ertesi gün, 4 °C'de 10 dakika boyunca 16.000 x g'da santrifüj örnekleri.
- Protein peletini bozmadan asetonu çıkarın.
- 50 μL% 90 önceden soğutulmuş (-20 °C) aseton ekleyin. Vorteks, 4 °C'de ek 5 dakika boyunca 16.000 x g'da karıştırmak ve santrifüj yapmak için örnekler.
- Asetonları çıkarın ve numuneleri 2-3 dakika kurutun.
- Protein peletlerini 10 mM Tris tampon pH 8 ile yeniden biriktirin.
- MS sınıfı tripsinleri (20 μg stok) 40 μL 10 mM Tris tampon pH 8'de yeniden depoleyin ve her numuneye 2,5 μg tripsin ekleyin.
- Numuneleri bir gecede 37 °C'de kuluçkaya yatırın.
NOT: Protokol burada duraklatılabilir. - Renk ölçümü peptit tahlili kullanarak peptit konsantrasyonu değerlendirin.
- Örnekleri% 5 formik asitle söndür.
- 10 μg numuneyi temiz bir polipropilen tüpe aktarın.
- Numuneyi vakum santrifüjü kullanarak kurutun ve suda 20 μL MS sınıfı % 0,1 formik asit (FA) ile yeniden ıslatın.
- Her numuneyi ön yarık kapaklı temiz otomatik örnekleyici şişelere aktarın.
8. Yüksek performanslı Sıvı Kromatografisi-Tandem Kütle Spektrometresi (LC-MS/MS)
- FPOP değişikliklerini yerelleştirmek için, LC-MS/MS çözümlemesi kullanarak sindirilen hücre lisatını çözümle.
- Suda %0,1 FA (A) ve asetonitrilde (ACN) (B) %0,1 FA mobil faz kullanın.
- 180 μm x 20 mm C18 (5 μm ve 100 Å) bindirme kolonuna 0,5 μg numune yükleyin ve sütunu % 99 (A) ve% 1 (B) ile 15 dakika boyunca yıkayın.
- 75 μm x 30 cm C18 (5 μm ve 125 Å) analitik sütun kullanarak, 120 dakika boyunca 0.300 μL / dk akış hızına sahip sindirilmiş peptitleri elute ve ayrı olarak.
- LC gradyanini aşağıdaki gibi çalıştırın: 0−1 dk, %3 solvent B; 2−100 dk, %10−45 B;100−110 dk, %45-100 B; 110−115 dk, %100 B.
- Sütunu 115-116 dakikadan %3 (B) olarak yenileyin ve 116-120 dakikadan itibaren %3 'te (B) tutun.
- Nano elektrospray iyonizasyon ile pozitif iyon modunda eluted peptitleri analiz edin.
- MS1 spektrumunu 60.000 çözünürlükte 375-1500 m/z tarama aralığında unun.
- Otomatik kazanç kontrolü (AGC) hedefini maksimum 50 ms enjeksiyon süresi ve5,0e 4 yoğunluk eşiği ile 5,0e5 olarak ayarlayın.
- 1,2 m/z yalıtım penceresi ve 4 saniyelik bir döngü süresi ile veriye bağımlı edinme (DDA) aracılığıyla 2-6 şarj durumları ile öncü iyonları yalıtın.
- MS2 iyonlarını yüksek enerjili çarpışma dissosiyatifine (HCD) (%32 normalleştirilmiş enerji) maruz bırak.
- 1 MS/MS alımından sonra peptitleri 60 saniye boyunca hariç tutun.
- MS/MS çözünürlüğünü 5,0e 4 AGC hedefi ve maksimum35 ms enjeksiyon süresiyle 15.000 olarak ayarlayın.
9. Proteome keşifçisi/veri işleme
- İlgili bir Homo sapiens protein veritabanı ve sindirme enzimine karşı mevcut aşağıdan yukarıya proteomik analiz yazılımında tandem ham veri dosyalarını arayın.
- Protein analizi arama parametrelerini ayarlayın.
- Parça toleransı 0,02 Da ve üst iyon toleransı 10 ppm olarak ayarlayın.
- Trypsin için enzim özgüllüğünü ayarlayın ve bir kaçırılan bölünmeye izin verin.
- Kütle aralığını 375-1500 m/z olarak ayarlayın.
- Peptit güvenini %95 (orta) ve kalıntı güvenini %99 (yüksek) olarak belirleyin.
- %5'lik keşif oranı (FDR) filtresi ile en az iki farklı peptit tanımlanmışsa proteinleri kabul edin.
- Karbamidometilasyonu statik bir modifikasyon ve bilinen tüm hidroksil radikal yan zincir modifikasyonlarını dinamik değişiklikler olarak15,16 olarak ayarlayın.
- Dosyalar aramayı tamamladıktan sonra, sırayı, değişiklik konumlarını, protein üyeliğini, spektrum dosyasını, öncü bolluğunu ve saklama süresi bilgilerini elektronik bir veritabanına verin.
- Bu denklemden peptit veya kalıntı başına değişiklik kapsamını hesaplayın:
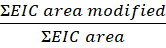
NOT: Değiştirilen EIC alanı, oksidatif modifikasyonlu peptit veya kalıntının ayıklanmış iyon kromatografik alanıdır (EIC), EIC alanı ise oksidatif modifikasyonlu ve oksidatif modifikasyon olmadan aynı peptit veya kalıntının toplam alanıdır. Zamanla, hidrojen peroksit varlığında protein oksitlenecek ve arka plan oksidasyonlarına neden olacaktır. Modifikasyonun kapsamını hesaplamak için, modifiye peptit alanı toplam alana bölünür. Işıtılmamış bir denetim örneği, arka plan oksidasyonu için hesaplar. Kontrol örneğinden arka plan oksidasyonu, bir FPOP değişikliğini tanımlamak için lazerle işlenmiş numuneden çıkarılır.
Sonuçlar
Platform inkübatör koşullarının lazer platformundaki hücre kültürü için yeterli olduğunu doğrulamak için, GCaMP2 geçici olarak HEK293T'ye transkseptif olarak transksepsiyon edildi ve her iki plaka için transfeksiyon verimliliği floresan görüntüleme ile değerlendirildi (Şekil 4A). GCaMP2, genetik olarak kodlanmış hücre içi kalsiyum göstergesi olarak kullanılan kalsiyum algılamalı bir floresan proteindir. Yeşil floresan protein (GFP) ve kalsiyum bağlayıcı protein calmodulin'in bir füzyonudur. Transeksiyon verimliliğini ölçmek için PLASMID PRL-TK ile trans enfekte olmuş HEK 293 hücreleri üzerinde luciferaz tahlili yapıldı (Şekil 4B). Bu sonuçlar, platform inkübatörünün standart inkübatörün performansını aştığını ve transfeksiyon verimliliğinde 1,13 kat artış sağlayarak optimal hücre kültürü ortamı için nicel bir kıyaslama sağladığını göstermektedir.
Akış sisteminde etiketlenen HEK293T hücrelerindeki FPOP modifikasyonları, platform inkübatörde etiketlenenlerle karşılaştırıldı ve platform inkübatörünü hem modifiye protein sayısındahemde bu proteinlerdeki toplam FPOP kapsama alanında akış sistemini geride bıraktı. Platform inkübatöründe elde edilen FPOP modifiye proteinlerinin sayısı yaklaşık 1051 idi, tipik bir deneyde elde edilenlerden 2.2 kat daha fazlaydı. Değişiklikler her deney için iki biyolojik kopya arasında birleştirildi. Ayrıca, PIXY daha yüksek verim sağlar.
Bir proteinde daha yüksek modifikasyon kapsamının avantajını göstermek için, IC-FPOP modifikasyonları peptit seviyesinde lokalize edildi ve 375 amino asit proteini olan aktin için sistemler arasındaki sonuçlardaki farklılıkları ayırt etmek için modifikasyonun kapsamı ölçüldü. Akış sisteminde, sınırlı yapısal bilgi sağlayan iki modifiye peptit tespit edildi (Şekil 6A). Bununla birlikte, platform inkübatörde aktin dizisini kapsayan beş modifiye peptit tespit edildi. Tandem kütle spektrumu, Pro322 kalıntılarının her deneyde hem değiştirildiğini hem de tespit edildiğini gösterir (Şekil 6B). Platform inkübatör örneklerinde modifiye edilen beş peptit on iki modifiye kalıntı içerirken, akış sistemi ile sadece dört kalıntı değiştirildi (Şekil 6C). Oksidasyon kapsamındaki artış protein genelinde daha yapısal bilgiler sağlar.
Espino ve ark. insan hastalığı durumları için bir solucan modeli olan C. elegansiçinde in vivo (IV-FPOP) olarak gerçekleştirilecek FPOP kapasitesini gösterdi17. IV-FPOP bir akış sistemi üzerinden de gerçekleştirilirken, PIXY sistemi solucanlarla uyumluluk için test edildi. Platform inkübatörde her kuyuda 20 °C'de yaklaşık 10.000 solucan inkübe edildi LC−MS/MS analizi, platform inkübatörde IV-FPOP tarafından akış sistemi ile modifiye edilen 545 proteine kıyasla 792 proteinin modifiye edildiğini ortaya koydu(Şekil 7). Bu sonuçlar, 2D hücre kültürüne ek olarak, bu yeni metodolojinin C. elegansgibi diğer biyolojik sistemlerin çalışmasıyla da uyumlu olduğunu göstermektedir.
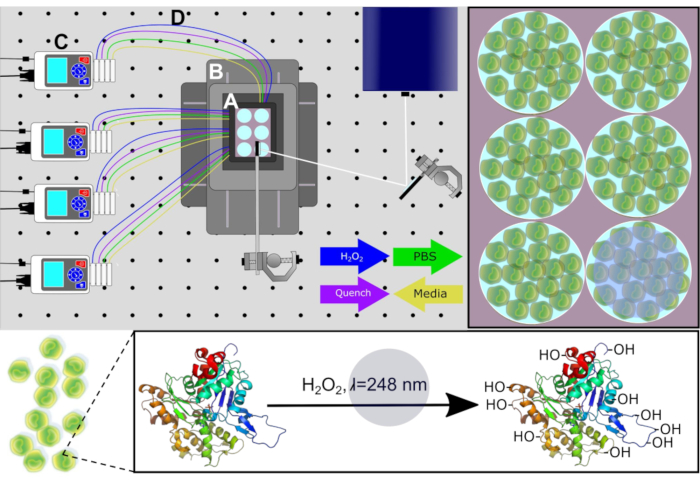
Şekil 1. PIXY Sisteminin Şeması. Sistem bileşenleri: (A) kademeli inkübatör, (B) konumlandırma sistemi , (C) peristaltik pompalar ve (D) perfüzyon hatları. Hücre kültürü ortamı, H 2O 2ve söndürme çözeltileri hesaplanan zaman noktalarında aşılanmadan önce pompalar aracılığıyla her kuyudan çıkarılır. Işıtlama için lazer yolu beyaz renkte sergilendi. Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Hareketli XY Stage ile Bir Platform İnkübatöründe Hücre içi Hızlı Fotokimyasal Oksidasyon Uygulama izni ile yeniden basılmıştır. Analitik Kimya, 92(2), 1691-1696 2019. Telif Hakkı 2020 Amerikan Kimya Derneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2. Tamamen Monte PIXY sistemi. (A) Dokunmatik izleme sistemi, (B) karbondioksit ünitesi, (C) sıcaklık ünitesi, (D) hava pompası, (E) nemlendirici, (F) optik aynalar, (G) platform inkübatörü, (H) konumlandırma aşaması, (I) 248nm KrF ekscimer lazer ve (J) peristaltik pompalar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
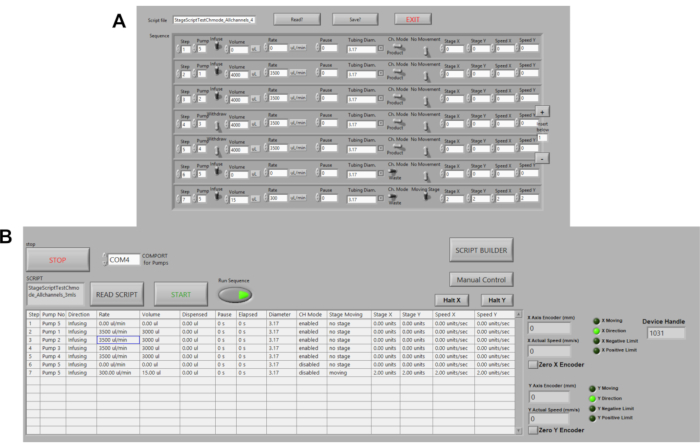
Şekil 3. Peristaltik Pompaların Otomasyonu. (A) LABVIEW'de örnek komut dosyası. Komut seçenekleri arasında ses düzeyi, akış hızı, duraklamalar, akış yönü bulunur. Hız, sahne mesafesi ve konum şu anda otomatik hale veriliyor. (B) LABVIEW'de komut dosyası okuyucusu. Burada, komut komut dosyaları yüklenir ve ardından pompaları başlatmak için Sırayı Çalıştır ve BAŞLAT tuşuna basılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
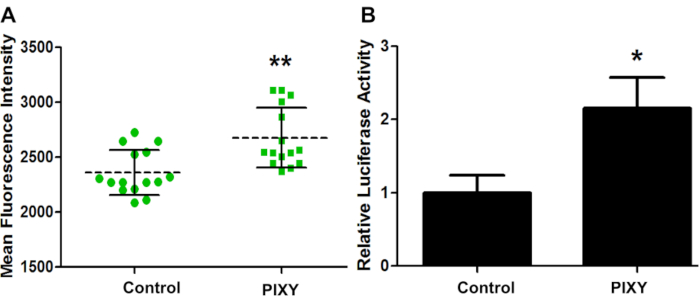
Şekil 4. HEK hücre transeksiyon verimliliği. (A) Standart inkübatör (Kontrol) ve stage-top inkübatör (PIXY) arasında GCaMP2 transfeksiyon karşılaştırmasının ortalama floresan yoğunluğu. Noktalar ve kareler, bir önlemin alındığı bir kuyudaki her noktayı temsil eder. (B) Transfeksiyon verimliliği, farklı bir vektör plazmid, pRL-TK ile nicelleştirilmiş ve doğrulanmıştır. P değeri< 0.005. Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Hareketli XY Stage ile Bir Platform İnkübatöründe Hücre içi Hızlı Fotokimyasal Oksidasyon Uygulama izni ile yeniden basılmıştır. Analitik Kimya, 92(2), 1691-1696 2019. Telif Hakkı 2020 Amerikan Kimya Derneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
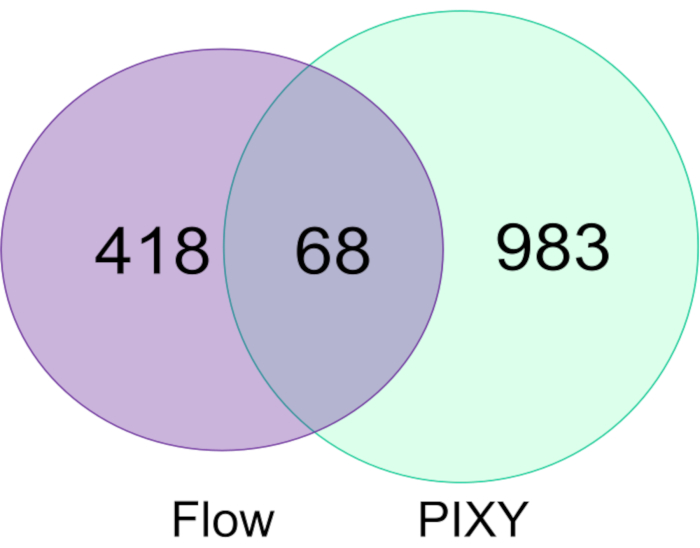
Şekil 5. Tek hücre akış sisteminde ve PIXY'de modifiye proteinlerin karşılaştırılması. Akış sisteminde (mor) ve PIXY'de (yeşil) kullanılarak değiştirilen proteinlerin venn diyagramı. Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Hareketli XY Stage ile Bir Platform İnkübatöründe Hücre içi Hızlı Fotokimyasal Oksidasyon Uygulama izni ile yeniden basılmıştır. Analitik Kimya, 92(2), 1691-1696 2019. Telif Hakkı 2020 Amerikan Kimya Derneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
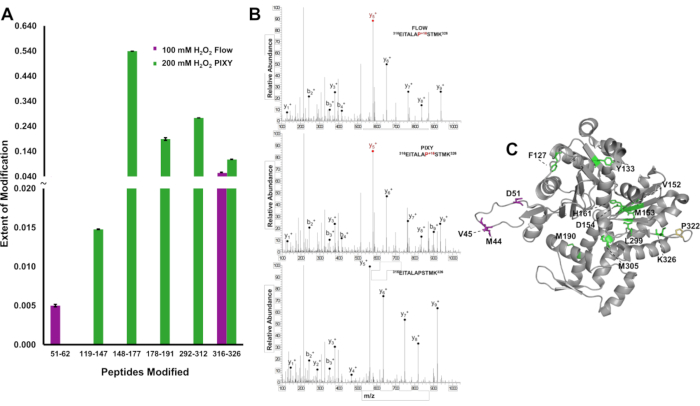
Şekil 6. IC-FPOP değişikliklerinin yerelleştirilmesi. Sistemler arasında IC-FPOP değişikliklerinin karşılaştırılması. (A) Akış sisteminden (mor) ve platform inkübatöründen (yeşil) aktin içindeki oksidatif olarak değiştirilmiş peptitlerin çubuk grafiği. (B) Her iki sistemde de modifiye proline ve değiştirilmemiş aktin peptit (C) FPOP modifiye aktin kalıntılarına sahip aktin (peptit 316-326) tandem MS spektrumu (PDB: 6ZXJ, zincir A platform inkübatörde 11 modifiye kalıntı (yeşil), akış sisteminde 3 modifiye kalıntı (mor), 1 üst üste gelen modifiye kalıntı (sarı). Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Hareketli XY Stage ile Bir Platform İnkübatöründe Hücre içi Hızlı Fotokimyasal Oksidasyon Uygulama izni ile yeniden basılmıştır. Analitik Kimya, 92(2), 1691-1696 2019. Telif Hakkı 2020 Amerikan Kimya Derneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
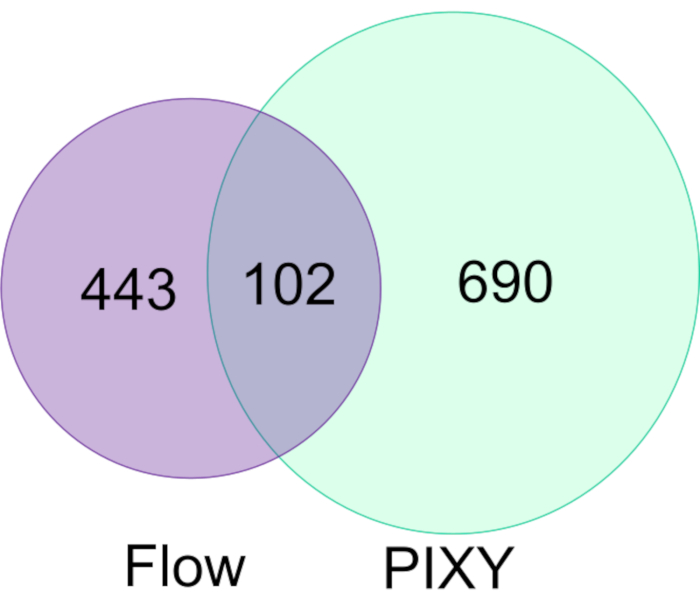
Şekil 7. C. elegans'taki FPOP modifiye proteinlerinin akışa ve PIXY'ye göre karşılaştırılması. Akış sistemine kıyasla PIXY kullanan oksidatif olarak değiştirilmiş proteinlerde 1,5 kat artış vardır. Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L.M., Hareketli XY Stage ile Bir Platform İnkübatöründe Hücre içi Hızlı Fotokimyasal Oksidasyon Uygulama izni ile yeniden basılmıştır. Analitik Kimya, 92(2), 1691-1696 2019. Telif Hakkı 2020 Amerikan Kimya Derneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1. İş akışı değişikliği dağıtımı ve kütle kaymaları (Da). Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Proteinler işin çoğunu canlı hücrelerde gerçekleştirir. Bu önem göz önüne alındığında, daha büyük komplekslerdeki inceliklerin ve hücrelerdeki enzymatic reaksiyonların saflaştırılmış sistemlerin aksine anlaşılmasını derinleştirmek için hücresel ortamda protein fonksiyonu ve daha yüksek sıra yapısı (HOS) hakkında ayrıntılı verilere ihtiyaç vardır. Bunu yapmak için, Proteinlerin Hücre İçi Hızlı Fotokimyasal Oksidasyonu (IC-FPOP) başlıklı bir hidroksil radikal protein ayak baskısı (HRFP) yöntemi benimsenmiştir. Çoğu FPOP çalışması nispeten saf protein sistemlerinde in vitro olarak yapılmıştır, bu da bağlayıcı etkileşimleri ve protein konformasyon dinamiklerini etkileyen kalabalık moleküler ortamla belirgin bir şekilde tezat oluşturur. Sonuç olarak, in vitro deneyler18'den elde edilen bulgular ile gerçek bir hücresel ortamda elde edilecek bulgular arasında bir uçurum vardır. Bir in vitro FPOP deneyinin idealize edilmiş koşulları ile hücrenin karmaşık doğası arasındaki boşluğu kapatmak için, hücre-FPOP platformunda altı kuyulu yeni bir otomatik plaka tabanlı geliştirilmiştir. Bu yeni FPOP teknolojisi, bu moleküler türleri tanımlayıp karakterize edebilir ve hem sağlıklı hem de hastalıklı durumlarda dinamik moleküler etkileşimlerini takip edebilir. Bu yeni platforma Hareketli XY aşamasına (PIXY) sahip Platform Inkübatörü denir.
FPOP, proteom içindeki yapısal bilgileri karakterize etmek için başarıyla kullanılmıştır. Bununla birlikte, her biyolojik tekniğin daha fazla iyileştirme gerektiren belirli sınırlamaları vardır. Lazer fotoliz sırasında ve reaktifsiz hidroksil radikallerini verimli bir şekilde söndürmek için spesifik reaktifler gereklidir. Sindirilmiş peptitlerin ayrılması, yapısal bilgileri en üst düzeye çıkarmak için büyük miktarda zaman gerektirebilir. Bu bilgi zenginliği, MS sonrası veri analizi sırasında da kapsamlı nicelik gerektirebilir1. Hücre kültürü için gerekli periferik makineler ve lazer platformundaki IC-FPOP da dahil olmak üzere platform inkübatörü, bazı laboratuvarlar için mümkün olmayabilecek büyük bir maliyetle birlikte gelir. İlerleme kaydedilmeye devam ettikçe, sağlam yazılım ve analiz araçları tekniği daha da ilerletmelidir; bazıları bu çalışmada sergilenmiştir. Bu platform inkübatörde güncel çalışmalar HEK293T hücrelerinde ve C. elegans'ta gerçeklenmiştir. IC-FPOP yönteminin Çin hamster yumurtalığı (CHO), Vero, MCF-7 ve MCF10-A hücreleri19dahil olmak üzere çok çeşitli hücre hatları ile uyumlu olduğu gösterilmiştir. Genel IC-FPOP yöntemi bu statik platforma çevrilebilir olduğundan, bu hücre hatları PIXY kullanılarak da çalışmaya uygun olmalıdır.
IC-FPOP, amino asitlerin solventle erişilebilir yan zincirlerini oksidatif olarak değiştirmek içinH2 O2'yi kullanır, daha sonra biyolojik bağlam sağlamada önemli olan canlı hücreler içindeki protein etkileşimlerini, yapısını ve metabolik etkilerini daha da ayırt eder. Hücrelerin H2O2 ilavesinden sonra uygulanabilir olduğunu doğrulamak için bir IC-FPOP deneyinden önce gereklidir. Hücre canlılığı çalışmaları, hücrelerin200mM 13'ekadar H2 O 2 konsantrasyonlarının varlığında uygulanabilir olduğunu göstermiştir. H 2O 2'ninortam çıkarıldıktan sonra doğrudan hücrelere 200 mM'lik son bir konsantrasyonda aşılandığından emin olmak da önemlidir. Hücre kültürü ortamlarının tamamen kaldırılmaması, değişen konsantrasyonlarda H2O2. Standart koşullarla karşılaştırıldığında, kuluçka süresinin 10 saniyeye çıkarılması ve H2O2 konsantrasyonunun artırılması, platform inkübatörde IC-FPOP tarafından değiştirilen daha yüksek sayıda proteine yol açtı. Pompaların düzgün çalıştığından ve sıvının dağıldığından emin olmak için kullanmadan önce peristaltik pompaların astar edilmesi zorunludur. Bunun yapılmaması boruda hava kabarcıklarına, hücreleri batırmak için yetersiz H2O2 hacmine ve/veya yetersiz söndürme çözeltisine neden olabilir.
Ortaya çıkabilecek bir diğer konu da sistemdeki istenmeyen gecikmelerdir. Bunun bir örneği, entegrasyon yazılımını kullanarak 1000 veya daha fazla milisaniyelik siparişte önemli gecikmeler ekleyen pompa sistemleri için alınan komutları doğrulama işlemidir. Bu sorun, deney sırasında pompalarla iletişimi en aza indirerek ve önceden ayarlanmış komutları mümkün olduğunca önceden kullanarak düzeltilebilir.
Gelecekte, PIXY için hedef tam otomatik ve entegre bir sistem üretmektir. Peristaltik pompalara ek olarak, lazer darbesinin tetiklenilmesi otomatikleştirilecektir. Hız ve doğruluğu artırmak için platform inkübatörünün hızlı hareketi için yeni bir konumlandırma sistemi de kullanılacaktır. Sistemin tüm bileşenleri, verimi daha da artırmak için entegrasyon yazılımı kullanılarak programlanarak programlanarak devam edecektir.
Açıklamalar
Yazarlar rakip finansal çıkar beyanda bulunmİyorlar.
Burada sunulan araştırma, aşağıda atıfta bulunulmuş patent başvurusu ile ilişkilidir:
ABD Geçici Olmayan Patent Başvuru Numarası: 17/042.565
Başlık: "Protein Katlamayı Belirleme Cihaz ve Yöntemi"
UMB Docket Numarası: LJ-2018-104 UMass Ref: UMA 18-059.
Teşekkürler
Bu çalışma NIH R01 GM128983-01'den bir hibe ile desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ismatec Reglo ICC Peristaltic Pumps | Cole-Palmer | 122270050 | |
| Kinematic Mirror Mount for Ø2" Optics | Thor Labs | ||
| 10X trypsin−EDTA | Corning | AB00490-00005 | |
| 50.0mm 248nm 45°, Excimer Laser Line Mirror | Edmond Optics | ||
| Acetone, HPLC Grade | Fisher Scientific | ||
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | ||
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 23275 | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| ACQUITY UPLC M-Class System | Waters | A53225 | |
| Afinia H480 3D Printer | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| air pump | OKOlabs | D12345 | |
| Aluminum Foil | Fisher Scientific | Stock #63-120 | |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | ||
| carbon dioxide unit | OKOlabs | MadMotor®-UHV | |
| Centrifuge | Eppendorf | ||
| connectors (Y PP 1/16” and 1/16x1/8”) | Cole-Palmer | 116891000 | |
| Delicate Task Wipers | Fisher Scientific | 022625501 | |
| Dithiothreiotol (DTT) | AmericanBio | ||
| DMSO, Anhydrous | Invitrogen | LS118-500 | |
| Dulbecco’s phosphate-buffered saline (DPBS) | Corning | SK-78001-82 | |
| EX350 excimer laser | GAM Laser | PI89900 | |
| Fetal bovine serum (FBS) | Corning | SK-12023-78 | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| HEK293T cells | Paul Shapiro Lab (University of Maryland Baltimore) | ||
| humidifier | OKOlabs | Nano-LPMW stage | |
| HV3-2 VALVE | Hamilton | BP152-500 | |
| Hydrogen Peroxide | Fisher Scientific | LS120-500 | |
| Iodoacetamide (IAA) | ACROS Organics | ||
| LABVIEW Professional 2018 | National Instruments | 86728 | |
| MadMotor Positioning system and controllers | Mad City Labs | W6-4 | |
| Methanol, LC/MS Grade | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Microcentrifuge | Thermo Scientific | H301-T Unit-BL-PLUS | |
| N,N′-Dimethylthiourea (DMTU) | ACROS Organics | ||
| Nanopositioinging stage | Mad City Labs | ||
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | ||
| OKO Touch Monitoring System | OKOlabs | ||
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | 7Z02936 | |
| PE50-C pyroelectric energy meter | Ophir Optronics | ||
| Penicillin-streptomycin | Corning | ||
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | ||
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | ||
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 75002436 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 06-666A | |
| pressure gauge | OKOlabs | OKO-AIR-PUMP-BL | |
| PTFE filter | OKOlabs | CO2-UNIT-BL | |
| Six 33 mm PLA filament rings | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| sterile incubator | OKOlabs | ||
| temperature unit | OKOlabs | OKO-TOUCH | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | A117-50 | |
| TiNKERcad | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| Tris Base | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| tubing (Tygon 3.18 and 1.59 ID) | Cole-Palmer | 177350250 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Water, LC/MS Grade | Fisher Scientific | 88702 | |
| 90058 | |||
| KM200 | |||
| 186007496 |
Referanslar
- Johnson, D. T., Di Stefano, L. H., Jones, L. M. Fast photochemical oxidation of proteins (FPOP): A powerful mass spectrometry based structural proteomics tool. Journal of Biological Chemistry. 294 (32), 11969-11979 (2019).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemical Reviews. 120 (10), 4355-4454 (2019).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-883 (2019).
- Zhao, B., et al. Covalent Labeling with an α,β-Unsaturated Carbonyl Scaffold for Studying Protein Structure and Interactions by Mass Spectrometry. Analytical Chemistry. 92 (9), 6637-6644 (2020).
- Hambly, D. M., Gross, M. L. Laser Flash Photolysis of Hydrogen Peroxide to Oxidize Protein Solvent-Accessible Residues on the Microsecond Timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Li, K. S., Shi, L., Gross, M. L. Mass Spectrometry-Based Fast Photochemical Oxidation of Proteins (FPOP) for Higher Order Structure Characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Chea, E. E., Jones, L. M. Modifications generated by fast photochemical oxidation of proteins reflect the native conformations of proteins. Protein Science. 27 (6), 1047-1056 (2018).
- Hambly, D., Gross, M. Laser flash photochemical oxidation to locate heme binding and conformational changes in myoglobin. International Journal of Mass Spectrometry. 259 (1), 124-129 (2007).
- Yan, Y. Fast photochemical oxidation of proteins (FPOP) maps the epitope of EGFR binding to adnectin. Journal of the American Society for Mass Spectrometry. 25 (12), 2084-2092 (2014).
- Zhang, Y., Wecksler, A. T., Molina, P., Deperalta, G., Gross, M. L. Mapping the Binding Interface of VEGF and a Monoclonal Antibody Fab-1 Fragment with Fast Photochemical Oxidation of Proteins (FPOP) and Mass Spectrometry. Journal of the American Society for Mass Spectrometry. 28 (5), 850-858 (2017).
- Espino, J. A., Mali, V. S., Jones, L. M. In Cell Footprinting Coupled with Mass Spectrometry for the Structural Analysis of Proteins in Live Cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L. M. Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytical Chemistry. 92 (2), 1691-1696 (2019).
- Bangel-Ruland, N., et al. Cystic fibrosis transmembrane conductance regulator-mRNA delivery: a novel alternative for cystic fibrosis gene therapy. The Journal of Gene Medicine. 15 (11-12), 414-426 (2013).
- Gau, B. C., Chen, H., Zhang, Y., Gross, M. L. Sulfate Radical Anion as a New Reagent for Fast Photochemical Oxidation of Proteins. Analytical Chemistry. 82 (18), 7821-7827 (2010).
- Xu, G. C., et al. Hydroxyl Radical-Mediated Modification of Proteins as Probes for StructuralProteomics. Chemical Reviews. American Chemical Society. 107 (8), 3514-3543 (2007).
- Espino, J. A., Jones, L. M. Illuminating Biological Interactions with In Vivo Protein Footprinting. Analytical Chemistry. 9 (10), 6577-6584 (2019).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast Photochemical Oxidation of Protein Footprints Faster than Protein Unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Kaur, U., Johnson, D. T., Jones, L. M. Validation of the Applicability of In-Cell Fast Photochemical Oxidation of Proteins across Multiple Eukaryotic Cell Lines. Journal of the American Society for Mass Spectrometry. 31 (7), 1372-1379 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır