Method Article
Платформа инкубатора с Movable XY этап: Новая платформа для реализации в ячейке быстрой фотохимической окисления белков
В этой статье
Резюме
Новая статическая платформа используется для характеристики белковой структуры и взаимодействия сайтов в родной клеточной среде с использованием метода следа белка называется в клетке быстрого фотохимического окисления белков (IC-FPOP).
Аннотация
Быстрая фотохимическая окисление белков (FPOP) в сочетании с масс-спектрометрией (MS) стала бесценным инструментом в структурной протеомии для допроса белковых взаимодействий, структуры и конформациальной динамики белка как функции доступности растворителя. В последние годы сфера применения FPOP, метода гидроксилового радикального белка (HRPF), была расширена до маркировки белка в живых клеточных культурах, обеспечивая средства для изучения белковых взаимодействий в запутанной клеточной среде. Модификации внутриклеточного белка могут дать представление о лиганде, индуцированных структурных изменениях или конформациальных изменениях, сопровождающих образование белкового комплекса, все в клеточном контексте. Белковый след был достигнут с использованием обычной системы на основе потока и 248 нм лазера KrF excimer для получения гидроксиловых радикалов с помощью фотолиза перекиси водорода, требуя 20 минут анализа для одного образца клетки. Для облегчения экспериментов FPOP, решенных во времени, было впервые использовать новую платформу IC-FPOP на основе 6-колодец. В нынешней системе один лазерный импульс облучает всю колодец, что усеивает экспериментальные сроки FPOP, что приводит к 20 секундам времени анализа, что в 60 раз уменьшается. Это значительно сократило время анализа позволяет исследовать клеточные механизмы, такие как биохимические сигнальные каскады, сворачивание белков и дифференциальные эксперименты (т.е. без наркотиков против наркотиков) в зависимости от времени. Этот новый прибор, озаглавленный Платформа инкубатор с Movable XY этап (PIXY), позволяет пользователю выполнять клеточной культуры и IC-FPOP непосредственно на оптической скамейке с помощью платформы инкубатора с температурой, CO2 и контроля влажности. Платформа также включает в себя этап позиционирования, перистальтические насосы и зеркальную оптику для наведения лазерного луча. Условия IC-FPOP, такие как конфигурация оптики, скорость потока, переходные трансфекции и концентрация H2O2 в PIXY, были оптимизированы и рецензировано. Автоматизация всех компонентов системы позволит снизить манипуляции человека и увеличить пропускную способность.
Введение
Методы следа протеина могут показать глубокую информацию на организации протеинов. Эти основные структурные биологии MS-методы являются компонентом масс-спектрометрии инструментарий. Эти методы зонд белка высшей структуры порядка (HOS) и синергии черезковалентную маркировку 1,2,3,4. Быстрое фотохимическое окисление белков (FPOP) использует гидроксиловые радикалы для окислительного изменения растворителя доступныхбоковых цепей аминокислот 5,6 (Таблица 1). Метод использует эксимерный лазер на 248 нм для фотолиза перекиси водорода (H2O2) для генерации гидроксиловых радикалов. Теоретически, 19 из 20 аминокислот могут быть окислительно изменены с Gly является единственным исключением. Однако из-за различных показателей реактивности аминокислот с гидроксильными радикалами, модификация только подмножества из них наблюдалась экспериментально. Тем не менее, метод имеет потенциал для анализа по длине последовательности белка5. FPOP изменяет белки на микросекундной шкале времени, что делает его полезным в изучении слабых взаимодействий с быстрыми темпами. Доступность растворителя изменяется при связывании лиганда или изменении конформации белка, таким образом, сила метода заключается в сравнении модели маркировки белка в нескольких состояниях (т.е. без лиганда по сравнению с лиганд-связанным). В результате, FPOP был успешным в выявлении белково-белкового и белково-лигандового взаимодействия сайтов и регионов конформацииизменения 7,8,9,10. Метод FPOP был расширен от изучения очищенных белковых систем до анализа в клетках. В-клеток FPOP (IC-FPOP) может окислительно модифицировать более тысячи белков в клетках, чтобы обеспечить структурную информацию черезпротеом 11,12. Обычная платформа IC-FPOP использует систему потока для потока ячеек одного файла мимо лазерного луча. Развитие этой системы позволило отдельным клеткам иметь равное воздействие лазерного облучения. Это привело к 13-кратному росту числа окислительно помеченных белков12. Однако ограничением системы потока является длина одного выборочного эксперимента, состоящего из 10-минутного интервала облучения, в течение которого происходит модификация, и дополнительного 10-минутного цикла стирки. Временные ограничения IC-FPOP делают его непригодным для изучения недолговечных белковых складных промежуточных или изменений, которые существуют между сетями взаимодействия в биохимических сигнальных каскадах. Это временное ограничение вдохновило на разработку новой платформы IC-FPOP, оснащенной более высокой пропускной способностью.
Для точного измерения структуры белка более высокого порядка в родной клеточной среде, новый дизайн позволяет клеточной культуры, которая будет осуществляться непосредственно на лазерной платформе, что позволяет IC-FPOP быть высокой пропускной способностью. Эта установка также позволяет свести к минимуму возмущения клеточной среды, в отличие от IC-FPOP, используя поток, где адепт клетки должны быть удалены из субстрата. Новая платформа позволяет IC-FPOP происходить в стерильной инкубационной системе с использованием CO2 и температурно-контролируемой верхней камеры при использовании настроенной зеркальной оптики для наведения лазерного луча, системы позиционирования для движения XY и перистралтических насосов для химического обмена. Новая платформа для проведения IC-FPOP озаглавлена «Инкубатор платформы» с Movable XY Stage (PIXY)(рисунок 1). В PIXY IC-FPOP осуществляется на клетках человека, выращенных в шести хорошо пластин в камере инкубатора платформы. Для этой конфигурации лазерный луч отражается вниз на пластину, используя зеркала, совместимые с лучом, как этап позиционирования, который держит инкубатор перемещается, в XY-самолете, так что лазерный луч стратегически выровнен только облучать один хорошо за один раз. Валидация исследования показывают, что IC-FPOP может быть выполнена быстрее в PIXY, чем в системе потока и приводит к увеличению аминокислотных модификаций на белок. Разработка этой новой платформы IC-FPOP будет изложена на знаниях, которые могут быть получены из клеточных экспериментов13.
протокол
1. Сборка инкубатора платформы со сценой Movable XY
ПРИМЕЧАНИЕ: Новая платформа включает в себя инкубационные системы, этап позиционирования и контроллеры, перистальтические насосы, 248 нм Excimer лазер KrF, и оптические зеркала, собранные на императорской оптической доске.
- Сборка инкубационой системы: блок температуры, блок двуокиси углерода, увлажнитель, воздушный насос и система сенсорногомониторинга (рисунок 2A-E).
ПРИМЕЧАНИЕ: Подробные инструкции по сборке предоставляются производителем. Инкубационая система должна стабилизироваться до 5% CO2, 37 градусов по Цельсию и 85% влажности перед ростом клеток в инкубаторе. Эти параметры могут зависеть от линии ячейки. - Соберите пользовательские шесть хорошо пластины инкубатор, нанопозиционирование привода этапе, и XY диск этапе. Первые винты в последний, соответственно.
ПРИМЕЧАНИЕ: Подробные инструкции по сборке, предоставленные производителем. - Подключите четыре перистальтических насоса в последовательности "цепочки ромашки" через кабели RS-232 с помощью кабеля RS-232 к USB-кабелю, подключенного к управляющему компьютеру. Подключите полимерные трубки 3,18 мм (например, Tygon) к каждому каналу на каждом ролике насосного канала.
ПРИМЕЧАНИЕ: Каждый насос имеет четыре ролика. Направление и скорость потока роликов вручную манипулируются. - Вставьте 1/16" x 1/8" разъемы в конце каждой полимерной трубки с 3,18 мм. Вставьте 1/16'' конец разъема в 1.59 ID полимерных труб, а затем вставить полимерные трубки в инкубатор через пользовательские порты. Поместите другой конец трубки в раствор, который будет вливается во время экспериментов IC-FPOP.
ПРИМЕЧАНИЕ: Для перфузионных линий инкубатор имеет 36 пользовательских портов для трубных линий по всей периферии для размещения всех используемых реагентов. - Винт один 50 мм, 248 нм, 45 "excimer лазерной линии зеркало в кинематической зеркальной крепления для 2" оптики в доске 10-11 точек сетки от 248 нм лазерной диафрагмы. Поместите второе зеркало под углом 90 градусов к первому на другой стороне инкубатора. Угол второго зеркала вниз примерно на 45 "для лазерного луча наведения на инкубатор (Рисунок 2F-J).
2. Синхронизация и первоначальная автоматизация системы с помощью интеграционного программного обеспечения
- Установите последнюю версию интеграционного программного обеспечения, необходимого для управления драйверами и насосами.
- Ссылаясь на руководство насоса, переименовать насосы, начиная с '5' и увеличение стоимости. Команды могут быть отправлены в насосную систему с помощью подпрограммы ручного управления в интеграционном программном обеспечении.
ПРИМЕЧАНИЕ: Установка насоса в режим канала автоматически изменяет конвенцию именования насоса в набор, 1, 2, 3 и 4, соответствующие четырем каналам насоса. - Откройте интеграционную программу для автоматизации платформы инкубатора.
- Выберите соответствующее название устройства USB comport (например, COM4), соответствующее насосной системе USB-кабель, из меню высадки соединения с маркировкой Comport для насосов.
- Нажмите кнопку Script Builder, чтобы редактировать/создавать скрипт для платформы автоматизированного инкубатора платформы. Нажмите Сохранить сценарий, чтобы сохранить последовательность в качестве текстового файла(рисунок 3A).
ПРИМЕЧАНИЕ: Скрипт строитель имеет пользовательский интерфейс для определения сценария с определениями числа насоса, направление, скорость, объем, диаметр трубки, режим канала, и время задержки. - Если режим канала желал в создании скрипта, шаг в скрипте должен быть посвящен изменению режима насоса в и из режима канала, и следующие шаги, соответствующие каналам насоса, должны быть помечены как насосы 1-4.
ПРИМЕЧАНИЕ: Это гарантирует, что никакие два насоса не могут одновременно быть в режиме канала во время скрипта инкубатора платформы и что каждый насос переключается обратно в устаревший режим после того, как команды были отправлены на нужные каналы. - Нажмите кнопку Read Script и выберите подходящий файл скрипта, желаемый для работы инкубатора платформы.
- Переключите кнопку Run Sequence на положение ON (зеленый), чтобы запустить скрипт, а затем нажмите кнопку START (рисунок 3B).
3. Выращивать клетки в инкубаторе платформы
ПРИМЕЧАНИЕ: Клетки должны быть помещены в инкубатор платформы в стерильных условиях в капюшоне культуры клеток за день до экспериментов.
- Отвинтить инкубатор платформы от стадии нанопозиции и отключить температуру, газ и увлажнители линий. После распыления инкубатора с 70% этанола, поместите его в капюшон культуры клеток.
- Выращивайте клетки в Т-175 примерно до 80-90% слияния до передачи.
ПРИМЕЧАНИЕ: Термин слияние используется в качестве меры числа / охвата клеток в блюдо клеточной культуры или колбу. - Удалите мультимедиа и смойте буфером.
- Отсоедините ячейки с помощью трипсина-ЭДТА с помощью протокола производителя.
- Повторное время в 8 мл мультимедиа и подсчитайте ячейки.
- Семена фибронектина/коллагена14 покрыты шестью пластинами с примерно 90-95 йл повторно набранных клеток в каждой хорошо. Этот объем будет уместным для достижения 80-90% слияния (1,2 миллиона клеток) в каждой из них на следующий день.
ПРИМЕЧАНИЕ: Шесть хорошо пластины должны быть покрыты коллагеном до посева. Реагенты, используемые во время IC-FPOP, пропитаны быстрыми скоростями потока. Покрытые пластины обеспечивают преждевременное отсоединеемое количество клеток из-за вливания реагентов. - Поместите семенную пластину в инкубатор платформы и накройте крышкой кварца.
ПРИМЕЧАНИЕ: Во время проектирования и разработки крышка стеклянного инкубатора была изменена на кварц, поэтому она совместима с ультрафиолетовым лазерным светом. - Замените и защитите инкубатор платформы на этапе нанопозиционирования привода. Восстановите линии температуры, газа и увлажнителя.
- Пусть клетки вырастут до слияния в одночасье.
ПРИМЕЧАНИЕ: Следующие шаги клеточной культуры являются необязательными и предназначены для экспериментов, в которых человеческие клетки постоянно трансфицированы. Эти шаги оценивают эффективность трансфекции в условиях клеточной культуры. - Трансфект плазмида, содержащая ген химерного белка GCaMP2 в heK 293 клеток с использованием коммерческих катико-липидных трансфекции комплект.
- Выполняем переходные трансфекции GCaMP2 в клетках HEK293T в двух шести-хорошо пластинах.
- Инкубировать одну пластину из шести колодец в инкубаторе платформы, а вторую шестиуголую пластину в стандартном инкубаторе CO2.
- Сравните эффективность трансфекции в каждой пластине с помощью флуоресценции изображения с помощью флуоресцентного микроскопа.
4. Сделать утолить буфер и H2O2
- Сделайте 100 мл буфера утоления, содержащего 125 мМ N-терт-Бутыл-α-фенилнитрон (PBN) и 125 мМ N, Нэ-Диметилтиуреа (ДМТУ).
ПРИМЕЧАНИЕ: DMTU и PBN являются свободными радикальными падальщиками и являются ячейками, проницаемыми. - РазбавитьH 2Oот 2 до 200 мм. Каждый образец требует 6 мл H2O2, чтобы полностью погрузить слой клеток в нижней части каждой хорошо.
ПРИМЕЧАНИЕ: Буфер утоления делается накануне и хранится при 4 градусах цельсия на ночь, защищенный от света. РазбавитьH2 O 2 в день эксперимента.
5. Настройка инкубатора платформы для IC-FPOP
ПРИМЕЧАНИЕ: Инкубатор платформы должен быть собран в стерильных условиях. Соберите инкубатор в стерильном капюшоне культуры клеток.
- Отвинтить инкубатор платформы от стадии позиционирования и отключить температуру, газ и увлажнители линий.
- После распыления инкубатора с 70% этанола, поместите его в капюшон культуры клеток.
- Удалите шестиявую пластину с инкубатора платформы, закрелите оригинальную крышку пластины и подтвердите слияние клеток с помощью микроскопа.
- После того, как слияние клеток было подтверждено, замените шестиугонюю пластину на сочные клетки обратно в инкубатор платформы внутри капота клеточной культуры.
- Вставьте три прекайта (15 см) 1,59 ID полимерных трубок в каждом хорошо через встроенные порты. Промыть трубки к стенам колодец и провести с пользовательскими 3D печатных колец.
ПРИМЕЧАНИЕ: Шесть 33 мм PLA нити 3D печатных колец были специально разработаны для обеспечения трубки к стенам пластины, не нарушая клетки или вставая на пути лазерного импульса. - Обложка платформы инкубатор с его кварцевой крышкой. Замените и закретув верхний инкубатор на системе позиционирования. Восстановите линии температуры, газа и увлажнителя.
- Подключите полимерные трубки 1.59 ID к 1/16"концу разъемов 1/16x1/8.
6. Выполнение IC-FPOP в инкубаторе платформы
- Подготовь сценарий интеграционного программного обеспечения для вывода насоса. Используйте один перистальтический насос (Pump 8), чтобы полностью удалить клеточные средства массовой информации из всех шести скважин.
- Основные растворители в каждом канале трех других перистальтических насосов (насосы 5-7). Настоять H2O2 и утолить буфер в соответствующих переменных труб до тех пор, пока реагенты не достигнут портов инкубатора.
- Подтвердите, что лазерный луч был правильно под углом зеркал и достигает инкубатора раскованным.
ПРИМЕЧАНИЕ: Лазерные защитные очки должны носить всякий раз, когда лазер используется. Не преждевременно облучать клетки во время рыбалки / выравнивания процесса. Используйте картон, чтобы полностью покрыть крышку кварца при выравниваи луча. Кроме того, используйте печатный контур на белой бумаге из шести хорошо пластины для дальнейшего подтверждения лазерного луча удара по центру каждой хорошо. Используйте параметр непрерывного импульса на самой низкой частоте и энергии для выравнивания. - Проверьте лазерную энергию с помощью внешнего датчика. Используйте один лазерный импульс 160 мДж на 50 Гц и 27 кВ.
ПРИМЕЧАНИЕ: Таймер необходим для следующих шагов. - Подготовь сценарий интеграционного программного обеспечения для инфузии насоса после подтверждения выравнивания пучка.
- Запустите таймер и нажмите кнопку Пуск на скрипте насоса интеграционного программного обеспечения в то же время.
- Настоять 200 мМ Н2O2 при 35 мл/мин в первую колодец (6-10 секундная отметка на таймере).
ПРИМЕЧАНИЕ: Существует пяти секунд задержки, прежде чем насос начинает наполнить. Он также принимает лазер за семь секунд до импульса срабатывает. Лазерный импульс должен прийти сразу после H2O2 вливания. - Нажмите кнопку Пуск на лазерном программном обеспечении на 5-секундной отметке, чтобы вызвать импульс на 11-секундной отметке на таймере.
- Настоять раствор на 125 мМ при 35 мл/мин в первую колодец сразу после лазерного импульса. Вручную переместив этап позиционирования, чтобы выровнять следующий колодец с лазерным лучом.
- Повторите вышеуказанные шаги 6.5-6.9 до тех пор, пока каждая колодец не будет обработана.
ПРИМЕЧАНИЕ: IC-POP выполняется в техническом тройном из трех лазерных и трех не лазеров образцов. Одна обработанная пластина из шести колодец служит одной биологической репликацией. - В капюшоне культуры клетки, используйте скребок клетки для того чтобы перенести клетки от каждого наилучшим образом в индивидуальные 15 mL конические пробки. Клетки центрифуги на 1200 х г в течение 5 минут.
- Отбросьте сверхнатантные и мизупендные клетки в 100 МКЛ буфера лиза RIPA.
- Передача клеток в отдельные полипропилевые трубки 1,2 мл.
- Flash заморозить все образцы в жидком азоте и поместить в морозильную камеру -80 градусов по Цельсию до использования.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь.
7. Извлечение, очистка белка и протеолиза
- Оттепель образцов и тепла при температуре 95 градусов по Цельсию в тепловом блоке в течение 5 минут.
- После нагрева, охладить на льду в течение 5 минут.
- Добавьте 25 единиц нуклеазы в лизат клетки, чтобы деградировать однострунной, двухструнной, линейной и круговой ДНК и РНК и инкубировать в комнате умеренной в течение 15 минут.
- Образцы центрифуги при 16 000 х г в течение 10 минут при 4 градусах Цельсия.
- Соберите супернатант и перенесите в чистую полипропиленовую трубку.
- Проверьте концентрацию белка с помощью колоритного протеина.
- Перенесите 100 мкг образца в чистую полипропиленовую трубку и довнесите до 100 МКЛ с буфером клеточного лиза.
- Уменьшите образцы с 10 мМ дитиотрейтол (DTT) при 50 градусов по Цельсию в течение 45 минут.
- Прохладные образцы при комнатной температуре в течение 10 минут.
- Алкилат с 50 мМ иодоацетамид (IAA) при комнатной температуре в течение 20 минут.
ПРИМЕЧАНИЕ: Защитите IAA от света - Добавьте 460 МКЛ предварительно охлажденного ацетона (-20 градусов по Цельсию). Вортекс образцов и место на -20 градусов по Цельсию на ночь.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь. - На следующий день образцы центрифуги при 16 000 х г в течение 10 минут при 4 градусах Цельсия.
- Удалите ацетон, не нарушая белковые гранулы.
- Добавьте 50 МКЛ 90% предварительно охлажденного (-20 градусов по Цельсию) ацетона. Образцы вортекса смешивать и центрифуга при 16 000 х г в течение еще 5 минут при 4 градусах Цельсия.
- Удалить ацетон и дать образцам высохнуть в течение 2-3 минут.
- Реуспенд белковые гранулы с 10 мМ Трис буфер рН 8.
- Resuspend MS класса трипсина (20 мкг бульона) в 40 МКл из 10 мМ Трис буфер рН 8 и добавить 2,5 мкг трипсина в каждом образце.
- Инкубационые образцы при 37 градусах по Цельсию за ночь.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь. - Оцените концентрацию пептида с помощью колоритного пептидного анализа.
- Утолить образцы 5% кремовой кислотой.
- Перенесите 10 мкг образца в чистую полипропиленовую трубку.
- Высушите образец с помощью вакуумной центрифуги и повторно почистим 20 МКЛ 0,1% мякотиновой кислоты (ФА) в воде.
- Перенесите каждый образец на чистые флаконы автозапчагов с предварительно разрезанными колпачками.
8. Высокопроизводительность жидкой хроматографии-тандем масс-спектрометрии (LC-MS/MS)
- Чтобы локализовать модификации FPOP, проанализируйте переваренный лизат клеток с помощью анализа LC-MS/MS.
- Используйте мобильные фазы 0,1% FA в воде (A) и 0,1% FA в ацетонитриле (ACN) (B).
- Загрузите 0,5 мкг образца на столбец 180 мкм х 20 мм C18 (5 мкм и 100 мк) захвата столбца и мыть столбец с 99% (A) и 1% (B) в течение 15 минут.
- Используя аналитическую колонку 75 мкм х 30 см C18 (5 мкм и 125 евро), элютные и отдельные переваренные пептиды со скоростью потока 0,300 МКЛ/мин в течение 120 минут.
- Вы запустите градиент LC следующим образом: 0'1 мин, 3% растворитель B; 2–100 мин,10-45% Б;100-110 мин, 45-100% Б; 110-115 мин,100% Б.
- Восстановление колонны на 3% (B) от 115-116 минут и удерживайте на 3% (B) от 116-120 минут.
- Анализ eluted пептидов в положительном ионом режиме с ионизацией наноэспрей.
- Приобретайте спектры MS1 в диапазоне сканирования м/з 375-1500 с разрешением 60 000.
- Установите автоматическую цель управления усилением (AGC) до 5.0e5 с максимальным временем впрыска 50 мс и 5.0e4 порог интенсивности.
- Изолировать ионы-прекурсоры с состояниями заряда 2-6 через зависимое от данных приобретение (DDA) с изоляционные окна 1,2 м / з и время цикла 4 секунды.
- Субъект MS2 ионов высокой энергии столкновения диссоциации (HCD) (32% нормализованной энергии).
- Исключите пептиды после приобретения 1 MS/MS в течение 60 секунд.
- Установите разрешение MS/MS до 15 000 с целью AGC 5.0e4 и максимальным временем впрыска 35 мс.
9. Обнаружение/обработка данных Proteome
- Поиск тандема необработанных файлов данных о доступных снизу вверх протеомики анализа программного обеспечения против соответствующих Homo sapiens белковой базы данных и дайджест фермента.
- Установите параметры поиска анализа белка.
- Установите толерантность к фрагментам до 0.02 Da и родительской ионные допуски до 10 промилле.
- Установите специфичность фермента, чтобы трипсин и позволяют один пропущенный декольте.
- Установите дальность массы до 375-1500 м/з.
- Установить пептид доверия на 95% (средний) и остатков доверия на 99% (высокий).
- Примите белки, если по крайней мере два различных пептида идентифицируются с фильтром 5% открытия (FDR).
- Установите карбамидометилирование как статическую модификацию и все известные гидроксиловы радикальные боковыецепи модификаций 15,16 в качестве динамических модификаций.
- После завершения поиска файлов, последовательности экспорта, расположения модификаций, присоединения белка, файла спектра, изобилия прекурсоров и времени хранения информации в электронную базу данных.
- Рассчитайте степень модификации на пептид или остаток из этого уравнения:
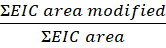
ПРИМЕЧАНИЕ: Область EIC изменена является извлеченной ионой хроматографической областью (EIC) пептида или остатка с окислительной модификацией, а область EIC является общей площадью того же пептида или остатка с окислительной модификацией и без нее. Со временем белок в присутствии перекиси водорода окисляется, что приводит к фоновым окислениям. Для расчета степени модификации площадь модифицированного пептида делится на общую площадь. Необлученный образец управления объясняет фоновое окисление. Фоновое окисление из контрольного образца вычитается из обработанного лазером образца для идентификации модификации FPOP.
Результаты
Чтобы подтвердить, что условия инкубатора платформы достаточны для клеточной культуры на лазерной платформе, GCaMP2 был временно трансфицирован в HEK293T, и эффективность трансфекции для обеих пластин была оценена с помощью флуоресценции изображения(рисунок 4A). GCaMP2 является кальцием зондирования флуоресцентного белка, используемого в качестве генетически закодированного внутриклеточного индикатора кальция. Это слияние зеленого флуоресцентного белка (GFP) и связывающего кальция белка, калькодулина. Анализ люциферазы был проведен на клетках HEK 293, трансфицированных плазмидной prl-TK для количественной оценки эффективности трансфекции(рисунок 4B). Эти результаты показывают, что инкубатор платформы превысил производительность стандартного инкубатора, с 1,13-кратным увеличением эффективности трансфекции, обеспечивая количественный ориентир для оптимальной среды культуры клеток.
Модификации FPOP в клетках HEK293T, помеченных в системе потока, были сравнены с теми, которые помечены в инкубаторе платформы, и показали, что инкубатор платформы превосходит систему потока как по количеству модифицированныхбелков (рисунок 5), таки по общей охвату FPOP в этих белках. Количество модифицированных белков FPOP, приобретенных в инкубаторе платформы, составило примерно 1051, что в 2,2 раза больше, чем в ходе типичного эксперимента. Изменения были объединены между двумя биологическими репликациями для каждого эксперимента. Кроме того, PIXY обеспечивает более высокую пропускную способность.
Чтобы продемонстрировать преимущество более высокого охвата модификацией белка, модификации IC-FPOP были локализованы на пептидном уровне, и степень модификации была количественно определена, чтобы различать различия в результатах между системами актина, 375 аминокислотного белка. В системе потока были обнаружены два модифицированных пептида, обеспечивающих ограниченную структурную информацию(рисунок 6A). Тем не менее, пять модифицированных пептидов, охватывающих актин последовательность были обнаружены в платформе инкубатора. Тандемные масс-спектры указывают на то, что остатки Pro322 были изменены и обнаружены в каждомэксперименте (рисунок 6B). Пять пептидов, модифицированных в образцах инкубатора платформы, содержали двенадцать модифицированных остатков, в то время как только четыре остатка были изменены ссистемой потока (рисунок 6C). Увеличение охвата окислением обеспечивает более структурную информацию по всему белку.
Espino и др. продемонстрировали способность FPOP быть выполнены in vivo (IV-FPOP) в C. elegans, червь модель для человеческих заболеванийгосударств 17. В то время как IV-FPOP также выполняется через систему потока, система PIXY была протестирована на совместимость с червями. Приблизительно 10 000 червей были инкубированы в каждой из них в инкубаторе платформы при 20 градусах по Цельсию. Анализ LC-MS/MS показал, что 792 белка были модифицированы IV-FPOP в инкубаторе платформы по сравнению с 545 белками, модифицированными ссистемой потока (рисунок 7). Эти результаты показывают, что в дополнение к культуре 2D клеток, эта новая методология также совместима с изучением других биологических систем, таких как C. elegans.
Рисунок 1. Схема системы PIXY. Компоненты системы: (A) этап-топ инкубатор, (B) система позиционирования , (C) перистальтические насосы, и (D) перфузионные линии. Средства массовой информации культуры ячейки удаляются из каждой системы с помощьюнасосов доH 2 O2 и утолить решения вливаются в расчетных точках времени. Лазерный путь для облучения продемонстрированы в белом цвете. Перепечатано с разрешения Джонсона, Д. Т., Паншон-Смит, Б., Эспино, Дж.А., Гершенсон, А., Джонс, Л.M., Внедрение внутриклеточного быстрого фотохимического окисления белков в инкубаторе платформы с подвижной XY этапе. Аналитическая химия, 92(2), 1691-1696 2019. Авторское право 2020 Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2. Полностью собранная система PIXY. (A) Коснитесь системы мониторинга, (B) единицы двуокиси углерода, (C) температурный блок, (D) воздушныйнасос,( E ) увлажнитель, (F) оптические зеркала, (G) платформы инкубатор, (H) позиционирование этапе, (I) 248nm KrF excimer лазера, и (J) перисталтических насосов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
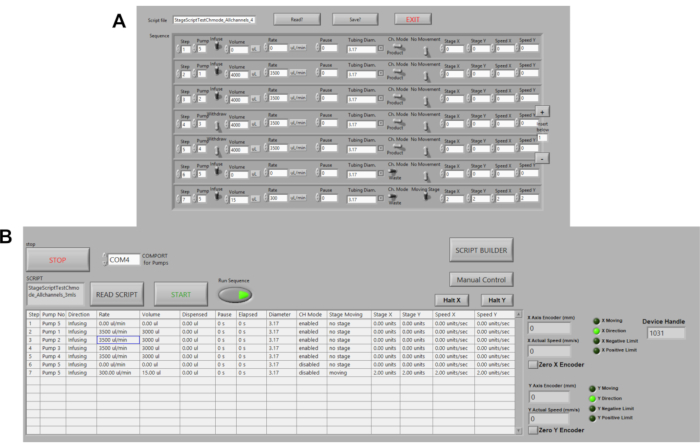
Рисунок 3. Автоматизация перистальтических насосов. (A)Пример сценария команды в LABVIEW. Параметры командования включают объем, скорость потока, паузы, направление потока. Скорость, расстояние и местоположение в настоящее время автоматизированы. (B)Читатель сценария в LABVIEW. Здесь загружаются командные скрипты, затем бегут последовательности и START нажимаются, чтобы инициировать насосы. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
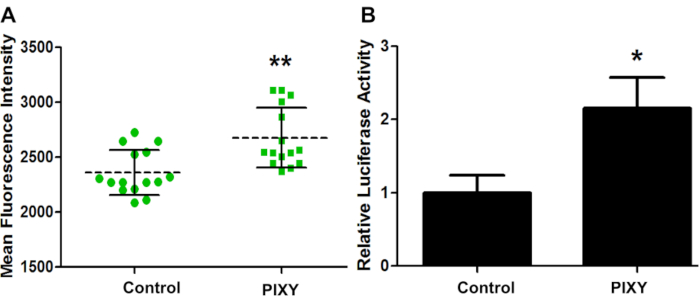
Рисунок 4. Эффективность трансфекции клеток HEK. (A)Средняя флуоресцентная интенсивность трансфекции GCaMP2 сравнение между стандартным инкубатором (control) и этап-топ инкубатор (PIXY). Точки и квадраты представляют каждую точку в хорошо, где была взята мера. (B)Эффективность трансфекции количественно и проверены с другой плазмид вектор, PRL-TK. P-значение< 0.005. Перепечатано с разрешения Джонсона, Д. Т., Паншон-Смит, Б., Эспино, Дж.А., Гершенсон, А., Джонс, Л.M., Внедрение внутриклеточного быстрого фотохимического окисления белков в инкубаторе платформы с подвижной XY этапе. Аналитическая химия, 92(2), 1691-1696 2019. Авторское право 2020 Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
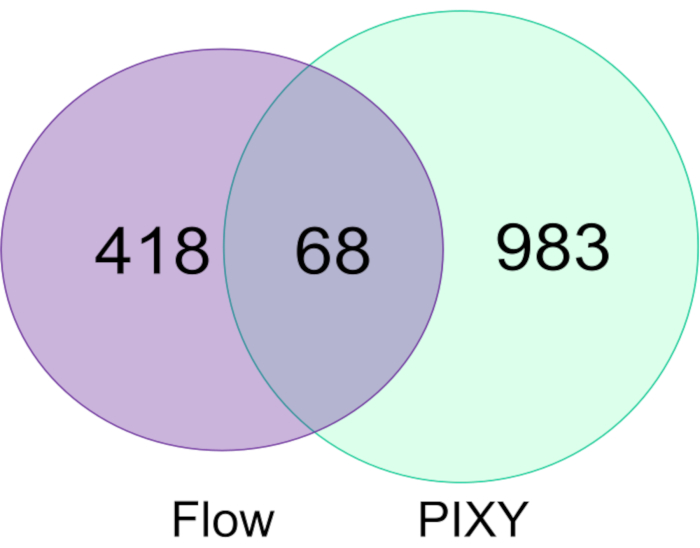
Рисунок 5. Сравнение белков, модифицированных в системе одноклеточного потока и PIXY. Диаграмма Венна белков, модифицированных с использованием в системе потока (фиолетовый) и в PIXY (зеленый). Перепечатано с разрешения Джонсона, Д. Т., Паншон-Смит, Б., Эспино, Дж.А., Гершенсон, А., Джонс, Л.M., Внедрение внутриклеточного быстрого фотохимического окисления белков в инкубаторе платформы с подвижной XY этапе. Аналитическая химия, 92(2), 1691-1696 2019. Авторское право 2020 Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
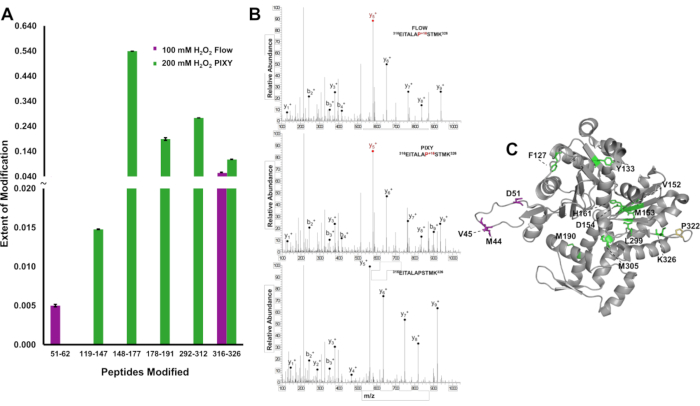
Рисунок 6. Локализация модификаций IC-FPOP. Сравнение модификаций IC-FPOP между системами. (A) Бар график окислительно модифицированных пептидов в актине из системы потока (фиолетовый) против платформы инкубатора (зеленый). (B) Тандем MS спектры актина (пептид 316-326) с модифицированной пролин в обеих системах и неизмененных актин пептид (C) FPOP модифицированных остатков актина (PDB: 6'XJ, цепь 11 модифицированных остатков в платформе инкубатора (зеленый), 3 модифицированных остатков в системе потока (фиолетовый), 1 перекрывающихся модифицированных остатков (желтый). Перепечатано с разрешения Джонсона, Д. Т., Паншон-Смит, Б., Эспино, Дж.А., Гершенсон, А., Джонс, Л.M., Внедрение внутриклеточного быстрого фотохимического окисления белков в инкубаторе платформы с подвижной XY этапе. Аналитическая химия, 92(2), 1691-1696 2019. Авторское право 2020 Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
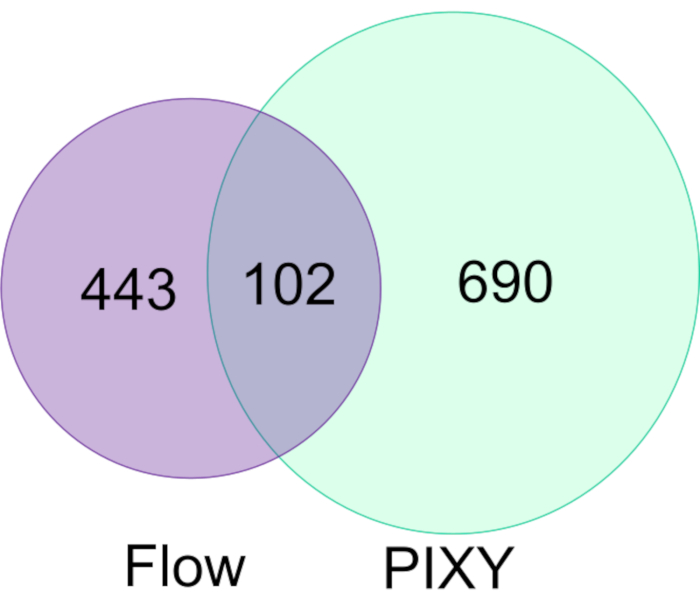
Рисунок 7. Сравнение модифицированных белков FPOP в C. elegans по течению против PIXY. По сравнению с системой потока количество окислительно модифицированных белков с использованием PIXY увеличивается в 1,5 раза. Перепечатано с разрешения Джонсона, Д. Т., Паншон-Смит, Б., Эспино, Дж.А., Гершенсон, А., Джонс, Л.M., Внедрение внутриклеточного быстрого фотохимического окисления белков в инкубаторе платформы с подвижной XY этапе. Аналитическая химия, 92(2), 1691-1696 2019. Авторское право 2020 Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Таблица 1. Распределение модификаций рабочего процесса и массовые сдвиги (Da). Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Белки выполняют большую часть работы в живых клетках. Учитывая это значение, подробные данные о функции белка и более высокой структуре порядка (HOS) в клеточной среде необходимы для углубления понимания тонкостей в больших комплексах и энзиматических реакций в клетках, в отличие от очищенных систем. Для этого был принят метод гидроксиловой радикальной белковой печати ног (HRFP), озаглавленный «Быстрое фотохимическое окисление белков» (IC-FPOP). Большинство исследований FPOP были проведены в пробирке в относительно чистых белковых системах, что заметно контрастирует с переполненной молекулярной средой, которая влияет на связывающие взаимодействия и конформацию белка. В результате существует пропасть между выводами экспериментов in vitro 18 и результатами, полученными в реальной клеточной среде. Для преодоления разрыва между идеализированными условиями эксперимента in vitro FPOP и сложным характером ячейки была разработана новая автоматизированная платформа из шести хорошо, основанная на cell-FPOP. Эта новая технология FPOP способна идентифицировать и охарактеризовать эти молекулярные виды и отслеживать их динамические молекулярные взаимодействия как в здоровых, так и в больных состояниях. Эта новая платформа называется Платформа инкубатор с Movable XY этапе (PIXY).
FPOP успешно используется для характеристики структурной информации в протеоме. Однако каждый биологический метод имеет определенные ограничения, которые требуют дальнейшего совершенствования. Специфические реагенты необходимы во время лазерного фотолиза и для эффективного затухления неотредактированных гидроксиловырных радикалов. Разделение переваренных пептидов может потребовать большого количества времени, чтобы максимизировать структурную информацию. Это богатство информации может также потребовать обширной количественной оценки во время анализа данных после MS1. Платформа инкубатора, в том числе периферийного оборудования, необходимого для клеточной культуры и IC-FPOP на лазерной платформе, поставляется с большой стоимостью, которая не может быть осуществима для некоторых лабораторий. По мере дальнейшего прогресса надежные программные средства и инструменты анализа должны продвигать этот метод дальше; некоторые из которых представлены в данном исследовании. Текущие исследования в этой платформе инкубатора были проведены на HEK293T клеток и в C. elegans. Метод IC-FPOP был показан, чтобы быть совместимым с широким спектром клеточных линий, включая китайский хомяк яичников (CHO), Веро, MCF-7, и MCF10-Aклетки 19. Поскольку общий метод IC-FPOP можно перевести на эту статическую платформу, эти клеточные линии должны быть подменяемыми для изучения с использованием PIXY.
IC-FPOP использует H2O2 для окислительного изменения растворителя доступных боковых цепей аминокислот, чтобы затем дальнейшее различить белковых взаимодействий, структуры и метаболических эффектов в жизнеспособных клетках, что имеет важное значение в обеспечении биологического контекста. Перед экспериментом IC-FPOP необходимо подтвердить, что клетки жизнеспособны после добавления H2O2. Исследования жизнеспособности клеток показали, что клетки были жизнеспособными в присутствии концентраций H2O2 до 200 мМ 13. Важно также убедиться, что H2O2 вливается в окончательную концентрацию 200 мМ непосредственно на ячейках после удаления мультимедиа. Неспособность полностью удалить средства массовой информации культуры клеток вызовет различные концентрации H2O2. По сравнению со стандартными условиями, увеличение инкубационного времени до 10 секунд наряду сувеличением концентрацииH 2 O2 привело к увеличению количества белков, модифицированных IC-FPOP в инкубаторе платформы. Крайне важно премьер перистальтических насосов перед использованием для обеспечения насосы работают должным образом и жидкость рассеивается. Невыполнение этого решения может привести к пузырькам воздуха в трубках, недостаточному объему H2O2 для погружения клеток и/или недостаточному объему раствора для затухления.
Другой проблемой, которая может возникнуть, являются нежелательные задержки в системе. Примером этого является процесс проверки полученных команд для насосных систем, который добавляет значительные задержки порядка 1000 или более миллисекунд с использованием интеграционного программного обеспечения. Эта проблема может быть исправлена путем минимизации связи с насосами во время эксперимента и использования заранее установленных команд как можно больше.
В будущем целью PIXY является создание полностью автоматизированной и интегрированной системы. В дополнение к перистальным насосам, запуск лазерного импульса будет автоматизирован. Новая система позиционирования будет также использоваться для быстрого движения инкубатора платформы для повышения скорости и точности. Все компоненты системы будут по-прежнему запрограммированы с использованием интеграционного программного обеспечения для дальнейшего увеличения пропускной способности.
Раскрытие информации
Авторы заявляют об отсутствие конкурирующих финансовых интересов.
Представленное в настоящем настоящем году исследование связано с приведенной ниже патентной заявкой:
Номер неведней патентной заявки в США: 17/042,565
Название: "Устройство и метод определения сворачивания белков"
UMB Список: LJ-2018-104 UMass Ref: UMA 18-059.
Благодарности
Эта работа была поддержана грантом NIH R01 GM128983-01.
Материалы
| Name | Company | Catalog Number | Comments |
| Ismatec Reglo ICC Peristaltic Pumps | Cole-Palmer | 122270050 | |
| Kinematic Mirror Mount for Ø2" Optics | Thor Labs | ||
| 10X trypsin−EDTA | Corning | AB00490-00005 | |
| 50.0mm 248nm 45°, Excimer Laser Line Mirror | Edmond Optics | ||
| Acetone, HPLC Grade | Fisher Scientific | ||
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | ||
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 23275 | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| ACQUITY UPLC M-Class System | Waters | A53225 | |
| Afinia H480 3D Printer | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| air pump | OKOlabs | D12345 | |
| Aluminum Foil | Fisher Scientific | Stock #63-120 | |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | ||
| carbon dioxide unit | OKOlabs | MadMotor®-UHV | |
| Centrifuge | Eppendorf | ||
| connectors (Y PP 1/16” and 1/16x1/8”) | Cole-Palmer | 116891000 | |
| Delicate Task Wipers | Fisher Scientific | 022625501 | |
| Dithiothreiotol (DTT) | AmericanBio | ||
| DMSO, Anhydrous | Invitrogen | LS118-500 | |
| Dulbecco’s phosphate-buffered saline (DPBS) | Corning | SK-78001-82 | |
| EX350 excimer laser | GAM Laser | PI89900 | |
| Fetal bovine serum (FBS) | Corning | SK-12023-78 | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| HEK293T cells | Paul Shapiro Lab (University of Maryland Baltimore) | ||
| humidifier | OKOlabs | Nano-LPMW stage | |
| HV3-2 VALVE | Hamilton | BP152-500 | |
| Hydrogen Peroxide | Fisher Scientific | LS120-500 | |
| Iodoacetamide (IAA) | ACROS Organics | ||
| LABVIEW Professional 2018 | National Instruments | 86728 | |
| MadMotor Positioning system and controllers | Mad City Labs | W6-4 | |
| Methanol, LC/MS Grade | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Microcentrifuge | Thermo Scientific | H301-T Unit-BL-PLUS | |
| N,N′-Dimethylthiourea (DMTU) | ACROS Organics | ||
| Nanopositioinging stage | Mad City Labs | ||
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | ||
| OKO Touch Monitoring System | OKOlabs | ||
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | 7Z02936 | |
| PE50-C pyroelectric energy meter | Ophir Optronics | ||
| Penicillin-streptomycin | Corning | ||
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | ||
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | ||
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 75002436 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 06-666A | |
| pressure gauge | OKOlabs | OKO-AIR-PUMP-BL | |
| PTFE filter | OKOlabs | CO2-UNIT-BL | |
| Six 33 mm PLA filament rings | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| sterile incubator | OKOlabs | ||
| temperature unit | OKOlabs | OKO-TOUCH | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | A117-50 | |
| TiNKERcad | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| Tris Base | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| tubing (Tygon 3.18 and 1.59 ID) | Cole-Palmer | 177350250 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Water, LC/MS Grade | Fisher Scientific | 88702 | |
| 90058 | |||
| KM200 | |||
| 186007496 |
Ссылки
- Johnson, D. T., Di Stefano, L. H., Jones, L. M. Fast photochemical oxidation of proteins (FPOP): A powerful mass spectrometry based structural proteomics tool. Journal of Biological Chemistry. 294 (32), 11969-11979 (2019).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemical Reviews. 120 (10), 4355-4454 (2019).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-883 (2019).
- Zhao, B., et al. Covalent Labeling with an α,β-Unsaturated Carbonyl Scaffold for Studying Protein Structure and Interactions by Mass Spectrometry. Analytical Chemistry. 92 (9), 6637-6644 (2020).
- Hambly, D. M., Gross, M. L. Laser Flash Photolysis of Hydrogen Peroxide to Oxidize Protein Solvent-Accessible Residues on the Microsecond Timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Li, K. S., Shi, L., Gross, M. L. Mass Spectrometry-Based Fast Photochemical Oxidation of Proteins (FPOP) for Higher Order Structure Characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Chea, E. E., Jones, L. M. Modifications generated by fast photochemical oxidation of proteins reflect the native conformations of proteins. Protein Science. 27 (6), 1047-1056 (2018).
- Hambly, D., Gross, M. Laser flash photochemical oxidation to locate heme binding and conformational changes in myoglobin. International Journal of Mass Spectrometry. 259 (1), 124-129 (2007).
- Yan, Y. Fast photochemical oxidation of proteins (FPOP) maps the epitope of EGFR binding to adnectin. Journal of the American Society for Mass Spectrometry. 25 (12), 2084-2092 (2014).
- Zhang, Y., Wecksler, A. T., Molina, P., Deperalta, G., Gross, M. L. Mapping the Binding Interface of VEGF and a Monoclonal Antibody Fab-1 Fragment with Fast Photochemical Oxidation of Proteins (FPOP) and Mass Spectrometry. Journal of the American Society for Mass Spectrometry. 28 (5), 850-858 (2017).
- Espino, J. A., Mali, V. S., Jones, L. M. In Cell Footprinting Coupled with Mass Spectrometry for the Structural Analysis of Proteins in Live Cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L. M. Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytical Chemistry. 92 (2), 1691-1696 (2019).
- Bangel-Ruland, N., et al. Cystic fibrosis transmembrane conductance regulator-mRNA delivery: a novel alternative for cystic fibrosis gene therapy. The Journal of Gene Medicine. 15 (11-12), 414-426 (2013).
- Gau, B. C., Chen, H., Zhang, Y., Gross, M. L. Sulfate Radical Anion as a New Reagent for Fast Photochemical Oxidation of Proteins. Analytical Chemistry. 82 (18), 7821-7827 (2010).
- Xu, G. C., et al. Hydroxyl Radical-Mediated Modification of Proteins as Probes for StructuralProteomics. Chemical Reviews. American Chemical Society. 107 (8), 3514-3543 (2007).
- Espino, J. A., Jones, L. M. Illuminating Biological Interactions with In Vivo Protein Footprinting. Analytical Chemistry. 9 (10), 6577-6584 (2019).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast Photochemical Oxidation of Protein Footprints Faster than Protein Unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Kaur, U., Johnson, D. T., Jones, L. M. Validation of the Applicability of In-Cell Fast Photochemical Oxidation of Proteins across Multiple Eukaryotic Cell Lines. Journal of the American Society for Mass Spectrometry. 31 (7), 1372-1379 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены