Method Article
חממת פלטפורמה עם שלב Movable XY: פלטפורמה חדשה ליישום חמצון פוטוכימי מהיר בתא של חלבונים
In This Article
Summary
פלטפורמה סטטית חדשה משמשת לאפיון מבנה החלבון ואתרי האינטראקציה בסביבת התאים המקומית תוך שימוש בטכניקת טביעת רגל של חלבון הנקראת חמצון פוטוכימי מהיר בתא של חלבונים (IC-FPOP).
Abstract
חמצון פוטוכימי מהיר של חלבונים (FPOP) בשילוב עם ספקטרומטריית מסה (MS) הפך לכלי רב ערך בפרוטאומיקה מבנית כדי לחקור אינטראקציות חלבון, מבנה ודינמיקה קונפורמטיבית של חלבונים כפונקציה של נגישות ממס. בשנים האחרונות הורחב היקף ה-FPOP, טכניקה להדפסת רגלי חלבון רדיקלית הידרוקסיל (HRPF), לתיוג חלבונים בתרביות תאים חיים, המספקים את האמצעים לחקר אינטראקציות חלבון בסביבה התאית המפותלת. שינויים בחלבון בתא יכולים לספק תובנות לגבי שינויים מבניים הנגרמים על ידי ליגנד או שינויים קונפורמיים הנלווים להיווצרות קומפלקס חלבונים, הכל בהקשר התאי. טביעת רגל של חלבונים הושגה באמצעות מערכת מבוססת זרימה מקובלת לייזר 248 ננומטר KrF excimer להניב רדיקלים הידרוקסיל באמצעות פוטוליזה של מי חמצן, הדורש 20 דקות של ניתוח עבור מדגם תא אחד. כדי להקל על ניסויי FPOP שנפתרו בזמן, השימוש בפלטפורמת IC-FPOP חדשה המבוססת על 6 בארות היה חלוץ. במערכת הנוכחית, פולס לייזר יחיד מקרין באר שלמה אחת, אשר חותכת את מסגרת הזמן הניסיונית FPOP וכתוצאה מכך 20 שניות של זמן ניתוח, ירידה של פי 60. זמן ניתוח מופחת מאוד זה מאפשר לחקור מנגנונים תאיים כגון מפלים איתות ביוכימי, קיפול חלבונים, וניסויים דיפרנציאליים (כלומר, ללא סמים לעומת סמים מאוגדים) באופן תלוי זמן. מכשור חדש זה, שכותרתו חממת פלטפורמה עם שלב Movable XY (PIXY), מאפשר למשתמש לבצע תרבות תאים ו- IC-FPOP ישירות על הספסל האופטי באמצעות חממת פלטפורמה עם טמפרטורה, CO2 ובקרת לחות. הפלטפורמה כוללת גם שלב מיצוב, משאבות פריסטליות ואופטיקה מראה להנחיית קרן לייזר. תנאי IC-FPOP כגון תצורת אופטיקה, קצב זרימה, טרנזיט ארעי וריכוז H2O2 ב- PIXY עברו אופטימיזציה וסקרו עמיתים. אוטומציה של כל מרכיבי המערכת תפחית את המניפולציה האנושית ותגדיל את התפוקה.
Introduction
טכניקות טביעת רגל של חלבונים יכולות לחשוף מידע מעמיק על ארגון החלבונים. טכניקות חיוניות אלה המבוססות על ביולוגיה מבנית MS הן מרכיב בארגז הכלים של ספקטרומטריית המסה. שיטות אלה בדיקה חלבון מבנה מסדר גבוה יותר (HOS) וסינרגיה באמצעות תיוג covalent1,2,3,4. חמצון פוטוכימי מהיר של חלבונים (FPOP) מעסיק רדיקלים הידרוקסיל כדי לשנות באופן חמצוני שרשראות צד נגיש ממס של חומצות אמינו5,6 (טבלה 1). השיטה משתמשת לייזר excimer ב 248 ננומטר עבור פוטוליזה של מי חמצן (H2O2) כדי ליצור רדיקלים הידרוקסיל. תיאורטית, 19 מתוך 20 חומצות האמינו ניתן לשנות באופן חמצוני עם גלי להיות היוצא מן הכלל הבודד. עם זאת, בשל שיעורי תגובתיות משתנים של חומצות אמינו עם רדיקלים hydroxyl, שינוי של רק תת קבוצה של אלה נצפתה באופן ניסיוני. עדיין, השיטה יש פוטנציאל לניתוח לאורך רצף חלבון5. FPOP משנה חלבונים בציר הזמן של מיקרו-שניות, מה שהופך אותו לשימושי בחקר אינטראקציות חלשות עם קצבי ניתוק מהירים. נגישות ממס משתנה על קשירה ליגנד או שינוי קונפורמציה חלבון, ולכן, כוחה של השיטה טמון בהשוואה של דפוס תיוג של חלבון במצבים מרובים (כלומר, ללא ליגנד בהשוואה ליגנד מאוגד). כתוצאה מכך, FPOP הצליחה לזהות אתרי אינטראקציה של חלבון-חלבון וחלבון-ליגנד ואזורים של שינוי קונפורמי7,8,9,10. שיטת FPOP הורחבה ממחקר של מערכות חלבון מטוהרות לניתוח תאים. FPOP בתא (IC-FPOP) יכול לשנות באופן חמצוני מעל אלף חלבונים בתאים כדי לספק מידע מבני על פני פרוטאום11,12. פלטפורמת IC-FPOP הקונבנציונלית משתמשת במערכת זרימה כדי לזרום תאים קובץ יחיד מעבר לקרן הלייזר. הפיתוח של מערכת זו אפשר לתאים בודדים יש חשיפה שווה הקרנת לייזר. זה הוביל לעלייה של פי 13 במספר החלבונים המסומנים בצורה חמצונית12. עם זאת, מגבלה של מערכת הזרימה היא אורך של ניסוי מדגם יחיד המורכב מרווח הקרנה של 10 דקות שבמהלכו מתרחש שינוי ומחזור שטיפה נוסף של 10 דקות. אילוצי הזמן של IC-FPOP הופכים אותו לבלתי מתאים לחקר ביניים מתקפלים של חלבונים קצרי מועד או לשינויים הקיימים בין רשתות אינטראקציה במפלים של איתות ביוכימי. מגבלה זמנית זו נתנה השראה לעיצוב פלטפורמת IC-FPOP חדשה המצוידת בתפוקה גבוהה יותר.
כדי למדוד במדויק מבנה חלבון בסדר גבוה יותר בסביבת התאים המקורית, העיצוב החדש מאפשר תרבית תאים להתבצע ישירות בפלטפורמת הלייזר, המאפשרת IC-FPOP להיות תפוקה גבוהה. התקנה זו מאפשרת גם הפרעה ממוזערת לסביבה הסלולרית, בניגוד ל- IC-FPOP באמצעות זרימה שבה יש להסיר תאים חסידים מהמצע. הפלטפורמה החדשה מאפשרת ל- IC-FPOP להתרחש במערכת דגירה סטרילית באמצעות CO2 ותא עליון שלב מבוקר טמפרטורה תוך שימוש באופטיקה מראה מוגדרת להנחיית קרן לייזר, מערכת מיקום עבור תנועת XY ומשאבות פריסטליות להחלפה כימית. הפלטפורמה החדשה לניהול IC-FPOP נקראת חממת פלטפורמה עם שלב XY נייד (PIXY) (איור 1). ב- PIXY, IC-FPOP מתבצע על תאים אנושיים הגדלים בלוחות שש בארות בתוך תא החממה של הפלטפורמה. עבור תצורה זו, קרן הלייזר משתקפת כלפי מטה אל הצלחת באמצעות מראות תואמות קרן כשלב מיקום המחזיק את החממה מועברת, במישור ה- XY, כך שקרן הלייזר מיושרת אסטרטגית להקרין רק באר אחת בכל פעם. מחקרי אימות מראים כי IC-FPOP יכול להתבצע מהר יותר ב- PIXY מאשר במערכת הזרימה ומוביל לשינויים מוגברים בחומצות אמינו לחלבון. הפיתוח של פלטפורמת IC-FPOP חדשה זו תסביר את הידע שניתן להשיג מניסויים סלולריים13.
Protocol
1. הרכבה של חממת פלטפורמה עם שלב Movable XY
הערה: הפלטפורמה החדשה כוללת את מערכת הדגירה, את שלב המיקום ואת הבקרים, המשאבות peristaltic, לייזר 248 ננומטר KrF excimer, ואת המראות האופטיות התאספו על לוח לחם אופטי אימפריאלי.
- הרכבו את מערכת הדגירה: יחידת הטמפרטורה, יחידת פחמן דו-חמצני, מכשיר אדים, משאבת אוויר ומערכת ניטור מגע (איור 2A-E).
הערה: הוראות הרכבה מפורטות מסופקות על-ידי היצרן. מערכת הדגירה חייבת להתייצב על 5% CO2, 37 °C (77 °F) ו 85% לחות לפני גידול תאים בתוך החממה. פרמטרים אלה עשויים להיות תלויים בקו התא. - להרכיב את האינקובטור מותאם אישית שש באר צלחת, שלב כונן nanopositioning, ואת שלב כונן XY. לשעבר ברגים לתוך האחרון, בהתאמה.
הערה: הוראות הרכבה מפורטות שסופקו על-ידי היצרן. - חבר את ארבע המשאבות peristaltic ברצף "שרשרת חיננית" באמצעות כבלי RS-232, עם RS-232 לכבל USB מחובר למחשב השולט. חבר צינורות פולימר 3.18 מ"מ מזהה (למשל, Tygon) לכל ערוץ על כל רולר ערוץ משאבה.
הערה: לכל משאבה יש ארבעה רולים. כיוון וקצב זרימה של רולים הם מניפולציה ידנית. - הכנס מחברים בגודל 1/16 אינץ' x 1/8 אינץ' בסוף כל צינור פולימר בגודל 3.18 מ"מ. הכנס את קצה המחבר בגודל 1/16 אינץ' לצינורות פולימר של 1.59 מזהה ולאחר מכן הכנס את צינורות הפולימר לאינקובטור באמצעות יציאות מותאמות אישית. הנח את הקצה השני של הצינור בתמיסה שיוחד במהלך ניסויי IC-FPOP.
הערה: עבור קווי זלוף, החממה יש 36 יציאות מותאמות אישית עבור קווי צינורות בכל רחבי הפריפריה כדי להכיל את כל ריאגנטים בשימוש. - בורג אחד 50 מ"מ, 248 ננומטר, 45° מראה קו לייזר excimer בתוך תושבת מראה קינמטית עבור אופטיקה Ø2" לתוך לוח הלחם 10-11 נקודות רשת מן צמצם לייזר 248 ננומטר. מניחים את המראה השנייה בזווית של 90° לראשון בצד השני של האינקובטור. זווית המראה השנייה כלפי מטה בערך 45° להנחיית קרן לייזר לאינקובטור (איור 2F-J).
2. סנכרון ואוטומציה ראשונית של המערכת באמצעות תוכנת אינטגרציה
- התקן את הגירסה העדכנית ביותר של תוכנת האינטגרציה הדרושה כדי לשלוט על מנהלי ההתקנים והמשאבות.
- בהתייחסו למדריך המשאבה, שנה את שמות המשאבות החל מ- '5' והגדלת הערך. ניתן לשלוח את הפקודות למערכת המשאבה באמצעות תוכנית המשנה 'בקרה ידנית' בתוכנת האינטגרציה.
הערה: הגדרת משאבה למצב ערוץ משנה באופן אוטומטי את מוסכמת מתן השמות של המשאבה לסט, 1, 2, 3 ו- 4, המתאימה לארבעת ערוצי המשאבה. - פתח את תוכנת האינטגרציה לאוטומציה של חממת הפלטפורמה.
- בחר את שם התקן יציאת ה- USB המתאים (לדוגמה, COM4) המתאים לכבל ה- USB של מערכת המשאבה מהתפריט הנפתח של החיבור שכותרתו Comport עבור משאבות.
- לחץ על לחצן בונה התסריטים כדי לערוך/ליצור סקריפט לפלטפורמת החממה האוטומטית של הפלטפורמה. לחץ על שמור קובץ Script כדי לשמור את הרצף כקובץ טקסט ( איור3A).
הערה: לבונה התסריטים יש ממשק משתמש להגדרת הסקריפט עם הגדרות של מספר משאבה, כיוון, קצב, נפח, קוטר צינורות, מצב ערוץ והשהיה מתוזמן. - אם מצב הערוץ רצוי בהכנת הסקריפט, יש להקדיש שלב בתסריט לשינוי המשאבה במצב ערוץ ומחוצה לו, והשלבים הבאים המתאימים לערוצי המשאבה חייבים להיות מסומנים כמשאבות 1-4.
הערה: פעולה זו מבטיחה כי אין שתי משאבות יכול להיות בו זמנית במצב ערוץ במהלך סקריפט חממה פלטפורמה וכי כל משאבה מועברת בחזרה למצב מדור קודם לאחר הפקודות נשלחו לערוצים הדרושים. - לחץ על לחצן קרא סקריפט ובחר את קובץ ה- Script המתאים הרצוי לפעולת החממה של הפלטפורמה.
- עברו בין הלחצן 'הפעל רצף' למיקום ON (ירוק) כדי להפעיל את קובץ ה- Script ולאחר מכן לחצו על הלחצן START (איור 3B).
3. לגדל תאים באינקובטור הפלטפורמה
הערה: יש למקם תאים באינקובטור הפלטפורמה בתנאים סטריליים במכסה המנוע של תרבות התאים יום לפני הניסוי.
- פתח את חממת הפלטפורמה משלב הננו-מיקום ונתק את קווי הטמפרטורה, הגז ומכשיר האדים. לאחר ריסוס החממה עם 70% אתנול, למקם אותו מכסה המנוע תרבות התא.
- לגדל תאים T-175 על 80-90% מפגש לפני ההעברה.
הערה: המונח מפגש משמש כמדד למספר/כיסוי של התאים בצלחת תרבית תאים או בקבוקון. - הסר מדיה ושטוף באמצעות מאגר.
- נתק תאים באמצעות trypsin-EDTA באמצעות פרוטוקול היצרן.
- התחדש ב- 8 מ"ל של מדיה וספור את התאים.
- זרע פיברונקטין / קולגן14 מצופה שש בארות לוחות עם כ 90-95 μL של תאים בשימוש חוזר בכל באר. נפח זה יהיה מתאים להשיג 80-90% מפגש (~ 1.2 מיליון תאים) בכל באר ביום המחרת.
הערה: צלחות שש באר חייב להיות מצופה קולגן לפני הזריעה. ריאגנטים המשמשים במהלך IC-FPOP חדורים עם קצבי זרימה מהירים. לוחות מצופים להבטיח תאים אינם מנותקים בטרם עת עקב עירוי של ריאגנטים. - מניחים את הצלחת הזרעים לתוך חממת הפלטפורמה ומכסים במכסה הקוורץ.
הערה: במהלך התכנון והפיתוח שונה מכסה חממת הזכוכית לקוורץ, כך שהוא תואם לאור הלייזר האולטרה סגול. - החלף ואבטח את חממת הפלטפורמה בחזרה על שלב כונן nanopositioning. חבר מחדש את קווי הטמפרטורה, הגז ומכשיר האדים.
- תן לתאים לגדול ל המפגש בן לילה.
הערה: השלבים הבאים של תרבית התאים הם אופציונליים ומיועדים לניסויים שבהם תאים אנושיים מוחדרים באופן חולף. צעדים אלה מעריכים את יעילות ההעתקה בתנאים של תרבות התא. - להצליב את פלסמיד המכיל את הגן עבור חלבון כימרי GCaMP2 לתוך HEK 293 תאים באמצעות ערכת טרנספטציה מקצועית-שומנים מסחרית.
- בצע טרנזיט ארעי של GCaMP2 בתאי HEK293T בשתי לוחות שש בארות.
- דגירה צלחת אחת שש באר באינקובטור פלטפורמה, ואת הצלחת השנייה שש באר באינקובטור CO2 סטנדרטי.
- השווה יעילות transfection בתוך כל צלחת על ידי הדמיה פלואורסצנטית באמצעות מיקרוסקופ פלואורסצנטי.
4. הפוך את חיץ הרווה ו H2O2
- הפוך 100 מ"ל של מאגר מרווה המכיל 125 mM N-tert-Butyl-α-פניניטרון (PBN) ו 125 מ"מ N, N′-דימתילתיאוריה (DMTU).
הערה: DMTU ו- PBN הם אוכלי נבלות רדיקלים חופשיים והם חדירים לתאים. - לדלל H2O2 עד 200 מ"מ. כל דגימה דורשת 6 מ"ל של H2O2 כדי לטבול באופן מלא את שכבת התאים בתחתית כל באר.
הערה: מאגר המרווה נעשה יום קודם לכן ומאוחסן ב 4 מעלות צלזיוס לילה, מוגן מפני אור. לדלל את H2O2 ביום הניסוי.
5. הקם את חממת הפלטפורמה עבור IC-FPOP
הערה: חממת הפלטפורמה חייבת להיות מורכבת בתנאים סטריליים. להרכיב את האינקובטור במכסה המנוע של תרבות התא סטרילי.
- פתח את חממת האסדה משלב המיקום ונתק את קווי הטמפרטורה, הגז ומכשיר האדים.
- לאחר ריסוס האינקובטור עם 70% אתנול, למקם אותו מכסה המנוע של תרבות התא.
- הסר את לוחית שש הבארות מהחממה של הפלטפורמה, אבטח את המכסה המקורי של הצלחת ואשר את המפגש עם התאים באמצעות מיקרוסקופ.
- לאחר אישור מפגש התא, החלף את הצלחת שש באר עם תאים confluent בחזרה באינקובטור פלטפורמה בתוך מכסה המנוע של תרבות התא.
- הכנס שלוש צינורות פולימרים חתוכים מראש (15 ס"מ) של 1.59 מזהה בכל באר דרך היציאות המוטבעות. לשטוף את הצינורות לקירות הבאר ולהחזיק עם טבעות מודפסות 3D מותאם אישית.
הערה: שש טבעות מודפסות 33 מ"מ PLA נימה 3D תוכננו בהתאמה אישית כדי לאבטח את הצינור לקירות הצלחת מבלי להפריע לתאים או להפריע לדופק הלייזר. - כסו את חממת הפלטפורמה במכסה הקוורץ שלה. החלף ואבטח את החממה העליונה של הבמה במערכת המיקום. חבר מחדש את קווי הטמפרטורה, הגז ומכשיר האדים.
- חבר צינורות פולימר עם 1.59 מזהים לקצה 1/16 אינץ' של מחברי 1/16x1/8 אינץ'.
6. ביצוע IC-FPOP בחממת הפלטפורמה
- הכן סקריפט תוכנת אינטגרציה לנסיגת משאבה. השתמש במשאבה פריסטלית אחת (Pump 8) כדי להסיר לחלוטין את מדיית התאים מכל שש הבארות.
- ממיסים ראשוניים בכל ערוץ של שלוש המשאבות הפריסטליות האחרות (משאבות 5-7). להחדיר H2O2 ולחוצץ להרוות בצינורות לסירוגין שלהם בהתאמה עד ריאגנטים להגיע ליציאות האינקובטור.
- ודא שקרן הלייזר זוויתית כראוי על ידי המראות ומגיעה לאינקובטור ללא מעצורים.
הערה: יש לענוד משקפי בטיחות בלייזר בכל פעם שהלייזר נמצא בשימוש. אל תקרינה את התאים בטרם עת במהלך תהליך ההקרנה/היישור. השתמש בקרטון כדי לכסות לחלוטין את מכסה הקוורץ בעת יישור הקרן. כמו כן, השתמש בקווי מתאר מודפסים על נייר לבן של צלחת שש בארות כדי לאשר עוד יותר שקרן הלייזר פוגעת במרכז כל באר. השתמש בהגדרת הדופק הרציף בתדר ובאנרגיה הנמוכים ביותר ליישור. - בדוק אנרגיית לייזר באמצעות חיישן חיצוני. השתמש פולס לייזר אחד יחיד של 160 mJ ב 50 הרץ ו 27 kV.
הערה: דרוש טיימר עבור השלבים הבאים. - הכינו את סקריפט תוכנת האינטגרציה לעירוי משאבה לאחר אישור יישור הקרן.
- התחל את שעון העצר ולחץ על לחצן התחל בקובץ Script של משאבת תוכנת האינטגרציה בו-זמנית.
- להחדיר 200 מ"מ H2O2 ב 35 מ"ל / דקה לתוך הבאר הראשונה (6-10 סימן שני על טיימר).
הערה: יש עיכוב של חמש שניות לפני משאבה מתחיל להחדיר. זה גם לוקח את הלייזר שבע שניות לפני הדופק מופעל. פולס הלייזר חייב לבוא מיד לאחר עירוי H2O2. - לחץ על לחצן התחל בתוכנת הלייזר בסימן 5 השניות כדי להפעיל את הדופק בסימן 11 השניות על שעון העצר.
- להחדיר 125 מ"מ להרוות פתרון ב 35 מ"ל / דקה לתוך הבאר הראשונה מיד לאחר פולס הלייזר. הזז ידנית את שלב המיקום כדי ליישר את הבאר הבאה עם קרן הלייזר.
- חזור על השלבים לעיל 6.5-6.9 עד שכל באר תעובד.
הערה: IC-POP מבוצע משולש טכני של שלושה לייזר ושלוש דגימות שאינן לייזר. צלחת אחת מעובדת של שש בארות משמשת כשכפול ביולוגי אחד. - במכסה המנוע של תרבות התא, השתמש במגרד תאים כדי להעביר את התאים מכל באר לצינורות חרוטיים בודדים של 15 מ"ל. תאי צנטריפוגה ב 1,200 x g במשך 5 דקות.
- השלך את התאים supernatant ו resuspend ב 100 μL של מאגר תמוגה RIPA.
- העבר תאים לצינורות פוליפרופילן בודדים של 1.2 מ"ל.
- פלאש להקפיא את כל הדגימות חנקן נוזלי ומניחים במקפיא -80 מעלות צלזיוס עד השימוש.
הערה: ניתן להשהות את הפרוטוקול כאן.
7. מיצוי חלבונים, טיהור ופרוטאוליזה
- להפשיר את הדגימות ואת החום ב 95 מעלות צלזיוס בגוש חום במשך 5 דקות.
- לאחר החימום, מצננים על הקרח במשך 5 דקות.
- מוסיפים 25 יחידות של גרעין לליסט התא כדי להשפיל דנ"א חד-גדילי, דו-גדילי, ליניארי ומעוקל ו-RNA ולהדגיר בחדר ממוזג במשך 15 דקות.
- דגימות צנטריפוגה ב 16,000 x g במשך 10 דקות ב 4 מעלות צלזיוס.
- לאסוף את supernatant ולהעביר צינור פוליפרופילן נקי.
- בדוק את ריכוז החלבון באמצעות בדיקת חלבון צבעונית.
- להעביר 100 מיקרוגרם של מדגם לצינור פוליפרופילן נקי ולהביא 100 μL עם מאגר תמוגה התא.
- להפחית דגימות עם 10 מ"מ dithiothreitol (DTT) ב 50 מעלות צלזיוס במשך 45 דקות.
- דגימות קרירות בטמפרטורת החדר במשך 10 דקות.
- אלקילאט עם 50 מ"מ iodoacetamide (IAA) בטמפרטורת החדר במשך 20 דקות.
הערה: הגן על רשות העתיקות מפני אור - הוסף 460 μL של אצטון מצונן מראש (-20 מעלות צלזיוס). דגימות וורטקס ומניחים ב -20 מעלות צלזיוס לילה.
הערה: ניתן להשהות את הפרוטוקול כאן. - למחרת, דגימות צנטריפוגה ב 16,000 x g במשך 10 דקות ב 4 מעלות צלזיוס.
- הסר אצטון מבלי לשבש את גלולת החלבון.
- הוסף 50 μL של 90% מראש מצונן (-20 מעלות צלזיוס) אצטון. דגימות וורטקס לערבב וצנטריפוגה ב 16,000 x g במשך 5 דקות נוספות ב 4 מעלות צלזיוס.
- הסר אצטון ולתת דגימות יבש במשך 2-3 דקות.
- גלולת חלבון resuspend עם 10 mM Tris חיץ pH 8.
- Resuspend MS כיתה טריפסין (20 מיקרוגרם מלאי) ב 40 μL של 10 mM Tris מאגר pH 8 ולהוסיף 2.5 מיקרוגרם של טריפסין לכל מדגם.
- דגימות דגירה ב 37 מעלות צלזיוס לילה.
הערה: ניתן להשהות את הפרוטוקול כאן. - להעריך את ריכוז הפפטיד באמצעות בדיקת פפטיד צבעונית.
- להרוות את הדגימות עם 5% חומצה פורמית.
- להעביר 10 מיקרוגרם של מדגם לצינור פוליפרופילן נקי.
- יבש את המדגם באמצעות צנטריפוגה ואקום resuspend עם 20 μL של MS כיתה 0.1% חומצה פורמית (FA) במים.
- מעבירים כל דגימה לבקבוקונים נקיים של דגימה אוטומטית עם אותיות חתוכות מראש.
8. כרומטוגרפיה נוזלית בעלת ביצועים גבוהים-ספקטרומטריית מסה טנדם (LC-MS/MS)
- כדי להתאים לשפות FPOP שינויים, לנתח את lysate התא מתעכל באמצעות ניתוח LC-MS/MS.
- השתמש בשלבים ניידים של 0.1% FA במים (A) ו 0.1% FA באצטוניטריל (ACN) (B).
- טען 0.5 מיקרוגרם של מדגם על 180 מיקרומטר x 20 מ"מ C18 (5 מיקרומטר ו 100 Å) עמודת השמנה ולשטוף את העמודה עם 99% (A) ו 1% (B) במשך 15 דקות.
- באמצעות 75 מיקרומטר x 30 ס"מ C18 (5 מיקרומטר ו 125 Å) עמודה אנליטית, elute ופפטידים מתעכלים נפרדים עם קצב זרימה של 0.300 μL / min במשך 120 דקות.
- הפעל הדרגתי LC כדלקמן: 0-1 דקות, 3% ממס B; 2-100 דקות, 10-45% B;100-110 דקות, 45-100% B; 110-115 דקות, 100% B.
- תחדש את העמודה ב- 3% (B) מ- 115-116 דקות והחזק ב- 3% (B) מ- 116-120 דקות.
- לנתח פפטידים eluted במצב יון חיובי עם יינון ננו electrospray.
- השג ספקטרום MS1 בטווח סריקה של 375-1500 ברזולוציה של 60,000.
- הגדר את יעד בקרת הגברה אוטומטית (AGC) ל- 5.0e5 עם זמן הזרקה מרבי של 50 אלפיות השנייה ו- 5.0eסף 4 אינטנסיביות.
- בודד יונים מבשרים עם מצבי טעינה 2-6 באמצעות רכישה תלוית נתונים (DDA) עם חלון בידוד של 1.2 מ'/z וזמן מחזור של 4 שניות.
- הכפיף יוני MS2 לדיסוציאציה התנגשות באנרגיה גבוהה (HCD) (32% אנרגיה מנורמלת).
- אל תכלול פפטידים לאחר רכישת MS/MS למשך 60 שניות.
- הגדר את רזולוציית MS/MS ל- 15,000 עם יעד AGC של 5.0e4 וזמן הזרקה מרבי של 35 אלפיות השנייה.
9. מגלה פרוטאום/עיבוד נתונים
- חפש קבצי נתונים גולמיים דו-מושביים בתוכנת ניתוח פרוטאומיקה מלמטה למעלה מול מסד נתונים רלוונטי של חלבונים של הומו ספיינס ואנזים לעיכול.
- הגדר את פרמטרי החיפוש של ניתוח החלבון.
- הגדר עמידות שברים ל- 0.02 Da וסובלנות יון אב ל- 10 עמודים לדקה.
- הגדר ספציפיות אנזים כדי טריפסין ולאפשר מחשוף אחד שלא נענו.
- הגדר את טווח המסה ל- 375-1500 מ'/z.
- לבסס אמון פפטיד ב 95% (בינוני) ושאריות אמון ב 99% (גבוה).
- קבל חלבונים אם מזוהים לפחות שני פפטידים נפרדים עם מסנן שיעור הגילוי (FDR) של 5%.
- הגדר carbamidomethylation כשינוי סטטי וכל השינויים הידועים הידרוקסיל רדיקלי שרשרת צד15,16 כמו שינויים דינמיים.
- לאחר שהקבצים מסיימים לחפש, לייצא רצף, לשנות מיקומים, הצטרפות לחלבון, קובץ ספקטרום, שפע מבשר, ושמירת מידע זמן למסד נתונים אלקטרוני.
- חשב את מידת השינוי לכל פפטיד או שאריות משוואה זו:
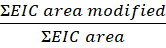
הערה: אזור EIC שונה הוא אזור כרומטוגרפי יון שחולץ (EIC) של פפטיד או שאריות עם שינוי חמצוני, ואזור EIC הוא האזור הכולל של אותו פפטיד או שאריות עם וללא שינוי חמצוני. עם הזמן, חלבון בנוכחות מי חמצן יתחמצן, וכתוצאה מכך חמצון רקע. כדי לחשב את מידת השינוי, האזור של הפפטיד שהשתנה מחולק לפי השטח הכולל. דוגמה לבקרה שאינה מוקרנת מהווה חמצון רקע. חמצון הרקע מדגם הבקרה מנוכה מהמדגם שטופל בלייזר כדי לזהות שינוי FPOP.
תוצאות
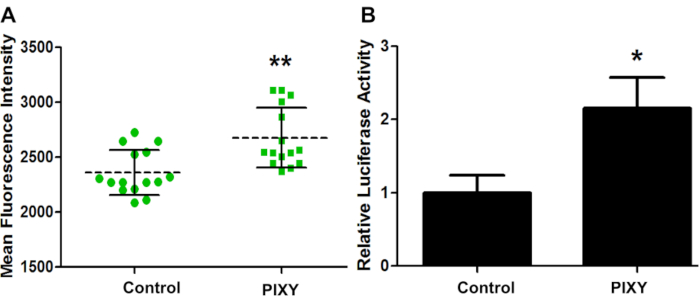
כדי לאשר שתנאי החממה של הפלטפורמה מספיקים לתרבות התאים בפלטפורמת הלייזר, GCaMP2 הוחלף באופן ארעי לתוך HEK293T ויעילות ההעתקה לשני הלוחות הוערכה באמצעות הדמיית פלואורסצנטיות(איור 4A). GCaMP2 הוא חלבון פלואורסצנטי חישת סידן המשמש כחיווי סידן תאי מקודד גנטית. זהו היתוך של חלבון פלואורסצנטי ירוק (GFP) וחלבון מחייב סידן, calmodulin. בדיקת לוציפראז בוצעה בתאי HEK 293 עם פלסמיד פרל-TK על מנת לכמת יעילות של פליטת רוחב(איור 4B). תוצאות אלו מראות כי חממת הפלטפורמה חרגה מביצועי החממה הסטנדרטית, עם עלייה של פי 1.13 ביעילות ההעתקה, ומספקת אמת מידה כמותית לסביבת תרבות התאים האופטימלית.
שינויים ב-FPOP בתאי HEK293T המסומנים במערכת הזרימה הושוו לאלה שסומנו בחממת הפלטפורמה והראו כי חממת הפלטפורמה עולה על מערכת הזרימה הן במספר החלבונים ששונו (איור 5)והן בכיסוי FPOP הכולל בחלבונים אלה. מספר החלבונים ששונו על ידי FPOP שנרכשו בחממת הפלטפורמה היה כ-1051, פי 2.2 יותר מאלה שנרכשו בניסוי טיפוסי. שינויים שולבו בין שני משכפלים ביולוגיים עבור כל ניסוי. יתר על כן, PIXY מספק תפוקה גבוהה יותר.
כדי להדגים את היתרון של כיסוי שינוי גבוה יותר על פני חלבון, שינויים IC-FPOP היו מקומיים ברמת פפטיד ואת היקף השינוי היה לכמת להבחין הבדלים בתוצאות בין המערכות עבור actin, חלבון חומצת אמינו 375. במערכת הזרימה זוהו שני פפטידים ששונו, המספקים מידע מבני מוגבל (איור 6A). עם זאת, חמישה פפטידים מותאמים המשתרעים על רצף האקטין זוהו באינקובטור הפלטפורמה. ספקטרום מסה טנדם מצביע על כך שהשאריות Pro322 שונו וזוהו בכל ניסוי (איור 6B). חמשת הפפטידים ששונו בדגימות החממה הכילו 12 שאריות ששונו, בעוד שרק ארבע שאריות שונו באמצעות מערכת הזרימה (איור 6C). הגידול בכיסוי החמצון מספק מידע מבני רב יותר על פני החלבון.
אספינו ואח 'הדגימו את היכולת של FPOP להתבצע vivo (IV-FPOP) בתוך C. elegans, מודל תולעת למחלות אנושיות מדינות17. בעוד IV-FPOP מבוצע גם באמצעות מערכת זרימה, מערכת PIXY נבדקה לתאימות עם התולעים. כ-10,000 תולעים דגירו בכל באר באינקובטור הפלטפורמה ב-20 °C (LC-MS/MS) ניתוח גילה כי 792 חלבונים שונו על ידי IV-FPOP בחממת הפלטפורמה בהשוואה ל-545 החלבונים ששונו עם מערכת הזרימה (איור 7). תוצאות אלה מראות כי בנוסף לתרבות התאים הדו-מימדית, מתודולוגיה חדשה זו תואמת גם את המחקר של מערכות ביולוגיות אחרות כגון C. elegans.
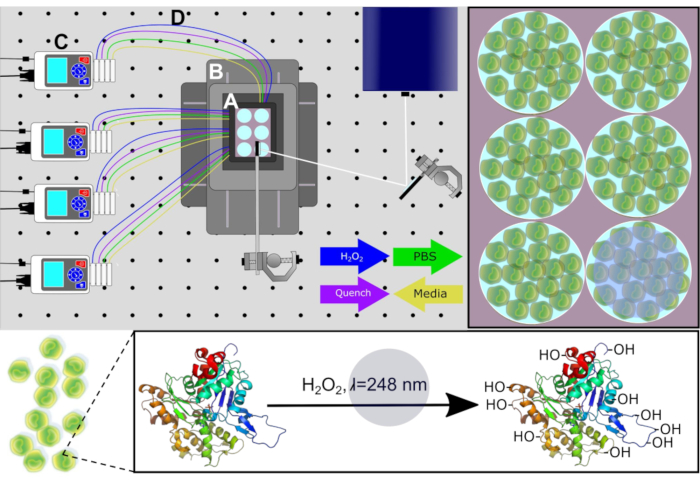
איור 1. סכמטי של מערכת PIXY. רכיבי מערכת: (A) חממה שלב העליון, (B) מערכת מיקום , (C) משאבות peristaltic, ו - (D) קווי זלוף. מדיה תרבות התא מוסר מכל באר באמצעות משאבות לפני H2O2 ופתרונות להרוות הם חדורים בנקודות זמן מחושבות. שביל לייזר להקרנה לראווה בלבן. הודפס מחדש באישור ג'ונסון, ד.ט., פונשון-סמית', ב', אספינו, ג'יי.איי, גרשנסון, א', ג'ונס, ל.M,, הטמעת חמצון פוטוכימי מהיר בתא של חלבונים באינקובטור פלטפורמה עם שלב XY מטלטלין. כימיה אנליטית, 92(2), 1691-1696 2019. זכויות יוצרים 2020 האגודה האמריקנית לכימיה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2. מערכת PIXY מורכבת במלואה. (A) מערכת ניטור מגע, (B) יחידת פחמן דו חמצני, (C) יחידת טמפרטורה, (D) משאבת אוויר, (E) מפזר אדים, (F)מראות אופטיות, (G) חממת פלטפורמה, (H) שלב מיקום, (I) 248nm לייזר exrF excimer, ו - (J) משאבות פריסטאליות. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
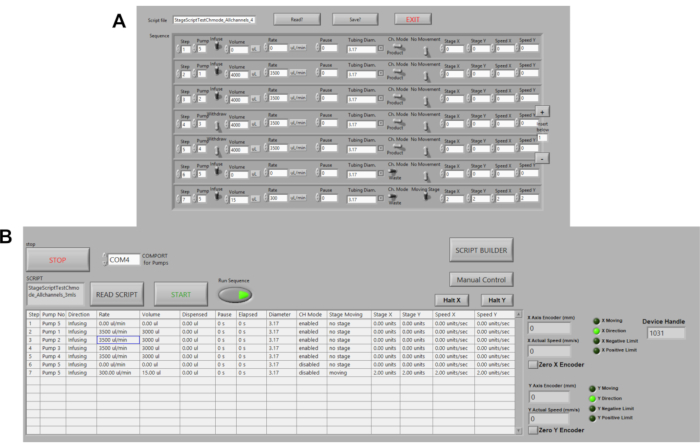
איור 3. אוטומציה של משאבות פריסטליות. (A) קובץ Script לדוגמה של פקודות ב- LABVIEW. אפשרויות הפקודה כוללות נפח, קצב זרימה, השהיות, כיוון זרימה. המהירות, מרחק הבמה והמיקום נמצאים כעת באוטומציה. (B) קורא תסריטים ב- LABVIEW. כאן, קבצי Script של פקודות מועלים לאחר מכן הפעל רצף ו- START לחוצים ליזום משאבות. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 4. יעילות טרנס-פליטה של תא HEK. (A)עוצמת פלואורסצנט ממוצעת של השוואת החלקה GCaMP2 בין חממה סטנדרטית (Control) לבין חממה הבמה העליונה (PIXY). נקודות וריבועים מייצגים כל נקודה בבאר שבה ננקט מדד. (B)יעילות Transfection כמותי ומאומת עם פלסמיד וקטור שונה, pRL-TK. ערך P< 0.005. הודפס מחדש באישור ג'ונסון, ד.ט., פונשון-סמית', ב', אספינו, ג'יי.איי, גרשנסון, א', ג'ונס, ל.M,, הטמעת חמצון פוטוכימי מהיר בתא של חלבונים באינקובטור פלטפורמה עם שלב XY מטלטלין. כימיה אנליטית, 92(2), 1691-1696 2019. זכויות יוצרים 2020 האגודה האמריקנית לכימיה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
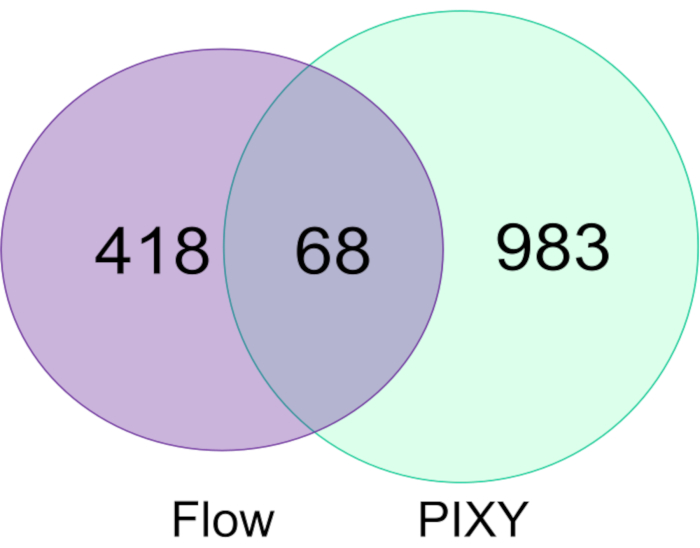
איור 5. השוואה של חלבונים ששונו במערכת זרימת התא הבודד ו- PIXY. דיאגרמת Venn של חלבונים ששונו באמצעות במערכת הזרימה (סגול) וב- PIXY (ירוק). הודפס מחדש באישור ג'ונסון, ד.ט., פונשון-סמית', ב', אספינו, ג'יי.איי, גרשנסון, א', ג'ונס, ל.M,, הטמעת חמצון פוטוכימי מהיר בתא של חלבונים באינקובטור פלטפורמה עם שלב XY מטלטלין. כימיה אנליטית, 92(2), 1691-1696 2019. זכויות יוצרים 2020 האגודה האמריקנית לכימיה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
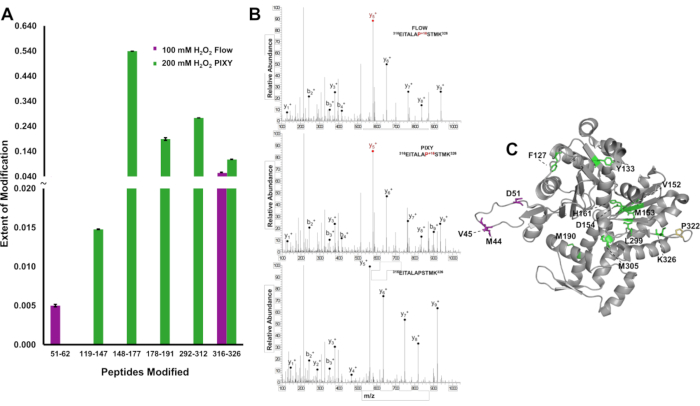
איור 6. לוקליזציה של שינויי IC-FPOP. השוואה בין שינויים IC-FPOP בין מערכות. (A)גרף עמודות של פפטידים שעברו שינוי חמצוני בתוך אקטין ממערכת הזרימה (סגול) לעומת חממת פלטפורמה (ירוק). (B)טנדם MS ספקטרום של אקטין (פפטיד 316-326) עם פרולין שונה בשתי המערכות ואקטין פפטיד (C) FPOP שונה שאריות של אקטין (PDB: 6ZXJ, שרשרת A 11 שאריות שונה בחממת פלטפורמה (ירוק), 3 שאריות שונה במערכת הזרימה (סגול), 1 שאריות שונה חופפות (צהוב). הודפס מחדש באישור ג'ונסון, ד.ט., פונשון-סמית', ב', אספינו, ג'יי.איי, גרשנסון, א', ג'ונס, ל.M,, הטמעת חמצון פוטוכימי מהיר בתא של חלבונים באינקובטור פלטפורמה עם שלב XY מטלטלין. כימיה אנליטית, 92(2), 1691-1696 2019. זכויות יוצרים 2020 האגודה האמריקנית לכימיה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
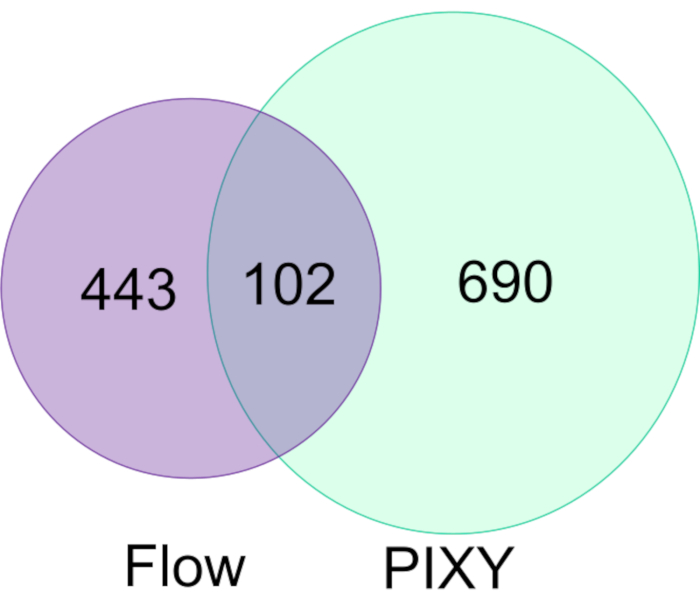
איור 7. השוואה של חלבונים ששונו על ידי FPOP ב- C. elegans לפי זרימה לעומת PIXY. יש עלייה של פי 1.5 בחלבונים שעברו שינוי חמצוני באמצעות PIXY בהשוואה למערכת הזרימה. הודפס מחדש באישור ג'ונסון, ד.ט., פונשון-סמית', ב', אספינו, ג'יי.איי, גרשנסון, א', ג'ונס, ל.M,, הטמעת חמצון פוטוכימי מהיר בתא של חלבונים באינקובטור פלטפורמה עם שלב XY מטלטלין. כימיה אנליטית, 92(2), 1691-1696 2019. זכויות יוצרים 2020 האגודה האמריקנית לכימיה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
חלבונים מבצעים חלק גדול מהעבודה בתאים חיים. בהתחשב בחשיבות זו, יש צורך בנתונים מפורטים על תפקוד החלבון ומבנה מסדר גבוה יותר (HOS) בסביבה התאית כדי להעמיק את ההבנה של המורכבות במתחמים גדולים יותר ותגובות אנזימטיות בתאים לעומת מערכות מטוהרות. כדי לעשות זאת, שיטה להדפסת רגל חלבון רדיקלית הידרוקסיל (HRFP) אומצה בשם בתא חמצון פוטוכימי מהיר של חלבונים (IC-FPOP). רוב מחקרי FPOP נעשו במבחנה במערכות חלבון טהורות יחסית, המנוגדות במידה ניכרת לסביבה המולקולרית הצפופה המשפיעה על אינטראקציות מחייבות ודינמיקה קונפורמציה של חלבונים. כתוצאה מכך, יש תהום בין הממצאים מניסויי במבחנה 18 לבין אלה שיושגו בסביבה תאית בפועל. כדי לגשר על הפער בין התנאים האידיאליים של ניסוי FPOP במבחנה לבין האופי המורכב של התא, פותחה פלטפורמת FPOP אוטומטית חדשה בת שש בארות בפלטפורמת cell-FPOP. טכנולוגיית FPOP חדשנית זו מסוגלת לזהות ולאפיין מינים מולקולריים אלה ולאתר את האינטראקציות המולקולריות הדינמיות שלהם במצבים בריאים וחולים כאחד. פלטפורמה חדשה זו נקראת חממת פלטפורמה עם שלב Movable XY (PIXY).
FPOP שימש בהצלחה כדי לאפיין את המידע המבני בתוך הפרוטום. עם זאת, לכל טכניקה ביולוגית יש מגבלות מסוימות הדורשות שיפור נוסף. ריאגנטים ספציפיים נדרשים במהלך פוטוליזה בלייזר כדי להרוות ביעילות רדיקלים הידרוקסיל unreacted. הפרדת פפטידים מתעכלים יכולה לדרוש כמויות גדולות של זמן כדי למקסם את המידע המבני. שפע זה של מידע יכול גם לדרוש כמותיות נרחבת במהלך ניתוח נתונים שלאחר MS1. חממת הפלטפורמה, כולל המכונות ההיקפיות הדרושות לתרבות התאים ו- IC-FPOP בפלטפורמת הלייזר, מגיעה עם עלות גדולה שעשויה שלא להיות אפשרית עבור מעבדות מסוימות. ככל שההתקדמות ממשיכה להתבצע, כלי תוכנה וניתוח חזקים צריכים לקדם את הטכניקה עוד יותר; חלקם מוצגים במחקר זה. מחקרים עדכניים באינקובטור פלטפורמה זה בוצעו על תאי HEK293T וב- C. elegans. שיטת IC-FPOP הוכח להיות תואם עם מגוון רחב של קווי תאים כולל השחלה אוגר סינית (CHO), Vero, MCF-7, ו MCF10-A תאים19. מכיוון ששיטת IC-FPOP הכללית ניתנת לתרגום לפלטפורמה סטטית זו, קווי תאים אלה צריכים להיות נוחים למחקר גם באמצעות PIXY.
IC-FPOP מנצל H2O 2 כדי לשנות חמצונישרשראות צד נגיש ממס של חומצות אמינו, ולאחר מכן להבחין עוד יותר אינטראקציות חלבון, מבנה, והשפעות מטבוליות בתוך תאים קיימא אשר משמעותי במתן הקשר ביולוגי. זה חיוני לפני ניסוי IC-FPOP כדי לאשר כי התאים הם קיימא לאחר H2O2 תוספת. מחקרי הכדאיות של התא הראו כי התאים היו קיימא בנוכחות ריכוזי H2O2 עד 200 מ"מ 13. חשוב גם לוודא H2O2 הוא חדורים בריכוז הסופי של 200 mM ישירות על תאים לאחר הסרת מדיה. כישלון להסיר לחלוטין את המדיה תרבות התא יגרום ריכוזים שונים של H2O2. בהשוואה לתנאים סטנדרטיים, הגדלת זמן הדגירה ל -10 שניות יחד עם הגדלת ריכוז H2O2 הוביל למספר גבוה יותר של חלבונים ששונו על ידי IC-FPOP באינקובטור הפלטפורמה. זה הכרחי כדי משאבות פרייסטליות הממשלה לפני השימוש כדי להבטיח משאבות פועלות כראוי נוזלים מפוזרים. כישלון לעשות זאת עלול לגרום בועות אוויר בצינורות, נפח מספיק של H2O2 כדי לטבול תאים, ו / או נפח מספיק של פתרון להרוות.
בעיה נוספת שעלולה להתעורר היא עיכובים לא רצויים במערכת. דוגמה לכך היא תהליך אימות הפקודות שהתקבלו עבור מערכות המשאבה אשר מוסיף עיכובים משמעותיים בסדר גודל של 1000 אלפיות שניה או יותר באמצעות תוכנת האינטגרציה. ניתן לתקן בעיה זו על ידי מזעור התקשורת עם המשאבות במהלך הניסוי ושימוש בפקודות מוגדרות מראש מראש ככל האפשר.
בעתיד, המטרה של PIXY היא לייצר מערכת אוטומטית ומשולבת לחלוטין. בנוסף למשאבות peristaltic, הפעלת פולס הלייזר יהיה אוטומטי. מערכת מיצוב חדשה תנוצל גם לתנועה מהירה של חממת הפלטפורמה כדי לשפר את המהירות והדיוק. כל רכיבי המערכת ימשיכו להיות מתוכנתים באמצעות תוכנת האינטגרציה כדי להגדיל עוד יותר את התפוקה.
Disclosures
המחברים מצהירים שאין אינטרס כספי מתחרה.
המחקר המוצג בזאת קשור לבקשת הפטנט המוזכרת להלן:
מספר בקשה לפטנט בארה"ב: 17/042,565
כותרת: "מכשיר ושיטה לקביעת קיפול חלבונים"
מספר לוח הזמנים של UMB: LJ-2018-104 UMass Ref: UMA 18-059.
Acknowledgements
עבודה זו נתמכה על ידי מענק של NIH R01 GM128983-01.
Materials
| Name | Company | Catalog Number | Comments |
| Ismatec Reglo ICC Peristaltic Pumps | Cole-Palmer | 122270050 | |
| Kinematic Mirror Mount for Ø2" Optics | Thor Labs | ||
| 10X trypsin−EDTA | Corning | AB00490-00005 | |
| 50.0mm 248nm 45°, Excimer Laser Line Mirror | Edmond Optics | ||
| Acetone, HPLC Grade | Fisher Scientific | ||
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | ||
| ACQUITY UPLC M-Class Symmetry C18 Trap Column, 100Å, 5 µm, 180 µm x 20 mm, 2G, V/M, 1/pkg | Waters | 23275 | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| ACQUITY UPLC M-Class System | Waters | A53225 | |
| Afinia H480 3D Printer | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| air pump | OKOlabs | D12345 | |
| Aluminum Foil | Fisher Scientific | Stock #63-120 | |
| Aqua 5 µm C18 125 Å packing material | Phenomenex | ||
| carbon dioxide unit | OKOlabs | MadMotor®-UHV | |
| Centrifuge | Eppendorf | ||
| connectors (Y PP 1/16” and 1/16x1/8”) | Cole-Palmer | 116891000 | |
| Delicate Task Wipers | Fisher Scientific | 022625501 | |
| Dithiothreiotol (DTT) | AmericanBio | ||
| DMSO, Anhydrous | Invitrogen | LS118-500 | |
| Dulbecco’s phosphate-buffered saline (DPBS) | Corning | SK-78001-82 | |
| EX350 excimer laser | GAM Laser | PI89900 | |
| Fetal bovine serum (FBS) | Corning | SK-12023-78 | |
| Formic Acid, LC/MS Grade | Fisher Scientific | A929-4 | 4 L quantity is not necessary |
| HEK293T cells | Paul Shapiro Lab (University of Maryland Baltimore) | ||
| humidifier | OKOlabs | Nano-LPMW stage | |
| HV3-2 VALVE | Hamilton | BP152-500 | |
| Hydrogen Peroxide | Fisher Scientific | LS120-500 | |
| Iodoacetamide (IAA) | ACROS Organics | ||
| LABVIEW Professional 2018 | National Instruments | 86728 | |
| MadMotor Positioning system and controllers | Mad City Labs | W6-4 | |
| Methanol, LC/MS Grade | Fisher Scientific | 01-213-100 | any brand is sufficient |
| Microcentrifuge | Thermo Scientific | H301-T Unit-BL-PLUS | |
| N,N′-Dimethylthiourea (DMTU) | ACROS Organics | ||
| Nanopositioinging stage | Mad City Labs | ||
| N-tert-Butyl-α-phenylnitrone (PBN) | ACROS Organics | ||
| OKO Touch Monitoring System | OKOlabs | ||
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | 7Z02936 | |
| PE50-C pyroelectric energy meter | Ophir Optronics | ||
| Penicillin-streptomycin | Corning | ||
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Scientific | ||
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Scientific | ||
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 75002436 | |
| Pierce Universal Nuclease for Cell Lysis | Fisher Scientific | 06-666A | |
| pressure gauge | OKOlabs | OKO-AIR-PUMP-BL | |
| PTFE filter | OKOlabs | CO2-UNIT-BL | |
| Six 33 mm PLA filament rings | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| sterile incubator | OKOlabs | ||
| temperature unit | OKOlabs | OKO-TOUCH | |
| Thermo Scientific Pierce RIPA Buffer | Fisher Scientific | A117-50 | |
| TiNKERcad | (Innovation Space University of Maryland Baltimore Campus Library) | ||
| Tris Base | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| tubing (Tygon 3.18 and 1.59 ID) | Cole-Palmer | 177350250 | |
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | A454SK-4 | 4 L quantity is not necessary |
| Water, LC/MS Grade | Fisher Scientific | 88702 | |
| 90058 | |||
| KM200 | |||
| 186007496 |
References
- Johnson, D. T., Di Stefano, L. H., Jones, L. M. Fast photochemical oxidation of proteins (FPOP): A powerful mass spectrometry based structural proteomics tool. Journal of Biological Chemistry. 294 (32), 11969-11979 (2019).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemical Reviews. 120 (10), 4355-4454 (2019).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-883 (2019).
- Zhao, B., et al. Covalent Labeling with an α,β-Unsaturated Carbonyl Scaffold for Studying Protein Structure and Interactions by Mass Spectrometry. Analytical Chemistry. 92 (9), 6637-6644 (2020).
- Hambly, D. M., Gross, M. L. Laser Flash Photolysis of Hydrogen Peroxide to Oxidize Protein Solvent-Accessible Residues on the Microsecond Timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Li, K. S., Shi, L., Gross, M. L. Mass Spectrometry-Based Fast Photochemical Oxidation of Proteins (FPOP) for Higher Order Structure Characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Chea, E. E., Jones, L. M. Modifications generated by fast photochemical oxidation of proteins reflect the native conformations of proteins. Protein Science. 27 (6), 1047-1056 (2018).
- Hambly, D., Gross, M. Laser flash photochemical oxidation to locate heme binding and conformational changes in myoglobin. International Journal of Mass Spectrometry. 259 (1), 124-129 (2007).
- Yan, Y. Fast photochemical oxidation of proteins (FPOP) maps the epitope of EGFR binding to adnectin. Journal of the American Society for Mass Spectrometry. 25 (12), 2084-2092 (2014).
- Zhang, Y., Wecksler, A. T., Molina, P., Deperalta, G., Gross, M. L. Mapping the Binding Interface of VEGF and a Monoclonal Antibody Fab-1 Fragment with Fast Photochemical Oxidation of Proteins (FPOP) and Mass Spectrometry. Journal of the American Society for Mass Spectrometry. 28 (5), 850-858 (2017).
- Espino, J. A., Mali, V. S., Jones, L. M. In Cell Footprinting Coupled with Mass Spectrometry for the Structural Analysis of Proteins in Live Cells. Analytical Chemistry. 87 (15), 7971-7978 (2015).
- Rinas, A., Mali, V. S., Espino, J. A., Jones, L. M. Development of a Microflow System for In-Cell Footprinting Coupled with Mass Spectrometry. Analytical Chemistry. 88 (20), 10052-10058 (2016).
- Johnson, D. T., Punshon-Smith, B., Espino, J. A., Gershenson, A., Jones, L. M. Implementing In-Cell Fast Photochemical Oxidation of Proteins in a Platform Incubator with a Movable XY Stage. Analytical Chemistry. 92 (2), 1691-1696 (2019).
- Bangel-Ruland, N., et al. Cystic fibrosis transmembrane conductance regulator-mRNA delivery: a novel alternative for cystic fibrosis gene therapy. The Journal of Gene Medicine. 15 (11-12), 414-426 (2013).
- Gau, B. C., Chen, H., Zhang, Y., Gross, M. L. Sulfate Radical Anion as a New Reagent for Fast Photochemical Oxidation of Proteins. Analytical Chemistry. 82 (18), 7821-7827 (2010).
- Xu, G. C., et al. Hydroxyl Radical-Mediated Modification of Proteins as Probes for StructuralProteomics. Chemical Reviews. American Chemical Society. 107 (8), 3514-3543 (2007).
- Espino, J. A., Jones, L. M. Illuminating Biological Interactions with In Vivo Protein Footprinting. Analytical Chemistry. 9 (10), 6577-6584 (2019).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast Photochemical Oxidation of Protein Footprints Faster than Protein Unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Kaur, U., Johnson, D. T., Jones, L. M. Validation of the Applicability of In-Cell Fast Photochemical Oxidation of Proteins across Multiple Eukaryotic Cell Lines. Journal of the American Society for Mass Spectrometry. 31 (7), 1372-1379 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved