Method Article
用于细胞和药物输送应用的可注射超分子-纳米粒子水凝胶
摘要
本协议描述了可注射超分子-纳米粒子(PNP)水凝胶生物材料的合成和配方。这些材料在药物输送、生物制药稳定、细胞封装和输送方面具有应用性。
摘要
这些方法描述了如何制造成注射性超分子-纳米粒子(PNP)水凝胶用作生物材料。PNP水凝胶由两个组成部分组成:疏水性改性纤维素作为网络聚合物和自组装的核心壳纳米粒子,通过动态、多价相互作用充当非共效交叉链接器。这些方法既描述了这些自组装纳米粒子通过纳米沉淀的形成,也描述了两个组件的配方和混合,以形成具有可调谐机械特性的水凝胶。还详细使用动态光散射 (DLS) 和风湿学来描述合成材料的质量。最后,通过体外实验,证明了这些水凝胶对药物输送、生物制药稳定、细胞封装和输送的效用,以描述药物释放、热稳定性、细胞沉降和生存能力。由于其生物相容性、注射性和温和凝胶形成条件,该水凝胶系统是一个易于调谐的平台,适合多种生物医学应用。
引言
注射水凝胶是一种新兴的工具,以受控的方式向身体输送治疗细胞和药物1。这些材料可以装载药物或细胞,可以通过直接注射到表面组织或导管输送到深层组织以微创的方式施用。一般来说,可注射水凝胶由水膨胀的聚合物网络组成,这些聚合物网络通过瞬时物理相互作用相互交织在一起。在休息时,这些交叉链接为凝胶提供一个类似固体的结构,但在应用足够的机械力时,这些交叉链接会暂时中断,将材料转换为液体状状态,可以很容易地流动2。正是这些风湿特性,使物理水凝胶切变薄,并在注射3期间流经小针直径。注入后,对聚合物网络的材料进行改造,使其自我愈合,并迅速形成原位4、5的固体状凝胶。这些结构可以作为药物的缓慢释放库或组织再生的脚手架6,7。这些材料已应用于不同的应用,包括药物输送技术,再生医学和免疫工程1,8,9,10,11,12。
天然材料(如藻酸盐和胶原蛋白)和合成材料(如聚乙二醇(PEG)或类似的亲水聚合物)都已开发为生物相容注射水凝胶材料13,14,15。许多天然材料表现出批次变化,影响可重复性4,16。这些材料通常对温度敏感,在达到生理温度时进行固化:因此,处理这些材料会带来额外的技术和后勤挑战。合成材料允许更精确的化学控制和出色的可重复性,但这些材料有时可能受到不利的免疫反应,限制其生物相容性,一个关键的特点,在体内治疗应用6,18,19。最近的努力表明,在工程中涉及许多复杂的设计标准,包括优化机械性能,聚合物网络网格大小,生物活性分子线索,生物降解性,和免疫原性的材料20,21,22,23,24,25,26。所有这些因素都必须根据兴趣的应用来考虑,这意味着模块化、化学可调谐的平台是满足广泛应用的理想选择。
本方法描述了可注射聚合物纳米粒子(PNP)水凝胶平台的配方和使用,该平台具有可调谐的机械特性、高度的生物相容性和低免疫原性,并提出了生物活性分子线索27、28、29、30、31、32、33的结合点。这些PNP水凝胶由疏水性改性纤维素聚合物和自组装的核心壳纳米粒子组成,包括聚(乙二醇)-块-聚(乳酸)(PEG-PLA)27,34,相互作用,产生超分子网络。更具体地说,多德西尔改性羟基甲基纤维素聚合物(HPMC-C12)与PEG-PLA纳米粒子表面动态相互作用,并在这些纳米粒子之间架起桥梁,形成这个聚合物网络27,34。这些动态的多价相互作用使材料在注射过程中剪切变薄,并在给药后快速自我修复。PNP水凝胶组件通过简单的单锅反应很容易制造,PNP水凝胶是在温和条件下通过简单混合两个成分35而形成的。由于易于制造,该水凝胶平台具有高度可翻译的规模。PNP水凝胶的机械特性和网格尺寸通过改变配方中聚合物和纳米粒子组件的重量百分比来控制。先前与这个平台的研究表明,PNP水凝胶是高度生物相容的,可生物降解的,非免疫性28,30,31。总的来说,这些水凝胶在生物医学应用中具有广泛的效用,包括术后粘附预防、组织工程和再生、持续药物输送和免疫工程。
研究方案
在开始此协议之前,必须使用先前公布的方法27、28、29、30、31、36、37、38合成 HPMC-C12和 PEG-PLA。
1. 纳米粒子(NP)合成纳米沉淀
注:本节描述了单批 NP 的合成,在缓冲溶液中产生 250 μL 的 20 wt% NPs(每批 50 毫克干 PEG-PLA 聚合物)。有关步骤提供了增加批次数量的说明。
- 将 50 毫克 PEG-PLA 聚合物测量为 8 mL 玻璃闪烁小瓶,并添加 1 mL 丙酮三酯。漩涡完全溶解。
注意:要增加批次数量,请线性地缩放此步骤,并在单小瓶中添加所需的聚合物和溶剂总量。 - 将 10 毫升超纯水加入 20 毫升玻璃闪烁小瓶中,并加一个小搅拌棒。放在一个搅拌板设置为600转/ 米。
注意:如果步骤 1.1 已缩放,则仍需要为每个等效批次沉淀到单个闪烁小瓶中。例如,对于溶解在4mL丙酮三甲酸酯中的200毫克聚合物,准备4 x 20毫升闪烁小瓶。 - 要通过纳米沉淀形成 NP,请使用 200μL 移液器将 1 mL 的聚合物溶剂溶液滴入水中。搅拌2分钟。PEG-PLA 的 PLA 块不能在水中溶于水,因此,核心壳 NP 将以疏水的 PLA 块为核心进行自组装,亲水 PEG 块作为外壳进行自组装。
- 通过动态光散射 (DLS) 验证粒子大小。
注:此程序是专门为具有相关软件包的市售板阅读器编写的(参见 材料表)。有关使用替代仪器,请参阅仪器制造商描述的样品制备方法。- 用 80 μL 的超纯水稀释 20 μL 的 NP 溶液(分析浓度:1 毫克/mL PEG-PLA NPs)。将每口井 30μL 添加到透明底部黑色 384 井板(三方分析)。
- 使用软件包中的预设协议选项使用 DLS 板读取器测量每个样品的水动力半径和多散射度。作为典型协议的示例,设置数据收集参数,以获取每次采集 2-5 秒持续时间的 5-10 DLS 测量值,然后报告每口井的平均颗粒大小和分布,这些尺寸和分布来自球状蛋白质模型计算。要形成具有一致风湿特性的水凝胶,产生的颗粒应为 30-50 nm 的水动力学直径,多散(PD) < 0.2。
注意:如果 NP 小于预期,请在第 1.1 步中使用 75% 丙酮三酯 / 25% 二甲基硫氧化物 (DMSO) 的解决方案。增加DMSO在溶剂溶剂中的百分比通常会增加颗粒大小。
- 将 NP 解决方案从 20 mL 闪烁小瓶转移到离心滤光单元中。离心机在 4500 x g 1 小时集中 NP 解决方案到<250 μL。
- 将所需的缓冲液(如磷酸盐缓冲盐水 (PBS) 中再注入 20 wt% NPs。 派珀特将离心滤芯单元的内容重新放入焦油微中微管或玻璃闪烁小瓶中,在质量平衡上。使用少量(50-100μL)缓冲区冲洗过滤器,并确保收集所有NP。 添加缓冲区,达到250毫克的总质量。
注:在暂停期间可以汇集批次。NP 库存解决方案可在 4 °C 下存储约 1 个月。不要冻结。对于更长的存储空间,请在使用前通过 DLS 验证大小和多散度。
2. 水凝胶制剂和药物或细胞的封装
注:本节描述了 1 mL 的 2:10 PNP 水凝胶配方的制备,2:10 表示 2 wt% HPMC-C12 和 10 wt% NPs(12 wt% 总固体聚合物)和 88 wt% 缓冲液、药物货物溶液或细胞悬架。配方百分比可以变化,以产生具有一系列机械特性的水凝胶。例如,1:5 PNP水凝胶用于细胞沉降和生存实验结果。
- 在PBS(或其他选择缓冲区)中准备6 wt%HPMC-C12 的股票解决方案。溶解48小时,以确保聚合物完全分散。
注:HPMC-C12 库存解决方案在室温下稳定数月。但是,建议在 4 °C 下存储以抑制微生物生长。 - 将 333 毫克 6 wt% HPMC-C12 库存解决方案添加到 1 mL Luer 锁注射器中。
- 将 500 μL 的 20 wt% NP 库存解决方案添加到微型中微富格管中。添加 167 μL 的 PBS 和移液器混合。使用针头,用稀释的 NP 解决方案填充另一个 1 mL Luer 锁注射器。
注意:要装载药物货物,计算药物在水凝胶中所需的最终浓度,并将适当的量装载到与 NPs 混合的 PBS 的 167 μL 中。如果原位检测(如监测药物稳定性)需要分子探针,则以与上文描述的类似方式装载探针以装载毒品货物。要加载细胞,计算水凝胶中所需的最终细胞浓度,并将适当数量的细胞加载到与 NPs 混合的 PBS 的 167 μL 中。 - 使用肘部混合法35混合两个水凝胶组件(HPMC-C12和NPs)。
- 将 Luer 肘部连接器连接到含有 NP 溶液的注射器(可选地也包含药物货物或细胞)。将 NP 解决方案推过肘部,直到在开放端可见半月板。稍微向后拉,连接含有 HPMC-C12 解决方案的注射器。
注意:在混合过程中,必须尽量减少肘部连接中的空气,以防止气泡在整个水凝胶中形成和分散。当将细胞与肘部搅拌机混合时,注意更轻柔地混合,因为混合速度过快可能会使细胞受到高切变力,导致细胞死亡。 - 通过肘部搅拌机来回泵送两种溶液约 60 个周期,直到形成均匀、不透明的白色水凝胶材料。
- 将整个水凝胶体积推入一个注射器中。取出空注射器,将柱塞拉回装有凝胶的注射器上,从肘部连接器中回收材料。用针头或插头盖住。
注意:由于混合过程中的死空间,必须说明水凝胶体积损失的约300μL。例如,如果需要最终水凝胶体积的 700 μL,则应准备 1 mL 的水凝胶。水凝胶配方过程可以通过使用更大的注射器来扩展。然而,对于硬水凝胶配方,如2:10,它可能变得难以混合和注射从大于3mL的注射器的体积,由于注射器桶与肘部或针直径的比例增加。 - 在室温下将水凝胶存放在注射器中。但是,如果药物被封装,建议在 4 °C 的存储,除非药物制造商另有说明。不要冻结材料。
- 将 Luer 肘部连接器连接到含有 NP 溶液的注射器(可选地也包含药物货物或细胞)。将 NP 解决方案推过肘部,直到在开放端可见半月板。稍微向后拉,连接含有 HPMC-C12 解决方案的注射器。
3. 测量水凝胶配方的风湿特性
注:此协议与 材料表 中提及的具有 20 mm 锯齿板几何形状的商业风湿计特别使用。有关使用其他仪器,请参阅制造商的样品制备说明。
- 制定至少 700 μL 的 PNP 水凝胶用于风湿特征。
- 在锯齿状风湿板的中心注入材料。金额将因所选几何间隙而异。作为参考,700μm 的间隙需要 400-500 μL 的材料。
- 将风湿度计降低到修剪间隙(500-1000 μm),并缓慢地转动顶部风湿板,因为它与 PNP 水凝胶接触,以确保缝隙均匀而完全地填补。
- 检查PNP水凝胶的装载情况,使其覆盖整个流湿板表面。使用铲子或塑料修剪器轻轻修剪和去除任何多余的材料,使其有一个非常轻微的凸起的板。
- 将流光计降低到最终几何间隙,并验证样品是否干净加载。
- 使用振荡测试(如振幅或频率扫描)或流量测试(如流扫描或步进测试)测量样品的机械特性。
注意:在所示的代表性数据中,振荡振幅测试以 10 rad/s 的恒定频率运行。振荡频率扫描以恒定的 1% 应变运行,在振幅扫描的线性粘度范围内。流量扫描从高剪切率到低剪切率39。所有测试均以每十年收集 10 分的数据和室温完成。测试参数可能需要根据配方的特性进行调整。将更硬的 PNP 材料(如 2:10 配方)限制为高剪切率可能导致材料从流湿板中弹出,导致机械特征不准确,并且需要在随后的测试之间重新加载样品。下面显示的代表性数据可用于质量控制测试期间的比较。
4. 体外药物释放的特点
- 通过将玻璃毛细管切割到所需的长度来准备毛细管。使用一次性铲子或移液器尖端将少量环氧树脂推入管子末端以形成插头,从而密封每个管子的一端。允许环氧树脂设置每个制造商的建议时间。
注:管子必须短于注射针的长度。建议采用内径为 2-3μm 的管子,这样 2.5 内的长度将包含至少 300 μL 的总体积。 - 在含有感兴趣药物的注射器中,至少配制 500μL 的 PNP 水凝胶材料。将每个样品组用单独的注射器准备。
- 使用长皮下针(22G,4 英寸)在每根毛细管底部注射 100-200 μL 的 PNP 水凝胶。每组至少准备三根管子(三分)。
- (可选)将填充的毛细管放在圆锥离心管和离心机中,在 1000 x g 下放置 1 分钟,以确保水凝胶表面均匀。此步骤可能需要重复,根据需要更改时间和速度以平滑材料表面。
注意:确保离心机保持良好平衡。 - 使用注射器、针头或移液器,小心地在毛细管中的水凝胶顶部填充 200-300 μL 的 PBS。不要接触或打扰水凝胶的表面。用盖子或插头密封管,或用至少两层石蜡膜盖住管子。
- (可选)在 37 °C 下孵化样品,以模拟体内条件。
- 根据药物释放的预期时间尺度,在选定的时间点使用注射器和针头,小心地从每个毛细管中完全取出 PBS,而不会干扰水凝胶表面。用新鲜的 PBS 替换删除的音量。在适当条件下存储别名报价。
注:可以优化步骤 4.3、4.5 和 4.7 中的推荐量和时间点,以便在一定时间尺度内捕获体外药物释放,具体取决于材料中装载的药物数量以及释放到超自然物质的速度。对于缓慢释放的药物,所选时间点的样本可能是 6 小时、1 天、3 天、1 周和 2 周。阿里报价也可以分析,因为它们被收购,而不是存储。 - 研究结束后,使用ELISA、HPLC或荧光检测等适当方法分析药物,以量化在40、41、42点每个时间点释放的药物数量。适当的检测方法因感兴趣的药物而异。
注:体外释放研究可用于比较不同水凝胶制剂或药物货物之间的释放。体外释放时间尺度通常不直接指示体内释放的预期时间尺度。
5. 凝胶封装胰岛素的热稳定性特征
- 每组至少制图 1.2 mL PNP 水凝胶。按照第2.3节描述的程序,将胰岛素(药物货物)和硫氯乙烯T(ThT)(分子探针)放入PNP水凝胶中。
注:聚合的主要机制,因此,胰岛素的灭活是通过淀粉样纤维的形成。ThT是一个合适的分子探针,因为它在淀粉样纤维的存在下产生强烈的荧光信号,从而能够对胰岛素聚集进行原位监测。根据感兴趣的药物货物,可以通过不同的方法监测聚合。对于显示的代表性数据,胰岛素最终浓度为 6.7 或 10 毫克/mL,ThT 最终浓度为 25 μM。 - 使用 21 G 针,将每口井 200μL 的 PNP 水凝胶注入黑色 96 井板中。每个样本组至少应以三分位测量。密封板,带有光学透明胶粘板密封,以防止蒸发。
- 将板插入装有温度控制、震动和动能读取编程的板式读取器中,并开始读取协议。使用以下条件使用市售板阅读器(见材料表)获取了代表性数据:
- 压力老化条件:连续线性摇晃(410 cpm,5 mm),在37°C。
- 数据采集:以20分钟为间隔激发/排放450纳米/482纳米
注:如果没有具有温度控制、摇床和动能读取功能的板读取器,板可以放置在孵化器中的摇床板上,并在选定时间点手动读取高于波长。
- 将数据绘制为每组的平均荧光信号。聚合时间可以通过定义任意信号阈值43来量化。
注:对于下文所示的代表性数据,阈值定义为 750,000 个任意荧光单元 (AFU)。此值选择高于测量基线,同时仍然足以捕获由荧光信号急剧增加指示的聚合开始。 - 当样品聚合或视觉上开始脱水时,终止检测。
6. 评估细胞生存能力
- 按照上述协议(通常为 1 - 5 x 106 细胞/mL)制定至少 2 mL 的 PNP 水凝胶,其中含有所需的细胞浓度。将每个样品组用单独的注射器准备。
- 使用 21G 针头,在透明底部 96 井板中将 150μL PNP 水凝胶注入每口井中;每口井都是一个复制品。每个样本组每个时间点应有 3-5 个复制。将板在50 x g 上离心2分钟,均匀地将水凝胶铺入井中。
- 在水凝胶顶部添加 100 μL 的相应细胞介质。每天删除此媒体并添加 100 μL 新媒体。
- 在第 1 天,取出水凝胶顶部的介质,为每个样本组指定的复制点。在水凝胶顶部添加 50 μL 的 2 mM 钙素 AM 溶液。孵化30分钟。
注:钙素AM可用于识别和标记活细胞。在活细胞中,非荧光钙素AM通过乙酰甲基酯水解后的细胞内酯酶转化为绿色荧光钙素。 - 使用共聚焦显微镜将每口井的中心映入 96 井板中。测量面积至少 300μm2,z 堆栈至少跨越 150 μm。使用共聚焦波长设置捕捉钙化物的荧光(激发/发射:495 nm/515 nm)。
- 根据需要,在每个后续时间点重复步骤 6.4 和 6.5。
- 要分析每个图像,请使用 FIJI 或类似软件将所有 z 堆栈图像折叠成单平面最大强度图像。量化每个图像中的荧光细胞数量。与第一天的荧光细胞数量相比,每个时间点的荧光细胞数量比例是PNP水凝胶中的相对细胞生存能力。
7. 评估细胞沉降
- 计算在最终浓度为 5 x 106 细胞/mL 时形成 500-700 μL PNP 水凝胶所需的细胞数量。将 1 mL PBS 中的细胞悬浮在浓度为 1 x 106 细胞/mL 中。通过添加50μL的2m钙素AM染色细胞。用染料孵化细胞10分钟。
- 在适当条件下的离心机单元,取出 PBS 并重新注入形成所需 PNP 水凝胶 500-700 μL 所需的 PBS 体积中的细胞。
注:产品文档中通常提供建议的速度和持续时间,以离心机每个特定的单元格类型。 - 按照协议第 2 节,用染色细胞(5 x 106 个细胞/mL)制定 500-700 μL 的 PNP 水凝胶。
- 使用 21G 针头,注射 100-200 μL 的 PNP 水凝胶,其中含有库维特底部的染色细胞。每个样本应执行三个复制。注射时在库维特内来回移动针头,以防止气泡形成。
- 立即(时间t=0),图像的cuvette躺在他们的身边,在整个平面凹槽矩形区域在库维特的底部。使用圆环瓷砖扫描功能对整个井区进行成像,并在 100 μm 深度内以 3D 成像 Z 栈。对于以后的可视化,要么使用共聚焦显微镜软件拼接所有单独的瓷砖,并执行最大强度投影,以形成一个大面积的单一图像,要么在个人计算机上使用FIJI软件44,45。
- 成像后,直立立立。
- 图像在1小时和4小时观察细胞是否已经定居在水凝胶或他们是否保持悬浮。
注意:这些时间点是建议,可以根据需要修改。 - 要分析每个图像,将所有 z 堆栈图像折叠成单平面最大强度图像。使用 FIJI 或类似软件,通过测量 cuvette 的中心垂直轮廓下的荧光强度来量化细胞分布,以确定沉降程度。
结果
PNP水凝胶制造和定性
PNP水凝胶是通过混合两个主要成分形成的-疏水改性HPMC聚合物和PEG-PLA纳米粒子(图1a)。治疗性货物最容易被纳入额外的缓冲,用于在水凝胶制备之前稀释纳米粒子成分。对于下游生物医学特征,使用肘部混合方法便于使用,使两个组件(图1b)的混合简单且可重复。充分混合后,水凝胶应感觉牢固的注射器,但在压力下屈服,从标准针(21G显示)(图1c)挤出。注水后,水凝胶应迅速设置为固体状材料,以抵抗来自重力的流动。为了充分描述水凝胶的特征,并确保一致的批次产品,应使用流光计上的几个不同实验对样品进行分析。凝胶的剪切和自我修复能力将很容易观察到使用流扫描协议和步切变协议,分别(图2a,b)。对于更硬的凝胶,如 2:10 配方,用户应寻找粘度,以减少至少两个数量级的流量扫描期间,剪切率从 0.1 增加到 100s-1,从而模拟注射期间的机械条件。步切协议应显示高剪切步骤下粘度降低的量级顺序,以及在低剪切步骤期间快速返回(<5 s 恢复时间)以基线粘度。使用线性粘胶态的振荡剪切频率扫描实验对存储和损失莫杜利进行特征化应显示频率范围为 0.1-100 rads-1(图 2c)的实心样属性。特别是,通常不应该有剪切存储和损失莫杜利的交叉,这是可观察到的低频率更硬的配方,如2:10水凝胶。这种交叉事件可能表明起始材料的质量问题,无论是经过改进的 HPMC 或 PEG-PLA 聚合物,还是 PEG-PLA 纳米粒子的大小和分散性。应当指出,对于较弱的水凝胶配方(如 1:5 水凝胶),可预期会出现交叉事件。PNP水凝胶上的振荡剪切幅度扫描显示,材料在应用高应力值之前不会产生,这表明这些材料具有产量应力,即材料流动所需的阈值应力。
PNP水凝胶释放动力学的特征
设计用于药物输送的PNP凝胶的一个重要步骤是从选定的配方中描述药物释放动力学。这有几个技术,但一个简单的体外方法提供了有用的数据,在早期配方开发(图3a)。通过调节 HPMC-C12或 NPs 的数量来改变 PNP 水凝胶的聚合物含量是调整这些水凝胶的机械特性和网格大小的最简单方法,它们可以直接影响货物通过聚合物网络的扩散和材料释放率(图 3b)。对于大于动态网格大小(即高分子量或大水动力半径)的货物,研究人员应期望从水凝胶库缓慢、溶解介释货物。动态网状尺寸大于或等于货物大小的配方将允许使用传统的货物扩散模型描述扩散介导释放,并释放 46、47、48、49。根据释放曲线的形状,研究人员可以调整水凝胶,使其向慢(例如,增加聚合物含量)或更快(例如,减少聚合物含量)释放。
评估治疗货物的稳定性
在开始前环状或细胞研究之前,确定水凝胶配方中治疗货物的稳定性至关重要。与其他合成药物方法相比,PNP水凝胶通过混合到散装材料中,以温和的方式将货物纳入其中,封装不太可能损坏货物。这些研究表明,PNP水凝胶还可以稳定易受热不稳定(如胰岛素)的货物,大大延长保质期,减少对冷藏和分配的依赖(图4)。重要的是在封装到水凝胶中以及长时间储存后立即评估货物的状况。这些数据表明,胰岛素在连续热和机械应力下储存28天后,在水凝胶中保持稳定,使用简单的荧光检测来测量胰岛素聚合。对于无法进行适当板检测的情况,另一种技术是对货物进行圆形二分法测量,这对于确定蛋白质药物的二级结构特别有用。
确定PNP水凝胶中的细胞生存能力和分散性
许多治疗细胞需要粘附图案才能保持活力,因此加入精氨酸-甘氨酸-阿斯巴酸(RGD)肽等内含蛋白图案是适应PNP水凝胶用于细胞疗法50的重要一步。模块化PEG-PLA聚合物由NPs组成,通过简单的"点击"化学28,51使PEG冠状体的化学功能化。在此示例中,细胞粘合 RGD 肽附着在 PEG-PLA 聚合物上,以促进细胞与 PNP 水凝胶结构的结合。缺乏粘附位点的配方具有较低的细胞生存能力,因为与用这些粘附图案(图5a,b)封装在配方中的细胞相比,封装细胞无法增殖。封装细胞可以用钙素 AM 或其他适当的荧光染料(例如 CFSE)标记,以便于用荧光显微镜进行细胞计数。在优化过程中,应将可行性与未经修改的 PNP 水凝胶进行比较,以确保整合功能化配方能够增强可行性和增殖性。如果集成蛋白功能化配方提供与未修改的水凝胶类似的功效,这可能表明用于合并粘附图案的结合化学存在故障。
研究人员应该期望在使用适当的水凝胶配方时,封装细胞通过水凝胶介质均匀地分散。这将允许在水凝胶给定过程中对细胞进行一致和可预测的给料,并应转化为给液凝胶中细胞在给电后局部保留。使用荧光显微镜技术可以很容易地确定细胞的分布。细胞可以用适当的染料标记,然后使用同焦显微镜成像。图像可以进行视觉评估(图5c),也可以使用图像J软件定量(图5d)测量图像垂直轴沿线的平均荧光强度(或预计因重力而发生的任何轴细胞沉降)。如果水凝胶配方太弱,无法支持细胞在较长的时间范围内处于悬浮状态,细胞沉降将会发生,如 图 5中的 1:1 配方所观察到的。增加聚合物含量可以解决因沉降而导致的同质细胞分散问题。
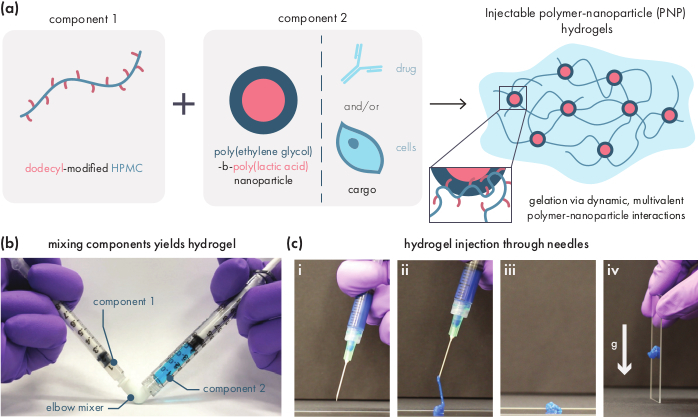
图1:聚合物-纳米粒子(PNP)水凝胶通过混合两个成分很容易形成。 (a) 第一个组件是多西西里改性羟基甲基纤维素(HPMC-C12)溶液,第二个组件是聚(乙二醇)-块-聚(乳酸)(PEG-PLA)纳米粒子以及任何治疗货物的溶液。这两个组件的温和混合产生可注射的水凝胶,HPMC-C12 聚合物通过与PEG-PLA纳米粒子的动态多价相互作用进行物理交联。(b) 通过与两个注射器混合来展示凝胶配方,每个注射器都含有 PNP 水凝胶的一个成分。通过将两个注射器与 Luer 锁肘部连接器连接起来,这两个组件可在无菌条件下轻松混合,从而产生预装到注射器中的无气泡水凝胶,供立即使用。NP 解决方案被染成蓝色以用于演示。(c) PNP水凝胶的注入及其再凝固的示范。(i) PNP 水凝胶在注射器中,附着 21G 针。(二) 注射将水凝胶置于剪切下,暂时打破聚合物和纳米粒子之间的相互作用,从而产生类似液体的一致性。(三) 注水后,动态聚合物-纳米粒子相互作用迅速改革,使水凝胶自我愈合成固体。(四)固体水凝胶不会在比其产量应力(如重力)弱的力动。PNP 水凝胶被染成蓝色以进行演示。 请单击此处查看此图的较大版本。
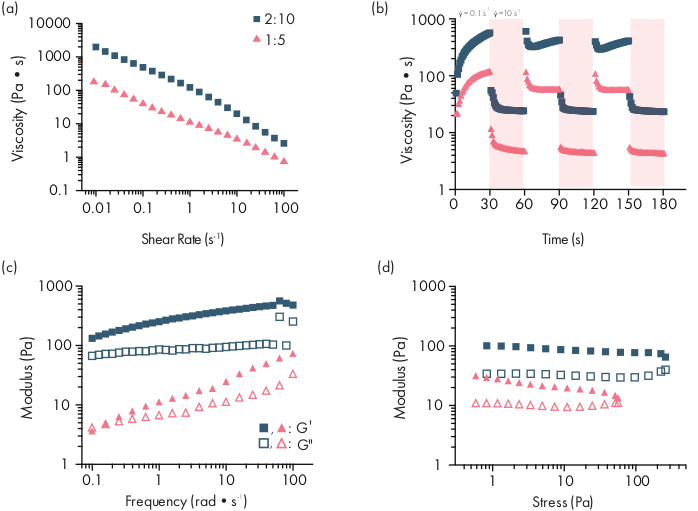
图2:两种PNP水凝胶配方的风湿特征。 配方表示为聚合物 wt.: NP wt.%。(a) PNP水凝胶的切变率从低到高,稳步剪切流量。粘度作为剪切率的函数,是剪切特性的特点。(b) 粘度作为低剪切率(白色背景:0.1 s−1)与高剪切率(红色背景:10s−1)之间的振荡剪切速率的函数,显示了PNP水凝胶的自我修复特性。剪切率征收每人30分。(c) 弹性存储模组 G+ 和粘性损失模组 G"作为各种 PNP 水凝胶配方的恒定 1% 应变频率函数。(d) 振幅以 10 rad/s 的恒定频率扫除,将 PNP 水凝胶的弹性存储模组 G+ 和粘性损失模组 G"作为应力函数。这种风湿特征可以用作质量控制的比较。此图已改编自 Grosskopf 等人。 28请单击此处查看此图的较大版本。
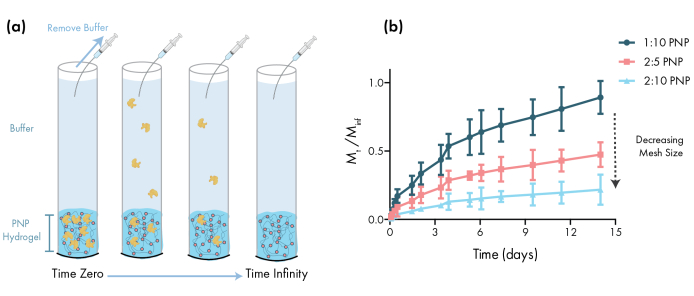
图3:从PNP水凝胶中体外释放牛血清白蛋白(BSA)。 配方表示为聚合物 wt.: NP wt.%。(a) 描述实验体外释放协议的原理图。随着时间的推移,从PNP水凝胶加载毛细管中去除阿里报价。(b) BSA 从 1:10 PNP、2:5 PNP 和 2:10 PNP 的体外释放报告为按指定时间点收集的质量除以在测定期间收集的总质量(数据显示为平均± SD: n = 3)。通过吸收测量检测到BSA。 请单击此处查看此图的较大版本。
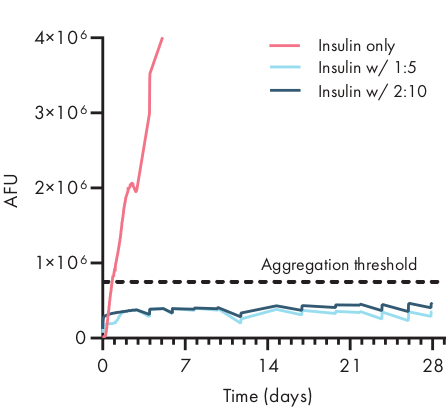
图4:通过ThT检测,在PNP水凝胶中封装的胰岛素的热稳定性。 配方表示为聚合物 wt.: NP wt.%。在 1:5 和 2:10 PNP 水凝胶中封装的胰岛素在 37 °C 的应力老化条件和持续搅拌时保持未聚合超过 28 天。在 PBS 中配制的胰岛素聚合时间为 20 ± 4 小时(平均± SD,聚合阈值 750,000 AFU)。平均呈现的数据 为 n = 4 实验复制(AFU,任意荧光单元)。此图已改编自 Meis 等人。 38请单击此处查看此图的较大版本。
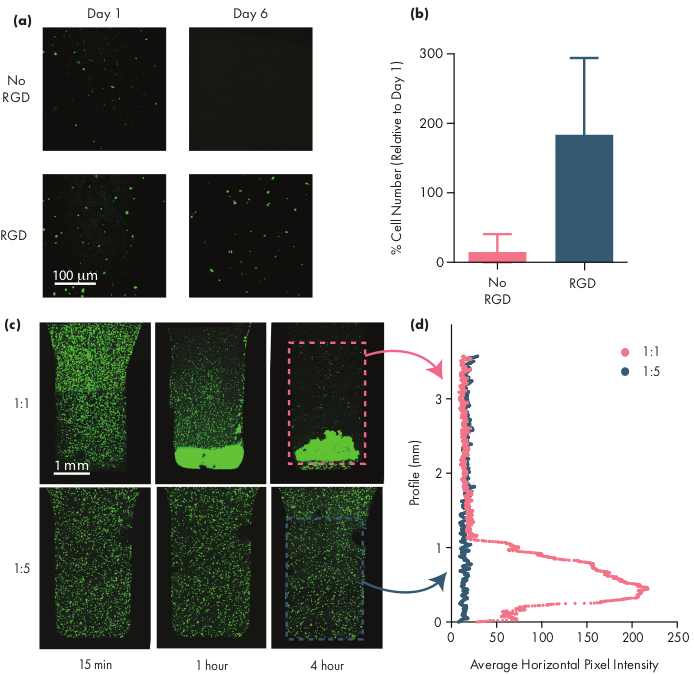
图5:PNP水凝胶中的细胞生存能力和细胞沉淀性。(a) 在 1:5 PNP 水凝胶中,有或没有细胞粘合精氨酸 -甘氨酸 (RGD) 图案的活 hMSC 具有代表性图像,这些图像与 PEG-PLA NPs 结合。比例杆表示 100μm. (b)第 6 天的细胞生存能力定义为图像中的荧光细胞数量相对于第 1 天的荧光细胞数量(数据显示为平均± SD;n = 3)。(c,d)细胞封装和定居实验与hMSC。(c) 钙素AM染色 hMSC 的最大强度图像,封装在 1:1 PNP 水凝胶(上排)和 1:5 PNP 水凝胶(下排)跨越 4 小时,以量化细胞沉降。比例杆表示沿水凝胶垂直轮廓的 hMSC 的平均水平像素强度为 1 mm. (d) 。此图已改编自 Grosskopf 等人。 28请单击此处查看此图的较大版本。
讨论
聚合物-纳米粒子 (PNP) 水凝胶易于制造,通过直接注射或导管输送,通过微创施用,使治疗细胞和药物能够长期局部输送。这些协议描述了PNP水凝胶的配方和确保所生成材料质量的定性方法。超分子PNP水凝胶可扩展制造,通过改性纤维素聚合物和聚合物核心壳纳米粒子的简单混合而形成。目前的方法描述了通过简单的肘部混合协议形成注射器预装凝胶的简单程序。通过对每个组件(如 DLS)的质量控制指标来监控 NP 大小和分布,可以重复地制定具有一致风湿特性的 PNP 水凝胶材料。通过改变 HPMC-C12或 NP 的量,可以调节由此产生的 PNP 水凝胶的网格大小和刚度。这些特性可以调整,以最适合特定的生物医学应用,并与此处详细的风湿方法,研究人员可以描述PNP水凝胶的剪切稀释和自我修复特性,因为他们优化其特定应用的平台。还介绍了体外释放研究的方法:研究人员可以利用这些研究来描述相关药物释放的相对时间尺度,为未来体内研究提供参考。利用稳定性研究,研究人员还可以评估这些材料在时间和极端温度下帮助保持敏感生物疗法的生物结构和稳定性的能力,并具有降低生物治疗药物冷链依赖性的潜在应用。最后,通过简单的细胞生存能力检测,可以评估PNP材料中的细胞生长和迁移,在细胞疗法和脚手架中具有潜在的应用。
我们的团队已经发现了许多引人注目的应用,PNP水凝胶平台27。PNP水凝胶已用于缓慢交付亚单位疫苗,使抗原和辅助剂的匹配动能释放配置文件,以提高幽默免疫反应31的幅度,持续时间和质量。PNP水凝胶的网状尺寸比大多数常用的水凝胶要小,因此它们能够有效地减缓扩散和缓慢释放分子货物。PNP水凝胶独特的组织粘附特性和机械特性也被用来形成物理屏障,防止手术产生的粘附性,在手术后将水凝胶喷洒到器官的大片表面区域。PNP水凝胶也被证明是有效的细胞输送工具,机械特性实际上保护细胞免受注射过程中注射针中发生的机械力的伤害,提高细胞的生存能力29。当 NP 与细胞粘合肽结合时,细胞可以连接并与 PNP 基质接合以保持可行。使用这种方法,PNP水凝胶已被证明,以改善注射干细胞的局部保留相比,使用液体车辆的方法28。此外,PNP水凝胶已被证明可以防止热诱导聚集的封装胰岛素,即使在苛刻的压力老化条件下,表明这些材料可能能够减少冷藏温度敏感药物38的需要。
总的来说,这里描述的方法将允许研究小组制造和探索PNP水凝胶作为生物材料。这些协议提供实验室规模的合成技术,以制造足够的水凝胶材料,以追求体外和体内研究。上述研究表明,这些材料的动态交联使得它能够适应一系列生物医学应用,允许受困细胞的主动动力,同时限制分子货物的被动扩散。预计研究人员将发现PNP平台是一个可访问和强大的工具,通过控制药物输送改善临床结果,并研究基本的生物机制,如细胞招募和机械生物学。
披露声明
这些作者没有什么可透露的。
致谢
这项研究得到了比尔和梅林达·盖茨基金会(OPP1113682)和比尔·梅林达·盖茨基金会(OPP1211043)人类系统免疫学中心的财政支持。C.M.M得到了斯坦福大学研究生奖学金和斯坦福生物X威廉和林达·斯蒂尔奖学金的支持。A.K.G. 感谢国家科学基金会研究生研究奖学金和斯坦福大学科学与工程研究生奖学金的加比兰奖学金。S.C由国家卫生研究院国家癌症研究所根据第32CA247352号奖获得支持。作者还要热情地感谢阿佩尔实验室的成员,包括吉利·罗斯博士、安东尼·余博士、林赛·斯台普顿博士、赫克托·洛佩兹·埃尔南德斯博士、安德里亚·达基诺博士、朱莉·拜莱特博士、席琳·连、本·欧、艾米莉·梅尼、艾米莉·盖尔博士和安东·史密斯博士多年来为帮助阿佩尔实验室开发这些协议所付出的努力和时间。
材料
| Name | Company | Catalog Number | Comments |
| 21G needles | BD | 305165 | PNP hydrogel injection |
| 22G, 4 in hypodermic needles | Air-Tite | N224 | In vitro release studies |
| 384-well plates, black, clear bottom | Corning | 3540 | Dynamic light scattering (DLS) |
| 96-well plates, black | Fisher Scientific | 07-200-627 | Biostability studies |
| 96-well plates, clear | Corning | 3599 | Cell viability and settling studies |
| Calcein AM | Thermo Fisher Scientific | C3100MP | Cell viability and settling studies |
| Capillary tubes | McMaster-Carr | 8729K66 | In vitro release studies |
| Centrifugal filter units | Fisher Scientific | UFC901024 | NP concentration |
| Cuvettes | Millipore Sigma | BR759015-100EA | Cell viability and settling studies |
| DLS Plate Reader | Wyatt Technology | DynaPro II Plate Reader | Dynamic light scattering (DLS) |
| Epoxy | VWR International | 300007-392 (EA) | In vitro release studies |
| Hypodermic needles | Air-Tite | 8300015027 | In vitro release studies |
| Luer elbow connector | Cole-Parmer | EW-30800-12 | PNP hydrogel formulation |
| Luer lock syringe | Fisher Scientific | 14-955-456 | PNP hydrogel formulation |
| Phosphate Buffered Saline (1x) | Fisher Scientific | 10010049 | PNP hydrogel formulation |
| Plastic Spatula | Thomas Scientific | 1229F13 | Rheological characterization |
| Plate Reader | BioTek | Synergy H1 Hybrid Multi-Mode Plate Reader | Biostability studies |
| Plate seals | Excel Scientific | TS-RT2-100 | Biostability studies |
| Recombinant human insulin | Gibco | A11382II | Biostability studies |
| Rheometer | TA Instruments | DHR-2 Rheometer | Rheological characterization |
| Thioflavin T | Sigma-Aldrich | T3516-5G | Biostability studies |
参考文献
- Mandal, A., Clegg, J. R., Anselmo, A. C., Mitragotri, S. Hydrogels in the clinic. Bioengineering Translational Medicine. 5 (2), 10158 (2020).
- Appel, E. A., del Barrio, J., Loh, X. J., Scherman, O. A. Supramolecular polymeric hydrogels. Chemical Society Reviews. 41 (18), 6195-6214 (2012).
- Mann, J. L., Yu, A. C., Agmon, G., Appel, E. A. Supramolecular polymeric biomaterials. Biomaterials Science. 6 (1), 10-37 (2018).
- Foster, A. A., Marquardt, L. M., Heilshorn, S. C. The diverse roles of hydrogel mechanics in injectable stem cell transplantation. Current Opinion in Chemical Engineering. 15, 15-23 (2017).
- Aguado, B. A., Mulyasasmita, W., Su, J., Lampe, K. J., Heilshorn, S. C. Improving viability of stem cells during syringe needle flow through the design of hydrogel cell carriers. Tissue Engineering Part A. 18 (7-8), 806-815 (2012).
- Marquardt, L. M., Heilshorn, S. C. Design of injectable materials to improve stem cell transplantation. Current Stem Cell Reports. 2 (3), 207-220 (2016).
- Guvendiren, M., Burdick, J. A. Engineering synthetic hydrogel microenvironments to instruct stem cells. Current Opinion in Biotechnology. 24 (5), 841-846 (2013).
- Marquardt, L. M., et al. Designer, injectable gels to prevent transplanted Schwann cell loss during spinal cord injury therapy. Science Advances. 6 (14), 1039 (2020).
- Stephan, S. B., et al. Biopolymer implants enhance the efficacy of adoptive T-cell therapy. Nature Biotechnology. 33 (1), 97-101 (2015).
- Tuladhar, A., et al. Injectable hydrogel enables local and sustained co-delivery to the brain: two clinically approved biomolecules, cyclosporine and erythropoietin, accelerate functional recovery in rat model of stroke. Biomaterials. 235, 119794 (2020).
- Pakulska, M. M., Miersch, S., Shoichet, M. S. Designer protein delivery: From natural to engineered affinity-controlled release systems. Science. 351 (6279), (2016).
- Gupta, D., Tator, C. H., Shoichet, M. S. Fast-gelling injectable blend of hyaluronan and methylcellulose for intrathecal, localized delivery to the injured spinal cord. Biomaterials. 27 (11), 2370-2379 (2006).
- Verbeke, C. S., Mooney, D. J. Injectable, pore-forming hydrogels for in vivo enrichment of immature dendritic cells. Advanced Healthcare Materials. 4 (17), 2677-2687 (2015).
- Tous, E., Purcell, B., Ifkovits, J. L., Burdick, J. A. Injectable acellular hydrogels for cardiac repair. Journal of Cardiovascular Translational Research. 4 (5), 528-542 (2011).
- Zhao, X., et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing. Biomaterials. 122, 34-47 (2017).
- Johnson, T. D., Christman, K. L. Injectable hydrogel therapies and their delivery strategies for treating myocardial infarction. Expert Opinion on Drug Delivery. 10 (1), 59-72 (2013).
- Kleinman, H. K., Martin, G. R. . Seminars in Cancer Biology. , 378-386 (2005).
- Hickey, J. W., et al. Engineering an artificial T-cell stimulating matrix for immunotherapy. Advanced Materials. 31 (23), 1807359 (2019).
- Baumann, M. D., et al. An injectable drug delivery platform for sustained combination therapy. Journal of Controlled Release. 138 (3), 205-213 (2009).
- Trappmann, B., et al. Matrix degradability controls multicellularity of 3D cell migration. Nature Communications. 8 (1), 1-8 (2017).
- Figueiredo, L., et al. Assessing glucose and oxygen diffusion in hydrogels for the rational design of 3D stem cell scaffolds in regenerative medicine. Journal of Tissue Engineering and Regenerative Medicine. 12 (5), 1238-1246 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. , 1-24 (2019).
- Chaudhuri, O., et al. Substrate stress relaxation regulates cell spreading. Nature Communications. 6 (1), 1-7 (2015).
- Cai, L., Dewi, R. E., Heilshorn, S. C. Injectable hydrogels with in situ double network formation enhance retention of transplanted stem cells. Advanced Functional Materials. 25 (9), 1344-1351 (2015).
- Fisher, S. A., Baker, A. E., Shoichet, M. S. Designing peptide and protein modified hydrogels: selecting the optimal conjugation strategy. Journal of the American Chemical Society. 139 (22), 7416-7427 (2017).
- Li, R. H., Altreuter, D. H., Gentile, F. T. Transport characterization of hydrogel matrices for cell encapsulation. Biotechnology and Bioengineering. 50 (4), 365-373 (1996).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6 (6295), (2015).
- Grosskopf, A. K., et al. Injectable supramolecular polymer-nanoparticle hydrogels enhance human mesenchymal stem cell delivery. Bioengineering and Translational Medicine. 5 (1), 10147 (2020).
- Lopez Hernandez, H., Grosskopf, A. K., Stapleton, L. M., Agmon, G., Appel, E. A. Non-newtonian polymer-nanoparticle hydrogels enhance cell viability during injection. Macromolecular Bioscience. 19 (1), (2019).
- Stapleton, L. M., et al. Use of a supramolecular polymeric hydrogel as an effective post-operative pericardial adhesion barrier. Nature Biomedical Engineering. 3 (8), 611-620 (2019).
- Roth, G. A., et al. Injectable hydrogels for sustained codelivery of subunit vaccines enhance humoral immunity. ACS Central Science. , (2020).
- Steele, A. N., et al. A biocompatible therapeutic catheter-deliverable hydrogel for in situ tissue engineering. Advanced Healthcare Materials. 8 (5), 1801147 (2019).
- Fenton, O. S., et al. Injectable polymer-nanoparticle hydrogels for local immune cell recruitment. Biomacromolecules. 20 (12), 4430-4436 (2019).
- Yu, A. C., Smith, A. A., Appel, E. A. Structural considerations for physical hydrogels based on polymer-nanoparticle interactions. Molecular Systems Design & Engineering. 5 (1), 401-407 (2020).
- Wisdom, K., Chaudhuri, O., Koledova, Z. . 3D Cell Culture: Methods and Protocols. , 29-37 (2017).
- Lohmeijer, B. G., et al. Guanidine and amidine organocatalysts for ring-opening polymerization of cyclic esters. Macromolecules. 39 (25), 8574-8583 (2006).
- Cheng, J., et al. Formulation of functionalized PLGA-PEG nanoparticles for in vivo targeted drug delivery. Biomaterials. 28 (5), 869-876 (2007).
- Meis, C. M., et al. Self-assembled, dilution-responsive hydrogels for enhanced thermal stability of insulin biopharmaceuticals. ACS Biomaterials Science & Engineering. , (2020).
- Franck, A., Germany, T. Viscoelasticity and dynamic mechanical testing. TA Instruments. , (1993).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6, 6295 (2015).
- Gallastegui, A., et al. Controlled release of antibiotics from photopolymerized hydrogels: kinetics and microbiological studies. Materials Science and Engineering: C. 102, 896-905 (2019).
- Qiao, M., Chen, D., Ma, X., Liu, Y. Injectable biodegradable temperature-responsive PLGA-PEG-PLGA copolymers: synthesis and effect of copolymer composition on the drug release from the copolymer-based hydrogels. International Journal of Pharmaceutics. 294 (1-2), 103-112 (2005).
- Schlein, M. Insulin Formulation Characterization-The Thioflavin T Assays. The AAPS Journal. 19 (2), 397-408 (2017).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Sakas, G., Grimm, M., Savopoulos, A. . EUROGRAPHICS workshop on Rendering Techniques. , 51-63 (1995).
- Axpe, E., et al. A multiscale model for solute diffusion in hydrogels. Macromolecules. 52 (18), 6889-6897 (2019).
- Peppas, N., Bures, P., Leobandung, W., Ichikawa, H. Hydrogels in pharmaceutical formulations. European Journal of Pharmaceutics and Biopharmaceutics. 50 (1), 27-46 (2000).
- Ritger, P. L., Peppas, N. A. A simple equation for description of solute release I. Fickian and non-fickian release from non-swellable devices in the form of slabs, spheres, cylinders or discs. Journal of Controlled Release. 5 (1), 23-36 (1987).
- Reinhart, C. T., Peppas, N. A. Solute diffusion in swollen membranes. Part II. Influence of crosslinking on diffusive properties. Journal of Membrane Science. 18, 227-239 (1984).
- Salinas, C. N., Anseth, K. S. The influence of the RGD peptide motif and its contextual presentation in PEG gels on human mesenchymal stem cell viability. Journal of Tissue Engineering and Regenerative. 2 (5), 296-304 (2008).
- Smith, A. A., et al. Nanoparticles presenting potent TLR7/8 agonists enhance anti-PD-L1 immunotherapy in cancer treatment. Biomacromolecules. 21 (9), 3704-3712 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。