Method Article
Hidrogeles de polímeros y nanopartículas supramoleculares inyectables para aplicaciones de administración de células y fármacos
En este artículo
Resumen
Este protocolo describe la síntesis y formulación de biomateriales inyectables de hidrogel de polímeros y nanopartículas supramoleculares (PNP). Se demuestran las aplicaciones de estos materiales para la administración de fármacos, la estabilización biofarmacéutica y la encapsulación y administración celular.
Resumen
Estos métodos describen cómo formular hidrogeles de nanopartículas de polímero (PNP) supramoleculares inyectables para su uso como biomateriales. Los hidrogeles PNP se componen de dos componentes: celulosa modificada hidrofóbicamente como polímero de red y nanopartículas de núcleo-cáscara autoensambladas que actúan como reticuladores no covalentes a través de interacciones dinámicas y multivalentes. Estos métodos describen tanto la formación de estas nanopartículas autoensambladas a través de la nanoprecipitación como la formulación y mezcla de los dos componentes para formar hidrogeles con propiedades mecánicas sintonizables. También se detalla el uso de la dispersión dinámica de luz (DLS) y la reología para caracterizar la calidad de los materiales sintetizados. Finalmente, la utilidad de estos hidrogeles para la administración de fármacos, la estabilización biofarmacéutica y la encapsulación y administración celular se demuestra a través de experimentos in vitro para caracterizar la liberación de fármacos, la estabilidad térmica y el asentamiento y viabilidad celular. Debido a su biocompatibilidad, inyectabilidad y condiciones de formación de gel suaves, este sistema de hidrogel es una plataforma fácilmente sintonizable adecuada para una amplia gama de aplicaciones biomédicas.
Introducción
Los hidrogeles inyectables son una herramienta emergente para entregar células terapéuticas y fármacos al cuerpo de forma controlada1. Estos materiales pueden ser cargados con fármacos o células y pueden ser administrados de una manera mínimamente invasiva a través de la inyección directa a los tejidos superficiales o por la entrega de catéter a los tejidos profundos. En general, los hidrogeles inyectables se componen de redes de polímeros hinchados por agua que están reticuladas entre sí por interacciones físicas transitorias. En reposo, estos reticulados proporcionan una estructura similar a la de un sólido a los geles, pero tras la aplicación de suficiente fuerza mecánica, estos reticulados se interrumpen temporalmente, transformando el material en un estado similar a un líquido que puede fluir fácilmente2. Son estas propiedades reológicas las que permiten que los hidrogeles físicos se adelgazan y fluyan a través de pequeños diámetros de aguja durante la inyección3. Después de la inyección, la red polimérica del material se reforma, lo que le permite auto-curarse y formar rápidamente un gel de tipo sólido in situ4,5. Estas estructuras pueden actuar como depósitos de liberación lenta de fármacos o andamios para la regeneración de tejidos6,7. Estos materiales se han utilizado en diversas aplicaciones que abarcan la tecnología de administración de fármacos, la medicina regenerativa y la inmunoingeniería1,8,9,10,11,12.
Tanto los materiales naturales (por ejemplo, alginato y colágeno) como los materiales sintéticos (por ejemplo, poli(etilenglicol) (PEG) o polímeros hidrofílicos similares) se han desarrollado como materiales de hidrogel inyectables biocompatibles13,14,15. Muchos materiales naturales exhiben variación de lote a lote que afecta la reproducibilidad4,16. Estos materiales son a menudo sensibles a la temperatura, curándose al alcanzar temperaturas fisiológicas; por lo tanto, la manipulación de estos materiales plantea desafíos técnicos y logísticosadicionales 17. Los materiales sintéticos permiten un control químico más preciso y una excelente reproducibilidad, pero estos materiales a veces pueden estar sujetos a respuestas inmunitarias adversas que limitan su biocompatibilidad, una característica crítica para aplicaciones terapéuticas in vivo6,18,19. Los esfuerzos recientes han demostrado que hay muchos criterios de diseño complejos involucrados en la ingeniería de un material de hidrogel inyectable, incluida la optimización de las propiedades mecánicas, el tamaño de la malla de la red de polímeros, las señales moleculares bioactivas, la biodegradabilidad y la inmunogenicidad del material20,21,22,23, 24,25,26. Todos estos factores deben considerarse en función de la aplicación de interés, lo que significa que una plataforma modular y químicamente sintonizable es ideal para satisfacer una amplia gama de aplicaciones.
Los presentes métodos describen la formulación y el uso de una plataforma inyectable de hidrogel de polímero-nanopartícula (PNP) que exhibe propiedades mecánicas sintonizables, un alto grado de biocompatibilidad y baja inmunogenicidad, y presenta sitios para conjugar señales moleculares bioactivas27,28,29,30,31,32,33. Estos hidrogeles PNP están compuestos por polímeros de celulosa modificados hidrofóbicamente y nanopartículas de capa central autoensambladas que comprenden poli(etilenglicol)-bloque-poli(ácido láctico) (PEG-PLA)27,34 que interactúan para producir una red supramolecular. Más concretamente, los polímeros de hidroxipropilmetilcelulosa modificados por dodecil (HPMC-C12)interactúan dinámicamente con la superficie de las nanopartículas PEG-PLA y puentean entre estas nanopartículas para formar esta redpolimérica 27,34. Estas interacciones dinámicas y multivalentes permiten que los materiales se adelgacen durante la inyección y se auto-curen rápidamente después de la administración. Los componentes de hidrogel PNP se fabrican fácilmente a través de reacciones simples de una olla y el hidrogel PNP se forma en condiciones suaves mediante la simple mezcla de los dos componentes35. Debido a la facilidad de fabricación, esta plataforma de hidrogel es altamente traducible a escala. Las propiedades mecánicas y el tamaño de malla de los hidrogeles PNP se controlan alterando el porcentaje de peso de los componentes de polímeros y nanopartículas en la formulación. Estudios previos con esta plataforma indican que los hidrogeles PNP son altamente biocompatibles, biodegradables y no inmunogénicos28,30,31. En general, estos hidrogeles presentan una amplia utilidad en aplicaciones biomédicas que abarcan la prevención de la adhesión postoperatoria, la ingeniería y regeneración de tejidos, la administración sostenida de fármacos y la inmunoingeniería.
Protocolo
Antes de iniciar este protocolo, es necesario sintetizar HPMC-C12 y PEG-PLA utilizando métodos previamente publicados27,28,29,30,31,36,37,38.
1. Síntesis de nanopartículas (NP) por nanoprecipitación
NOTA: Esta sección describe la síntesis de un solo lote de NPs, produciendo 250 μL de 20% en peso de NPs en solución tampón (50 mg de polímero peg-PLA seco por lote). Las notas para escalar el número de lotes se proporcionan en los pasos pertinentes.
- Mida 50 mg de polímero PEG-PLA en un vial de centelleo de vidrio de 8 ml y agregue 1 mL de acetonitrilo. Vórtice para disolverse completamente.
NOTA: Para escalar el número de lotes, escale linealmente este paso y agregue la cantidad total de polímero y disolvente necesarios en un solo vial. - Agregue 10 ml de agua ultrapura en un vial de centelleo de vidrio de 20 ml con una pequeña barra de agitación. Coloque una placa de agitación a 600 rpm.
NOTA: Si se ha escalado el paso 1.1, todavía es necesario tener un vial de centelleo individual para precipitar para cada lote equivalente. Por ejemplo, para 200 mg de polímero disuelto en 4 mL de acetonitrilo, prepare 4 x 20 ml de viales de centelleo. - Para formar NPs por nanoprecipitación, agregue 1 mL de solución de disolvente polimérico gota a gota en el agua utilizando una pipeta de 200 μL. Revuelva durante 2 min. El bloque de PLA del PEG-PLA no es soluble en agua, y como resultado, los NPs de la cáscara del núcleo se autoensamblarán con los bloques de PLA hidrofóbicos como el núcleo y los bloques de PEG hidrófilos como la cáscara.
- Verifique el tamaño de partícula mediante dispersión de luz dinámica (DLS).
Nota : este procedimiento está escrito específicamente para un lector de placas disponible en el comercio con el paquete de software asociado (consulte tabla de materiales). Para el uso de instrumentos alternativos, consulte los métodos de preparación de muestras descritos por el fabricante del instrumento.- Diluir 20 μL de solución de NP con 80 μL de agua ultrapura (concentración de análisis: 1 mg/mL peg-PLA NPs). Agregue 30 μL por pozo a una placa negra de 384 pozos de fondo transparente (analice por triplicado).
- Mida el radio hidrodinámico y la polidispersidad de cada muestra con un lector de placas DLS utilizando las opciones de protocolo preestablecidas en el paquete de software. Como ejemplo de un protocolo típico, establezca los parámetros de recolección de datos para adquirir mediciones de 5-10 DLS de 2-5 s de duración por adquisición y luego informe un tamaño de partícula medio y una distribución por pozo, calculado a partir del modelo de proteínas globulares. Para formar hidrogeles con propiedades reológicas consistentes, las partículas resultantes deben ser de 30-50 nm de diámetro hidrodinámico con una polidispersidad (DP) < 0,2.
NOTA: Si los NPs son más pequeños de lo deseado, utilice una solución de acetonitrilo al 75% / sulfóxido de dimetilo al 25% (DMSO) en el paso 1.1. El aumento del porcentaje de DMSO en la solución solvente generalmente aumentará el tamaño de partícula.
- Transfiera la solución de NP del vial de centelleo de 20 ml a una unidad de filtro centrífuga. Centrífuga a 4500 x g durante 1 h para concentrar la solución de NP a <250 μL.
- Resuspend en tampón deseado, como solución salina tamponada con fosfato (PBS), a 20% en peso de NPs. Pipetear el contenido de la unidad de filtro centrífuga en un tubo de microcentrífuga tarada o vial de centelleo de vidrio en un balance de masa. Utilice una pequeña cantidad (50-100 μL) de tampón para enjuagar el filtro y asegurar la recolección de todos los NPs. Agregue el tampón para alcanzar una masa total de 250 mg.
Nota : lotes se pueden agrupar durante la resuspensión. Las soluciones de stock de NP se pueden almacenar a 4 °C durante aproximadamente 1 mes. No congele. Para un almacenamiento más largo, verifique el tamaño y la polidispersidad por DLS antes del uso.
2. Formulación de hidrogel y encapsulación de fármacos o células
NOTA: Esta sección describe la preparación de 1 mL de formulación de hidrogel PNP 2:10, con 2:10 denotando 2% en peso HPMC-C12 y 10% en peso NPs (12% en peso de polímero sólido total) y 88% en peso solución tampón, solución de carga de fármacos o suspensión celular. Los porcentajes de formulación se pueden variar para producir hidrogeles con una gama de propiedades mecánicas. Por ejemplo, se utilizaron hidrogeles PNP 1:5 para el asentamiento celular y los resultados experimentales de viabilidad mostrados.
- Prepare una solución común de 6% en peso hpmc-C12 en PBS (u otro tampón de elección). Disuelva durante 48 h para asegurar que el polímero esté completamente disperso.
NOTA: La solución de stock HPMC-C12 es estable durante meses a temperatura ambiente. Sin embargo, se recomienda el almacenamiento a 4 °C para inhibir el crecimiento microbiano. - Añadir 333 mg de 6% en peso hpmc-c12 solución común en una jeringa de bloqueo Luer de 1 ml.
- Añadir 500 μL de solución de 20% en peso de NP a un tubo de microcentrífuga. Añadir 167 μL de PBS y pipeta para mezclar. Con una aguja, llene otra jeringa de bloqueo Luer de 1 ml con la solución de NP diluida.
NOTA: Para cargar la carga de la droga, calcule la concentración final deseada de la droga en el hidrogel y cargue la cantidad apropiada en los 167 μL de PBS que se mezclan con los NPs. Si una sonda molecular es necesaria para un ensayo in situ, como para monitorear la estabilidad del fármaco, cargue la sonda de una manera similar a la descrita anteriormente para cargar la carga de la droga. Para cargar las células, calcule la concentración celular final deseada en el hidrogel y cargue el número apropiado de células en los 167 μL de PBS que se mezclan con los NPs. - Mezcle los dos componentes del hidrogel (HPMC-C12 y NPs) utilizando un método de mezcla de codo35.
- Coloque el conector del codo Luer a la jeringa que contiene la solución de NP (opcionalmente, también contiene carga o células de medicamentos). Empuje la solución de NP a través del codo hasta que el menisco sea visible en el extremo abierto. Tire ligeramente hacia atrás y conecte la jeringa que contiene la solución HPMC-C12.
NOTA: Es importante minimizar el aire en la conexión del codo para evitar la formación y dispersión de burbujas en todo el hidrogel durante el proceso de mezcla. Al mezclar células con el mezclador de codo, tenga cuidado de mezclar más suavemente ya que mezclar demasiado rápido puede someter las células a altas fuerzas de cizallamiento, lo que conduce a la muerte celular. - Bombee las dos soluciones hacia adelante y hacia atrás a través del mezclador de codo durante aproximadamente 60 ciclos hasta que se haya formado un material de hidrogel blanco opaco homogéneo.
- Empuje todo el volumen de hidrogel en una jeringa. Retire la jeringa vacía y vuelva a dibujar el émbolo en la jeringa cargada en gel para recuperar el material del conector del codo. Tapa con una aguja o tapón.
NOTA: Es necesario tener en cuenta ~ 300 μL de volumen de hidrogel perdido debido al espacio muerto en el proceso de mezcla. Por ejemplo, si se desea 700 μL de volumen final de hidrogel, se debe preparar 1 mL de hidrogel. El proceso de formulación de hidrogel se puede ampliar mediante el uso de jeringas más grandes. Sin embargo, para formulaciones rígidas de hidrogel, como 2:10, puede ser difícil de mezclar e inyectar desde jeringas de más de 3 ml de volumen debido a la relación cada vez mayor de barril de jeringa a diámetro de codo o aguja. - Guarde el hidrogel en la jeringa a temperatura ambiente. Sin embargo, si los medicamentos están encapsulados, se recomienda almacenar a 4 °C a menos que el fabricante del medicamento especifique lo contrario. No congele el material.
- Coloque el conector del codo Luer a la jeringa que contiene la solución de NP (opcionalmente, también contiene carga o células de medicamentos). Empuje la solución de NP a través del codo hasta que el menisco sea visible en el extremo abierto. Tire ligeramente hacia atrás y conecte la jeringa que contiene la solución HPMC-C12.
3. Medición de las propiedades reológicas de las formulaciones de hidrogel
NOTA: Este protocolo se utiliza específicamente con el reómetro comercial mencionado en la Tabla de Materiales con una geometría de placa aserrada de 20 mm. Para el uso de otros instrumentos, consulte las instrucciones del fabricante para la preparación de la muestra.
- Formular al menos 700 μL de hidrogel PNP para su caracterización reológica.
- Inyecte material en el centro de la placa del reómetro dentado. La cantidad variará en función de la brecha de geometría elegida. Como referencia, un espacio de 700 μm requiere ~ 400-500 μL de material.
- Baje el reómetro al hueco de ajuste (500-1000 μm) y gire lentamente la placa superior del reómetro a medida que hace contacto con el hidrogel PNP para asegurarse de que el hueco se llene de manera uniforme y completa.
- Inspeccione la carga del hidrogel PNP de tal manera que cubra toda la superficie de la placa del reómetro. Use una espátula o un recortador de plástico para recortar y eliminar suavemente cualquier exceso de material, de tal manera que tenga un abultado muy leve fuera de la placa.
- Baje el reómetro al espacio de geometría final y verifique que la muestra esté cargada limpiamente.
- Mida las propiedades mecánicas de la muestra mediante pruebas oscilatorias, como barridos de amplitud o frecuencia, o pruebas de flujo, como barridos de flujo o pruebas de paso.
NOTA: En los datos representativos mostrados, las pruebas de amplitud oscilatoria se ejecutan a una frecuencia constante de 10 rad/s. Los barridos de frecuencia oscilatoria se ejecutan a una deformación constante del 1%, dentro del régimen viscoelástico lineal del barrido de amplitud. Los barridos de flujo se ejecutaron desde altas tasas de cizalladura hasta bajas tasas decizalladura 39. Todas las pruebas se completan con 10 puntos por década de datos recogidos y a temperatura ambiente. Los parámetros de prueba pueden necesitar ser ajustados dependiendo de las propiedades de la formulación. Someter materiales PNP más rígidos, como las formulaciones de 2:10, a altas tasas de cizallamiento puede hacer que el material sea expulsado de las placas del reómetro, lo que resulta en una caracterización mecánica inexacta y requiere la recarga de la muestra entre pruebas posteriores. Los datos representativos que se muestran a continuación se pueden utilizar para la comparación durante las pruebas de control de calidad.
4. Caracterización de la liberación in vitro de fármacos
- Prepare los tubos capilares cortando los tubos capilares de cristal a la longitud deseada. Selle un extremo de cada tubo usando una espátula o punta de pipeta desechable para empujar una pequeña cantidad de epoxi en el extremo del tubo para formar un tapón. Permita que el epoxi se establezca según el tiempo recomendado por el fabricante.
NOTA: El tubo debe ser más corto que la longitud de la aguja de inyección. Se recomienda un tubo con un diámetro interior de 2-3 μm de tal manera que una longitud de 2,5 pulgadas contenga al menos 300 μL de volumen total. - Formular al menos 500 μL de un material de hidrogel PNP en una jeringa que contenga el fármaco de interés. Prepare cada grupo de muestra en una jeringa separada.
- Inyecte 100-200 μL del hidrogel PNP en la parte inferior de cada tubo capilar usando una aguja hipodérmica larga (22G, 4 pulgadas). Prepare al menos tres tubos (triplicado) por grupo de muestras.
- (Opcional) Coloque los tubos capilares llenos en un tubo de centrífuga cónica y la centrífuga durante 1 minuto a 1000 x g para asegurarse de que la superficie del hidrogel sea uniforme. Este paso puede necesitar ser repetido, alterando el tiempo y la velocidad según sea necesario para alisar la superficie del material.
PRECAUCIÓN: Asegúrese de que la centrífuga esté bien equilibrada. - Llene cuidadosamente 200-300 μL de PBS encima del hidrogel en el tubo capilar usando una jeringa y aguja o pipeta. No entre en contacto ni perturbe la superficie del hidrogel. Selle el tubo con una tapa o tapón o cubierta con al menos dos capas de película de parafina.
- (Opcional) Incubar muestras a 37 °C para simular condiciones in vivo.
- Retire cuidadosamente completamente el PBS de cada capilar, sin perturbar la superficie del hidrogel, usando una jeringa y una aguja en los puntos de tiempo elegidos dependiendo de la escala de tiempo anticipada de liberación del fármaco. Reemplace el volumen retirado por PBS fresco. Guarde las alícuotas en condiciones adecuadas.
NOTA: Los volúmenes y puntos de tiempo recomendados en los pasos 4.3, 4.5 y 4.7 se pueden optimizar para capturar la liberación in vitro de fármacos en un rango de escalas de tiempo, dependiendo de la cantidad de droga que se carga en el material y la rapidez con la que se libera en el sobrenadante. Una muestra de puntos de tiempo seleccionados podría ser 6 h, 1 día, 3 días, 1 semana y 2 semanas para una droga de liberación lenta. Las alícuotas también se pueden analizar a medida que se adquieren en lugar de almacenarse. - Al finalizar el estudio, analizar las alícuotas con un método adecuado como ELISA, HPLC o ensayo de fluorescencia para cuantificar la cantidad de fármaco liberado en cada momento del punto40,41,42. El método de detección apropiado variará dependiendo del fármaco de interés.
NOTA: Los estudios de liberación in vitro son útiles para comparar la liberación entre diferentes formulaciones de hidrogel o carga de fármacos. La escala de tiempo de liberación in vitro a menudo no indica directamente una escala de tiempo esperada de liberación in vivo.
5. Caracterización de la estabilidad térmica de la insulina encapsulada en gel
- Formular al menos 1,2 mL de hidrogel PNP por grupo de muestras. Siguiendo el procedimiento descrito en la sección 2.3, cargue tanto insulina (carga de fármaco) como tioflavina T (ThT) (sonda molecular) en el hidrogel PNP.
NOTA: El mecanismo primario de agregación y, por lo tanto, inactivación de la insulina es a través de la formación de fibrillas amiloides. ThT es una punta de prueba molecular conveniente porque produce una señal fuerte de la fluorescencia en presencia de fibrillas amiloides, permitiendo la supervisión in situ de la agregación de la insulina. Dependiendo de la carga de la droga de interés, la agregación puede ser monitoreada a través de diferentes métodos. Para los datos representativos mostrados, la insulina se cargó a una concentración final de 6,7 o 10 mg/mL y ThT a una concentración final de 25 μM. - Usando una aguja de 21 G, inyecte 200 μL de hidrogel PNP por pocillo en una placa negra de 96 pocillos. Cada grupo de muestras debe medirse al menos por triplicado. Placa de sellado con un sello de placa adhesiva ópticamente transparente para evitar la evaporación.
- Inserte la placa en un lector de placas equipado con control de temperatura, agitación y programación de lectura cinética y comience el protocolo de lectura. Los datos representativos se adquirieron con un lector de placas disponible comercialmente (ver Tabla de Materiales) utilizando las siguientes condiciones:
- Condiciones de envejecimiento estresadas: temblor lineal continuo (410 cpm, 5 mm) a 37 °C.
- Adquisición de datos: excitación/emisión 450 nm/482 nm a intervalos de 20 min
NOTA: Si un lector de placas con control de temperatura, agitadora y capacidades de lectura cinética no está disponible, la placa se puede colocar en una placa agitadora en una incubadora y leer manualmente en longitudes de onda superiores en puntos de tiempo seleccionados.
- Trazar los datos como señal de fluorescencia media a lo largo del tiempo para cada grupo. El tiempo hasta la agregación puede cuantificarse definiendo un umbral de señal arbitrario43.
NOTA: Para los datos representativos que se muestran a continuación, el umbral se definió como 750.000 unidades de fluorescencia arbitraria (AFU). Este valor fue elegido para estar sobre la línea de fondo medida mientras que todavía capturaba suficientemente el inicio de la agregación indicado por un aumento agudo de la señal fluorescente. - Termine el ensayo cuando las muestras se agregan o comienzan a deshidratarse visualmente.
6. Evaluación de la viabilidad celular
- Formular al menos 2 mL de hidrogel PNP que contenga la concentración celular deseada siguiendo los protocolos anteriores (normalmente 1 - 5 x 106 células/mL). Prepare cada grupo de muestra en una jeringa separada.
- Usando una aguja de 21G, inyecte hidrogel PNP de 150 μL en cada pocillo en una placa inferior transparente de 96 pocillos; cada pozo es una réplica. Cada grupo de muestras debe tener 3-5 réplicas por punto de tiempo. Centrifugar la placa a 50 x g durante 2 min para esparcir el hidrogel uniformemente en el pozo.
- Añadir 100 μL del medio celular apropiado encima del hidrogel. Retire este medio cada día y agregue 100 μL de nuevo medio.
- El día 1, retire los medios en la parte superior del hidrogel para las réplicas designadas para ese punto de tiempo para cada grupo de muestras. Añadir 50 μL de solución de caleína AM de 2 mM encima de los hidrogeles. Incubar durante 30 min.
NOTA: Calcein AM se puede utilizar para identificar y etiquetar células vivas. En células vivas, la caleína no fluorescente AM se convierte en una caleína verde-fluorescente, por esterasas intracelulares después de la hidrólisis del éster de acetoximetil. - Imagen del centro de cada pozo en una placa de 96 pozos usando un microscopio confocal. Examine un área de al menos 300 μm2 con una pila z que abarque al menos 150 μm. Utilice la configuración de longitud de onda confocal para capturar la fluorescencia de la calcina (excitación/emisión: 495 nm/515 nm).
- Repita los pasos 6.4 y 6.5 para cada punto de tiempo posterior, según desee.
- Para analizar cada imagen, contraiga todas las imágenes de z-stack en una sola imagen de intensidad máxima plana utilizando FIJI o un software similar. Cuantifique el número de células fluorescentes en cada imagen. La proporción del número de células fluorescentes en cada punto de tiempo en comparación con el número de células fluorescentes en el día 1 es la viabilidad relativa de la célula en los hidrogeles PNP.
7. Evaluación de la sedimentación celular
- Calcular el número de células necesarias para formular 500-700 μL de hidrogel PNP a una concentración final de 5 x 106 células/mL. Suspenda las células en 1 mL de PBS a una concentración de 1 x 106 células/mL. Manche las células añadiendo 50 μL de caleína AM de 2 mM. Incubar las células con el tinte durante 10 min.
- Centrífuga las células en condiciones adecuadas, retire el PBS y resuspend las células en el volumen de PBS necesario para formar 500-700 μL del hidrogel PNP deseado.
NOTA: La velocidad y la duración recomendadas para centrifugar cada tipo de celda específico se proporciona normalmente en la documentación del producto. - Formular 500-700 μL de hidrogel PNP con las células teñidas (5 x 106 células/mL) siguiendo el protocolo sección 2.
- Usando una aguja de 21G, inyecte 100-200 μL de hidrogel PNP que contiene las células teñidas en el fondo de una cubeta. Se deben realizar tres réplicas para cada muestra. Mueva la aguja hacia adelante y hacia atrás dentro de la cubeta mientras se inyecta para evitar la formación de burbujas.
- Inmediatamente (tiempo t = 0), imagen de las cubetas que se encuentran de lado sobre toda el área plana del rectángulo de la cubeta en la base de la cubeta. Utilice las capacidades de escaneo de teselas confocales para obtener imágenes de toda el área del pozo e imaginar una pila z en 3D a través de una profundidad de 100 μm. Para una visualización posterior, utilice el software de microscopio confocal para unir todas las baldosas individuales y realizar una proyección de máxima intensidad para formar una sola imagen del área grande o utilice el software FIJI en una computadora personal44,45.
- Después de la toma de imágenes, soporte las cubetas en posición vertical.
- Imagen a las 1 h y 4 h para observar si las células se han asentado en el hidrogel o si permanecen suspendidas.
Nota : estos puntos de tiempo son sugerencias y se pueden modificar como desee. - Para analizar cada imagen, contraiga todas las imágenes de la pila z en una sola imagen de intensidad máxima plana. Utilizando FIJI o software similar, cuantifique la distribución celular midiendo la intensidad de fluorescencia en el perfil vertical central de la cubeta para determinar el grado de sedimentación.
Resultados
Fabricación y caracterización de hidrogel PNP
Los hidrogeles PNP se forman a través de la mezcla de los dos componentes principales: polímeros HPMC modificados hidrofóbicamente y nanopartículas PEG-PLA (Figura 1a). La carga terapéutica se incorpora más fácilmente en el tampón adicional utilizado para diluir el componente de nanopartículas antes de la preparación del hidrogel. Para la caracterización biomédica aguas abajo, es conveniente utilizar un método de mezcla de codo que permita la mezcla simple y reproducible de los dos componentes (Figura 1b). Después de una mezcla adecuada, el hidrogel debe sentirse firme en la jeringa, pero rendir bajo presión y extruir de una aguja estándar (21G mostrado) (Figura 1c). Después de la inyección, el hidrogel debe establecerse rápidamente en un material similar a un sólido que resista el flujo de la gravedad. Para caracterizar completamente el hidrogel y garantizar productos consistentes de lote a lote, las muestras deben analizarse utilizando varios experimentos diferentes en un reómetro. Las capacidades de cizalladura y autocuración del gel se observarán fácilmente utilizando un protocolo de barrido de flujo y un protocolo de cizalladura escalonada, respectivamente (Figura 2a,b). Para geles más rígidos, como la formulación 2:10, el usuario debe buscar la viscosidad para disminuir al menos dos órdenes de magnitud durante el barrido de flujo a medida que la tasa de cizalladura se incrementa de 0.1 a 100 s-1,lo que simula las condiciones mecánicas durante la inyección. El protocolo de cizalladura paso a paso debe revelar una disminución de órdenes de magnitud de la viscosidad bajo los pasos de alto cizalladura, y un retorno rápido (< tiempo de recuperación de s) a la viscosidad basal durante los pasos de cizalladura baja. La caracterización de los módulos de almacenamiento y pérdida utilizando un experimento de barrido de frecuencia de cizalladura oscilatoria en el régimen viscoelástico lineal debe revelar propiedades similares a sólidos en rangos de frecuencia de 0.1-100 rad s-1 (Figura 2c). En particular, por lo general no debe haber un cruce de los módulos de almacenamiento y pérdida de cizalladura que es observable a bajas frecuencias para formulaciones más rígidas como los hidrogeles 2:10. Tal evento de cruce puede indicar problemas en la calidad de los materiales de partida, ya sea el polímero HPMC o PEG-PLA modificado, o el tamaño y la dispersión de las nanopartículas PEG-PLA. Cabe señalar que se puede esperar un evento cruzado para formulaciones de hidrogel más débiles, como el hidrogel 1:5. Los barridos de amplitud de cizalladura oscilatoria en hidrogeles PNP revelan que los materiales no rinden hasta que se aplican altos valores de tensión, lo que indica que estos materiales poseen una tensión de rendimiento, una cantidad umbral de tensión requerida para que el material fluya.
Caracterización de la cinética de liberación de hidrogeles PNP
Un paso esencial en el diseño de geles PNP para la administración de fármacos es la caracterización de la cinética de liberación de fármacos a partir de una formulación elegida. Existen varias técnicas para ello, pero una metodología in vitro sencilla proporciona datos útiles durante el desarrollo temprano de la formulación(Figura 3a). Variar el contenido polimérico de los hidrogeles PNP mediante la modulación de la cantidad de HPMC-C12 o NPs es la forma más sencilla de ajustar las propiedades mecánicas y el tamaño de malla de estos hidrogeles, lo que puede tener un impacto directo en la difusión de la carga a través de la red de polímeros y la tasa de liberación de los materiales (Figura 3b). Para la carga que es mayor que el tamaño dinámico de la malla (es decir, alto peso molecular o gran radio hidrodinámico), los investigadores deben esperar una liberación lenta, mediada por disolución de la carga desde el depósito de hidrogel. Las formulaciones con tamaños de malla dinámicos mayores o iguales al tamaño de la carga permitirán una liberación mediada por difusión que se puede describir utilizando modelos tradicionales de difusión de carga y liberación46,47,48,49. Basándose en la forma de la curva de liberación, los investigadores pueden reformular el hidrogel para ajustarlo hacia una liberación más lenta (por ejemplo, aumentar el contenido de polímeros) o más rápida (por ejemplo, disminuir el contenido de polímero).
Evaluación de la estabilidad de la carga terapéutica
Determinar la estabilidad de la carga terapéutica en una formulación de hidrogel es fundamental antes de que se coman los estudios preclínicos o celulares. En comparación con otros métodos sintéticos para encapsular drogas, los hidrogeles PNP incorporan la carga de una manera suave al mezclarse en el material a granel, y es poco probable que la encapsulación dañe la carga. Estos estudios indican que los hidrogeles PNP también pueden estabilizar la carga que es susceptible a la inestabilidad térmica, como la insulina, extendiendo considerablemente la vida útil y reduciendo la dependencia del almacenamiento y distribución en frío (Figura 4). Es importante evaluar el estado de la carga inmediatamente después de la encapsulación en el hidrogel, así como después de largos períodos de almacenamiento. Estos datos muestran que la insulina permanece estable en hidrogeles después de 28 días de almacenamiento bajo estrés térmico y mecánico continuo, utilizando un simple ensayo de fluorescencia para medir la agregación de insulina. Una técnica alternativa para los casos en que un ensayo de placa apropiado no está disponible sería realizar mediciones de dicroísmo circular de la carga, que es particularmente útil para determinar la estructura secundaria de los fármacos proteicos.
Determinación de la viabilidad celular y dispersión en hidrogeles PNP
Muchas células terapéuticas requieren motivos de adhesión para seguir siendo viables, y por lo tanto la inclusión de motivos de integrina como los péptidos de ácido arginina-glicina-aspártico (RGD) es un paso importante en la adaptación de hidrogeles de PNP para terapias celulares50. El polímero modular PEG-PLA que comprende los NPs permite la funcionalización química de la corona PEG a través de simples químicos de "clic"28,51. En este ejemplo, los péptidos RGD adhesivos celulares se unieron al polímero PEG-PLA para promover el compromiso celular con la estructura de hidrogel PNP. Las formulaciones que carecen de sitios de adhesión tendrán baja viabilidad celular ya que las células encapsuladas no proliferan en comparación con las células encapsuladas en formulaciones con estos motivos de adhesión (Figura 5a,b). Las células encapsuladas se pueden etiquetar con caleína AM u otro tinte fluorescente apropiado (por ejemplo, CFSE) para facilitar el conteo celular con un microscopio de fluorescencia. Durante la optimización, la viabilidad debe compararse con los hidrogeles de PNP no modificadas para asegurar que las formulaciones funcionalizadas con integrina proporcionen una mayor viabilidad y proliferación. Si las formulaciones funcionalizadas con integrina proporcionan una eficacia similar a la de los hidrogeles no modificadas, esto puede indicar un fallo en la química de conjugación utilizada para incorporar los motivos de adhesión.
Los investigadores deben esperar que las células encapsuladas se dispersen uniformemente a través del medio de hidrogel cuando se utiliza una formulación de hidrogel adecuada. Esto permitirá una dosificación consistente y predecible de las células durante la administración de hidrogel y debería traducirse en la retención local de células en el hidrogel después de la administración. La distribución de las células se puede determinar fácilmente utilizando técnicas de microscopía de fluorescencia. Las células se pueden etiquetar con un tinte apropiado y luego se pueden obtener imágenes usando microscopía confocal. Las imágenes se pueden evaluar visualmente (Figura 5c) y también cuantitativamente (Figura 5d) utilizando el software ImageJ para medir la intensidad media de fluorescencia a lo largo del eje vertical de la imagen (o a lo largo del eje que se espera que se produzca la sedimentación celular debido a la gravedad). Si la formulación de hidrogel es demasiado débil para soportar las células en suspensión durante períodos de tiempo prolongados, se producirá la sedimentación celular, como se observa en la formulación 1:1 de la Figura 5. El aumento del contenido de polímeros puede resolver problemas con la dispersión celular no homogénea debido a la sedimentación.
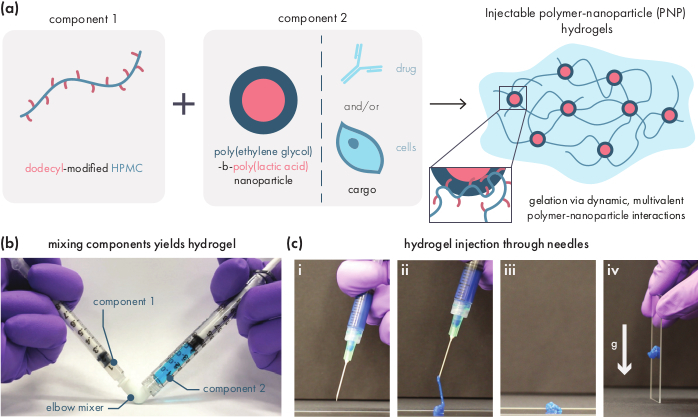
Figura 1:Los hidrogeles de nanopartículas poliméricas (PNP) se forman fácilmente mezclando dos componentes. (a)El primer componente es una solución de hidroxipropilmetilcelulosa modificada por dodecil (HPMC-C12),y el segundo componente es una solución de nanopartículas de poli(etilenglicol)-bloque-poli(ácido láctico) (PEG-PLA) junto con cualquier carga terapéutica. La mezcla suave de estos dos componentes produce un hidrogel inyectable, donde los polímeros HPMC-C12 están reticulados físicamente por interacciones dinámicas y multivalentes con las nanopartículas PEG-PLA. b) Fotografía que demuestre la formulación de gel mezclando con dos jeringuillas, cada una de las cual contiene un componente del hidrogel PNP. Al conectar las dos jeringas con un conector de codo Luer-lock, los dos componentes se pueden mezclar fácilmente en condiciones estériles para producir un hidrogel sin burbujas precargado en una jeringa para uso inmediato. La solución de NP se tiñe de azul con el fin de demostración. c)Demostración de la inyección de hidrogeles de PNP y su re-solidificación. i) Hidrogel PNP en una jeringa con una aguja 21G adherida. ii) La inyección coloca el hidrogel bajo cizalladura, lo que rompe temporalmente las interacciones entre el polímero y las nanopartículas, creando una consistencia similar a la de un fluido. iii) Después de la inyección, las interacciones dinámicas polímero-nanopartícula se reforman rápidamente, permitiendo que el hidrogel se auto-cure en un sólido. iv) El hidrogel sólido no fluye por fuerzas más débiles que su tensión de rendimiento, como la gravedad. El hidrogel PNP se tiñe de azul con el propósito de demostración. Haga clic aquí para ver una versión más amplia de esta figura.
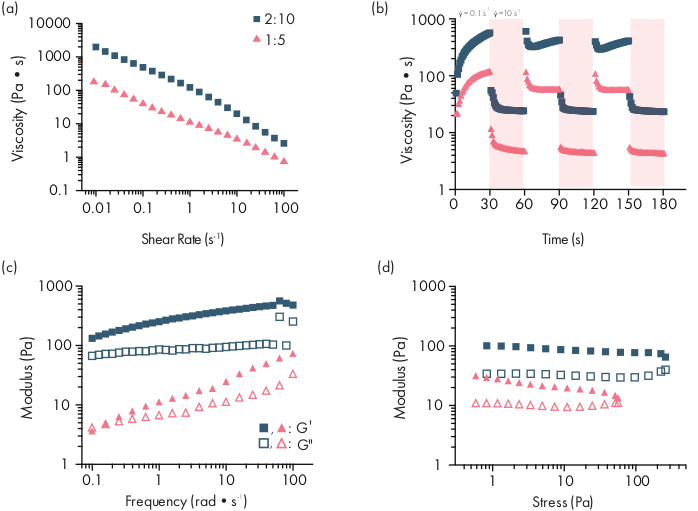
Figura 2: Caracterización reológica de dos formulaciones de hidrogel PNP. Las formulaciones se denotan como polímero wt.%: NP wt.%. (a)Barridos de flujo de cizalladura constante de baja a alta tasa de cizalladura de los hidrogeles PNP. La viscosidad en función de la velocidad de cizalladura caracteriza las propiedades de cizalladura-adelgazamiento. (b)Viscosidad en función de las tasas de cizallamiento oscilantes entre bajas tasas de cizallamiento (fondo blanco; 0,1 s−1)a altas tasas de cizallamiento (fondo rojo; 10 s−1)que demuestran las propiedades autorreparables de los hidrogeles PNP. Las tasas de cizalladura se imponen por 30 s cada una. (c) Módulo de almacenamiento elástico G′ y módulo de pérdida viscosa G" en función de la frecuencia a una tensión constante del 1% para diversas formulaciones de hidrogel PNP. (d)Barridos de amplitud a una frecuencia constante de 10 rad/s para caracterizar el módulo de almacenamiento elástico G′ y el módulo de pérdida viscosa G" de hidrogeles PNP en función de la tensión. Esta caracterización reológica se puede utilizar como comparación para el control de calidad. Esta cifra ha sido adaptada de Grosskopf et al.28Por favor, haga clic aquí para ver una versión más grande de esta figura.
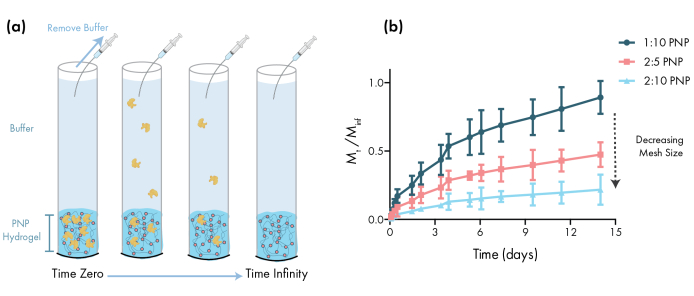
Figura 3: Liberación in vitro de albúmina sérica bovina (BSA) a partir de hidrogeles PNP. Las formulaciones se denotan como polímero wt.%: NP wt.%. (a) Esquema que describe el protocolo experimental de liberación in vitro. Las alícuotas se eliminan de los tubos capilares cargados de hidrogel de PNP con el tiempo. b)La liberación in vitro de BSA a partir de 1:10 PNP, 2:5 PNP y 2:10 PNP notificada como la masa recogida por el punto de tiempo especificado dividido por la masa total recogida durante el ensayo (datos mostrados como media ± DE; n = 3). BSA fue detectado con medidas de la absorbancia. Haga clic aquí para ver una versión más amplia de esta figura.
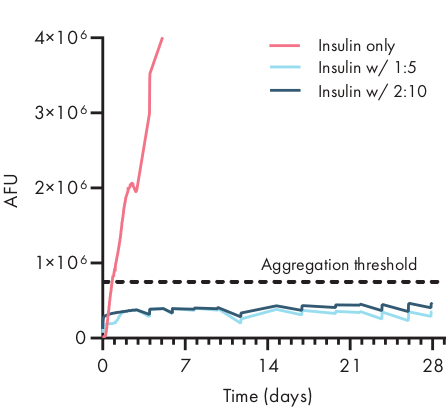
Figura 4: Estabilidad térmica de la insulina encapsulada en hidrogeles PNP por ensayo ThT. Las formulaciones se denotan como polímero wt.%: NP wt.%. La insulina encapsulada en hidrogel 1:5 y 2:10 PNP seguía siendo unaggregated por más de 28 días en las condiciones tensionadas del envejecimiento del °C 37 y de la agitación constante. El tiempo hasta la agregación para la insulina formulada en PBS era 20 ± 4 h (malo ± SD, umbral de la agregación 750.000 AFU). Datos presentados como un promedio de n = 4 réplicas experimentales (AFU, unidades arbitrarias de fluorescencia). Esta cifra ha sido adaptada de Meis et al.38Por favor, haga clic aquí para ver una versión más grande de esta figura.
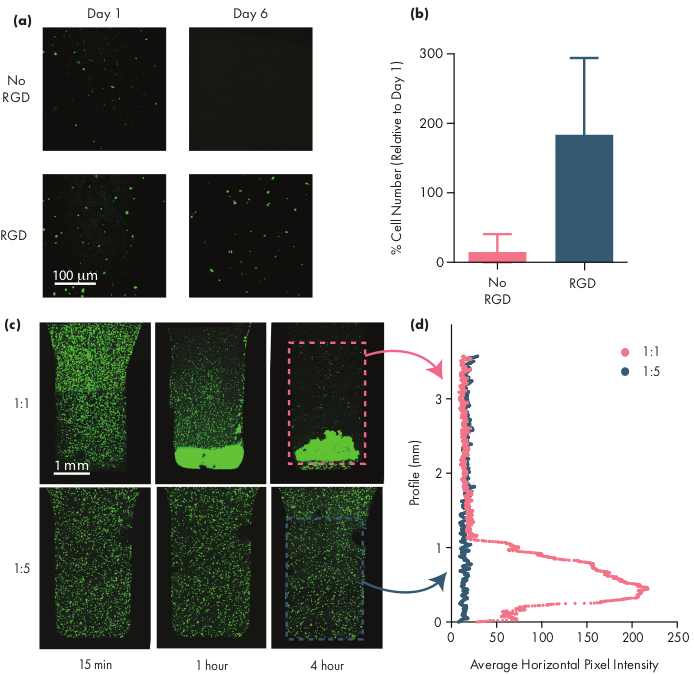
Figura 5:Viabilidad celular y sedimentación celular en hidrogeles PNP. (a,b)Estudios de viabilidad celular en hidrogeles PNP con células madre mesenquimales humanas (hMSCs). (a)Imágenes representativas de hMSCs viables en hidrogeles de 1:5 PNP con y sin el motivo de ácido arginina-glicina-aspártico (RGD) adhesivo de células conjugado con los HMSCs de PEG-PLA. La barra de escala representa 100 μm.(b)Viabilidad celular en el día 6 definida como el número de células fluorescentes en la imagen en relación con el número de células fluorescentes en el día 1 (datos mostrados como media ± DE; n = 3). c,d) Experimentos de encapsulación celular y asentamiento con hMSCs. (c) Imágenes de máxima intensidad de calcina AM-teñidos hMSCs encapsulados en hidrogel 1:1 PNP (fila superior) y 1:5 PNP hidrogel (fila inferior) a través de 4 horas para cuantificar el asentamiento celular. La barra de escala representa 1 mm.(d)Intensidad media de píxeles horizontales de los hMSC a lo largo del perfil vertical del hidrogel. Esta cifra ha sido adaptada de Grosskopf et al.28Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los hidrogeles de nanopartículas de polímero (PNP) se fabrican fácilmente y permiten la administración local a largo plazo de células terapéuticas y fármacos a través de la administración mínimamente invasiva a través de inyección directa o administración por catéter. Estos protocolos describen la formulación de hidrogeles PNP y los métodos de caracterización para asegurar la calidad de los materiales resultantes. Los hidrogeles PNP supramoleculares son escalables a la fabricación y se forman a través de la simple mezcla de polímeros de celulosa modificados y nanopartículas poliméricas de capa central. Los actuales métodos describen procedimientos fáciles para formar los geles precargados en jeringuillas con protocolos simples de la mezcla del codo. A través de métricas de control de calidad de cada uno de los componentes, como DLS para monitorear el tamaño y la distribución de NP, se pueden formular de forma reproducible materiales de hidrogel PNP con propiedades reológicas consistentes. Variando la cantidad de HPMC-C12 o NPs, se puede modular el tamaño de malla y la rigidez del hidrogel PNP resultante. Estas propiedades se pueden ajustar para adaptarse mejor a una aplicación biomédica en particular, y con los métodos reológicos detallados aquí, los investigadores pueden caracterizar las propiedades de cizalladura y autocuración de los hidrogeles PNP a medida que optimizan la plataforma para sus aplicaciones específicas. También se describen métodos para estudios de liberación in vitro; los investigadores pueden utilizar estos estudios para caracterizar la escala de tiempo relativa de liberación de fármacos de interés, informando futuros estudios in vivo. Utilizando estudios de estabilidad, los investigadores también pueden evaluar la capacidad de estos materiales para ayudar a preservar la estructura biológica y la estabilidad de la bioterapéutica sensible a lo largo del tiempo y las temperaturas extremas, con aplicaciones potenciales convincentes para reducir la dependencia de la cadena de frío de la bioterapéutica. Finalmente, con ensayos simples de viabilidad celular, se puede evaluar el crecimiento celular y la migración dentro de materiales PNP, con aplicaciones potenciales en terapias celulares y andamios.
Nuestro grupo ha encontrado muchas aplicaciones convincentes para la plataforma de hidrogel PNP27. Los hidrogeles de PNP se han utilizado para la administración lenta de vacunas de subunidades, lo que permite emparejar perfiles cinéticos de liberación de antígenos y adyuvantes para aumentar la magnitud, duración y calidad de la respuesta inmune humoral31. Se ha encontrado que los hidrogeles PNP tienen un tamaño de malla más pequeño que los hidrogeles más comúnmente utilizados, por lo que son efectivos para ralentizar la difusión y liberar lentamente la carga molecular. Las propiedades únicas de adherencia tisular y las propiedades mecánicas de los hidrogeles de PNP también se han utilizado para formar barreras físicas para prevenir las adherencias derivadas de la cirugía mediante la pulverización de los hidrogeles sobre grandes áreas superficiales de órganos después de la cirugía30. Los hidrogeles de PNP también han demostrado ser vehículos eficaces de administración celular, y las propiedades mecánicas realmente protegen a las células de las fuerzas mecánicas que ocurren en la aguja de la jeringa durante la inyección, mejorando la viabilidad celular29. Cuando los NPs se conjugan con un péptido adhesivo celular, las células pueden unirse y comprometerse con la matriz PNP para seguir siendo viables. Utilizando este enfoque, se ha demostrado que los hidrogeles de PNP mejoran la retención local de células madre inyectadas en comparación con los métodos que utilizan vehículos líquidos28. Además, se ha demostrado que los hidrogeles de PNP previenen la agregación inducida térmicamente de insulina encapsulada, incluso en condiciones de envejecimiento estresadas, lo que sugiere que estos materiales pueden ser capaces de reducir la necesidad de refrigerar medicamentos sensibles a la temperatura38.
En general, las metodologías descritas aquí permitirán a los grupos de investigación fabricar y explorar hidrogeles PNP como biomaterial. Estos protocolos proporcionan las técnicas de síntesis a escala de laboratorio para fabricar suficiente material de hidrogel para llevar a cabo estudios in vitro e in vivo. Los estudios descritos anteriormente indican que los reticulados dinámicos de estos materiales permiten que sea adecuado para una gama de aplicaciones biomédicas al permitir la motilidad activa de las células atrapadas al tiempo que restringe la difusión pasiva de la carga molecular. Se prevé que los investigadores encontrarán en la plataforma PNP una herramienta accesible y poderosa para mejorar los resultados clínicos a través de la administración controlada de fármacos y para estudiar mecanismos biológicos básicos como el reclutamiento celular y la mecanobiología.
Divulgaciones
Estos autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue apoyada financieramente por el Centro de Inmunología de Sistemas Humanos con la Fundación Bill y Melinda Gates (OPP1113682) y la Fundación Bill y Melinda Gates (OPP1211043). C.M.M. fue apoyado por una Beca de Posgrado de Stanford y la Beca William y Lynda Steere de Stanford Bio-X. A.K.G. está agradecido por una beca de investigación de posgrado de la Fundación Nacional de Ciencias y la beca Gabilan de la Beca de Posgrado de Stanford en Ciencias e Ingeniería. S.C. fue apoyado por el Instituto Nacional del Cáncer de los Institutos Nacionales de Salud bajo el número de premio F32CA247352. A los autores también les gustaría agradecer calurosamente a los miembros de Appel Lab, incluidos el Dr. Gillie Roth, el Dr. Anthony Yu, el Dr. Lyndsay Stapleton, el Dr. Héctor López Hernández, la Dra. Andrea d'Aquino, la Dra. Julie Baillet, Celine Liong, Ben Ou, Emily Meany, Emily Gale y el Dr. Anton Smith por su esfuerzo y tiempo para ayudar al Laboratorio Appel a desarrollar estos protocolos a lo largo de los años.
Materiales
| Name | Company | Catalog Number | Comments |
| 21G needles | BD | 305165 | PNP hydrogel injection |
| 22G, 4 in hypodermic needles | Air-Tite | N224 | In vitro release studies |
| 384-well plates, black, clear bottom | Corning | 3540 | Dynamic light scattering (DLS) |
| 96-well plates, black | Fisher Scientific | 07-200-627 | Biostability studies |
| 96-well plates, clear | Corning | 3599 | Cell viability and settling studies |
| Calcein AM | Thermo Fisher Scientific | C3100MP | Cell viability and settling studies |
| Capillary tubes | McMaster-Carr | 8729K66 | In vitro release studies |
| Centrifugal filter units | Fisher Scientific | UFC901024 | NP concentration |
| Cuvettes | Millipore Sigma | BR759015-100EA | Cell viability and settling studies |
| DLS Plate Reader | Wyatt Technology | DynaPro II Plate Reader | Dynamic light scattering (DLS) |
| Epoxy | VWR International | 300007-392 (EA) | In vitro release studies |
| Hypodermic needles | Air-Tite | 8300015027 | In vitro release studies |
| Luer elbow connector | Cole-Parmer | EW-30800-12 | PNP hydrogel formulation |
| Luer lock syringe | Fisher Scientific | 14-955-456 | PNP hydrogel formulation |
| Phosphate Buffered Saline (1x) | Fisher Scientific | 10010049 | PNP hydrogel formulation |
| Plastic Spatula | Thomas Scientific | 1229F13 | Rheological characterization |
| Plate Reader | BioTek | Synergy H1 Hybrid Multi-Mode Plate Reader | Biostability studies |
| Plate seals | Excel Scientific | TS-RT2-100 | Biostability studies |
| Recombinant human insulin | Gibco | A11382II | Biostability studies |
| Rheometer | TA Instruments | DHR-2 Rheometer | Rheological characterization |
| Thioflavin T | Sigma-Aldrich | T3516-5G | Biostability studies |
Referencias
- Mandal, A., Clegg, J. R., Anselmo, A. C., Mitragotri, S. Hydrogels in the clinic. Bioengineering Translational Medicine. 5 (2), 10158 (2020).
- Appel, E. A., del Barrio, J., Loh, X. J., Scherman, O. A. Supramolecular polymeric hydrogels. Chemical Society Reviews. 41 (18), 6195-6214 (2012).
- Mann, J. L., Yu, A. C., Agmon, G., Appel, E. A. Supramolecular polymeric biomaterials. Biomaterials Science. 6 (1), 10-37 (2018).
- Foster, A. A., Marquardt, L. M., Heilshorn, S. C. The diverse roles of hydrogel mechanics in injectable stem cell transplantation. Current Opinion in Chemical Engineering. 15, 15-23 (2017).
- Aguado, B. A., Mulyasasmita, W., Su, J., Lampe, K. J., Heilshorn, S. C. Improving viability of stem cells during syringe needle flow through the design of hydrogel cell carriers. Tissue Engineering Part A. 18 (7-8), 806-815 (2012).
- Marquardt, L. M., Heilshorn, S. C. Design of injectable materials to improve stem cell transplantation. Current Stem Cell Reports. 2 (3), 207-220 (2016).
- Guvendiren, M., Burdick, J. A. Engineering synthetic hydrogel microenvironments to instruct stem cells. Current Opinion in Biotechnology. 24 (5), 841-846 (2013).
- Marquardt, L. M., et al. Designer, injectable gels to prevent transplanted Schwann cell loss during spinal cord injury therapy. Science Advances. 6 (14), 1039 (2020).
- Stephan, S. B., et al. Biopolymer implants enhance the efficacy of adoptive T-cell therapy. Nature Biotechnology. 33 (1), 97-101 (2015).
- Tuladhar, A., et al. Injectable hydrogel enables local and sustained co-delivery to the brain: two clinically approved biomolecules, cyclosporine and erythropoietin, accelerate functional recovery in rat model of stroke. Biomaterials. 235, 119794 (2020).
- Pakulska, M. M., Miersch, S., Shoichet, M. S. Designer protein delivery: From natural to engineered affinity-controlled release systems. Science. 351 (6279), (2016).
- Gupta, D., Tator, C. H., Shoichet, M. S. Fast-gelling injectable blend of hyaluronan and methylcellulose for intrathecal, localized delivery to the injured spinal cord. Biomaterials. 27 (11), 2370-2379 (2006).
- Verbeke, C. S., Mooney, D. J. Injectable, pore-forming hydrogels for in vivo enrichment of immature dendritic cells. Advanced Healthcare Materials. 4 (17), 2677-2687 (2015).
- Tous, E., Purcell, B., Ifkovits, J. L., Burdick, J. A. Injectable acellular hydrogels for cardiac repair. Journal of Cardiovascular Translational Research. 4 (5), 528-542 (2011).
- Zhao, X., et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing. Biomaterials. 122, 34-47 (2017).
- Johnson, T. D., Christman, K. L. Injectable hydrogel therapies and their delivery strategies for treating myocardial infarction. Expert Opinion on Drug Delivery. 10 (1), 59-72 (2013).
- Kleinman, H. K., Martin, G. R. . Seminars in Cancer Biology. , 378-386 (2005).
- Hickey, J. W., et al. Engineering an artificial T-cell stimulating matrix for immunotherapy. Advanced Materials. 31 (23), 1807359 (2019).
- Baumann, M. D., et al. An injectable drug delivery platform for sustained combination therapy. Journal of Controlled Release. 138 (3), 205-213 (2009).
- Trappmann, B., et al. Matrix degradability controls multicellularity of 3D cell migration. Nature Communications. 8 (1), 1-8 (2017).
- Figueiredo, L., et al. Assessing glucose and oxygen diffusion in hydrogels for the rational design of 3D stem cell scaffolds in regenerative medicine. Journal of Tissue Engineering and Regenerative Medicine. 12 (5), 1238-1246 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. , 1-24 (2019).
- Chaudhuri, O., et al. Substrate stress relaxation regulates cell spreading. Nature Communications. 6 (1), 1-7 (2015).
- Cai, L., Dewi, R. E., Heilshorn, S. C. Injectable hydrogels with in situ double network formation enhance retention of transplanted stem cells. Advanced Functional Materials. 25 (9), 1344-1351 (2015).
- Fisher, S. A., Baker, A. E., Shoichet, M. S. Designing peptide and protein modified hydrogels: selecting the optimal conjugation strategy. Journal of the American Chemical Society. 139 (22), 7416-7427 (2017).
- Li, R. H., Altreuter, D. H., Gentile, F. T. Transport characterization of hydrogel matrices for cell encapsulation. Biotechnology and Bioengineering. 50 (4), 365-373 (1996).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6 (6295), (2015).
- Grosskopf, A. K., et al. Injectable supramolecular polymer-nanoparticle hydrogels enhance human mesenchymal stem cell delivery. Bioengineering and Translational Medicine. 5 (1), 10147 (2020).
- Lopez Hernandez, H., Grosskopf, A. K., Stapleton, L. M., Agmon, G., Appel, E. A. Non-newtonian polymer-nanoparticle hydrogels enhance cell viability during injection. Macromolecular Bioscience. 19 (1), (2019).
- Stapleton, L. M., et al. Use of a supramolecular polymeric hydrogel as an effective post-operative pericardial adhesion barrier. Nature Biomedical Engineering. 3 (8), 611-620 (2019).
- Roth, G. A., et al. Injectable hydrogels for sustained codelivery of subunit vaccines enhance humoral immunity. ACS Central Science. , (2020).
- Steele, A. N., et al. A biocompatible therapeutic catheter-deliverable hydrogel for in situ tissue engineering. Advanced Healthcare Materials. 8 (5), 1801147 (2019).
- Fenton, O. S., et al. Injectable polymer-nanoparticle hydrogels for local immune cell recruitment. Biomacromolecules. 20 (12), 4430-4436 (2019).
- Yu, A. C., Smith, A. A., Appel, E. A. Structural considerations for physical hydrogels based on polymer-nanoparticle interactions. Molecular Systems Design & Engineering. 5 (1), 401-407 (2020).
- Wisdom, K., Chaudhuri, O., Koledova, Z. . 3D Cell Culture: Methods and Protocols. , 29-37 (2017).
- Lohmeijer, B. G., et al. Guanidine and amidine organocatalysts for ring-opening polymerization of cyclic esters. Macromolecules. 39 (25), 8574-8583 (2006).
- Cheng, J., et al. Formulation of functionalized PLGA-PEG nanoparticles for in vivo targeted drug delivery. Biomaterials. 28 (5), 869-876 (2007).
- Meis, C. M., et al. Self-assembled, dilution-responsive hydrogels for enhanced thermal stability of insulin biopharmaceuticals. ACS Biomaterials Science & Engineering. , (2020).
- Franck, A., Germany, T. Viscoelasticity and dynamic mechanical testing. TA Instruments. , (1993).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6, 6295 (2015).
- Gallastegui, A., et al. Controlled release of antibiotics from photopolymerized hydrogels: kinetics and microbiological studies. Materials Science and Engineering: C. 102, 896-905 (2019).
- Qiao, M., Chen, D., Ma, X., Liu, Y. Injectable biodegradable temperature-responsive PLGA-PEG-PLGA copolymers: synthesis and effect of copolymer composition on the drug release from the copolymer-based hydrogels. International Journal of Pharmaceutics. 294 (1-2), 103-112 (2005).
- Schlein, M. Insulin Formulation Characterization-The Thioflavin T Assays. The AAPS Journal. 19 (2), 397-408 (2017).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Sakas, G., Grimm, M., Savopoulos, A. . EUROGRAPHICS workshop on Rendering Techniques. , 51-63 (1995).
- Axpe, E., et al. A multiscale model for solute diffusion in hydrogels. Macromolecules. 52 (18), 6889-6897 (2019).
- Peppas, N., Bures, P., Leobandung, W., Ichikawa, H. Hydrogels in pharmaceutical formulations. European Journal of Pharmaceutics and Biopharmaceutics. 50 (1), 27-46 (2000).
- Ritger, P. L., Peppas, N. A. A simple equation for description of solute release I. Fickian and non-fickian release from non-swellable devices in the form of slabs, spheres, cylinders or discs. Journal of Controlled Release. 5 (1), 23-36 (1987).
- Reinhart, C. T., Peppas, N. A. Solute diffusion in swollen membranes. Part II. Influence of crosslinking on diffusive properties. Journal of Membrane Science. 18, 227-239 (1984).
- Salinas, C. N., Anseth, K. S. The influence of the RGD peptide motif and its contextual presentation in PEG gels on human mesenchymal stem cell viability. Journal of Tissue Engineering and Regenerative. 2 (5), 296-304 (2008).
- Smith, A. A., et al. Nanoparticles presenting potent TLR7/8 agonists enhance anti-PD-L1 immunotherapy in cancer treatment. Biomacromolecules. 21 (9), 3704-3712 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados