Method Article
Injizierbare supramolekulare Polymer-Nanopartikel-Hydrogele für Zell- und Arzneimittelverabreichungsanwendungen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Synthese und Formulierung von injizierbaren, supramolekularen Polymer-Nanopartikel (PNP)-Hydrogel-Biomaterialien. Anwendungen dieser Materialien für die Wirkstoffabgabe, die biopharmazeutische Stabilisierung sowie die Zellverkapselung und -abgabe werden demonstriert.
Zusammenfassung
Diese Methoden beschreiben, wie injizierbare, supramolekulare Polymer-Nanopartikel(PNP)-Hydrogele für die Verwendung als Biomaterialien formuliert werden. PNP-Hydrogele bestehen aus zwei Komponenten: hydrophob modifizierter Cellulose als Netzwerkpolymer und selbstorganisierenden Kern-Schalen-Nanopartikeln, die durch dynamische, multivalente Wechselwirkungen als nicht-kovalente Vernetzunger fungieren. Diese Methoden beschreiben sowohl die Bildung dieser selbst zusammengesetzten Nanopartikel durch Nanopräzipitation als auch die Formulierung und Mischung der beiden Komponenten zu Hydrogelen mit abstimmbaren mechanischen Eigenschaften. Die Verwendung von dynamischer Lichtstreuung (DLS) und Rheologie zur Charakterisierung der Qualität der synthetisierten Materialien wird ebenfalls detailliert beschrieben. Schließlich wird der Nutzen dieser Hydrogele für die Wirkstoffabgabe, die biopharmazeutische Stabilisierung sowie die Zellverkapselung und -abgabe durch In-vitro-Experimente zur Charakterisierung der Wirkstofffreisetzung, der thermischen Stabilität sowie der Zellabsetzung und -lebensfähigkeit nachgewiesen. Aufgrund seiner Biokompatibilität, Injizierbarkeit und milden Gelbildungsbedingungen ist dieses Hydrogelsystem eine leicht abstimmbare Plattform, die für eine Reihe von biomedizinischen Anwendungen geeignet ist.
Einleitung
Injizierbare Hydrogele sind ein aufstrebendes Werkzeug, um therapeutische Zellen und Medikamente kontrolliert an den Körper zu liefern1. Diese Materialien können mit Medikamenten oder Zellen beladen und minimalinvasiv durch direkte Injektion in oberflächliches Gewebe oder durch Katheterabgabe an tiefe Gewebe verabreicht werden. Im Allgemeinen bestehen injizierbare Hydrogele aus wassergeschwollenen Polymernetzwerken, die durch transiente, physikalische Wechselwirkungen miteinander vernetzt sind. Im Ruhezustand verleihen diese Vernetzungen den Gelen eine feststoffähnliche Struktur, aber bei Anwendung ausreichender mechanischer Kraft werden diese Vernetzungen vorübergehend gestört und das Material in einen flüssigkeitsähnlichen Zustand umgewandelt, der leicht fließen kann2. Es sind diese rheologischen Eigenschaften, die es physikalischen Hydrogelen ermöglichen, während der Injektion zu scheren und durch kleine Nadeldurchmesser zu fließen3. Nach der Injektion reformiert sich das Polymernetzwerk des Materials, so dass es sich selbst heilen und schnell ein feststoffähnliches Gel in situ4,5 bildenkann. Diese Strukturen können als langsam freisetzende Depots für Medikamente oder Gerüste zur Geweberegeneration fungieren6,7. Diese Materialien wurden in verschiedenen Anwendungen eingesetzt, darunter Drug Delivery Technology, regenerative Medizin und Immunoengineering1,8,9,10,11,12.
Sowohl natürliche Materialien (z. B. Alginat und Kollagen) als auch synthetische Materialien (z. B. Poly(ethylenglykol) (PEG) oder ähnliche hydrophile Polymere) wurden als biokompatible injizierbare Hydrogelmaterialien entwickelt13,14,15. Viele natürliche Materialien weisen Batch-to-Batch-Variationen auf, die die Reproduzierbarkeit beeinflussen4,16. Diese Materialien sind oft temperaturempfindlich und härten bei Erreichen physiologischer Temperaturen aus; Der Umgang mit diesen Materialien stellt daher zusätzliche technische und logistische Herausforderungendar 17. Synthetische Materialien ermöglichen eine präzisere chemische Kontrolle und eine ausgezeichnete Reproduzierbarkeit, aber diese Materialien können manchmal nachteiligen Immunantworten ausgesetzt sein, die ihre Biokompatibilität einschränken, ein kritisches Merkmal für in vivo therapeutische Anwendungen6,18,19. Jüngste Bemühungen haben gezeigt, dass es viele komplexe Designkriterien gibt, die an der Entwicklung eines injizierbaren Hydrogelmaterials beteiligt sind, einschließlich der Optimierung der mechanischen Eigenschaften, der Polymernetzwerkmaschengröße, der bioaktiven molekularen Hinweise, der biologischen Abbaubarkeit und der Immunogenität des Materials20,21,22 , 23,24,25,26. All diese Faktoren müssen je nach Anwendung berücksichtigt werden, was bedeutet, dass eine modulare, chemisch abstimmbare Plattform ideal ist, um eine breite Palette von Anwendungen zu erfüllen.
Die vorliegenden Verfahren beschreiben die Formulierung und die Verwendung einer injizierbaren Polymer-Nanopartikel (PNP) Hydrogel-Plattform, die abstimmbare mechanische Eigenschaften, ein hohes Maß an Biokompatibilität und eine geringe Immunogenität aufweist und Stellen für die Konjugation bioaktiver molekularer Hinweise27,28,29,30,31,32,33darstellt. Diese PNP-Hydrogele bestehen aus hydrophob modifizierten Cellulosepolymeren und selbstorganifizierten Kern-Schalen-Nanopartikeln, die Poly(ethylenglykol)-Block-Poly(milchsäure) (PEG-PLA)27,34 enthalten, die interagieren, um ein supramolekulares Netzwerk zu erzeugen. Genauer gesagt interagieren die Dodecyl-modifizierten Hydroxypropylmethylcellulosepolymere (HPMC-C12)dynamisch mit der Oberfläche von PEG-PLA-Nanopartikeln und überbrücken zwischen diesen Nanopartikeln, um dieses Polymernetzwerk zu bilden27,34. Diese dynamischen, multivalenten Wechselwirkungen ermöglichen es den Materialien, während der Injektion zu scheren und nach der Verabreichung schnell selbst zu heilen. Die PNP-Hydrogel-Komponenten werden leicht durch einfache Eintopfreaktionen hergestellt und das PNP-Hydrogel wird unter milden Bedingungen durch einfaches Mischen der beiden Komponentengebildet 35. Aufgrund der einfachen Herstellung ist diese Hydrogel-Plattform in hohem Maße übersetzbar. Die mechanischen Eigenschaften und die Maschenweite von PNP-Hydrogelen werden durch Veränderung des Gewichtsprozents der Polymer- und Nanopartikelkomponenten in der Formulierung gesteuert. Frühere Studien mit dieser Plattform deuten darauf hin, dass PNP-Hydrogele hochgradig biokompatibel, biologisch abbaubar und nicht immunogen sind28,30,31. Insgesamt bieten diese Hydrogele einen breiten Nutzen in biomedizinischen Anwendungen, die postoperative Adhäsionsprävention, Tissue Engineering und Regeneration, nachhaltige Arzneimittelabgabe und Immunengineering umfassen.
Protokoll
Vor Beginn dieses Protokolls ist es notwendig, HPMC-C12 und PEG-PLA mit zuvor veröffentlichten Methoden27,28,29,30,31,36,37,38 zusynthetisieren.
1. Nanopartikelsynthese (NP) durch Nanopräzipitation
HINWEIS: Dieser Abschnitt beschreibt die Synthese einer einzelnen Charge von NPs, wobei 250 μL von 20 Gew.-% NPs in Pufferlösung (50 mg trockenes PEG-PLA-Polymer pro Charge) hergestellt werden. Hinweise zur Skalierung der Chargenanzahl finden Sie in den entsprechenden Schritten.
- Messen Sie 50 mg PEG-PLA-Polymer in eine 8-ml-Glasszintillationsfläschchen und fügen Sie 1 ml Acetonitril hinzu. Wirbel vollständig aufzulösen.
HINWEIS: Um die Anzahl der Chargen zu erhöhen, skalieren Sie diesen Schritt linear und addieren Sie die Gesamtmenge an Polymer und Lösungsmittel, die in einer einzigen Durchstechflasche benötigt wird. - 10 ml Reinstwasser in eine 20 ml Glasszintillationsfläschchen mit einem kleinen Rührstab geben. Auf eine auf 600 U/min eingestellte Rührplatte legen.
HINWEIS: Wenn Schritt 1.1 skaliert wurde, ist es immer noch notwendig, für jede gleichwertige Charge eine individuelle Szintillationsfläschchen zum Ausfällen zu haben. Zum Beispiel für 200 mg Polymer, gelöst in 4 ml Acetonitril, bereiten Sie 4 x 20 ml Szintillationsfläschchen vor. - Um NPs durch Nanopräzipitation zu bilden, fügen Sie 1 ml Polymerlösungslösung tropfenweise in das Wasser mit einer 200 μL Pipette hinzu. 2 Min. umrühren. Der PLA-Block des PEG-PLA ist nicht wasserlöslich, und infolgedessen werden sich Kernschalen-NPs mit den hydrophoben PLA-Blöcken als Kern und den hydrophilen PEG-Blöcken als Hülle selbst zusammensetzen.
- Überprüfen Sie die Partikelgröße durch dynamische Lichtstreuung (DLS).
HINWEIS: Dieses Verfahren ist speziell für einen handelsüblichen Plattenleser mit dem zugehörigen Softwarepaket geschrieben (siehe Materialtabelle). Informationen zur Verwendung alternativer Instrumente finden Sie in den vom Hersteller des Geräts beschriebenen Probenvorbereitungsmethoden.- 20 μL NP-Lösung mit 80 μL Reinstwasser verdünnen (Analysekonzentration: 1 mg/ml PEG-PLA NPs). 30 μL pro Vertiefung zu einer klaren schwarzen 384-Well-Platte geben (in dreifacher Ausfertigung analysieren).
- Messen Sie den hydrodynamischen Radius und die Polydispersität jeder Probe mit einem DLS-Plattenleser unter Verwendung voreingestellter Protokolloptionen im Softwarepaket. Als Beispiel für ein typisches Protokoll stellen Sie die Datenerfassungsparameter so ein, dass sie 5-10 DLS-Messungen mit einer Dauer von 2-5 s pro Erfassung erfassen und dann eine mittlere Partikelgröße und -verteilung pro Vertiefung melden, berechnet aus dem Globularproteinmodell. Um Hydrogele mit konsistenten rheologischen Eigenschaften zu bilden, sollten die resultierenden Partikel einen hydrodynamischen Durchmesser von 30-50 nm mit einer Polydispersität (PD) < 0,2 aufweisen.
HINWEIS: Wenn die NPs kleiner als gewünscht sind, verwenden Sie eine Lösung aus 75% Acetonitril / 25% Dimethylsulfoxid (DMSO) in Schritt 1.1. Die Erhöhung des DMSO-Anteils in der Lösungsmittellösung erhöht im Allgemeinen die Partikelgröße.
- Die NP-Lösung aus der 20-ml-Szintillationsdurchstechflasche wird in eine Zentrifugalfiltereinheit überführen. Zentrifuge bei 4500 x g für 1 h, um die NP-Lösung auf <250 μL zu konzentrieren.
- In gewünschtem Puffer, wie z.B. phosphatgepufferter Kochsalzlösung (PBS), auf 20 Gew.-% NPs auffüllen. Pipetten Sie den Inhalt der Zentrifugalfiltereinheit in ein geteertes Mikrozentrifugenröhrchen oder eine Glasszintillationsfläschchen auf einer Massenbilanz. Verwenden Sie eine kleine Menge (50-100 μL) Puffer, um den Filter zu spülen und die Sammlung aller NPs sicherzustellen. Fügen Sie Puffer hinzu, um eine Gesamtmasse von 250 mg zu erreichen.
HINWEIS: Chargen können während der Resuspension gepoolt werden. NP-Lagerlösungen können ca. 1 Monat bei 4 °C gelagert werden. Nicht einfrieren. Für eine längere Lagerung überprüfen Sie die Größe und Polydispersität vor der Verwendung mit DLS.
2. Hydrogelformulierung und Verkapselung von Arzneimitteln oder Zellen
HINWEIS: Dieser Abschnitt beschreibt die Herstellung von 1 ml 2:10 PNP-Hydrogelformulierung, wobei 2:10 2 Gew.-% HPMC-C12 und10 Gew.-% NPs (12 Gew.-% Gesamtfestpolymer) und 88 Gew.-% Pufferlösung, Arzneimittelfrachtlösung oder Zellsuspension bezeichnet. Die Formulierungsprozentsätze können variiert werden, um Hydrogele mit einer Reihe von mechanischen Eigenschaften zu erhalten. Zum Beispiel wurden 1:5 PNP-Hydrogele für die Zellabsetzung und Lebensfähigkeit experimentelle Ergebnisse gezeigt.
- Bereiten Sie eine Stammlösung von 6 Gew.-% HPMC-C12 in PBS (oder einem anderen Puffer Ihrer Wahl) vor. 48 h auflösen, um sicherzustellen, dass das Polymer vollständig dispergiert ist.
HINWEIS: Die HPMC-C12 Lagerlösung ist monatelang bei Raumtemperatur stabil. Eine Lagerung bei 4 °C wird jedoch empfohlen, um das mikrobielle Wachstum zu hemmen. - 333 mg 6 Gew.-% HPMC-C12 Stammlösung in eine 1 ml Luer Lock Spritze geben.
- 500 μL 20 Gew.-% NP-Stammlösung in ein Mikrozentrifugenröhrchen geben. Fügen Sie 167 μL PBS hinzu und piepsen Sie sie zum Mischen. Füllen Sie mit einer Nadel eine weitere 1 ml Luer Lock Spritze mit der verdünnten NP-Lösung.
HINWEIS: Um Arzneimittelladung zu laden, berechnen Sie die gewünschte Endkonzentration des Arzneimittels im Hydrogel und laden Sie die entsprechende Menge in die 167 μL PBS, die mit den NPs gemischt wird. Wenn eine molekulare Sonde für einen In-situ-Assay erforderlich ist, z. B. zur Überwachung der Arzneimittelstabilität, laden Sie die Sonde auf ähnliche Weise wie oben beschrieben zum Laden von Arzneimittelladung. Um Zellen zu beladen, berechnen Sie die gewünschte Endzellkonzentration im Hydrogel und laden Sie die entsprechende Anzahl von Zellen in die 167 μL PBS, die mit den NPs gemischt werden. - Mischen Sie die beiden Hydrogelkomponenten (HPMC-C12 und NPs) mit einem Ellenbogenmischverfahren35.
- Befestigen Sie den Luer-Ellenbogenanschluss an der Spritze, die NP-Lösung enthält (optional auch mit Medikamentenladung oder -zellen). Drücken Sie die NP-Lösung durch den Ellenbogen, bis der Meniskus am offenen Ende sichtbar ist. Ziehen Sie sich leicht zurück und schließen Sie die Spritze mit hpMC-C12-Lösung an.
HINWEIS: Es ist wichtig, die Luft in der Ellenbogenverbindung zu minimieren, um die Bildung und Ausbreitung von Blasen im gesamten Hydrogel während des Mischvorgangs zu verhindern. Achten Sie beim Mischen von Zellen mit dem Ellenbogenmischer darauf, vorsichtiger zu mischen, da ein zu schnelles Mischen die Zellen hohen Scherkräften aussetzen kann, was zum Zelltod führt. - Pumpen Sie die beiden Lösungen etwa 60 Zyklen lang durch den Ellenbogenmischer hin und her, bis sich ein homogenes, undurchsichtiges weißes Hydrogelmaterial gebildet hat.
- Drücken Sie das gesamte Volumen des Hydrogels in eine Spritze. Entfernen Sie die leere Spritze und ziehen Sie den Kolben wieder auf die gelbeladene Spritze, um Material aus dem Ellenbogenanschluss zurückzugewinnen. Kappe mit Nadel oder Stecker.
HINWEIS: Es ist notwendig, ~ 300 μL verlorenes Hydrogelvolumen aufgrund des Totraums im Mischprozess zu berücksichtigen. Wenn beispielsweise 700 μL endgültiges Hydrogelvolumen gewünscht werden, sollte 1 ml Hydrogel hergestellt werden. Der Hydrogel-Formulierungsprozess kann durch die Verwendung größerer Spritzen skaliert werden. Bei steifen Hydrogelformulierungen wie 2:10 kann es jedoch schwierig werden, Spritzen mit einem Volumen von mehr als 3 ml zu mischen und zu injizieren, da das Verhältnis von Spritzenlauf zu Ellenbogen- oder Nadeldurchmesser zunimmt. - Lagern Sie das Hydrogel in der Spritze bei Raumtemperatur. Wenn Medikamente jedoch verkapselt sind, wird eine Lagerung bei 4 °C empfohlen, sofern der Arzneimittelhersteller nichts anderes angibt. Frieren Sie das Material nicht ein.
- Befestigen Sie den Luer-Ellenbogenanschluss an der Spritze, die NP-Lösung enthält (optional auch mit Medikamentenladung oder -zellen). Drücken Sie die NP-Lösung durch den Ellenbogen, bis der Meniskus am offenen Ende sichtbar ist. Ziehen Sie sich leicht zurück und schließen Sie die Spritze mit hpMC-C12-Lösung an.
3. Messung der rheologischen Eigenschaften von Hydrogelformulierungen
HINWEIS: Dieses Protokoll wird speziell für das in der Materialtabelle erwähnte kommerzielle Rheometer mit einer gezackten Plattengeometrie von 20 mm verwendet. Informationen zur Verwendung anderer Instrumente finden Sie in den Anweisungen des Herstellers zur Probenvorbereitung.
- Formulieren Sie mindestens 700 μL PNP-Hydrogel zur rheologischen Charakterisierung.
- Injizieren Sie Material in die Mitte der gezackten Rheometerplatte. Der Betrag variiert je nach gewähltem Geometriespalt. Als Referenz benötigt ein Spalt von 700 μm ~ 400-500 μL Material.
- Senken Sie das Rheometer auf den Trimmspalt (500-1000 μm) und drehen Sie langsam die obere Rheometerplatte, wenn sie mit dem PNP-Hydrogel in Kontakt kommt, um sicherzustellen, dass die Lücke gleichmäßig und vollständig gefüllt wird.
- Prüfen Sie die Beladung des PNP-Hydrogels so, dass es die gesamte Rheometerplattenoberfläche bedeckt. Verwenden Sie einen Spatel oder Kunststofftrimmer, um überschüssiges Material vorsichtig zu trimmen und zu entfernen, so dass es eine sehr leichte Ausbuchtung aus der Platte hat.
- Senken Sie das Rheometer auf den letzten Geometriespalt und überprüfen Sie, ob die Probe sauber geladen ist.
- Messen Sie die mechanischen Eigenschaften der Probe mit oszillatorischen Tests wie Amplituden- oder Frequenz-Sweeps oder Strömungstests wie Flow-Sweeps oder Schritttests.
HINWEIS: In den gezeigten repräsentativen Daten werden oszillatorische Amplitudentests mit einer konstanten Frequenz von 10 rad/s durchgeführt. Oszillatorische Frequenz-Sweeps werden mit einer konstanten Dehnung von 1% innerhalb des linearen viskoelastischen Regimes des Amplituden-Sweeps ausgeführt. Flow Sweeps wurden von hohen Scherraten zu niedrigen Scherraten durchgeführt39. Alle Tests werden mit 10 Punkten pro Jahrzehnt gesammelter Daten und bei Raumtemperatur abgeschlossen. Die Testparameter müssen möglicherweise in Abhängigkeit von den Eigenschaften der Formulierung angepasst werden. Das Unterziehen steiferer PNP-Materialien wie 2:10-Formulierungen mit hohen Scherraten kann dazu führen, dass das Material von den Rheometerplatten ausgestoßen wird, was zu einer ungenauen mechanischen Charakterisierung führt und ein Nachladen der Probe zwischen nachfolgenden Tests erfordert. Repräsentative Daten, die unten gezeigt werden, können zum Vergleich während der Qualitätskontrolle verwendet werden.
4. Charakterisierung der Freisetzung von In-vitro-Arzneimitteln
- Bereiten Sie Kapillarrohre vor, indem Sie Glaskapillarrohre auf die gewünschte Länge schneiden. Versiegeln Sie ein Ende jedes Röhrchens, indem Sie einen Einwegspatel oder eine Pipettenspitze verwenden, um eine kleine Menge Epoxid in das Ende des Rohrs zu drücken, um einen Pfropfen zu bilden. Lassen Sie Epoxidharz gemäß der vom Hersteller empfohlenen Zeit einstellen.
HINWEIS: Das Röhrchen muss kürzer als die Länge der Injektionsnadel sein. Schläuche mit einem Innendurchmesser von 2-3 μm werden so empfohlen, dass eine Länge von 2,5 Zoll mindestens 300 μL Gesamtvolumen enthält. - Formulieren Sie mindestens 500 μL eines PNP-Hydrogelmaterials in einer Spritze, die das interessierende Arzneimittel enthält. Bereiten Sie jede Probengruppe in einer separaten Spritze vor.
- Injizieren Sie 100-200 μL des PNP-Hydrogels am Boden jedes Kapillarröhrchens mit einer langen hypodermischen Nadel (22G, 4 Zoll). Bereiten Sie mindestens drei Röhrchen (dreifach) pro Probengruppe vor.
- (Optional) Gefüllte Kapillarröhrchen in ein konisches Zentrifugenrohr und eine Zentrifuge für 1 minute bei 1000 x g legen, um sicherzustellen, dass die Oberfläche des Hydrogels gleichmäßig ist. Dieser Schritt muss möglicherweise wiederholt werden, wobei Zeit und Geschwindigkeit nach Bedarf geändert werden müssen, um die Oberfläche des Materials zu glätten.
ACHTUNG: Stellen Sie sicher, dass die Zentrifuge gut ausbalanciert ist. - Füllen Sie vorsichtig 200-300 μL PBS auf das Hydrogel im Kapillarrohr mit einer Spritze und einer Nadel oder Pipette. Kontaktiere oder störe nicht die Oberfläche des Hydrogels. Versiegeln Sie das Rohr mit einer Kappe oder einem Stecker oder einer Abdeckung mit mindestens zwei Schichten Paraffinfolie.
- (Optional) Inkubieren Sie Proben bei 37 °C, um In-vivo-Bedingungen zu simulieren.
- Entfernen Sie das PBS vorsichtig vollständig von jeder Kapillare, ohne die Hydrogeloberfläche zu stören, indem Sie eine Spritze und eine Nadel zu ausgewählten Zeitpunkten verwenden, abhängig von der erwarteten Zeitskala der Arzneimittelfreisetzung. Ersetzen Sie das entfernte Volume durch frisches PBS. Lagern Sie Aliquots unter geeigneten Bedingungen.
HINWEIS: Die empfohlenen Volumina und Zeitpunkte in den Schritten 4.3, 4.5 und 4.7 können optimiert werden, um die Freisetzung von In-vitro-Arzneimitteln über eine Reihe von Zeitskalen zu erfassen, je nachdem, wie viel Arzneimittel im Material geladen ist und wie schnell es in den Überstand freisetzt. Eine Stichprobe ausgewählter Zeitpunkte könnte 6 h, 1 Tag, 3 Tage, 1 Woche und 2 Wochen für ein langsam freisetzendes Medikament sein. Aliquots können auch analysiert werden, wenn sie erworben und nicht gespeichert werden. - Analysieren Sie nach Abschluss der Studie Aliquoten mit einer geeigneten Methode wie ELISA, HPLC oder Fluoreszenzassay, um die Menge des zu jedem Zeitpunkt freigesetzten Arzneimittels zu quantifizieren40,41,42. Die geeignete Nachweismethode variiert je nach dem interessierenden Medikament.
HINWEIS: In-vitro-Freisetzungsstudien sind nützlich, um die Freisetzung zwischen verschiedenen Hydrogelformulierungen oder Arzneimittelladungen zu vergleichen. Die In-vitro-Freisetzungszeitskala zeigt oft nicht direkt eine erwartete Zeitskala der Freisetzung in vivo an.
5. Charakterisierung der thermischen Stabilität von gelverkapseltem Insulin
- Formulieren Sie mindestens 1,2 ml PNP-Hydrogel pro Probengruppe. Nach dem in Abschnitt 2.3 beschriebenen Verfahren werden sowohl Insulin (Arzneimittelladung) als auch Thioflavin T (ThT) (molekulare Sonde) in das PNP-Hydrogel geladen.
HINWEIS: Der primäre Mechanismus der Aggregation und damit der Inaktivierung von Insulin ist die Bildung von Amyloidfibrillen. ThT ist eine geeignete molekulare Sonde, da sie in Gegenwart von Amyloidfibrillen ein starkes Fluoreszenzsignal erzeugt, das eine In-situ-Überwachung der Insulinaggregation ermöglicht. Abhängig von der interessierenden Arzneimittelfracht kann die Aggregation durch verschiedene Methoden überwacht werden. Für die gezeigten repräsentativen Daten wurde Insulin auf eine Endkonzentration von 6,7 oder 10 mg/ml und ThT auf eine Endkonzentration von 25 μM geladen. - Injizieren Sie mit einer 21 G-Nadel 200 μL PNP-Hydrogel pro Vertiefung in eine schwarze 96-Well-Platte. Jede Probengruppe sollte mindestens dreifach gemessen werden. Dichtungsplatte mit optisch klarer Klebeplattendichtung zur Verhinderung von Verdunstung.
- Legen Sie die Platte in einen Plattenleser ein, der mit Temperaturregelung, Schütteln und kinetischer Leseprogrammierung ausgestattet ist, und beginnen Sie mit dem Leseprotokoll. Repräsentative Daten wurden mit einem handelsüblichen Plattenleser (siehe Materialtabelle) unter folgenden Bedingungen erfasst:
- Beanspruchte Alterungsbedingungen: kontinuierliches lineares Schütteln (410 cpm, 5 mm) bei 37 °C.
- Datenerfassung: Anregung/Emission 450 nm/482 nm in 20-min-Intervallen
HINWEIS: Wenn ein Plattenleser mit Temperaturregelung, Shaker und kinetischen Lesefunktionen nicht verfügbar ist, kann die Platte auf eine Shakerplatte in einem Inkubator gelegt und zu ausgewählten Zeitpunkten manuell bei über den Wellenlängen gelesen werden.
- Zeichnen Sie die Daten als mittleres Fluoreszenzsignal über die Zeit für jede Gruppe auf. Die Zeit bis zur Aggregation kann quantifiziert werden, indem ein beliebiger Signalschwellenwert43definiert wird.
HINWEIS: Für die unten gezeigten repräsentativen Daten wurde der Schwellenwert als 750.000 arbiträr fluoreszierende Einheiten (AFU) definiert. Dieser Wert wurde so gewählt, dass er über dem gemessenen Ausgangswert liegt und gleichzeitig den Beginn der Aggregation, der durch einen starken fluoreszierenden Signalanstieg angezeigt wird, ausreichend erfasst. - Beenden Sie den Assay, wenn sich die Proben aggregieren oder visuell zu dehydrieren beginnen.
6. Beurteilung der Zelllebensfähigkeit
- Formulieren Sie mindestens 2 ml PNP-Hydrogel mit der gewünschten Zellkonzentration gemäß den oben genannten Protokollen (normalerweise 1 - 5 x 106 Zellen/ml). Bereiten Sie jede Probengruppe in einer separaten Spritze vor.
- Injizieren Sie mit einer 21G-Nadel 150 μL PNP-Hydrogel in jede Vertiefung in eine klare bodenige 96-Well-Platte. jede Vertiefung ist eine Replikation. Jede Probengruppe sollte 3-5 Replikate pro Zeitpunkt haben. Zentrifugiert die Platte bei 50 x g für 2 min, um das Hydrogel gleichmäßig im Brunnen zu verteilen.
- Fügen Sie 100 μL des entsprechenden Zellmediums auf das Hydrogel hinzu. Entfernen Sie diese Medien jeden Tag und fügen Sie 100 μL neue Medien hinzu.
- Entfernen Sie an Tag 1 das Medium auf dem Hydrogel für die für diesen Zeitpunkt bestimmten Replikate für jede Probengruppe. Fügen Sie 50 μL 2 mM Calcein AM-Lösung auf die Hydrogele hinzu. 30 Min. inkubieren.
HINWEIS: Calcein AM kann verwendet werden, um lebende Zellen zu identifizieren und zu kennzeichnen. In lebenden Zellen wird das nicht fluoreszierende Calcein AM durch intrazelluläre Esterasen nach der Acetoxymethylesterhydrolyse durch grün fluoreszierendes Calcein umgewandelt. - Stellen Sie das Zentrum jeder Vertiefung in einer 96-Well-Platte mit einem konfokalen Mikroskop ab. Vermessen Sie eine Fläche von mindestens 300 μm 2 miteinem Z-Stack von mindestens 150 μm. Verwenden Sie konfokale Wellenlängeneinstellungen, um die Fluoreszenz von Calcein zu erfassen (Anregung/Emission: 495 nm/515 nm).
- Wiederholen Sie die Schritte 6.4 und 6.5 für jeden nachfolgenden Zeitpunkt wie gewünscht.
- Um jedes Bild zu analysieren, reduzieren Sie alle Z-Stack-Bilder mit FIJI oder einer ähnlichen Software in ein einziges Bild mit maximaler Intensität. Quantifizieren Sie die Anzahl der fluoreszierenden Zellen in jedem Bild. Das Verhältnis der Anzahl der fluoreszierenden Zellen zu jedem Zeitpunkt im Vergleich zur Anzahl der fluoreszierenden Zellen an Tag 1 ist die relative Zelllebensfähigkeit in den PNP-Hydrogelen.
7. Beurteilung der Zellablagerung
- Berechnen Sie die Anzahl der Zellen, die erforderlich sind, um 500-700 μL PNP-Hydrogel bei einer Endkonzentration von 5 x 106 Zellen / ml zu formulieren. Suspendieren Sie Zellen in 1 ml PBS in einer Konzentration von 1 x 106 Zellen/ml. Färben Sie Zellen durch Zugabe von 50 μL 2 mM Calcein AM. Inkubieren Sie die Zellen mit dem Farbstoff für 10 min.
- Zentrifugenzellen entfernen unter geeigneten Bedingungen das PBS und resuspendieren die Zellen in dem Volumen von PBS, das benötigt wird, um 500-700 μL des gewünschten PNP-Hydrogels zu bilden.
HINWEIS: Die empfohlene Geschwindigkeit und Dauer für die Zentrifuge jedes spezifischen Zelltyps finden Sie in der Produktdokumentation. - Formulieren Sie 500-700 μL PNP-Hydrogel mit den gefärbten Zellen (5 x 106 Zellen/ml) gemäß Protokollabschnitt 2.
- Injizieren Sie mit einer 21G-Nadel 100-200 μL PNP-Hydrogel, das die gefärbten Zellen im Boden einer Küvette enthält. Für jede Probe sollten drei Replikate durchgeführt werden. Bewegen Sie die Nadel während der Injektion innerhalb der Küvette hin und her, um Blasenbildung zu verhindern.
- Stellen Sie sich sofort (Zeit t=0) die küvetten ab, die auf ihrer Seite über den gesamten flachen Küvettenrechteckbereich an der Basis der Küvette liegen. Verwenden Sie die Funktionen zum Scannen konfokaler Kacheln, um den gesamten Bohrplatzbereich abbilden und einen Z-Stack in 3D über eine Tiefe von 100 μm abbilden. Für die spätere Visualisierung verwenden Sie entweder die konfokale Mikroskopsoftware, um alle einzelnen Kacheln zusammenzusetzen und eine Projektion mit maximaler Intensität durchzuführen, um ein einzelnes Bild der großen Fläche zu bilden, oder verwenden Sie die FIJI-Software auf einem PC44,45.
- Nach der Bildgebung die Küvetten aufrecht stellen.
- Bild um 1 h und 4 h, um zu beobachten, ob sich Zellen im Hydrogel angesiedelt haben oder ob sie suspendiert bleiben.
HINWEIS: Diese Zeitpunkte sind Vorschläge und können belieben geändert werden. - Um jedes Bild zu analysieren, reduzieren Sie alle Z-Stack-Bilder in ein einziges Ebenenbild mit maximaler Intensität. Quantifizieren Sie mit FIJI oder einer ähnlichen Software die Zellverteilung, indem Sie die Fluoreszenzintensität im mittleren vertikalen Profil der Küvette messen, um den Grad der Setzung zu bestimmen.
Ergebnisse
Herstellung und Charakterisierung von PNP-Hydrogel
PNP-Hydrogele werden durch die Mischung der beiden Hauptkomponenten - hydrophob modifizierte HPMC-Polymere und PEG-PLA-Nanopartikel - gebildet (Abbildung 1a). Therapeutische Fracht wird am einfachsten in den zusätzlichen Puffer eingebaut, der verwendet wird, um die Nanopartikelkomponente vor der Hydrogelpräparation zu verdünnen. Für die nachgeschaltete biomedizinische Charakterisierung ist es zweckmäßig, ein Ellenbogenmischverfahren zu verwenden, das ein einfaches und reproduzierbares Mischen der beiden Komponenten ermöglicht (Abbildung 1b). Nach ausreichendem Mischen sollte sich das Hydrogel in der Spritze fest anfühlen, aber unter Druck nachgeben und aus einer Standardnadel extrudieren (21G gezeigt) (Abbildung 1c). Nach der Injektion sollte sich das Hydrogel schnell in ein feststoffähnliches Material feststellen, das dem Fluss der Schwerkraft widersteht. Um das Hydrogel vollständig zu charakterisieren und konsistente Batch-to-Batch-Produkte zu gewährleisten, sollten Proben mit verschiedenen Experimenten auf einem Rheometer analysiert werden. Die Scherverdünnungs- und Selbstheilungsfähigkeiten des Gels können leicht mit einem Flow-Sweep-Protokoll bzw. einem Step-Shear-Protokoll beobachtet werden (Abbildung 2a, b). Bei steiferen Gelen, wie der 2:10-Formulierung, sollte der Benutzer darauf achten, dass die Viskosität während des Strömungsfegens um mindestens zwei Größenordnungen abnimmt, da die Scherrate von 0,1 auf 100 s-1erhöht wird, was die mechanischen Bedingungen während der Injektion simuliert. Das Stufenscherprotokoll sollte eine Abnahme der Viskosität um Größenordnungen unter den Schritten mit hoher Scherung und eine schnelle Rückkehr (<5 s Erholungszeit) zur Ausgangsviskosität während der niedrigen Scherschritte zeigen. Die Charakterisierung der Speicher- und Verlustmodule mittels eines oszillatorischen Scherfrequenz-Sweep-Experiments im linearen viskoelastischen Regime sollte feststoffähnliche Eigenschaften in Frequenzbereichen von 0,1-100 rad s-1 aufdecken (Abbildung 2c). Insbesondere sollte es typischerweise keine Kreuzung der Scherspeicher- und Verlustmodule geben, die bei niedrigen Frequenzen für steifere Formulierungen wie die 2:10-Hydrogele beobachtbar ist. Ein solches Crossover-Ereignis kann auf Probleme in der Qualität der Ausgangsmaterialien hinweisen, entweder des modifizierten HPMC- oder PEG-PLA-Polymers oder der Größe und Dispergierfähigkeit der PEG-PLA-Nanopartikel. Es ist zu beachten, dass bei schwächeren Hydrogelformulierungen, wie dem 1:5 Hydrogel, ein Crossover-Ereignis zu erwarten ist. Oszillierende Scheramplituden-Sweeps auf PNP-Hydrogelen zeigen, dass die Materialien erst nachgeben, wenn hohe Spannungswerte angewendet werden, was darauf hindeutet, dass diese Materialien eine Streckgrenze aufweisen, eine Schwellenspannung, die für den Fluss des Materials erforderlich ist.
Charakterisierung der Freisetzungskinetik aus PNP-Hydrogelen
Ein wesentlicher Schritt bei der Entwicklung von PNP-Gelen für die Wirkstoffabgabe ist die Charakterisierung der Arzneimittelfreisetzungskinetik aus einer ausgewählten Formulierung. Es gibt mehrere Techniken dafür, aber eine einfache In-vitro-Methodik liefert nützliche Daten während der frühen Formulierungsentwicklung (Abbildung 3a). Die Variation des Polymergehalts der PNP-Hydrogele durch Modulation der Menge an HPMC-C12 oder NPs ist der einfachste Weg, um die mechanischen Eigenschaften und die Maschenweite dieser Hydrogele abzustimmen, was sich direkt auf die Diffusion der Ladung durch das Polymernetzwerk und die Freisetzungsrate aus den Materialien auswirken kann (Abbildung 3b). Für Ladungen, die größer als die dynamische Maschenweite sind (d. H. Hohes Molekulargewicht oder großer hydrodynamischer Radius), sollten Forscher mit einer langsamen, auflösungsvermittelten Freisetzung von Fracht aus dem Hydrogeldepot rechnen. Formulierungen mit dynamischen Maschenöffnungen größer oder gleich der Größe der Ladung ermöglichen eine diffusionsvermittelte Freisetzung, die mit traditionellen Modellen der Ladungsdiffusion und Freisetzung46,47,48,49beschrieben werden kann. Basierend auf der Form der Freisetzungskurve können Forscher das Hydrogel neu formulieren, um es auf eine langsamere (z. B. Erhöhung des Polymergehalts) oder schnellere (z. B. Verringerung des Polymergehalts) Freisetzung abzustimmen.
Beurteilung der Stabilität therapeutischer Ladung
Die Bestimmung der Stabilität der therapeutischen Ladung in einer Hydrogelformulierung ist entscheidend, bevor präklinische oder zelluläre Studien beginnt. Im Vergleich zu anderen synthetischen Methoden zur Verkapselung von Medikamenten integrieren PNP-Hydrogele Fracht auf sanfte Weise, indem sie sich in das Schüttgut mischen, und es ist unwahrscheinlich, dass die Verkapselung die Ladung beschädigt. Diese Studien deuten darauf hin, dass PNP-Hydrogele auch Ladung stabilisieren können, die anfällig für thermische Instabilität ist, wie Insulin, wodurch die Haltbarkeit erheblich verlängert und die Abhängigkeit von Kühllagerung und -verteilung verringert wird (Abbildung 4). Es ist wichtig, den Zustand der Ladung unmittelbar nach der Verkapselung in das Hydrogel sowie nach längerer Lagerung zu bewerten. Diese Daten zeigen, dass Insulin in Hydrogelen nach 28 Tagen Lagerung unter kontinuierlicher thermischer und mechanischer Belastung stabil bleibt, wobei ein einfacher Fluoreszenzassay zur Messung der Insulinaggregation verwendet wird. Eine alternative Technik für Fälle, in denen kein geeigneter Plattenassay verfügbar ist, wäre die Durchführung von zirkulären Dichroismusmessungen der Ladung, was besonders nützlich ist, um die Sekundärstruktur von Proteinarzneimitteln zu bestimmen.
Bestimmung der Zelllebensfähigkeit und -dispersion in PNP-Hydrogelen
Viele therapeutische Zellen benötigen Adhäsionsmotive, um lebensfähig zu bleiben, und daher ist die Einbeziehung von Integrinmotiven wie Arginin-Glycin-Asparaginsäure (RGD) Peptiden ein wichtiger Schritt bei der Anpassung von PNP-Hydrogelen für Zelltherapien50. Das modularePEG-PLA-Polymer,bestehend aus den NPs, ermöglicht die chemische Funktionalisierung der PEG-Korona durch einfache "Klick"-Chemikalien28,51. In diesem Beispiel wurden zelladhäsive RGD-Peptide an das PEG-PLA-Polymer gebunden, um die Zellinteraktion mit der PNP-Hydrogelstruktur zu fördern. Formulierungen ohne Adhäsionsstellen weisen eine geringe Zelllebensfähigkeit auf, da sich verkapselte Zellen im Vergleich zu Zellen, die in Formulierungen mit diesen Adhäsionsmotiven verkapselt sind, nicht vermehren (Abbildung 5a, b). Verkapselte Zellen können mit Calcein AM oder einem anderen geeigneten Fluoreszenzfarbstoff (z. B. CFSE) markiert werden, um das Zellzählen mit einem Fluoreszenzmikroskop zu erleichtern. Während der Optimierung sollte die Lebensfähigkeit mit unmodifizierten PNP-Hydrogelen verglichen werden, um sicherzustellen, dass integrinfunktionalisierte Formulierungen eine verbesserte Lebensfähigkeit und Proliferation bieten. Wenn integrinfunktionalisierte Formulierungen eine ähnliche Wirksamkeit wie unmodifizierte Hydrogele bieten, kann dies auf ein Versagen der Konjugationschemie hinweisen, die zur Aufnahme der Adhäsionsmotive verwendet wird.
Forscher sollten erwarten, dass verkapselte Zellen gleichmäßig durch das Hydrogelmedium verteilt werden, wenn sie eine geeignete Hydrogelformulierung verwenden. Dies ermöglicht eine konsistente und vorhersehbare Dosierung der Zellen während der Hydrogel-Verabreichung und sollte nach der Verabreichung zu einer lokalen Retention der Zellen im Hydrogel führen. Die Verteilung der Zellen kann leicht mit Fluoreszenzmikroskopie-Techniken bestimmt werden. Zellen können mit einem geeigneten Farbstoff markiert und dann mit konfokaler Mikroskopie abgebildet werden. Die Bilder können visuell (Abbildung 5c) und auch quantitativ (Abbildung 5d) mit der ImageJ-Software bewertet werden, um die durchschnittliche Fluoreszenzintensität entlang der vertikalen Achse des Bildes (oder entlang der Achse, aufgrund der Schwerkraft zu erwarten ist) zu messen. Wenn die Hydrogelformulierung zu schwach ist, um die Zellen in Suspension über längere Zeiträume zu unterstützen, tritt eine Zellablagerung auf, wie in der 1:1-Formulierung in Abbildung 5beobachtet. Die Erhöhung des Polymergehalts kann Probleme mit inhomogener Zelldispersion aufgrund von Absetzungen lösen.
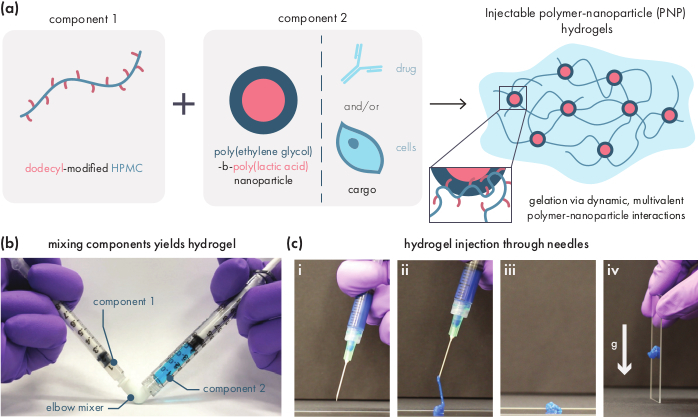
Abbildung 1: Polymer-Nanopartikel (PNP)-Hydrogele werden leicht durch Mischen von zwei Komponenten gebildet. (a) Die erste Komponente ist eine Lösung von Dodecyl-modifizierter Hydroxypropylmethylcellulose (HPMC-C12),und die zweite Komponente ist eine Lösung von Poly(ethylenglykol)-Block-Poly(milchsäure)(PEG-PLA)-Nanopartikeln zusammen mit jeder therapeutischen Ladung. Durch die schonende Mischung dieserbeiden Komponenten ergibt sich ein injizierbares Hydrogel, bei dem die HPMC-C12-Polymere durch dynamische, multivalente Wechselwirkungen mit den PEG-PLA-Nanopartikeln physikalisch vernetzt sind. b)Foto, das die Gelformulierung durch Mischen mit zwei Spritzen demonstriert, die jeweils eine Komponente des PNP-Hydrogels enthalten. Durch die Verbindung der beiden Spritzen mit einem Luer-Lock-Ellenbogenverbinder können die beiden Komponenten leicht unter sterilen Bedingungen gemischt werden, um ein blasenfreies Hydrogel zu erhalten, das zur sofortigen Verwendung in eine Spritze vorgeladen ist. Die NP-Lösung wird zu Demonstrationszwecken blau gefärbt. c)Nachweis der Injektion von PNP-Hydrogelen und ihrer Wiedererstarrung. (i) PNP-Hydrogel in einer Spritze mit einer angebrachten 21G-Nadel. (ii) Die Injektion legt das Hydrogel unter eine Scherung, die die Wechselwirkungen zwischen Polymer und Nanopartikeln vorübergehend aufbricht und eine flüssigkeitsähnliche Konsistenz erzeugt. (iii) Nach der Injektion reformieren sich die dynamischen Polymer-Nanopartikel-Wechselwirkungen schnell, so dass sich das Hydrogel selbst zu einem Feststoff heilen kann. (iv) Das feste Hydrogel fließt nicht unter Kräften, die schwächer sind als seine Streckgrenze, wie z.B. Schwerkraft. Das PNP-Hydrogel wird zu Demonstrationszwecken blau gefärbt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
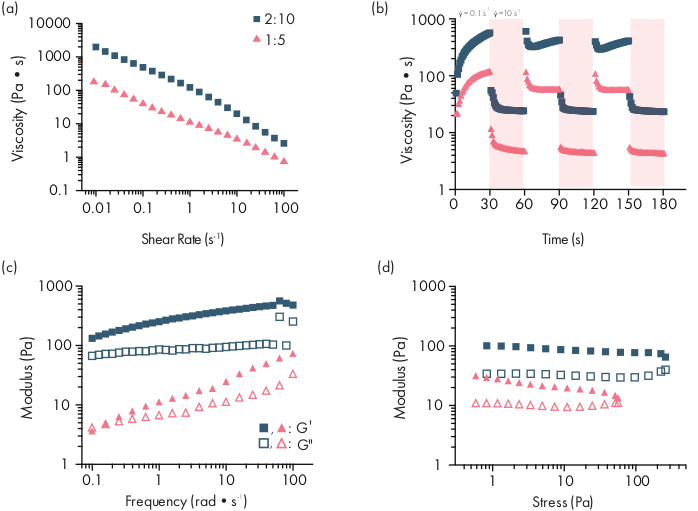
Abbildung 2: Rheologische Charakterisierung von zwei PNP-Hydrogelformulierungen. Formulierungen werden als Polymer Gew.%: NP Gew.%bezeichnet. (a) Stetiger Scherstrom von niedriger bis hoher Scherrate von PNP-Hydrogelen. Die Viskosität in Abhängigkeit von der Scherrate charakterisiert die Scherverdünnungseigenschaften. (b) Viskosität in Abhängigkeit von oszillierenden Scherraten zwischen niedrigen Scherraten (weißer Hintergrund; 0,1 s−1) bis zu hohen Scherraten (roter Hintergrund; 10 s−1), die selbstheilende Eigenschaften von PNP-Hydrogelen zeigen. Scherraten werden für jeweils 30 s auferlegt. (c) Elastischer Speichermodul G′ und viskoser Verlustmodul G" als Funktion der Frequenz bei einer konstanten Dehnung von 1% für verschiedene PNP-Hydrogelformulierungen. (d) Amplitudenfeger mit einer konstanten Frequenz von 10 rad/s, um den elastischen Speichermodul G′und den viskosen Verlustmodul G"von PNP-Hydrogelen in Abhängigkeit von der Spannung zu charakterisieren. Diese rheologische Charakterisierung kann als Vergleich zur Qualitätskontrolle verwendet werden. Diese Abbildung wurde von Grosskopf et al.28adaptiertBitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
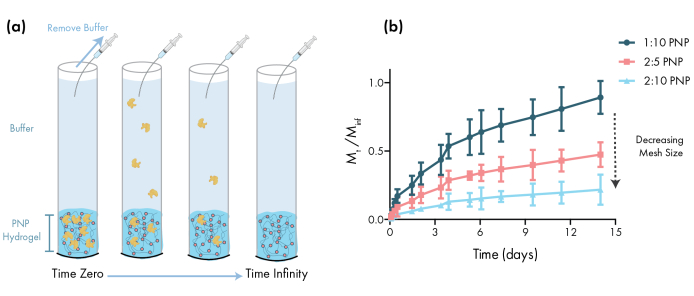
Abbildung 3: In-vitro-Freisetzung von Rinderserumalbumin (BSA) aus PNP-Hydrogelen. Formulierungen werden als Polymer Gew.%: NP Gew.%bezeichnet. a)Schematisch zur Beschreibung des experimentellen In-vitro-Freisetzungsprotokolls. Aliquots werden im Laufe der Zeit aus PNP-Hydrogel-beladenen Kapillarrohren entfernt. b)Die In-vitro-Freisetzung von BSA aus 1:10 PNP, 2:5 PNP und 2:10 PNP wird als die um den angegebenen Zeitpunkt gesammelte Masse dividiert durch die während des Assays gesammelte Gesamtmasse angegeben (Daten, die als Mittelwert ± SD angegeben sind; n = 3). BSA wurde durch Absorptionsmessungen nachgewiesen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
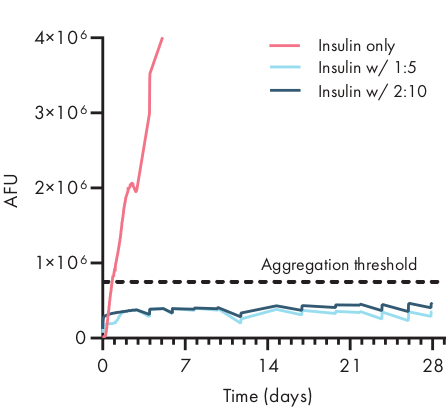
Abbildung 4: Thermische Stabilität von Insulin, das durch ThT-Assay in PNP-Hydrogelen verkapselt ist. Formulierungen werden als Polymer Gew.%: NP Gew.%bezeichnet. Insulin, das sowohl in 1:5- als auch in 2:10-PNP-Hydrogel eingekapselt war, blieb bei gestressten Alterungsbedingungen von 37 °C und ständiger Bewegung über 28 Tage lang unaggregiert. Die Aggregationszeit für Insulin, das in PBS formuliert wurde, betrug 20 ± 4 h (mittlere ± SD, Aggregationsschwelle 750.000 AFU). Die Daten werden als Mittelwert von n = 4 experimentellen Replikaten (AFU, beliebige Fluoreszenzeinheiten) dargestellt. Diese Abbildung wurde von Meis et al.38adaptiertBitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
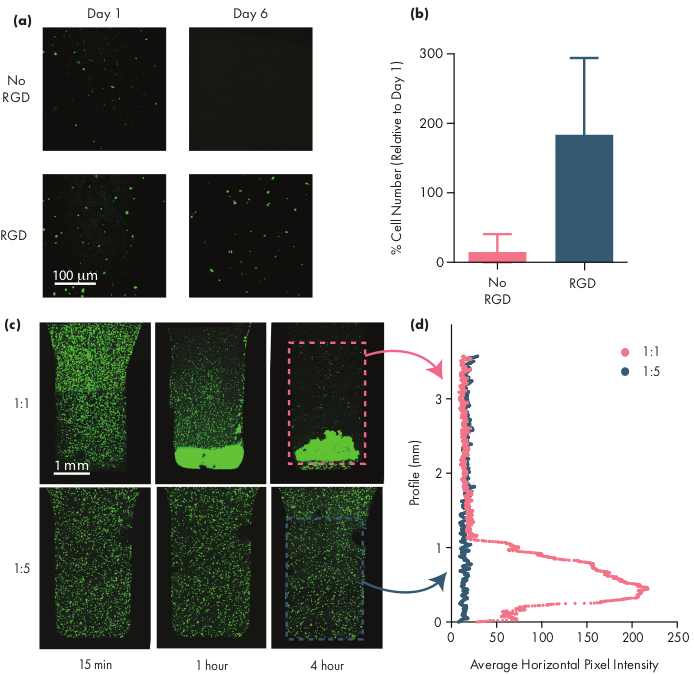
Abbildung 5: Zelllebensfähigkeit und Zellabsetzung in PNP-Hydrogelen. (a,b) Zelllebensfähigkeitsstudien in PNP-Hydrogelen mit humanen mesenchymalen Stammzellen (hMSCs). (a) Repräsentative Bilder lebensfähiger hMSCs in 1:5 PNP-Hydrogelen mit und ohne das zelladhäsive Arginin-Glycin-Asparaginsäure (RGD)-Motiv, das mit den PEG-PLA-NPs konjugiert ist. hMSCs wurden vor der konfokalen Bildgebung 30 Minuten lang mit Calcein gefärbt. Der Skalenbalken stellt 100 μm dar. (b) Zelllebensfähigkeit an Tag 6 definiert als Anzahl der fluoreszierenden Zellen im Bild relativ zur Anzahl der fluoreszierenden Zellen an Tag 1 (Daten als Mittelwert ± SD; n = 3). c,d) Zellverkapselungs- und Absetzexperimente mit hMSCs. (c) Bilder mit maximaler Intensität von Calcein AM-gefärbten hMSCs, die in 1:1 PNP-Hydrogel (obere Reihe) und 1:5 PNP-Hydrogel (untere Reihe) über 4 Stunden gekapselt sind, um die Zellablagerung zu quantifizieren. Der Maßstabsbalken stellt 1 mm dar. (d) Durchschnittliche horizontale Pixelintensität von hMSCs entlang des vertikalen Profils des Hydrogels. Diese Abbildung wurde von Grosskopf et al.28adaptiertBitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Polymer-Nanopartikel-Hydrogele (PNP) sind leicht herzustellen und ermöglichen die langfristige lokale Abgabe therapeutischer Zellen und Medikamente durch minimalinvasive Verabreichung durch Direkteinspritzung oder Katheterabgabe. Diese Protokolle beschreiben die Formulierung von PNP-Hydrogelen und die Charakterisierungsmethoden zur Qualitätssicherung der resultierenden Materialien. Supramolekulare PNP-Hydrogele sind skalierbar und werden durch einfaches Mischen von modifizierten Cellulosepolymeren und polymeren Kern-Schalen-Nanopartikeln gebildet. Die vorliegenden Methoden beschreiben einfache Verfahren zur Bildung von Gelen, die in Spritzen durch einfache Ellenbogenmischprotokolle vorgeladen sind. Durch Qualitätskontrollmetriken jedes der Komponenten, wie DLS zur Überwachung der NP-Größe und -Verteilung, kann man PNP-Hydrogelmaterialien mit konsistenten rheologischen Eigenschaften reproduzierbar formulieren. Durch Variation der Menge an HPMC-C12 oder NPs kann man die Maschenweite und Steifigkeit des resultierenden PNP-Hydrogels modulieren. Diese Eigenschaften können optimal auf eine bestimmte biomedizinische Anwendung abgestimmt werden, und mit den hier beschriebenen rheologischen Methoden können die Forscher die scherverdünnenden und selbstheilenden Eigenschaften von PNP-Hydrogelen charakterisieren, da sie die Plattform für ihre spezifischen Anwendungen optimieren. Methoden für In-vitro-Freisetzungsstudien werden ebenfalls beschrieben; Forscher können diese Studien verwenden, um die relative Zeitskala der Freisetzung von Medikamenten von Interesse zu charakterisieren und zukünftige In-vivo-Studien zu informieren. Mithilfe von Stabilitätsstudien können Forscher auch die Fähigkeit dieser Materialien bewerten, die biologische Struktur und Stabilität empfindlicher Biotherapeutika über Zeit und extreme Temperaturen zu erhalten, mit überzeugenden potenziellen Anwendungen, um die Kühlkettenabhängigkeit von Biotherapeutika zu reduzieren. Schließlich können mit einfachen Zelllebensfähigkeitstests das Zellwachstum und die Migration innerhalb von PNP-Materialien bewertet werden, mit potenziellen Anwendungen in Zelltherapien und Gerüsten.
Unsere Gruppe hat viele überzeugende Anwendungen für die PNP-Hydrogel-Plattform27gefunden. PNP-Hydrogele wurden für die langsame Verabreichung von Untereinheitenimpfstoffen verwendet, die übereinstimmende kinetische Freisetzungsprofile von Antigenen und Adjuvantien ermöglichen, um das Ausmaß, die Dauer und die Qualität der humoralen Immunantwort zu steigern31. Es wurde festgestellt, dass PNP-Hydrogele eine kleinere Maschenweite haben als die am häufigsten verwendeten Hydrogele, so dass sie die Diffusion verlangsamen und molekulare Fracht langsam freisetzen. Die einzigartigen Gewebeadhärenzeigenschaften und mechanischen Eigenschaften von PNP-Hydrogelen wurden auch verwendet, um physikalische Barrieren zu bilden, um Adhäsionen zu verhindern, die durch operationale Entstehen, indem die Hydrogele nach der Operation über große Oberflächen von Organen gesprüht werden30. PNP-Hydrogele haben sich auch als effektive Zellabgabevehikel erwiesen, und die mechanischen Eigenschaften schützen die Zellen tatsächlich vor den mechanischen Kräften, die während der Injektion in der Spritzennadel auftreten, was die Zelllebensfähigkeit verbessert29. Wenn die NPs mit einem zelladhäsiven Peptid konjugiert werden, können sich Die Zellen an die PNP-Matrix anheften und mit ihr interagieren, um lebensfähig zu bleiben. Mit diesem Ansatz wurde gezeigt, dass PNP-Hydrogele die lokale Retention von injizierten Stammzellen im Vergleich zu Methoden mit flüssigen Vehikeln verbessern28. Darüber hinaus wurde gezeigt, dass PNP-Hydrogele die thermisch induzierte Aggregation von verkapseltem Insulin auch unter harten stressbelasteten Alterungsbedingungen verhindern, was darauf hindeutet, dass diese Materialien in der Lage sein könnten, die Notwendigkeit zu reduzieren, temperaturempfindliche Medikamente zukühlen 38.
Insgesamt werden die hier beschriebenen Methoden es Forschungsgruppen ermöglichen, PNP-Hydrogele als Biomaterial herzustellen und zu erforschen. Diese Protokolle bieten die Synthesetechniken im Labormaßstab, um genügend Hydrogelmaterial herzustellen, um sowohl In-vitro- als auch In-vivo-Studien durchzuführen. Die oben beschriebenen Studien deuten darauf hin, dass die dynamische Vernetzung dieser Materialien es ermöglicht, für eine Reihe von biomedizinischen Anwendungen geeignet zu sein, indem sie die aktive Motilität von eingefangenen Zellen ermöglichen und gleichzeitig die passive Diffusion molekularer Fracht einschränken. Es wird erwartet, dass die Forscher die PNP-Plattform als ein zugängliches und leistungsfähiges Werkzeug zur Verbesserung der klinischen Ergebnisse durch kontrollierte Medikamentenabgabe und zur Untersuchung grundlegender biologischer Mechanismen wie Zellrekrutierung und Mechanobiologie finden werden.
Offenlegungen
Diese Autoren haben nichts zu enthüllen.
Danksagungen
Diese Forschung wurde vom Center for Human Systems Immunology mit der Bill & Melinda Gates Foundation (OPP1113682) und der Bill & Melinda Gates Foundation (OPP1211043) finanziell unterstützt. C.M.M. wurde durch ein Stanford Graduate Fellowship und das Stanford Bio-X William and Lynda Steere Fellowship unterstützt. A.K.G. ist dankbar für ein National Science Foundation Graduate Research Fellowship und das Gabilan Fellowship des Stanford Graduate Fellowship in Science and Engineering. S.C. wurde vom National Cancer Institute der National Institutes of Health unter der Award-Nummer F32CA247352 unterstützt. Die Autoren möchten auch den Mitgliedern des Appel Lab, darunter Dr. Gillie Roth, Dr. Anthony Yu, Dr. Lyndsay Stapleton, Dr. Hector Lopez Hernandez, Dr. Andrea d'Aquino, Dr. Julie Baillet, Celine Liong, Ben Ou, Emily Meany, Emily Gale und Dr. Anton Smith, herzlich für ihre Bemühungen und Ihre Zeit danken, die sie dem Appel Lab bei der Entwicklung dieser Protokolle im Laufe der Jahre geholfen haben.
Materialien
| Name | Company | Catalog Number | Comments |
| 21G needles | BD | 305165 | PNP hydrogel injection |
| 22G, 4 in hypodermic needles | Air-Tite | N224 | In vitro release studies |
| 384-well plates, black, clear bottom | Corning | 3540 | Dynamic light scattering (DLS) |
| 96-well plates, black | Fisher Scientific | 07-200-627 | Biostability studies |
| 96-well plates, clear | Corning | 3599 | Cell viability and settling studies |
| Calcein AM | Thermo Fisher Scientific | C3100MP | Cell viability and settling studies |
| Capillary tubes | McMaster-Carr | 8729K66 | In vitro release studies |
| Centrifugal filter units | Fisher Scientific | UFC901024 | NP concentration |
| Cuvettes | Millipore Sigma | BR759015-100EA | Cell viability and settling studies |
| DLS Plate Reader | Wyatt Technology | DynaPro II Plate Reader | Dynamic light scattering (DLS) |
| Epoxy | VWR International | 300007-392 (EA) | In vitro release studies |
| Hypodermic needles | Air-Tite | 8300015027 | In vitro release studies |
| Luer elbow connector | Cole-Parmer | EW-30800-12 | PNP hydrogel formulation |
| Luer lock syringe | Fisher Scientific | 14-955-456 | PNP hydrogel formulation |
| Phosphate Buffered Saline (1x) | Fisher Scientific | 10010049 | PNP hydrogel formulation |
| Plastic Spatula | Thomas Scientific | 1229F13 | Rheological characterization |
| Plate Reader | BioTek | Synergy H1 Hybrid Multi-Mode Plate Reader | Biostability studies |
| Plate seals | Excel Scientific | TS-RT2-100 | Biostability studies |
| Recombinant human insulin | Gibco | A11382II | Biostability studies |
| Rheometer | TA Instruments | DHR-2 Rheometer | Rheological characterization |
| Thioflavin T | Sigma-Aldrich | T3516-5G | Biostability studies |
Referenzen
- Mandal, A., Clegg, J. R., Anselmo, A. C., Mitragotri, S. Hydrogels in the clinic. Bioengineering Translational Medicine. 5 (2), 10158 (2020).
- Appel, E. A., del Barrio, J., Loh, X. J., Scherman, O. A. Supramolecular polymeric hydrogels. Chemical Society Reviews. 41 (18), 6195-6214 (2012).
- Mann, J. L., Yu, A. C., Agmon, G., Appel, E. A. Supramolecular polymeric biomaterials. Biomaterials Science. 6 (1), 10-37 (2018).
- Foster, A. A., Marquardt, L. M., Heilshorn, S. C. The diverse roles of hydrogel mechanics in injectable stem cell transplantation. Current Opinion in Chemical Engineering. 15, 15-23 (2017).
- Aguado, B. A., Mulyasasmita, W., Su, J., Lampe, K. J., Heilshorn, S. C. Improving viability of stem cells during syringe needle flow through the design of hydrogel cell carriers. Tissue Engineering Part A. 18 (7-8), 806-815 (2012).
- Marquardt, L. M., Heilshorn, S. C. Design of injectable materials to improve stem cell transplantation. Current Stem Cell Reports. 2 (3), 207-220 (2016).
- Guvendiren, M., Burdick, J. A. Engineering synthetic hydrogel microenvironments to instruct stem cells. Current Opinion in Biotechnology. 24 (5), 841-846 (2013).
- Marquardt, L. M., et al. Designer, injectable gels to prevent transplanted Schwann cell loss during spinal cord injury therapy. Science Advances. 6 (14), 1039 (2020).
- Stephan, S. B., et al. Biopolymer implants enhance the efficacy of adoptive T-cell therapy. Nature Biotechnology. 33 (1), 97-101 (2015).
- Tuladhar, A., et al. Injectable hydrogel enables local and sustained co-delivery to the brain: two clinically approved biomolecules, cyclosporine and erythropoietin, accelerate functional recovery in rat model of stroke. Biomaterials. 235, 119794 (2020).
- Pakulska, M. M., Miersch, S., Shoichet, M. S. Designer protein delivery: From natural to engineered affinity-controlled release systems. Science. 351 (6279), (2016).
- Gupta, D., Tator, C. H., Shoichet, M. S. Fast-gelling injectable blend of hyaluronan and methylcellulose for intrathecal, localized delivery to the injured spinal cord. Biomaterials. 27 (11), 2370-2379 (2006).
- Verbeke, C. S., Mooney, D. J. Injectable, pore-forming hydrogels for in vivo enrichment of immature dendritic cells. Advanced Healthcare Materials. 4 (17), 2677-2687 (2015).
- Tous, E., Purcell, B., Ifkovits, J. L., Burdick, J. A. Injectable acellular hydrogels for cardiac repair. Journal of Cardiovascular Translational Research. 4 (5), 528-542 (2011).
- Zhao, X., et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing. Biomaterials. 122, 34-47 (2017).
- Johnson, T. D., Christman, K. L. Injectable hydrogel therapies and their delivery strategies for treating myocardial infarction. Expert Opinion on Drug Delivery. 10 (1), 59-72 (2013).
- Kleinman, H. K., Martin, G. R. . Seminars in Cancer Biology. , 378-386 (2005).
- Hickey, J. W., et al. Engineering an artificial T-cell stimulating matrix for immunotherapy. Advanced Materials. 31 (23), 1807359 (2019).
- Baumann, M. D., et al. An injectable drug delivery platform for sustained combination therapy. Journal of Controlled Release. 138 (3), 205-213 (2009).
- Trappmann, B., et al. Matrix degradability controls multicellularity of 3D cell migration. Nature Communications. 8 (1), 1-8 (2017).
- Figueiredo, L., et al. Assessing glucose and oxygen diffusion in hydrogels for the rational design of 3D stem cell scaffolds in regenerative medicine. Journal of Tissue Engineering and Regenerative Medicine. 12 (5), 1238-1246 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. , 1-24 (2019).
- Chaudhuri, O., et al. Substrate stress relaxation regulates cell spreading. Nature Communications. 6 (1), 1-7 (2015).
- Cai, L., Dewi, R. E., Heilshorn, S. C. Injectable hydrogels with in situ double network formation enhance retention of transplanted stem cells. Advanced Functional Materials. 25 (9), 1344-1351 (2015).
- Fisher, S. A., Baker, A. E., Shoichet, M. S. Designing peptide and protein modified hydrogels: selecting the optimal conjugation strategy. Journal of the American Chemical Society. 139 (22), 7416-7427 (2017).
- Li, R. H., Altreuter, D. H., Gentile, F. T. Transport characterization of hydrogel matrices for cell encapsulation. Biotechnology and Bioengineering. 50 (4), 365-373 (1996).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6 (6295), (2015).
- Grosskopf, A. K., et al. Injectable supramolecular polymer-nanoparticle hydrogels enhance human mesenchymal stem cell delivery. Bioengineering and Translational Medicine. 5 (1), 10147 (2020).
- Lopez Hernandez, H., Grosskopf, A. K., Stapleton, L. M., Agmon, G., Appel, E. A. Non-newtonian polymer-nanoparticle hydrogels enhance cell viability during injection. Macromolecular Bioscience. 19 (1), (2019).
- Stapleton, L. M., et al. Use of a supramolecular polymeric hydrogel as an effective post-operative pericardial adhesion barrier. Nature Biomedical Engineering. 3 (8), 611-620 (2019).
- Roth, G. A., et al. Injectable hydrogels for sustained codelivery of subunit vaccines enhance humoral immunity. ACS Central Science. , (2020).
- Steele, A. N., et al. A biocompatible therapeutic catheter-deliverable hydrogel for in situ tissue engineering. Advanced Healthcare Materials. 8 (5), 1801147 (2019).
- Fenton, O. S., et al. Injectable polymer-nanoparticle hydrogels for local immune cell recruitment. Biomacromolecules. 20 (12), 4430-4436 (2019).
- Yu, A. C., Smith, A. A., Appel, E. A. Structural considerations for physical hydrogels based on polymer-nanoparticle interactions. Molecular Systems Design & Engineering. 5 (1), 401-407 (2020).
- Wisdom, K., Chaudhuri, O., Koledova, Z. . 3D Cell Culture: Methods and Protocols. , 29-37 (2017).
- Lohmeijer, B. G., et al. Guanidine and amidine organocatalysts for ring-opening polymerization of cyclic esters. Macromolecules. 39 (25), 8574-8583 (2006).
- Cheng, J., et al. Formulation of functionalized PLGA-PEG nanoparticles for in vivo targeted drug delivery. Biomaterials. 28 (5), 869-876 (2007).
- Meis, C. M., et al. Self-assembled, dilution-responsive hydrogels for enhanced thermal stability of insulin biopharmaceuticals. ACS Biomaterials Science & Engineering. , (2020).
- Franck, A., Germany, T. Viscoelasticity and dynamic mechanical testing. TA Instruments. , (1993).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6, 6295 (2015).
- Gallastegui, A., et al. Controlled release of antibiotics from photopolymerized hydrogels: kinetics and microbiological studies. Materials Science and Engineering: C. 102, 896-905 (2019).
- Qiao, M., Chen, D., Ma, X., Liu, Y. Injectable biodegradable temperature-responsive PLGA-PEG-PLGA copolymers: synthesis and effect of copolymer composition on the drug release from the copolymer-based hydrogels. International Journal of Pharmaceutics. 294 (1-2), 103-112 (2005).
- Schlein, M. Insulin Formulation Characterization-The Thioflavin T Assays. The AAPS Journal. 19 (2), 397-408 (2017).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Sakas, G., Grimm, M., Savopoulos, A. . EUROGRAPHICS workshop on Rendering Techniques. , 51-63 (1995).
- Axpe, E., et al. A multiscale model for solute diffusion in hydrogels. Macromolecules. 52 (18), 6889-6897 (2019).
- Peppas, N., Bures, P., Leobandung, W., Ichikawa, H. Hydrogels in pharmaceutical formulations. European Journal of Pharmaceutics and Biopharmaceutics. 50 (1), 27-46 (2000).
- Ritger, P. L., Peppas, N. A. A simple equation for description of solute release I. Fickian and non-fickian release from non-swellable devices in the form of slabs, spheres, cylinders or discs. Journal of Controlled Release. 5 (1), 23-36 (1987).
- Reinhart, C. T., Peppas, N. A. Solute diffusion in swollen membranes. Part II. Influence of crosslinking on diffusive properties. Journal of Membrane Science. 18, 227-239 (1984).
- Salinas, C. N., Anseth, K. S. The influence of the RGD peptide motif and its contextual presentation in PEG gels on human mesenchymal stem cell viability. Journal of Tissue Engineering and Regenerative. 2 (5), 296-304 (2008).
- Smith, A. A., et al. Nanoparticles presenting potent TLR7/8 agonists enhance anti-PD-L1 immunotherapy in cancer treatment. Biomacromolecules. 21 (9), 3704-3712 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten