Method Article
Инъекционные супрамолекулярные полимерно-наночастицы гидрогели для клеточных и лекарственных средств
В этой статье
Резюме
Этот протокол описывает синтез и рецептуру инъекционных супрамолекулярных полимерно-наночастиц (ПНП) гидрогелевых биоматериалов. Продемонстрировано применение этих материалов для доставки лекарств, биофармацевтической стабилизации, инкапсуляции и доставки клеток.
Аннотация
Эти методы описывают, как сформулировать инъекционные супрамолекулярные полимерно-наночастицы (PNP) гидрогели для использования в качестве биоматериалов. Гидрогели PNP состоят из двух компонентов: гидрофобно модифицированной целлюлозы в качестве сетевого полимера и самособранных наночастиц ядра-оболочки, которые действуют как нековалентные поперечные связующие звена посредством динамических, поливалентных взаимодействий. Эти способы описывают как образование этих самособранных наночастиц посредством нанопреципитации, так и формулирование и смешивание двух компонентов с образованием гидрогелей с настраиваемыми механическими свойствами. Также подробно описано использование динамического рассеяния света (DLS) и реологии для характеристики качества синтезированных материалов. Наконец, полезность этих гидрогелей для доставки лекарств, биофармацевтической стабилизации и инкапсуляции и доставки клеток демонстрируется с помощью экспериментов in vitro для характеристики высвобождения лекарств, термической стабильности, а также оседания и жизнеспособности клеток. Благодаря своей биосовместимости, инъективности и мягким условиям образования геля, эта гидрогелевая система является легко настраиваемой платформой, подходящей для целого ряда биомедицинских применений.
Введение
Инъекционные гидрогели являются новым инструментом для доставки терапевтических клеток и лекарств в организм контролируемым образом1. Эти материалы могут быть загружены лекарствами или клетками и могут вводиться минимально инвазивным способом путем прямой инъекции в поверхностные ткани или путем катетерной доставки в глубокие ткани. В общем, инъекционные гидрогели состоят из набухших в воде полимерных сетей, которые сшиты друг с другом временными физическими взаимодействиями. В состоянии покоя эти сшивки обеспечивают гелям твердую структуру, но при приложении достаточной механической силы эти сшивки временно нарушаются, превращая материал в жидкое состояние, которое может легко протекать2. Именно эти реологические свойства позволяют физическим гидрогелям разбавлень и протекать через малые диаметры игл во время инъекции3. После инъекции полимерная сеть материала реформируется, что позволяет ему самовосстанавливаться и быстро образовывать твердоподобный гель in situ4,5. Эти структуры могут действовать как депо с медленным высвобождением для лекарств или каркасы для регенерации тканей6,7. Эти материалы использовались в различных приложениях, охватывающих технологию доставки лекарств, регенеративную медицину и иммуноинженерию1,8,9,10,11,12.
Как природные материалы (например, альгинат и коллаген), так и синтетические материалы (например, поли(этиленгликоль) (ПЭГ) или аналогичные гидрофильные полимеры) были разработаны как биосовместимые инъекционные гидрогелевые материалы13,14,15. Многие природные материалы демонстрируют вариации от партии к партии, влияющие на воспроизводимость4,16. Эти материалы часто чувствительны к температуре, отверждаются при достижении физиологических температур; таким образом, обращение с этими материалами создает дополнительные технические и логистическиепроблемы17. Синтетические материалы обеспечивают более точный химический контроль и отличную воспроизводимость, но эти материалы иногда могут подвергаться неблагоприятным иммунным реакциям, которые ограничивают их биосовместимость, что является критическим признаком для терапевтических применений in vivo6,18,19. Недавние усилия показали, что существует много сложных критериев проектирования, связанных с разработкой инъекционного гидрогелевого материала, включая оптимизацию механических свойств, размера сетки полимерной сети, биологически активных молекулярных сигналов, биоразлагаемости и иммуногенности материала20,21,22,23,24,25,26. Все эти факторы должны учитываться в зависимости от интересующего применения, что означает, что модульная, химически настраиваемая платформа идеально подходит для удовлетворения широкого спектра применений.
Настоящие способы описывают композицию и использование инъекционной платформы гидрогеля полимер-наночастицы (ПНП), которая проявляет настраиваемые механические свойства, высокую степень биосовместимости и низкую иммуногенность и представляет участки для сопряжения биологически активных молекулярных сигналов27,28,29,30,31,32,33. Эти гидрогели PNP состоят из гидрофобно-модифицированных целлюлозных полимеров и самособранных наночастиц ядра-оболочки, включающих поли(этиленгликоль)-блок-поли(молочная кислота) (PEG-PLA)27,34, которые взаимодействуют с получением супрамолекулярной сети. Более конкретно, додецил-модифицированные гидроксипропилметилцеллюлозные полимеры (HPMC-C12)динамически взаимодействуют с поверхностью наночастиц PEG-PLA и мостом между этими наночастицами с образованием этой полимерной сети27,34. Эти динамические, многовалентные взаимодействия позволяют материалам разреживаться во время инъекции и быстро самовоспроизводиться после введения. Компоненты гидрогеля PNP легко изготавливаются путем простых реакций с одним горшком, а гидрогель PNP образуется в мягких условиях путем простого смешивания двух компонентов35. Благодаря простоте изготовления эта гидрогелевая платформа хорошо транслируется в масштабе. Механические свойства и размер ячеек гидрогелей PNP контролируются путем изменения весового процента полимерных и наночастиц компонентов в составе. Предыдущие исследования с этой платформой показывают, что гидрогели PNP являются высоко биосовместимыми, биоразлагаемыми и неиммуногенными28,30,31. В целом, эти гидрогели представляют широкую полезность в биомедицинских приложениях, охватывающих послеоперационную профилактику адгезии, тканевую инженерию и регенерацию, устойчивую доставку лекарств и иммуноинженерию.
протокол
Перед началом работы этого протокола необходимо синтезировать HPMC-C12 и PEG-PLA с использованием ранее опубликованных методов27,28,29,30,31,36,37,38.
1. Синтез наночастиц (NP) путем нанопреципитации
ПРИМЕЧАНИЕ: В настоящем разделе описывается синтез одной партии НП, производящей 250 мкл 20 мас.% НП в буферном растворе (50 мг сухого полимера ПЭГ-PLA на партию). Примечания по масштабированию количества партий предоставляются на соответствующих этапах.
- Измерьте 50 мг полимера PEG-PLA в стеклянный флакон 8 мл и добавьте 1 мл ацетонитрила. Вихрь полностью растворяется.
ПРИМЕЧАНИЕ: Чтобы увеличить количество партий, линейно масштабируйте этот этап и добавьте общее количество полимера и растворителя, необходимых в одном флаконе. - Добавьте 10 мл сверхчистой воды в стеклянный флакон емкостью 20 мл с небольшим перемешиванием. Поставьте на перемешиваемую пластину, установленную на 600 об/мин.
ПРИМЕЧАНИЕ: Если этап 1.1 был масштабирован, по-прежнему необходимо иметь отдельный сцинтилляционный флакон для осаждения для каждой эквивалентной партии. Например, для 200 мг полимера, растворенного в 4 мл ацетонитрила, готовят 4 х 20 мл сцинтилляционных флаконов. - Чтобы сформировать НП путем нанопреципитации, добавьте 1 мл раствора полимерного растворителя по каплям в воду, используя пипетку объемом 200 мкл. Перемешивать в течение 2 мин. Блок PLA PEG-PLA не растворим в воде, и в результате НЧ-оболочка ядра будет самособираться с гидрофобными блоками PLA в качестве ядра и гидрофильными блоками PEG в качестве оболочки.
- Проверьте размер частиц с помощью динамического рассеяния света (DLS).
ПРИМЕЧАНИЕ: Эта процедура специально написана для коммерчески доступного считывателя пластин с соответствующим пакетом программного обеспечения (см. Таблицу материалов). Для использования альтернативных инструментов обратитесь к методам пробоподготовки, описанным изготовителем прибора.- Разбавить 20 мкл раствора NP 80 мкл сверхчистой воды (концентрация анализа: 1 мг/мл НП ПЭГ-НОАК). Добавьте 30 мкл на скважину к прозрачной нижней черной 384-скважинной пластине (анализ в трех процентах).
- Измерьте гидродинамический радиус и полидисперсность каждого образца с помощью считывателя пластин DLS, используя предустановленные параметры протокола в программном пакете. В качестве примера типичного протокола задайте параметры сбора данных для получения 5-10 измерений DLS длительностью 2-5 с на приобретение, а затем сообщите о среднем размере и распределении частиц на скважину, рассчитанном на основе модели глобулярных белков. Для образования гидрогелей с последовательными реологическими свойствами полученные частицы должны иметь гидродинамический диаметр 30-50 нм с полидисперсностью (PD) < 0,2.
ПРИМЕЧАНИЕ: Если НП меньше желаемого, используют раствор 75% ацетонитрила/25% диметилсульфоксида (ДМСО) на этапе 1.1. Увеличение процента ДМСО в растворе растворителя, как правило, увеличивает размер частиц.
- Перенесите раствор NP из сцинтилляционного флакона 20 мл в центробежный фильтрующий блок. Центрифугу при 4500 х г в течение 1 ч концентрируют раствор NP до <250 мкл.
- Повторное суспендирование в желаемом буфере, таком как фосфатно-буферный физиологический раствор (PBS), до 20 мас.% НП. Пипетка содержимого центробежного фильтрующего блока в смоляную микроцентрифужную трубку или стеклянный сцинтилляционный флакон на массовый баланс. Используйте небольшое количество (50-100 мкл) буфера для промывки фильтра и обеспечения сбора всех НП. Добавьте буфер, чтобы достичь общей массы 250 мг.
ПРИМЕЧАНИЕ: Пакеты могут быть объединены во время повторного суспендирования. Растворы NP можно хранить при 4 °C в течение приблизительно 1 месяца. Не замораживать. Для более длительного хранения перед использованием проверьте размер и полидисперсность по DLS.
2. Гидрогелевая формула и инкапсуляция лекарств или клеток
ПРИМЕЧАНИЕ: В этом разделе описывается приготовление 1 мл 2:10 PNP гидрогеля, причем 2:10 обозначает 2 мас.% HPMC-C12 и 10 мас.% NP (12 мас.% общего твердого полимера) и 88 мас.% буферного раствора, раствора лекарственного средства или клеточной суспензии. Процентное содержание состава может быть изменено для получения гидрогелей с различными механическими свойствами. Например, гидрогели 1:5 PNP были использованы для оседания клеток и показали экспериментальные результаты жизнеспособности.
- Готовят бульонный раствор 6 мас.% HPMC-C12 в PBS (или другом буфере по выбору). Растворяют в течение 48 ч, чтобы обеспечить полную диспергированность полимера.
ПРИМЕЧАНИЕ: Стоковое решение HPMC-C12 стабильно в течение нескольких месяцев при комнатной температуре. Однако для ингибирования роста микробов рекомендуется хранение при 4 °C. - Добавьте 333 мг 6 мас.% раствора HPMC-C12 в шприц Luer lock 1 мл.
- Добавьте 500 мкл 20 мас.% раствора NP в микроцентрифужную трубку. Добавьте 167 мкл PBS и пипетку для смешивания. Используя иглу, заполните еще 1 мл шприца Luer lock разбавленным раствором NP.
ПРИМЕЧАНИЕ: Для загрузки лекарственного груза рассчитайте желаемую конечную концентрацию лекарственного средства в гидрогеле и загрузите соответствующее количество в 167 мкл PBS, которое смешивается с НП. Если молекулярный зонд необходим для анализа in situ, например, для мониторинга стабильности лекарственного средства, загрузите зонд таким же образом, как описано выше для загрузки лекарственного груза. Для тензодатчиков рассчитывают желаемую конечную концентрацию клеток в гидрогеле и загружают соответствующее количество ячеек в 167 мкл PBS, который смешивается с НП. - Смешайте два компонента гидрогеля (HPMC-C12 и NPs) с использованием локтевого методасмешивания 35.
- Прикрепите коленчатый соединитель Luer к шприцеву, содержащему раствор NP (необязательно также содержащий лекарственный груз или клетки). Протолкнуть раствор NP через локоть до тех пор, пока мениск не будет виден на открытом конце. Слегка ототяните назад и подключите шприц, содержащий раствор HPMC-C12.
ПРИМЕЧАНИЕ: Важно свести к минимуму воздух в коленном соединении, чтобы предотвратить образование и рассеивание пузырьков по всему гидрогелю во время процесса смешивания. При смешивании клеток с локтевым миксером позаботьтесь о том, чтобы смешивать более мягко, так как слишком быстрое смешивание может подвергнуть клетки высоким силам сдвига, что приведет к гибели клеток. - Перекачивайте два раствора вперед и назад через коленчатый смеситель в течение примерно 60 циклов, пока не образуется однородный, непрозрачный белый гидрогельный материал.
- Вытолкнуть весь объем гидрогеля в один шприц. Снимите пустой шприц и верните плунжер обратно на шприц с гелевым нагруженным гелем, чтобы извлечь материал из коленного разъема. Колпачок с иглой или пробкой.
ПРИМЕЧАНИЕ: Необходимо учитывать ~300 мкл потерянного объема гидрогеля из-за мертвого пространства в процессе смешивания. Например, если желательно 700 мкл конечного объема гидрогеля, следует приготовить 1 мл гидрогеля. Процесс приготовления гидрогеля может быть расширен с помощью более крупных шприцев. Однако для жестких гидрогелевых составов, таких как 2:10, может стать трудно смешивать и вводить из шприцев объемом более 3 мл из-за увеличения отношения ствола шприца к диаметру локтя или иглы. - Хранить гидрогель в шприце при комнатной температуре. Однако, если лекарства инкапсулированы, рекомендуется хранение при 4 °C, если производитель лекарственного средства не указывает иное. Не замораживайте материал.
- Прикрепите коленчатый соединитель Luer к шприцеву, содержащему раствор NP (необязательно также содержащий лекарственный груз или клетки). Протолкнуть раствор NP через локоть до тех пор, пока мениск не будет виден на открытом конце. Слегка ототяните назад и подключите шприц, содержащий раствор HPMC-C12.
3. Измерение реологических свойств гидрогелевых составов
ПРИМЕЧАНИЕ: Этот протокол специально используется с коммерческим реометром, упомянутым в Таблице материалов с зазубренной геометрией пластины 20 мм. Для использования других инструментов обратитесь к инструкции производителя по пробоподготовке.
- Сформулируют не менее 700 мкл гидрогеля PNP для реологической характеристики.
- Впрыскиваем материал в центр зазубренная пластина реометра. Размер будет варьироваться в зависимости от выбранного геометрии зазора. Для справки, зазор 700 мкм требует ~ 400-500 мкл материала.
- Опустите реометр к зазору дифферента (500-1000 мкм) и медленно поверните верхнюю пластину реометра, когда она вступает в контакт с гидрогелем PNP, чтобы обеспечить равномерное и полное заполнение зазора.
- Проверьте нагрузку гидрогеля PNP таким образом, чтобы он покрывал всю поверхность пластины реометра. Используйте шпатель или пластиковый триммер, чтобы аккуратно обрезать и удалить любой лишний материал, так что он имеет очень небольшую выпуклость из пластины.
- Опустите реометр до конечного геометрионного зазора и убедитесь, что образец чисто загружен.
- Измерьте механические свойства образца с помощью колебательных испытаний, таких как амплитудные или частотные развертки, или тестов потока, таких как развертки потока или ступенчатые испытания.
ПРИМЕЧАНИЕ: В представленных репрезентативных данных испытания на амплитуду колебаний проводятся с постоянной частотой 10 рад/с. Колебательные частотные развертки выполняются при постоянной деформации 1%, в пределах линейного вязкоупругого режима амплитудной развертки. Развертки потока были запущены от высоких скоростей сдвига до низких скоростей сдвига39. Все тесты завершаются с 10 баллами за десятилетие собранных данных и при комнатной температуре. Параметры испытания, возможно, потребуется скорректировать в зависимости от свойств состава. Подвергая более жесткие материалы PNP, такие как составы 2:10, высоким скоростям сдвига, может привести к выбросу материала из пластин реометра, что приведет к неточной механической характеристике и потребует перегрузки образца между последующими испытаниями. Репрезентативные данные, показанные ниже, могут быть использованы для сравнения во время тестирования контроля качества.
4. Характеристика высвобождения препарата in vitro
- Подготовьте капиллярные трубки, разрезав стеклянные капиллярные трубки на нужную длину. Запечатайте один конец каждой трубки, используя одноразовый шпатель или наконечник пипетки, чтобы протолкнуть небольшое количество эпоксидной смолы в конец трубки, чтобы сформировать пробку. Позвольте эпоксидной смоле устанавливаться в соответствии с рекомендованным производителем временем.
ПРИМЕЧАНИЕ: Трубка должна быть короче длины инъекционной иглы. Трубки с внутренним диаметром 2-3 мкм рекомендуются таким образом, чтобы длина 2,5 дюйма содержала не менее 300 мкл общего объема. - Сформулируют по меньшей мере 500 мкл гидрогелевого материала PNP в шприце, содержащем интересующее лекарственное средство. Подготовьте каждую группу образцов в отдельном шприце.
- Вводят 100-200 мкл гидрогеля PNP в нижнюю часть каждой капиллярной трубки с помощью длинной подкожной иглы (22G, 4 дюйма). Подготовьте не менее трех пробирок (трижды) на группу образцов.
- (Необязательно) Поместите заполненные капиллярные трубки в коническую центрифужную трубку и центрифугу на 1 мин при 1000 х г, чтобы поверхность гидрогеля была однородной. Этот шаг, возможно, потребуется повторить, изменяя время и скорость по мере необходимости для сглаживания поверхности материала.
ВНИМАНИЕ: Убедитесь, что центрифуга хорошо сбалансирована. - Осторожно заполните 200-300 мкл PBS поверх гидрогеля в капиллярной трубке с помощью шприца и иглы или пипетки. Не контактировать и не беспокоить поверхность гидрогеля. Запечатайте трубку колпачком или заглушкой или крышкой, по меньшей мере, двумя слоями парафиновой пленки.
- (Необязательно) Инкубировать образцы при 37 °C для имитации условий in vivo.
- Осторожно полностью удалить PBS с каждого капилляра, не нарушая поверхность гидрогеля, используя шприц и иглу в выбранные моменты времени в зависимости от ожидаемой временной шкалы высвобождения препарата. Замените удаленный том свежей PBS. Храните аликвоты при соответствующих условиях.
ПРИМЕЧАНИЕ: Рекомендуемые объемы и временные точки на этапах 4.3, 4.5 и 4.7 могут быть оптимизированы для захвата высвобождения лекарственного средства in vitro в течение диапазона временных масштабов, в зависимости от того, сколько лекарственного средства загружено в материал и как быстро оно высвобождается в супернатант. Выборка выбранных временных точек может составлять 6 ч, 1 день, 3 дня, 1 неделю и 2 недели для препарата с медленным высвобождением. Аликвоты также могут быть проанализированы по мере их приобретения, а не хранения. - По завершении исследования анализируют аликвоты с помощью соответствующего метода, такого как ИФА, ВЭЖХ или флуоресцентный анализ, для количественной оценки количества лекарственного средства, высвобождаемого в каждый моментвремени 40,41,42. Соответствующий метод обнаружения будет варьироваться в зависимости от интересующего препарата.
ПРИМЕЧАНИЕ: Исследования высвобождения in vitro полезны для сравнения высвобождения между различными составами гидрогелей или грузом лекарств. Временная шкала выпуска in vitro не часто напрямую указывает на ожидаемую временную шкалу выпуска in vivo.
5. Характеристика термической стабильности гелеобразно-инкапсулированного инсулина
- Сформулируйте не менее 1,2 мл гидрогеля PNP на группу образцов. Следуя процедуре, описанной в разделе 2.3, загрузите инсулин (лекарственное средство) и тиофлавин T (ThT) (молекулярный зонд) в гидрогель PNP.
ПРИМЕЧАНИЕ: Основной механизм агрегации и, следовательно, инактивации инсулина заключается в образовании амилоидных фибрилл. ThT является подходящим молекулярным зондом, поскольку он производит сильный флуоресцентный сигнал в присутствии амилоидных фибрилл, что позволяет контролировать агрегацию инсулина in situ. В зависимости от интересующего лекарственного груза агрегация может контролироваться различными методами. Для показанных репрезентативных данных инсулин загружали до конечной концентрации 6,7 или 10 мг/мл и ТТ до конечной концентрации 25 мкМ. - Используя иглу 21 Г, впрыскивайте 200 мкл гидрогеля PNP на скважину в черную 96-скважинную пластину. Каждая выборка группы должна измеряться как минимум в трех измерениях. Уплотнительная пластина с оптически прозрачным клейким уплотнением для предотвращения испарения.
- Вставьте пластину в считыватель пластин, оснащенный программированием контроля температуры, встряхивания и кинетического считывания, и начните чтение протокола. Репрезентативные данные были получены с помощью коммерчески доступного считывателя пластин (см. Таблицу материалов) с использованием следующих условий:
- Напряженные условия старения: непрерывное линейное встряхивание (410 cpm, 5 мм) при 37 °C.
- Сбор данных: возбуждение/излучение 450 нм/482 нм с интервалом 20 мин
ПРИМЕЧАНИЕ: Если пластинчатый считыватель с возможностью контроля температуры, шейкера и кинетического считывания недоступен, пластина может быть помещена на шейкерную пластину в инкубаторе и считывать вручную на длинах волн выше в выбранные моменты времени.
- Построение данных в виде среднего флуоресцентного сигнала с течением времени для каждой группы. Время до агрегирования может быть количественно определено путем определения произвольного порога сигнала43.
ПРИМЕЧАНИЕ: Для репрезентативных данных, показанных ниже, пороговое значение было определено как 750 000 произвольных флуоресцентных единиц (AFU). Это значение было выбрано так, чтобы быть выше измеренного базового уровня, в то же время в достаточной степени фиксируя начало агрегации, обозначенное резким увеличением флуоресцентного сигнала. - Прекращают анализ, когда образцы накапливаются или визуально начинают обезвоживаться.
6. Оценка жизнеспособности клеток
- Сформулируют, по меньшей мере, 2 мл гидрогеля PNP, содержащего желаемую концентрацию клеток, следуя вышеуказанным протоколам (обычно 1 - 5 х10 6 клеток/мл). Подготовьте каждую группу образцов в отдельном шприце.
- Используя иглу 21G, ввести 150 мкл гидрогеля PNP в каждую скважину в прозрачной нижней 96-скважинной пластине; каждая скважина является одной репликой. Каждая выборочная группа должна иметь 3-5 реплик на момент времени. Центрифугируют пластину при 50 х г в течение 2 мин, чтобы равномерно распределить гидрогель в скважине.
- Добавьте 100 мкл соответствующей клеточной среды поверх гидрогеля. Удаляйте этот носитель каждый день и добавляйте 100 мкл новых носителей.
- На 1-й день удалите среду поверх гидрогеля для назначенных реплик для этой временной точки для каждой группы образцов. Добавьте 50 мкл раствора кальциина AM 2 мМ поверх гидрогелей. Инкубировать в течение 30 мин.
ПРИМЕЧАНИЕ: Calcein AM может использоваться для идентификации и маркировки живых клеток. В живых клетках нефлуоресцентный кальциин AM превращается в зелено-флуоресцентный кальциин внутриклеточными эстеразами после гидролиза ацетоксиметилового эфира. - Изобразите центр каждой скважины в 96-скважинной пластине с помощью конфокального микроскопа. Обследовать площадь не менее 300мкм2 с z-стеком, охватывающим не менее 150 мкм. Используйте конфокальные настройки длины волны для захвата флуоресценции кальциина (возбуждение/излучение: 495 нм/515 нм).
- Повторите этапы 6.4 и 6.5 для каждой последующей точки времени по желанию.
- Чтобы проанализировать каждое изображение, сверните все изображения z-стека в одну плоскость изображения максимальной интенсивности с помощью FIJI или аналогичного программного обеспечения. Количественно оцените количество флуоресцентных клеток на каждом изображении. Отношение количества флуоресцентных клеток в каждый момент времени к числу флуоресцентных клеток на 1-й день является относительной жизнеспособностью клеток в гидрогелях PNP.
7. Оценка оседания клеток
- Рассчитайте количество клеток, необходимое для получения 500-700 мкл гидрогеля PNP при конечной концентрации 5 х 106 клеток/мл. Суспендированы клетки в 1 мл PBS в концентрации 1 х 106 клеток/мл. Окрашивают клетки добавлением 50 мкл 2 мМ кальциина АМ. Инкубировать клетки с красителем в течение 10 мин.
- Центрифугные клетки при соответствующих условиях удаляют PBS и повторно суспендируют клетки в объеме PBS, необходимом для образования 500-700 мкл желаемого гидрогеля PNP.
ПРИМЕЧАНИЕ: Рекомендуемая скорость и продолжительность центрифуги каждого конкретного типа ячеек обычно указаны в документации к продукту. - Сформулируйте 500-700 мкл гидрогеля PNP с окрашенными клетками (5 x 106 клеток/мл) в соответствии с разделом 2 протокола.
- Используя иглу 21G, вводят 100-200 мкл гидрогеля PNP, содержащего окрашенные клетки в нижней части кюветы. Для каждого образца следует выполнить три реплики. Перемещайте иглу вперед и назад внутри кюветы во время инъекции, чтобы предотвратить образование пузырьков.
- Немедленно (время t = 0) изобразить кюветы, лежащие на боку над всей плоской областью прямоугольника кюветы у основания кюветы. Используйте возможности конфокального сканирования плиток для получения изображения всей площади скважины и изображения z-стека в 3D на глубине 100 мкм. Для последующей визуализации либо используйте программное обеспечение конфокального микроскопа, чтобы сшить вместе все отдельные плитки и выполнить проекцию максимальной интенсивности для формирования единого изображения большой площади, либо используйте программное обеспечение FIJI на персональном компьютере44,45.
- После визуализации встаньте кюветами вертикально.
- Изображение через 1 ч и 4 ч, чтобы увидеть, осели ли клетки в гидрогеле или они остаются взвешенными.
ПРИМЕЧАНИЕ: Эти временные точки являются предложениями и могут быть изменены по желанию. - Чтобы проанализировать каждое изображение, сверните все изображения z-стека в одну плоскость изображения максимальной интенсивности. Используя FIJI или аналогичное программное обеспечение, количественно оцените распределение клеток, измеряя интенсивность флуоресценции вниз по центральному вертикальному профилю кюветы для определения степени оседания.
Результаты
Изготовление и определение характеристик гидрогеля PNP
Гидрогели PNP образуются путем смешивания двух основных компонентов - гидрофобно-модифицированных полимеров HPMC и наночастиц PEG-PLA(рисунок 1a). Терапевтический груз легче всего включается в дополнительный буфер, используемый для разбавления компонента наночастиц перед получением гидрогеля. Для последующей биомедицинской характеристики удобно использовать метод локтевого смешивания, который позволяет просто и воспроизводимо смешивать два компонента(рисунок 1b). После адекватного перемешивания гидрогель должен чувствовать себя твердым в шприце, но выдаваться под давлением и выдавливаться из стандартной иглы (показано 21G)(рисунок 1c). После инъекции гидрогель должен быстро поместиться в твердый материал, который сопротивляется потоку от силы тяжести. Чтобы полностью охарактеризовать гидрогель и обеспечить согласованность продуктов от партии к партии, образцы должны быть проанализированы с использованием нескольких различных экспериментов на реометре. Возможности геля по истончению и самовосстановлению будут легко наблюдаться с помощью протокола развертки потока и протокола ступенчатого сдвига соответственно(рисунок 2a,b). Для более жестких гелей, таких как состав 2:10, пользователь должен искать вязкость для уменьшения по крайней мере на два порядка во время развертки потока, поскольку скорость сдвига увеличивается с 0,1 до 100с-1,что имитирует механические условия во время инъекции. Протокол ступенчатого сдвига должен выявить снижение вязкости на порядки под высокими ступенями сдвига и быстрое возвращение (время восстановления <5 с) к исходной вязкости во время ступеней низкого сдвига. Характеристика модулей накопления и потерь с помощью эксперимента колебательного сдвига частоты развертки в линейном вязкоупругом режиме должна выявить твердотопливные свойства в диапазонах частот от 0,1-100 радс-1 (рис. 2в). В частности, как правило, не должно быть пересечения модулей хранения сдвига и потерь, которые наблюдаются на низких частотах для более жестких составов, таких как гидрогели 2:10. Такое событие кроссовера может указывать на проблемы с качеством исходных материалов, либо модифицированного полимера HPMC или PEG-PLA, либо размером и дисперсией наночастиц PEG-PLA. Следует отметить, что событие кроссовера можно ожидать для более слабых составов гидрогелей, таких как гидрогель 1:5. Колебательные сдвиги амплитуды сдвига на гидрогелях PNP показывают, что материалы не уступают до тех пор, пока не будут применены высокие значения напряжений, что указывает на то, что эти материалы обладают пределом текучести, пороговым величиной напряжения, необходимой для протекания материала.
Характеристика кинетики высвобождения из гидрогелей PNP
Важным шагом в разработке гелей PNP для доставки лекарств является характеристика кинетики высвобождения лекарственного средства из выбранной формулы. Для этого существует несколько методов, но простая методология in vitro предоставляет полезные данные при разработке ранних рецептур(рисунок 3a). Изменение содержания полимеров в гидрогелях PNP путем модуляции количества HPMC-C12 или NPs является наиболее простым способом настройки механических свойств и размера ячеек этих гидрогелей, которые могут оказывать непосредственное влияние на диффузию груза через полимерную сеть и скорость высвобождения из материалов(рисунок 3b). Для груза, который больше, чем динамический размер ячеек (т. Е. Высокая молекулярная масса или большой гидродинамический радиус), исследователи должны ожидать медленного, опосредованного растворением высвобождения груза из гидрогелевого депо. Составы с динамическими размерами ячеек, превышающих или равными размеру груза, позволят осуществлять диффузионно-опосредованный выпуск, который может быть описан с использованием традиционных моделей диффузии и выпуска груза46,47,48,49. Основываясь на форме кривой высвобождения, исследователи могут переформулировать гидрогель, чтобы настроить его на более медленное (например, увеличение содержания полимера) или более быстрое (например, снижение содержания полимера) высвобождение.
Оценка устойчивости лечебного груза
Определение стабильности терапевтического груза в гидрогелевом составе имеет решающее значение до начала доклинических или клеточных исследований. По сравнению с другими синтетическими методами инкапсуляции лекарств, гидрогели PNP включают груз в щадящем виде путем смешивания с сыпучим материалом, и маловероятно, что инкапсуляция повредит груз. Эти исследования показывают, что гидрогели PNP могут также стабилизировать груз, подверженный тепловой нестабильности, такой как инсулин, значительно продлевая срок годности и уменьшая зависимость от холодного хранения и распределения(рисунок 4). Важно оценивать состояние груза сразу после инкапсуляции в гидрогель, а также после длительных периодов хранения. Эти данные показывают, что инсулин остается стабильным в гидрогелях после 28 дней хранения при непрерывном тепловом и механическом напряжении, используя простой флуоресцентный анализ для измерения агрегации инсулина. Альтернативным методом для случаев, когда соответствующий пластинчатый анализ недоступен, было бы выполнение круговых измерений дихроизма груза, что особенно полезно для определения вторичной структуры белковых препаратов.
Определение жизнеспособности и дисперсии клеток в гидрогелях PNP
Многие терапевтические клетки требуют адгезионных мотивов, чтобы оставаться жизнеспособными, и, таким образом, включение мотивов интегрина, таких как пептиды аргинин-глицин-аспарагиновой кислоты (RGD), является важным шагом в адаптации гидрогелей PNP для клеточной терапии50. Модульный полимер PEG-PLA, содержащий НП, позволяет химическую функционализацию короны ПЭГ с помощью простых «щелкающих» химикатов28,51. В этом примере клеточно-адгезивные пептиды RGD были присоединены к полимеру PEG-PLA для содействия взаимодействию клеток со структурой гидрогеля PNP. Составы, не имеющие адгезионных участков, будут иметь низкую жизнеспособность клеток, поскольку инкапсулированные клетки не могут пролиферировать по сравнению с клетками, инкапсулированными в составы с этими адгезионными мотивами(рисунок 5a,b). Инкапсулированные клетки могут быть помечены кальциеном AM или другим соответствующим флуоресцентным красителем (например, CFSE) для облегчения подсчета клеток с помощью флуоресцентного микроскопа. Во время оптимизации жизнеспособность следует сравнивать с немодифицированными гидрогелями PNP, чтобы гарантировать, что функционализированные интегрином составы обеспечивают повышенную жизнеспособность и распространение. Если интегрин-функционализированные составы обеспечивают такую же эффективность, как и немодифицированные гидрогели, это может указывать на сбой в химии конъюгации, используемой для включения мотивов адгезии.
Исследователи должны ожидать, что инкапсулированные клетки будут равномерно диспергированы через гидрогелевую среду при использовании соответствующего гидрогелевого состава. Это позволит обеспечить последовательное и предсказуемое дозирование клеток во время введения гидрогеля и должно привести к локальному удержанию клеток в гидрогеле после введения. Распределение клеток может быть легко определено с помощью методов флуоресцентной микроскопии. Клетки могут быть помечены соответствующим красителем, а затем визуализироваться с помощью конфокальной микроскопии. Изображения могут быть оценены визуально(рисунок 5c),а также количественно(рисунок 5d)с использованием программного обеспечения ImageJ для измерения средней интенсивности флуоресценции вдоль вертикальной оси изображения (или вдоль любой оси, которая, как ожидается, произойдет оседание клеток из-за гравитации). Если состав гидрогеля слишком слаб, чтобы поддерживать клетки в суспензии в течение длительных временных интервалов, произойдет оседание клеток, как это наблюдается в формуле 1:1 на рисунке 5. Увеличение содержания полимера может решить проблемы с неоднородной дисперсией клеток из-за оседания.
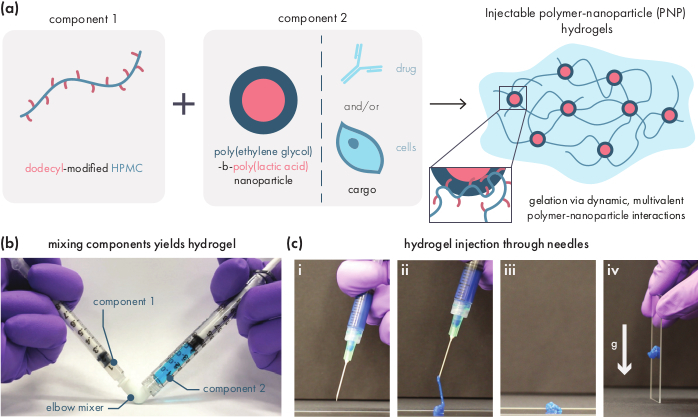
Рисунок 1:Полимерно-наночастицы (ПНП) гидрогели легко образуются путем смешивания двух компонентов. (а)Первый компонент представляет собой раствор додецил-модифицированной гидроксипропилметилцеллюлозы (HPMC-C12),а второй компонент представляет собой раствор наночастиц поли(этиленгликоль)-блок-поли(молочная кислота) (ПЭГ-PLA) вместе с любым терапевтическим грузом. Мягкое смешивание этих двух компонентов дает инъекционный гидрогель, где полимеры HPMC-C12 физически сшиваются динамическими, многовалентными взаимодействиями с наночастицами PEG-PLA. (b)Фотография, демонстрирующая состав геля путем смешивания с двумя шприцами, каждый из которых содержит один компонент гидрогеля PNP. Соединяя два шприца с коленным разъемом Luer-lock, два компонента можно легко смешивать в стерильных условиях, чтобы получить безпузырьковый гидрогель, предварительно загруженный в шприц для немедленного использования. Раствор NP окрашивается в синий цвет с целью демонстрации. с)Демонстрация инъекционных гидрогелей ПНП и их повторного затвердевания. i) гидрогель PNP в шприце с прикрепленной иглой 21G. (ii) Инъекция помещает гидрогель под сдвиг, который временно прерывает взаимодействие между полимером и наночастицами, создавая текучую консистенцию. iii) после инъекции динамические взаимодействия полимер-наночастицы быстро реформируется, позволяя гидрогелю самовосцеляться в твердое вещество. iv) твердый гидрогель не протекает под действием сил, более слабых, чем его предел текучести, таких, как сила тяжести. Гидрогель PNP окрашивается в синий цвет с целью демонстрации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
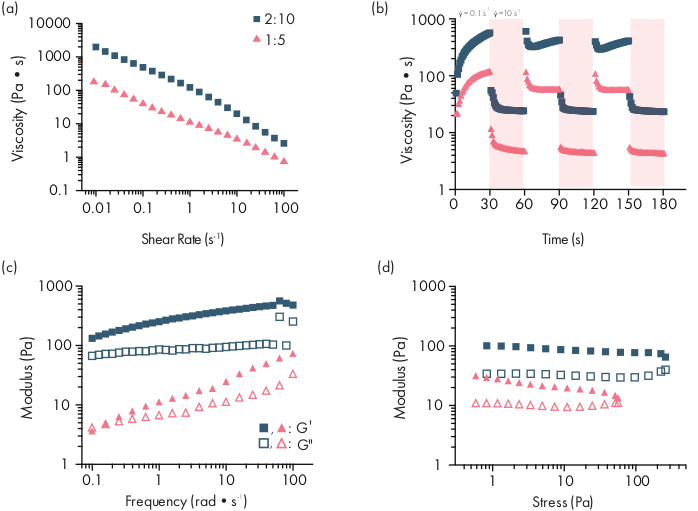
Рисунок 2:Реологическая характеристика двух составов гидрогеля PNP. Составы обозначаются как полимер мас.%: NP мас.%. а) Устойчивыйсдвигового потока при сдвиге гидрогелей PNP от низкой до высокой скорости сдвига. Вязкость как функция скорости сдвига характеризует свойства сдвиго-истончения. (b)Вязкость как функция колебательных скоростей сдвига между низкими скоростями сдвига (белый фон; 0,1 с−1)и высокими скоростями сдвига (красный фон; 10 с−1),демонстрируя самовосстанавливающиеся свойства гидрогелей PNP. Ставки сдвига налагаются на 30 с каждый. (c)Модуль упругости накопления G′и модуль вязкостных потерь G"в зависимости от частоты при постоянной деформации 1% для различных составов гидрогеля PNP. (d)Амплитуда развертывается с постоянной частотой 10 рад/с для характеристики модуля упругости накопления G′и модуля вязкостных потерь G"гидрогелей PNP в зависимости от напряжения. Эта реологическая характеристика может быть использована в качестве сравнения для контроля качества. Этот рисунок был адаптирован из Grosskopf et al.28Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
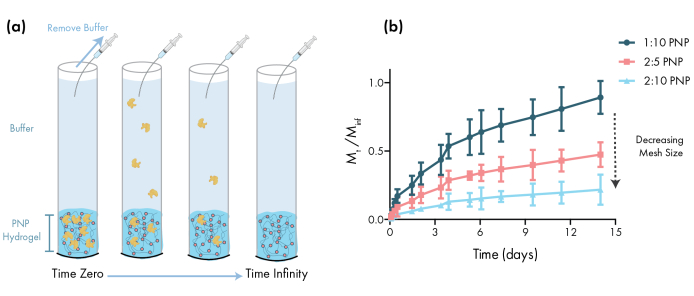
Рисунок 3:Высвобождение in vitro бытового сывороточного альбумина (BSA) из гидрогелей PNP. Составы обозначаются как полимер мас.%: NP мас.%. (a) Схема, описывающая экспериментальный протокол высвобождения in vitro. Аликвоты удаляются из капиллярных трубок, нагруженных гидрогелем PNP, с течением времени. b)высвобождение BSA in vitro из 1:10 PNP, 2:5 PNP и 2:10 PNP, сообщенное как масса, собранная к указанному временному моменту, деленная на общую массу, собранную в ходе анализа (данные, показанные как среднее ± SD; n = 3). BSA был обнаружен с помощью измерений поглощения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 4:Термическая стабильность инсулина, инкапсулированного в гидрогелях PNP методом анализа ThT. Составы обозначаются как полимер мас.%: NP мас.%. Инсулин, инкапсулированный в гидрогеле 1:5 и 2:10 PNP, оставался неагрегированным в течение более 28 дней при стрессовых условиях старения 37 ° C и постоянном перемешивании. Время до агрегации инсулина, сформулированного в PBS, составляло 20 ± 4 ч (среднее ± SD, порог агрегации 750 000 AFU). Данные представлены в виде среднего значения n = 4 экспериментальных реплик (AFU, произвольные флуоресцентные единицы). Этот рисунок был адаптирован из Meis et al.38Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
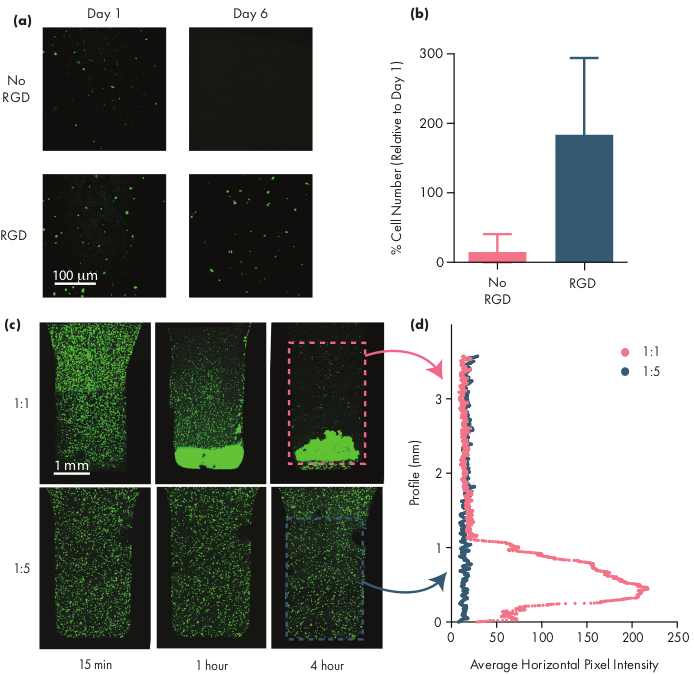
Рисунок 5:Жизнеспособность клеток и оседание клеток в гидрогелях PNP. (a,b) Исследования жизнеспособности клеток в гидрогелях PNP с мезенхимальными стволовыми клетками человека (hMSCs). (a) Репрезентативные изображения жизнеспособных hMSC в гидрогелях 1:5 PNP смотивомклеточного адгезивного аргинина-глицина-аспарагиновой кислоты (RGD) и без него, конъюгированного с NP PEG-PLA. hMSC окрашивали кальциеном в течение 30 мин до конфокальной визуализации. Шкала представляет собой 100 мкм.(b)Жизнеспособность клеток на 6-й день определяется как количество флуоресцентных клеток на изображении относительно количества флуоресцентных клеток на 1-й день (данные показаны как среднее ± SD; n = 3). (с,г) Эксперименты по инкапсуляции и оседлению клеток с помощью гМСК. c) изображения максимальной интенсивности гМСК, окрашенных кальцеином AM, инкапсулированных в гидрогеле PNP 1:1 (верхний ряд) и гидрогеле PNP 1:5 PNP (нижний ряд) в течение 4 часов для количественной оценки осаждения клеток. Шкала представляет собой 1 мм. (d) Средняя горизонтальная интенсивность пикселей hMSC вдоль вертикального профиля гидрогеля. Этот рисунок был адаптирован из Grosskopf et al.28Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Полимерно-наночастицы (ПНП) гидрогели легко изготавливаются и обеспечивают долгосрочную локальную доставку терапевтических клеток и лекарств посредством минимально инвазивного введения с помощью прямой инъекции или катетера. Эти протоколы описывают рецептуру гидрогелей PNP и методы характеристики для обеспечения качества полученных материалов. Супрамолекулярные гидрогели PNP масштабируемы для производства и образуются путем простого смешивания модифицированных целлюлозных полимеров и полимерных наночастиц ядра-оболочки. Настоящие методы описывают поверхностные процедуры по образованию гелей, предварительно загруженных в шприцы с помощью простых протоколов смешивания локтей. С помощью показателей контроля качества каждой из составных частей, таких как DLS для мониторинга размера и распределения NP, можно воспроизводимо сформулировать гидрогелевые материалы PNP с последовательными реологическими свойствами. Варьируя количество HPMC-C12 или NP, можно модулировать размер сетки и жесткость полученного гидрогеля PNP. Эти свойства могут быть настроены в соответствии с конкретным биомедицинским применением, и с помощью реологических методов, подробно описанных здесь, исследователи могут охарактеризовать свойства сдвиг-истончения и самовосстановления гидрогелей PNP, поскольку они оптимизируют платформу для их конкретных применений. Также описаны методы исследований высвобождения in vitro; Исследователи могут использовать эти исследования для характеристики относительной временной шкалы выпуска интересующих препаратов, информируя о будущих исследованиях in vivo. Используя исследования стабильности, исследователи также могут оценить способность этих материалов помочь сохранить биологическую структуру и стабильность чувствительных биотерапевтических средств во времени и экстремальных температурах, с убедительными потенциальными приложениями для снижения зависимости холодовой цепи от биотерапевтических средств. Наконец, с помощью простых анализов жизнеспособности клеток можно оценить рост и миграцию клеток в материалах PNP с потенциальным применением в клеточной терапии и каркасах.
Наша группа нашла много убедительных применений для платформы PNP hydrogel27. Гидрогели PNP использовались для медленной доставки субъединитных вакцин, что позволяет сопоставлять кинетические профили высвобождения антигенов и адъювантов для повышения величины, продолжительности и качества гуморального иммунного ответа31. Было обнаружено, что гидрогели PNP имеют меньший размер ячеек, чем наиболее часто используемые гидрогели, поэтому они эффективны при замедлении диффузии и медленном высвобождении молекулярного груза. Уникальные свойства адгезии тканей и механические свойства гидрогелей PNP также использовались для формирования физических барьеров для предотвращения спаек, возникающих в результате операции, путем распыления гидрогелей на большие площади поверхности органов после операции30. Было также показано, что гидрогели PNP являются эффективными средствами доставки клеток, а механические свойства фактически защищают клетки от механических сил, возникающих в игле шприца во время инъекции, улучшая жизнеспособность клеток29. Когда NP конъюгируются с клеточно-адгезивным пептидом, клетки могут присоединяться и взаимодействовать с матрицей PNP, чтобы оставаться жизнеспособными. Было показано, что используя этот подход, гидрогели PNP улучшают местное удержание введенных стволовых клеток по сравнению со методами с использованием жидких транспортных средств28. Кроме того, было показано, что гидрогели PNP предотвращают термически индуцированную агрегацию инкапсулированного инсулина даже в суровых стрессовых условиях старения, предполагая, что эти материалы могут быть в состоянии уменьшить необходимость охлаждения чувствительных к температуре лекарств38.
В целом, методологии, описанные здесь, позволят исследовательским группам изготавливать и исследовать гидрогели PNP в качестве биоматериала. Эти протоколы обеспечивают лабораторные методы синтеза для изготовления достаточного количества гидрогелевого материала для проведения исследований как in vitro, так и in vivo. Исследования, описанные выше, показывают, что динамические сшивки этих материалов позволяют ему быть пригодным для целого ряда биомедицинских применений, обеспечивая активную подвижность захваченных клеток при одновременном ограничении пассивной диффузии молекулярного груза. Ожидается, что исследователи найдут платформу PNP доступным и мощным инструментом для улучшения клинических результатов за счет контролируемой доставки лекарств и изучения основных биологических механизмов, таких как рекрутмент клеток и механобиология.
Раскрытие информации
Этим авторам нечего раскрывать.
Благодарности
Это исследование было финансово поддержано Центром иммунологии систем человека с Фондом Билла и Мелинды Гейтс (OPP1113682) и Фондом Билла и Мелинды Гейтс (OPP1211043). C.M.M. был поддержан Стэнфордской стипендией для выпускников и Стэнфордской стипендией Уильяма и Линды Стир. A.K.G. благодарен за стипендию Национального научного фонда для аспирантов и стипендию Габилана Стэнфордской аспирантуры в области науки и техники. S.C. был поддержан Национальным институтом рака Национальных институтов здравоохранения под номером F32CA247352. Авторы также хотели бы тепло поблагодарить членов Appel Lab, включая д-ра Джилли Рота, д-ра Энтони Ю, д-ра Линдси Стэплтон, д-ра Гектора Лопеса Эрнандеса, д-ра Андреа д'Акино, д-ра Джули Байе, Селин Лионг, Бена Оу, Эмили Мини, Эмили Гейл и д-ра Антона Смита за их усилия и время в оказании помощи Лаборатории Аппеля в разработке этих протоколов на протяжении многих лет.
Материалы
| Name | Company | Catalog Number | Comments |
| 21G needles | BD | 305165 | PNP hydrogel injection |
| 22G, 4 in hypodermic needles | Air-Tite | N224 | In vitro release studies |
| 384-well plates, black, clear bottom | Corning | 3540 | Dynamic light scattering (DLS) |
| 96-well plates, black | Fisher Scientific | 07-200-627 | Biostability studies |
| 96-well plates, clear | Corning | 3599 | Cell viability and settling studies |
| Calcein AM | Thermo Fisher Scientific | C3100MP | Cell viability and settling studies |
| Capillary tubes | McMaster-Carr | 8729K66 | In vitro release studies |
| Centrifugal filter units | Fisher Scientific | UFC901024 | NP concentration |
| Cuvettes | Millipore Sigma | BR759015-100EA | Cell viability and settling studies |
| DLS Plate Reader | Wyatt Technology | DynaPro II Plate Reader | Dynamic light scattering (DLS) |
| Epoxy | VWR International | 300007-392 (EA) | In vitro release studies |
| Hypodermic needles | Air-Tite | 8300015027 | In vitro release studies |
| Luer elbow connector | Cole-Parmer | EW-30800-12 | PNP hydrogel formulation |
| Luer lock syringe | Fisher Scientific | 14-955-456 | PNP hydrogel formulation |
| Phosphate Buffered Saline (1x) | Fisher Scientific | 10010049 | PNP hydrogel formulation |
| Plastic Spatula | Thomas Scientific | 1229F13 | Rheological characterization |
| Plate Reader | BioTek | Synergy H1 Hybrid Multi-Mode Plate Reader | Biostability studies |
| Plate seals | Excel Scientific | TS-RT2-100 | Biostability studies |
| Recombinant human insulin | Gibco | A11382II | Biostability studies |
| Rheometer | TA Instruments | DHR-2 Rheometer | Rheological characterization |
| Thioflavin T | Sigma-Aldrich | T3516-5G | Biostability studies |
Ссылки
- Mandal, A., Clegg, J. R., Anselmo, A. C., Mitragotri, S. Hydrogels in the clinic. Bioengineering Translational Medicine. 5 (2), 10158 (2020).
- Appel, E. A., del Barrio, J., Loh, X. J., Scherman, O. A. Supramolecular polymeric hydrogels. Chemical Society Reviews. 41 (18), 6195-6214 (2012).
- Mann, J. L., Yu, A. C., Agmon, G., Appel, E. A. Supramolecular polymeric biomaterials. Biomaterials Science. 6 (1), 10-37 (2018).
- Foster, A. A., Marquardt, L. M., Heilshorn, S. C. The diverse roles of hydrogel mechanics in injectable stem cell transplantation. Current Opinion in Chemical Engineering. 15, 15-23 (2017).
- Aguado, B. A., Mulyasasmita, W., Su, J., Lampe, K. J., Heilshorn, S. C. Improving viability of stem cells during syringe needle flow through the design of hydrogel cell carriers. Tissue Engineering Part A. 18 (7-8), 806-815 (2012).
- Marquardt, L. M., Heilshorn, S. C. Design of injectable materials to improve stem cell transplantation. Current Stem Cell Reports. 2 (3), 207-220 (2016).
- Guvendiren, M., Burdick, J. A. Engineering synthetic hydrogel microenvironments to instruct stem cells. Current Opinion in Biotechnology. 24 (5), 841-846 (2013).
- Marquardt, L. M., et al. Designer, injectable gels to prevent transplanted Schwann cell loss during spinal cord injury therapy. Science Advances. 6 (14), 1039 (2020).
- Stephan, S. B., et al. Biopolymer implants enhance the efficacy of adoptive T-cell therapy. Nature Biotechnology. 33 (1), 97-101 (2015).
- Tuladhar, A., et al. Injectable hydrogel enables local and sustained co-delivery to the brain: two clinically approved biomolecules, cyclosporine and erythropoietin, accelerate functional recovery in rat model of stroke. Biomaterials. 235, 119794 (2020).
- Pakulska, M. M., Miersch, S., Shoichet, M. S. Designer protein delivery: From natural to engineered affinity-controlled release systems. Science. 351 (6279), (2016).
- Gupta, D., Tator, C. H., Shoichet, M. S. Fast-gelling injectable blend of hyaluronan and methylcellulose for intrathecal, localized delivery to the injured spinal cord. Biomaterials. 27 (11), 2370-2379 (2006).
- Verbeke, C. S., Mooney, D. J. Injectable, pore-forming hydrogels for in vivo enrichment of immature dendritic cells. Advanced Healthcare Materials. 4 (17), 2677-2687 (2015).
- Tous, E., Purcell, B., Ifkovits, J. L., Burdick, J. A. Injectable acellular hydrogels for cardiac repair. Journal of Cardiovascular Translational Research. 4 (5), 528-542 (2011).
- Zhao, X., et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing. Biomaterials. 122, 34-47 (2017).
- Johnson, T. D., Christman, K. L. Injectable hydrogel therapies and their delivery strategies for treating myocardial infarction. Expert Opinion on Drug Delivery. 10 (1), 59-72 (2013).
- Kleinman, H. K., Martin, G. R. . Seminars in Cancer Biology. , 378-386 (2005).
- Hickey, J. W., et al. Engineering an artificial T-cell stimulating matrix for immunotherapy. Advanced Materials. 31 (23), 1807359 (2019).
- Baumann, M. D., et al. An injectable drug delivery platform for sustained combination therapy. Journal of Controlled Release. 138 (3), 205-213 (2009).
- Trappmann, B., et al. Matrix degradability controls multicellularity of 3D cell migration. Nature Communications. 8 (1), 1-8 (2017).
- Figueiredo, L., et al. Assessing glucose and oxygen diffusion in hydrogels for the rational design of 3D stem cell scaffolds in regenerative medicine. Journal of Tissue Engineering and Regenerative Medicine. 12 (5), 1238-1246 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. , 1-24 (2019).
- Chaudhuri, O., et al. Substrate stress relaxation regulates cell spreading. Nature Communications. 6 (1), 1-7 (2015).
- Cai, L., Dewi, R. E., Heilshorn, S. C. Injectable hydrogels with in situ double network formation enhance retention of transplanted stem cells. Advanced Functional Materials. 25 (9), 1344-1351 (2015).
- Fisher, S. A., Baker, A. E., Shoichet, M. S. Designing peptide and protein modified hydrogels: selecting the optimal conjugation strategy. Journal of the American Chemical Society. 139 (22), 7416-7427 (2017).
- Li, R. H., Altreuter, D. H., Gentile, F. T. Transport characterization of hydrogel matrices for cell encapsulation. Biotechnology and Bioengineering. 50 (4), 365-373 (1996).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6 (6295), (2015).
- Grosskopf, A. K., et al. Injectable supramolecular polymer-nanoparticle hydrogels enhance human mesenchymal stem cell delivery. Bioengineering and Translational Medicine. 5 (1), 10147 (2020).
- Lopez Hernandez, H., Grosskopf, A. K., Stapleton, L. M., Agmon, G., Appel, E. A. Non-newtonian polymer-nanoparticle hydrogels enhance cell viability during injection. Macromolecular Bioscience. 19 (1), (2019).
- Stapleton, L. M., et al. Use of a supramolecular polymeric hydrogel as an effective post-operative pericardial adhesion barrier. Nature Biomedical Engineering. 3 (8), 611-620 (2019).
- Roth, G. A., et al. Injectable hydrogels for sustained codelivery of subunit vaccines enhance humoral immunity. ACS Central Science. , (2020).
- Steele, A. N., et al. A biocompatible therapeutic catheter-deliverable hydrogel for in situ tissue engineering. Advanced Healthcare Materials. 8 (5), 1801147 (2019).
- Fenton, O. S., et al. Injectable polymer-nanoparticle hydrogels for local immune cell recruitment. Biomacromolecules. 20 (12), 4430-4436 (2019).
- Yu, A. C., Smith, A. A., Appel, E. A. Structural considerations for physical hydrogels based on polymer-nanoparticle interactions. Molecular Systems Design & Engineering. 5 (1), 401-407 (2020).
- Wisdom, K., Chaudhuri, O., Koledova, Z. . 3D Cell Culture: Methods and Protocols. , 29-37 (2017).
- Lohmeijer, B. G., et al. Guanidine and amidine organocatalysts for ring-opening polymerization of cyclic esters. Macromolecules. 39 (25), 8574-8583 (2006).
- Cheng, J., et al. Formulation of functionalized PLGA-PEG nanoparticles for in vivo targeted drug delivery. Biomaterials. 28 (5), 869-876 (2007).
- Meis, C. M., et al. Self-assembled, dilution-responsive hydrogels for enhanced thermal stability of insulin biopharmaceuticals. ACS Biomaterials Science & Engineering. , (2020).
- Franck, A., Germany, T. Viscoelasticity and dynamic mechanical testing. TA Instruments. , (1993).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6, 6295 (2015).
- Gallastegui, A., et al. Controlled release of antibiotics from photopolymerized hydrogels: kinetics and microbiological studies. Materials Science and Engineering: C. 102, 896-905 (2019).
- Qiao, M., Chen, D., Ma, X., Liu, Y. Injectable biodegradable temperature-responsive PLGA-PEG-PLGA copolymers: synthesis and effect of copolymer composition on the drug release from the copolymer-based hydrogels. International Journal of Pharmaceutics. 294 (1-2), 103-112 (2005).
- Schlein, M. Insulin Formulation Characterization-The Thioflavin T Assays. The AAPS Journal. 19 (2), 397-408 (2017).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Sakas, G., Grimm, M., Savopoulos, A. . EUROGRAPHICS workshop on Rendering Techniques. , 51-63 (1995).
- Axpe, E., et al. A multiscale model for solute diffusion in hydrogels. Macromolecules. 52 (18), 6889-6897 (2019).
- Peppas, N., Bures, P., Leobandung, W., Ichikawa, H. Hydrogels in pharmaceutical formulations. European Journal of Pharmaceutics and Biopharmaceutics. 50 (1), 27-46 (2000).
- Ritger, P. L., Peppas, N. A. A simple equation for description of solute release I. Fickian and non-fickian release from non-swellable devices in the form of slabs, spheres, cylinders or discs. Journal of Controlled Release. 5 (1), 23-36 (1987).
- Reinhart, C. T., Peppas, N. A. Solute diffusion in swollen membranes. Part II. Influence of crosslinking on diffusive properties. Journal of Membrane Science. 18, 227-239 (1984).
- Salinas, C. N., Anseth, K. S. The influence of the RGD peptide motif and its contextual presentation in PEG gels on human mesenchymal stem cell viability. Journal of Tissue Engineering and Regenerative. 2 (5), 296-304 (2008).
- Smith, A. A., et al. Nanoparticles presenting potent TLR7/8 agonists enhance anti-PD-L1 immunotherapy in cancer treatment. Biomacromolecules. 21 (9), 3704-3712 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены