Method Article
Hidrogéis de polímero supramolecular injetável para aplicações de entrega de células e medicamentos
Neste Artigo
Resumo
Este protocolo descreve a síntese e formulação de biomateriais hidrogéis de polímero supramolecular injetável (PNP). As aplicações desses materiais para entrega de medicamentos, estabilização biofarmacêutica e encapsulamento e entrega celular são demonstradas.
Resumo
Estes métodos descrevem como formular hidrogéis de polímero-nanopartícula supramolecular injetável (PNP) para uso como biomateriais. Os hidrogéis PNP são compostos por dois componentes: celulose hidrofobicamente modificada como polímero de rede e nanopartículas de concha-núcleo auto-montadas que atuam como elos transversais não covalentes através de interações dinâmicas e multivalentes. Estes métodos descrevem tanto a formação dessas nanopartículas auto-montadas através da nanoprecipitação, bem como a formulação e mistura dos dois componentes para formar hidrogéis com propriedades mecânicas tunable. O uso de dispersão dinâmica de luz (DLS) e reologia para caracterizar a qualidade dos materiais sintetizados também é detalhado. Finalmente, a utilidade desses hidrogéis para entrega de medicamentos, estabilização biofarmacêutica e encapsulamento e entrega celular é demonstrada através de experimentos in vitro para caracterizar a liberação de drogas, estabilidade térmica e fixação celular e viabilidade. Devido à sua biocompatibilidade, injebilidade e condições leves de formação de gel, este sistema de hidrogel é uma plataforma prontamente incapaz adequada para uma série de aplicações biomédicas.
Introdução
Hidrogéis injetáveis são uma ferramenta emergente para fornecer células terapêuticas e drogas ao corpo de forma controlada1. Esses materiais podem ser carregados com drogas ou células e podem ser administrados de forma minimamente invasiva através de injeção direta a tecidos superficiais ou por entrega de cateteres a tecidos profundos. Em geral, os hidrogéis injetáveis são compostos por redes de polímeros inchados pela água que são interligadas por interações físicas transitórias. Em repouso, esses crosslinks fornecem uma estrutura sólida para os géis, mas após a aplicação de força mecânica suficiente esses crosslinks são temporariamente interrompidos, transformando o material em um estado líquido que pode facilmente fluir2. São essas propriedades reológicas que permitem que os hidrogéis físicos sefinam e fluam através de pequenos diâmetros de agulha durante a injeção3. Após a injeção, a rede de polímeros das reformas materiais, permitindo que se auto-cure e forme rapidamente um gel sólido em situ4,5. Essas estruturas podem atuar como depósitos de liberação lenta para drogas ou andaimes para regeneração tecidual6,7. Esses materiais têm sido utilizados em diversas aplicações que englobam a tecnologia de entrega de medicamentos, medicina regenerativa e imunoengenharia1,8,9,10,11,12.
Tanto materiais naturais (por exemplo, alginato e colágeno) quanto materiais sintéticos (por exemplo, poli (etileno glicol) (PEG) ou polímeros hidrofílicos similares) foram desenvolvidos como materiais hidrogel injetáveis biocompatíveis13,14,15. Muitos materiais naturais apresentam variação em lote afetando a reprodutibilidade4,16. Esses materiais são frequentemente sensíveis à temperatura, curando-se ao atingir temperaturas fisiológicas; assim, o manuseio desses materiais coloca desafios técnicos e logísticos adicionais17. Materiais sintéticos permitem um controle químico mais preciso e excelente reprodutibilidade, mas esses materiais às vezes podem estar sujeitos a respostas imunes adversas que limitam sua biocompatibilidade, característica crítica para aplicações terapêuticas in vivo6,18,19. Esforços recentes têm mostrado que existem muitos critérios complexos de projeto envolvidos na engenharia de um material hidrogel injetável, incluindo a otimização de propriedades mecânicas, tamanho da malha de rede de polímeros, pistas moleculares bioativas, biodegradabilidade e imunogenicidade do material20,21,22,23,24,25,26. Todos esses fatores devem ser considerados dependendo da aplicação de juros, o que significa que uma plataforma modular, quimicamente incapaz, é ideal para satisfazer uma ampla amplitude de aplicações.
Os métodos atuais descrevem a formulação e o uso de uma plataforma de hidrogéis polímero-nanopartícula injetável (PNP) que exibe propriedades mecânicas tíclicas, alto grau de biocompatibilidade e baixa imunogenicidade, e apresenta locais para conjugar sinais moleculares bioativos27,28,29,30,31,32,33. Estes hidrogéis PNP são compostos de polímeros de celulose hidrofobicamente modificados e nanopartículas de concha-núcleo auto-montadas que compreendem poli (etileno glicol)-bloco-poli (ácido láctico) (PEG-PLA)27,34 que interagem para produzir uma rede supramolecular. Mais especificamente, os polímeros de celulose hidroxipropiletila modificada dodecil (HPMC-C12) interagem dinamicamente com a superfície das nanopartículas PEG-PLA e fazem a ponte entre essas nanopartículas para formar esta rede de polímeros27,34. Essas interações dinâmicas e multivalentes permitem que os materiais se afinem durante a injeção e se auto-curem rapidamente após a administração. Os componentes do hidrogel PNP são facilmente fabricados através de reações simples de um pote e o hidrogel PNP é formado em condições leves por simples mistura dos dois componentes35. Devido à facilidade de fabricação, esta plataforma de hidrogel é altamente traduzível em escala. As propriedades mecânicas e o tamanho da malha dos hidrogéis PNP são controlados alterando a porcentagem de peso dos componentes de polímero e nanopartículas na formulação. Estudos anteriores com esta plataforma indicam que os hidrogéis PNP são altamente biocompatíveis, biodegradáveis e nãoimunogênicos 28,30,31. No geral, esses hidrogéis apresentam ampla utilidade em aplicações biomédicas que abrangem prevenção de adesão pós-operatória, engenharia e regeneração de tecidos, entrega sustentada de medicamentos e imunoengenharia.
Protocolo
Antes de iniciar este protocolo, é necessário sintetizar o HPMC-C12 e o PEG-PLA utilizando os métodos publicados anteriormente27,28,29,30,31,36,37,38.
1. Síntese de nanopartículas (PN) por nanoprecipitação
NOTA: Esta seção descreve a síntese de um único lote de NPs, produzindo 250 μL de 20 wt% NPs em solução tampão (50 mg de polímero PEG-PLA seco por lote). Notas para aumentar o número de lotes são fornecidas em etapas relevantes.
- Meça 50 mg de polímero PEG-PLA em um frasco de cintilação de vidro de 8 mL e adicione 1 mL de acetonitrilo. Vórtice para dissolver completamente.
NOTA: Para aumentar o número de lotes, dimensione linearmente esta etapa e adicione a quantidade total de polímero e solvente necessários em um único frasco. - Adicione 10 mL de água ultrauso em um frasco de cintilação de vidro de 20 mL com uma pequena barra de agitação. Coloque uma placa de agitação a 600 rpm.
NOTA: Se a etapa 1.1 tiver sido dimensionada, ainda é necessário ter um frasco de cintilação individual para precipitar-se em cada lote equivalente. Por exemplo, para 200 mg de polímero dissolvido em 4 mL de acetonitrilo, prepare frascos de cintilação de 4 x 20 mL. - Para formar NPs por nanoprecipitação, adicione 1 mL de solução de solvente de polímero em gota na água usando uma pipeta de 200 μL. Mexa por 2 min. O bloco PLA do PEG-PLA não é solúvel em água e, como resultado, os NPs de concha-núcleo se auto-montarão com os blocos PLA hidrofóbicos como o núcleo e os blocos de PEG hidrofílicos como a casca.
- Verifique o tamanho das partículas por dispersão dinâmica de luz (DLS).
NOTA: Este procedimento é escrito especificamente para um leitor de placas comercialmente disponível com o pacote de software associado (ver Tabela de Materiais). Para a utilização de instrumentos alternativos, consulte os métodos de preparação da amostra descritos pelo fabricante do instrumento.- Diluir 20 μL de solução NP com 80 μL de água ultrapura (concentração de análise: 1 mg/mL PEG-PLA NPs). Adicione 30 μL por poço a uma placa preta de 384 poços (analisar em triplicado).
- Meça o raio hidrodinâmico e a polidispersidade de cada amostra com um leitor de placaS DLS usando opções de protocolo predefinidos no pacote de software. Como exemplo de um protocolo típico, defina os parâmetros de coleta de dados para adquirir medições de 5-10 DLS de 2-5 s de duração por aquisição e, em seguida, relatar um tamanho médio de partículas e distribuição por poço, calculado a partir do modelo de proteínas globulares. Para formar hidrogéis com propriedades reológicas consistentes, as partículas resultantes devem ser de 30-50 nm de diâmetro hidrodinâmico com uma polidispersidade (DP) < 0,2.
NOTA: Se os NPs forem menores do que o desejado, utilize uma solução de acetonitrilo de 75% / 25% de sulfóxido de dimetil (DMSO) na etapa 1.1. Aumentar a porcentagem de DMSO na solução de solvente geralmente aumentará o tamanho das partículas.
- Transfira a solução NP do frasco de cintilação de 20 mL para uma unidade de filtro centrífugo. Centrifugar a 4500 x g por 1 h para concentrar a solução NP para <250 μL.
- Resuspend no tampão desejado, como salina tamponada com fosfato (PBS), a 20 wt% NPs. Pipeta o conteúdo da unidade de filtro centrífugas em um tubo de microcentrifuge tared ou frasco de cintilação de vidro em um equilíbrio de massa. Use uma pequena quantidade (50-100 μL) de tampão para enxaguar o filtro e garantir a coleta de todos os NPs. Adicione o buffer para atingir uma massa total de 250 mgs.
NOTA: Os lotes podem ser agrupados durante a ressuspensão. As soluções de estoque NP podem ser armazenadas a 4 °C por aproximadamente 1 mês. Não congele. Para maior armazenamento, verifique o tamanho e a polidispersidade por DLS antes de usar.
2. Formulação de hidrogel e encapsulamento de drogas ou células
NOTA: Esta seção descreve a preparação de 1 mL de formulação de hidrogel PNP de 2:10, com 2:10 denotando 2 wt% HPMC-C12 e 10 wt% NPs (polímero sólido total de 12 wt%) e solução tampão 88 wt%, solução de carga de drogas ou suspensão celular. Os percentuais de formulação podem ser variados para produzir hidrogéis com uma gama de propriedades mecânicas. Por exemplo, foram utilizados hidrogéis PNP 1:5 para os resultados experimentais de assentamento e viabilidade das células mostrados.
- Prepare a solução de estoque de 6 wt% HPMC-C12 em PBS (ou outro buffer de escolha). Dissolva-se por 48h para garantir que o polímero esteja totalmente disperso.
NOTA: A solução de estoque HPMC-C12 está estável por meses à temperatura ambiente. No entanto, recomenda-se o armazenamento a 4 °C para inibir o crescimento microbiano. - Adicione 333 mg de solução de estoque HPMC-C12 de 6 wt% em uma seringa de bloqueio Luer de 1 mL.
- Adicione 500 μL de solução de estoque de 20 wt% NP a um tubo de microcentrifuuge. Adicione 167 μL de PBS e pipeta para misturar. Usando uma agulha, encha outra seringa de bloqueio Luer de 1 mL com a solução NP diluída.
NOTA: Para carregar a carga de droga, calcule a concentração final desejada da droga no hidrogel e carregue a quantidade apropriada nos 167 μL de PBS que é misturado com os NPs. Se uma sonda molecular for necessária para um ensaio in situ, como para monitorar a estabilidade da droga, carregue a sonda de forma semelhante à descrita acima para carregar carga de drogas. Para carregar células, calcule a concentração celular final desejada no hidrogel e carregue o número apropriado de células para o 167 μL de PBS que é misturado com os NPs. - Misture os dois componentes de hidrogel (HPMC-C12 e NPs) usando um método de mistura de cotovelo35.
- Conecte o conector do cotovelo Luer à seringa contendo solução NP (opcionalmente também contendo carga de drogas ou células). Empurre a solução NP através do cotovelo até que o menisco seja visível na extremidade aberta. Puxe ligeiramente para trás e conecte a seringa contendo a solução HPMC-C12.
NOTA: É importante minimizar o ar na conexão do cotovelo para evitar a formação e dispersão de bolhas em todo o hidrogel durante o processo de mistura. Ao misturar células com a batedeira de cotovelo, tome cuidado para misturar mais suavemente, pois a mistura muito rapidamente pode sujeitar as células a altas forças de corte, levando à morte celular. - Bombeie as duas soluções para frente e para trás através da batedeira de cotovelo por aproximadamente 60 ciclos até que um material hidrogel branco homogêneo e opaco tenha se formado.
- Empurre todo o volume de hidrogel em uma seringa. Remova a seringa vazia e desenhe o êmbolo de volta na seringa carregada em gel para recuperar o material do conector do cotovelo. Tampa com uma agulha ou plugue.
NOTA: É necessário contabilizar ~300 μL de volume de hidrogel perdido devido ao espaço morto no processo de mistura. Por exemplo, se 700 μL de volume final de hidrogel for desejado, 1 mL de hidrogel deve ser preparado. O processo de formulação de hidrogel pode ser ampliado usando seringas maiores. No entanto, para formulações rígidas de hidrogel, como 2:10, pode tornar-se difícil misturar e injetar de seringas maiores que 3 mL em volume devido à crescente proporção de barril de seringa ao diâmetro do cotovelo ou agulha. - Armazene o hidrogel na seringa à temperatura ambiente. No entanto, se as drogas forem encapsuladas, o armazenamento a 4 °C é recomendado a menos que o fabricante da droga especicula o contrário. Não congele o material.
- Conecte o conector do cotovelo Luer à seringa contendo solução NP (opcionalmente também contendo carga de drogas ou células). Empurre a solução NP através do cotovelo até que o menisco seja visível na extremidade aberta. Puxe ligeiramente para trás e conecte a seringa contendo a solução HPMC-C12.
3. Medição de propriedades reológicas de formulações de hidrogel
NOTA: Este protocolo é especificamente utilizado com o reômetro comercial mencionado na Tabela de Materiais com uma geometria de placa serrilhada de 20 mm. Para o uso de outros instrumentos, consulte as instruções do fabricante para a preparação da amostra.
- Formular pelo menos 700 μL de hidrogel PNP para caracterização reológica.
- Injete material no centro da placa de reômetro serrilhada. O valor variará dependendo da lacuna de geometria escolhida. Para referência, uma lacuna de 700 μm requer ~400-500 μL de material.
- Abaixe o reômetro para a abertura do corte (500-1000 μm) e gire lentamente a placa de reômetro superior à medida que faz contato com o hidrogel PNP para garantir que a lacuna seja preenchida uniforme e completamente.
- Inspecione o carregamento do hidrogel PNP de tal forma que cubra toda a superfície da placa de reômetro. Use uma espátula ou aparador plástico para aparar suavemente e remover qualquer excesso de material, de tal forma que tenha uma leve protuberância fora da placa.
- Abaixe o reômetro para a lacuna de geometria final e verifique se a amostra está bem carregada.
- Meça as propriedades mecânicas da amostra utilizando testes oscilatórios, como amplitude ou varreduras de frequência, ou testes de fluxo, como varreduras de fluxo ou testes de etapas.
NOTA: Nos dados representativos apresentados, os testes de amplitude oscilatória são executados em uma frequência constante de 10 rad/s. As varreduras de frequência oscilatória são executadas a uma tensão constante de 1%, dentro do regime viscoelástico linear da varredura de amplitude. As varreduras de fluxo foram executadas de altas taxas de cisalhamento para baixas taxas de cisalhamento39. Todos os testes são concluídos com 10 pontos por década de dados coletados e em temperatura ambiente. Os parâmetros de teste podem precisar ser ajustados dependendo das propriedades da formulação. Submeter materiais PNP mais rígidos, como formulações de 2:10 a altas taxas de corte, pode fazer com que o material seja ejetado das placas de reômetro, resultando em caracterização mecânica imprecisa e exigindo recarga da amostra entre testes subsequentes. Os dados representativos mostrados abaixo podem ser usados para comparação durante os testes de controle de qualidade.
4. Caracterizando a liberação de drogas in vitro
- Prepare tubos capilares cortando tubos capilares de vidro ao comprimento desejado. Sele uma extremidade de cada tubo usando uma espátula descartável ou ponta de pipeta para empurrar uma pequena quantidade de epóxi na extremidade do tubo para formar um plugue. Permita que o epóxi defina o tempo recomendado pelo fabricante.
NOTA: O tubo deve ser mais curto do que o comprimento da agulha de injeção. Recomenda-se tubos com diâmetro interno de 2-3 μm, de tal forma que um comprimento de 2,5 polegadas contenha pelo menos 300 μL de volume total. - Forme pelo menos 500 μL de um material de hidrogel PNP em uma seringa contendo a droga de interesse. Prepare cada grupo de amostra em uma seringa separada.
- Injete 100-200 μL do hidrogel PNP na parte inferior de cada tubo capilar usando uma agulha hipodérmica longa (22G, 4 polegadas). Prepare pelo menos três tubos (triplicado) por grupo amostral.
- (Opcional) Coloque tubos capilares preenchidos em um tubo cônico de centrífuga e centrífuga por 1 min a 1000 x g para garantir que a superfície do hidrogel seja uniforme. Esta etapa pode precisar ser repetida, alterando o tempo e a velocidade conforme necessário para suavizar a superfície do material.
ATENÇÃO: Certifique-se de que a centrífuga está bem equilibrada. - Encha cuidadosamente 200-300 μL de PBS em cima do hidrogel no tubo capilar usando uma seringa e agulha ou pipeta. Não entre em contato ou perturbe a superfície do hidrogel. Sele o tubo com uma tampa ou plug ou tampa com pelo menos duas camadas de filme de parafina.
- (Opcional) Incubar amostras a 37 °C para simular condições in vivo.
- Remova cuidadosamente o PBS de cada capilar, sem perturbar a superfície do hidrogel, usando uma seringa e agulha nos pontos de tempo escolhidos, dependendo da escala de tempo prevista para a liberação da droga. Substitua o volume removido por PBS fresco. Armazene alíquotas em condições apropriadas.
NOTA: Os volumes e pontos de tempo recomendados nas etapas 4.3, 4.5 e 4.7 podem ser otimizados para capturar a liberação de drogas in vitro em uma série de escalas de tempo, dependendo da quantidade de droga carregada no material e da rapidez com que ela se libera no supernante. Uma amostra de pontos de tempo selecionados pode ser de 6h, 1 dia, 3 dias, 1 semana e 2 semanas para uma droga de liberação lenta. As alíquotas também podem ser analisadas à medida que são adquiridas em vez de armazenadas. - Na conclusão do estudo, analise alíquotas com método adequado como ELISA, HPLC ou ensaio de fluorescência para quantificar a quantidade de droga liberada em cada ponto de tempo40,41,42. O método de detecção apropriado variará dependendo da droga de interesse.
NOTA: Estudos de liberação in vitro são úteis para comparar a liberação entre diferentes formulações de hidrogel ou carga de medicamentos. A escala de tempo de lançamento in vitro muitas vezes não indica diretamente uma escala de tempo esperada de lançamento in vivo.
5. Caracterizando a estabilidade térmica da insulina encapsulada em gel
- Formular pelo menos 1,2 mL de hidrogel PNP por grupo amostral. Seguindo o procedimento descrito na seção 2.3, carregue insulina (carga de drogas) e thioflavvin T (ThT) (sonda molecular) no hidrogel PNP.
NOTA: O principal mecanismo de agregação e, portanto, a inativação da insulina é através da formação de fibrilas amiloides. ThT é uma sonda molecular adequada porque produz um forte sinal de fluorescência na presença de fibrilas amiloides, permitindo o monitoramento in situ da agregação de insulina. Dependendo da carga de drogas de interesse, a agregação pode ser monitorada através de diferentes métodos. Para os dados representativos apresentados, a insulina foi carregada para uma concentração final de 6,7 ou 10 mg/mL e ThT para uma concentração final de 25 μM. - Usando uma agulha de 21 G, injete 200 μL de hidrogel PNP por poço em uma placa preta de 96 poços. Cada grupo amostral deve ser medido em pelo menos triplicado. Placa de vedação com uma vedação de placa adesiva opticamente clara para evitar a evaporação.
- Insira placa em um leitor de placas equipado com controle de temperatura, agitação e programação de leitura cinética e comece a ler o protocolo. Os dados representativos foram adquiridos com um leitor de placas comercialmente disponível (ver Tabela de Materiais) utilizando as seguintes condições:
- Condições de envelhecimento estressadas: tremor linear contínuo (410 cpm, 5 mm) a 37 °C.
- Aquisição de dados: excitação/emissão 450 nm/482 nm em intervalos de 20 min
NOTA: Se um leitor de placas com capacidade de controle de temperatura, shaker e leitura cinética não estiver disponível, a placa pode ser colocada em uma placa de agitador em uma incubadora e lida manualmente em comprimentos de onda acima em pontos de tempo selecionados.
- Plotar dados como sinal de fluorescência média ao longo do tempo para cada grupo. O tempo de agregação pode ser quantificado definindo um limiar de sinal arbitrário43.
NOTA: Para os dados representativos apresentados abaixo, o limiar foi definido como 750.000 unidades de fluorescência arbitrária (AFU). Este valor foi escolhido para estar acima da linha de base medida, ao mesmo tempo em que capturou suficientemente o início da agregação indicada por um aumento acentuado do sinal fluorescente. - Finalize o ensaio quando as amostras agregam ou começarem a desidratar visualmente.
6. Avaliar a viabilidade celular
- Formule pelo menos 2 mL de hidrogel PNP contendo a concentração celular desejada seguindo os protocolos acima (normalmente 1 - 5 x 106 células/mL). Prepare cada grupo de amostra em uma seringa separada.
- Usando uma agulha 21G, injete 150 μL de hidrogel PNP em cada poço em uma placa de fundo claro de 96 poços; cada poço é uma réplica. Cada grupo amostral deve ter 3-5 réplicas por ponto de tempo. Centrifugar a placa a 50 x g por 2 min para espalhar o hidrogel uniformemente no poço.
- Adicione 100 μL da mídia celular apropriada em cima do hidrogel. Remova esta mídia todos os dias e adicione 100 μL de novas mídias.
- No primeiro dia, remova a mídia em cima do hidrogel para as réplicas designadas para esse ponto de tempo para cada grupo amostral. Adicione 50 μL de solução de 2 mM de calcein AM em cima dos hidrogéis. Incubar por 30 min.
NOTA: Calcein AM pode ser usado para identificar e rotular células vivas. Em células vivas, o calcein AM não fluorescente é convertido em uma calceina verde-fluorescente, por esterases intracelulares após hidrólise ester acetoximilo. - Imagem o centro de cada poço em uma placa de 96 poços usando um microscópio confocal. Pesquise uma área de pelo menos 300 μm2 com uma pilha z abrangendo pelo menos 150 μm. Use configurações de comprimento de onda confocal para capturar a fluorescência da calceina (excitação/emissão: 495 nm/515 nm).
- Repita a etapa 6.4 e 6.5 para cada ponto de tempo subsequente como desejado.
- Para analisar cada imagem, destrua todas as imagens da pilha de z em uma única imagem de intensidade máxima de plano usando FIJI ou software semelhante. Quantifique o número de células fluorescentes em cada imagem. A razão do número de células fluorescentes em cada ponto de tempo em comparação com o número de células fluorescentes no dia 1 é a viabilidade celular relativa nos hidrogéis PNP.
7. Avaliação da fixação celular
- Calcule o número de células necessárias para formular 500-700 μL de hidrogel PNP em uma concentração final de 5 x 106 células/mL. Suspender células em 1 mL de PBS a uma concentração de 1 x 106 células/mL. Coloribiliza as células adicionando 50 μL de 2 mM de calcein AM. Incubar as células com o corante por 10 minutos.
- Centrífugas em condições adequadas, remova o PBS e resuspense as células no volume de PBS necessários para formar 500-700 μL do hidrogel PNP desejado.
NOTA: A velocidade e duração recomendadas para centrifugar cada tipo de célula específica é normalmente fornecida na documentação do produto. - Formular 500-700 μL de hidrogel PNP com as células manchadas (5 x 106 células/mL) seguindo a seção de protocolo 2.
- Usando uma agulha 21G, injete 100-200 μL de hidrogel PNP contendo as células manchadas no fundo de um cuvette. Três réplicas devem ser realizadas para cada amostra. Mova a agulha para frente e para trás dentro da cuvette enquanto injeta para evitar a formação de bolhas.
- Imediatamente (tempo t=0), imagem as cuvetas deitadas de lado sobre toda a área plana cuvette retângulo na base do cuvette. Use os recursos de varredura de ladrilhos confocal para imaginar toda a área do poço e imagem de uma pilha de z em 3D através de uma profundidade de 100 μm. Para visualização posterior, use o software de microscópio confocal para costurar todas as telhas individuais e realizar uma projeção de intensidade máxima para formar uma única imagem da grande área ou usar o software FIJI em um computador pessoal44,45.
- Seguindo a imagem, fique de pé as cuvetas.
- Imagem às 1h e 4h para observar se as células se instalaram no hidrogel ou se permanecem suspensas.
NOTA: Esses pontos de tempo são sugestões e podem ser modificados conforme desejado. - Para analisar cada imagem, destrua todas as imagens da pilha z em uma única imagem de intensidade máxima do plano. Usando FIJI ou software similar, quantifique a distribuição celular medindo a intensidade da fluorescência pelo perfil vertical central da cuvette para determinar o grau de assentamento.
Resultados
Fabricação e caracterização de hidrogel PNP
Os hidrogéis PNP são formados através da mistura dos dois componentes primários - polímeros HPMC hidrofobicamente modificados e nanopartículas PEG-PLA(Figura 1a). A carga terapêutica é mais facilmente incorporada ao tampão adicional usado para diluir o componente nanopartícula antes da preparação do hidrogel. Para caracterização biomédica a jusante, é conveniente usar um método de mistura de cotovelo que permita a mistura simples e reprodutível dos dois componentes(Figura 1b). Após a mistura adequada, o hidrogel deve se sentir firme na seringa, mas produzir sob pressão e extrusão a partir de uma agulha padrão (21G mostrada) (Figura 1c). Após a injeção, o hidrogel deve rapidamente se fixar em um material sólido que resiste ao fluxo da gravidade. Para caracterizar totalmente o hidrogel e garantir produtos consistentes em lote a lote, as amostras devem ser analisadas usando vários experimentos diferentes em um reômetro. As capacidades de afinamento e auto-recuperação do gel serão facilmente observadas usando um protocolo de varredura de fluxo e protocolo de cisalhamento,respectivamente (Figura 2a,b). Para géis mais rígidos, como a formulação 2:10, o usuário deve procurar viscosidade para diminuir pelo menos duas ordens de magnitude durante a varredura de fluxo à medida que a taxa de cisalhamento é aumentada de 0,1 para 100 s-1, o que simula as condições mecânicas durante a injeção. O protocolo de corte de passo deve revelar uma diminuição de ordens de magnitude na viscosidade sob os degraus de alta tesoura, e um retorno rápido (tempo de recuperação de <5) à viscosidade da linha de base durante os passos de corte baixos. A caracterização do moduli de armazenamento e perda usando um experimento de varredura de frequência de cisalhamento oscilatório no regime viscoelástico linear deve revelar propriedades sólidas em frequências de 0,1-100 rad s-1 (Figura 2c). Em particular, normalmente não deve haver um crossover do moduli de armazenamento e perda de tesoura que é observável em baixas frequências para formulações mais rígidas como os hidrogéis 2:10. Tal evento de crossover pode indicar problemas na qualidade dos materiais de partida, seja no polímero HPMC ou PEG-PLA modificados, ou no tamanho e dispersão das nanopartículas PEG-PLA. Deve-se notar que um evento crossover pode ser esperado para formulações de hidrogel mais fracas, como o hidrogel 1:5. As varreduras de amplitude de cisalhamento oscilatória nos hidrogéis PNP revelam que os materiais não rendem até que valores elevados de estresse sejam aplicados, indicando que esses materiais possuem um estresse de rendimento, uma quantidade limiar de estresse necessária para o material fluir.
Caracterizando cinética de liberação de hidrogéis PNP
Um passo essencial na concepção de géis PNP para entrega de medicamentos é a caracterização da cinética de liberação de medicamentos a partir de uma formulação escolhida. Existem várias técnicas para isso, mas uma metodologia in vitro simples fornece dados úteis durante o desenvolvimento precoce da formulação(Figura 3a). Variar o teor de polímero dos hidrogéis PNP através da modulação da quantidade de HPMC-C12 ou NPs é a maneira mais simples de ajustar as propriedades mecânicas e o tamanho da malha desses hidrogéis, que podem ter um impacto direto na difusão da carga através da rede de polímeros e taxa de liberação dos materiais(Figura 3b). Para a carga maior do que o tamanho dinâmico da malha (ou seja, alto peso molecular ou grande raio hidrodinâmico), os pesquisadores devem esperar uma liberação lenta e mediada por dissolução da carga do depósito de hidrogel. Formulações com tamanhos dinâmicos de malha maiores ou iguais ao tamanho da carga permitirão a liberação mediada por difusão que pode ser descrita usando modelos tradicionais de difusão de carga e liberação46,47,48,49. Com base na forma da curva de liberação, os pesquisadores podem reformular o hidrogel para ajustá-lo em direção a uma versão mais lenta (por exemplo, aumentar o teor de polímero) ou mais rápido (por exemplo, diminuir o teor de polímero).
Avaliação da estabilidade da carga terapêutica
Determinar a estabilidade da carga terapêutica em uma formulação de hidrogel é fundamental antes de iniciar estudos pré-clínicos ou celulares. Em comparação com outros métodos sintéticos para encapsular drogas, os hidrogéis PNP incorporam a carga de forma suave, misturando-se ao material a granel, e é improvável que o encapsulamento danifique a carga. Esses estudos indicam que os hidrogéis PNP também podem estabilizar a carga suscetível à instabilidade térmica, como a insulina, prolongando consideravelmente a vida útil e reduzindo a dependência do armazenamento e distribuição a frio(Figura 4). É importante avaliar a condição da carga imediatamente após o encapsulamento no hidrogel, bem como após longos períodos de armazenamento. Esses dados mostram que a insulina permanece estável em hidrogéis após 28 dias de armazenamento sob estresse térmico e mecânico contínuo, usando um simples ensaio de fluorescência para medir a agregação de insulina. Uma técnica alternativa para os casos em que um ensaio de placa apropriado não está disponível seria realizar medições circulares de dicromaísmo da carga, o que é particularmente útil para determinar a estrutura secundária de medicamentos proteicos.
Determinando viabilidade celular e dispersão em hidrogéis PNP
Muitas células terapêuticas requerem motivos de adesão para permanecer viável, e, portanto, a inclusão de motivos integrin como peptídeos de ácido arginino-glicoscina-aspartic (RGD) é um passo importante na adaptação dos hidrogéis PNP para terapias celulares50. O polímero modular PEG-PLA que compreende os NPs permite a funcionalidade química da coroa PEG através de químicas simples de "clique"28,51. Neste exemplo, os peptídeos RGD adesivos de células foram anexados ao polímero PEG-PLA para promover o engajamento celular com a estrutura do hidrogel PNP. Formulações sem locais de adesão terão baixa viabilidade celular, pois as células encapsuladas não se proliferam em comparação com as células encapsuladas em formulações com esses motivos de adesão(Figura 5a,b). As células encapsuladas podem ser rotuladas com calcein AM ou outro corante fluorescente apropriado (por exemplo, CFSE) para facilitar a contagem de células com um microscópio de fluorescência. Durante a otimização, a viabilidade deve ser comparada com hidrogéis PNP não modificados para garantir que formulações não funcionais estão proporcionando maior viabilidade e proliferação. Se as formulações não funcionais de integrin estão fornecendo eficácia semelhante à de hidrogéis não modificados, isso pode indicar uma falha na química de conjugação usada para incorporar os motivos de adesão.
Os pesquisadores devem esperar que as células encapsuladas sejam uniformemente dispersas através do meio de hidrogel ao usar uma formulação de hidrogel apropriada. Isso permitirá uma dosagem consistente e previsível das células durante a administração do hidrogel e deve se traduzir na retenção local de células no hidrogel após a administração. A distribuição das células pode ser facilmente determinada usando técnicas de microscopia de fluorescência. As células podem ser rotuladas com um corante apropriado e depois imagens usando microscopia confocal. As imagens podem ser avaliadas visualmente (Figura 5c) e também quantitativamente(Figura 5d) usando o software ImageJ para medir a intensidade média da fluorescência ao longo do eixo vertical da imagem (ou ao longo do eixo de fixação celular devido à gravidade. Se a formulação de hidrogel for muito fraca para suportar as células em suspensão em prazos prolongados, ocorrerá a fixação celular, como observado na formulação 1:1 na Figura 5. O aumento do teor de polímeros pode resolver problemas com a dispersão celular inhomogênea devido à fixação.
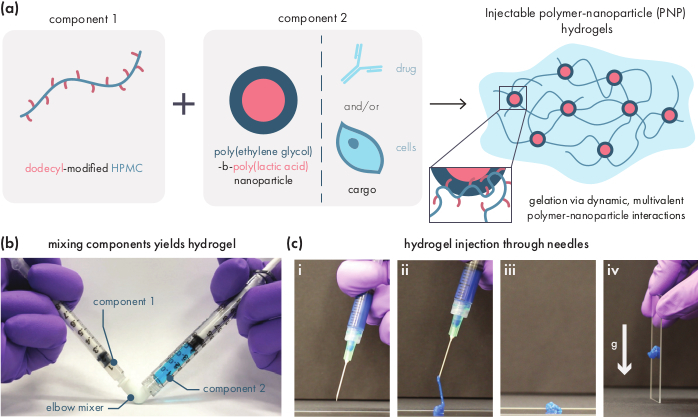
Figura 1: Os hidrogéis de nanopartículas de polímero (PNP) são facilmente formados pela mistura de dois componentes. (a) O primeiro componente é uma solução de celulose hidroxipropiletila modificada dodecil (HPMC-C12),e o segundo componente é uma solução de nanopartículas debloco-poli(ácido láctico) (PEG-PLA) junto com qualquer carga terapêutica. A mistura suave desses dois componentes produz um hidrogel injetável, onde os polímeros HPMC-C12 são fisicamente interligados por interações dinâmicas e multivalentes com as nanopartículas PEG-PLA. (b) Fotografia demonstrando formulação de gel misturando-se com duas seringas, cada uma contendo um componente do hidrogel PNP. Ao conectar as duas seringas com um conector de cotovelo luer-lock, os dois componentes podem ser facilmente misturados em condições estéreis para produzir um hidrogel sem bolhas pré-carregado em uma seringa para uso imediato. A solução NP é tingida de azul com o propósito de demonstração. (c) Demonstração da injeção de hidrogéis PNP e sua res solidificação. i Hidrogel PNP em uma seringa com agulha 21G anexada. (ii) A injeção coloca o hidrogel sob a tesoura que quebra temporariamente as interações entre polímeros e nanopartículas, criando uma consistência fluida. (iii) Pós-injeção, as interações dinâmicas polímero-nanopartículas se reformam rapidamente, permitindo que o hidrogel se auto-cure em um sólido. (iv) O hidrogel sólido não flui sob forças mais fracas do que seu estresse de rendimento, como a gravidade. O hidrogel PNP é tingido de azul para fins de demonstração. Clique aqui para ver uma versão maior desta figura.
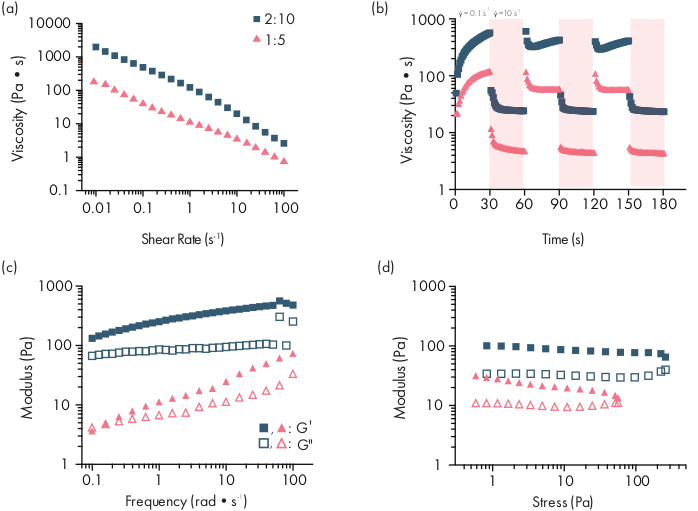
Figura 2: Caracterização reológica de duas formulações de hidrogel PNP. As formulações são denotadas como polímeras wt.%: NP wt.%. aFluxo de cisalhamento constante varre de baixa a alta taxa de cisalhamento de hidrogéis PNP. A viscosidade em função da taxa de corte caracteriza propriedades de corte. (b) Viscosidade em função de oscilar taxas de tesoura entre baixas taxas de corte (fundo branco; 0,1 s−1) a altas taxas de corte (fundo vermelho; 10 s−1) demonstrando propriedades de auto-recuperação dos hidrogéis PNP. As taxas de tesoura são impostas para 30 s cada. (c) Módulo de armazenamento elástico G' e módulo de perda viscosa G" em função da frequência em uma tensão constante de 1% para várias formulações de hidrogel PNP. (d) Amplitude varre a uma frequência constante de 10 rad/s para caracterizar o módulo de armazenamento elástico G' e o módulo de perda viscoso G" dos hidrogéis PNP em função do estresse. Essa caracterização reológica pode ser usada como comparação para controle de qualidade. Este número foi adaptado de Grosskopf et al.28Por favor clique aqui para ver uma versão maior desta figura.
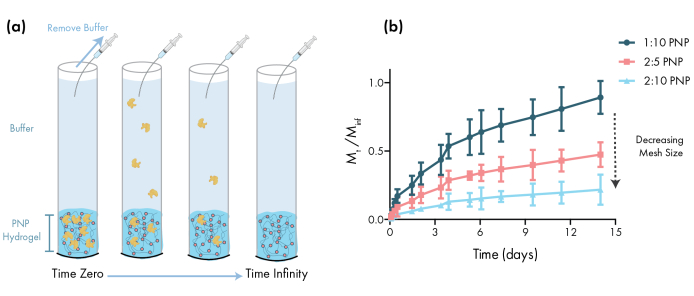
Figura 3: Lançamento in vitro de albumina de soro bovino (BSA) de hidrogéis PNP. As formulações são denotadas como polímeras wt.%: NP wt.%. aEsquema descrevendo o protocolo experimental de liberação in vitro. As alíquotas são removidas dos tubos capilares carregados por hidrogel PNP ao longo do tempo. (b) A liberação in vitro do BSA a partir de 1:10 PNP, 2:5 PNP e 2:10 PNP relatada como o ponto de tempo de massa coletado pelo ponto de tempo especificado dividido pela massa total coletada durante o ensaio (dados mostrados como média ± SD; n = 3). A BSA foi detectada através de medições de absorvência. Clique aqui para ver uma versão maior desta figura.
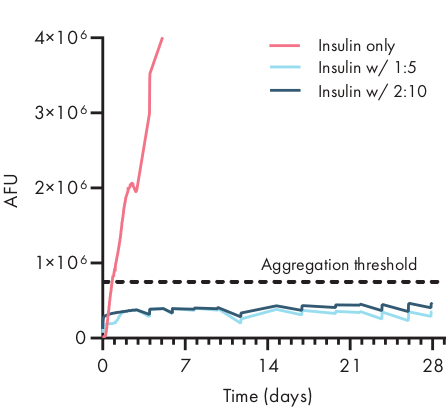
Figura 4: Estabilidade térmica da insulina encapsulada em hidrogéis PNP por ensaio tht. As formulações são denotadas como polímeras wt.%: NP wt.%. Insulina encapsulada em 1:5 e 2:10 PNP hidrogel permaneceu semagrecimento por mais de 28 dias em condições de envelhecimento estressada de 37 °C e agitação constante. O tempo de agregação de insulina formulada na PBS foi de 20 ± 4 h (± média SD, limiar de agregação 750.000 AFU). Dados apresentados como uma média de n = 4 réplicas experimentais (AFU, unidades de fluorescência arbitrária). Esta figura foi adaptada de Meis et al.38Clique aqui para ver uma versão maior desta figura.
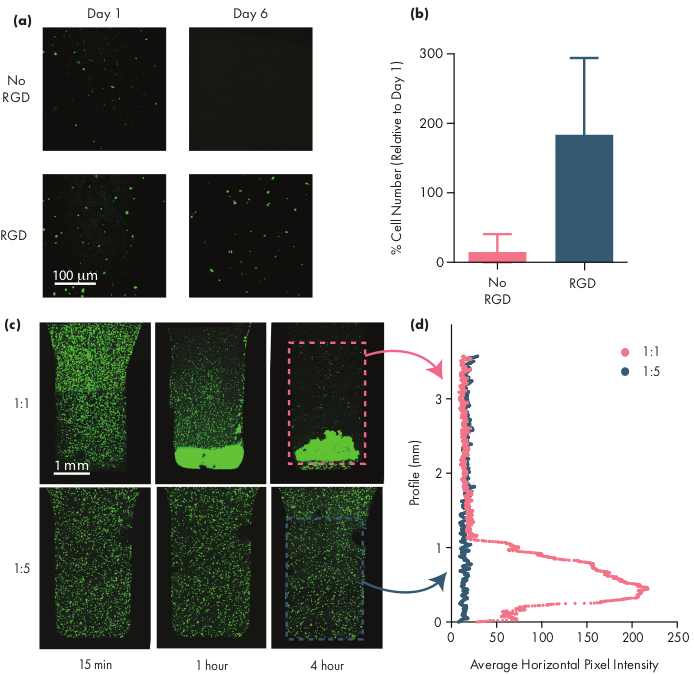
Figura 5: Viabilidade celular e fixação celular em hidrogéis PNP. (a,b) Estudos de viabilidade celular em hidrogéis PNP com células-tronco mesenquimais humanas (hMSCs). (a) Imagens representativas de hMSCs viáveis em hidrogéis PNP 1:5 com e sem o motivo arginina-glina-glicina-asparta (RGD) conjugado aos NPs PEG-PLA. hMSCs foram manchados por 30 min antes da imagem confocrática. Barra de escala representa 100 μm. (b) Viabilidade celular no dia 6 definida como número de células fluorescentes na imagem em relação ao número de células fluorescentes no dia 1 (dados mostrados como média ± SD; n = 3). (c,d) Encapsulamento celular e experimentos de assentamento com hMSCs. c Imagens de intensidade máxima de hMSCs manchados de calcein AM encapsulados em hidrogel PNP 1:1 (linha superior) e 1:5 PNP hidrogel (linha inferior) ao longo de 4 horas para quantificar a fixação celular. A barra de escala representa 1 mm. (d) Intensidade média de pixels horizontais de hMSCs ao longo do perfil vertical do hidrogel. Este número foi adaptado de Grosskopf et al.28Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Os hidrogéis de polímero-nanopartícula (PNP) são facilmente fabricados e permitem a entrega local de células terapêuticas e medicamentos a longo prazo através de administração minimamente invasiva através de injeção direta ou entrega de cateter. Esses protocolos descrevem a formulação de hidrogéis PNP e os métodos de caracterização para garantir a qualidade dos materiais resultantes. Os hidrogéis PNP supramoleculares são escaláveis para fabricação e são formados através da simples mistura de polímeros de celulose modificadas e nanopartículas policricanas de concha-núcleo. Os métodos atuais descrevem procedimentos fáceis para formar géis pré-carregados em seringas através de protocolos simples de mistura de cotovelo. Através de métricas de controle de qualidade de cada uma das partes componentes, como dls para monitorar o tamanho e distribuição nP, pode-se reproduzir materiais de hidrogel PNP com propriedades reológicas consistentes. Através da variação da quantidade de HPMC-C12 ou NPs, pode-se modular o tamanho da malha e rigidez do hidrogel PNP resultante. Essas propriedades podem ser ajustadas para melhor se adequar a uma determinada aplicação biomédica, e com os métodos reológicos aqui detalhados, os pesquisadores podem caracterizar as propriedades de afinamento de tesoura e auto-cura dos hidrogéis PNP à medida que otimizam a plataforma para suas aplicações específicas. Métodos para estudos de liberação in vitro também são descritos; os pesquisadores podem usar esses estudos para caracterizar a escala de tempo relativa de liberação de medicamentos de interesse, informando futuros estudos in vivo. Usando estudos de estabilidade, os pesquisadores também podem avaliar a capacidade desses materiais de ajudar a preservar a estrutura biológica e a estabilidade da bioterapêutica sensível ao longo do tempo e temperaturas extremas, com aplicações potenciais convincentes para reduzir a dependência da cadeia fria da bioterapêutica. Finalmente, com ensaios simples de viabilidade celular, o crescimento celular e a migração dentro dos materiais PNP podem ser avaliados, com aplicações potenciais em terapias celulares e andaimes.
Nosso grupo encontrou muitas aplicações convincentes para a plataforma de hidrogel PNP27. Hidrogéis PNP têm sido utilizados para a entrega lenta de vacinas subunidades, permitindo perfis de liberação cinética combinadas de antígenos e adjuvantes para aumentar a magnitude, duração e qualidade da resposta imune humoral31. Os hidrogéis PNP têm um tamanho de malha menor do que os hidrogéis mais comumente usados, por isso são eficazes na desaceleração da difusão e na liberação lenta de carga molecular. As propriedades únicas de adesão tecidual e as propriedades mecânicas dos hidrogéis PNP também foram utilizadas para formar barreiras físicas para evitar aderências decorrentes da cirurgia, pulverizando os hidrogéis sobre grandes áreas superficiais dos órgãos após a cirurgia30. Os hidrogéis PNP também têm se mostrado veículos eficazes de entrega de células, e as propriedades mecânicas realmente protegem as células das forças mecânicas que ocorrem na agulha da seringa durante a injeção, melhorando a viabilidade celular29. Quando os NPs são conjugados com um peptídeo adesivo celular, as células podem se conectar e se envolver com a matriz PNP para permanecer viável. Usando essa abordagem, os hidrogéis PNP têm sido mostrados para melhorar a retenção local de células-tronco injetadas em comparação com métodos que utilizam veículos líquidos28. Além disso, hidrogéis PNP têm sido mostrados para evitar a agregação termicamente induzida de insulina encapsulada, mesmo sob condições de envelhecimento severas e estressadas, sugerindo que esses materiais podem ser capazes de reduzir a necessidade de refrigerar drogas sensíveis à temperatura38.
No geral, as metodologias aqui descritas permitirão que grupos de pesquisa fabricassem e explorassem hidrogéis PNP como um bioma material. Esses protocolos fornecem as técnicas de síntese em escala de laboratório para fabricar material hidrogel suficiente para prosseguir tanto estudos in vitro quanto in vivo. Os estudos descritos acima indicam que os crosslinks dinâmicos desses materiais permitem que ele seja adequado para uma série de aplicações biomédicas, permitindo a motilidade ativa das células presas, restringindo a difusão passiva da carga molecular. Espera-se que os pesquisadores encontrem a plataforma PNP uma ferramenta acessível e poderosa para melhorar os resultados clínicos através da entrega controlada de medicamentos e estudar mecanismos biológicos básicos, como recrutamento celular e mecanobiologia.
Divulgações
Esses autores não têm nada a revelar.
Agradecimentos
Esta pesquisa foi apoiada financeiramente pelo Center for Human Systems Imunology com a Fundação Bill & Melinda Gates (OPP1113682) e pela Fundação Bill & Melinda Gates (OPP1211043). C.M.M. foi apoiado pela Stanford Graduate Fellowship e pela Stanford Bio-X William e Lynda Steere Fellowship. A.K.G. é grato por uma Bolsa de Pesquisa de Pós-Graduação da National Science Foundation e pela Gabilan Fellowship da Stanford Graduate Fellowship in Science and Engineering. S.C. foi apoiado pelo Instituto Nacional de Câncer dos Institutos Nacionais de Saúde sob o Prêmio Número F32CA247352. Os autores também gostariam de reconhecer calorosamente os membros do Laboratório Appel, incluindo o Dr. Gillie Roth, Dr. Anthony Yu, Dr. Lyndsay Stapleton, Dr. Hector Lopez Hernandez, Dr. Andrea d'Aquino, Dr. Julie Baillet, Celine Liong, Ben Ou, Emily Meany, Emily Gale e Dr. Anton Smith por seu esforço e tempo em ajudar o Laboratório Appel a desenvolver esses protocolos ao longo dos anos.
Materiais
| Name | Company | Catalog Number | Comments |
| 21G needles | BD | 305165 | PNP hydrogel injection |
| 22G, 4 in hypodermic needles | Air-Tite | N224 | In vitro release studies |
| 384-well plates, black, clear bottom | Corning | 3540 | Dynamic light scattering (DLS) |
| 96-well plates, black | Fisher Scientific | 07-200-627 | Biostability studies |
| 96-well plates, clear | Corning | 3599 | Cell viability and settling studies |
| Calcein AM | Thermo Fisher Scientific | C3100MP | Cell viability and settling studies |
| Capillary tubes | McMaster-Carr | 8729K66 | In vitro release studies |
| Centrifugal filter units | Fisher Scientific | UFC901024 | NP concentration |
| Cuvettes | Millipore Sigma | BR759015-100EA | Cell viability and settling studies |
| DLS Plate Reader | Wyatt Technology | DynaPro II Plate Reader | Dynamic light scattering (DLS) |
| Epoxy | VWR International | 300007-392 (EA) | In vitro release studies |
| Hypodermic needles | Air-Tite | 8300015027 | In vitro release studies |
| Luer elbow connector | Cole-Parmer | EW-30800-12 | PNP hydrogel formulation |
| Luer lock syringe | Fisher Scientific | 14-955-456 | PNP hydrogel formulation |
| Phosphate Buffered Saline (1x) | Fisher Scientific | 10010049 | PNP hydrogel formulation |
| Plastic Spatula | Thomas Scientific | 1229F13 | Rheological characterization |
| Plate Reader | BioTek | Synergy H1 Hybrid Multi-Mode Plate Reader | Biostability studies |
| Plate seals | Excel Scientific | TS-RT2-100 | Biostability studies |
| Recombinant human insulin | Gibco | A11382II | Biostability studies |
| Rheometer | TA Instruments | DHR-2 Rheometer | Rheological characterization |
| Thioflavin T | Sigma-Aldrich | T3516-5G | Biostability studies |
Referências
- Mandal, A., Clegg, J. R., Anselmo, A. C., Mitragotri, S. Hydrogels in the clinic. Bioengineering Translational Medicine. 5 (2), 10158 (2020).
- Appel, E. A., del Barrio, J., Loh, X. J., Scherman, O. A. Supramolecular polymeric hydrogels. Chemical Society Reviews. 41 (18), 6195-6214 (2012).
- Mann, J. L., Yu, A. C., Agmon, G., Appel, E. A. Supramolecular polymeric biomaterials. Biomaterials Science. 6 (1), 10-37 (2018).
- Foster, A. A., Marquardt, L. M., Heilshorn, S. C. The diverse roles of hydrogel mechanics in injectable stem cell transplantation. Current Opinion in Chemical Engineering. 15, 15-23 (2017).
- Aguado, B. A., Mulyasasmita, W., Su, J., Lampe, K. J., Heilshorn, S. C. Improving viability of stem cells during syringe needle flow through the design of hydrogel cell carriers. Tissue Engineering Part A. 18 (7-8), 806-815 (2012).
- Marquardt, L. M., Heilshorn, S. C. Design of injectable materials to improve stem cell transplantation. Current Stem Cell Reports. 2 (3), 207-220 (2016).
- Guvendiren, M., Burdick, J. A. Engineering synthetic hydrogel microenvironments to instruct stem cells. Current Opinion in Biotechnology. 24 (5), 841-846 (2013).
- Marquardt, L. M., et al. Designer, injectable gels to prevent transplanted Schwann cell loss during spinal cord injury therapy. Science Advances. 6 (14), 1039 (2020).
- Stephan, S. B., et al. Biopolymer implants enhance the efficacy of adoptive T-cell therapy. Nature Biotechnology. 33 (1), 97-101 (2015).
- Tuladhar, A., et al. Injectable hydrogel enables local and sustained co-delivery to the brain: two clinically approved biomolecules, cyclosporine and erythropoietin, accelerate functional recovery in rat model of stroke. Biomaterials. 235, 119794 (2020).
- Pakulska, M. M., Miersch, S., Shoichet, M. S. Designer protein delivery: From natural to engineered affinity-controlled release systems. Science. 351 (6279), (2016).
- Gupta, D., Tator, C. H., Shoichet, M. S. Fast-gelling injectable blend of hyaluronan and methylcellulose for intrathecal, localized delivery to the injured spinal cord. Biomaterials. 27 (11), 2370-2379 (2006).
- Verbeke, C. S., Mooney, D. J. Injectable, pore-forming hydrogels for in vivo enrichment of immature dendritic cells. Advanced Healthcare Materials. 4 (17), 2677-2687 (2015).
- Tous, E., Purcell, B., Ifkovits, J. L., Burdick, J. A. Injectable acellular hydrogels for cardiac repair. Journal of Cardiovascular Translational Research. 4 (5), 528-542 (2011).
- Zhao, X., et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing. Biomaterials. 122, 34-47 (2017).
- Johnson, T. D., Christman, K. L. Injectable hydrogel therapies and their delivery strategies for treating myocardial infarction. Expert Opinion on Drug Delivery. 10 (1), 59-72 (2013).
- Kleinman, H. K., Martin, G. R. . Seminars in Cancer Biology. , 378-386 (2005).
- Hickey, J. W., et al. Engineering an artificial T-cell stimulating matrix for immunotherapy. Advanced Materials. 31 (23), 1807359 (2019).
- Baumann, M. D., et al. An injectable drug delivery platform for sustained combination therapy. Journal of Controlled Release. 138 (3), 205-213 (2009).
- Trappmann, B., et al. Matrix degradability controls multicellularity of 3D cell migration. Nature Communications. 8 (1), 1-8 (2017).
- Figueiredo, L., et al. Assessing glucose and oxygen diffusion in hydrogels for the rational design of 3D stem cell scaffolds in regenerative medicine. Journal of Tissue Engineering and Regenerative Medicine. 12 (5), 1238-1246 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. , 1-24 (2019).
- Chaudhuri, O., et al. Substrate stress relaxation regulates cell spreading. Nature Communications. 6 (1), 1-7 (2015).
- Cai, L., Dewi, R. E., Heilshorn, S. C. Injectable hydrogels with in situ double network formation enhance retention of transplanted stem cells. Advanced Functional Materials. 25 (9), 1344-1351 (2015).
- Fisher, S. A., Baker, A. E., Shoichet, M. S. Designing peptide and protein modified hydrogels: selecting the optimal conjugation strategy. Journal of the American Chemical Society. 139 (22), 7416-7427 (2017).
- Li, R. H., Altreuter, D. H., Gentile, F. T. Transport characterization of hydrogel matrices for cell encapsulation. Biotechnology and Bioengineering. 50 (4), 365-373 (1996).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6 (6295), (2015).
- Grosskopf, A. K., et al. Injectable supramolecular polymer-nanoparticle hydrogels enhance human mesenchymal stem cell delivery. Bioengineering and Translational Medicine. 5 (1), 10147 (2020).
- Lopez Hernandez, H., Grosskopf, A. K., Stapleton, L. M., Agmon, G., Appel, E. A. Non-newtonian polymer-nanoparticle hydrogels enhance cell viability during injection. Macromolecular Bioscience. 19 (1), (2019).
- Stapleton, L. M., et al. Use of a supramolecular polymeric hydrogel as an effective post-operative pericardial adhesion barrier. Nature Biomedical Engineering. 3 (8), 611-620 (2019).
- Roth, G. A., et al. Injectable hydrogels for sustained codelivery of subunit vaccines enhance humoral immunity. ACS Central Science. , (2020).
- Steele, A. N., et al. A biocompatible therapeutic catheter-deliverable hydrogel for in situ tissue engineering. Advanced Healthcare Materials. 8 (5), 1801147 (2019).
- Fenton, O. S., et al. Injectable polymer-nanoparticle hydrogels for local immune cell recruitment. Biomacromolecules. 20 (12), 4430-4436 (2019).
- Yu, A. C., Smith, A. A., Appel, E. A. Structural considerations for physical hydrogels based on polymer-nanoparticle interactions. Molecular Systems Design & Engineering. 5 (1), 401-407 (2020).
- Wisdom, K., Chaudhuri, O., Koledova, Z. . 3D Cell Culture: Methods and Protocols. , 29-37 (2017).
- Lohmeijer, B. G., et al. Guanidine and amidine organocatalysts for ring-opening polymerization of cyclic esters. Macromolecules. 39 (25), 8574-8583 (2006).
- Cheng, J., et al. Formulation of functionalized PLGA-PEG nanoparticles for in vivo targeted drug delivery. Biomaterials. 28 (5), 869-876 (2007).
- Meis, C. M., et al. Self-assembled, dilution-responsive hydrogels for enhanced thermal stability of insulin biopharmaceuticals. ACS Biomaterials Science & Engineering. , (2020).
- Franck, A., Germany, T. Viscoelasticity and dynamic mechanical testing. TA Instruments. , (1993).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6, 6295 (2015).
- Gallastegui, A., et al. Controlled release of antibiotics from photopolymerized hydrogels: kinetics and microbiological studies. Materials Science and Engineering: C. 102, 896-905 (2019).
- Qiao, M., Chen, D., Ma, X., Liu, Y. Injectable biodegradable temperature-responsive PLGA-PEG-PLGA copolymers: synthesis and effect of copolymer composition on the drug release from the copolymer-based hydrogels. International Journal of Pharmaceutics. 294 (1-2), 103-112 (2005).
- Schlein, M. Insulin Formulation Characterization-The Thioflavin T Assays. The AAPS Journal. 19 (2), 397-408 (2017).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Sakas, G., Grimm, M., Savopoulos, A. . EUROGRAPHICS workshop on Rendering Techniques. , 51-63 (1995).
- Axpe, E., et al. A multiscale model for solute diffusion in hydrogels. Macromolecules. 52 (18), 6889-6897 (2019).
- Peppas, N., Bures, P., Leobandung, W., Ichikawa, H. Hydrogels in pharmaceutical formulations. European Journal of Pharmaceutics and Biopharmaceutics. 50 (1), 27-46 (2000).
- Ritger, P. L., Peppas, N. A. A simple equation for description of solute release I. Fickian and non-fickian release from non-swellable devices in the form of slabs, spheres, cylinders or discs. Journal of Controlled Release. 5 (1), 23-36 (1987).
- Reinhart, C. T., Peppas, N. A. Solute diffusion in swollen membranes. Part II. Influence of crosslinking on diffusive properties. Journal of Membrane Science. 18, 227-239 (1984).
- Salinas, C. N., Anseth, K. S. The influence of the RGD peptide motif and its contextual presentation in PEG gels on human mesenchymal stem cell viability. Journal of Tissue Engineering and Regenerative. 2 (5), 296-304 (2008).
- Smith, A. A., et al. Nanoparticles presenting potent TLR7/8 agonists enhance anti-PD-L1 immunotherapy in cancer treatment. Biomacromolecules. 21 (9), 3704-3712 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados