Method Article
Idrogel supramolecolari supramolecolari iniettabili per applicazioni di somministrazione di cellule e farmaci
In questo articolo
Riepilogo
Questo protocollo descrive la sintesi e la formulazione di biomateriali idrogel iniettabili, supramolecolari polimeri-nanoparticella (PNP). Vengono dimostrate le applicazioni di questi materiali per la somministrazione di farmaci, la stabilizzazione biofarmaceutica e l'incapsulamento e la consegna delle cellule.
Abstract
Questi metodi descrivono come formulare idrogel iniettabili, supramolecolari polimero-nanoparticella (PNP) da utilizzare come biomateriali. Gli idrogel PNP sono composti da due componenti: la cellulosa idrofobicamente modificata come polimero di rete e le nanoparticelle di guscio centrale auto-assemblate che agiscono come collegamenti trasversali non covalenti attraverso interazioni dinamiche e multivalenti. Questi metodi descrivono sia la formazione di queste nanoparticelle auto-assemblate attraverso la nanoprecipitazione, sia la formulazione e la miscelazione dei due componenti per formare idrogel con proprietà meccaniche tonnibili. Viene inoltre dettagliato l'uso dello scattering dinamico della luce (DLS) e della reologia per caratterizzare la qualità dei materiali sintetizzati. Infine, l'utilità di questi idrogel per la somministrazione di farmaci, la stabilizzazione biofarmaceutica e l'incapsulamento e la consegna delle cellule è dimostrata attraverso esperimenti in vitro per caratterizzare il rilascio di farmaci, la stabilità termica, la sedimentazione e la vitalità delle cellule. Grazie alla sua biocompatibilità, iniettabilità e condizioni di formazione di gel delicati, questo sistema idrogel è una piattaforma facilmente tonnibile adatta a una vasta gamma di applicazioni biomediche.
Introduzione
Gli idrogel iniettabili sono uno strumento emergente per fornire cellule e farmaci terapeutici al corpo in modo controllato1. Questi materiali possono essere caricati con farmaci o cellule e possono essere somministrati in modo minimamente invasivo attraverso l'iniezione diretta ai tessuti superficiali o mediante somministrazione di catetere ai tessuti profondi. In generale, gli idrogel iniettabili sono composti da reti polimeriche gonfie d'acqua che sono reti incrociate da interazioni fisiche transitorie. A riposo, questi collegamenti incrociati forniscono una struttura solida ai gel, ma all'applicazione di una forza meccanica sufficiente questi collegamenti incrociati vengono temporaneamente interrotti, trasformando il materiale in uno stato liquido che può facilmentefluire 2. Sono queste proprietà reologiche che permettono agli idrogel fisici di tranciare-sottile e fluire attraverso piccoli diametri dell'ago durantel'iniezione 3. Dopo l'iniezione, la rete polimerica del materiale si riforma, permettendogli di auto-guarire e formare rapidamente un gel solido in situ4,5. Queste strutture possono fungere da depositi a lento rilascio per farmaci o impalcature per la rigenerazione deitessuti 6,7. Questi materiali sono stati utilizzati in diverse applicazioni che comprendono la tecnologia di somministrazione dei farmaci, la medicina rigenerativa e l'immunoingegneria1,8,9,10,11,12.
Sia i materiali naturali (ad esempio, alginato e collagene) che i materiali sintetici (ad esempio, poli(glicole etilenico) (PEG) o polimeri idrofili simili) sono stati sviluppati come materiali idrogel iniettabili biocompatibili13,14,15. Molti materiali naturali presentano variazioni da lotto a lotto che influiscono sullariproducibilità 4,16. Questi materiali sono spesso sensibili alla temperatura, curando al raggiungimento delle temperature fisiologiche; pertanto, la movimentazione di questi materiali pone ulteriori sfide tecniche elogistiche 17. I materiali sintetici consentono un controllo chimico più preciso e un'eccellente riproducibilità, ma questi materiali possono talvolta essere soggetti a risposte immunitarie avverse che ne limitano la biocompatibilità, caratteristica critica per applicazioni terapeutiche in vivo6,18,19. Recenti sforzi hanno dimostrato che ci sono molti complessi criteri di progettazione coinvolti nell'ingegneria di un materiale idrogel iniettabile, tra cui l'ottimizzazione delle proprietà meccaniche, la dimensione delle maglie della rete polimerica, gli spunti molecolari bioattivi, la biodegradabilità e l'immunogenicitàdel materiale 20,21,22,23,24,25,26. Tutti questi fattori devono essere considerati a seconda dell'applicazione dell'interesse, il che significa che una piattaforma modulare chimicamente tonnibile è ideale per soddisfare un'ampia gamma di applicazioni.
I metodi attuali descrivono la formulazione e l'uso di una piattaforma idrogel polimero-nanoparticella iniettabile (PNP) che presenta proprietà meccaniche tonnibili, un alto grado di biocompatibilità e bassa immunogenicità, e presenta siti per coniugare segnali molecolari bioattivi27,28,29,30,31,32,33. Questi idrogel PNP sono composti da polimeri della cellulosa idrofobicamente modificati e nanoparticelle di guscio di nucleo auto-assemblate che comprendono poli(glicole etilenico)-blocco-poly(acido lattico) (PEG-PLA)27,34 che interagiscono per produrre una rete supramolecolare. Più specificamente, i polimeri di cellulosa idrossipropilmetil modificati dal dodecil (HPMC-C12)interagiscono dinamicamente con la superficie delle nanoparticelle PEG-PLA e ponte tra queste nanoparticelle per formare questa rete polimerica27,34. Queste interazioni dinamiche e multivalenti consentono ai materiali di essere sottili durante l'iniezione e di auto-guarire rapidamente dopo la somministrazione. I componenti dell'idrogel PNP sono facilmente fabbricati attraverso semplici reazioni un vaso e l'idrogel PNP si forma in condizioni miti mediante semplice miscelazione dei due componenti35. Grazie alla facilità di fabbricazione, questa piattaforma idrogel è altamente traducibile su larga scala. Le proprietà meccaniche e le dimensioni delle maglie degli idrogel PNP sono controllate alterando la percentuale di peso dei componenti del polimero e delle nanoparticelle nella formulazione. Studi precedenti con questa piattaforma indicano che gli idrogel PNP sono altamente biocompatibili, biodegradabili e non immunogenici28,30,31. Nel complesso, questi idrogel presentano un'ampia utilità nelle applicazioni biomediche che comprendono la prevenzione dell'adesione post-operatoria, l'ingegneria e la rigenerazione dei tessuti, l'erogazione sostenuta di farmaci e l'immunoingegneria.
Protocollo
Prima di iniziare questo protocollo, è necessario sintetizzare HPMC-C12 e PEG-PLA utilizzandometodi precedentemente pubblicati 27,28,29,30,31,36,37,38.
1. Sintesi della nanoparticella (NP) per nanoprecipitazione
NOTA: Questa sezione descrive la sintesi di un singolo lotto di NP, producendo 250 μL di 20 wt% NP in soluzione tampone (50 mg di polimero PEG-PLA secco per lotto). Le note per l'aumento del numero di batch vengono fornite nei passaggi pertinenti.
- Misurare 50 mg di polimero PEG-PLA in un flaconcino a scintillazione in vetro da 8 mL e aggiungere 1 mL di acetonitrile. Vortice da sciogliere completamente.
NOTA: Per azzere il numero di lotti, ridimensionare linearmente questo passaggio e aggiungere la quantità totale di polimero e solvente necessaria in un unico flaconcino. - Aggiungere 10 mL di acqua ultrapura in una fiala a scintillazione in vetro da 20 mL con una piccola barra di agitazione. Indossare una piastra di agitazione impostata a 600 giri/min.
NOTA: Se il passaggio 1.1 è stato scalato, è comunque necessario avere una fiala a scintillazione individuale in cui precipitare per ogni lotto equivalente. Ad esempio, per 200 mg di polimero sciolto in 4 mL di acetonitrile, preparare 4 flaconcini a scintillazione da 20 mL. - Per formare NP per nanoprecipitazione, aggiungere 1 mL di soluzione di solvente polimerico dropwise nell'acqua utilizzando una pipetta da 200 μL. Mescolare per 2 minuti. Il blocco PLA del PEG-PLA non è solubile in acqua, e di conseguenza, i NP core-shell si autoassemblano con i blocchi PLA idrofobici come nucleo e il PEG idrofilo si blocca come il guscio.
- Verificare la dimensione delle particelle mediante lo scattering dinamico della luce (DLS).
NOTA: Questa procedura è specificatamente scritta per un lettore di lastre disponibile in commercio con il pacchetto software associato (vedi Tabella dei materiali). Per l'uso di strumenti alternativi, fare riferimento ai metodi di preparazione del campione descritti dal produttore dello strumento.- Diluire 20 μL di soluzione NP con 80 μL di acqua ultrapura (concentrazione di analisi: 1 mg/mL PEG-PLA NPs). Aggiungere 30 μL per pozzo a una piastra nera chiara a 384 pomp pomp etti (analizzare in triplice copia).
- Misurare il raggio idrodinamico e la polidispersità di ogni campione con un lettore di piastre DLS utilizzando opzioni di protocollo preimpostate nel pacchetto software. Come esempio di protocollo tipico, impostare i parametri di raccolta dati per acquisire misurazioni 5-10 DLS della durata di 2-5 s per acquisizione e quindi segnalare una dimensione e una distribuzione medie delle particelle per pozzo, calcolate dal modello delle proteine globulari. Per formare idrogel con proprietà reologiche coerenti, le particelle risultanti devono essere di 30-50 nm di diametro idrodinamico con una polidispersità (PD) < 0,2.
NOTA: Se i PN sono più piccoli del desiderato, utilizzare una soluzione di acetonitrile al 75% / 25% di solfossido di dimetile (DMSO) nella fase 1.1. L'aumento della percentuale di DMSO nella soluzione solvente aumenterà generalmente la dimensione delle particelle.
- Trasferire la soluzione NP dal flaconcino a scintillazione da 20 mL in un'unità filtrante centrifuga. Centrifuga a 4500 x g per 1 h per concentrare la soluzione NP <250 μL.
- Resuspend nel tampone desiderato, come la salina tamponata con fosfato (PBS), al 20 wt% NPs. Pipettare il contenuto dell'unità filtrante centrifuga in un tubo di microcentrifugo tarato o una fiala di scintillazione di vetro su un bilanciere di massa. Utilizzare una piccola quantità (50-100 μL) di tampone per risciacquare il filtro e garantire la raccolta di tutti i PNP. Aggiungere tampone per raggiungere una massa totale di 250 mg.
NOTA: I lotti possono essere raggruppati durante la sospensione. Le soluzioni stock NP possono essere conservate a 4 °C per circa 1 mese. Non congelare. Per una conservazione più lunga, verificare le dimensioni e la polidispersità di DLS prima dell'uso.
2. Formulazione e incapsulamento di idrogel di farmaci o cellule
NOTA: Questa sezione descrive la preparazione di 1 mL di formulazione idrogel PNP 2:10, con 2:10 che denota 2 wt% HPMC-C12 e 10 wt% NPs (12 wt% polimero solido totale) e 88 wt% soluzione tampone, soluzione di carico del farmaco o sospensione cellulare. Le percentuali di formulazione possono essere varie per produrre idrogel con una gamma di proprietà meccaniche. Ad esempio, gli idrogel PNP 1:5 sono stati utilizzati per la sedimentazione cellulare e sono stati mostrati risultati sperimentali di vitalità.
- Preparare una soluzione stock di 6 wt% HPMC-C12 in PBS (o altro buffer preferito). Sciogliere per 48 ore per assicurarsi che il polimero sia completamente disperso.
NOTA: La soluzione stock HPMC-C12 è stabile per mesi a temperatura ambiente. Tuttavia, si raccomanda la conservazione a 4 °C per inibire la crescita microbica. - Aggiungere 333 mg di soluzione stock HPMC-C12 da 6 wt% in una siringa di blocco Luer da 1 ml.
- Aggiungere 500 μL di soluzione stock NP 20 wt% a un tubo di microcentrifugo. Aggiungere 167 μL di PBS e pipetta da mescolare. Utilizzando un ago, riempire un'altra siringa di blocco Luer da 1 ml con la soluzione NP diluita.
NOTA: Per caricare il carico di droga, calcolare la concentrazione finale desiderata del farmaco nell'idrogel e caricare la quantità appropriata nei 167 μL di PBS mescolati con i PN. Se una sonda molecolare è necessaria per un saggio in situ, ad esempio per monitorare la stabilità del farmaco, caricare la sonda in modo simile a quanto descritto sopra per caricare il carico di droga. Per caricare le cellule, calcolare la concentrazione di cellule finali desiderata nell'idrogel e caricare il numero appropriato di cellule nei 167 μL di PBS mescolati con i PN. - Mescolare i due componenti dell'idrogel (HPMC-C12 e NPs) utilizzando un metodo di miscelazione delgomito 35.
- Collegare il connettore del gomito Luer alla siringa contenente soluzione NP (facoltativamente contenente anche il carico di droga o le cellule). Spingere la soluzione NP attraverso il gomito fino a quando il menisco è visibile all'estremità aperta. Tirare leggermente indietro e collegare la siringa contenente la soluzione HPMC-C12.
NOTA: È importante ridurre al minimo l'aria nella connessione del gomito per prevenire la formazione e la dispersione di bolle in tutto l'idrogel durante il processo di miscelazione. Quando si mescolano le cellule con il miscelatore del gomito, fare attenzione a mescolare più delicatamente poiché la miscelazione troppo rapidamente può sottoponere le cellule ad alte forze di taglio, portando alla morte cellulare. - Pompare le due soluzioni avanti e indietro attraverso il miscelatore di gomiti per circa 60 cicli fino a formare un materiale idrogel bianco omogeneo e opaco.
- Spingere l'intero volume di idrogel in un'unica siringa. Rimuovere la siringa vuota e disegnare lo stantuffo sulla siringa caricata in gel per recuperare il materiale dal connettore del gomito. Cappuccio con ago o spina.
NOTA: È necessario tenere conto di ~ 300 μL di volume di idrogel perso a causa dello spazio morto nel processo di miscelazione. Ad esempio, se si desidera 700 μL di volume finale di idrogel, devono essere preparati 1 mL di idrogel. Il processo di formulazione dell'idrogel può essere ridimensionato utilizzando siringhe più grandi. Tuttavia, per formulazioni idrogel rigide, come 2:10, può diventare difficile mescolare e iniettare da siringhe di dimensioni superiori a 3 ml di volume a causa dell'aumento del rapporto tra canna della siringa e gomito o diametro dell'ago. - Conservare l'idrogel nella siringa a temperatura ambiente. Tuttavia, se i farmaci sono incapsulati, si raccomanda la conservazione a 4 °C a meno che il produttore del farmaco non specifichi diversamente. Non congelare il materiale.
- Collegare il connettore del gomito Luer alla siringa contenente soluzione NP (facoltativamente contenente anche il carico di droga o le cellule). Spingere la soluzione NP attraverso il gomito fino a quando il menisco è visibile all'estremità aperta. Tirare leggermente indietro e collegare la siringa contenente la soluzione HPMC-C12.
3. Misurazione delle proprietà reologiche delle formulazioni idrogel
NOTA: Questo protocollo è specificamente utilizzato con il reometro commerciale menzionato nella tabella dei materiali con una geometria della piastra seghettata di 20 mm. Per l'uso di altri strumenti, fare riferimento alle istruzioni del produttore per la preparazione del campione.
- Formulare almeno 700 μL di idrogel PNP per la caratterizzazione reologica.
- Iniettare materiale al centro della piastra del reometro seghettata. La quantità varia a seconda dello spazio geometrico scelto. Per riferimento, uno spazio di 700 μm richiede ~400-500 μL di materiale.
- Abbassare il reometro allo spazio di trim (500-1000 μm) e ruotare lentamente la piastra del reometro superiore mentre prende contatto con l'idrogel PNP per assicurarsi che lo spazio sia riempito in modo uniforme e completo.
- Ispezionare il carico dell'idrogel PNP in modo che copra l'intera superficie della piastra del reometro. Utilizzare una spatola o un trimmer di plastica per tagliare delicatamente e rimuovere qualsiasi materiale in eccesso, in modo che abbia un leggero rigonfiamento dalla piastra.
- Abbassare il reometro allo spazio di geometria finale e verificare che il campione sia caricato in modo pulito.
- Misurare le proprietà meccaniche del campione utilizzando test oscillatori, ad esempio sweep di ampiezza o frequenza, o test di flusso, ad esempio sweep di flusso o test di fase.
NOTA: Nei dati rappresentativi mostrati, le prove di ampiezza oscillatoria vengono eseguite ad una frequenza costante di 10 rad/s. Le sweep di frequenza oscillatoria vengono eseguite a una tensione costante dell'1%, all'interno del regime viscoelastico lineare dello sweep di ampiezza. Le sweep di flusso sono state eseguite da alte velocità di taglio a basse velocità ditaglio 39. Tutti i test sono completati con 10 punti per decennio di dati raccolti e a temperatura ambiente. Potrebbe essere necessario regolare i parametri di prova in base alle proprietà della formulazione. Assottinare materiali PNP più rigidi come formulazioni 2:10 ad alte velocità di taglio può causare l'espulsa del materiale dalle piastre del reometro, con conseguente caratterizzazione meccanica imprecisa e richiedendo il ricaricamento del campione tra le prove successive. I dati rappresentativi riportati di seguito possono essere utilizzati per il confronto durante i test di controllo qualità.
4. Caratterizzare il rilascio di farmaci in vitro
- Preparare i tubi capillari tagliando i tubi capillari in vetro alla lunghezza desiderata. Sigillare un'estremità di ogni tubo utilizzando una spatola monouso o una punta di pipetta per spingere una piccola quantità di epossidica all'estremità del tubo per formare una spina. Lasciare impostare l'epossidico in base al tempo consigliato dal produttore.
NOTA: Il tubo deve essere più corto della lunghezza dell'ago di iniezione. Si raccomanda un tubo con diametro interno di 2-3 μm in modo che una lunghezza di 2,5 pollici contenga almeno 300 μL di volume totale. - Formulare almeno 500 μL di un materiale idrogel PNP in una siringa contenente il farmaco di interesse. Preparare ogni gruppo di campioni in una siringa separata.
- Iniettare 100-200 μL dell'idrogel PNP nella parte inferiore di ogni tubo capillare utilizzando un lungo ago ipodermico (22G, 4 pollici). Preparare almeno tre tubi (triplice copia) per gruppo campione.
- (Facoltativo) Posizionare tubi capillari riempiti in un tubo di centrifuga conico e centrifugare per 1 min a 1000 x g per garantire che la superficie dell'idrogel sia uniforme. Questo passaggio potrebbe dover essere ripetuto, alterando il tempo e la velocità in base alle esigenze per levigare la superficie del materiale.
ATTENZIONE: Assicurarsi che la centrifuga sia ben bilanciata. - Riempire con cura 200-300 μL di PBS sopra l'idrogel nel tubo capillare utilizzando una siringa e un ago o una pipetta. Non contattare o disturbare la superficie dell'idrogel. Sigillare il tubo con un cappuccio o un tappo o un coperchio con almeno due strati di pellicola di paraffina.
- (Facoltativo) Incubare campioni a 37 °C per simulare condizioni in vivo.
- Rimuovere completamente il PBS da ogni capillare, senza disturbare la superficie dell'idrogel, utilizzando una siringa e un ago nei punti di tempo scelti a seconda della scala di tempo prevista per il rilascio del farmaco. Sostituire il volume rimosso con PBS fresco. Conservare le aliquote in condizioni appropriate.
NOTA: I volumi e i punti di tempo raccomandati nei passaggi 4.3, 4.5 e 4.7 possono essere ottimizzati per catturare il rilascio di farmaci in vitro in una serie di tempi, a seconda della quantità di farmaco caricato nel materiale e della velocità con cui rilascia nel supernatante. Un campione di punti di tempo selezionati potrebbe essere di 6 ore, 1 giorno, 3 giorni, 1 settimana e 2 settimane per un farmaco a rilascio lento. Le aliquote possono anche essere analizzate man mano che vengono acquisite piuttosto che memorizzate. - Al termine dello studio, analizzare le aliquote con un metodo appropriato come ELISA, HPLC o saggio di fluorescenza per quantificare la quantità di farmaco rilasciato inogni momento punto 40,41,42. Il metodo di rilevamento appropriato varierà a seconda del farmaco di interesse.
NOTA: Gli studi sul rilascio in vitro sono utili per confrontare il rilascio tra diverse formulazioni di idrogel o carico di farmaci. La scala di tempo di rilascio in vitro non indica spesso direttamente una scala di tempo prevista per il rilascio in vivo.
5. Caratterizzare la stabilità termica dell'insulina incapsulata in gel
- Formulare almeno 1,2 mL di idrogel PNP per gruppo campione. Seguendo la procedura descritta nella sezione 2.3, caricare sia l'insulina (carico di droga) che la tioflavina T (ThT) (sonda molecolare) nell'idrogel PNP.
NOTA: Il meccanismo primario di aggregazione e, quindi, inattivazione dell'insulina è attraverso la formazione di fibrille amiloide. ThT è una sonda molecolare adatta perché produce un forte segnale di fluorescenza in presenza di fibrille amiloide, consentendo il monitoraggio in situ dell'aggregazione dell'insulina. A seconda del carico di droga di interesse, l'aggregazione può essere monitorata attraverso diversi metodi. Per i dati rappresentativi riportati, l'insulina è stata caricata ad una concentrazione finale di 6,7 o 10 mg/mL e ThT ad una concentrazione finale di 25 μM. - Utilizzando un ago da 21 G, iniettare 200 μL di idrogel PNP per pozzo in una piastra nera da 96 po '. Ogni gruppo campione deve essere misurato almeno in triplice copia. Piastra di tenuta con guarnizione della piastra adesiva otticamente chiara per evitare l'evaporazione.
- Inserire la piastra in un lettore di lastre dotato di controllo della temperatura, agitazione e programmazione di lettura cinetica e iniziare a leggere il protocollo. I dati rappresentativi sono stati acquisiti con un lettore di lastre disponibile in commercio (vedi Tabella dei materiali) utilizzando le seguenti condizioni:
- Condizioni di invecchiamento stressato: scuotimento lineare continuo (410 cpm, 5 mm) a 37 °C.
- Acquisizione dati: eccitazione/emissione 450 nm/482 nm a intervalli di 20 minuti
NOTA: Se un lettore di piastre con capacità di controllo della temperatura, shaker e lettura cinetica non è disponibile, la piastra può essere posizionata su una piastra shaker in un incubatore e letta manualmente a lunghezze d'onda superiori in punti di tempo selezionati.
- Tracciare i dati come segnale di fluorescenza media nel tempo per ogni gruppo. Il tempo di aggregazione può essere quantificato definendo una soglia di segnale arbitraria43.
NOTA: Per i dati rappresentativi riportati di seguito, la soglia è stata definita come 750.000 unità di fluorescenza arbitrarie (AFU). Questo valore è stato scelto per essere al di sopra della linea di base misurata pur catturando a sufficienza l'inizio dell'aggregazione indicato da un forte aumento del segnale fluorescente. - Terminare il test quando i campioni si aggregano o iniziano visivamente a disidratarsi.
6. Valutazione della redditività cellulare
- Formulare almeno 2 mL di idrogel PNP contenente la concentrazione cellulare desiderata seguendo i protocolli precedenti (normalmente 1 - 5 x 106 celle /mL). Preparare ogni gruppo di campioni in una siringa separata.
- Utilizzando un ago da 21G, iniettare idrogel PNP da 150 μL in ogni pozzo in una piastra chiara a 96 po 'di fondo; ogni pozzo è una replica. Ogni gruppo di campioni deve avere 3-5 repliche per punto di tempo. Centrifugare la piastra a 50 x g per 2 minuti per stendere l'idrogel uniformemente nel pozzo.
- Aggiungere 100 μL del supporto cellulare appropriato sopra l'idrogel. Rimuovere questo supporto ogni giorno e aggiungere nuovi supporti da 100 μL.
- Il primo giorno, rimuovere il supporto sopra l'idrogel per le repliche designate per quel punto di tempo per ogni gruppo di campioni. Aggiungere 50 μL di soluzione di calceina AM da 2 mM sopra gli idrogel. Incubare per 30 minuti.
NOTA: Calcein AM può essere utilizzato per identificare ed etichettare le cellule vive. Nelle cellule vive, la calceina non fluorescente AM viene convertita in calceina verde-fluorescente, mediante esterasi intracellulare dopo idrolisi dell'estere acetoximetile. - Immagine del centro di ogni pozzo in una piastra da 96 porri utilizzando un microscopio confocale. Rilevamento di un'area di almeno 300 μm2 con una pila z che si estende per almeno 150 μm. Utilizzare le impostazioni della lunghezza d'onda confocale per catturare la fluorescenza della calceina (eccitazione/emissione: 495 nm/515 nm).
- Ripetere i passaggi 6.4 e 6.5 per ogni punto di tempo successivo come desiderato.
- Per analizzare ogni immagine, comprimere tutte le immagini dello stack Z in un'immagine a intensità massima a piano singolo utilizzando FIJI o software simile. Quantificare il numero di celle fluorescenti in ogni immagine. Il rapporto tra il numero di celle fluorescenti in ogni punto di tempo rispetto al numero di celle fluorescenti al primo giorno è la vitalità relativa delle cellule negli idrogel PNP.
7. Valutazione della sedimentazione cellulare
- Calcolare il numero di cellule necessarie per formulare 500-700 μL di idrogel PNP ad una concentrazione finale di 5 x 106 celle/mL. Sospendere le celle in 1 mL di PBS ad una concentrazione di 1 x 106 celle/mL. Cellule di macchia aggiungendo 50 μL di 2 mM calceina AM. Incubare le cellule con il colorante per 10 minuti.
- Centrifugare le cellule in condizioni appropriate, rimuovere il PBS e rimescolare le cellule nel volume di PBS necessario per formare 500-700 μL dell'idrogel PNP desiderato.
NOTA: La velocità e la durata consigliate per centrifugare ogni tipo di cella specifico sono in genere fornite nella documentazione del prodotto. - Formulare 500-700 μL di idrogel PNP con le celle macchiate (5 x 106 celle/mL) seguendo la sezione 2 del protocollo.
- Utilizzando un ago 21G, iniettare 100-200 μL di idrogel PNP contenente le celle macchiate nella parte inferiore di una cuvetta. Per ogni campione devono essere eseguite tre repliche. Spostare l'ago avanti e indietro all'interno della cuvetta durante l'iniezione per evitare la formazione di bolle.
- Immediatamente (tempo t=0), immagini le cuvette sdraiate su un lato su tutta l'area piatta del rettangolo della cuvetta alla base della cuvetta. Usa le funzionalità di scansione dei riquadri confocali per immaginere l'intera area del pozzo e imageare uno stack Z in 3D su una profondità di 100 μm. Per una visualizzazione successiva, utilizzare il software al microscopio confocale per unire tutte le singole tessere ed eseguire una proiezione di intensità massima per formare una singola immagine dell'area grande o utilizzare il software FIJI su un personal computer44,45.
- Dopo l'imaging, stare in posizione verticale le cuvette.
- Immagine a 1 h e 4 ore per osservare se le cellule si sono depositate nell'idrogel o se rimangono sospese.
NOTA: Questi punti di tempo sono suggerimenti e possono essere modificati come desiderato. - Per analizzare ogni immagine, comprimete tutte le immagini dello stack Z in un'unica immagine di intensità massima del piano. Utilizzando FIJI o software simile, quantificare la distribuzione cellulare misurando l'intensità della fluorescenza lungo il profilo verticale centrale della cuvetta per determinare il grado di sedimentazione.
Risultati
Fabbricazione e caratterizzazione di idrogel PNP
Gli idrogel PNP si formano attraverso la miscelazione dei due componenti primari: polimeri HPMC idrofobicamente modificati e nanoparticelle PEG-PLA (Figura 1a). Il carico terapeutico è più facilmente incorporato nel tampone aggiuntivo utilizzato per diluire il componente della nanoparticella prima della preparazione dell'idrogel. Per la caratterizzazione biomedica a valle, è conveniente utilizzare un metodo di miscelazione del gomito che consenta una miscelazione semplice e riproducibile dei due componenti (Figura 1b). Dopo un'adeguata miscelazione, l'idrogel deve sentirsi fermo nella siringa, ma cedere sotto pressione ed estrudere da un ago standard (21G mostrato)(Figura 1c). Dopo l'iniezione, l'idrogel dovrebbe rapidamente essere impostato in un materiale solido che resiste al flusso dalla gravità. Per caratterizzare completamente l'idrogel e garantire prodotti coerenti da lotto a lotto, i campioni devono essere analizzati utilizzando diversi esperimenti su un reometro. Le capacità di diradamento e autoguarigione del gel saranno facilmente osservabili utilizzando rispettivamente un protocollo di sweep di flusso e un protocollo step-shear (Figura 2a,b). Per gel più rigidi, come la formulazione 2:10, l'utente deve cercare la viscosità per diminuire almeno due ordini di grandezza durante lo sweep di flusso poiché la velocità di taglio viene aumentata da 0,1 a 100 s-1, che simula le condizioni meccaniche durante l'iniezione. Il protocollo step-shear dovrebbe rivelare una diminuzione degli ordini di grandezza della viscosità sotto i gradini ad alto taglio e un rapido ritorno (tempo di recupero di <5 s) alla viscosità di base durante le fasi di taglio basse. La caratterizzazione dei moduli di stoccaggio e perdita mediante un esperimento di sweep di frequenza di taglio oscillatorio nel regime viscoelastico lineare dovrebbe rivelare proprietà solide a intervalli di frequenza da 0,1-100 rad s-1 (Figura 2c). In particolare, in genere non dovrebbe esserci un crossover dei moduli di stoccaggio e perdita di taglio che è osservabile a basse frequenze per formulazioni più rigide come gli idrogel 2:10. Tale evento crossover può indicare problemi nella qualità delle materie prime, sia il polimero HPMC o PEG-PLA modificato, sia le dimensioni e la dispersione delle nanoparticelle PEG-PLA. Va notato che ci si può aspettare un evento crossover per formulazioni idrogel più deboli, come l'idrogel 1:5. Le sweep di ampiezza oscillatoria del taglio sugli idrogel PNP rivelano che i materiali non producono fino a quando non vengono applicati alti valori di sollecitazione, indicando che questi materiali possiedono una sollecitazione di snervamento, una quantità soglia di sollecitazione necessaria affinché il materiale fluisca.
Caratterizzazione della cinetica di rilascio dagli idrogel PNP
Un passo essenziale nella progettazione di gel PNP per il rilascio di farmaci è la caratterizzazione della cinetica del rilascio di farmaci da una formulazione scelta. Esistono diverse tecniche a tal fine, ma una semplice metodologia in vitro fornisce dati utili durante lo sviluppo precoce della formulazione (Figura 3a). Variare il contenuto polimerico degli idrogel PNP modulando la quantità di HPMC-C12 o NPs è il modo più semplice per ottimizzare le proprietà meccaniche e le dimensioni delle maglie di questi idrogel, che possono avere un impatto diretto sulla diffusione del carico attraverso la rete polimerica e la velocità di rilascio dai materiali(Figura 3b). Per il carico che è più grande della dimensione dinamica delle maglie (cioè un elevato peso molecolare o un ampio raggio idrodinamico), i ricercatori dovrebbero aspettarsi un lento rilascio mediato dalla dissoluzione del carico dal deposito di idrogel. Formulazioni con maglie dinamiche maggiori o uguali alle dimensioni del carico consentiranno il rilascio mediato dalla diffusione che può essere descritto utilizzando modelli tradizionali di diffusione del caricoe rilascio 46,47,48,49. In base alla forma della curva di rilascio, i ricercatori possono riformulare l'idrogel per sintonizzarlo verso un rilascio più lento (ad esempio, aumentare il contenuto di polimeri) o più veloce (ad esempio, diminuire il contenuto di polimeri).
Valutazione della stabilità del carico terapeutico
Determinare la stabilità del carico terapeutico in una formulazione di idrogel è fondamentale prima di iniziare studi preclinici o cellulari. Rispetto ad altri metodi sintetici per l'incapsulamento dei farmaci, gli idrogel PNP incorporano il carico in modo delicato mescolando nel materiale sfuso ed è improbabile che l'incapsulamento danneggi il carico. Questi studi indicano che gli idrogel PNP possono anche stabilizzare il carico suscettibile all'instabilità termica, come l'insulina, prolungando notevolmente la durata di conservazione e riducendo la dipendenza dallo stoccaggio e dalla distribuzione a freddo (Figura 4). È importante valutare le condizioni del carico immediatamente dopo l'incapsulamento nell'idrogel e dopo lunghi periodi di stoccaggio. Questi dati mostrano che l'insulina rimane stabile negli idrogel dopo 28 giorni di conservazione sotto stress termico e meccanico continuo, utilizzando un semplice test di fluorescenza per misurare l'aggregazione dell'insulina. Una tecnica alternativa per i casi in cui non è disponibile un saggio appropriato sulle lastre consisterebbe nell'eseguire misurazioni circolari del dicroismo del carico, che è particolarmente utile per determinare la struttura secondaria dei farmaci proteici.
Determinazione della vitalità cellulare e della dispersione negli idrogel PNP
Molte cellule terapeutiche richiedono motivi di adesione per rimanere vitali, e quindi l'inclusione di motivi integrina come i peptidi arginina-glicina-acido aspartico (RGD) è un passo importante nell'adattamento degli idrogel PNP per le terapie cellulari50. Il polimeromodularePEG - PLA composto dai NP consente la funzionalizzazione chimica della corona PEG attraverso semplici sostanze chimiche "click"28,51. In questo esempio, peptidi RGD adesivi per cellule sono stati attaccati al polimero PEG-PLA per promuovere l'innesto cellulare con la struttura idrogel PNP. Le formulazioni prive di siti di adesione avranno una bassa vitalità cellulare in quanto le cellule incapsulate non proliferano rispetto alle cellule incapsulate in formulazioni con questi motivi di adesione (Figura 5a, b). Le cellule incapsulate possono essere etichettate con calceina AM o un altro colorante fluorescente appropriato (ad esempio, CFSE) per facilitare il conteggio delle cellule con un microscopio a fluorescenza. Durante l'ottimizzazione, la vitalità dovrebbe essere paragonata agli idrogel PNP non modificati per garantire che le formulazioni funzionalizzate all'integrina forniscano una maggiore vitalità e proliferazione. Se le formulazioni funzionalizzate all'integrina stanno fornendo un'efficacia simile a idrogel non modificati, ciò può indicare un fallimento nella chimica coniugazione utilizzata per incorporare i motivi di adesione.
I ricercatori dovrebbero aspettarsi che le cellule incapsulate siano disperse uniformemente attraverso il mezzo idrogel quando utilizzano un'appropriata formulazione di idrogel. Ciò consentirà un dosamento coerente e prevedibile delle cellule durante la somministrazione di idrogel e dovrebbe tradursi nella ritenzione locale delle cellule nell'idrogel dopo la somministrazione. La distribuzione delle cellule può essere facilmente determinata utilizzando tecniche di microscopia a fluorescenza. Le cellule possono essere etichettate con un colorante appropriato e quindi immagini utilizzando la microscopia confocale. Le immagini possono essere valutate visivamente (Figura 5c) e anche quantitativamente (Figura 5d) utilizzando il software ImageJ per misurare l'intensità media della fluorescenza lungo l'asse verticale dell'immagine (o lungo qualsiasi asse di sedimentazione cellulare dovuto alla gravità). Se la formulazione dell'idrogel è troppo debole per sostenere le cellule in sospensione su tempi prolungati, si verificherà la sedimentazione cellulare, come osservato nella formulazione 1:1 nella figura 5. L'aumento del contenuto di polimeri può risolvere i problemi con la dispersione delle cellule disomogenee a causa della sedimentazione.
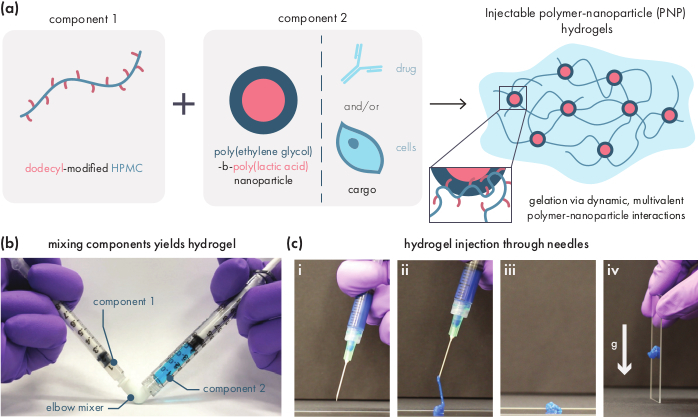
Figura 1: Gli idrogel polimerico-nanoparticella (PNP) si formano facilmente mescolando due componenti. (a) Il primo componente è una soluzione di idrossipropilmetilcellulosa modificata dal dodecil (HPMC-C12), e il secondo componente è una soluzione di nanoparticelle di poli(glicole etilenico)-blocco-poli(acido lattico) (PEG-PLA) insieme a qualsiasi carico terapeutico. La miscelazione delicata di questi due componenti produce un idrogel iniettabile, dove i polimeri HPMC-C12 sono fisicamente collegati da interazioni dinamiche e multivalenti con le nanoparticelle PEG-PLA. bFotografiache dimostra la formulazione del gel mescolando con due siringhe, ognuna contenente un componente dell'idrogel PNP. Collegando le due siringhe con un connettore a gomito Luer-lock, i due componenti possono essere facilmente miscelati in condizioni sterili per produrre un idrogel privo di bolle precaricato in una siringa per un uso immediato. La soluzione NP è tinta di blu a scopo dimostrativo. cDimostrazionedell'iniezione di idrogel PNP e della loro ri-solidificazione. (i) Idrogel PNP in una siringa con un ago 21G attaccato. (ii) L'iniezione mette l'idrogel sotto taglio che rompe temporaneamente le interazioni tra polimero e nanoparticelle, creando una consistenza fluida. (iii) Dopo l'iniezione, le interazioni dinamico polimero-nanoparticella si riformano rapidamente, permettendo all'idrogel di auto-guarire in un solido. ( iv) L'idrogel solido non scorre sotto forze più deboli della sua sollecitazione di snervata, come la gravità. L'idrogel PNP è tinto di blu ai fini della dimostrazione. Clicca qui per visualizzare una versione più grande di questa figura.
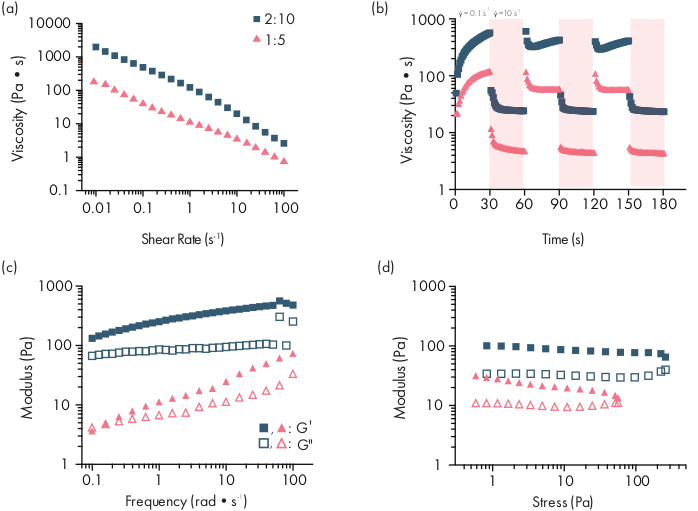
Figura 2: Caratterizzazione reologica di due formulazioni di idrogel PNP. Le formulazioni sono denotati come wt polimerico.%: NP wt.%. (a) Il flusso di taglio costante spazza da bassa a alta velocità di taglio degli idrogel PNP. La viscosità in funzione della velocità di taglio caratterizza le proprietà di diradamento del taglio. (b) Viscosità in funzione delle oscillazioni delle velocità di taglio tra basse velocità di taglio (sfondo bianco; 0,1 s−1) a velocità di taglio elevate (sfondo rosso; 10 s−1)che dimostrano proprietà auto-curative degli idrogel PNP. Le velocità di taglio sono imposte per 30 s ciascuna. (c) Modulo di stoccaggio elastico G′ e modulo di perdita viscosa G" in funzione della frequenza ad un ceppo costante dell'1% per varie formulazioni di idrogel PNP. (d) Sweep di ampiezza ad una frequenza costante di 10 rad/s per caratterizzare il modulo di stoccaggio elastico G′ e il modulo di perdita viscosa G" degli idrogel PNP in funzione dello stress. Questa caratterizzazione reologica può essere utilizzata come confronto per il controllo di qualità. Questa cifra è stata adattata da Grosskopf etal.
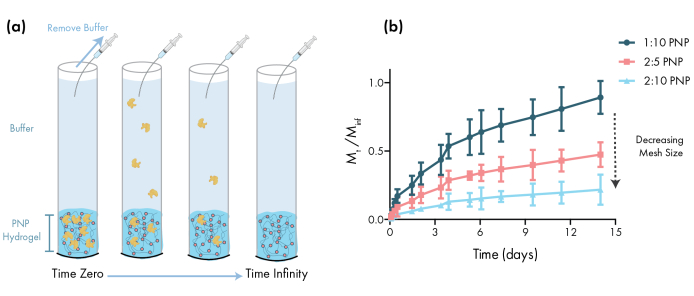
Figura 3: Rilascio in vitro di albumina siere bovina (BSA) da idrogel PNP. Le formulazioni sono denotati come wt polimerico.%: NP wt.%. (a) Schema che descrive il protocollo sperimentale di rilascio in vitro. Le aliquote vengono rimosse dai tubi capillari carichi di idrogel PNP nel tempo. b Ilrilascio in vitro di BSA da 1:10 PNP, 2:5 PNP e 2:10 PNP ha indicato come la massa raccolta dal punto di tempo specificato diviso per la massa totale raccolta durante il saggio (dati indicati come media ± SD; n = 3). La BSA è stata rilevata attraverso misurazioni di assorbanza. Clicca qui per visualizzare una versione più grande di questa figura.
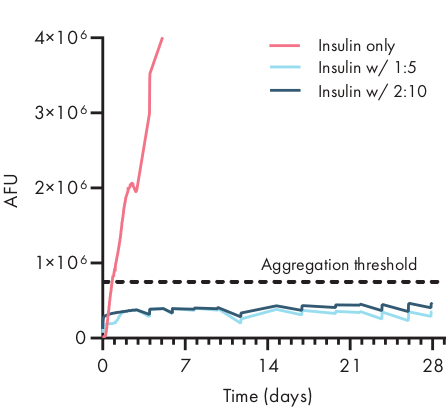
Figura 4: Stabilità termica dell'insulina incapsulata negli idrogel PNP dal saggio ThT. Le formulazioni sono denotati come wt polimerico.%: NP wt.%. L'insulina incapsulata sia in idrogel PNP 1:5 che 2:10 è rimasta non disaggregata per oltre 28 giorni in condizioni di invecchiamento stressato di 37 °C e agitazione costante. Il tempo di aggregazione per l'insulina formulato in PBS era di 20 ± 4 ore (media ± SD, soglia di aggregazione 750.000 AFU). Dati presentati come media di n = 4 repliche sperimentali (AFU, unità di fluorescenza arbitrarie). Questa cifra è stata adattata da Meis etal.
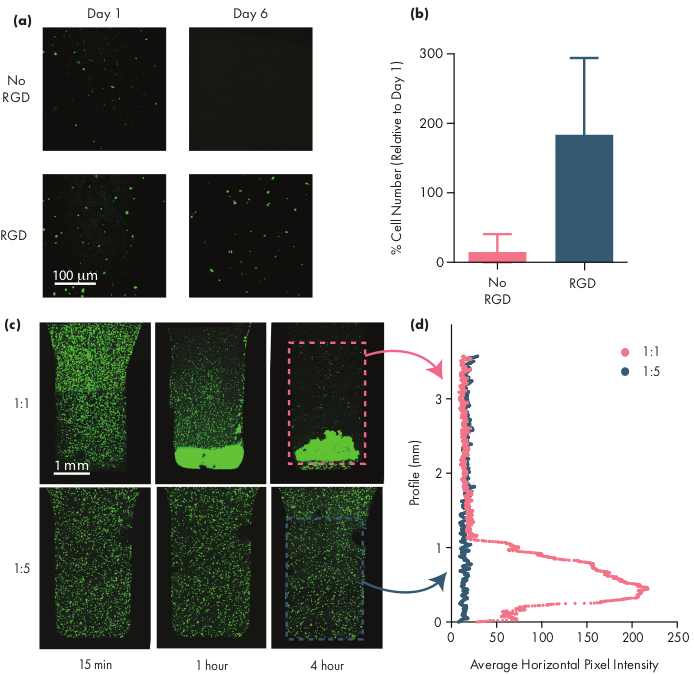
Figura 5: Vitalità cellulare e sedimentazione cellulare negli idrogel PNP. (a,b) Studi di vitalità cellulare in idrogel PNP con cellule staminali mesenchimali umane (hSPC). (a) Immagini rappresentative di hSPC vitali in idrogel PNP 1:5 con e senza il motivo dell'acido acido argoinina-glicina-aspartico (RGD) adesivo coniugato con i PNP PEG-PLA. La barra di scala rappresenta 100 μm. (b) Vitalità cellulare il giorno 6 definita come numero di celle fluorescenti nell'immagine rispetto al numero di celle fluorescenti il primo giorno (dati mostrati come ± SD medio; n = 3). (c,d) Esperimenti di incapsulamento e sedimentazione delle celle con hMSC. (c) Immagini di intensità massima degli HMSC macchiati di calceina AM incapsulati in idrogel PNP 1:1 (riga superiore) e idrogel PNP 1:5 (riga inferiore) su 4 ore per quantificare la sedimentazione cellulare. La barra di scala rappresenta 1 mm. (d) Intensità media orizzontale dei pixel degli HMSC lungo il profilo verticale dell'idrogel. Questa cifra è stata adattata da Grosskopf etal.
Discussione
Gli idrogel polimerico-nanoparticella (PNP) sono facilmente fabbricabili e consentono la somministrazione locale a lungo termine di cellule e farmaci terapeutici attraverso una somministrazione minimamente invasiva tramite iniezione diretta o consegna del catetere. Questi protocolli descrivono la formulazione degli idrogel PNP e i metodi di caratterizzazione per garantire la qualità dei materiali risultanti. Gli idrogel PNP supramolecolari sono scalabili da produrre e si formano attraverso la semplice miscelazione di polimeri di cellulosa modificati e nanoparticelle polimeriche a guscio di nucleo. I metodi attuali descrivono procedure facili per formare gel precaricati nelle siringhe attraverso semplici protocolli di miscelazione del gomito. Attraverso le metriche di controllo qualità di ciascuna delle parti componenti, come DLS per monitorare le dimensioni e la distribuzione NP, si possono formulare riproducibilmente materiali idrogel PNP con proprietà reologiche coerenti. Variando la quantità di HPMC-C12 o NP, si possono modulare le dimensioni delle maglie e la rigidità dell'idrogel PNP risultante. Queste proprietà possono essere sintonizzate per adattarsi al meglio a una particolare applicazione biomedica, e con i metodi reologici qui dettagliati i ricercatori possono caratterizzare le proprietà di diradamento del taglio e auto-guarigione degli idrogel PNP in quanto ottimizzano la piattaforma per le loro applicazioni specifiche. Vengono inoltre descritti i metodi per gli studi sul rilascio in vitro; i ricercatori possono utilizzare questi studi per caratterizzare la scala cronologica relativa del rilascio di farmaci di interesse, informando futuri studi in vivo. Utilizzando studi di stabilità, i ricercatori possono anche valutare la capacità di questi materiali di aiutare a preservare la struttura biologica e la stabilità della bioterapica sensibile nel tempo e temperature estreme, con applicazioni potenziali convincenti per ridurre la dipendenza della catena del freddo dalla bioterapia. Infine, con semplici test di vitalità cellulare, è possibile valutare la crescita cellulare e la migrazione all'interno dei materiali PNP, con potenziali applicazioni nelle terapie cellulari e nelle impalcature.
Il nostro gruppo ha trovato molte applicazioni interessanti per la piattaforma di idrogel PNP27. Gli idrogel PNP sono stati utilizzati per la consegna lenta di vaccini subunità, consentendo profili di rilascio cinetico abbinati di antigeni e coadiuvanti di aumentare la grandezza, la durata e la qualità della risposta immunitaria umorista31. Gli idrogel PNP hanno una dimensione delle maglie più piccola rispetto agli idrogel più comunemente usati, quindi sono efficaci nel rallentare la diffusione e rilasciare lentamente il carico molecolare. Le proprietà uniche di aderenza ai tessuti e le proprietà meccaniche degli idrogel PNP sono state utilizzate anche per formare barriere fisiche per prevenire le aderenze derivanti dalla chirurgia spruzzando gli idrogel su ampie aree superficiali degli organi dopo l'interventochirurgico 30. Gli idrogel PNP hanno anche dimostrato di essere efficaci veicoli per la somministrazione di cellule e le proprietà meccaniche proteggono effettivamente le cellule dalle forze meccaniche che si verificano nell'ago della siringa durante l'iniezione, migliorando la vitalitàcellulare 29. Quando gli NP sono coniugati con un peptide adesivo cellulare, le cellule possono attaccarsi e interagire con la matrice PNP per rimanere vitali. Utilizzando questo approccio, gli idrogel PNP hanno dimostrato di migliorare la ritenzione locale delle cellule staminali iniettate rispetto ai metodi che utilizzano veicoli liquidi28. Inoltre, gli idrogel PNP hanno dimostrato di prevenire l'aggregazione indotta termicamente di insulina incapsulata, anche in condizioni di invecchiamento stressato difficili, suggerendo che questi materiali potrebbero essere in grado di ridurre la necessità di refrigerare farmaci sensibili alla temperatura38.
Nel complesso, le metodologie qui descritte consentiranno ai gruppi di ricerca di fabbricare ed esplorare gli idrogel PNP come biomateriale. Questi protocolli forniscono le tecniche di sintesi su scala di laboratorio per fabbricare abbastanza materiale idrogel per perseguire studi sia in vitro che in vivo. Gli studi sopra descritti indicano che i collegamenti dinamici di questi materiali consentono di adattarlo a una serie di applicazioni biomediche consentendo la motilità attiva delle cellule intrappolate, limitando al contempo la diffusione passiva del carico molecolare. Si prevede che i ricercatori troveranno la piattaforma PNP uno strumento accessibile e potente per migliorare i risultati clinici attraverso la somministrazione controllata di farmaci e per studiare meccanismi biologici di base come il reclutamento cellulare e la meccanobiologia.
Divulgazioni
Questi autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata sostenuta finanziariamente dal Center for Human Systems Immunology con Bill & Melinda Gates Foundation (OPP1113682) e dalla Bill & Melinda Gates Foundation (OPP1211043). C.M.M. è stato supportato da una Stanford Graduate Fellowship e dalla Stanford Bio-X William and Lynda Steere Fellowship. A.K.G. è grata per una National Science Foundation Graduate Research Fellowship e la Gabilan Fellowship della Stanford Graduate Fellowship in Scienze e Ingegneria. S.C. è stato sostenuto dal National Cancer Institute of the National Institutes of Health con il numero di premio F32CA247352. Gli autori vorrebbero anche riconoscere calorosamente i membri dell'Appel Lab tra cui il Dr. Gillie Roth, il Dr. Anthony Yu, il Dr. Lyndsay Stapleton, il Dr. Hector Lopez Hernandez, il Dr. Andrea d'Aquino, la Dott.ssa Julie Baillet, Celine Liong, Ben Ou, Emily Meany, Emily Gale e il Dr. Anton Smith per il loro sforzo e il loro tempo nell'aiutare l'Appel Lab a sviluppare questi protocolli nel corso degli anni.
Materiali
| Name | Company | Catalog Number | Comments |
| 21G needles | BD | 305165 | PNP hydrogel injection |
| 22G, 4 in hypodermic needles | Air-Tite | N224 | In vitro release studies |
| 384-well plates, black, clear bottom | Corning | 3540 | Dynamic light scattering (DLS) |
| 96-well plates, black | Fisher Scientific | 07-200-627 | Biostability studies |
| 96-well plates, clear | Corning | 3599 | Cell viability and settling studies |
| Calcein AM | Thermo Fisher Scientific | C3100MP | Cell viability and settling studies |
| Capillary tubes | McMaster-Carr | 8729K66 | In vitro release studies |
| Centrifugal filter units | Fisher Scientific | UFC901024 | NP concentration |
| Cuvettes | Millipore Sigma | BR759015-100EA | Cell viability and settling studies |
| DLS Plate Reader | Wyatt Technology | DynaPro II Plate Reader | Dynamic light scattering (DLS) |
| Epoxy | VWR International | 300007-392 (EA) | In vitro release studies |
| Hypodermic needles | Air-Tite | 8300015027 | In vitro release studies |
| Luer elbow connector | Cole-Parmer | EW-30800-12 | PNP hydrogel formulation |
| Luer lock syringe | Fisher Scientific | 14-955-456 | PNP hydrogel formulation |
| Phosphate Buffered Saline (1x) | Fisher Scientific | 10010049 | PNP hydrogel formulation |
| Plastic Spatula | Thomas Scientific | 1229F13 | Rheological characterization |
| Plate Reader | BioTek | Synergy H1 Hybrid Multi-Mode Plate Reader | Biostability studies |
| Plate seals | Excel Scientific | TS-RT2-100 | Biostability studies |
| Recombinant human insulin | Gibco | A11382II | Biostability studies |
| Rheometer | TA Instruments | DHR-2 Rheometer | Rheological characterization |
| Thioflavin T | Sigma-Aldrich | T3516-5G | Biostability studies |
Riferimenti
- Mandal, A., Clegg, J. R., Anselmo, A. C., Mitragotri, S. Hydrogels in the clinic. Bioengineering Translational Medicine. 5 (2), 10158 (2020).
- Appel, E. A., del Barrio, J., Loh, X. J., Scherman, O. A. Supramolecular polymeric hydrogels. Chemical Society Reviews. 41 (18), 6195-6214 (2012).
- Mann, J. L., Yu, A. C., Agmon, G., Appel, E. A. Supramolecular polymeric biomaterials. Biomaterials Science. 6 (1), 10-37 (2018).
- Foster, A. A., Marquardt, L. M., Heilshorn, S. C. The diverse roles of hydrogel mechanics in injectable stem cell transplantation. Current Opinion in Chemical Engineering. 15, 15-23 (2017).
- Aguado, B. A., Mulyasasmita, W., Su, J., Lampe, K. J., Heilshorn, S. C. Improving viability of stem cells during syringe needle flow through the design of hydrogel cell carriers. Tissue Engineering Part A. 18 (7-8), 806-815 (2012).
- Marquardt, L. M., Heilshorn, S. C. Design of injectable materials to improve stem cell transplantation. Current Stem Cell Reports. 2 (3), 207-220 (2016).
- Guvendiren, M., Burdick, J. A. Engineering synthetic hydrogel microenvironments to instruct stem cells. Current Opinion in Biotechnology. 24 (5), 841-846 (2013).
- Marquardt, L. M., et al. Designer, injectable gels to prevent transplanted Schwann cell loss during spinal cord injury therapy. Science Advances. 6 (14), 1039 (2020).
- Stephan, S. B., et al. Biopolymer implants enhance the efficacy of adoptive T-cell therapy. Nature Biotechnology. 33 (1), 97-101 (2015).
- Tuladhar, A., et al. Injectable hydrogel enables local and sustained co-delivery to the brain: two clinically approved biomolecules, cyclosporine and erythropoietin, accelerate functional recovery in rat model of stroke. Biomaterials. 235, 119794 (2020).
- Pakulska, M. M., Miersch, S., Shoichet, M. S. Designer protein delivery: From natural to engineered affinity-controlled release systems. Science. 351 (6279), (2016).
- Gupta, D., Tator, C. H., Shoichet, M. S. Fast-gelling injectable blend of hyaluronan and methylcellulose for intrathecal, localized delivery to the injured spinal cord. Biomaterials. 27 (11), 2370-2379 (2006).
- Verbeke, C. S., Mooney, D. J. Injectable, pore-forming hydrogels for in vivo enrichment of immature dendritic cells. Advanced Healthcare Materials. 4 (17), 2677-2687 (2015).
- Tous, E., Purcell, B., Ifkovits, J. L., Burdick, J. A. Injectable acellular hydrogels for cardiac repair. Journal of Cardiovascular Translational Research. 4 (5), 528-542 (2011).
- Zhao, X., et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing. Biomaterials. 122, 34-47 (2017).
- Johnson, T. D., Christman, K. L. Injectable hydrogel therapies and their delivery strategies for treating myocardial infarction. Expert Opinion on Drug Delivery. 10 (1), 59-72 (2013).
- Kleinman, H. K., Martin, G. R. . Seminars in Cancer Biology. , 378-386 (2005).
- Hickey, J. W., et al. Engineering an artificial T-cell stimulating matrix for immunotherapy. Advanced Materials. 31 (23), 1807359 (2019).
- Baumann, M. D., et al. An injectable drug delivery platform for sustained combination therapy. Journal of Controlled Release. 138 (3), 205-213 (2009).
- Trappmann, B., et al. Matrix degradability controls multicellularity of 3D cell migration. Nature Communications. 8 (1), 1-8 (2017).
- Figueiredo, L., et al. Assessing glucose and oxygen diffusion in hydrogels for the rational design of 3D stem cell scaffolds in regenerative medicine. Journal of Tissue Engineering and Regenerative Medicine. 12 (5), 1238-1246 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. , 1-24 (2019).
- Chaudhuri, O., et al. Substrate stress relaxation regulates cell spreading. Nature Communications. 6 (1), 1-7 (2015).
- Cai, L., Dewi, R. E., Heilshorn, S. C. Injectable hydrogels with in situ double network formation enhance retention of transplanted stem cells. Advanced Functional Materials. 25 (9), 1344-1351 (2015).
- Fisher, S. A., Baker, A. E., Shoichet, M. S. Designing peptide and protein modified hydrogels: selecting the optimal conjugation strategy. Journal of the American Chemical Society. 139 (22), 7416-7427 (2017).
- Li, R. H., Altreuter, D. H., Gentile, F. T. Transport characterization of hydrogel matrices for cell encapsulation. Biotechnology and Bioengineering. 50 (4), 365-373 (1996).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6 (6295), (2015).
- Grosskopf, A. K., et al. Injectable supramolecular polymer-nanoparticle hydrogels enhance human mesenchymal stem cell delivery. Bioengineering and Translational Medicine. 5 (1), 10147 (2020).
- Lopez Hernandez, H., Grosskopf, A. K., Stapleton, L. M., Agmon, G., Appel, E. A. Non-newtonian polymer-nanoparticle hydrogels enhance cell viability during injection. Macromolecular Bioscience. 19 (1), (2019).
- Stapleton, L. M., et al. Use of a supramolecular polymeric hydrogel as an effective post-operative pericardial adhesion barrier. Nature Biomedical Engineering. 3 (8), 611-620 (2019).
- Roth, G. A., et al. Injectable hydrogels for sustained codelivery of subunit vaccines enhance humoral immunity. ACS Central Science. , (2020).
- Steele, A. N., et al. A biocompatible therapeutic catheter-deliverable hydrogel for in situ tissue engineering. Advanced Healthcare Materials. 8 (5), 1801147 (2019).
- Fenton, O. S., et al. Injectable polymer-nanoparticle hydrogels for local immune cell recruitment. Biomacromolecules. 20 (12), 4430-4436 (2019).
- Yu, A. C., Smith, A. A., Appel, E. A. Structural considerations for physical hydrogels based on polymer-nanoparticle interactions. Molecular Systems Design & Engineering. 5 (1), 401-407 (2020).
- Wisdom, K., Chaudhuri, O., Koledova, Z. . 3D Cell Culture: Methods and Protocols. , 29-37 (2017).
- Lohmeijer, B. G., et al. Guanidine and amidine organocatalysts for ring-opening polymerization of cyclic esters. Macromolecules. 39 (25), 8574-8583 (2006).
- Cheng, J., et al. Formulation of functionalized PLGA-PEG nanoparticles for in vivo targeted drug delivery. Biomaterials. 28 (5), 869-876 (2007).
- Meis, C. M., et al. Self-assembled, dilution-responsive hydrogels for enhanced thermal stability of insulin biopharmaceuticals. ACS Biomaterials Science & Engineering. , (2020).
- Franck, A., Germany, T. Viscoelasticity and dynamic mechanical testing. TA Instruments. , (1993).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6, 6295 (2015).
- Gallastegui, A., et al. Controlled release of antibiotics from photopolymerized hydrogels: kinetics and microbiological studies. Materials Science and Engineering: C. 102, 896-905 (2019).
- Qiao, M., Chen, D., Ma, X., Liu, Y. Injectable biodegradable temperature-responsive PLGA-PEG-PLGA copolymers: synthesis and effect of copolymer composition on the drug release from the copolymer-based hydrogels. International Journal of Pharmaceutics. 294 (1-2), 103-112 (2005).
- Schlein, M. Insulin Formulation Characterization-The Thioflavin T Assays. The AAPS Journal. 19 (2), 397-408 (2017).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Sakas, G., Grimm, M., Savopoulos, A. . EUROGRAPHICS workshop on Rendering Techniques. , 51-63 (1995).
- Axpe, E., et al. A multiscale model for solute diffusion in hydrogels. Macromolecules. 52 (18), 6889-6897 (2019).
- Peppas, N., Bures, P., Leobandung, W., Ichikawa, H. Hydrogels in pharmaceutical formulations. European Journal of Pharmaceutics and Biopharmaceutics. 50 (1), 27-46 (2000).
- Ritger, P. L., Peppas, N. A. A simple equation for description of solute release I. Fickian and non-fickian release from non-swellable devices in the form of slabs, spheres, cylinders or discs. Journal of Controlled Release. 5 (1), 23-36 (1987).
- Reinhart, C. T., Peppas, N. A. Solute diffusion in swollen membranes. Part II. Influence of crosslinking on diffusive properties. Journal of Membrane Science. 18, 227-239 (1984).
- Salinas, C. N., Anseth, K. S. The influence of the RGD peptide motif and its contextual presentation in PEG gels on human mesenchymal stem cell viability. Journal of Tissue Engineering and Regenerative. 2 (5), 296-304 (2008).
- Smith, A. A., et al. Nanoparticles presenting potent TLR7/8 agonists enhance anti-PD-L1 immunotherapy in cancer treatment. Biomacromolecules. 21 (9), 3704-3712 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon