Method Article
Hydrogels supramoléculaires injectables de polymères-nanoparticules pour les applications cellulaires et d’administration de médicaments
Dans cet article
Résumé
Ce protocole décrit la synthèse et la formulation de biomatériaux injectables supramoléculaires d’hydrogel polymère-nanoparticule (PNP). Les applications de ces matériaux pour l’administration de médicaments, la stabilisation biopharmaceutique, l’encapsulation cellulaire et l’administration sont démontrées.
Résumé
Ces méthodes décrivent comment formuler des hydrogels de polymères-nanoparticules (PNP) supramoléculaires injectables destinés à être utilisés comme biomatériaux. Les hydrogels PNP sont composés de deux composants : la cellulose modifiée hydrophobement en tant que polymère de réseau et les nanoparticules noyau-enveloppe auto-assemblées qui agissent comme des réticulateurs non covalents grâce à des interactions dynamiques et multivalentes. Ces méthodes décrivent à la fois la formation de ces nanoparticules auto-assemblées par nanoprécipitation ainsi que la formulation et le mélange des deux composants pour former des hydrogels aux propriétés mécaniques accordables. L’utilisation de la diffusion dynamique de la lumière (DLS) et de la rhéologie pour caractériser la qualité des matériaux synthétisés est également détaillée. Enfin, l’utilité de ces hydrogels pour l’administration de médicaments, la stabilisation biopharmaceutique, l’encapsulation cellulaire et l’administration est démontrée par des expériences in vitro pour caractériser la libération de médicaments, la stabilité thermique, ainsi que le tassement et la viabilité cellulaires. En raison de sa biocompatibilité, de son injectabilité et de ses conditions de formation de gel doux, ce système d’hydrogel est une plate-forme facilement accordable adaptée à une gamme d’applications biomédicales.
Introduction
Les hydrogels injectables sont un outil émergent pour fournir des cellules thérapeutiques et des médicaments à l’organisme de manière contrôlée1. Ces matériaux peuvent être chargés de médicaments ou de cellules et peuvent être administrés d’une manière minimalement invasive par injection directe dans les tissus superficiels ou par l’administration de cathéter aux tissus profonds. En général, les hydrogels injectables sont composés de réseaux polymères gonflés à l’eau qui sont réticulés entre eux par des interactions physiques transitoires. Au repos, ces réticulations fournissent une structure solide aux gels, mais lors de l’application d’une force mécanique suffisante, ces réticulations sont temporairement perturbées, transformant le matériau en un état de type liquide qui peut facilement s’écouler2. Ce sont ces propriétés rhéologiques qui permettent aux hydrogels physiques de s’amenuiser et de s’écouler à travers de petits diamètres d’aiguille lors de l’injection3. Après injection, le réseau polymère du matériau se reforme, lui permettant de s’auto-guérir et de former rapidement un gel in situ de type solide4,5. Ces structures peuvent agir comme des dépôts à libération lente pour les médicaments ou des échafaudages pour la régénération tissulaire6,7. Ces matériaux ont été utilisés dans diverses applications englobant la technologie d’administration de médicaments, la médecine régénérative et l’immunoingénierie1,8,9,10,11,12.
Des matériaux naturels (par exemple, l’alginate et le collagène) et des matériaux synthétiques (par exemple, le poly(éthylène glycol) (PEG) ou des polymères hydrophiles similaires) ont été développés en tant que matériaux hydrogel injectables biocompatibles13,14,15. De nombreux matériaux naturels présentent des variations de lot à lot affectant la reproductibilité4,16. Ces matériaux sont souvent sensibles à la température, durcissant lorsqu’ils atteignent des températures physiologiques; ainsi, la manipulation de ces matériaux pose des défis techniques et logistiques supplémentaires17. Les matériaux synthétiques permettent un contrôle chimique plus précis et une excellente reproductibilité, mais ces matériaux peuvent parfois être soumis à des réponses immunitaires défavorables qui limitent leur biocompatibilité, une caractéristique critique pour les applications thérapeutiques in vivo6,18,19. Des effortsrécents ont montré qu’il existe de nombreux critères de conception complexes impliqués dans l’ingénierie d’un matériau hydrogel injectable, y compris l’optimisation des propriétés mécaniques, la taille du maillage du réseau polymère, les indices moléculaires bioactifs, la biodégradabilité et l’immunogénicité du matériau20,21,22, 23,24,25,26. Tous ces facteurs doivent être pris en compte en fonction de l’application d’intérêt, ce qui signifie qu’une plate-forme modulaire et réglable chimiquement est idéale pour satisfaire un large éventail d’applications.
Les présentes méthodes décrivent la formulation et l’utilisation d’une plateforme injectable polymère-nanoparticule (PNP) d’hydrogel qui présente des propriétés mécaniques accordables, un degré élevé de biocompatibilité et une faible immunogénicité, et présente des sites de conjugaison des indices moléculaires bioactifs27,28,29,30,31,32,33. Ces hydrogels PNP sont composés de polymères de cellulose modifiés hydrophobement et de nanoparticulesnoyau-enveloppe auto-assemblées comprenant du poly(éthylène glycol)- bloc-poly(acide lactique) (PEG-PLA)27,34 qui interagissent pour produire un réseau supramoléculaire. Plus précisément, les polymères d’hydroxypropylméthylcellulose modifiés par dodécyle (HPMC-C12) interagissent dynamiquement avec la surface des nanoparticules de PEG-PLA et font le pont entre ces nanoparticules pour former ce réseau polymère27,34. Ces interactions dynamiques et multivalentes permettent aux matériaux de s’amincir pendant l’injection et de s’auto-guérir rapidement après l’administration. Les composants de l’hydrogel PNP sont facilement fabriqués par de simples réactions à un pot et l’hydrogel PNP est formé dans des conditions douces par simple mélange des deux composants35. En raison de la facilité de fabrication, cette plate-forme d’hydrogel est hautement traduisible à grande échelle. Les propriétés mécaniques et la taille du maillage des hydrogels PNP sont contrôlées en modifiant le pourcentage en poids des composants polymères et nanoparticulaires dans la formulation. Des études antérieures avec cette plate-forme indiquent que les hydrogels PNP sont hautement biocompatibles, biodégradables et non immunogènes28,30,31. Dans l’ensemble, ces hydrogels présentent une grande utilité dans les applications biomédicales englobant la prévention de l’adhérence postopératoire, l’ingénierie tissulaire et la régénération, l’administration soutenue de médicaments et l’immuno-ingénierie.
Protocole
Avant de commencer ce protocole, il est nécessaire de synthétiser HPMC-C12 et PEG-PLA en utilisant les méthodes précédemment publiées27, 28,29,30,31,36,37,38.
1. Synthèse de nanoparticules (NP) par nanoprécipitation
NOTA : Cette section décrit la synthèse d’un seul lot d’IP, produisant 250 μL d’IP à 20 % en poids dans une solution tampon (50 mg de polymère PEG-PLA sec par lot). Des notes pour augmenter le nombre de lots sont fournies aux étapes pertinentes.
- Mesurer 50 mg de polymère PEG-PLA dans un flacon de scintillation en verre de 8 mL et ajouter 1 mL d’acétonitrile. Vortex à dissoudre complètement.
REMARQUE: Pour augmenter le nombre de lots, mettez à l’échelle linéairement cette étape et ajoutez la quantité totale de polymère et de solvant nécessaire dans un seul flacon. - Ajouter 10 mL d’eau ultrapure dans un flacon de scintillation en verre de 20 mL avec une petite barre d’agitation. Mettez sur une plaque d’agitation réglée à 600 tr / min.
REMARQUE: Si l’étape 1.1 a été mise à l’échelle, il est toujours nécessaire d’avoir un flacon de scintillation individuel dans laquelle précipiter pour chaque lot équivalent. Par exemple, pour 200 mg de polymère dissous dans 4 mL d’acétonitrile, préparer des flacons de scintillation de 4 x 20 mL. - Pour former des IP par nanoprécipitation, ajoutez 1 mL de solution de solvant polymère goutte à goutte dans l’eau à l’aide d’une pipette de 200 μL. Remuer pendant 2 min. Le bloc PLA du PEG-PLA n’est pas soluble dans l’eau et, par conséquent, les IP à noyau-coquille s’auto-assemblent avec les blocs de PLA hydrophobes comme noyau et les blocs de PEG hydrophile comme coquille.
- Vérifiez la taille des particules par diffusion dynamique de la lumière (DLS).
REMARQUE: Cette procédure est spécifiquement écrite pour un lecteur de plaques disponible dans le commerce avec le progiciel associé (voir table des matériaux). Pour l’utilisation d’instruments de remplacement, se reporter aux méthodes de préparation des échantillons décrites par le fabricant de l’instrument.- Diluer 20 μL de solution de NP avec 80 μL d’eau ultrapure (concentration d’analyse : 1 mg/mL de PEG-PLA NP). Ajouter 30 μL par puits à une plaque noire claire de 384 puits (analyser en trois exemplaires).
- Mesurez le rayon hydrodynamique et la polydispersité de chaque échantillon à l’aide d’un lecteur de plaque DLS à l’aide d’options de protocole prédéfinies dans le progiciel. À titre d’exemple de protocole typique, définissez les paramètres de collecte de données pour acquérir des mesures 5-10 DLS d’une durée de 2-5 s par acquisition, puis signalez une taille et une distribution moyennes des particules par puits, calculées à partir du modèle de protéines globulaires. Pour former des hydrogels avec des propriétés rhéologiques cohérentes, les particules résultantes doivent avoir un diamètre hydrodynamique de 30 à 50 nm avec une polydispersité (PD) < 0,2.
REMARQUE : Si les NPs sont plus petits que souhaités, utilisez une solution d’acétonitrile à 75% / 25% de diméthylsulfoxyde (DMSO) à l’étape 1.1. L’augmentation du pourcentage de DMSO dans la solution de solvant augmentera généralement la taille des particules.
- Transférer la solution NP du flacon de scintillation de 20 mL dans un filtre centrifuge. Centrifuger à 4500 x g pendant 1 h pour concentrer la solution NP à <250 μL.
- Remettre en suspension dans le tampon désiré, tel qu’une solution saline tamponnée au phosphate (PBS), à 20 % en poids de NPs. Pipetter le contenu de l’unité filtrant centrifuge dans un tube de microcentrifugation taré ou un flacon de scintillation en verre sur un bilan massique. Utilisez une petite quantité (50-100 μL) de tampon pour rincer le filtre et assurer la collecte de tous les NPs. Ajouter un tampon pour atteindre une masse totale de 250 mg.
Remarque : lots peuvent être regroupés pendant la remise en suspension. Les solutions de stock de NP peuvent être conservées à 4 °C pendant environ 1 mois. Ne pas congeler. Pour un stockage plus long, vérifiez la taille et la polydispersité par DLS avant utilisation.
2. Formulation d’hydrogel et encapsulation de médicaments ou de cellules
NOTA : Cette section décrit la préparation de 1 mL de formulation d’hydrogel PNP 2:10, avec 2:10 désignant 2 % en poids de HPMC-C12 et 10 % en poids de NPs (12 % en poids de polymère solide total) et 88 % en poids de solution tampon, de solution de cargaison de médicament ou de suspension cellulaire. Les pourcentages de formulation peuvent être variés pour donner des hydrogels avec une gamme de propriétés mécaniques. Par exemple, des hydrogels de PNP 1:5 ont été utilisés pour les résultats expérimentaux de décantation et de viabilité cellulaires présentés.
- Préparer une solution mère de 6 % en poids de HPMC-C12 dans du PBS (ou un autre tampon de choix). Dissoudre pendant 48 h pour s’assurer que le polymère est complètement dispersé.
REMARQUE: La solution mère HPMC-C12 est stable pendant des mois à température ambiante. Cependant, le stockage à 4 °C est recommandé pour inhiber la croissance microbienne. - Ajouter 333 mg de solution mère HPMC-C12 à 6 % en poids dans une seringue à verrouillage Luer de 1 mL.
- Ajouter 500 μL de solution mère np à 20 % en poids dans un tube à microcentrifugation. Ajouter 167 μL de PBS et pipette pour mélanger. À l’aide d’une aiguille, remplissez une autre seringue Luer de 1 mL avec la solution np diluée.
NOTA : Pour charger la cargaison de drogue, calculer la concentration finale désirée de la drogue dans l’hydrogel et charger la quantité appropriée dans les 167 μL de PBS qui est mélangé avec les IP. Si une sonde moléculaire est nécessaire pour un essai in situ, par exemple pour surveiller la stabilité du médicament, chargez la sonde de la même manière que celle décrite ci-dessus pour le chargement de la cargaison de médicament. Pour charger les cellules, calculer la concentration finale souhaitée dans l’hydrogel et charger le nombre approprié de cellules dans les 167 μL de PBS qui sont mélangés avec les PN. - Mélanger les deux composants hydrogel (HPMC-C12 et NPs) à l’aide d’un procédé de mélange coude35.
- Fixez le connecteur du coude Luer à la seringue contenant une solution np (éventuellement contenant également une cargaison de médicament ou des cellules). Poussez la solution NP à travers le coude jusqu’à ce que le ménisque soit visible à l’extrémité ouverte. Tirez légèrement vers l’arrière et connectez la seringue contenant la solution HPMC-C12.
REMARQUE: Il est important de minimiser l’air dans la connexion du coude pour empêcher la formation et la dispersion de bulles dans tout l’hydrogel pendant le processus de mélange. Lorsque vous mélangez des cellules avec le mélangeur de coude, prenez soin de mélanger plus doucement car un mélange trop rapide peut soumettre les cellules à des forces de cisaillement élevées, conduisant à la mort cellulaire. - Pompez les deux solutions d’avant en arrière à travers le mélangeur de coude pendant environ 60 cycles jusqu’à ce qu’un matériau d’hydrogel blanc homogène et opaque se soit formé.
- Poussez tout le volume d’hydrogel dans une seringue. Retirez la seringue vide et tirez le piston sur la seringue chargée de gel pour récupérer le matériau du connecteur du coude. Capuchon avec une aiguille ou un bouchon.
REMARQUE: Il est nécessaire de tenir compte d’environ 300 μL de volume d’hydrogel perdu en raison de l’espace mort dans le processus de mélange. Par exemple, si l’on souhaite 700 μL de volume final d’hydrogel, il faut préparer 1 mL d’hydrogel. Le processus de formulation d’hydrogel peut être mis à l’échelle en utilisant des seringues plus grandes. Cependant, pour les formulations d’hydrogel rigides, telles que 2:10, il peut devenir difficile de mélanger et d’injecter à partir de seringues de plus de 3 mL en volume en raison du rapport croissant entre le canon de la seringue et le diamètre du coude ou de l’aiguille. - Conservez l’hydrogel dans la seringue à température ambiante. Toutefois, si les médicaments sont encapsulés, il est recommandé de les entreser à 4 °C, à moins que le fabricant du médicament n’en décide autrement. Ne congelez pas le matériau.
- Fixez le connecteur du coude Luer à la seringue contenant une solution np (éventuellement contenant également une cargaison de médicament ou des cellules). Poussez la solution NP à travers le coude jusqu’à ce que le ménisque soit visible à l’extrémité ouverte. Tirez légèrement vers l’arrière et connectez la seringue contenant la solution HPMC-C12.
3. Mesure des propriétés rhéologiques des formulations d’hydrogel
REMARQUE: Ce protocole est spécifiquement utilisé avec le rhéomètre commercial mentionné dans la table des matériaux avec une géométrie de plaque dentelée de 20 mm. Pour l’utilisation d’autres instruments, reportez-vous aux instructions du fabricant pour la préparation des échantillons.
- Formuler au moins 700 μL d’hydrogel PNP pour la caractérisation rhéologique.
- Injecter du matériel au centre de la plaque de rhéomètre dentelée. Le montant varie en fonction de l’écart de géométrie choisi. Pour référence, un espace de 700 μm nécessite environ 400-500 μL de matériau.
- Abaissez le rhéomètre à l’espace de coupe (500-1000 μm) et tournez lentement la plaque du rhéomètre supérieure lorsqu’elle entre en contact avec l’hydrogel PNP pour vous assurer que l’écart est rempli uniformément et complètement.
- Inspecter le chargement de l’hydrogel PNP de manière à ce qu’il couvre toute la surface de la plaque du rhéomètre. Utilisez une spatule ou une tondeuse en plastique pour couper et enlever délicatement tout excès de matière, de sorte qu’il ait un très léger renflement hors de la plaque.
- Abaissez le rhéomètre jusqu’à l’écart de géométrie final et vérifiez que l’échantillon est chargé correctement.
- Mesurez les propriétés mécaniques de l’échantillon à l’aide de tests oscillatoires, tels que des balayages d’amplitude ou de fréquence, ou de tests de débit, tels que des balayages d’écoulement ou des tests par étapes.
NOTA: Dans les données représentatives présentées, les essais d’amplitude oscillatoire sont effectués à une fréquence constante de 10 rad/s. Les balayages de fréquence oscillatoire sont exécutés à une contrainte constante de 1%, dans le régime viscoélastique linéaire du balayage d’amplitude. Les balayages d’écoulement ont été exécutés à partir de taux de cisaillement élevés à de faibles taux de cisaillement39. Tous les tests sont complétés avec 10 points par décennie de données collectées et à température ambiante. Les paramètres d’essai devront peut-être être ajustés en fonction des propriétés de la formulation. Soumettre des matériaux PNP plus rigides tels que des formulations 2:10 à des taux de cisaillement élevés peut entraîner l’éjection du matériau des plaques du rhéomètre, ce qui entraîne une caractérisation mécanique inexacte et nécessite le rechargement de l’échantillon entre les tests ultérieurs. Les données représentatives présentées ci-dessous peuvent être utilisées à des fins de comparaison pendant les essais de contrôle de la qualité.
4. Caractérisation de la libération in vitro de médicaments
- Préparer des tubes capillaires en coupant des tubes capillaires en verre à la longueur souhaitée. Scellez une extrémité de chaque tube à l’aide d’une spatule ou d’une pointe de pipette jetable pour pousser une petite quantité d’époxy à l’extrémité du tube pour former un bouchon. Laisser l’époxy se régler selon le temps recommandé par le fabricant.
NOTA : Le tube doit être plus court que la longueur de l’aiguille d’injection. Un tube de 2 à 3 μm de diamètre intérieur est recommandé de telle sorte qu’une longueur de 2,5 po contienne au moins 300 μL de volume total. - Formuler au moins 500 μL d’un matériau d’hydrogel PNP dans une seringue contenant le médicament d’intérêt. Préparez chaque groupe d’échantillons dans une seringue séparée.
- Injecter 100 à 200 μL de l’hydrogel PNP au fond de chaque tube capillaire à l’aide d’une longue aiguille hypodermique (22G, 4 pouces). Préparer au moins trois tubes (triples) par groupe d’échantillons.
- (Facultatif) Placer les tubes capillaires remplis dans un tube de centrifugation conique et centrifuger pendant 1 min à 1000 x g pour vous assurer que la surface de l’hydrogel est uniforme. Cette étape peut devoir être répétée, en modifiant le temps et la vitesse si nécessaire pour lisser la surface du matériau.
ATTENTION : Assurez-vous que la centrifugeuse est bien équilibrée. - Remplissez soigneusement 200 à 300 μL de PBS sur le dessus de l’hydrogel dans le tube capillaire à l’aide d’une seringue et d’une aiguille ou d’une pipette. Ne pas entrer en contact avec la surface de l’hydrogel ni la perturber. Sceller le tube avec un capuchon ou un bouchon ou un couvercle avec au moins deux couches de film de paraffine.
- (Facultatif) Incuber des échantillons à 37 °C pour simuler des conditions in vivo.
- Retirez soigneusement complètement le PBS de chaque capillaire, sans perturber la surface de l’hydrogel, à l’aide d’une seringue et d’une aiguille à des moments choisis en fonction de l’échelle de temps prévue de la libération du médicament. Remplacez le volume supprimé par un nouveau système de gestion du système de gestion des produits. Entreposer les aliquotes dans des conditions appropriées.
REMARQUE : Les volumes et les points de temps recommandés aux étapes 4.3, 4.5 et 4.7 peuvent être optimisés pour capturer la libération in vitro du médicament sur une plage d’échelles de temps, en fonction de la quantité de médicament chargée dans le matériau et de la vitesse à laquelle il se libère dans le surnageant. Un échantillon de points de temps sélectionnés pourrait être 6 h, 1 jour, 3 jours, 1 semaine et 2 semaines pour un médicament à libération lente. Les aliquotes peuvent également être analysées au fur et à mesure qu’elles sont acquises plutôt que stockées. - A la fin de l’étude, analyser les aliquotes avec une méthode appropriée telle que ELISA, HPLC ou test de fluorescence pour quantifier la quantité de médicament libéré à chaque point de temps40,41,42. La méthode de détection appropriée variera en fonction du médicament d’intérêt.
REMARQUE: Les études de libération in vitro sont utiles pour comparer la libération entre différentes formulations d’hydrogel ou cargaison de médicaments. L’échelle de temps de libération in vitro n’indique pas souvent directement une échelle de temps prévue de libération in vivo.
5. Caractérisation de la stabilité thermique de l’insuline encapsulée en gel
- Formuler au moins 1,2 mL d’hydrogel PNP par groupe d’échantillons. Suivant la procédure décrite à la section 2.3, charger à la fois l’insuline (cargaison de médicament) et la thioflavine T (ThT) (sonde moléculaire) dans l’hydrogel PNP.
REMARQUE: Le principal mécanisme d’agrégation et, par conséquent, d’inactivation de l’insuline est par la formation de fibrilles amyloïdes. ThT est une sonde moléculaire appropriée car elle produit un signal de fluorescence fort en présence de fibrilles amyloïdes, permettant une surveillance in situ de l’agrégation de l’insuline. Selon la cargaison de drogue d’intérêt, l’agrégation peut être surveillée par différentes méthodes. Pour les données représentatives présentées, l’insuline a été chargée à une concentration finale de 6,7 ou 10 mg/mL et le ThT à une concentration finale de 25 μM. - À l’aide d’une aiguille de 21 G, injectez 200 μL d’hydrogel PNP par puits dans une plaque noire de 96 puits. Chaque groupe d’échantillons doit être mesuré au moins en trois exemplaires. Scellez la plaque avec un joint de plaque adhésive optiquement transparent pour éviter l’évaporation.
- Insérez la plaque dans un lecteur de plaque équipé d’un contrôle de la température, d’une secousse et d’une programmation de lecture cinétique et commencez le protocole de lecture. Des données représentatives ont été acquises à l’aide d’un lecteur de plaques disponible dans le commerce (voir la table des matières) en utilisant les conditions suivantes :
- Conditions de vieillissement stressées : secousses linéaires continues (410 cpm, 5 mm) à 37 °C.
- Acquisition de données : excitation/émission 450 nm/482 nm à des intervalles de 20 minutes
REMARQUE: Si un lecteur de plaque avec des capacités de contrôle de la température, de shaker et de lecture cinétique n’est pas disponible, la plaque peut être placée sur une plaque de shaker dans un incubateur et lue manuellement à des longueurs d’onde supérieures à des points de temps sélectionnés.
- Tracer les données en tant que signal de fluorescence moyen au fil du temps pour chaque groupe. Le temps d’agrégation peut être quantifié en définissant un seuil de signal arbitraire43.
NOTA : Pour les données représentatives présentées ci-dessous, le seuil a été défini comme étant de 750 000 unités de fluorescence arbitraires (UQA). Cette valeur a été choisie pour être supérieure à la ligne de base mesurée tout en capturant suffisamment le début de l’agrégation indiqué par une forte augmentation du signal fluorescent. - Mettre fin à l’essai lorsque les échantillons s’agrègent ou commencent visuellement à se déshydrater.
6. Évaluation de la viabilité des cellules
- Formuler au moins 2 mL d’hydrogel PNP contenant la concentration cellulaire souhaitée suivant les protocoles ci-dessus (normalement 1 - 5 x 106 cellules/mL). Préparez chaque groupe d’échantillons dans une seringue séparée.
- À l’aide d’une aiguille 21G, injectez de l’hydrogel PNP de 150 μL dans chaque puits dans une plaque de 96 puits à fond clair; chaque puits est une répétition. Chaque groupe d’échantillons doit avoir 3 à 5 répétitions par point de temps. Centrifuger la plaque à 50 x g pendant 2 min pour répartir l’hydrogel uniformément dans le puits.
- Ajouter 100 μL du support cellulaire approprié sur l’hydrogel. Supprimez ce support chaque jour et ajoutez 100 μL de nouveaux médias.
- Le jour 1, retirez le support au-dessus de l’hydrogel pour les répétitions désignées pour ce point de temps pour chaque groupe d’échantillons. Ajouter 50 μL de solution de calcéine AM à 2 mM sur les hydrogels. Incuber pendant 30 min.
Remarque : Calcein AM peut être utilisé pour identifier et étiqueter les cellules vivantes. Dans les cellules vivantes, la calcéine AM non fluorescente est convertie en calcénine verte-fluorescente, par estérases intracellulaires après hydrolyse de l’ester acétoxyméthylique. - Imaginez le centre de chaque puits dans une plaque de 96 puits à l’aide d’un microscope confocal. Arpenter une zone d’au moins 300μm 2 avec une pile z couvrant au moins 150 μm. Utilisez les réglages confocaux de longueur d’onde pour capturer la fluorescence de la calcéine (excitation/émission : 495 nm/515 nm).
- Répétez les étapes 6.4 et 6.5 pour chaque point de temps suivant comme vous le souhaitez.
- Pour analyser chaque image, réduisez toutes les images z-stack en une image d’intensité maximale plane unique à l’aide de FIJI ou d’un logiciel similaire. Quantifier le nombre de cellules fluorescentes dans chaque image. Le rapport entre le nombre de cellules fluorescentes à chaque point temporel et le nombre de cellules fluorescentes au jour 1 est la viabilité relative des cellules dans les hydrogels PNP.
7. Évaluation de l’installation en cellule
- Calculer le nombre de cellules nécessaires pour formuler 500-700 μL d’hydrogel PNP à une concentration finale de 5 x 106 cellules/mL. Suspendre les cellules dans 1 mL de PBS à une concentration de 1 x 106 cellules/mL. Colorer les cellules en ajoutant 50 μL de calcine AM de 2 mM. Incuber les cellules avec le colorant pendant 10 min.
- Centrifuger les cellules aux conditions appropriées, retirer le PBS et ressusciter les cellules dans le volume de PBS nécessaire pour former 500-700 μL de l’hydrogel PNP désiré.
REMARQUE : la vitesse et la durée recommandées pour centrifuger chaque type de cellule spécifique sont généralement fournies dans la documentation du produit. - Formuler 500-700 μL d’hydrogel PNP avec les cellules colorées (5 x 106 cellules/mL) en suivant la section 2 du protocole.
- À l’aide d’une aiguille 21G, injectez 100 à 200 μL d’hydrogel PNP contenant les cellules colorées dans le fond d’une cuvette. Trois répétitions doivent être effectuées pour chaque échantillon. Déplacez l’aiguille d’avant en arrière dans la cuvette pendant l’injection pour prévenir la formation de bulles.
- Immédiatement (temps t=0), imaginez les cuvettes gisant sur le côté sur toute la zone rectangulaire de la cuvette plate à la base de la cuvette. Utilisez les fonctionnalités de numérisation de tuiles confocales pour imager toute la zone du puits et imager une z-stack en 3D sur une profondeur de 100 μm. Pour une visualisation ultérieure, utilisez le logiciel de microscope confocal pour assembler toutes les tuiles individuelles et effectuez une projection d’intensité maximale pour former une seule image de la grande surface ou utilisez le logiciel FIJI sur un ordinateur personnel44,45.
- Après l’imagerie, tenez les cuvettes debout.
- Image à 1 h et 4 h pour observer si les cellules se sont déposées dans l’hydrogel ou si elles restent en suspension.
Remarque : Ces points de temps sont des suggestions et peuvent être modifiés comme vous le souhaitez. - Pour analyser chaque image, réduisez toutes les images z-stack en une image d’intensité maximale plane unique. À l’aide de FIJI ou d’un logiciel similaire, quantifier la distribution cellulaire en mesurant l’intensité de fluorescence le long du profil vertical central de la cuvette pour déterminer le degré de décantation.
Résultats
Fabrication et caractérisation de l’hydrogel PNP
Les hydrogels PNP sont formés par le mélange des deux composants primaires - les polymères HPMC modifiés hydrophobement et les nanoparticules de PEG-PLA(Figure 1a). La cargaison thérapeutique est plus facilement incorporée dans le tampon supplémentaire utilisé pour diluer le composant nanoparticulaire avant la préparation de l’hydrogel. Pour la caractérisation biomédicale en aval, il est pratique d’utiliser une méthode de mélange de coude qui permet un mélange simple et reproductible des deux composants(figure 1b). Après un mélange adéquat, l’hydrogel doit se sentir ferme dans la seringue, mais céder sous pression et extruder à partir d’une aiguille standard (21G montré) (Figure 1c). Après l’injection, l’hydrogel doit rapidement se fixer dans un matériau solide qui résiste à l’écoulement de la gravité. Pour caractériser pleinement l’hydrogel et assurer la cohérence des produits de lot à lot, les échantillons doivent être analysés à l’aide de plusieurs expériences différentes sur un rhéomètre. Les capacités de cisaillement-amincissement et d’auto-guérison du gel seront facilement observées à l’aide d’un protocole de balayage d’écoulement et d’un protocole de cisaillement par étapes, respectivement(figure 2a,b). Pour les gels plus rigides, tels que la formulation 2:10, l’utilisateur doit rechercher une viscosité pour diminuer d’au moins deux ordres de grandeur pendant le balayage de l’écoulement car le taux de cisaillement est augmenté de 0,1 à 100 s-1, ce qui simule les conditions mécaniques lors de l’injection. Le protocole de cisaillement par étapes devrait révéler une diminution d’un ordre de grandeur de la viscosité sous les étapes de cisaillement élevé et un retour rapide (temps de récupération de <5 s) à la viscosité de base pendant les étapes de cisaillement faible. La caractérisation des modules de stockage et de perte à l’aide d’une expérience de balayage de fréquence de cisaillement oscillatoire dans le régime viscoélastique linéaire devrait révéler des propriétés de type solide à des gammes de fréquences allant de 0,1 à 100 rad s-1 (figure 2c). En particulier, il ne devrait généralement pas y avoir de croisement des modules de stockage et de perte de cisaillement observable à basse fréquence pour des formulations plus rigides comme les hydrogels 2:10. Un tel événement croisé peut indiquer des problèmes dans la qualité des matériaux de départ, soit le polymère HPMC ou PEG-PLA modifié, soit la taille et la dispersion des nanoparticules de PEG-PLA. Il convient de noter qu’un événement croisé peut être attendu pour les formulations d’hydrogel plus faibles, telles que l’hydrogel 1:5. Les balayages de l’amplitude de cisaillement oscillatoire sur les hydrogels PNP révèlent que les matériaux ne cèdent pas tant que des valeurs de contrainte élevées ne sont pas appliquées, indiquant que ces matériaux possèdent une limite d’élasticité, une quantité seuil de contrainte requise pour que le matériau s’écoule.
Caractérisation de la cinétique de libération des hydrogels de PNP
Une étape essentielle dans la conception de gels PNP pour l’administration de médicaments est la caractérisation de la cinétique de libération de médicaments à partir d’une formulation choisie. Il existe plusieurs techniques pour cela, mais une méthodologie in vitro simple fournit des données utiles lors du développement précoce de la formulation (Figure 3a). La variation de la teneur en polymère des hydrogels PNP par modulation de la quantité de HPMC-C12 ou de NPs est le moyen le plus simple d’ajuster les propriétés mécaniques et la taille du maillage de ces hydrogels, ce qui peut avoir un impact direct sur la diffusion de la cargaison à travers le réseau polymère et le taux de libération des matériaux(Figure 3b). Pour la cargaison qui est plus grande que le maillage dynamique (c.-à-d. poids moléculaire élevé ou grand rayon hydrodynamique), les chercheurs doivent s’attendre à un rejet lent et médié par la dissolution de la cargaison du dépôt d’hydrogel. Les formulations avec des maillages dynamiques supérieurs ou égaux à la taille de la cargaison permettront une libération médiée par diffusion qui peut être décrite à l’aide des modèles traditionnels de diffusion et de libération de la cargaison46,47,48,49. En fonction de la forme de la courbe de libération, les chercheurs peuvent reformuler l’hydrogel pour l’ajuster vers une libération plus lente (p. ex., augmenter la teneur en polymère) ou plus rapide (p. ex., diminuer la teneur en polymère).
Évaluation de la stabilité de la cargaison thérapeutique
Déterminer la stabilité de la cargaison thérapeutique dans une formulation d’hydrogel est essentiel avant de commencer des études précliniques ou cellulaires. Par rapport à d’autres méthodes synthétiques d’encapsulation des médicaments, les hydrogels PNP incorporent la cargaison en douceur en se mélangeant dans le matériau en vrac, et il est peu probable que l’encapsulation endommage la cargaison. Ces études indiquent que les hydrogels PNP peuvent également stabiliser la cargaison qui est sensible à l’instabilité thermique, comme l’insuline, prolongeant considérablement la durée de conservation et réduisant la dépendance à l’entreposage frigorifique et à la distribution(figure 4). Il est important d’évaluer l’état de la cargaison immédiatement après l’encapsulation dans l’hydrogel ainsi qu’après de longues périodes de stockage. Ces données montrent que l’insuline reste stable dans les hydrogels après 28 jours de stockage sous contrainte thermique et mécanique continue, en utilisant un test de fluorescence simple pour mesurer l’agrégation de l’insuline. Une autre technique pour les cas où un dosage approprié sur plaque n’est pas disponible serait d’effectuer des mesures de dichroïsme circulaire de la cargaison, ce qui est particulièrement utile pour déterminer la structure secondaire des médicaments protéiques.
Détermination de la viabilité et de la dispersion des cellules dans les hydrogels de PNP
De nombreuses cellules thérapeutiques nécessitent des motifs d’adhésion pour rester viables, et donc l’inclusion de motifs d’intégrine comme les peptides d’acide arginine-glycine-aspartique (RGD) est une étape importante dans l’adaptation des hydrogels PNP pour les thérapies cellulaires50. Le polymère modulairePEG-PLAcomprenant les PN permet la fonctionnalisation chimique de la couronne PEG par de simples chimies « clic »28,51. Dans cet exemple, des peptides RGD adhésifs cellulaires ont été attachés au polymère PEG-PLA pour favoriser l’engagement cellulaire avec la structure de l’hydrogel PNP. Les formulations dépourvues de sites d’adhésion auront une faible viabilité cellulaire car les cellules encapsulées ne prolifèrent pas par rapport aux cellules encapsulées dans des formulations avec ces motifs d’adhésion(figure 5a,b). Les cellules encapsulées peuvent être étiquetées avec de la calcéne AM ou un autre colorant fluorescent approprié (p. ex., CFSE) pour faciliter le comptage cellulaire avec un microscope à fluorescence. Au cours de l’optimisation, la viabilité doit être comparée aux hydrogels de PNP non modifiés pour s’assurer que les formulations fonctionnalisées par l’intégrine offrent une viabilité et une prolifération accrues. Si les formulations intégrin-fonctionnalisées offrent une efficacité similaire à celle des hydrogels non modifiés, cela peut indiquer un échec de la chimie de conjugaison utilisée pour incorporer les motifs d’adhésion.
Les chercheurs devraient s’attendre à ce que les cellules encapsulées soient dispersées uniformément à travers le milieu hydrogel lorsqu’ils utilisent une formulation d’hydrogel appropriée. Cela permettra un dosage cohérent et prévisible des cellules pendant l’administration d’hydrogel et devrait se traduire par une rétention locale des cellules dans l’hydrogel après l’administration. La distribution des cellules peut être facilement déterminée à l’aide de techniques de microscopie à fluorescence. Les cellules peuvent être étiquetées avec un colorant approprié, puis iées à l’aide de la microscopie confocale. Les images peuvent être évaluées visuellement(figure 5c)et aussi quantitativement(figure 5d)à l’aide du logiciel ImageJ pour mesurer l’intensité moyenne de fluorescence le long de l’axe vertical de l’image (ou le long de l’axe de stabilisation cellulaire dû à la gravité). Si la formulation d’hydrogel est trop faible pour soutenir les cellules en suspension sur des périodes prolongées, la décantation cellulaire se produira, comme observé dans la formulation 1:1 de la figure 5. L’augmentation de la teneur en polymère peut résoudre les problèmes de dispersion des cellules non homogènes dus à la décantation.
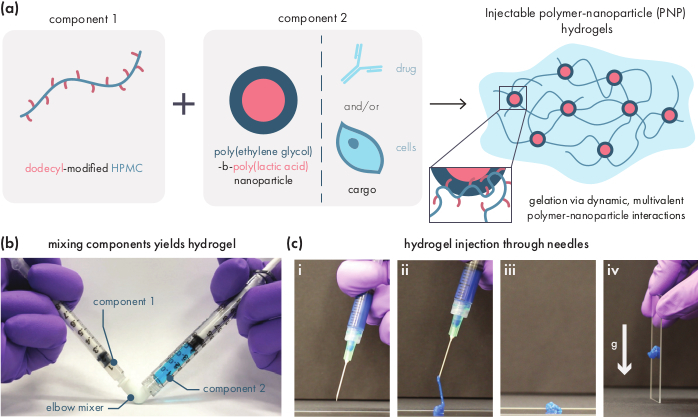
Figure 1: Leshydrogels polymères-nanoparticules (PNP) se forment facilement en mélangeant deux composants. (a) Le premier composant est une solution d’hydroxypropylméthylcellulose modifiée par dodécyle (HPMC-C12)et le second composant est une solution de nanoparticules de poly(éthylène glycol)-bloc-poly(acide lactique) (PEG-PLA) avec toute cargaison thérapeutique. Le mélange doux de ces deux composants donne un hydrogel injectable, où les polymères HPMC-C12 sont physiquement réticulés par des interactions dynamiques et multivalentes avec les nanoparticules de PEG-PLA. b)Photographie démontrant la formulation du gel par mélange avec deux seringues, chacune contenant un composant de l’hydrogel PNP. En connectant les deux seringues avec un connecteur de coude Luer-lock, les deux composants peuvent être facilement mélangés dans des conditions stériles pour donner un hydrogel sans bulles préchargé dans une seringue pour une utilisation immédiate. La solution NP est teintée en bleu à des fins de démonstration. c)Démonstration de l’injection d’hydrogels PNP et de leur re-solidification. i) Hydrogel PNP dans une seringue munie d’une aiguille 21G attachée. ii) L’injection place l’hydrogel sous cisaillement qui rompt temporairement les interactions entre le polymère et les nanoparticules, créant ainsi une consistance semblable à celle d’un fluide. (iii) Après l’injection, les interactions dynamiques polymère-nanoparticule se reforment rapidement, permettant à l’hydrogel de s’auto-guérir en un solide. iv) L’hydrogel solide ne s’écoule pas sous des forces plus faibles que sa limite d’élasticité, telles que la gravité. L’hydrogel PNP est teinté en bleu à des fins de démonstration. Veuillez cliquer ici pour voir une version plus grande de cette figure.
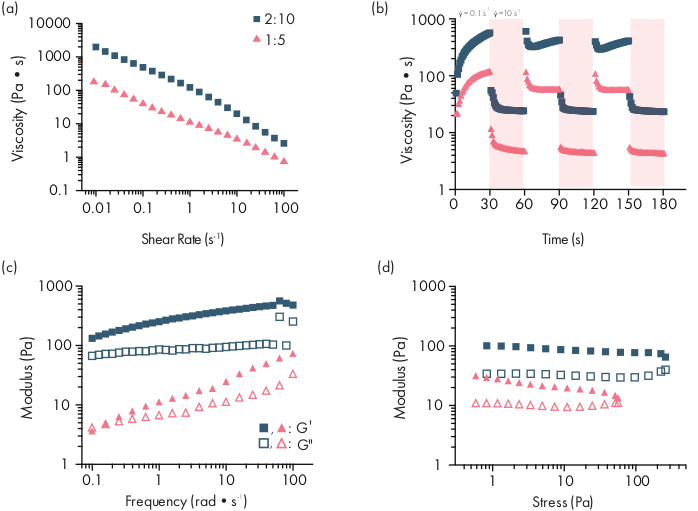
Figure 2: Caractérisation rhéologique de deux formulations d’hydrogel PNP. Les formulations sont notées polymère en poids.%: NP en poids.%. (a)Le flux de cisaillement constant balaie du taux de cisaillement faible à élevé des hydrogels PNP. La viscosité en fonction du taux de cisaillement caractérise les propriétés de cisaillement-amincissement. b)Viscosité en fonction des taux de cisaillement oscillants entre de faibles taux de cisaillement (fond blanc; 0,1 s−1)et des taux de cisaillement élevés (fond rouge; 10 s−1)démontrant les propriétés auto-cicatrisantes des hydrogels PNP. Les taux de cisaillement sont imposés pour 30 s chacun. (c)Module de stockage élastique G′et module de perte visqueux G" en fonction de la fréquence à une déformation constante de 1% pour diverses formulations d’hydrogel PNP. (d)L’amplitude balaie à une fréquence constante de 10 rad/s pour caractériser le module de stockage élastique G′et le module de perte visqueux G »des hydrogels PNP en fonction de la contrainte. Cette caractérisation rhéologique peut être utilisée comme comparaison pour le contrôle de la qualité. Ce chiffre a été adapté de Grosskopf et al.28Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
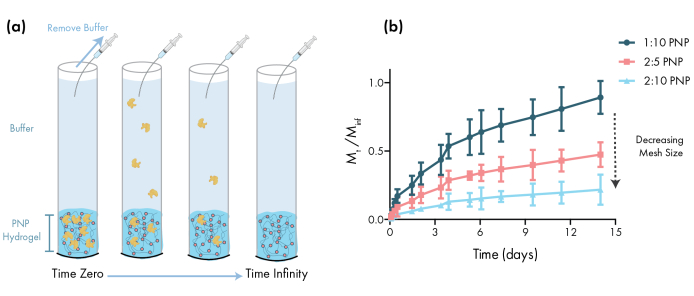
Figure 3: Libération in vitro d’albumine sérique bovine (BSA) à partir d’hydrogels PNP. Les formulations sont notées polymère en poids.%: NP en poids.%. (a) Schéma décrivant le protocole expérimental de libération in vitro. Les aliquotes sont retirées des tubes capillaires chargés d’hydrogel PNP au fil du temps. b)La libération in vitro de BSA à partir de 1:10 PNP, 2:5 PNP et 2:10 PNP rapporté comme étant la masse collectée par le point de temps spécifié divisée par la masse totale recueillie au cours de l’essai (données indiquées en moyenne ± ET; n = 3). BSA a été détecté par des mesures d’absorbance. Veuillez cliquer ici pour voir une version plus grande de cette figure.
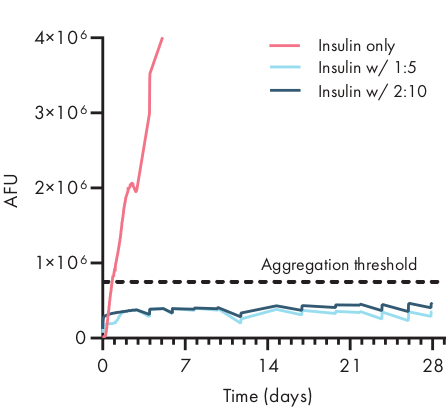
Figure 4: Stabilité thermique de l’insuline encapsulée dans des hydrogels PNP par dosage ThT. Les formulations sont notées polymère en poids.%: NP en poids.%. L’insuline encapsulée dans l’hydrogel PNP 1:5 et 2:10 est restée non aggréguée pendant plus de 28 jours à des conditions de vieillissement stressées de 37 °C et à une agitation constante. Le temps à l’agrégation pour l’insuline formulée dans pbs était 20 ± 4 h (écart-type moyen ±, seuil d’agrégation 750.000 AFU). Données présentées en moyenne de n = 4 répétitions expérimentales (AFU, unités de fluorescence arbitraires). Ce chiffre a été adapté de Meis et al.38Veuillez cliquer ici pour voir une version plus grande de cette figure.
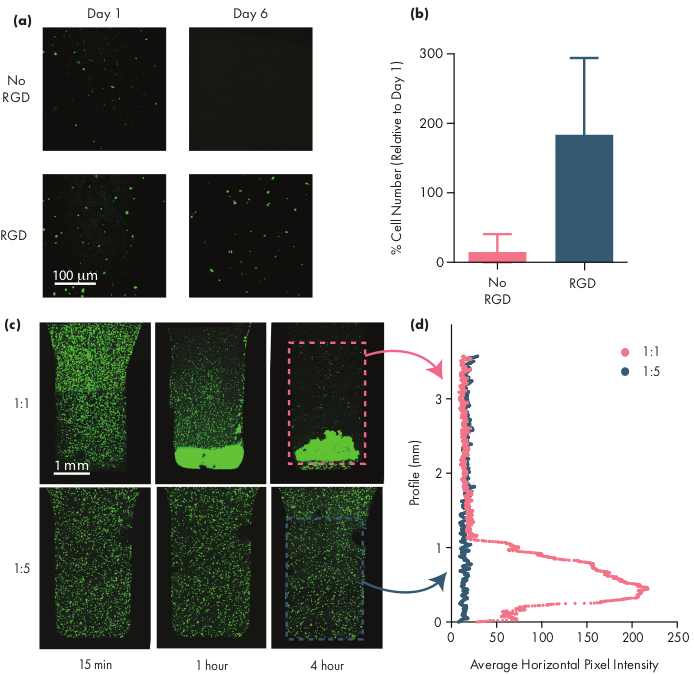
Figure 5: Viabilité cellulaire et décantation cellulaire dans les hydrogels PNP. (a,b) Études de viabilité cellulaire dans les hydrogels PNP avec des cellules souches mésenchymateuses humaines (HMSC). (a) Images représentatives de hMSCs viables dans 1:5 hydrogels de PNP avec et sans le motif cellule-adhésif d’arginine-glycine-acide aspartique (RGD) conjugué au PEG-PLA NPs. hMSCs ont été calcein-souillés pendant la minute 30 avant la formation image confocale. La barre d’échelle représente 100 μm.(b)Viabilité cellulaire au jour 6 définie comme le nombre de cellules fluorescentes dans l’image par rapport au nombre de cellules fluorescentes au jour 1 (données présentées comme moyenne ± l’écart-type; n = 3). (c,d) Expériences d’encapsulation et de règlement cellulaires avec des hMSCs. c) Images d’intensité maximale de hMSCs colorés en calcine AM encapsulés dans de l’hydrogel PNP 1:1 (rangée du haut) et de l’hydrogel PNP 1:5 (rangée du bas) sur 4 heures pour quantifier le tassement cellulaire. La barre d’échelle représente 1 mm.(d)L’intensité moyenne en pixels horizontaux des HMSC le long du profil vertical de l’hydrogel. Ce chiffre a été adapté de Grosskopf et al.28Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Les hydrogels de polymères-nanoparticules (PNP) sont facilement fabriqués et permettent l’administration locale à long terme de cellules thérapeutiques et de médicaments par administration mini-invasive par injection directe ou par cathéter. Ces protocoles décrivent la formulation des hydrogels PNP et les méthodes de caractérisation pour assurer la qualité des matériaux résultants. Les hydrogels de PNP supramoléculaires sont évolutifs à fabriquer et sont formés par le simple mélange de polymères de cellulose modifiés et de nanoparticules polymères noyau-enveloppe. Les méthodes actuelles décrivent des procédures faciles pour former des gels préchargés dans des seringues grâce à de simples protocoles de mélange de coude. Grâce à des mesures de contrôle de la qualité de chacune des composantes, telles que DLS pour surveiller la taille et la distribution np, on peut formuler de manière reproductible des matériaux d’hydrogel PNP avec des propriétés rhéologiques cohérentes. En faisant varier la quantité de HPMC-C12 ou de NPs, on peut moduler la taille du maillage et la rigidité de l’hydrogel PNP résultant. Ces propriétés peuvent être réglées pour convenir au mieux à une application biomédicale particulière, et avec les méthodes rhéologiques détaillées ici, les chercheurs peuvent caractériser les propriétés de cisaillement-amincissement et d’auto-guérison des hydrogels PNP car ils optimisent la plate-forme pour leurs applications spécifiques. Les méthodes d’études de libération in vitro sont également décrites; les chercheurs peuvent utiliser ces études pour caractériser l’échelle de temps relative de libération des médicaments d’intérêt, en éclairant les futures études in vivo. À l’aide d’études de stabilité, les chercheurs peuvent également évaluer la capacité de ces matériaux à aider à préserver la structure biologique et la stabilité des produits biothérapeutiques sensibles au fil du temps et des températures extrêmes, avec des applications potentielles convaincantes pour réduire la dépendance de la chaîne du froid des biothérapeutiques. Enfin, avec des tests de viabilité cellulaire simples, la croissance et la migration cellulaires dans les matériaux PNP peuvent être évaluées, avec des applications potentielles dans les thérapies cellulaires et les échafaudages.
Notre groupe a trouvé de nombreuses applications convaincantes pour la plate-forme d’hydrogel PNP27. Les hydrogels PNP ont été utilisés pour ralentir l’administration des vaccins sous-unitaires, permettant des profils de libération cinétique appariés d’antigènes et d’adjuvants pour augmenter l’ampleur, la durée et la qualité de la réponse immunitaire humorale31. Les hydrogels PNP se sont avérés avoir un maillage plus petit que les hydrogels les plus couramment utilisés, ils sont donc efficaces pour ralentir la diffusion et libérer lentement la cargaison moléculaire. Les propriétés uniques d’adhérence tissulaire et les propriétés mécaniques des hydrogels PNP ont également été utilisées pour former des barrières physiques afin de prévenir les adhérences résultant de la chirurgie en pulvérisant les hydrogels sur de grandes surfaces d’organes après la chirurgie30. Les hydrogels PNP se sont également avérés être des véhicules d’administration de cellules efficaces, et les propriétés mécaniques protègent en fait les cellules des forces mécaniques survenant dans l’aiguille de la seringue pendant l’injection, améliorant la viabilité cellulaire29. Lorsque les IP sont conjugués avec un peptide adhésif cellulaire, les cellules peuvent se fixer et s’engager avec la matrice PNP pour rester viables. En utilisant cette approche, il a été démontré que les hydrogels PNP améliorent la rétention locale des cellules souches injectées par rapport aux méthodes utilisant des véhicules liquides28. En outre, il a été démontré que les hydrogels PNP empêchent l’agrégation thermiquement induite de l’insuline encapsulée, même dans des conditions de vieillissement stressées sévères, ce qui suggère que ces matériaux peuvent être en mesure de réduire la nécessité de réfrigérer les médicaments sensibles à la température38.
Dans l’ensemble, les méthodologies décrites ici permettront aux groupes de recherche de fabriquer et d’explorer les hydrogels PNP en tant que biomatériaux. Ces protocoles fournissent les techniques de synthèse à l’échelle du laboratoire pour fabriquer suffisamment de matériel d’hydrogel pour poursuivre des études in vitro et in vivo. Les études décrites ci-dessus indiquent que les réticulations dynamiques de ces matériaux lui permettent d’être adapté à une gamme d’applications biomédicales en permettant la motilité active des cellules piégées tout en limitant la diffusion passive de la cargaison moléculaire. On s’attend à ce que les chercheurs trouvent la plateforme PNP un outil accessible et puissant pour améliorer les résultats cliniques grâce à l’administration contrôlée de médicaments et pour étudier les mécanismes biologiques de base tels que le recrutement cellulaire et la mécanobiologie.
Déclarations de divulgation
Ces auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été soutenue financièrement par le Center for Human Systems Immunology avec la Fondation Bill &Melinda Gates (OPP1113682) et la Fondation Bill &Melinda Gates (OPP1211043). C.M.M. a été soutenu par une bourse d’études supérieures de Stanford et la bourse William et Lynda Steere de Stanford Bio-X. A.K.G. est reconnaissant pour une bourse de recherche supérieure de la National Science Foundation et la bourse Gabilan de la bourse d’études supérieures stanford en sciences et en ingénierie. S.C. a été soutenu par le National Cancer Institute des National Institutes of Health sous le numéro de bourse F32CA247352. Les auteurs tiennent également à remercier chaleureusement les membres d’Appel Lab, y compris le Dr Gillie Roth, le Dr Anthony Yu, le Dr Lyndsay Stapleton, le Dr Hector Lopez Hernandez, le Dr Andrea d’Aquino, la Dre Julie Baillet, Céline Liong, Ben Ou, Emily Meany, Emily Gale et le Dr Anton Smith, pour les efforts et le temps qu’ils ont consacrés à aider l’Appel Lab à élaborer ces protocoles au fil des ans.
matériels
| Name | Company | Catalog Number | Comments |
| 21G needles | BD | 305165 | PNP hydrogel injection |
| 22G, 4 in hypodermic needles | Air-Tite | N224 | In vitro release studies |
| 384-well plates, black, clear bottom | Corning | 3540 | Dynamic light scattering (DLS) |
| 96-well plates, black | Fisher Scientific | 07-200-627 | Biostability studies |
| 96-well plates, clear | Corning | 3599 | Cell viability and settling studies |
| Calcein AM | Thermo Fisher Scientific | C3100MP | Cell viability and settling studies |
| Capillary tubes | McMaster-Carr | 8729K66 | In vitro release studies |
| Centrifugal filter units | Fisher Scientific | UFC901024 | NP concentration |
| Cuvettes | Millipore Sigma | BR759015-100EA | Cell viability and settling studies |
| DLS Plate Reader | Wyatt Technology | DynaPro II Plate Reader | Dynamic light scattering (DLS) |
| Epoxy | VWR International | 300007-392 (EA) | In vitro release studies |
| Hypodermic needles | Air-Tite | 8300015027 | In vitro release studies |
| Luer elbow connector | Cole-Parmer | EW-30800-12 | PNP hydrogel formulation |
| Luer lock syringe | Fisher Scientific | 14-955-456 | PNP hydrogel formulation |
| Phosphate Buffered Saline (1x) | Fisher Scientific | 10010049 | PNP hydrogel formulation |
| Plastic Spatula | Thomas Scientific | 1229F13 | Rheological characterization |
| Plate Reader | BioTek | Synergy H1 Hybrid Multi-Mode Plate Reader | Biostability studies |
| Plate seals | Excel Scientific | TS-RT2-100 | Biostability studies |
| Recombinant human insulin | Gibco | A11382II | Biostability studies |
| Rheometer | TA Instruments | DHR-2 Rheometer | Rheological characterization |
| Thioflavin T | Sigma-Aldrich | T3516-5G | Biostability studies |
Références
- Mandal, A., Clegg, J. R., Anselmo, A. C., Mitragotri, S. Hydrogels in the clinic. Bioengineering Translational Medicine. 5 (2), 10158 (2020).
- Appel, E. A., del Barrio, J., Loh, X. J., Scherman, O. A. Supramolecular polymeric hydrogels. Chemical Society Reviews. 41 (18), 6195-6214 (2012).
- Mann, J. L., Yu, A. C., Agmon, G., Appel, E. A. Supramolecular polymeric biomaterials. Biomaterials Science. 6 (1), 10-37 (2018).
- Foster, A. A., Marquardt, L. M., Heilshorn, S. C. The diverse roles of hydrogel mechanics in injectable stem cell transplantation. Current Opinion in Chemical Engineering. 15, 15-23 (2017).
- Aguado, B. A., Mulyasasmita, W., Su, J., Lampe, K. J., Heilshorn, S. C. Improving viability of stem cells during syringe needle flow through the design of hydrogel cell carriers. Tissue Engineering Part A. 18 (7-8), 806-815 (2012).
- Marquardt, L. M., Heilshorn, S. C. Design of injectable materials to improve stem cell transplantation. Current Stem Cell Reports. 2 (3), 207-220 (2016).
- Guvendiren, M., Burdick, J. A. Engineering synthetic hydrogel microenvironments to instruct stem cells. Current Opinion in Biotechnology. 24 (5), 841-846 (2013).
- Marquardt, L. M., et al. Designer, injectable gels to prevent transplanted Schwann cell loss during spinal cord injury therapy. Science Advances. 6 (14), 1039 (2020).
- Stephan, S. B., et al. Biopolymer implants enhance the efficacy of adoptive T-cell therapy. Nature Biotechnology. 33 (1), 97-101 (2015).
- Tuladhar, A., et al. Injectable hydrogel enables local and sustained co-delivery to the brain: two clinically approved biomolecules, cyclosporine and erythropoietin, accelerate functional recovery in rat model of stroke. Biomaterials. 235, 119794 (2020).
- Pakulska, M. M., Miersch, S., Shoichet, M. S. Designer protein delivery: From natural to engineered affinity-controlled release systems. Science. 351 (6279), (2016).
- Gupta, D., Tator, C. H., Shoichet, M. S. Fast-gelling injectable blend of hyaluronan and methylcellulose for intrathecal, localized delivery to the injured spinal cord. Biomaterials. 27 (11), 2370-2379 (2006).
- Verbeke, C. S., Mooney, D. J. Injectable, pore-forming hydrogels for in vivo enrichment of immature dendritic cells. Advanced Healthcare Materials. 4 (17), 2677-2687 (2015).
- Tous, E., Purcell, B., Ifkovits, J. L., Burdick, J. A. Injectable acellular hydrogels for cardiac repair. Journal of Cardiovascular Translational Research. 4 (5), 528-542 (2011).
- Zhao, X., et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing. Biomaterials. 122, 34-47 (2017).
- Johnson, T. D., Christman, K. L. Injectable hydrogel therapies and their delivery strategies for treating myocardial infarction. Expert Opinion on Drug Delivery. 10 (1), 59-72 (2013).
- Kleinman, H. K., Martin, G. R. . Seminars in Cancer Biology. , 378-386 (2005).
- Hickey, J. W., et al. Engineering an artificial T-cell stimulating matrix for immunotherapy. Advanced Materials. 31 (23), 1807359 (2019).
- Baumann, M. D., et al. An injectable drug delivery platform for sustained combination therapy. Journal of Controlled Release. 138 (3), 205-213 (2009).
- Trappmann, B., et al. Matrix degradability controls multicellularity of 3D cell migration. Nature Communications. 8 (1), 1-8 (2017).
- Figueiredo, L., et al. Assessing glucose and oxygen diffusion in hydrogels for the rational design of 3D stem cell scaffolds in regenerative medicine. Journal of Tissue Engineering and Regenerative Medicine. 12 (5), 1238-1246 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. , 1-24 (2019).
- Chaudhuri, O., et al. Substrate stress relaxation regulates cell spreading. Nature Communications. 6 (1), 1-7 (2015).
- Cai, L., Dewi, R. E., Heilshorn, S. C. Injectable hydrogels with in situ double network formation enhance retention of transplanted stem cells. Advanced Functional Materials. 25 (9), 1344-1351 (2015).
- Fisher, S. A., Baker, A. E., Shoichet, M. S. Designing peptide and protein modified hydrogels: selecting the optimal conjugation strategy. Journal of the American Chemical Society. 139 (22), 7416-7427 (2017).
- Li, R. H., Altreuter, D. H., Gentile, F. T. Transport characterization of hydrogel matrices for cell encapsulation. Biotechnology and Bioengineering. 50 (4), 365-373 (1996).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6 (6295), (2015).
- Grosskopf, A. K., et al. Injectable supramolecular polymer-nanoparticle hydrogels enhance human mesenchymal stem cell delivery. Bioengineering and Translational Medicine. 5 (1), 10147 (2020).
- Lopez Hernandez, H., Grosskopf, A. K., Stapleton, L. M., Agmon, G., Appel, E. A. Non-newtonian polymer-nanoparticle hydrogels enhance cell viability during injection. Macromolecular Bioscience. 19 (1), (2019).
- Stapleton, L. M., et al. Use of a supramolecular polymeric hydrogel as an effective post-operative pericardial adhesion barrier. Nature Biomedical Engineering. 3 (8), 611-620 (2019).
- Roth, G. A., et al. Injectable hydrogels for sustained codelivery of subunit vaccines enhance humoral immunity. ACS Central Science. , (2020).
- Steele, A. N., et al. A biocompatible therapeutic catheter-deliverable hydrogel for in situ tissue engineering. Advanced Healthcare Materials. 8 (5), 1801147 (2019).
- Fenton, O. S., et al. Injectable polymer-nanoparticle hydrogels for local immune cell recruitment. Biomacromolecules. 20 (12), 4430-4436 (2019).
- Yu, A. C., Smith, A. A., Appel, E. A. Structural considerations for physical hydrogels based on polymer-nanoparticle interactions. Molecular Systems Design & Engineering. 5 (1), 401-407 (2020).
- Wisdom, K., Chaudhuri, O., Koledova, Z. . 3D Cell Culture: Methods and Protocols. , 29-37 (2017).
- Lohmeijer, B. G., et al. Guanidine and amidine organocatalysts for ring-opening polymerization of cyclic esters. Macromolecules. 39 (25), 8574-8583 (2006).
- Cheng, J., et al. Formulation of functionalized PLGA-PEG nanoparticles for in vivo targeted drug delivery. Biomaterials. 28 (5), 869-876 (2007).
- Meis, C. M., et al. Self-assembled, dilution-responsive hydrogels for enhanced thermal stability of insulin biopharmaceuticals. ACS Biomaterials Science & Engineering. , (2020).
- Franck, A., Germany, T. Viscoelasticity and dynamic mechanical testing. TA Instruments. , (1993).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6, 6295 (2015).
- Gallastegui, A., et al. Controlled release of antibiotics from photopolymerized hydrogels: kinetics and microbiological studies. Materials Science and Engineering: C. 102, 896-905 (2019).
- Qiao, M., Chen, D., Ma, X., Liu, Y. Injectable biodegradable temperature-responsive PLGA-PEG-PLGA copolymers: synthesis and effect of copolymer composition on the drug release from the copolymer-based hydrogels. International Journal of Pharmaceutics. 294 (1-2), 103-112 (2005).
- Schlein, M. Insulin Formulation Characterization-The Thioflavin T Assays. The AAPS Journal. 19 (2), 397-408 (2017).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Sakas, G., Grimm, M., Savopoulos, A. . EUROGRAPHICS workshop on Rendering Techniques. , 51-63 (1995).
- Axpe, E., et al. A multiscale model for solute diffusion in hydrogels. Macromolecules. 52 (18), 6889-6897 (2019).
- Peppas, N., Bures, P., Leobandung, W., Ichikawa, H. Hydrogels in pharmaceutical formulations. European Journal of Pharmaceutics and Biopharmaceutics. 50 (1), 27-46 (2000).
- Ritger, P. L., Peppas, N. A. A simple equation for description of solute release I. Fickian and non-fickian release from non-swellable devices in the form of slabs, spheres, cylinders or discs. Journal of Controlled Release. 5 (1), 23-36 (1987).
- Reinhart, C. T., Peppas, N. A. Solute diffusion in swollen membranes. Part II. Influence of crosslinking on diffusive properties. Journal of Membrane Science. 18, 227-239 (1984).
- Salinas, C. N., Anseth, K. S. The influence of the RGD peptide motif and its contextual presentation in PEG gels on human mesenchymal stem cell viability. Journal of Tissue Engineering and Regenerative. 2 (5), 296-304 (2008).
- Smith, A. A., et al. Nanoparticles presenting potent TLR7/8 agonists enhance anti-PD-L1 immunotherapy in cancer treatment. Biomacromolecules. 21 (9), 3704-3712 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon