Method Article
細胞および薬物送達用途のための注射可能な高分子ポリマーナノ粒子ヒドロゲル
要約
このプロトコルは、注射可能な、上分子ポリマーナノ粒子(PNP)ヒドロゲルバイオマテリアルの合成および処方を記述する。これらの物質の薬物送達、バイオ医薬品安定化、細胞カプセル化および送達への応用が実証されている。
要約
これらの方法は、生体材料として使用するための注射可能な、上分子ポリマーナノ粒子(PNP)ヒドロゲルを処方する方法を説明する。PNPヒドロゲルは、ネットワークポリマーとして疎水性改変セルロースと、動的で多価な相互作用を通じて非共有クロスリンカーとして機能する自己組み立てコアシェルナノ粒子の2つの成分で構成されています。これらの方法は、ナノ沈降を介してこれらの自己集合ナノ粒子の形成だけでなく、調整可能な機械的特性を有するヒドロゲルを形成するための2つの成分の製剤および混合を記述する。合成された材料の品質を特徴づけるための動的光散乱(DLS)とレジロジーの使用についても詳しく説明しています。最後に、薬物の放出、バイオ医薬品安定化、および細胞のカプセル化および送達のためのこれらのヒドロゲルの有用性は、薬物放出、熱安定性、および細胞の沈降および生存率を特徴付けるインビトロ実験を通じて実証される。生体適合性、注射性、および穏やかなゲル形成条件により、このヒドロゲルシステムは、さまざまな生物医学用途に適した容易に調整可能なプラットフォームです。
概要
注射用ヒドロゲルは、制御された方法で体に治療細胞や薬物を送達するための新たなツールです 1.これらの材料は、薬物または細胞を装填することができ、表面組織への直接注射または深部組織へのカテーテル送達によって、低侵襲的な方法で投与することができる。一般に、注入可能なヒドロゲルは、一過性の物理的相互作用によって架橋される水増増ポリマーネットワークで構成されています。安静時には、これらの架橋はゲルに固体状の構造を提供するが、十分な機械的な力を印加するとこれらの架橋が一時的に破壊され、物質を液体状に変えて、容易に流れ易い2。物理的なヒドロゲルが薄く、注射中に小さな針径を流れるようにするこれらのレオロジー特性です 3.注射後、材料改質のポリマーネットワークは、自己治癒し、かつ迅速に自傷的に形成することを可能にする4、5。これらの構造は、組織再生6,7のための薬物または足場のための徐放デポとして機能することができる。これらの材料は、薬物送達技術、再生医療、および免疫工学1、8、9、10、11、12を含む多様な用途で使用されてきた。
天然素材(例えば、アルギン酸およびコラーゲン)および合成材料(例えば、ポリ(エチレングリコール)(PEG)または類似の親水性ポリマー)の両方が生体適合性の注入性ヒドロゲル材料13、14、15として開発されている。多くの天然材料は、再現性4、16に影響を与えるバッチ間の変動を示す。これらの材料は、多くの場合、温度に敏感です, 生理学的温度に達すると硬化;したがって、これらの材料を取り扱う追加の技術的および物流上の課題17.合成材料は、より精密な化学的制御と優れた再現性を可能にするが、これらの材料は、生体適合性を制限する有害な免疫応答を受ける場合があり、生体内治療用途6、18、19に対する重要な特徴である。最近の取り組みでは、機械的特性の最適化、ポリマーネットワークメッシュサイズ、生理活性分子キュー、生分解性、および材料20、21、22、23、24、25、26の免疫原性の最適化を含む、注入可能なヒドロゲル材料のエンジニアリングに関わる多くの複雑な設計基準が示されている。これらの要因はすべて、対象の用途に応じて考慮する必要があり、モジュール式で化学的に調整可能なプラットフォームは、幅広いアプリケーションを満足させるのに理想的です。
本方法は、調整可能な機械的特性、高い生体適合性および低免疫原性を示す注入可能なポリマーナノ粒子(PNP)ヒドロゲルプラットフォームの使用との製剤及び使用を記載し、生理活性分子手掛かり27、28、29、30、31、32、33を結合するための部位を提示する。これらのPNPヒドロゲルは、疎水性修飾セルロースポリマーとポリ(エチレングリコール)-ブロック-ポリ(PEG-PLA)27、34を含む自己組み立て型コアシェルナノ粒子で構成され、この相互作用を有する、過剰分子ネットワークを生成する。より具体的には、ドデシル修飾ヒドロキシプロピルメチルセルロースポリマー(HPMC-C12)は、PEG-PLAナノ粒子の表面とこれらのナノ粒子間の架橋とを動的に相互作用し、このポリマーネットワーク27,34を形成する。これらの動的な多価相互作用により、材料は注入中に薄くせん断し、投与後に急速に自己治癒する。このPNPヒドロゲル成分は、簡単なワンポット反応を経て容易に製造され、PNPヒドロゲルは、2つの成分35を簡単に混合することによって穏やかな条件下で形成される。製造の容易さのために、このヒドロゲルのプラットホームはスケールで非常に翻訳可能である。PNPヒドロゲルの機械的特性およびメッシュサイズは、製剤中のポリマーおよびナノ粒子成分の重量パーセントを変化させることによって制御される。このプラットフォームでの以前の研究は、PNPヒドロゲルが高い生体適合性、生分解性、および非免疫原性28、30、31であることを示しています。全体として、これらのヒドロゲルは、術後接着防止、組織工学および再生、持続的な薬物送達および免疫工学を含む生物医学的用途において広い有用性を示す。
プロトコル
このプロトコルを開始する前に、以前に公開された方法27、28、29、30、31、36、37、38を使用してHPMC-C12とPEG-PLAを合成する必要があります。
1. ナノ沈降によるナノ粒子(NP)合成
注:このセクションでは、1つのNPの合成について説明し、バッファ溶液(1バッチあたり50mgのドライPEG-PLAポリマー)で20重量%のNPを250 μL生成します。バッチ数のスケールアップに関する注意事項は、関連する手順で提供されています。
- PEG-PLAポリマーの50mgを8mLガラスシンチレーションバイアルに測定し、1 mLのアセトニトリルを加えます。完全に溶解する渦。
注: バッチ数を増やすには、このステップを線形的にスケールし、必要なポリマーと溶媒の総量を単一のバイアルに追加します。 - 小さな攪拌バーで20 mLガラスシンチレーションバイアルに10mLの超純水を加えます。600rpmにセットした攪拌板に置きます。
注:ステップ1.1がスケーリングされている場合、同等のバッチごとに沈殿させるために個々のシンチレーションバイアルを持っている必要があります。例えば、アセトニトリルの4 mLに溶解したポリマーの200mgについて、4 x 20 mLシンチレーションバイアルを調製する。 - ナノ沈降法によってNPを形成するには、200 μLピペットを使用して1mLのポリマー溶媒溶液を水中に滴下して添加します。2分間かき混ぜます。PEG-PLAのPLAブロックは水に溶けなくて、その結果、コアシェルNPは、コアとして疎水性PLAブロックと親水性PEGブロックをシェルとして自己組み立てます。
- ダイナミックライト散乱(DLS)で粒子サイズを確認します。
注: この手順は、関連するソフトウェア パッケージを使用して市販のプレート リーダー用に記述されています ( 資料一覧を参照)。代替機器の使用については、機器の製造元が説明するサンプル調製方法を参照してください。- 80 μLの超純水(分析濃度:1 mg/mL PEG-PLA NPs)で20 μLのNP溶液を希釈します。透明なボトムブラックの384ウェルプレートにウェルあたり30μLを加えます(三重化分析)。
- ソフトウェアパッケージのプリセットプロトコルオプションを使用して、DLSプレートリーダーを使用して、各サンプルの流体力学半径と多分散を測定します。典型的なプロトコルの例として、取得ごとに2〜5秒のDLS測定値を取得し、球状タンパク質モデルから計算されたウェル当たりの平均粒子径と分布を報告するようにデータ収集パラメータを設定します。一貫したレオロジー特性を有するハイドロゲルを形成するために、得られる粒子は、0.2<多分散性(PD)を有する流体力学的直径で30〜50nmであるべきである。
注:NPが所望より小さい場合は、ステップ1.1で75%アセトニトリル/25%ジメチルスルホキシド(DMSO)の溶液を使用してください。溶媒溶液中のDMSOの割合を大きくすると、一般に粒子サイズが大きくなる。
- 20 mL シンチレーションバイアルから遠心フィルターユニットにNP溶液を移します。遠心分離機は4500 x g で1時間、NP溶液を<250 μLに濃縮する。
- リン酸緩衝生理食塩水(PBS)などの所望の緩衝液中で再懸濁し、20重量%のNPsにピペットを用いて、遠心フィルターユニットの内容物をタール型マイクロ遠心チューブまたはガラスシンチレーションバイアルに質量バランスで浸す。少量(50~100 μL)のバッファを使用してフィルタをすすい、すべてのNPsの収集を確実にします。
注: バッチは、再中断中にプールすることができます。NPストックソリューションは、約1ヶ月間4°Cで保存することができます。フリーズしないでください。より長い保管のために、使用前にDLSによってサイズおよび多分散性を確認してください。
2. ヒドロゲル製剤および薬物または細胞のカプセル化
注:このセクションでは、2:10 PNP ヒドロゲル製剤の 1 mL の調製について説明しますが、2:10 は 2 重量% HPMC-C12 および 10 重量% NP (12 重量% 全固体ポリマー) および 88 重量% バッファー溶液、薬物貨物溶液、または細胞懸濁液を示します。製剤のパーセンテージは、機械的特性の範囲を有するヒドロゲルを得るために変化させることができる。例えば、1:5 PNPヒドロゲルを細胞沈降及び生存率実験結果に使用した。
- PBS(または選択した他のバッファー)で6重量%HPMC-C12 のストック溶液を調製する。ポリマーが十分に分散されていることを確認するために48時間溶解する。
注意:HPMC-C12 ストックソリューションは室温で数ヶ月間安定しています。しかし、微生物の増殖を阻害するために4°Cでの貯蔵が推奨される。 - 6重量%HPMC-C12 ストック溶液の333mgを1 mLルアーロックシリンジに加えます。
- マイクロ遠心チューブに20重量%のNPストック溶液の500 μLを加えます。167 μLのPBSとピペットを混ぜます。針を使用して、希釈されたNP溶液で別の1 mLルアーロックシリンジを充填します。
注:薬物貨物をロードするには、ヒドロゲル中の薬物の所望の最終濃度を計算し、NPと混合されたPBSの167 μLに適切な量をロードします。薬物安定性を監視する場合など、in situアッセイに分子プローブが必要な場合は、薬物貨物を積み込むために上記と同様の方法でプローブをロードする。細胞をロードするには、ヒドロゲル内の望ましい最終細胞濃度を計算し、適切な数の細胞を、NPと混合したPBSの167 μLにロードします。 - エルボミキシング法35を用いて、2つのヒドロゲル成分(HPMC-C12およびNPs)を混合する。
- NP溶液を含むシリンジにLuerエルボードコネクタを取り付けます(オプションで薬物貨物またはセルも含みます)。開いた端に半月板が見えるまで、NP溶液を肘に押し込みます。少し引き戻して、HPMC-C12 溶液を含むシリンジを接続します。
注: 混合プロセス中にヒドロゲル全体の気泡の形成と分散を防ぐために、肘の接続の空気を最小限に抑えることが重要です。セルを肘ミキサーと混合する場合は、あまりにも急速に混合すると細胞が高い剪断力を受け、細胞死につながる可能性があるため、より穏やかに混合するように注意してください。 - 均質で不透明な白いヒドロゲル材料が形成されるまで、2つの溶液を約60サイクル、エルボーミキサーを通して前後にポンプで送ります。
- ヒドロゲルの全容を1つのシリンジに押し込みます。空のシリンジを取り外し、ゲルに詰めたシリンジにプランジャーを引き戻し、エルボーコネクタから材料を回収します。針またはプラグでキャップ。
注:混合プロセスのデッドスペースのために失われたヒドロゲルの容積の300 μLを考慮する必要があります。例えば、最終的なヒドロゲル体積の700 μLが望まれる場合、1 mLのヒドロゲルを調製する必要があります。ヒドロゲル製剤プロセスは、より大きな注射器を使用してスケールアップすることができます。しかし、2:10のような硬質ヒドロゲル製剤の場合、シリンジバレルと肘または針の直径の比率が増加するため、体積が3mLを超える注射器から混合および注入することが困難になる可能性があります。 - ヒドロゲルを注射器に室温で保存します。ただし、薬物がカプセル化されている場合は、薬剤メーカーが別途指定しない限り、4°Cでの保管をお勧めします。材料を凍結しないでください。
- NP溶液を含むシリンジにLuerエルボードコネクタを取り付けます(オプションで薬物貨物またはセルも含みます)。開いた端に半月板が見えるまで、NP溶液を肘に押し込みます。少し引き戻して、HPMC-C12 溶液を含むシリンジを接続します。
3. ヒドロゲル製剤のレオロジー特性の測定
注:このプロトコルは、特に20ミリメートルの鋸歯状プレートジオメトリで 材料表 に記載されている商業用のレオメータで使用されます。その他の機器の使用については、製造元の説明書を参照して、サンプルの準備を行ってください。
- レオロジーの特性評価のために、PNPヒドロゲルの少なくとも700 μLを処方する。
- 鋸歯状の回転計プレートの中央に材料を注入します。この量は、選択したジオメトリギャップによって異なります。参考までに、700 μmのギャップは材料の約400-500 μLを必要とします。
- トリムギャップ(500-1000 μm)にリメーターを下げ、PNPハイドロゲルと接触する際にゆっくりと上部のレオメータープレートを回して、ギャップが均等かつ完全に埋まるようにします。
- PNPヒドロゲルの荷重を、全体のレオメータプレート表面を覆うよう点検します。スパチュラまたはプラスチックトリマーを使用して、余分な材料を優しくトリミングして取り除き、プレートから非常にわずかな膨らみを持つよう。
- 最終的なジオメトリギャップに対してレオメーターを下げ、サンプルがクリーンロードされていることを確認します。
- 振幅や周波数スイープなどの振動テストを使用してサンプルの機械的特性を測定するか、フロースイープやステップテストなどのフローテストを使用します。
注: 示されている代表的なデータでは、振動振幅検定は一定の周波数 10 rad/s で実行されます。振動周波数スイープは、振幅スイープの線形粘弾性体の中で、一定の1%の歪みで実行されます。フロースイープは、高いせん断率から低いせん断率39に実行されました。すべてのテストは、収集されたデータの10年あたり10ポイントと室温で完了します。試験パラメータは、製剤の特性に応じて調整する必要がある場合があります。2:10製剤のような硬いPNP材料を高い剪断率に供すると、材料がロメータプレートから排出され、機械的特性が不正確になり、その後のテストの間にサンプルの再ロードが必要になります。以下に示す代表的なデータは、品質管理試験中の比較に使用できます。
4. インビトロ薬物放出の特徴付け
- 望ましい長さにガラスの毛管管を切断することによって毛細管管を準備する。使い捨てのスパチュラまたはピペットチップを使用して、少量のエポキシをチューブの端に押し込み、プラグを形成して各チューブの一端をシールします。エポキシは、メーカーの推奨時間ごとに設定することができます。
メモ:チューブは注射針の長さよりも短くなければなりません。2~3 μmの内径のチューブは、2.5インチの長さに合計容積の少なくとも300 μLが含まれるようなことをお勧めします。 - 目的の薬物を含む注射器に少なくとも500μLのPNPヒドロゲル材料を配合する。各サンプルグループを別々のシリンジで準備します。
- 長い皮下注射針(22G、4インチ)を使用して、各毛管の底部にPNPヒドロゲル100-200 μLを注入します。サンプルグループごとに少なくとも3本のチューブ(三重)を用意します。
- (オプション)充填されたキャピラリーチューブを円錐遠心管に入れ、遠心分離機を1000 x g で1分間配置し、ヒドロゲルの表面が均一であることを確認します。このステップは、材料の表面を滑らかにするために必要に応じて時間と速度を変更し、繰り返す必要があります。
注意: 遠心分離機がバランスが取れていることを確認してください。 - 慎重に注射器と針またはピペットを使用してキャピラリーチューブのヒドロゲルの上にPBSの200〜300 μLを充填します。ヒドロゲルの表面に接触したり、邪魔したりしないでください。キャップまたはプラグでチューブを密封するか、パラフィンフィルムの少なくとも2つの層でカバーします。
- (オプション)37°Cでサンプルをインキュベートし、インビボの状態をシミュレートします。
- 慎重に完全に各毛細血管からPBSを除去し、ヒドロゲル表面を乱すことなく、注射器と注射針を使用して、薬物放出の予想される時間スケールに応じて選択した時点で。取り外したボリュームを新しいPBSに置き換えます。適切な条件下でアリコートを保管してください。
注:ステップ4.3、4.5、4.7の推奨されるボリュームとポイントは、材料にロードされる薬物の量と上清にどれだけ速く放出するかに応じて、さまざまなタイムスケールにわたってインビトロ薬物放出をキャプチャするように最適化することができます。選択した時点のサンプルは、徐放薬の6時間、1日、3日、1週間および2週間である可能性があります。アリコートは、保存されるのではなく、取得された時点で分析することもできます。 - 研究の完了時に、ELISA、HPLCまたは蛍光アッセイなどの適切な方法でアリコートを分析し、各時点40、41、42で放出される薬物の量を定量化する。適切な検出方法は、対象の薬剤によって異なります。
注:インビトロ放出試験は、異なるヒドロゲル製剤または薬物貨物間の放出を比較するのに有用である。in vitroリリースタイムスケールは、生体内での放出の予想時間スケールを直接示すものではありません。
5. ゲルカプセル化インスリンの熱安定性の特徴
- サンプル基あたり少なくとも1.2 mLのPNPヒドロゲルを配合する。セクション2.3に記載の手順に従って、インスリン(薬物貨物)およびチオフラビンT(ThT)(分子プローブ)の両方をPNPヒドロゲルにロードする。
注:凝集の主なメカニズム、したがって、インスリンの不活性化はアミロイド線維の形成を通じてである。ThTはアミロイド線維の存在下で強い蛍光シグナルを生成し、インシュリン凝集のその場でのモニタリングを可能にするので、適切な分子プローブである。目的の薬物貨物に応じて、凝集は異なる方法で監視することができる。示された代表的なデータについては、インスリンを6.7または10mg/mLの最終濃度にロードし、ThTを最終濃度25μMにした。 - 21 G 針を使用して、1 ウェルあたり 200 μL の PNP ヒドロゲルを黒い 96 ウェル プレートに注入します。各サンプルグループは、少なくとも三重で測定する必要があります。蒸発を防ぐために光学的に透明な接着板シール付きシールプレート。
- 温度制御、揺れ、および運動読み取りプログラミングを備えたプレートリーダーにプレートを挿入し、読み取りプロトコルを開始します。代表的なデータは、次の条件を使用して、市販のプレートリーダー(資料表を参照)で取得されました。
- ストレスエージング条件:37°Cで連続的な直線振動(410°C、5mm)。
- データ取得:20分間隔で励起/放出450 nm/482 nm
注:温度制御、シェーカー、および運動読み取り機能を備えたプレートリーダーが利用できない場合、プレートはインキュベーターのシェーカープレートに置き、選択した時点で波長以上で手動で読み取ることができます。
- 各グループの平均蛍光信号としてデータをプロットします。集約までの時間は、任意の信号閾値43を定義することによって定量化することができる。
注: 下記の代表的なデータについては、しきい値は、750,000 任意の蛍光単位(AFU)として定義されました。この値は、急激な蛍光シグナル増加によって示される凝集の発症を十分に捉えながら、測定されたベースラインを上回るように選択した。 - サンプルが凝集または視覚的に脱水を開始したときにアッセイを終了します。
6. 細胞の生存率の評価
- 上記のプロトコルに続く所望の細胞濃度を含有するPNPヒドロゲルの少なくとも2mLを処方する(通常1〜5 x 106 細胞/mL)。各サンプルグループを別々のシリンジで準備します。
- 21G針を使用して、150 μL PNP ヒドロゲルを透明な底96ウェルプレートの各ウェルに注入します。各井戸は1つの複製です。各サンプル グループには、タイム ポイントごとに 3 ~ 5 個のレプリケートが必要です。50 x g でプレートを 2 分間遠心し、ウェル内にヒドロゲルを均等に広げます。
- ヒドロゲルの上に適切な細胞培地を100μL加えます。毎日このメディアを取り出し、100 μLの新しいメディアを追加します。
- 1日目に、各サンプルグループのそのタイムポイントの指定された反復のヒドロゲルの上にあるメディアを取り外します。ヒドロゲルの上に2 mMカルセインAM溶液の50 μLを加えます。30分間インキュベートします。
注: Calcein AM は、ライブ セルを識別してラベル付けするために使用できます。生細胞において、非蛍光カルセインAMは、アセトキシメチルエステル加水分解後の細胞内エステラーゼによって緑色蛍光カルセインに変換される。 - 共焦点顕微鏡を使用して、96ウェルプレート内の各ウェルの中心を画像化します。少なくとも150 μmに及ぶzスタックを持つ少なくとも300 μm2 の領域を調査します。共焦点波長設定を使用して、カルセインの蛍光を捕捉します(励起/発光:495 nm/515 nm)。
- 必要に応じて、以降の各時点に対してステップ 6.4 と 6.5 を繰り返します。
- 各画像を解析するには、フィジーまたは同様のソフトウェアを使用して、すべてのZスタック画像を単一平面最大強度イメージに集約します。各画像の蛍光細胞数を定量化します。1日目の蛍光細胞数と比較した各時点における蛍光細胞数の比率は、PNPヒドロゲルにおける相対的な細胞生存率である。
7. 細胞のセトリングの評価
- 5 x 106 細胞/mLの最終濃度で500-700 μLのPNPヒドロゲルを処方するのに必要な細胞数を計算します。1 x 106 細胞/mLの濃度でPBSの1mLの細胞を懸濁させる。2 mMカルセインAMの50μLを加えて細胞を染色する。色素を10分間インキュベートします。
- 適切な条件で遠心分離細胞は、PBSを除去し、所望のPNPヒドロゲルの500〜700μLを形成するために必要なPBSの体積中の細胞を再懸濁する。
注: 特定のセルタイプごとに遠心分離を行う場合の推奨速度と持続時間は、通常、製品マニュアルに記載されています。 - 500-700 μL の PNP ヒドロゲルを、次のプロトコルセクション 2 の染色セル (5 x 106 細胞/mL) で配合します。
- 21G針を使用して、染色された細胞を含むPNPヒドロゲルをキュベットの底に100〜200μL注入します。各サンプルに対して 3 つの反復を実行する必要があります。泡の形成を防ぐために注入しながら、キュベット内で針を前後に動かします。
- すぐに(時間t = 0)、キュヴェットの基部にある平らなキュベット矩形領域全体にわたって彼らの側に横たわっているキュベットをイメージします。共焦点タイルスキャン機能を使用して、ウェル領域全体を画像化し、100 μmの深さにわたって3DでZスタックを画像化します。後で視覚化するために、コンフォーカル顕微鏡ソフトウェアを使用して個々のタイルをすべてつなぎ合わせ、最大強度投影を行って大面積の単一画像を形成するか、パーソナルコンピュータ44、45でFIJIソフトウェアを使用します。
- イメージングの後、キュベットを直立して立ちます。
- 1時間および4時間の画像は、細胞がヒドロゲルに落ち着いたか、またはそれらが懸濁されたままであるかどうかを観察する。
注: これらの時間ポイントは提案であり、必要に応じて変更できます。 - 各イメージを解析するには、すべての Z スタック イメージを 1 つの平面最大輝度イメージに集約します。FIJIまたは類似のソフトウェアを使用して、キュベットの中心垂直プロファイルの下の蛍光強度を測定して細胞分布を定量化し、沈降の程度を決定する。
結果
PNPヒドロゲル製造と特性評価
PNPヒドロゲルは、疎水性修飾HPMCポリマーとPEG-PLAナノ粒子の2つの主要成分の混合を介して形成される(図1a)。治療用貨物は、ヒドロゲル調製前にナノ粒子成分を希釈するために使用される追加のバッファーに最も容易に組み込まれる。下流の生物医学的特性解析では、2つの成分の簡単で再現可能な混合を可能にする肘混合法を使用すると便利です(図1b)。十分な混合後、ヒドロゲルはシリンジにしっかりと感じるべきであるが、圧力下で収率を得て、標準的な針から押し出す(図1c)。注入後、ヒドロゲルは重力からの流れに抵抗する固体状の材料に急速に設定する必要があります。ヒドロゲルを完全に特徴付け、一貫したバッチからバッチ製品を確保するために、サンプルは、レオメータ上のいくつかの異なる実験を使用して分析する必要があります。ゲルのせん断と自己修復の機能は、それぞれフロースイーププロトコルとステップシェアプロトコルを使用して容易に観察されます(図2a、b)。2:10配合などの硬いゲルの場合、注入時の機械的条件をシミュレートするせん断速度が0.1から100s-1に増加するため、フロースイープ中に少なくとも2桁の粘度を求める必要があります。ステップせん断プロトコルは、高剪断ステップ下での粘度の桁違いの減少と、低剪断ステップ中のベースライン粘度への迅速な戻り(<5s回復時間)を明らかにするべきである。線形粘弾性体の振動剪断周波数スイープ実験を用いた記憶および損失モジュリの特性評価は、0.1-100 rads-1の周波数範囲で固体状の特性を明らかにするべきである(図2c)。特に、通常、2:10ヒドロゲルのような硬質製剤の低周波数で観察可能なせん断貯蔵と損失モジュライのクロスオーバーは存在しないはずです。このようなクロスオーバーイベントは、出発物質の品質、修飾HPMCまたはPEG-PLAポリマー、またはPEG-PLAナノ粒子のサイズおよび分散性の問題を示す可能性がある。なお、クロスオーバーイベントは、1:5ヒドロゲルのようなより弱いヒドロゲル製剤に対して期待できる。PNPヒドロゲル上の振動剪断振幅スイープは、高い応力値が適用されるまで材料が降伏しないことを明らかにし、これらの材料が降伏応力を有することを示し、材料が流れるのに必要な応力の閾値量である。
PNPヒドロゲルからの放出キネティックスの特性
薬物送達のためのPNPゲルを設計する上で不可欠なステップは、選択された製剤からの薬物放出動態の特徴付けである。これにはいくつかの手法がありますが、単純な in vitro 方法論は、初期の製剤開発中に有用なデータを提供します (図 3a)。HPMC-C12またはNPsの量を調節することによってPNPヒドロゲルのポリマー含有量を変化させることは、これらのヒドロゲルの機械的特性とメッシュサイズを調整する最も簡単な方法であり、ポリマーネットワークを介した貨物の拡散および材料からの放出速度に直接影響を与える可能性がある(図3b)。動的メッシュサイズ(すなわち、高分子量または大きな流体力学的半径)よりも大きい貨物の場合、研究者はヒドロゲルデポからの貨物のゆっくりとした溶解媒介放出を期待すべきである。動的メッシュサイズが貨物のサイズ以上の製剤は、貨物拡散の従来のモデルを使用して記述することができる拡散媒介放出を可能にし、46、47、48、49。放出曲線の形状に基づいて、研究者はヒドロゲルを再配合して、より遅い(例えば、ポリマー含有量を増加させる)またはより速く(例えば、ポリマー含有量を減少させる)放出に向けて調整することができる。
治療貨物の安定性の評価
ヒドロゲル製剤中の治療貨物の安定性を決定することは、前臨床または細胞研究を開始する前に重要です。カプセル化剤の他の合成方法と比較して、PNPヒドロゲルはバルク材料に混合することによって穏やかな方法で貨物を組み込み、カプセル化が貨物を損傷する可能性は低い。これらの研究は、PNPヒドロゲルがインスリンなどの熱不安定性の影響を受けやすい貨物を安定化させることができ、貯蔵寿命を大幅に延ばし、冷蔵および流通への依存を減らすことも示している(図4)。ヒドロゲルへのカプセル化後、および長期間の保管後に、すぐに貨物の状態を評価することが重要です。これらのデータは、インスリン凝集を測定するための単純な蛍光アッセイを用いて、連続的な熱および機械的ストレスの下で28日間の貯蔵後にヒドロゲル中でインスリンが安定していることを示している。適切なプレートアッセイが利用できない場合の代替技術は、貨物の循環二色測定を行うことであり、これはタンパク質薬物の二次構造を決定するのに特に有用である。
PNPヒドロゲルにおける細胞の生存率と分散の決定
多くの治療細胞は、生存可能であり続けるために接着モチーフを必要とし、したがってアルギニン-グリシン-アスパラギン酸(RGD)ペプチドのようなインテグリンモチーフを含めることは、細胞療法のためのPNPヒドロゲルを細胞療法に適応させる上で重要なステップである50。このNPsを含むモジュラーPEG-PLAポリマーは、簡単な「クリック」化学28、51を通じてPEGコロナの化学的機能化を可能にする。この例では、細胞接着RGDペプチドをPEG-PLAポリマーに結合させ、PNPヒドロゲル構造との細胞関与を促進した。接着部位を欠いた製剤は、これらの接着モチーフを有する製剤にカプセル化された細胞と比較して、カプセル化された細胞が増殖しにくいため、細胞生存率が低い(図5a、b)。カプセル化された細胞は、カルセインAMまたは別の適切な蛍光色素(例えば、CFSE)で標識することができ、蛍光顕微鏡で細胞を計る。最適化の間、生存率は、インテグリン機能化製剤が高められた生存率および増殖を提供することを保証するために、未修飾のPNPヒドロゲルと比較されるべきである。インテグリン機能化製剤が非修飾ヒドロゲルと同様の有効性を提供している場合、これは接着モチーフを組み込むために使用される共役化学における失敗を示す可能性がある。
研究者は、適切なヒドロゲル製剤を使用する場合、封入された細胞がヒドロゲル培地を通じて均等に分散されることを期待する必要があります。これは、ヒドロゲル投与中に細胞の一貫した予測可能な投与を可能にし、投与後にヒドロゲル中の細胞の局所的な保持に翻訳する必要があります。細胞の分布は、蛍光顕微鏡技術を用いて容易に決定することができる。細胞は適切な色素で標識し、次に共焦点顕微鏡を用いて画像化することができる。画像は、画像の縦軸に沿った平均蛍光強度を測定するために ImageJ ソフトウェアを使用して視覚的に評価することができます (図 5c) (図 5d)は、画像の垂直軸に沿って蛍光強度の平均を測定します (または重力による細胞の沈降が予想される軸に沿って)。ヒドロゲル製剤が長期間にわたって懸濁液中の細胞を支持するには弱すぎると、 図5の1:1製剤で観察されるように細胞の沈降が起こる。ポリマー含有量を増加させることで、沈降による不均一な細胞分散の問題を解決できます。
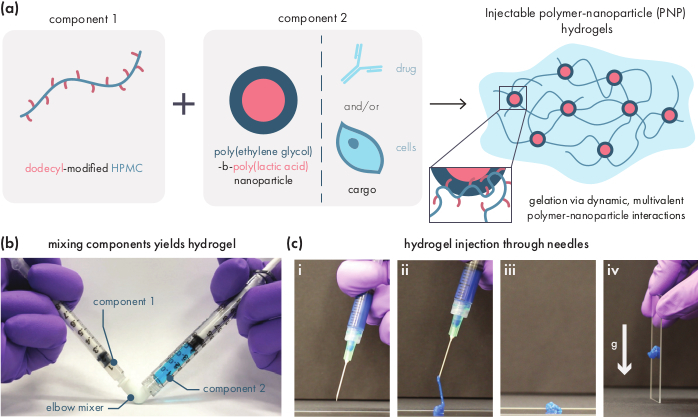
図1:ポリマーナノ粒子(PNP)ヒドロゲルは、2つの成分を混合して容易に形成される。(a)第1成分はドデシル修飾ヒドロキシプロピルメチルセルロース(HPMC-C12)の溶液であり、第2成分はポリ(エチレングリコール)-ブロック-ポリ(乳酸)(PEG-PLA)ナノ粒子と任意の治療貨物と共に溶液である。これら2つの成分の穏やかな混合は、HPMC-C12ポリマーがPEG-PLAナノ粒子との動的、多価相互作用によって物理的に架橋される注射ハイドロゲルをもたらす。(b)2つの注射器と混合してゲル製剤を示す写真、それぞれ1個がPNPヒドロゲルの1成分を含む。2つのシリンジをLuer-lock肘コネクタと接続することで、2つの成分を無菌条件下で容易に混合し、すぐに使用するために注射器にあらかじめロードされた気泡のないヒドロゲルを得ることができます。NP溶液はデモのために青色に染めます。(c)PNPヒドロゲルの注入とその再凝固のデモンストレーション。(i)21G針を付けた注射器中のPNPヒドロゲル。(ii) 注入は、ポリマーとナノ粒子の相互作用を一時的に破壊するシアー下にヒドロゲルを配置し、流体のような一貫性を作り出す。(iii)ポストインジェクションは、動的ポリマーナノ粒子相互作用を急速に改変し、ヒドロゲルを固体に自己治癒することを可能にする。(iv)固体ヒドロゲルは重力などの降伏応力よりも弱い力下で流れません。PNPヒドロゲルはデモのために青く染める。この図の大きなバージョンを表示するには、ここをクリックしてください。
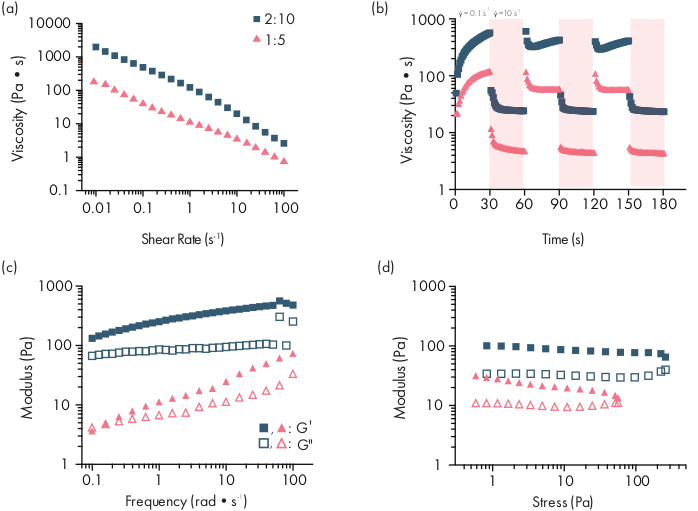
図2:2つのPNPハイドロゲル製剤のレオロジー特性製剤は、ポリマーwt%として表される。:NP wt.%。() PNP ヒドロゲルの低い剪断速度から高いせん断速度に安定したせん断流が掃引される。せん断速度の関数としての粘度は、せん断間の特性を特徴付けます。(b) 低剪断速度(白い背景;0.1s−1)から高剪断率(赤の背景;10s−1)の間の振動剪断率の関数としての粘度は、PNPヒドロゲルの自己治癒特性を示す。せん断料金はそれぞれ30 sに課されます。(c)様々なPNPヒドロゲル製剤のための一定1%株での周波数の関数として弾性記憶弾性G′および粘性損失係数G"。(d) 振幅スイープは、10のrad/sの一定の周波数でスイープし、ストレスの関数としてPNPヒドロゲルの弾性記憶弾性率G'および粘性損失係数G"を特徴付ける。このレオロジー特性は、品質管理の比較として使用できます。この図は、Grosskopfら28より大きなバージョンのこの図を表示するには、ここをクリックしてください。
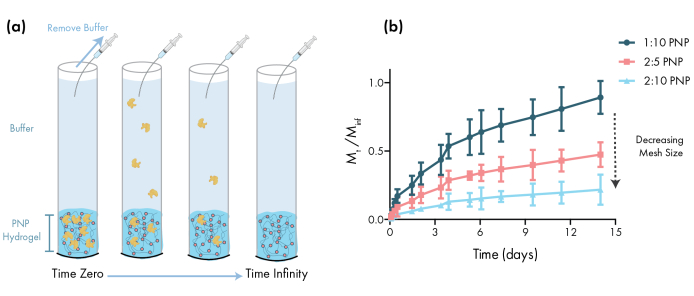
図3:PNPヒドロゲルからのウシ血清アルブミン(BSA)のインビトロ放出製剤は、ポリマーwt%として表される。:NP wt.%。() 実験in vitroリリースプロトコルを記述する回路図。アリコートは、PNPヒドロゲルにロードされた毛細管チューブから時間の経過とともに除去される。(b) BSAの1:10 PNP、2:5 PNPおよび2:10 PNPからのインビトロ放出は、アッセイ中に収集された総質量で割った指定された時点で収集された質量として報告された(平均±SDとして示されるデータ;n = 3)。BSAは吸光度測定を通じて検出された。この図の大きなバージョンを表示するには、ここをクリックしてください。
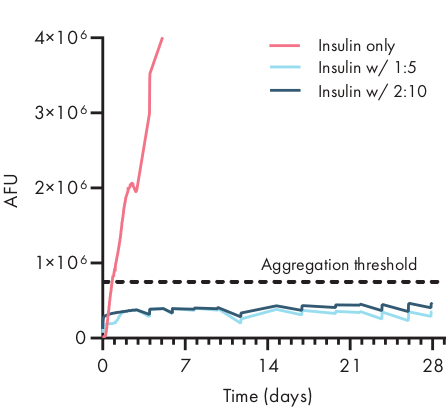
図4:ThTアッセイによりPNPヒドロゲルに封入されたインスリンの熱安定性 製剤は、ポリマーwt%として表される。:NP wt.%。1:5および2:10の両方でカプセル化されたインスリンは、37°Cのストレス老化状態および一定の攪拌において28日以上にわたって無凝集したままでした。PBSで製剤化されたインスリンに対する凝集時間は20±4時間であった(平均 ±SD、アグリゲーション閾値750,000 AFU)。 n=4 実験複製(AFU、任意の蛍光単位)の平均として提示されるデータ。この図はMeisらから適応されています38この図の大きなバージョンを表示するには、ここをクリックしてください。
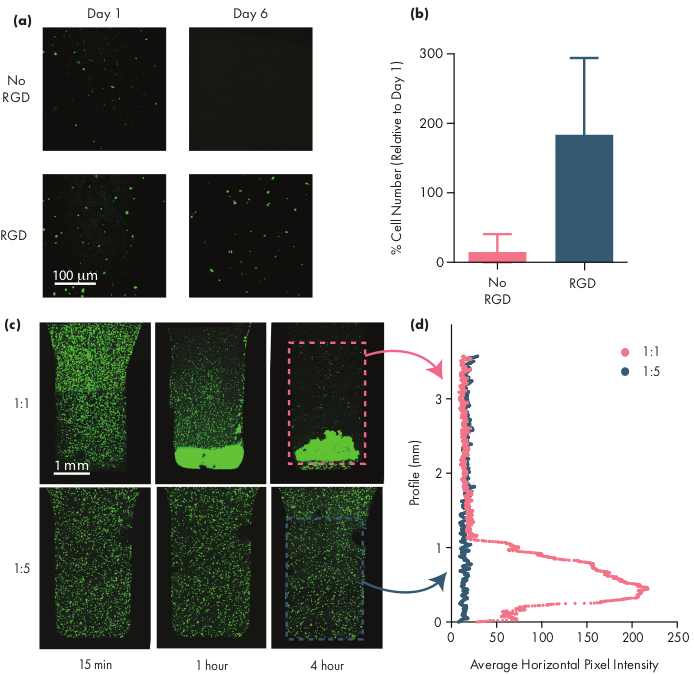
図5:PNPヒドロゲルにおける細胞生存率および細胞沈降性(a,b)ヒト間葉系幹細胞(hMSC)を有するPNPヒドロゲルにおける細胞生存率試験。(a)細胞接着アルギニングリシンアスパラギン酸(RGD)モチーフをPEG-PLA NPsに結合させた細胞接着アルギニン-グリシンアスパラギン酸(RGD)モチーフの有無を問わず、1:5 PNPヒドロゲル中の生存可能なhMSCの代表的な画像は、共焦点イメージングの前に30分間カルセイン染色された。スケールバーは100μm(b)6日目の細胞生存率を、1日目の蛍光細胞数に対する画像内の蛍光細胞数として定義(SD±平均値として示すデータ)n = 3)。(c,d)hMSCを用いた細胞カプセル化および沈降実験(c) セルセトリングを定量化するために、1:1 PNPヒドロゲル(上段)および1:5 PNPヒドロゲル(下段)にカプセル化されたカルセインAM染色hMCSの最大強度画像。スケールバーは、ヒドロゲルの垂直プロファイルに沿ったhMSCの平均水平ピクセル強度を1mm(d)で表します。この図は、Grosskopfら28より大きなバージョンのこの図を表示するには、ここをクリックしてください。
ディスカッション
ポリマーナノ粒子(PNP)ヒドロゲルは、容易に製造され、直接注射またはカテーテル送達を介して低侵襲投与を通じて治療細胞および薬物の長期局所送達を可能にする。これらのプロトコルは、PNPヒドロゲルの処方と、得られた材料の品質を保証するための特性評価方法を記述する。上分子PNPヒドロゲルは製造にスケーラブルであり、改変セルロースポリマーとポリマーコアシェルナノ粒子の簡単な混合によって形成されます。本手法は、簡単な肘混合プロトコルを介して注射器にあらかじめロードされたゲルを形成する簡単な手順を説明する。NPサイズと分布を監視するDLSなどの各コンポーネント部品の品質管理メトリックを通じて、一貫したレオロジー特性を持つPNPヒドロゲル材料を再現的に作り出すことができます。HPMC-C12またはNPの量を変化させることによって、1つは得られるPNPヒドロゲルのメッシュサイズおよび剛性を調節することができる。これらの特性は、特定の生物医学的用途に最も適するように調整することができ、ここで詳述されているレオロジー的方法を使用すると、研究者はPNPヒドロゲルのせん断薄化および自己治癒特性を特徴付けることができ、特定の用途に合わせてプラットフォームを最適化することができます。in vitro リリース研究の方法も説明されています。研究者は、これらの研究を使用して、関心のある薬物の放出の相対的なタイムスケールを特徴付けることができ、将来のインビボ研究に知らせる。安定性試験を用いて、研究者は、これらの材料の能力を評価して、時間と極端な温度の経過とともに敏感なバイオ医薬品の生物学的構造と安定性を維持するのに役立ち、バイオ医薬品のコールドチェーン依存性を低下させる魅力的な潜在的な用途を有する。最後に、簡単な細胞生存アッセイを用いて、PNP材料内の細胞増殖および移動を評価することができ、細胞療法および足場における潜在的な用途を有する。
私たちのグループは、PNPハイドロゲルプラットフォーム27のための多くの魅力的なアプリケーションを発見しました.PNPヒドロゲルは、サブユニットワクチンの遅い送達のために使用されており、抗原およびアジュバントの一致した運動放出プロファイルを可能にして、体液性免疫応答31の大きさ、持続時間、および品質を高める。PNPヒドロゲルは、最も一般的に使用されるヒドロゲルよりもメッシュサイズが小さいことが判明しているので、拡散を遅くし、ゆっくりと分子貨物を放出するのに効果的です。PNPヒドロゲルの独特な組織付着特性および機械的特性は、手術後の臓器の大きな表面積にヒドロゲルを噴霧することによって手術から生じる癒着を防ぐために物理的障壁を形成するために利用されている30。PNPヒドロゲルは、効果的な細胞送達車であることが示されており、また、機械的特性は、実際に注射中に注射針に生じる機械的力から細胞を遮蔽し、細胞生存率29を向上させる。NPが細胞接着ペプチドと共役する場合、細胞はPNPマトリックスを結合して係合して生存可能なままにすることができます。この手法を用いて、PNPヒドロゲルは、液体車28を用いた方法と比較して、注入幹細胞の局所保持を改善することが示されている。さらに、PNPヒドロゲルは、カプセル化されたインスリンの熱誘起凝集を防止することが示されており、過酷なストレスエージング条件下でも、これらの材料が温度感受性薬物38を冷蔵する必要性を低減することができる可能性があることを示唆している。
全体として、ここで説明する方法論は、研究グループが生体材料としてPNPヒドロゲルを製造し、探求することを可能にする。これらのプロトコルは、インビトロおよびインビボ研究の両方を追求するのに十分なヒドロゲル材料を製造するためのラボスケール合成技術を提供します。上記の研究は、これらの材料の動的架橋が、分子貨物の受動的拡散を制限しながら、生体内細胞の活動的な運動性を可能にすることにより、生物医学的用途の範囲に適していることを示している。研究者は、PNPプラットフォームが制御された薬物送達を通じて臨床結果を改善し、細胞の採用やメカノバイオロジーなどの基本的な生物学的メカニズムを研究するためのアクセス可能で強力なツールを見つけることが期待されています。
開示事項
これらの著者は開示するものは何もありません。
謝辞
この研究は、ビル&メリンダ・ゲイツ財団(OPP1113682)とビル&メリンダ・ゲイツ財団(OPP1211043)と人間システム免疫学センターによって財政的に支援されました。C.M.Mは、スタンフォード大学大学院フェローシップとスタンフォードバイオXウィリアムとリンダ・スティーア・フェローシップによってサポートされました。A.K.G.は、国立科学財団大学院研究フェローシップとスタンフォード大学理工学大学院フェローシップのガビランフェローシップに感謝しています。S.Cは、国立衛生研究所の国立がん研究所の支援を受け、F32CA247352賞を受賞しました。著者らはまた、ギリー・ロス博士、アンソニー・ユー博士、リンゼイ・ステープルトン博士、ヘクター・ロペス・ヘルナンデス博士、アンドレア・ダキーノ博士、ジュリー・バイレット博士、セリーヌ・ライオン、ベン・オウ、エミリー・ミーニー、エミリー・ゲイル、アントン・スミス博士を含むアッペル・ラボのメンバーが長年にわたってこれらのプロトコルを開発するのを助ける努力と時間を温かく認めたいと考えています。
資料
| Name | Company | Catalog Number | Comments |
| 21G needles | BD | 305165 | PNP hydrogel injection |
| 22G, 4 in hypodermic needles | Air-Tite | N224 | In vitro release studies |
| 384-well plates, black, clear bottom | Corning | 3540 | Dynamic light scattering (DLS) |
| 96-well plates, black | Fisher Scientific | 07-200-627 | Biostability studies |
| 96-well plates, clear | Corning | 3599 | Cell viability and settling studies |
| Calcein AM | Thermo Fisher Scientific | C3100MP | Cell viability and settling studies |
| Capillary tubes | McMaster-Carr | 8729K66 | In vitro release studies |
| Centrifugal filter units | Fisher Scientific | UFC901024 | NP concentration |
| Cuvettes | Millipore Sigma | BR759015-100EA | Cell viability and settling studies |
| DLS Plate Reader | Wyatt Technology | DynaPro II Plate Reader | Dynamic light scattering (DLS) |
| Epoxy | VWR International | 300007-392 (EA) | In vitro release studies |
| Hypodermic needles | Air-Tite | 8300015027 | In vitro release studies |
| Luer elbow connector | Cole-Parmer | EW-30800-12 | PNP hydrogel formulation |
| Luer lock syringe | Fisher Scientific | 14-955-456 | PNP hydrogel formulation |
| Phosphate Buffered Saline (1x) | Fisher Scientific | 10010049 | PNP hydrogel formulation |
| Plastic Spatula | Thomas Scientific | 1229F13 | Rheological characterization |
| Plate Reader | BioTek | Synergy H1 Hybrid Multi-Mode Plate Reader | Biostability studies |
| Plate seals | Excel Scientific | TS-RT2-100 | Biostability studies |
| Recombinant human insulin | Gibco | A11382II | Biostability studies |
| Rheometer | TA Instruments | DHR-2 Rheometer | Rheological characterization |
| Thioflavin T | Sigma-Aldrich | T3516-5G | Biostability studies |
参考文献
- Mandal, A., Clegg, J. R., Anselmo, A. C., Mitragotri, S. Hydrogels in the clinic. Bioengineering Translational Medicine. 5 (2), 10158 (2020).
- Appel, E. A., del Barrio, J., Loh, X. J., Scherman, O. A. Supramolecular polymeric hydrogels. Chemical Society Reviews. 41 (18), 6195-6214 (2012).
- Mann, J. L., Yu, A. C., Agmon, G., Appel, E. A. Supramolecular polymeric biomaterials. Biomaterials Science. 6 (1), 10-37 (2018).
- Foster, A. A., Marquardt, L. M., Heilshorn, S. C. The diverse roles of hydrogel mechanics in injectable stem cell transplantation. Current Opinion in Chemical Engineering. 15, 15-23 (2017).
- Aguado, B. A., Mulyasasmita, W., Su, J., Lampe, K. J., Heilshorn, S. C. Improving viability of stem cells during syringe needle flow through the design of hydrogel cell carriers. Tissue Engineering Part A. 18 (7-8), 806-815 (2012).
- Marquardt, L. M., Heilshorn, S. C. Design of injectable materials to improve stem cell transplantation. Current Stem Cell Reports. 2 (3), 207-220 (2016).
- Guvendiren, M., Burdick, J. A. Engineering synthetic hydrogel microenvironments to instruct stem cells. Current Opinion in Biotechnology. 24 (5), 841-846 (2013).
- Marquardt, L. M., et al. Designer, injectable gels to prevent transplanted Schwann cell loss during spinal cord injury therapy. Science Advances. 6 (14), 1039 (2020).
- Stephan, S. B., et al. Biopolymer implants enhance the efficacy of adoptive T-cell therapy. Nature Biotechnology. 33 (1), 97-101 (2015).
- Tuladhar, A., et al. Injectable hydrogel enables local and sustained co-delivery to the brain: two clinically approved biomolecules, cyclosporine and erythropoietin, accelerate functional recovery in rat model of stroke. Biomaterials. 235, 119794 (2020).
- Pakulska, M. M., Miersch, S., Shoichet, M. S. Designer protein delivery: From natural to engineered affinity-controlled release systems. Science. 351 (6279), (2016).
- Gupta, D., Tator, C. H., Shoichet, M. S. Fast-gelling injectable blend of hyaluronan and methylcellulose for intrathecal, localized delivery to the injured spinal cord. Biomaterials. 27 (11), 2370-2379 (2006).
- Verbeke, C. S., Mooney, D. J. Injectable, pore-forming hydrogels for in vivo enrichment of immature dendritic cells. Advanced Healthcare Materials. 4 (17), 2677-2687 (2015).
- Tous, E., Purcell, B., Ifkovits, J. L., Burdick, J. A. Injectable acellular hydrogels for cardiac repair. Journal of Cardiovascular Translational Research. 4 (5), 528-542 (2011).
- Zhao, X., et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing. Biomaterials. 122, 34-47 (2017).
- Johnson, T. D., Christman, K. L. Injectable hydrogel therapies and their delivery strategies for treating myocardial infarction. Expert Opinion on Drug Delivery. 10 (1), 59-72 (2013).
- Kleinman, H. K., Martin, G. R. . Seminars in Cancer Biology. , 378-386 (2005).
- Hickey, J. W., et al. Engineering an artificial T-cell stimulating matrix for immunotherapy. Advanced Materials. 31 (23), 1807359 (2019).
- Baumann, M. D., et al. An injectable drug delivery platform for sustained combination therapy. Journal of Controlled Release. 138 (3), 205-213 (2009).
- Trappmann, B., et al. Matrix degradability controls multicellularity of 3D cell migration. Nature Communications. 8 (1), 1-8 (2017).
- Figueiredo, L., et al. Assessing glucose and oxygen diffusion in hydrogels for the rational design of 3D stem cell scaffolds in regenerative medicine. Journal of Tissue Engineering and Regenerative Medicine. 12 (5), 1238-1246 (2018).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. , 1-24 (2019).
- Chaudhuri, O., et al. Substrate stress relaxation regulates cell spreading. Nature Communications. 6 (1), 1-7 (2015).
- Cai, L., Dewi, R. E., Heilshorn, S. C. Injectable hydrogels with in situ double network formation enhance retention of transplanted stem cells. Advanced Functional Materials. 25 (9), 1344-1351 (2015).
- Fisher, S. A., Baker, A. E., Shoichet, M. S. Designing peptide and protein modified hydrogels: selecting the optimal conjugation strategy. Journal of the American Chemical Society. 139 (22), 7416-7427 (2017).
- Li, R. H., Altreuter, D. H., Gentile, F. T. Transport characterization of hydrogel matrices for cell encapsulation. Biotechnology and Bioengineering. 50 (4), 365-373 (1996).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6 (6295), (2015).
- Grosskopf, A. K., et al. Injectable supramolecular polymer-nanoparticle hydrogels enhance human mesenchymal stem cell delivery. Bioengineering and Translational Medicine. 5 (1), 10147 (2020).
- Lopez Hernandez, H., Grosskopf, A. K., Stapleton, L. M., Agmon, G., Appel, E. A. Non-newtonian polymer-nanoparticle hydrogels enhance cell viability during injection. Macromolecular Bioscience. 19 (1), (2019).
- Stapleton, L. M., et al. Use of a supramolecular polymeric hydrogel as an effective post-operative pericardial adhesion barrier. Nature Biomedical Engineering. 3 (8), 611-620 (2019).
- Roth, G. A., et al. Injectable hydrogels for sustained codelivery of subunit vaccines enhance humoral immunity. ACS Central Science. , (2020).
- Steele, A. N., et al. A biocompatible therapeutic catheter-deliverable hydrogel for in situ tissue engineering. Advanced Healthcare Materials. 8 (5), 1801147 (2019).
- Fenton, O. S., et al. Injectable polymer-nanoparticle hydrogels for local immune cell recruitment. Biomacromolecules. 20 (12), 4430-4436 (2019).
- Yu, A. C., Smith, A. A., Appel, E. A. Structural considerations for physical hydrogels based on polymer-nanoparticle interactions. Molecular Systems Design & Engineering. 5 (1), 401-407 (2020).
- Wisdom, K., Chaudhuri, O., Koledova, Z. . 3D Cell Culture: Methods and Protocols. , 29-37 (2017).
- Lohmeijer, B. G., et al. Guanidine and amidine organocatalysts for ring-opening polymerization of cyclic esters. Macromolecules. 39 (25), 8574-8583 (2006).
- Cheng, J., et al. Formulation of functionalized PLGA-PEG nanoparticles for in vivo targeted drug delivery. Biomaterials. 28 (5), 869-876 (2007).
- Meis, C. M., et al. Self-assembled, dilution-responsive hydrogels for enhanced thermal stability of insulin biopharmaceuticals. ACS Biomaterials Science & Engineering. , (2020).
- Franck, A., Germany, T. Viscoelasticity and dynamic mechanical testing. TA Instruments. , (1993).
- Appel, E. A., et al. Self-assembled hydrogels utilizing polymer-nanoparticle interactions. Nature Communications. 6, 6295 (2015).
- Gallastegui, A., et al. Controlled release of antibiotics from photopolymerized hydrogels: kinetics and microbiological studies. Materials Science and Engineering: C. 102, 896-905 (2019).
- Qiao, M., Chen, D., Ma, X., Liu, Y. Injectable biodegradable temperature-responsive PLGA-PEG-PLGA copolymers: synthesis and effect of copolymer composition on the drug release from the copolymer-based hydrogels. International Journal of Pharmaceutics. 294 (1-2), 103-112 (2005).
- Schlein, M. Insulin Formulation Characterization-The Thioflavin T Assays. The AAPS Journal. 19 (2), 397-408 (2017).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Sakas, G., Grimm, M., Savopoulos, A. . EUROGRAPHICS workshop on Rendering Techniques. , 51-63 (1995).
- Axpe, E., et al. A multiscale model for solute diffusion in hydrogels. Macromolecules. 52 (18), 6889-6897 (2019).
- Peppas, N., Bures, P., Leobandung, W., Ichikawa, H. Hydrogels in pharmaceutical formulations. European Journal of Pharmaceutics and Biopharmaceutics. 50 (1), 27-46 (2000).
- Ritger, P. L., Peppas, N. A. A simple equation for description of solute release I. Fickian and non-fickian release from non-swellable devices in the form of slabs, spheres, cylinders or discs. Journal of Controlled Release. 5 (1), 23-36 (1987).
- Reinhart, C. T., Peppas, N. A. Solute diffusion in swollen membranes. Part II. Influence of crosslinking on diffusive properties. Journal of Membrane Science. 18, 227-239 (1984).
- Salinas, C. N., Anseth, K. S. The influence of the RGD peptide motif and its contextual presentation in PEG gels on human mesenchymal stem cell viability. Journal of Tissue Engineering and Regenerative. 2 (5), 296-304 (2008).
- Smith, A. A., et al. Nanoparticles presenting potent TLR7/8 agonists enhance anti-PD-L1 immunotherapy in cancer treatment. Biomacromolecules. 21 (9), 3704-3712 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved