需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
15N CPMG 放松分散,用于研究 μs-ms 时间尺度上的蛋白质符合性动力学
摘要
在这里,详细描述了在实验室中实施的协议,通过解决方案 NMR 光谱学获取和分析 15个 N 放松分散配置文件。
摘要
蛋白质构象动力学在调节酶催化、配体结合、异质和信号方面起着基础性作用,这些都是重要的生物过程。了解结构与动力学之间的平衡如何支配生物功能是现代结构生物学的一个新领域,并引发了多项技术和方法学的发展。其中,CPMG放松分散溶液NMR方法提供了关于在μs-ms时间尺度上发生的蛋白质相符合均衡的结构、动力学和热力学的独特原子分辨率信息。在这里,该研究提出了获取和分析15N放松分散实验的详细协议。例如,显示了用于分析细菌酶 I C 端域的 μs-ms 动力学的管道。
引言
卡尔-珀塞尔·梅布姆-吉尔(CPMG)放松分散(RD)实验用于常规基础,通过溶液NMR光谱学1、2、3、4、5来描述在μs-ms时间尺度上发生的象形平衡。与其他构象动力学调查方法相比, CPMG 技术在现代 NMR 光谱仪上相对容易实现,不需要专门的样品制备步骤(即结晶、样品冻结或对齐、和/或与荧光或参数标记共价),并提供关于交换过程的构象平衡返回结构、动能和热力学信息的综合特征。为了让 CPMG 实验报告构象平衡,必须适用两个条件:(i) 观察到的 NMR 自旋必须在进行构象交换(微状态)的状态中具有不同的化学变化:(ii) 交换必须在从 ~50μs 到 ~10ms 的时间尺度上发生。在这些条件下,观察到的横向放松率 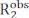 () 是内在 R2(在没有 μs-ms 动态的情况下测量的 R2)
() 是内在 R2(在没有 μs-ms 动态的情况下测量的 R2) 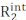 和对横向放松 (Rex)的交换贡献的总和。通过减少构成脉冲序列CPMG块的180°脉冲之间的间距,可以逐步消除对R2的研发贡献,并利用Bloch-McConnell理论对由此产生的RD曲线进行建模,以获得微态、每个微状态的微量人口和微状态之间的交换率(图1),2,3之间的化学移位差异。
和对横向放松 (Rex)的交换贡献的总和。通过减少构成脉冲序列CPMG块的180°脉冲之间的间距,可以逐步消除对R2的研发贡献,并利用Bloch-McConnell理论对由此产生的RD曲线进行建模,以获得微态、每个微状态的微量人口和微状态之间的交换率(图1),2,3之间的化学移位差异。
在15项N CPMG实验的文献中,报告了几个不同的脉冲序列和分析方案。本文介绍了在实验室中实施的协议。特别是,将采用关键步骤,准备NMR样本,建立和获取NMR实验,以及处理和分析NMR数据(图2)。为了便于将协议传输到其他实验室,脉冲程序、处理和分析脚本以及一个示例数据集作为补充文件提供,可在 (https://group.chem.iastate.edu/Venditti/downloads.html) 下载。所提供的脉冲序列在 CPMG 块中包含一个四步相周期,用于抑制偏移依赖物件 6,并编码用于获取多个交错实验。这些交错的实验有一个相同的放松期,但不同数量的重新聚焦脉冲,以实现不同的CPMG领域7。同样重要的是要注意,所述脉冲程序测量了NMR信号8的TROSY组件的15N R2。 总体而言,该议定书已成功应用于大中型蛋白质4、5、9、10的构象交换定性。对于较小的系统(<20 kDa),建议使用基于异核单量子一致性(HSQC)的脉冲序列11,12。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 准备NMR样本
- 表达并净化2H,15N-实验室的感兴趣的蛋白质样本。
注:虽然 15个 N 标记蛋白质样本可用于获取 CPMG RD 实验,但渗透(在可能的情况下)可显著提高获得数据的质量。文献13提供了生产渗透蛋白的协议。 - 缓冲区将纯化蛋白样品交换成脱气 NMR 缓冲器。
- 将 NMR 样本传输到 NMR 管中。
注:NMR样本的浓度需要仔细优化,以最大限度地提高信号与噪声比,并最大限度地减少蛋白质-蛋白质相互作用的发生。一般来说,CPMG实验的典型浓度范围为0.1-1.0m。
2. NMR实验的第一次设置
- 下载并解压 补充文件。
- 将文件位.vv 和trosy_15N_cpmg.vv(位于名为脉冲程序的文件夹中)复制到脉冲程序目录(<路径>/exp/斯坦/nmr/列表/pp/用户)。
注意:确保trosy_15N_cpmg.vv文件第一行中列出的位.vv 路径正确。 - 打开采集软件,并复制以前运行的1H-15N HSQC实验到一个新的实验使用命令edc。
- 使用命令 纸浆,将脉冲程序trosy_15N_cpmg.vv加载到新创建的实验中。
- 使用脉冲程序文件末尾提供的说明(trosy_15N_cpmg.vv)设置 CPMG 实验。
3. NMR 实验的常规设置
- 将样品引入磁铁中,执行获取任何 NMR 实验的所有基本步骤:锁定和垫住样品:匹配并调整 1个H和 15个N通道。
- 将 p1 和 p7 设置为 1H 和 15N 硬 90° 脉冲的持续时间。
注意:为了获得最佳结果,必须非常小心地校准15N 90° 脉冲。校准通常使用光谱仪手册中描述的 DMSO 中15个 N 标记尿素的 100 mM 样本完成校准。此外,还可以通过获取 1 H- 15N HSQC 频谱的第一个增量来直接检查工作 NMR样本上的校准,其中第一个 INEPT 块的15N 90° 脉冲切换到 180° 脉冲。如果校准正确,则应获得空位。 - 在采集窗口中,为 1H 和 15N 尺寸设置中心和光谱宽度。
注:以水信号频率为中心 1H频谱,以达到最佳的禁水效果。 - 设置放松延迟 (d30) 等于 0.7 T2, 其中 T2是蛋白质的预期 15N 横向放松时间.
注:d30 的价值可以通过经验进行优化以获得最佳效果。 - 使用命令vclist创建与图 1A 和图 1B中的参数 n对应的整数列表。确保列表中的每个条目与不同的 CPMG 字段(νcpmg)对应,根据νcpmg = 4 x n/ d30。请确保列表中的第一个数字为 0(这相当于跳过 CPMG 块和 d30 = 0 s 的参考实验),并且不要使用大于 1,000 x d30/ 4 的数字。大于此阈值的数字会导致νcpmg > 1 kHz,并可能损坏探头。
- 将 l8 设置为 vclist 中的条目数量,l3 设置为间接维度的实际点数(通常为 l3 设置为 64-200 的范围),1 td 等于 l8 x l3 x 2。
注意:执行步骤 3.7-3.11 以优化水抑制。 - 将接收器增益 (rg) 设置为 1;打开脉冲程序文件(edcpul),转到91行,删除 goo 999之前的分号,并保存文件。
- 使用命令 gs 调整参数 spdb0 (或 spdw0),以最大限度地降低 FID 信号的强度。
- 在脉冲程序文件的第 91 行重新引入分号并保存文件。
- 重复步骤 3.7-3.9 以优化 spdb11(脉冲程序文件的第 168 行)、spdb2(脉冲程序文件的第 179 行)和 pldb2(脉冲程序文件的第 184 行)。
- 运行命令 rga 以优化接收器增益。
- 将扫描次数(ns)设置为 8 的倍数。
- 运行命令 zg 开始实验。
4. NMR 数据的处理和分析
- 将名为 "过程 "(补充文件)的文件夹复制到包含 Ser 文件的目录中。
- 使用文件sep_fid.com和 ft2D.com 处理 NMR 数据。
注:有关如何编辑处理脚本的说明在sep_fid.com和 ft2D.com 文件中提供。 - 打开Sparky目录CPMG_Sparky_files中包含的ucsf文件。
注:ucsf文件由处理脚本创建。在vc列表中每个条目都有一个ucsf文件。第一个 ucsf 文件 (test_1.ucsf) 包含参考实验。随后的 ucsf 文件 (test_2. ucsf, test_3. ucsf,...test_n.ucsf)从最低到最大价值的νcpmg订购。 - 在参考 NMR 频谱 (test_1.ucsf) 上选择 NMR 交叉峰值。
- 使用 Sparky 命令 pa选择所有选定的跨峰。
- 运行闪闪发光的命令 rh。此命令打开对话窗口。选择 每个频谱中相同位置的选项高度。单击 "设置" 并检查所有 NMR 光谱。单击 "更新" 并保存工作目录中的输出文件。输出文件包含所有打开的 NMR 光谱的信号紧性矩阵。
注:更准确的协议,使用线形拟合恢复的强化从交错的伪-3D实验已经在文献14中描述。线形安装的免费软件可在 https://pint-nmr.github.io/PINT/ (PINT)、https://www.ucl.ac.uk/hansen-lab/fuda/ (FUDA) 以及 NMRPipe (nLinLS 模块) 和 SPARKY (它模块) 内提供。 - 对于每个 CPMG 字段,使用公式将信号强度转换为 R2 速率
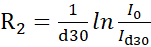 ,其中 I0 和 Id30 分别是参考强度 (vc = 0) 和放松 (vc > 0) NMR 光谱。
,其中 I0 和 Id30 分别是参考强度 (vc = 0) 和放松 (vc > 0) NMR 光谱。
注:在 补充文件中,提供了电子表格文件(R2_calc.xls)的模板,用于将信号的强化度转换为 R2 速率并可视化 RD 配置文件。 - 使用 Sparky 命令 st 阅读参考光谱中的噪声水平,并传播 R2 速率上的错误。
注:在 补充文件中,提供了用于在测量的 R2 速率上传播错误的电子表格文件 (R2_calc.xls) 模板。
5. 适合 RD 曲线
- 将名为"RD_fitting(补充文件)"的文件夹复制到工作目录中。
- 对于每个分配的 NMR 峰值,通过计算
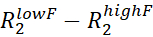 .和
.和 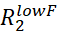
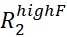 R2速率在 vclist 中的最低和最高νcpmg进行估计R ex 。
R2速率在 vclist 中的最低和最高νcpmg进行估计R ex 。
- 目视检查 Rex 大于估计误差两倍的 RD 曲线,并丢弃所有噪音太大而无法准确建模的 RD 曲线。
注:Rex 上的噪音可以从错误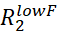 和
和 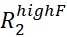 .
. - 使用 Rex 大于估计误差两倍的所有 RD 曲线为拟合脚本准备输入文件。
注:在拟合脚本中提供了有关准备输入文件的详细说明。示例输入文件作为 补充文件提供。通常,RD 数据在两个不同的静态字段中测量,并同时安装。在此协议中,需要两个不同的输入文件(补充文件)。 - 使用 补充文件中提供的脚本来安装 RD 数据。
注:提供两种不同的脚本,分别执行基于残留物或全球 RD 曲线的拟合。这两个脚本都适合使用两个站点交换模型和卡弗-里查德方程的 RD 曲线。更详细的说明在拟合脚本中提供。其他软件包,如Chemex(https://github.com/gbouvignies/ChemEx)和CATIA(https://www.ucl.ac.uk/hansen-lab/catia/)可用于使用块-麦康奈尔方程进行数据拟合。 - 测试安装参数的可靠性,估计减少 的χ 2 作为pb 和k ex的函数。
注:输出文件中提供了减少的χ 2。 pb和 kex可在拟合程序中使用下界和上限受特定值限制。在我们的脚本中,pb的下限和上限分别为磅 (2) 和 ub (2)。kex的下限和上限分别为磅 (3) 和 ub (3)。 - 估计所安装参数上的错误。这可以通过将脚本中MC_fac值设置为 1 和多次重复拟合(通常>20 重复)来完成。每个参数上的误差估计为分布的标准偏差。
注意:将MC_fac设置为 1 生成合成数据集,其中将高斯分布式错误(根据实验错误计算)添加到实验数据中。
Access restricted. Please log in or start a trial to view this content.
结果
此处描述的协议导致在 1 H- 15N TROSY频谱(图 3A)中为每个峰值获取 RD 配置文件。从收购的RD配置文件,可以估计交换贡献的15N横向放松每个骨干阿米德组(图3A,3B)。通过绘制被调查蛋白质的3D结构的R前图,可以识别在μs-ms时间尺度(图3C)上进行构造交换的结构区域。使用卡弗-里?...
Access restricted. Please log in or start a trial to view this content.
讨论
本手稿描述了在实验室中实施的协议,用于获取和分析15种 N RD 蛋白质数据。特别是,包括准备 NMR 样本、测量 NMR 数据和分析 RD 配置文件的关键步骤。下面讨论了有关研发实验的获取和分析的一些重要方面。然而,为了更深入地描述实验和数据分析,对原著文学的认真研究是强烈推荐的3、8、11、15、16。
Access restricted. Please log in or start a trial to view this content.
披露声明
所有作者都阅读并批准了手稿。我们声明没有利益冲突。
致谢
这项工作得到了来自NIGMS R35GM133488和罗伊·卡弗慈善信托基金到V.V.的资金支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Cryoprobe | Bruker | 5mm TCI 800 H-C/N-D cryoprobe | Improve sensitivity |
| Deuterium Oxide | Sigma Aldrich | 756822-1 | >99.8% pure, utilised in preparing NMR samples and deuterated cultures |
| Hand driven centrifuge | United Scientific supply | CENTFG1 | Used to remove any air bubbles or residual liquid stuck on the walls of NMR tube. |
| High Field NMR spectrometer | Bruker | Bruker Avance II 600, Bruker Avance 800 | Acquisition of the NMR data |
| MATLAB | MathWorks | https://www.mathworks.com/products/get-matlab.html | Modeling of the NMR data |
| NMR pasteur Pipette | Corning Incorporation | 7095D-NMR | Pyrex glass pastuer pipette to transfer liquid sample in NMR tube |
| NMR tube | Willmad Precision | 535-PP-7 | 5mm thin wall 7'' cylinderical glass tube |
| NMRPipe | Institute of Biosciences and Biotechnology research | https://www.ibbr.umd.edu/nmrpipe/install.html | NMR data processing |
| SPARKY | University of California, San Francisco | https://www.cgl.ucsf.edu/home/sparky/ | Analysis of the NMR data |
| Tospin 3.2 (or newer) | Bruker | https://www.bruker.com/protected/en/services/software-downloads/nmr/pc/pc-topspin.html | Acquisition Software |
参考文献
- Anthis, N. J., Clore, G. M. Visualizing transient dark states by NMR spectroscopy. Quarterly Reviews of Biophysics. 48 (1), 35-116 (2015).
- Lisi, G. P., Loria, J. P. Solution NMR spectroscopy for the study of enzyme allostery. Chemical Reviews. 116 (11), 6323-6369 (2016).
- Mittermaier, A., Kay, L. E. New tools provide new insights in NMR studies of protein dynamics. Science. 312 (5771), 224-228 (2006).
- Venditti, V., Clore, G. M. Conformational selection and substrate binding regulate the monomer/dimer equilibrium of the C-terminal domain of Escherichia coli enzyme I. Journal of Biological Chemistry. 287 (32), 26989-26998 (2012).
- Venditti, V., et al. Large interdomain rearrangement triggered by suppression of micro- to millisecond dynamics in bacterial Enzyme I. Nature Communications. 6, 5960(2015).
- Yip, G. N., Zuiderweg, E. R. A phase cycle scheme that significantly suppresses offset-dependent artifacts in the R2-CPMG 15N relaxation experiment. Journal of Magnetic Resonance. 171 (1), 25-36 (2004).
- Mulder, F. A., Skrynnikov, N. R., Hon, B., Dahlquist, F. W., Kay, L. E. Measurement of slow (micros-ms) time scale dynamics in protein side chains by (15)N relaxation dispersion NMR spectroscopy: application to Asn and Gln residues in a cavity mutant of T4 lysozyme. Journal of the American Chemical Society. 123 (5), 967-975 (2001).
- Loria, J. P., Rance, M., Palmer, A. G. 3rd A TROSY CPMG sequence for characterizing chemical exchange in large proteins. Journal of Biomolecular NMR. 15 (2), 151-155 (1999).
- Dotas, R. R., et al. Hybrid thermophilic/mesophilic enzymes reveal a role for conformational disorder in regulation of bacterial Enzyme I. Journal of Molecular Biology. 432 (16), 4481-4498 (2020).
- Purslow, J. A., et al. Active site breathing of human Alkbh5 revealed by solution NMR and accelerated molecular dynamics. Biophysical Journal. 115, 1895-1905 (2018).
- Loria, J. P., Rance, M., Palmer, A. G. 3rd A relaxation-compensated Carr−Purcell−Meiboom−Gill sequence for characterizing chemical exchange by NMR Spectroscopy. Journal of the American Chemical Society. 121 (10), 2331-2332 (1999).
- Hansen, D. F., Vallurupalli, P., Kay, L. E. An improved 15N relaxation dispersion experiment for the measurement of millisecond time-scale dynamics in proteins. Journal of Physical Chemistry B. 112 (19), 5898-5904 (2008).
- Tugarinov, V., Kanelis, V., Kay, L. E. Isotope labeling strategies for the study of high-molecular-weight proteins by solution NMR spectroscopy. Nature Protocols. 1 (2), 749-754 (2006).
- Niklasson, M., et al. Comprehensive analysis of NMR data using advanced line shape fitting. Journal of Biomolecular NMR. 69, 93-99 (2017).
- Palmer, A. G. 3rd, Kroenke, C. D., Loria, J. P. Nuclear magnetic resonance methods for quantifying microsecond-to-millisecond motions in biological macromolecules. Methods in Enzymology. 339, 204-238 (2001).
- Tollinger, M., Skrynnikov, N. R., Mulder, F. A., Forman-Kay, J. D., Kay, L. E. Slow dynamics in folded and unfolded states of an SH3 domain. Journal of the American Chemical Society. 123, 11341-11352 (2001).
- Carver, J. P., Richards, R. E. A general two-site solution for the chemical exchange produced dependence of T2 upon the Carr-Purcell pulse separation. Journal of Magnetic Resonance. 6 (1), 89-105 (1972).
- Egner, T. K., et al. Surface Contrast' NMR Reveals Non-innocent Role of Support in Pd/CeO2 Catalyzed Phenol Hydrogenation. ChemCatChem. 12 (6), 4160-4166 (2020).
- Egner, T. K., Naik, P., Nelson, N. C., Slowing, I. I., Venditti, V. Mechanistic Insight into Nanoparticle Surface Adsorption by Solution NMR Spectroscopy in an Aqueous Gel. Angewandte Chemie (International Edition in English). 56, 9802-9806 (2017).
- Tugarinov, V., Libich, D. S., Meyer, V., Roche, J., Clore, G. M. The energetics of a three-state protein folding system probed by high-pressure relaxation dispersion NMR spectroscopy. Angewandte Chemie (International Edition in English). 54, 11157-11161 (2015).
- Korzhnev, D. M., Kloiber, K., Kanelis, V., Tugarinov, V., Kay, L. E. Probing slow dynamics in high molecular weight proteins by methyl-TROSY NMR spectroscopy: application to a 723-residue enzyme. Journal of the American Chemical Society. 126 (12), 3964-3973 (2004).
- Mayzel, M., Ahlner, A., Lundstrom, P., Orekhov, V. Y. Measurement of protein backbone (13)CO and (15)N relaxation dispersion at high resolution. Journal of Biomolecular NMR. 69, 1-12 (2017).
- Pritchard, R. B., Hansen, D. F. Characterising side chains in large proteins by protonless (13)C-detected NMR spectroscopy. Nature Communications. 10, 1747(2019).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。