需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种测定谷物和豆类游离可溶性酚酸组成和抗氧化能力的广义方法
摘要
酚酸是存在于全谷物中的重要植物化学物质。它们具有生物活性特性,如抗氧化保护功能。这项工作旨在报告HPLC鉴定的广义方法,总酚含量估计以及谷物和豆类中酚酸抗氧化能力的测定。
摘要
酚酸是一类同时具有酚基和羧基的有机化合物。它们存在于谷物中,并集中在谷物的麸皮或豆类的种皮中。它们具有抗氧化特性,近年来引起了人们对其潜在的抗氧化保护健康功能的研究兴趣。这项工作提出了一种从全谷物中提取游离可溶性酚酸的广义方法,并分析了它们的抗氧化能力。使用五个全谷物样本,包括两种谷物(小麦和黄玉米)和三种豆类(豇豆,芸豆和大豆)。将谷物碾磨成面粉,并使用甲醇水溶液提取其游离可溶性酚酸。然后使用高压液相色谱仪(HPLC)鉴定化合物。Folin-Ciocalteu方法测定其总酚含量,同时使用DPPH自由基清除能力,Trolox等效抗氧化能力(TEAC)和氧自由基吸收能力(ORAC)测定测定其抗氧化能力。鉴定出的酚酸包括香草酸、咖啡酸、对香豆酸和阿魏酸。香草酸仅在豇豆中鉴定,而咖啡酸仅在芸豆中鉴定。在黄玉米、豇豆和大豆中鉴定出对香豆酸,而在所有样品中鉴定出阿魏酸。阿魏酸是确定的主要酚酸。样品中酚酸的总浓度按以下顺序下降:大豆>豇豆>黄玉米=芸豆>小麦。总抗氧化能力(DPPH,TEAC和ORAC测定值的总和)下降如下:大豆>芸豆>黄玉米=豇豆>小麦。这项研究得出结论,HPLC分析以及DPPH,TEAC和ORAC测定提供了有关全谷物酚酸组成和抗氧化特性的有用信息。
引言
酚酸是植物中研究的最重要植物化学物质之一,因为它们在植物防御食草动物和真菌感染以及维持植物组织中的结构支撑和完整性方面发挥着至关重要的作用1,2。它们在谷物的麸皮和豆类的种皮中含量丰富3.在结构上,它们分为两组:羟基苯甲酸(图1)和羟基肉桂酸(图2)。谷物和豆类中常见的羟基苯甲酸包括没食子酸、 对羟基苯甲酸、2,4-二羟基苯甲酸、原儿茶酸、香草酸和丁香酸,而常见的羟基肉桂酸包括咖啡酸、 对香豆酸、阿魏酸和芥子酸3。酚酸还具有抗氧化特性,因为它们能够清除导致脂肪氧化酸败的自由基,并在生理系统中启动和传播自由基诱导的氧化应激4,5。由于作为抗氧化剂的这种重要的生理作用,它们是最近研究的主题。这是因为当作为植物性食物的成分食用时,它们可以发挥抗氧化保护作用。
谷物和谷物制品是全世界人类和动物的主要碳水化合物食物来源6.谷物包括小麦,大米,玉米(玉米),大麦,小黑麦,小米和高粱。其中,玉米是利用量最大的,2019/2020年全球利用率估计为11.357亿吨,其次是小麦,同期全球估计利用率为7.575亿吨。谷物食品是消费者的重要能量来源,因为它们是碳水化合物的丰富来源。它们还提供一些蛋白质,脂肪,纤维,维生素和矿物质6。除了它们的营养价值外,谷物还是植物化学抗氧化剂的良好来源,特别是酚酸,它们具有保护生理系统免受自由基诱导的氧化损伤的潜力3。豆类也是营养物质的良好来源,蛋白质含量通常高于谷物。它们还含有维生素和矿物质,用于制备各种食物8。此外,豆类是各种植物化学抗氧化剂的良好来源,包括酚酸,类黄酮,花青素和原花青素9,10。不同品种的谷物和豆类可能具有不同的酚酸组成。因此,有必要研究谷物和豆类的酚酸组成及其品种,以了解它们在酚类抗氧化剂方面的潜在健康益处。
已经报道了许多用于测量谷物和豆类谷物中酚酸含量并确定其抗氧化活性的测定方法。全谷物酚酸最常用的分析方法是分光光度法和液相色谱法11。这项工作的目的是展示一种用于测定游离可溶性酚酸组成的广义高压液相色谱方法,以及用于测定某些全谷物谷物和豆类的总酚含量和抗氧化能力的分光光度法。
研究方案
1. 样品类型
- 本研究使用五个全谷物样品,包括两种谷物(例如硬粒小麦和黄玉米)和三种豆类(例如黑眼豇豆,大豆和红芸豆)。
- 使用咖啡研磨机将50克每种谷物一式三份研磨成面粉,并通过500μm筛子。
- 将它们储存在-20°C。
2. 样品制备
-
以干物质含量的测定和干重表达为基础
注:根据AOAC (2000)12的方法测定每个粉状样品的干物质含量。- 打开强制对流烤箱,将温度设置为130°C。
- 干燥干燥剂(硅胶)在烘箱中干燥30分钟至1小时,并将干燥的硅胶转移到干燥器中。
- 将每个样品的2g准确称重到干净,预干燥并称重的铝罐中。
- 将称重的样品在130°C下在强制对流炉中干燥1小时。
- 将干燥的样品转移到干燥器中,并使其冷却至环境温度。
- 称取干燥、冷却的样品并记录其重量。
- 计算每个样品的干物质含量如下:
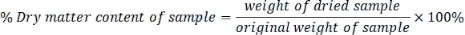
- 使用以下公式以干重为基础表示测量的每个参数:

-
酚酸萃取
注意:使用Y. Qiu等人5 的方法的修改提取谷物样品中的可溶性游离酚类化合物,该方法能够从毫克量的全谷物中提取酚类化合物。- 将 100 mg 全谷物面粉样品直接放入琥珀色的 2 mL 容量微量离心管中准确称量。管子的深色有助于防止混合物暴露在光线下。
- 向含有样品的每个试管中加入1 mL 80%HPLC级甲醇水溶液。
- 短暂涡旋以混合甲醇溶液和样品。
- 将样品超声处理60分钟以提取游离可溶性酚类化合物。在超声处理期间在样品上盖上盖子,以增加对光的保护。
- 超声处理后,将混合物以20,000× g 离心5分钟,以沉淀固体残留物,使上清液在上面。游离酚类化合物在离心后将存在于上清液中。
- 将上清液转移到干净的微量离心管中。
注意:上清液在注入HPLC仪器之前需要过滤。要过滤上清液,请取出3 mL注射器的柱塞并连接注射器过滤器。过滤器的孔径应不大于0.22μm。 - 将约0.4mL上清液移入注射器顶部。重新插入柱塞并将液体通过过滤器推入含有小瓶插入物的HPLC小瓶中。
- 一旦仪器被设置为运行手稿中概述的HPLC分析方法,将小瓶装入转盘中以与样品列表相对应。
- 在320nm和280nm处获得HPLC色谱图,显示代表不同酚类化合物的不同峰。
- 使用适当的标准曲线,在320nm处量化羟基肉桂酸,因为它们在该波长处具有最大的吸光度。通过相同的原理,在280nm处定量羟基苯甲酸。
- 将剩余的提取物储存在-20°C用于其他分析。
3. 酚类组合物
- 使用高压液相色谱仪(材料表)根据J. Xiang,F. .B. Apea-Bah,V. U. Ndolo,M.C. Katundu和T. Beta 4的方法鉴定和定量样品中提取的酚类化合物。
- 制备酚酸标准品(香草酸,咖啡酸,对香豆酸,阿魏酸和西那酸)以鉴定和定量提取物中的组成酚类化合物。
- 为此,称取每种标准品1mg,并溶解在1mL的50%甲醇水溶液中,以产生1,000μg/ mL的每种标准品。
- 在2 mL琥珀色离心管中混合等体积的所有五种标准品,以产生标准品混合物,每种标准品的浓度为200μg/ mL。
- 通过将一定体积放入新管中并用等体积的甲醇水溶液溶剂稀释来制备标准鸡尾酒的连续稀释液。
- 重复连续稀释至浓度为3.125μg/ mL。
- 另外,用溶剂单独稀释每个标准品40次,以获得每个标准品的25μg/ mL浓度。
- 将色谱柱温度设置为 35 °C,将样品烘箱温度设置为 15 °C。
- 为了制备流动相A(0.1%甲酸水溶液),将1mL甲酸转移到1L容量的容量瓶中,并将HPLC级水加入1L标记中。摇匀均匀。
- 为了制备流动相B(甲醇中0.1%甲酸),将1mL甲酸转移到1L容量容量的烧瓶中,并在1L标记处加入HPLC级甲醇。摇匀均匀。
- 如有必要,将音量调整到1 L标记。
- 通过0.45μm亲水滤纸过滤两个流动相。
- 对于分析,将10μL每种提取物或标准品(25μg/ mL标准品和标准混合物)注入反相柱上。
- 根据线性梯度程序用流动相洗脱25分钟,如下所示:0-3.81分钟,9%-14%B;3.81-4.85分钟, 14%-15% B;4.85-5.89分钟, 15%-15% B, 5.89-8.32分钟, 15%-17% B;8.32-9.71分钟, 17%-19% B;9.71-10.40分钟, 19%-19% B;10.40-12.48分钟, 19%-26% B;12.48-13.17分钟, 16%-28% B;13.17-14.21分钟, 28%-35% B;14.21-15.95分钟, 35%-40% B;15.95-16.64分钟, 40%-48% B;16.64-18.37分钟, 48%-53% B;18.37-22.53分钟, 53%-70% B;22.53-22.88分钟, 70%-90% B;22.88-25.00 分钟, 90% B.
- 将浓度为25μg/ mL的真实标准品在280nm和320nm处获得的色谱峰的保留时间与提取物的层析峰的保留时间进行比较,以确定样品中的组成酚类化合物。
- 绘制酚酸标准鸡尾酒的校准曲线,标准品的浓度在水平轴上,峰面积在垂直轴上
- 使用校准曲线将图上的峰面积与前面部分提到的280 nm和320 nm处的已鉴定化合物的峰面积进行比较,来估计已鉴定的酚类化合物的浓度。
4. 总酚含量
注意:使用F.B. Apea-Bah等人描述的Folin-Ciocalteu方法测定提取物的总酚含量。
- 在0.025~0.150mg/mL浓度范围内制备阿魏酸和没食子酸标准品,绘制校准曲线进行比较,用于估计总酚含量。
- 为此,将阿魏酸和没食子酸标准品分别精确称取1mg到2 mL容量离心管中。
- 向每个标准品中加入1 mL 50%甲醇水溶液并涡旋溶解,产生每个标准品的1 mg / mL储备。
- 从每个储备溶液中制备一系列稀释液,总共500μL。
- 将18.2μL每种提取物或标准品移液到96孔微孔板上的单独孔中。
- 向每种提取物或标准品中加入36.4μL10%(v / v)水性Folin-Ciocalteu试剂。
- 然后,向每个反应混合物中加入145.4μL700mM碳酸钠。
- 将反应混合物在室温(20-25°C)下在黑暗中孵育2小时。
- 在750nm处的酶标仪上读取吸光度。
- 绘制吸光度变化与酚酸标准品浓度的校准曲线,并使用它们来估计总酚含量。
- 以干重为基础,将结果表示为每克研磨样品的毫克阿魏酸当量(mg FAE / g)和每克研磨样品的毫克没食子酸当量(mg GAE / g)。
5. 抗氧化检测
注意:使用以下三种测定法测定谷物提取物的抗氧化能力:2,2-二苯基-1-丙烯酸肼(DPPH)自由基清除能力;2,2'-叠氮基-双(3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基清除能力,也称为Trolox当量抗氧化能力(TEAC);和氧自由基吸收能力(ORAC)。
- 标准曲线的Trolox标准品的制备
- 使用维生素E的水溶性类似物Trolox作为标准来估计全谷物提取物的 体外 抗氧化能力。
- 在 15 mL 试管中准确称量 1 mg Trolox。溶于4 mL 50%甲醇水溶液中。涡旋溶解以制备1mM(1000μM)的储备溶液。
- 制备6种浓度的Trolox,即50,100,200,400,600和800μM,以绘制标准曲线,以估计DPPH自由基清除能力和Trolox当量抗氧化能力(TEAC)。同样,制备6.25,12.5,25和50μM浓度的Trolox用于估计氧自由基吸收能力(ORAC)。将每种浓度的总体积组成为500μL,如 表1所示。
- 样品提取物的稀释
- 分析前用甲醇稀释样品提取物。这里,黄玉米和豇豆提取物被稀释两次,小麦和芸豆被稀释了五次,大豆提取物用甲醇稀释了10倍。
- 特罗洛克斯等效抗氧化能力 (TEAC) 测定
- 使用F.B. Apea-Bah等人描述的方法测量样品的Trolox当量抗氧化能力(TEAC)。
- 称取 8.23 mg ABTS 到干净的 2 mL 容量琥珀色离心管中。
- 接下来,称取1.62mg过硫酸钾到另一个干净的2 mL容量的琥珀离心管中。
- 向每个蒸馏水中加入1 mL蒸馏水并涡旋溶解它们。
注意:这导致16 mM ABTS储备溶液与6 mM过硫酸钾水溶液。 - 通过将ABTS和过硫酸钾溶液等体积混合来制备ABTS储备溶液。溶液将立即变为深色。
- 将试剂混合物在黑暗中孵育12-16小时。
- 用200mM磷酸盐缓冲盐水(PBS)稀释ABTS储备溶液30倍,形成ABTS工作溶液。为此,将 58 mL 的 200 mM PBS 加入 2 mL ABTS 储备溶液中。工作溶液将含有0.27 mM ABTS和0.1 mM过硫酸钾。
- 对于分析,将10μL每个稀释的提取物或Trolox放入96孔微孔板中。
- 向每个孔中加入190μLABTS工作溶液,并将反应混合物孵育60分钟。
- 在酶标仪中测量反应混合物在750nm处的吸光度。
- 使用浓度范围为100至800μmol/L的Trolox标准品绘制校准曲线。
- 根据校准曲线估计 ABTS 自由基清除能力。
- 以干重为基础,以每克(μmol TE/g)样品的微摩尔特罗氏当量表示结果。
- 断续器
注意:使用F.B. Apea-Bah等人13先前描述的方法测定样品的DPPH自由基清除能力。DPPH抗氧化测定需要产生自由基的化合物DPPH(2,2-二苯基-1-苦味酰肼)。- 将 1.2 mg DPPH 准确称量到 50 mL 空容量离心管中。将DPPH溶解在30mL甲醇中以制备60μmol / L甲醇溶液。
注意:DPPH测定测试样品提取物清除DPPH产生的自由基的能力。 - 对于分析,将5μL样品提取物或Trolox溶液加入微孔板孔中。
- 接下来,加入195μL的60μmol / L DPPH甲醇溶液并孵育60分钟。
- 测量反应混合物在515nm处的吸光度。
- 使用Trolox标准品(50-800μmol/ L)绘制校准曲线,其中垂直轴上的吸光度变化和水平轴上的Trolox浓度的变化。
- 根据校准曲线估计DPPH清除能力。
- 以干重为基础,以每克(μmol TE/g)样品的微摩尔特罗氏当量表示结果。
- 将 1.2 mg DPPH 准确称量到 50 mL 空容量离心管中。将DPPH溶解在30mL甲醇中以制备60μmol / L甲醇溶液。
- 氧自由基吸收能力
- 根据F.B. Apea-Bah等人的方法确定样品的氧自由基吸收能力(ORAC)。
- 首先,从1,000μM Trolox标准储备溶液中制备浓度为6.25,12.5,25和50μM的Trolox标准品,在75mM磷酸钾(K2HPO4 / KH2PO4)缓冲液中。
- 为此,称取1mg Trolox粉末,并在超声处理下溶解在4mL缓冲溶液中,以制备1,000μM储备溶液。
- 然后,将50μL储备溶液放入2mL容量离心管中,并用950μL缓冲溶液稀释,得到1,000μL50μM Trolox溶液。
- 将500μL的50μM溶液移液到新管中,并用等体积的缓冲液稀释,以获得25μM Trolox溶液。
- 重复25μM的连续稀释得到12.5μM,然后同样重复12.5μM的稀释,得到6.25μM。
- 准备样品提取物的适当稀释度。
- 用缓冲溶液稀释黄玉米和豇豆提取物20倍,小麦和芸豆提取物稀释50倍,大豆提取物稀释100倍。
- 将每个样品或Trolox标准品的200μL转移到黑色96孔微孔板的孔中以进行自动移液。
- 然后,向装有ORAC设备的三个试剂罐中填充,用以下物质:(1)缓冲液;(2)缓冲液中荧光素0.816nM;和(3)153 mM的2,2'-偶氮二(2-脒基丙烷)二盐酸盐(AAPH)在缓冲液中。
- 将它们放在容器中以进行自动移液。
- 根据标准操作程序设置ORAC机器和自动移液系统进行分析。
- 对于分析,设置自动移液系统,将25μL每个稀释的提取物或标准品转移到透明底部黑色96孔微孔板的孔中。
- 然后,在缓冲液中自动加入150μL0.816nM荧光素。
- 将反应混合物在37°C下在ORAC机器中孵育15分钟。
- 然后,自动向每个反应混合物中加入25μLAAPH。
- 将它们在37°C下在ORAC机器中孵育50分钟。
- 设置ORAC机器以测量孵育期内分别在485nm和520nm的激发和发射波长下的荧光衰变。
- 测量后,绘制Trolox标准曲线,水平轴上为Trolox(6.25-50μM),垂直轴上为荧光衰减。
- 从Trorox标准曲线估计提取物的氧自由基吸收能力。
- 以干重为基础,以μmol TE/g样品表示结果。
- 统计分析
- 将所有结果显示为至少一式三份的标准差±平均值。
- 执行方差分析 (ANOVA) 以确定晶粒类型对响应变量的影响。
- 如果 p < 0.05 处存在显著差异,则使用最小显著性差 (LSD) 来比较均值。
- 进行Pearson相关性分析以估计酚类含量与抗氧化能力之间的关系。
结果
表2 显示了在谷物和豆类谷物中鉴定的酚酸。根据现有的正品标准,在样品中鉴定出四种酚酸,它们是:香草酸,咖啡酸, 对香豆酸和阿魏酸。香草酸是一种羟基苯甲酸,而其他三种是羟基肉桂酸。香草酸仅在黑眼豇豆中鉴定,而咖啡酸仅在芸豆中鉴定。 在黄玉米,豇豆豆和大豆中鉴定出对香豆酸。按干重计算,其浓度范围在7.57至12.48微克/克面粉之间,黄玉米的最低值?...
讨论
全谷物被选为具有代表性的谷物和豆类,在世界范围内具有广泛的食品应用。虽然每种谷物的品种之间可能存在差异,但本研究的重点是展示一种用于全谷物的游离酚酸提取和分析的广义方法。通过大幅减少样品和溶剂的量来修改提取方法,以减少进行此类实验时释放到环境中的化学物质的量。这种改性还可以从毫克量的全谷物中提取酚醛。
HPLC分析产生样品中组成酚酸的色?...
披露声明
作者声明没有利益冲突。
致谢
作者感谢Alison Ser女士和Hannah Oduro-Obeng女士的技术支持,以及Janice Fajardo女士和Miguel del Rosario先生的视频编辑支持。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL Falcon conical centrifuge tubes | Fisher Scientific | 05-527-90 | |
| 2 mL Amber glass ID Surestop vial | Thermo Scientific | C5000-2W | |
| 2 mL Amber microcentrifuge tubes | VWR | 20170-084 | |
| 2,2′-Azobis(2-amidinopropane) dihydrochloride (AAPH) | Sigma-Aldrich | 440914-100G | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) (C18H18N4O6S4) ≥98%, | Sigma Aldrich | A1888-2G | |
| 2,2-Diphenyl-1pikrylhydrazyl (DPPH) (C18H12N5O6) | Sigma Aldrich | D913-2 | |
| 6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox) (C14H18O4), ≥98% | Fluka Chemika | 56510 | |
| 9 mm Autosampler Vial Screw Thread Caps | Thermo Scientific | 60180-670 | |
| 96 well flat bottom plates | Fisher Scientific | 12565501 | |
| Agilent BioTek ELx800 microplate reader | Fisher Scientific | BT-ELX800NB | |
| Agilent BioTek Precision 2000 96/384 Automated Microplate Pipetting System | Fisher Scientific | N/A | |
| Agilent BioTek FLx800 Microplate Fluorescence Reader | Fisher Scientific | N/A | |
| Analytical balance SI-114 | Denver Instrument | SI-114.1 | |
| Autosampler, Waters 717 Plus | Waters | WAT078900 | |
| BD 3 mL syringe Luer-Lok Tip | BD | 309657 | |
| Bransonic ultrasonic cleaner, Branson 5510 | Millipore Sigma | Z245143 | |
| Corning LSE Vortex Mixer | Corning | 6775 | |
| Durapore Filter (0.45 µm PVDF Membrane) | Merck Millipore Ltd | HVLP04700 | |
| Durapore Membrane Filters (0.45 µm HV) | Merck Millipore Ltd | HVHP04700 | |
| Eppendorf Research plus, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research plus, 0.5-5 mL | Eppendorf | 3123000071 | |
| Eppendorf Research plus, 100-1000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research plus, 10-100 µL | Eppendorf | 3123000047 | |
| Ethyl acetate, HPLC grade | Fisher Chemical | E195-4 | |
| Ferulic acid standard | Sigma Aldrich | 128708-5G | |
| Fluorescein | Fisher Scientific | AC119245000 | |
| Folin & Ciocalteu phenol reagent | Sigma Aldrich | F9252 | |
| Formic acid, 99% | Acros Organics, Janssen Pharmaceuticalaan 3a | 27048-0010 | |
| Gallic acid standard | Sigma | G7384 | |
| High performance liquid chromatograph (HPLC), Waters 2695 | Waters | 960402 | |
| Methanol, HPLC grade | Fisher Chemical | A452-4 | |
| Micro pipet tips, 0.5-10 µL | Fisherbrand | 21-197-2F | |
| Microcentrifuge Sorvall Legend Micro 21 centrifuge | Thermo Scientific | 75002435 | |
| Multichannel micropipette, Proline Plus, 30-300 µL | Sartorius | 728240 | |
| Photodiode array detector, Waters 2996 | Waters | 720000350EN | |
| Pipet tips, 1000 µL | VWR | 83007-382 | |
| Pipet tips, 1-5 mL | VWR | 82018-840 | |
| Potassium persulfate (K2S2O8), ≥99.0% | Sigma Aldrich | 216224-100G | |
| Potassium phosphate dibasic anhydrous (K2HPO4) | Fisher Scientific | P288-500 | |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | P285-500 | |
| PYREX 250 mL Short Neck Boiling Flask, Round Bottom | Corning | 4321-250 | |
| Reversed phase C18 Analytical Column (100 x 3 mm) Accucore aQ | Thermo Scientific | 17326-103030 | |
| Roto evaporator, IKA RV 10 | IKA | 0010005185 | |
| Sodium carbonate (NaCO3) anhydrous | Fisher Chemical | S263-1 | |
| Sodium chloride (NaCl) | Mallinckrodt AR® | 7581 | |
| Sodium phosphate dibasic anhydrous (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Sodium phosphate monobasic anhydrous (NaH2PO4) | Fisher bioreagents | BP329-500 | |
| Standardization pipet tips 0-200µL | Fisherbrand | 02-681-134 | |
| Syringe Driven Filter unit (0.22 µm) | Millex®-GV | SLGVR04NL | |
| Target micro-serts vial insert (400 µL) | Thermo Scientific | C4011-631 | |
| Ultrapure water (Direct Q-3 UV system with pump) | Millipore | ZRQSVP030 |
参考文献
- Huitu, O., et al. Silicon, endophytes and secondary metabolites as grass defenses against mammalian herbivores. Frontiers in Plant Science. 5, 478 (2014).
- Joshi, J. R., Burdman, S., Lipsky, A., Yariv, S., Yedidia, I. Plant phenolic acids affect the virulence of Pectobacterium aroidearum and P. carotovorum ssp. brasiliense via quorum sensing regulation. Molecular Plant Pathology. 17 (4), 487-500 (2016).
- Dykes, L., Rooney, L. W. Phenolic compounds in cereal grains and their health benefits. Cereal Foods World. 52 (3), 105-111 (2007).
- Xiang, J., Apea-Bah, F. B., Ndolo, V. U., Katundu, M. C., Beta, T. Profile of phenolic compounds and antioxidant activity of finger millet varieties. Food Chemistry. 275, 361-368 (2019).
- Qiu, Y., Liu, Q., Beta, T. Antioxidant properties of commercial wild rice and analysis of soluble and insoluble phenolic acids. Food Chemistry. 121 (1), 140-147 (2010).
- Beverly, R. L., Motarjemi, Y. . Encyclopedia of Food Safety. 3, 309-314 (2014).
- FAO. Food Outlook - Biannual report on global food markets. Food and Agriculture Organization. , (2020).
- Erbersdobler, H. F., Barth, C. A., Jahreis, G. Legumes in human nutrition. Nutrient content and protein quality of pulses. Ernahrungs Umschau. 64 (9), 134-139 (2017).
- Dueñas, M., Hernández, T., Estrella, I. Assessment of in vitro antioxidant capacity of the seed coat and the cotyledon of legumes in relation to their phenolic contents. Food Chemistry. 98 (1), 95-103 (2006).
- Khang, D. T., Dung, T. N., Elzaawely, A. A., Xuan, T. D. Phenolic profiles and antioxidant activity of germinated legumes. Foods. 5 (2), 27 (2016).
- Hefni, M. E., Amann, L. S., Witthöft, C. M. A HPLC-UV method for the quantification of phenolic acids in cereals. Food Analytical Methods. 12 (12), 2802-2812 (2019).
- AOAC. . Official Methods of Analysis. 17th edn. , (2000).
- Apea-Bah, F. B., Head, D., Scales, R., Bazylo, R., Beta, T. Hydrothermal extraction, a promising method for concentrating phenolic antioxidants from red osier dogwood (Cornus stolonifer) leaves and stems. Heliyon. 6 (10), 05158 (2020).
- Apea-Bah, F. B., Minnaar, A., Bester, M. J., Duodu, K. G. Sorghum-cowpea composite porridge as a functional food, Part II: Antioxidant properties as affected by simulated in vitro gastrointestinal digestion. Food Chemistry. 197, 307-315 (2016).
- Robbins, R. J., Bean, S. R. Development of a quantitative high-performance liquid chromatography-photodiode array detection measurement system for phenolic acids. Journal of Chromatography A. 1038 (1-2), 97-105 (2004).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Prior, R. L., Wu, X., Schaich, K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry. 53 (10), 4290-4302 (2005).
- Ainsworth, E. A., Gillespie, K. M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent. Nature Protocols. 2 (4), 875-877 (2007).
- Waterhouse, A. L. Determination of total phenolics. Current Protocols in Food Analytical Chemistry. 1, 1-8 (2002).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry. 53 (6), 1841-1856 (2005).
- Esterbauer, H., Wäg, G., Puhl, H. Lipid peroxidation and its role in atherosclerosis. British Medical Bulletin. 49 (3), 566-576 (1993).
- Esterbauer, H., Gebicki, J., Puhl, H., Jürgens, G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radical Biology and Medicine. 13 (4), 341-390 (1992).
- Apea-Bah, F. B., Serem, J. C., Bester, M. J., Duodu, K. G. Phenolic composition and antioxidant properties of Koose, a deep-fat fried cowpea cake. Food Chemistry. 237, 247-256 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。