このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
穀物およびマメ科植物の遊離可溶性フェノール酸組成および抗酸化能を決定するための一般化された方法
要約
フェノール酸は、全粒穀物に存在する重要な植物化学物質です。それらは抗酸化保護機能のような生理活性特性を有する。この研究は、HPLC同定、総フェノール含有量推定、および穀物および豆類中のフェノール酸の抗酸化能の測定のための一般化された方法に関する報告を目的としていた。
要約
フェノール酸は、フェノール基とカルボキシル基の両方を持つ有機化合物の一種です。それらは穀物に見られ、穀物のふすままたは豆類の種皮に集中します。彼らは、近年、それらの潜在的な抗酸化保護健康機能について、多くの研究の関心を集めている抗酸化特性を持っています。この研究は、全粒穀物から遊離可溶性フェノール酸を抽出し、それらの抗酸化能力を分析するための一般化された方法を提示する。2つの穀物(小麦および黄色トウモロコシ)および3つの豆類(ササゲ豆、インゲン豆、および大豆)を含む5つの全粒穀物サンプルを使用した。穀物を小麦粉に粉砕し、それらの遊離可溶性フェノール酸をメタノール水溶液を用いて抽出した。次いで、化合物を高圧液体クロマトグラフ(HPLC)を用いて同定した。Folin-Ciocalteu法を使用してそれらの総フェノール含有量を決定し、それらの抗酸化能力はDPPHラジカル消去能、トロロックス等価抗酸化能(TEAC)および酸素ラジカル吸光能(ORAC)アッセイを使用して決定した。同定されたフェノール酸には、バニリック酸、カフェ酸、 p-クマル酸およびフェルラ酸が含まれていた。バニリン酸はササゲでのみ同定され、カフェ酸はインゲン豆でのみ同定された。 p-クマル酸はイエローコーン、ササゲ、大豆で同定され、フェルラ酸はすべてのサンプルで同定された。フェルラ酸は、同定された優勢なフェノール酸であった。サンプル中のフェノール酸の総濃度は、以下の順序で減少した:大豆>ササゲ豆>黄色トウモロコシ=インゲン豆>小麦。総抗酸化能力(DPPH、TEACおよびORACアッセイの値の合計)は、以下のように減少した:大豆>インゲン豆>黄色トウモロコシ=ササゲ豆>小麦。この研究は、HPLC分析ならびにDPPH、TEAC、およびORACアッセイが、全粒穀物のフェノール酸組成および抗酸化特性に関する有用な情報を提供すると結論付けた。
概要
フェノール酸は、草食動物や真菌の感染に対する植物の防御に重要な役割を果たし、植物組織における構造的支持と完全性の維持に重要な役割を果たしているため、植物で研究されている最も重要な植物化学物質の1つです1,2。彼らは穀物のふすまと豆類の種皮に豊富にあります3.構造的には、それらは2つのグループに分けられる:ヒドロキシ安息香酸(図1)およびヒドロキシ桂皮酸(図2)。穀物および豆類における一般的なヒドロキシ安息香酸には、没食子酸、p-ヒドロキシ安息香酸、2,4-ジヒドロキシ安息香酸、プロトカテクイ酸、バニリック酸、およびシリンギン酸が含まれ、一般的なヒドロキシ桂皮酸にはカフェ酸、p-クマル酸、鉄原酸、シナピン酸3が含まれる。フェノール酸はまた、脂肪中の酸化的酸敗を引き起こすフリーラジカルを捕捉し、生理学的系においてラジカル誘発酸化ストレスを開始および伝播することができるので、抗酸化特性を有する4,5。抗酸化物質としてのこの重要な生理学的役割のために、それらは最近の研究の対象である。これは、植物性食品の成分として消費されると、抗酸化保護を発揮することができるからです。
穀物とシリアル製品は、世界中の人間と動物にとって主要な炭水化物食料源です6。穀物には、小麦、米、トウモロコシ(トウモロコシ)、大麦、トリチケール、キビ、ソルガムなどがあります。その中で、トウモロコシが最も利用されており、2019/2020年の推定世界利用量は11億3,570万トンで、続いて同じ期間に小麦が7億5,750万トンと推定されています7。シリアル食品は炭水化物の豊富な供給源であるため、消費者にとって大きなエネルギー源です。彼らはまた、いくつかのタンパク質、脂肪、繊維、ビタミンやミネラルを提供します6.それらの栄養価に加えて、穀物は植物化学的抗酸化物質、特にフェノール酸の良い供給源であり、ラジカル誘発酸化損傷から生理学的系を保護する可能性を秘めている3。マメ科植物はまた、栄養素の良い供給源であり、一般的に穀物よりもタンパク質が高いです。それらはまたビタミンとミネラルを含み、そして様々な食物の調製に使われます8。さらに、豆類は、フェノール酸、フラボノイド、アントシアニン、およびプロアントシアニジンを含む様々な植物化学的抗酸化物質の良好な供給源である9,10。穀物および豆類の異なる品種は、異なるフェノール酸組成を有し得る。したがって、フェノール系抗酸化物質に関してそれらの潜在的な健康上の利点を知るために、穀物および豆類およびそれらの品種のフェノール酸組成を研究する必要がある。
穀物およびマメ科植物の穀物中のフェノール酸の量を測定し、それらの抗酸化活性を決定するための多くのアッセイが報告されている。全粒フェノール酸の最も一般的な分析方法は、分光光度法および液体クロマトグラフィー11である。この研究の目的は、遊離可溶性フェノール酸組成を決定するための一般化された高圧液体クロマトグラフィー法、およびいくつかの全粒穀物および豆類の総フェノール含有量および抗酸化能を決定するための分光光度法を実証することであった。
プロトコル
1. サンプルの種類
- この研究には、2つの穀物(例えば、デュラム小麦およびイエローコーン)および3つの豆類(例えば、ブラックアイサゲ豆、大豆、および赤インゲン豆)を含む5つの全粒穀物サンプルを使用する。
- 各穀物の50gを3連で粉砕し、コーヒーグラインダーを使用して小麦粉にし、それらを500μmのふるいに通す。
- -20°Cで保管してください。
2. サンプル調製
-
乾物含有量の測定と乾燥重量基準の表現
注:AOAC(2000)12の方法に従って、各粉末サンプルの乾燥物含有量を決定する。- 強制対流式オーブンの電源を入れ、温度を 130 °C に設定します。
- 乾燥剤(シリカゲル)をオーブン中で30分~1時間乾燥させ、乾燥したシリカゲルをデシケーターに移した。
- 各サンプルの2gを正確に計量し、清潔で予備乾燥し、計量したアルミニウム缶に入れます。
- 秤量した試料を強制対流式オーブン中で130°Cで1時間乾燥させる。
- 乾燥したサンプルをデシケーターに移し、周囲温度まで冷却します。
- 乾燥し、冷却されたサンプルを計量し、その重量を記録します。
- 各サンプルの乾物含有量を次のように計算します。
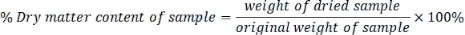
- 乾燥重量基準で測定された各パラメータを次の式で表します。

-
フェノール酸抽出
注:ミリグラム量の全粒穀物からのフェノール抽出を可能にするY. Qiu et al.5 の方法の改変を用いて、穀物サンプル中の可溶性遊離フェノール化合物を抽出する。- 全粒粉サンプル100mgを琥珀色の2mL容量の微量遠心管に直接正確に秤量する。チューブの暗い色は、混合物が光にさらされるのを防ぐのに役立ちます。
- サンプルを含む各チューブに1mLの80%水性HPLCグレードメタノールを加える。
- ボルテックスはメタノール溶液と試料とを短時間混合する。
- サンプルを60分間超音波処理して、遊離の可溶性フェノール化合物を抽出します。光からの追加の保護のための超音波処理の期間中、サンプルの上にカバーを置きます。
- 超音波処理後、混合物を20,000 × g で5分間遠心分離し、上清を上に残した固体残渣を沈降させる。遊離フェノール化合物は、遠心分離後の上清中に存在するであろう。
- 上清を清浄な微量遠心管に移す。
注:HPLC装置に注入する前に、上清をろ過する必要があります。上清をろ過するには、3mLシリンジのプランジャーを取り外し、シリンジフィルターを取り付けます。フィルターの孔径は 0.22 μm 以下でなければなりません。 - 約0.4 mLの上清をシリンジの上部にピペットで留める。プランジャーを再挿入し、フィルターを通して液体をバイアルインサートを含むHPLCバイアルに押し込みます。
- HPLC分析用の原稿に概説されている方法を実行するように機器がセットアップされたら、サンプルリストに対応するようにバイアルをカルーセルにロードします。
- 異なるフェノール化合物を表す明確なピークを示す320nmおよび280nmにおけるHPLCクロマトグラムを得る。
- 適切な標準曲線を使用して、ヒドロキシ桂皮酸は、この波長で最大の吸光度を有するので、320nmで定量する。同様の原理により、280nmにおけるヒドロキシ安息香酸類を定量する。
- 残りの抽出物を他の分析のために-20°Cで保存する。
フェノール組成物
- 高圧液体クロマトグラフ(材料表)を使用して、J. Xiang、F..B. Apea-Bah、V. U. Ndolo、M..C. Katundu、およびT. Beta 4の方法に基づいて、サンプル中の抽出されたフェノール化合物を同定および定量します。
- フェノール酸標準物質(バニリン酸、カフェ酸、パラクマル酸、フェルラ酸、シナピン酸)を調製して、抽出物中の構成フェノール化合物を同定および定量する。
- これを行うには、各標準物質1mgを秤量し、1mLの50%メタノール水溶液に溶解して、各標準物質の1,000μg/mLを生成する。
- 2 mL のアンバー遠沈管で 5 つの標準物質すべてを等量混合し、それぞれが 200 μg/mL の濃度の標準品のカクテルを生成します。
- 新しいチューブに容量を取り、等量のメタノール水溶液溶媒で希釈することによって、標準カクテルの段階希釈物を調製する。
- 3.125 μg/mL の濃度まで段階希釈を繰り返します。
- また、各標準物質を溶媒で40倍に別途希釈し、各標準物質の濃度を25μg/mLとした。
- カラム温度を35°C、サンプルオーブン温度を15°Cに設定します。
- 移動相A(0.1%ギ酸水溶液)を調製するために、1mLのギ酸を1L容量のメスフラスコに移し、HPLCグレードの水を1Lマークに加える。よく振って混ぜる。
- 移動相B(メタノール中の0.1%ギ酸)を調製するために、1mLのギ酸を1L容量メスフラスコに移し、HPLCグレードのメタノールを1Lマークに加える。よく振って混ぜる。
- 必要に応じて、音量を 1 L マークに調整します。
- 両方の移動相を0.45μmの親水性ろ紙でろ過します。
- 分析のために、各抽出物または標準物質(25 μg/mL 標準および標準カクテル)を逆相カラムに 10 μL 注入します。
- 次のように25分間の実行のための線形勾配プログラムに従って移動相で溶出する:0-3.81分、9%-14%B;3.81-4.85分、14%-15%B;4.85-5.89分、15%-15%B、5.89-8.32分、15%-17%B;8.32-9.71分、17%-19%B;9.71-10.40分、19%-19%B;10.40-12.48分、19%-26%B;12.48-13.17分、16%-28%B;13.17-14.21分、28%-35%B;14.21-15.95分、35%-40%B;15.95-16.64分、40%-48%B;16.64-18.37分、48%-53%B;18.37-22.53分、53%-70%B;22.53-22.88分、70%-90%B;22.88-25.00分、90%B。
- サンプル中の構成フェノール化合物を特定するために、280 nmおよび320 nmにおける濃度25 μg/mLの真正な標準について得られたクロマトグラフィーピークの保持時間を抽出物の保持時間と比較します。
- フェノール酸標準カクテルの検量線をプロットし、横軸に標準物質の濃度、縦軸にピーク面積
- 検量線を使用して、プロット上のピーク面積を、前のセクションで述べたように280nmおよび320nmにおける同定された化合物のピーク面積と比較することによって、同定されたフェノール化合物の濃度を推定する。
4.総フェノール含有量
注:F.B. Apea-Bahら13によって記載されたFolin-Cioculteu法を用いて抽出物の総フェノール含有量を決定する。
- 0.025~0.150mg/mLの濃度範囲内でフェルラ酸および没食子酸標準物質を調製し、比較して検量線をプロットし、総フェノール含有量を推定する。
- これを行うには、フェルラ酸および没食子酸標準物質のそれぞれ1mgを2mL容量の遠沈管に正確に秤量する。
- 各標準物質に50%メタノール水溶液1mLを加え、ボルテックスで溶解させ、各標準物質の1mg/mLストックを作製した。
- 各ストック溶液から一連の希釈液を合計500μLで調製する。
- 各抽出物または標準品の18.2 μLをピペットで96ウェルマイクロプレート上の別々のウェルに入れた。
- 36.4 μL の 10% (v/v) 水性フォリン・シオカルテウ試薬を各抽出物または標準液に加える。
- 次いで、各反応混合物に145.4 μLの700 mM炭酸ナトリウムを加える。
- 反応混合物を暗所、室温(20〜25°C)で2時間インキュベートする。
- 750nmのマイクロプレートリーダーで吸光度を読み取る。
- フェノール酸標準物質の濃度に対する吸光度の変化の検量線をプロットし、それらを使用して総フェノール含有量を推定する。
- 結果を、粉砕サンプル1グラムあたりのフェルラ酸当量ミリグラム(mg FAE/g)および粉砕サンプル1グラムあたりの没食子酸当量(mg GAE/g)として、乾燥重量ベースで表します。
5. 抗酸化アッセイ
注:以下の3つのアッセイを用いて穀物抽出物の抗酸化能を決定する:2,2-ジフェニル-1-ピクリルヒドラジル(DPPH)ラジカル消去能;2,2'-アジノビス(3-エチルベンゾチアゾリン-6-スルホン酸(ABTS)ラジカル消去能、トロロックス等価抗酸化能(TEAC)とも呼ばれる)、酸素ラジカル吸光度能(ORAC)とも呼ばれる。
- 標準曲線のトロロックス標準の作成
- ビタミンEの水溶性類似体であるトロロックスを標準として使用し、全粒穀物抽出物の インビトロ 抗酸化能を推定する。
- 15mLチューブに1mgのトロロックスを正確に計量する。4mLの50%メタノール水溶液に溶解する。ボルテックスを溶解させ、1mM(1000μM)の原液を調製した。
- 6つの濃度のトロロックス、すなわち50、100、200、400、600、および800μMを準備して、DPPHラジカル消去能およびトロロックス等価抗酸化能(TEAC)の推定のための標準曲線をプロットする。同様に、酸素ラジカル吸光度容量(ORAC)を推定するために、6.25、12.5、25、および50μM濃度のトロロックスを準備します。 表1に示すように各濃度の全容量を500 μLに構成する。
- サンプル抽出物の希釈
- 分析前にサンプル抽出物をメタノールで希釈する。ここで、イエローコーン及びササゲ抽出物を2倍に希釈し、小麦及びインゲン豆を5倍希釈し、大豆抽出物をメタノールで10倍希釈した。
- トロロックス等価抗酸化能(TEAC)アッセイ
- F.B. Apea-Bahら14により先に記載した方法を用いて試料のトロロックス等価抗酸化能(TEAC)を測定する。
- 8.23 mgのABTSを清潔な2 mL容量の琥珀色の遠沈管に入れます。
- 次に、1.62mgの過硫酸カリウムを別のきれいな2mL容量の琥珀色の遠沈管に秤量する。
- それぞれに1mLの蒸留水を加え、渦を巻いて溶かします。
注:これにより、6 mM 過硫酸カリウム水溶液を含む16 mM ABTSストック溶液が得られます。 - ABTSと過硫酸カリウム溶液とを等量混合してABTS原液を調製する。解決策はすぐに暗い色に変わります。
- 試薬混合物を暗所で12〜16時間インキュベートする。
- ABTSストック溶液を200mMリン酸緩衝生理食塩水(PBS)で30倍に希釈し、ABTS作業溶液を形成した。これを行うには、2 mLのABTSストック溶液に58 mLの200 mM PBSを加えます。作業溶液には、0.27 mM ABTSおよび0.1 mM 過硫酸カリウムが含まれます。
- 分析のために、各希釈抽出物またはトロロックスを10μLを96ウェルマイクロプレートに入れる。
- 各ウェルに190 μLのABTS作動溶液を加え、反応混合物を60分間インキュベートする。
- マイクロプレートリーダーで750nmにおける反応混合物の吸光度を測定する。
- 100~800μmol/Lの範囲の濃度のTrolox標準を使用して検量線をプロットします。
- 検量線からABTSラジカル消去能力を推定する。
- 結果を乾燥重量ベースでグラムあたりのマイクロモルトロロックス当量(μmol TE/g)として表します。
- DPPHアッセイ
注:F.B. Apea-Bah et al.13によって以前に説明した方法を用いて、サンプルのDPPHラジカル消去能力を決定する。DPPH抗酸化アッセイには、ラジカル発生化合物であるDPPH(2,2-ジフェニル-1-ピクリルヒドラジル)が必要です。- 空の50 mL容量の遠沈管に1.2 mgのDPPHを正確に計量します。DPPHを30mLのメタノールに溶解し、60μmol/Lのメタノール溶液を調製する。
注:DPPHアッセイは、DPPHによって生成されたフリーラジカルを捕捉するサンプル抽出物の能力をテストします。 - 分析のために、5 μLのサンプル抽出物またはトロロックス溶液をマイクロプレートウェルに加える。
- 次に、195 μL の 60 μmol/L DPPH メタノール溶液を加え、60 分間インキュベートします。
- 515nmにおける反応混合物の吸光度を測定する。
- トロロックス標準(50-800 μmol/L)を使用して検量線をプロットし、吸光度の変化を縦軸に、トロロックス濃度を横軸にしました。
- 検量線からDPPH消去能力を推定します。
- 結果を乾燥重量ベースでグラムあたりのマイクロモルトロロックス当量(μmol TE/g)として表します。
- 空の50 mL容量の遠沈管に1.2 mgのDPPHを正確に計量します。DPPHを30mLのメタノールに溶解し、60μmol/Lのメタノール溶液を調製する。
- 酸素ラジカル吸光能
- F.B. Apea-Bahら13の方法に基づいてサンプルの酸素ラジカル吸光能(ORAC)を決定する。
- まず、75 mM リン酸カリウム (K 2 HPO 4/KH 2 PO4) バッファー中の 1,000 μM トロロックス標準原液から、濃度6.25、12.5、25、および 50 μM のトロロックス標準物質を調製します。
- これを行うには、1mgのトロロックス粉末を秤量し、超音波処理下で4mLの緩衝液に溶解して、1,000μMストック溶液を調製する。
- その後、50 μLの原液を2 mL容量の遠沈管に取り、950 μLの緩衝液で希釈して、1,000 μLの50 μM Trolox溶液を得た。
- 50 μM 溶液 500 μL を新しいチューブにピペットし、等量のバッファーで希釈して、25 μM トロロックス溶液を得た。
- 25 μM の段階希釈を繰り返して 12.5 μM を得、次に同様に 12.5 μM の希釈を繰り返して 6.25 μM を得た。
- サンプル抽出物の適切な希釈液を調製する。
- 黄トウモロコシ及びササゲ抽出物を20倍、小麦及びインゲン豆抽出物を50倍、及び大豆抽出物を緩衝液で100倍希釈する。
- 各サンプルまたはトロロックス標準物質200 μLを黒色96ウェルマイクロプレートのウェルに移し、自動ピペッティングを行います。
- 次いで、ORAC装置を備えた3つの試薬タンクを、以下のもので満たします:(1)緩衝液;(2)緩衝液中の0.816 nMフルオレセイン;(3)緩衝液中の153mMの2,2'-アゾビス(2-アミジノプロパン)二塩酸塩(AAPH)。
- それらをコンセントに入れて、自動ピペッティングします。
- 標準操作手順に基づいて、分析用のORACマシンと自動ピペッティングシステムを設定します。
- 分析のために、各希釈抽出物または標準液の25 μLを透明な底の黒い96ウェルマイクロプレートのウェルに移すように自動ピペッティングシステムをセットアップしました。
- 次いで、150 μLの0.816 nMフルオレセインを緩衝液に自動的に添加する。
- 反応混合物をORACマシン中で37°Cで15分間インキュベートする。
- その後、各反応混合物に25 μLのAAPHを自動的に添加する。
- それらをORACマシンで37°Cで50分間インキュベートする。
- ORACマシンをセットアップして、インキュベーション期間にわたって、それぞれ485nmおよび520nmの励起波長および発光波長で蛍光減衰を測定する。
- 測定後、横軸にトロロックス(6.25-50 μM)、縦軸に蛍光減衰のトロロックス標準曲線をプロットします。
- トロロックス標準曲線から抽出物の酸素ラジカル吸光能を推定する。
- 結果を乾燥重量ベースでμmol TE/gサンプルとして表します。
- 統計解析
- すべての結果を、少なくとも3連の標準偏差±手段として提示します。
- 分散分析(ANOVA)を実行して、応答変数に対する粒子型の影響を判断します。
- p<0.05に有意差が存在する場合、最小有意差(LSD)を使用して平均を比較します。
- ピアソン相関分析を実行して、フェノール含有量と抗酸化能力の関係を推定します。
結果
表2 に、穀物及びマメ科植物粒において同定されたフェノール酸類を示す。入手可能な本物の標準に基づいて、サンプル中に4つのフェノール酸が同定され、それらはバニリック酸、カフェ酸、 p-クマル酸、およびフェルラ酸である。バニリン酸はヒドロキシ安息香酸であり、他の3つはヒドロキシ桂皮酸である。バニリン酸はブラックアイササゲ豆でのみ同定され、カフェ?...
ディスカッション
全粒穀物は、世界中で幅広い食品用途を見つける代表的な穀物および豆類として選択されました。各穀物の品種間にはばらつきが存在するかもしれないが、この研究の焦点は、全粒穀物の遊離フェノール酸抽出および分析のための一般化された方法を実証することであった。抽出方法は、そのような実験が行われたときに環境に放出される化学物質の量を減らすために、サンプルおよび溶媒?...
開示事項
著者らは利益相反がないと宣言しています。
謝辞
著者らは、アリソン・セル氏とハンナ・オドゥロ・オーベン氏の技術支援、ジャニス・ファハルド氏とミゲル・デル・ロザリオ氏によるビデオ編集のサポートに感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 15 mL Falcon conical centrifuge tubes | Fisher Scientific | 05-527-90 | |
| 2 mL Amber glass ID Surestop vial | Thermo Scientific | C5000-2W | |
| 2 mL Amber microcentrifuge tubes | VWR | 20170-084 | |
| 2,2′-Azobis(2-amidinopropane) dihydrochloride (AAPH) | Sigma-Aldrich | 440914-100G | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) (C18H18N4O6S4) ≥98%, | Sigma Aldrich | A1888-2G | |
| 2,2-Diphenyl-1pikrylhydrazyl (DPPH) (C18H12N5O6) | Sigma Aldrich | D913-2 | |
| 6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox) (C14H18O4), ≥98% | Fluka Chemika | 56510 | |
| 9 mm Autosampler Vial Screw Thread Caps | Thermo Scientific | 60180-670 | |
| 96 well flat bottom plates | Fisher Scientific | 12565501 | |
| Agilent BioTek ELx800 microplate reader | Fisher Scientific | BT-ELX800NB | |
| Agilent BioTek Precision 2000 96/384 Automated Microplate Pipetting System | Fisher Scientific | N/A | |
| Agilent BioTek FLx800 Microplate Fluorescence Reader | Fisher Scientific | N/A | |
| Analytical balance SI-114 | Denver Instrument | SI-114.1 | |
| Autosampler, Waters 717 Plus | Waters | WAT078900 | |
| BD 3 mL syringe Luer-Lok Tip | BD | 309657 | |
| Bransonic ultrasonic cleaner, Branson 5510 | Millipore Sigma | Z245143 | |
| Corning LSE Vortex Mixer | Corning | 6775 | |
| Durapore Filter (0.45 µm PVDF Membrane) | Merck Millipore Ltd | HVLP04700 | |
| Durapore Membrane Filters (0.45 µm HV) | Merck Millipore Ltd | HVHP04700 | |
| Eppendorf Research plus, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research plus, 0.5-5 mL | Eppendorf | 3123000071 | |
| Eppendorf Research plus, 100-1000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research plus, 10-100 µL | Eppendorf | 3123000047 | |
| Ethyl acetate, HPLC grade | Fisher Chemical | E195-4 | |
| Ferulic acid standard | Sigma Aldrich | 128708-5G | |
| Fluorescein | Fisher Scientific | AC119245000 | |
| Folin & Ciocalteu phenol reagent | Sigma Aldrich | F9252 | |
| Formic acid, 99% | Acros Organics, Janssen Pharmaceuticalaan 3a | 27048-0010 | |
| Gallic acid standard | Sigma | G7384 | |
| High performance liquid chromatograph (HPLC), Waters 2695 | Waters | 960402 | |
| Methanol, HPLC grade | Fisher Chemical | A452-4 | |
| Micro pipet tips, 0.5-10 µL | Fisherbrand | 21-197-2F | |
| Microcentrifuge Sorvall Legend Micro 21 centrifuge | Thermo Scientific | 75002435 | |
| Multichannel micropipette, Proline Plus, 30-300 µL | Sartorius | 728240 | |
| Photodiode array detector, Waters 2996 | Waters | 720000350EN | |
| Pipet tips, 1000 µL | VWR | 83007-382 | |
| Pipet tips, 1-5 mL | VWR | 82018-840 | |
| Potassium persulfate (K2S2O8), ≥99.0% | Sigma Aldrich | 216224-100G | |
| Potassium phosphate dibasic anhydrous (K2HPO4) | Fisher Scientific | P288-500 | |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | P285-500 | |
| PYREX 250 mL Short Neck Boiling Flask, Round Bottom | Corning | 4321-250 | |
| Reversed phase C18 Analytical Column (100 x 3 mm) Accucore aQ | Thermo Scientific | 17326-103030 | |
| Roto evaporator, IKA RV 10 | IKA | 0010005185 | |
| Sodium carbonate (NaCO3) anhydrous | Fisher Chemical | S263-1 | |
| Sodium chloride (NaCl) | Mallinckrodt AR® | 7581 | |
| Sodium phosphate dibasic anhydrous (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Sodium phosphate monobasic anhydrous (NaH2PO4) | Fisher bioreagents | BP329-500 | |
| Standardization pipet tips 0-200µL | Fisherbrand | 02-681-134 | |
| Syringe Driven Filter unit (0.22 µm) | Millex®-GV | SLGVR04NL | |
| Target micro-serts vial insert (400 µL) | Thermo Scientific | C4011-631 | |
| Ultrapure water (Direct Q-3 UV system with pump) | Millipore | ZRQSVP030 |
参考文献
- Huitu, O., et al. Silicon, endophytes and secondary metabolites as grass defenses against mammalian herbivores. Frontiers in Plant Science. 5, 478 (2014).
- Joshi, J. R., Burdman, S., Lipsky, A., Yariv, S., Yedidia, I. Plant phenolic acids affect the virulence of Pectobacterium aroidearum and P. carotovorum ssp. brasiliense via quorum sensing regulation. Molecular Plant Pathology. 17 (4), 487-500 (2016).
- Dykes, L., Rooney, L. W. Phenolic compounds in cereal grains and their health benefits. Cereal Foods World. 52 (3), 105-111 (2007).
- Xiang, J., Apea-Bah, F. B., Ndolo, V. U., Katundu, M. C., Beta, T. Profile of phenolic compounds and antioxidant activity of finger millet varieties. Food Chemistry. 275, 361-368 (2019).
- Qiu, Y., Liu, Q., Beta, T. Antioxidant properties of commercial wild rice and analysis of soluble and insoluble phenolic acids. Food Chemistry. 121 (1), 140-147 (2010).
- Beverly, R. L., Motarjemi, Y. . Encyclopedia of Food Safety. 3, 309-314 (2014).
- FAO. Food Outlook - Biannual report on global food markets. Food and Agriculture Organization. , (2020).
- Erbersdobler, H. F., Barth, C. A., Jahreis, G. Legumes in human nutrition. Nutrient content and protein quality of pulses. Ernahrungs Umschau. 64 (9), 134-139 (2017).
- Dueñas, M., Hernández, T., Estrella, I. Assessment of in vitro antioxidant capacity of the seed coat and the cotyledon of legumes in relation to their phenolic contents. Food Chemistry. 98 (1), 95-103 (2006).
- Khang, D. T., Dung, T. N., Elzaawely, A. A., Xuan, T. D. Phenolic profiles and antioxidant activity of germinated legumes. Foods. 5 (2), 27 (2016).
- Hefni, M. E., Amann, L. S., Witthöft, C. M. A HPLC-UV method for the quantification of phenolic acids in cereals. Food Analytical Methods. 12 (12), 2802-2812 (2019).
- AOAC. . Official Methods of Analysis. 17th edn. , (2000).
- Apea-Bah, F. B., Head, D., Scales, R., Bazylo, R., Beta, T. Hydrothermal extraction, a promising method for concentrating phenolic antioxidants from red osier dogwood (Cornus stolonifer) leaves and stems. Heliyon. 6 (10), 05158 (2020).
- Apea-Bah, F. B., Minnaar, A., Bester, M. J., Duodu, K. G. Sorghum-cowpea composite porridge as a functional food, Part II: Antioxidant properties as affected by simulated in vitro gastrointestinal digestion. Food Chemistry. 197, 307-315 (2016).
- Robbins, R. J., Bean, S. R. Development of a quantitative high-performance liquid chromatography-photodiode array detection measurement system for phenolic acids. Journal of Chromatography A. 1038 (1-2), 97-105 (2004).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Prior, R. L., Wu, X., Schaich, K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry. 53 (10), 4290-4302 (2005).
- Ainsworth, E. A., Gillespie, K. M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent. Nature Protocols. 2 (4), 875-877 (2007).
- Waterhouse, A. L. Determination of total phenolics. Current Protocols in Food Analytical Chemistry. 1, 1-8 (2002).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry. 53 (6), 1841-1856 (2005).
- Esterbauer, H., Wäg, G., Puhl, H. Lipid peroxidation and its role in atherosclerosis. British Medical Bulletin. 49 (3), 566-576 (1993).
- Esterbauer, H., Gebicki, J., Puhl, H., Jürgens, G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radical Biology and Medicine. 13 (4), 341-390 (1992).
- Apea-Bah, F. B., Serem, J. C., Bester, M. J., Duodu, K. G. Phenolic composition and antioxidant properties of Koose, a deep-fat fried cowpea cake. Food Chemistry. 237, 247-256 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved