Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Méthode généralisée de détermination de la composition en acide phénolique soluble libre et de la capacité antioxydante des céréales et des légumineuses
Dans cet article
Résumé
Les acides phénoliques sont des composés phytochimiques importants présents dans les grains entiers. Ils possèdent des propriétés bioactives telles que des fonctions protectrices antioxydantes. Ces travaux visaient à rendre compte d’une méthode généralisée pour l’identification HPLC, l’estimation de la teneur totale en phénols et la détermination de la capacité antioxydante des acides phénoliques dans les céréales et les légumineuses.
Résumé
Les acides phénoliques sont une classe de composés organiques qui portent à la fois un groupe phénolique et un groupe carboxylique. On les trouve dans les céréales et les concentrent dans le son des céréales ou dans les téguments des légumineuses. Ils possèdent des propriétés antioxydantes qui ont suscité beaucoup d’intérêt de la recherche ces dernières années, sur leurs fonctions potentielles de protection antioxydante pour la santé. Ce travail présente une méthode généralisée pour l’extraction d’acides phénoliques solubles libres à partir de grains entiers et l’analyse de leur capacité antioxydante. Cinq échantillons de grains entiers comprenant deux céréales (blé et maïs jaune) et trois légumineuses (haricot de vache, haricot et soja) ont été utilisés. Les grains ont été moulus en farine et leurs acides phénoliques solubles libres ont été extraits à l’aide de méthanol aqueux. Les composés ont ensuite été identifiés à l’aide d’un chromatographe liquide à haute pression (CLHP). La méthode Folin-Ciocalteu a été utilisée pour déterminer leur teneur totale en phénols, tandis que leurs capacités antioxydantes ont été déterminées à l’aide de la capacité de piégeage des radicaux DPPH, de la capacité antioxydante équivalente Trolox (TEAC) et de la capacité d’absorption des radicaux oxygénés (ORAC). Les acides phénoliques identifiés comprenaient les acides vanillique, caféique, p-coumarique et férulique. L’acide vanillique n’a été identifié que dans le niébé tandis que l’acide caféique n’a été identifié que dans le haricot rouge. L’acide p-coumarique a été identifié dans le maïs jaune, le niébé et le soja, tandis que l’acide férulique a été identifié dans tous les échantillons. L’acide férulique était l’acide phénolique prédominant identifié. La concentration totale d’acides phénoliques dans les échantillons a diminué dans l’ordre suivant : soja > haricot de niébé > maïs jaune = haricot rouge > blé. La capacité antioxydante totale (somme des valeurs des dosages DPPH, TEAC et ORAC) a diminué comme suit : soja > haricot rouge > maïs jaune = haricot de niébé > blé. Cette étude a conclu que l’analyse CLHP ainsi que les tests DPPH, TEAC et ORAC fournissent des informations utiles sur la composition en acide phénolique et les propriétés antioxydantes des grains entiers.
Introduction
Les acides phénoliques sont parmi les composés phytochimiques les plus importants étudiés chez les plantes en raison du rôle vital qu’ils jouent dans la défense des plantes contre l’herbivorie et les infections fongiques, ainsi que dans le maintien du soutien structurel et de l’intégrité des tissus végétaux 1,2. Ils sont abondants dans le son des céréales et le tégument des légumineuses3. Structurellement, ils sont divisés en deux groupes : les acides hydroxybenzoïques (Figure 1) et les acides hydroxycinnamiques (Figure 2). Les acides hydroxybenzoïques communs dans les céréales et les légumineuses comprennent les acides gallique, p-hydroxybenzoïque, 2,4-dihydroxybenzoïque, protocatéchuique, vanillique et syringique, tandis que les acides hydroxycinnamiques courants comprennent les acides caféique, p-coumarique, férulique et sinaïque3. Les acides phénoliques possèdent également des propriétés antioxydantes puisqu’ils sont capables de piéger les radicaux libres, qui provoquent le rancissement oxydatif des graisses, et d’initier et de propager le stress oxydatif induit par les radicaux dans les systèmes physiologiques 4,5. En raison de ce rôle physiologique vital en tant qu’antioxydants, ils font l’objet de recherches récentes. En effet, lorsqu’ils sont consommés en tant que composants d’aliments végétaux, ils peuvent exercer une protection antioxydante.
Les céréales et les produits céréaliers sont les principales sources alimentaires glucidiques pour les humains et les animaux dans le monde6. Les céréales comprennent le blé, le riz, le maïs, l’orge, le triticale, le mil et le sorgho. Parmi eux, le maïs est le plus utilisé, avec une utilisation mondiale estimée à 1 135,7 millions de tonnes en 2019/2020, suivi du blé avec une utilisation mondiale estimée à 757,5 millions de tonnes au cours de la même période7. Les aliments céréaliers sont d’excellentes sources d’énergie pour les consommateurs car ils sont riches en glucides. Ils fournissent également des protéines, des graisses, des fibres, des vitamines et des minéraux6. En plus de leur valeur nutritive, les céréales sont de bonnes sources d’antioxydants phytochimiques, en particulier les acides phénoliques, qui ont le potentiel de protéger le système physiologique contre les dommages oxydatifs induits par les radicaux3. Les légumineuses sont également de bonnes sources de nutriments et sont généralement plus riches en protéines que les céréales. Ils contiennent également des vitamines et des minéraux et sont utilisés dans la préparation de divers aliments8. De plus, les légumineuses sont de bonnes sources d’une variété d’antioxydants phytochimiques, y compris les acides phénoliques, les flavonoïdes, les anthocyanes et les proanthocyanidines 9,10. Différentes variétés de céréales et de légumineuses peuvent avoir une composition en acide phénolique différente. Il est donc nécessaire d’étudier la composition en acide phénolique des céréales et des légumineuses et de leurs variétés, afin de connaître leurs avantages potentiels pour la santé en ce qui concerne les antioxydants phénoliques.
Un certain nombre d’essais ont été rapportés pour mesurer la quantité d’acides phénoliques dans les céréales et les légumineuses, et déterminer leurs activités antioxydantes. Les méthodes d’analyse les plus courantes des acides phénoliques à grains entiers sont la spectrophotométrie et la chromatographie liquide11. L’objectif de ces travaux était de démontrer une méthode généralisée de chromatographie liquide à haute pression pour déterminer la composition en acide phénolique soluble libre, et des méthodes spectrophotométriques pour déterminer la teneur totale en phénol et la capacité antioxydante de certaines céréales à grains entiers et légumineuses.
Protocole
1. Type d’échantillons
- Utilisez cinq échantillons de grains entiers, comprenant deux céréales (p. ex. blé dur et maïs jaune) et trois légumineuses (p. ex. haricot de vache à œil noir, soja et haricot rouge) pour cette étude.
- Moudre 50 g de chaque grain en trois tranches en farine, à l’aide d’un moulin à café, et les passer à travers un tamis de 500 μm.
- Conservez-les à -20 °C.
2. Préparation de l’échantillon
-
Détermination de la teneur en matière sèche et expression de la base du poids sec
REMARQUE : Déterminer la teneur en matière sèche de chaque échantillon en poudre selon la méthode de l’AOAC (2000)12.- Allumez un four à convection forcée et réglez la température à 130 °C.
- Sécher le dessiccant (gel de silice) au four pendant 30 min à 1 h et transférer le gel de silice séché dans un dessiccateur.
- Pesez avec précision 2 g de chaque échantillon dans une canette en aluminium propre, préséchée et pesée.
- Sécher les échantillons pesés à 130 °C pendant 1 h dans un four à convection forcée.
- Transférer l’échantillon séché dans le dessiccateur et laisser refroidir à température ambiante.
- Peser l’échantillon séché et refroidi et enregistrer son poids.
- Calculer la teneur en matière sèche de chaque échantillon comme suit :
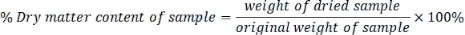
- Exprimer chaque paramètre mesuré en poids sec à l’aide de la formule suivante :

-
Extraction à l’acide phénolique
REMARQUE: Extraire les composés phénoliques libres solubles dans les échantillons de grains en utilisant une modification de la méthode de Y. Qiu et al.5 qui permet l’extraction phénolique à partir de quantités de milligrammes de grains entiers.- Peser avec précision 100 mg de l’échantillon de farine de grains entiers directement dans un tube de microcentrifugation de 2 mL de couleur ambrée. La couleur sombre du tube aide à prévenir l’exposition du mélange à la lumière.
- Ajouter 1 mL de méthanol aqueux de qualité CLHP à 80 % à chacun des tubes contenant les échantillons.
- Vortex brièvement pour mélanger la solution de méthanol et les échantillons.
- Soniquer les échantillons pendant 60 min pour extraire les composés phénoliques solubles libres. Mettez un couvercle sur les échantillons pendant toute la durée de la sonication pour une protection accrue contre la lumière.
- Après sonication, centrifuger le mélange à 20 000 × g pendant 5 min pour sédimenter les résidus solides en laissant le surnageant sur le dessus. Des composés phénoliques libres seront présents dans le surnageant après centrifugation.
- Transférer le surnageant dans un tube de microcentrifugation propre.
REMARQUE: Le surnageant doit être filtré avant d’être injecté dans l’instrument HPLC. Pour filtrer le surnageant, retirez le piston d’une seringue de 3 mL et fixez un filtre à seringue. Le filtre doit avoir une taille de pores ne dépassant pas 0,22 μm. - Pipettez environ 0,4 mL du surnageant dans le haut de la seringue. Réinsérez le piston et poussez le liquide à travers le filtre dans un flacon HPLC contenant un insert de flacon.
- Une fois que l’instrument a été configuré pour exécuter la méthode décrite dans le manuscrit pour l’analyse HPLC, chargez les flacons dans le carrousel pour correspondre à la liste d’échantillons.
- Obtenir des chromatogrammes HPLC à 320 nm et 280 nm montrant des pics distincts représentant différents composés phénoliques.
- En utilisant des courbes standard appropriées, quantifiez les acides hydroxycinnamiques à 320 nm car ils ont une absorbance maximale à cette longueur d’onde. Par le même principe, quantifier les acides hydroxybenzoïques à 280 nm.
- Conserver les extraits restants à -20 °C pour d’autres analyses.
3. Composition phénolique
- Utilisez un chromatographe liquide à haute pression (Table des matériaux) pour identifier et quantifier les composés phénoliques extraits dans les échantillons, sur la base de la méthode de J. Xiang, F.B. Apea-Bah, V. U. Ndolo, M.C. Katundu et T. Beta 4.
- Préparer des étalons d’acide phénolique (acide vanillique, acide caféique, acide p-coumarique, acide férulique et acide sinaïque) pour identifier et quantifier les composés phénoliques constitutifs dans les extraits.
- Pour ce faire, peser 1 mg de chaque étalon et dissoudre dans 1 mL de méthanol aqueux à 50 % pour produire 1 000 μg/mL de chaque étalon.
- Mélanger des volumes égaux des cinq étalons dans un tube de centrifugeuse ambrée de 2 mL pour produire un cocktail d’étalons, chacun ayant une concentration de 200 μg/mL.
- Préparer les dilutions en série du cocktail standard en prenant un volume dans un nouveau tube et en diluant avec un volume égal du solvant aqueux de méthanol.
- Répétez les dilutions en série jusqu’à une concentration de 3,125 μg/mL.
- De plus, diluer séparément chaque étalon 40 fois avec le solvant pour obtenir une concentration de 25 μg/mL de chaque étalon.
- Réglez la température de la colonne à 35 °C et la température du four d’échantillonnage à 15 °C.
- Pour préparer la phase A mobile (acide formique aqueux à 0,1 %), transférer 1 mL d’acide formique dans une fiole volumétrique d’une capacité de 1 L et ajouter de l’eau de qualité CLHP à la marque de 1 L. Bien agiter pour mélanger.
- Pour préparer la phase B mobile (0,1 % d’acide formique dans le méthanol), transférer 1 mL d’acide formique dans une fiole volumétrique d’une capacité de 1 L et ajouter du méthanol de qualité CLHP à la marque de 1 L. Bien agiter pour mélanger.
- Ajustez les volumes à la marque 1 L si nécessaire.
- Filtrer les deux phases mobiles à l’aide d’un papier filtre hydrophile de 0,45 μm.
- Pour l’analyse, injecter 10 μL de chaque extrait ou étalon (étalons de 25 μg/mL et cocktails étalons) dans la colonne de phase inverse.
- Elute avec les phases mobiles selon le programme de gradient linéaire pour une course de 25 min comme suit: 0-3,81 min, 9%-14% B; 3,81-4,85 min, 14%-15% B; 4,85-5,89 min, 15%-15% B, 5,89-8,32 min, 15%-17% B; 8,32-9,71 min, 17%-19% B; 9,71-10,40 min, 19%-19% B; 10,40-12,48 min, 19%-26% B; 12,48-13,17 min, 16%-28% B; 13,17-14,21 min, 28%-35% B; 14,21-15,95 min, 35%-40% B; 15,95-16,64 min, 40%-48% B; 16,64-18,37 min, 48%-53% B; 18,37-22,53 min, 53%-70% B; 22,53-22,88 min, 70%-90% B; 22.88-25.00 min, 90% B.
- Comparer les temps de rétention des pics chromatographiques obtenus pour les étalons authentiques de concentrations de 25 μg/mL, à 280 nm et 320 nm, avec ceux des extraits, afin d’identifier les composés phénoliques constitutifs dans les échantillons.
- Tracer les courbes d’étalonnage pour les cocktails étalons d’acide phénolique, avec concentration des étalons sur l’axe horizontal et la zone de crête sur l’axe vertical
- Utilisez les courbes d’étalonnage pour estimer les concentrations des composés phénoliques identifiés, en comparant les zones de crête sur la placette avec celles des composés identifiés à 280 nm et 320 nm comme mentionné dans la section précédente.
4. Teneur totale en phénol
NOTE: Déterminer la teneur totale en phénol des extraits à l’aide de la méthode Folin-Ciocalteu décrite par F.B. Apea-Bah et al.13.
- Préparer des étalons d’acide férulique et d’acide gallique dans la plage de concentration de 0,025 à 0,150 mg/mL pour tracer des courbes d’étalonnage en comparaison, afin d’estimer la teneur totale en phénols.
- Pour ce faire, pesez avec précision 1 mg d’acide férulique et d’acide gallique dans des tubes centrifuges d’une capacité de 2 mL.
- Ajouter 1 mL de méthanol aqueux à 50 % à chaque étalon et vortex à dissoudre, produisant 1 mg/mL de stock de chaque étalon.
- Préparer une série de dilutions de chaque solution mère dans un total de 500 μL.
- Pipette 18,2 μL de chaque extrait ou étalon dans un puits séparé sur une microplaque de 96 puits.
- Ajouter 36,4 μL de réactif aqueux Folin-Ciocalteu à 10 % (v/v) à chaque extrait ou étalon.
- Ensuite, ajoutez 145,4 μL de carbonate de sodium de 700 mM à chaque mélange réactionnel.
- Incuber les mélanges réactionnels dans l’obscurité à température ambiante (20-25 °C) pendant 2 h.
- Lisez l’absorbance sur un lecteur de microplaques à 750 nm.
- Tracer les courbes d’étalonnage de la variation de l’absorbance par rapport à la concentration des étalons d’acide phénolique et les utiliser pour estimer les teneurs totales en phénols.
- Exprimer les résultats en milligrammes équivalents acide férulique par gramme d’échantillon broyé (mg d’EAF/g) et en milligrammes d’équivalents d’acide gallique par gramme d’échantillon broyé (mg DGA/g) sur la base du poids sec.
5. Tests antioxydants
REMARQUE: Déterminer la capacité antioxydante des extraits de grain à l’aide des trois dosages suivants: capacité de piégeage des radicaux 2,2-diphényl-1-picrylhydrazyl (DPPH); Capacité de piégeage des radicaux de l’acide 2,2'-azino-bis(3-éthylbenzothiazoline-6-sulfonique (ABTS), également appelée capacité antioxydante équivalente à Trolox (TEAC); et capacité d’absorption des radicaux oxygénés (ORAC).
- Préparation des étalons Trolox pour les courbes standard
- Utilisez Trolox, un analogue hydrosoluble de la vitamine E, comme standard pour estimer la capacité antioxydante in vitro des extraits de grains entiers.
- Peser avec précision 1 mg de Trolox dans un tube de 15 mL. Dissoudre dans 4 mL de méthanol aqueux à 50 %. Vortex à dissoudre pour préparer une solution mère de 1 mM (1000 μM).
- Préparer six concentrations de Trolox, c’est-à-dire 50, 100, 200, 400, 600 et 800 μM pour tracer des courbes standard pour l’estimation de la capacité de piégeage des radicaux DPPH et de la capacité antioxydante équivalente Trolox (TEAC). De même, préparez des concentrations de 6,25, 12,5, 25 et 50 μM de Trolox pour estimer la capacité d’absorption des radicaux oxygénés (ORAC). Porter le volume total de chaque concentration à 500 μL comme indiqué dans le tableau 1.
- Dilution d’extraits d’échantillons
- Diluer les extraits d’échantillon avec du méthanol avant l’analyse. Ici, les extraits de maïs jaune et de niébé ont été dilués deux fois, le blé et le haricot rouge ont été dilués cinq fois tandis que l’extrait de soja a été dilué 10 fois avec du méthanol.
- Test de capacité antioxydante équivalente au trolox (TEAC)
- Mesurer la capacité antioxydante équivalente à Trolox (TEAC) des échantillons en utilisant la méthode décrite précédemment par F.B. Apea-Bah et al.14.
- Peser 8,23 mg d’ABTS dans un tube de centrifugeuse orange propre de 2 mL de capacité.
- Ensuite, pesez 1,62 mg de persulfate de potassium dans un autre tube de centrifugeuse orange propre de 2 mL de capacité.
- Ajouter 1 mL d’eau distillée à chacun d’eux et vortex pour les dissoudre.
REMARQUE: Il en résulte une solution mère ABTS de 16 mM avec une solution aqueuse de persulfate de potassium de 6 mM. - Préparer la solution mère ABTS en mélangeant les solutions ABTS et persulfate de potassium en volumes égaux. La solution passera immédiatement à une couleur sombre.
- Incuber le mélange de réactif dans l’obscurité pendant 12-16 h.
- Diluer la solution mère ABTS 30 fois avec une solution saline tamponnée au phosphate (PBS) de 200 mM, pour former la solution de travail ABTS. Pour ce faire, ajoutez 58 mL de PBS de 200 mM à 2 mL de la solution mère ABTS. La solution de travail contiendra 0,27 mM d’ABTS et 0,1 mM de persulfate de potassium.
- Pour l’analyse, placez 10 μL de chaque extrait dilué ou Trolox dans une microplaque de 96 puits.
- Ajouter 190 μL de solution de travail ABTS à chaque puits et incuber les mélanges réactionnels pendant 60 min.
- Mesurer l’absorbance des mélanges réactionnels à 750 nm dans un lecteur de microplaques.
- Utilisez les étalons Trolox à une concentration comprise entre 100 et 800 μmol/L pour tracer une courbe d’étalonnage.
- Estimer la capacité de piégeage des radicaux ABTS à partir de la courbe d’étalonnage.
- Exprimer les résultats sous forme d’équivalents Trolox en micromoles par gramme (μmol TE/g) d’échantillon sur la base du poids sec.
- Dosage de la DPPH
REMARQUE: Déterminer la capacité de piégeage des radicaux DPPH des échantillons en utilisant la méthode décrite précédemment par F.B. Apea-Bah et al.13. Le test antioxydant DPPH nécessite un composé générateur de radicaux, DPPH (2,2-diphényl-1-picrylhydrazyl).- Peser avec précision 1,2 mg de DPPH dans un tube de centrifugeuse vide d’une capacité de 50 mL. Dissoudre le DPPH dans 30 mL de méthanol pour préparer une solution méthanolique de 60 μmol/L.
REMARQUE: Le test DPPH teste la capacité des extraits d’échantillons à piéger les radicaux libres produits par DPPH. - Pour l’analyse, ajouter 5 μL d’extraits d’échantillon ou de solution de Trolox dans les puits de microplaques.
- Ensuite, ajouter 195 μL de la solution méthanolique DPPH de 60 μmol/L et incuber pendant 60 min.
- Mesurer l’absorbance du mélange réactionnel à 515 nm.
- Utilisez les étalons Trolox (50-800 μmol/L) pour tracer une courbe d’étalonnage, avec le changement d’absorbance sur l’axe vertical et les concentrations de Trolox sur l’axe horizontal.
- Estimer la capacité de récupération DPPH à partir de la courbe d’étalonnage.
- Exprimer les résultats sous forme d’équivalents Trolox en micromoles par gramme (μmol TE/g) d’échantillon sur la base du poids sec.
- Peser avec précision 1,2 mg de DPPH dans un tube de centrifugeuse vide d’une capacité de 50 mL. Dissoudre le DPPH dans 30 mL de méthanol pour préparer une solution méthanolique de 60 μmol/L.
- Capacité d’absorption des radicaux d’oxygène
- Déterminer la capacité d’absorption des radicaux oxygénés (ORAC) des échantillons en fonction de la méthode de F.B. Apea-Bah et al.13.
- Pour commencer, préparer des étalons Trolox de concentrations 6,25, 12,5, 25 et 50 μM à partir d’une solution mère étalon Trolox de 1 000 μM dans un tampon de phosphate de potassium de 75 mM (K2 HPO4/KH2PO4).
- Pour ce faire, peser 1 mg de poudre de Trolox et dissoudre dans 4 mL de la solution tampon sous sonication pour préparer une solution mère de 1 000 μM.
- Ensuite, prendre 50 μL de la solution mère dans un tube centrifuge de 2 mL de capacité et diluer avec 950 μL de solution tampon pour obtenir 1 000 μL de solution de Trolox de 50 μM.
- Pipeter 500 μL de la solution de 50 μM dans un nouveau tube et diluer avec un volume égal de tampon pour obtenir une solution de Trolox de 25 μM.
- Répétez la dilution en série des 25 μM pour obtenir 12,5 μM, puis répétez de la même manière la dilution de 12,5 μM pour obtenir 6,25 μM.
- Préparer les dilutions appropriées des extraits d’échantillons.
- Diluer les extraits jaunes de maïs et de niébé 20 fois, les extraits de blé et de haricots rouges 50 fois et l’extrait de soja 100 fois avec la solution tampon.
- Transférer 200 μL de chaque échantillon ou étalon Trolox dans les puits d’une microplaque noire de 96 puits pour un pipetage automatique.
- Ensuite, remplissez les trois réservoirs de réactifs fournis avec l’équipement ORAC, avec les éléments suivants: (1) la solution tampon; 2° 0,816 nM de fluorescéine dans le tampon; et (3) 153 mM de dichlorhydrate de 2,2′-azobis(2-amidinopropane) (AAPH) en tampon.
- Placez-les dans leurs récipients pour le pipetage automatique.
- Configurez la machine ORAC et le système de pipetage automatique pour l’analyse, sur la base de la procédure d’exploitation standard.
- Pour l’analyse, configurez le système de pipetage automatisé pour transférer 25 μL de chaque extrait dilué ou étalon vers les puits d’une microplaque noire de 96 puits à fond clair.
- Ensuite, ajoutez automatiquement 150 μL de 0,816 nM de fluorescéine dans le tampon.
- Incuber le mélange réactionnel à 37 °C pendant 15 min dans la machine ORAC.
- Ensuite, ajoutez automatiquement 25 μL de l’AAPH à chaque mélange réactionnel.
- Incuber à 37 °C pendant 50 min dans la machine ORAC.
- Configurez la machine ORAC pour mesurer la désintégration de fluorescence, au cours de la période d’incubation, à des longueurs d’onde d’excitation et d’émission de 485 nm et 520 nm, respectivement.
- Après les mesures, tracez une courbe standard Trolox, avec Trolox (6,25-50 μM) sur l’axe horizontal et la désintégration de fluorescence sur l’axe vertical.
- Estimer la capacité d’absorption des radicaux oxygénés des extraits de la courbe standard de Trolox.
- Exprimer les résultats sous forme d’échantillon de μmol TE/g sur la base du poids sec.
- Analyse statistique
- Présentez tous les résultats comme des moyens ±'écart-type d’au moins trois fois.
- Effectuer une analyse de variance (ANOVA) pour déterminer l’effet du type de grain sur les variables de réponse.
- Lorsqu’il existe des différences significatives à p < 0,05, utilisez la différence la moins significative (LSD) pour comparer les moyennes.
- Effectuer une analyse de corrélation de Pearson pour estimer la relation entre la teneur en phénols et les capacités antioxydantes.
Résultats
Le tableau 2 montre les acides phénoliques qui ont été identifiés dans les céréales et les légumineuses. Sur la base des normes authentiques disponibles, quatre acides phénoliques ont été identifiés dans les échantillons et ils sont: les acides vanillique, caféique, p-coumarique et férulique. L’acide vanillique est un acide hydroxybenzoïque tandis que les trois autres sont des acides hydroxycinnamiques. L’acide vanillique n’a été identifié que dans le haricot de niébé ...
Discussion
Les grains entiers ont été sélectionnés comme grains de céréales et légumineuses représentatifs qui trouvent de larges applications alimentaires dans le monde entier. Bien que des variations puissent exister entre les cultivars de chaque grain, l’objectif de cette étude était de démontrer une méthode généralisée d’extraction et d’analyse de l’acide phénolique libre pour les grains entiers. La méthode d’extraction a été modifiée en réduisant considérablement les quantités d’échantillons...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les auteurs remercient Mme Alison Ser et Mme Hannah Oduro-Obeng pour le soutien technique de Mme Alison Ser et de Mme Hannah Oduro-Obeng, ainsi que pour le soutien au montage vidéo de Mme Janice Fajardo et de M. Miguel del Rosario.
matériels
| Name | Company | Catalog Number | Comments |
| 15 mL Falcon conical centrifuge tubes | Fisher Scientific | 05-527-90 | |
| 2 mL Amber glass ID Surestop vial | Thermo Scientific | C5000-2W | |
| 2 mL Amber microcentrifuge tubes | VWR | 20170-084 | |
| 2,2′-Azobis(2-amidinopropane) dihydrochloride (AAPH) | Sigma-Aldrich | 440914-100G | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) (C18H18N4O6S4) ≥98%, | Sigma Aldrich | A1888-2G | |
| 2,2-Diphenyl-1pikrylhydrazyl (DPPH) (C18H12N5O6) | Sigma Aldrich | D913-2 | |
| 6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox) (C14H18O4), ≥98% | Fluka Chemika | 56510 | |
| 9 mm Autosampler Vial Screw Thread Caps | Thermo Scientific | 60180-670 | |
| 96 well flat bottom plates | Fisher Scientific | 12565501 | |
| Agilent BioTek ELx800 microplate reader | Fisher Scientific | BT-ELX800NB | |
| Agilent BioTek Precision 2000 96/384 Automated Microplate Pipetting System | Fisher Scientific | N/A | |
| Agilent BioTek FLx800 Microplate Fluorescence Reader | Fisher Scientific | N/A | |
| Analytical balance SI-114 | Denver Instrument | SI-114.1 | |
| Autosampler, Waters 717 Plus | Waters | WAT078900 | |
| BD 3 mL syringe Luer-Lok Tip | BD | 309657 | |
| Bransonic ultrasonic cleaner, Branson 5510 | Millipore Sigma | Z245143 | |
| Corning LSE Vortex Mixer | Corning | 6775 | |
| Durapore Filter (0.45 µm PVDF Membrane) | Merck Millipore Ltd | HVLP04700 | |
| Durapore Membrane Filters (0.45 µm HV) | Merck Millipore Ltd | HVHP04700 | |
| Eppendorf Research plus, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research plus, 0.5-5 mL | Eppendorf | 3123000071 | |
| Eppendorf Research plus, 100-1000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research plus, 10-100 µL | Eppendorf | 3123000047 | |
| Ethyl acetate, HPLC grade | Fisher Chemical | E195-4 | |
| Ferulic acid standard | Sigma Aldrich | 128708-5G | |
| Fluorescein | Fisher Scientific | AC119245000 | |
| Folin & Ciocalteu phenol reagent | Sigma Aldrich | F9252 | |
| Formic acid, 99% | Acros Organics, Janssen Pharmaceuticalaan 3a | 27048-0010 | |
| Gallic acid standard | Sigma | G7384 | |
| High performance liquid chromatograph (HPLC), Waters 2695 | Waters | 960402 | |
| Methanol, HPLC grade | Fisher Chemical | A452-4 | |
| Micro pipet tips, 0.5-10 µL | Fisherbrand | 21-197-2F | |
| Microcentrifuge Sorvall Legend Micro 21 centrifuge | Thermo Scientific | 75002435 | |
| Multichannel micropipette, Proline Plus, 30-300 µL | Sartorius | 728240 | |
| Photodiode array detector, Waters 2996 | Waters | 720000350EN | |
| Pipet tips, 1000 µL | VWR | 83007-382 | |
| Pipet tips, 1-5 mL | VWR | 82018-840 | |
| Potassium persulfate (K2S2O8), ≥99.0% | Sigma Aldrich | 216224-100G | |
| Potassium phosphate dibasic anhydrous (K2HPO4) | Fisher Scientific | P288-500 | |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | P285-500 | |
| PYREX 250 mL Short Neck Boiling Flask, Round Bottom | Corning | 4321-250 | |
| Reversed phase C18 Analytical Column (100 x 3 mm) Accucore aQ | Thermo Scientific | 17326-103030 | |
| Roto evaporator, IKA RV 10 | IKA | 0010005185 | |
| Sodium carbonate (NaCO3) anhydrous | Fisher Chemical | S263-1 | |
| Sodium chloride (NaCl) | Mallinckrodt AR® | 7581 | |
| Sodium phosphate dibasic anhydrous (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Sodium phosphate monobasic anhydrous (NaH2PO4) | Fisher bioreagents | BP329-500 | |
| Standardization pipet tips 0-200µL | Fisherbrand | 02-681-134 | |
| Syringe Driven Filter unit (0.22 µm) | Millex®-GV | SLGVR04NL | |
| Target micro-serts vial insert (400 µL) | Thermo Scientific | C4011-631 | |
| Ultrapure water (Direct Q-3 UV system with pump) | Millipore | ZRQSVP030 |
Références
- Huitu, O., et al. Silicon, endophytes and secondary metabolites as grass defenses against mammalian herbivores. Frontiers in Plant Science. 5, 478 (2014).
- Joshi, J. R., Burdman, S., Lipsky, A., Yariv, S., Yedidia, I. Plant phenolic acids affect the virulence of Pectobacterium aroidearum and P. carotovorum ssp. brasiliense via quorum sensing regulation. Molecular Plant Pathology. 17 (4), 487-500 (2016).
- Dykes, L., Rooney, L. W. Phenolic compounds in cereal grains and their health benefits. Cereal Foods World. 52 (3), 105-111 (2007).
- Xiang, J., Apea-Bah, F. B., Ndolo, V. U., Katundu, M. C., Beta, T. Profile of phenolic compounds and antioxidant activity of finger millet varieties. Food Chemistry. 275, 361-368 (2019).
- Qiu, Y., Liu, Q., Beta, T. Antioxidant properties of commercial wild rice and analysis of soluble and insoluble phenolic acids. Food Chemistry. 121 (1), 140-147 (2010).
- Beverly, R. L., Motarjemi, Y. . Encyclopedia of Food Safety. 3, 309-314 (2014).
- FAO. Food Outlook - Biannual report on global food markets. Food and Agriculture Organization. , (2020).
- Erbersdobler, H. F., Barth, C. A., Jahreis, G. Legumes in human nutrition. Nutrient content and protein quality of pulses. Ernahrungs Umschau. 64 (9), 134-139 (2017).
- Dueñas, M., Hernández, T., Estrella, I. Assessment of in vitro antioxidant capacity of the seed coat and the cotyledon of legumes in relation to their phenolic contents. Food Chemistry. 98 (1), 95-103 (2006).
- Khang, D. T., Dung, T. N., Elzaawely, A. A., Xuan, T. D. Phenolic profiles and antioxidant activity of germinated legumes. Foods. 5 (2), 27 (2016).
- Hefni, M. E., Amann, L. S., Witthöft, C. M. A HPLC-UV method for the quantification of phenolic acids in cereals. Food Analytical Methods. 12 (12), 2802-2812 (2019).
- AOAC. . Official Methods of Analysis. 17th edn. , (2000).
- Apea-Bah, F. B., Head, D., Scales, R., Bazylo, R., Beta, T. Hydrothermal extraction, a promising method for concentrating phenolic antioxidants from red osier dogwood (Cornus stolonifer) leaves and stems. Heliyon. 6 (10), 05158 (2020).
- Apea-Bah, F. B., Minnaar, A., Bester, M. J., Duodu, K. G. Sorghum-cowpea composite porridge as a functional food, Part II: Antioxidant properties as affected by simulated in vitro gastrointestinal digestion. Food Chemistry. 197, 307-315 (2016).
- Robbins, R. J., Bean, S. R. Development of a quantitative high-performance liquid chromatography-photodiode array detection measurement system for phenolic acids. Journal of Chromatography A. 1038 (1-2), 97-105 (2004).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Prior, R. L., Wu, X., Schaich, K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry. 53 (10), 4290-4302 (2005).
- Ainsworth, E. A., Gillespie, K. M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent. Nature Protocols. 2 (4), 875-877 (2007).
- Waterhouse, A. L. Determination of total phenolics. Current Protocols in Food Analytical Chemistry. 1, 1-8 (2002).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry. 53 (6), 1841-1856 (2005).
- Esterbauer, H., Wäg, G., Puhl, H. Lipid peroxidation and its role in atherosclerosis. British Medical Bulletin. 49 (3), 566-576 (1993).
- Esterbauer, H., Gebicki, J., Puhl, H., Jürgens, G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radical Biology and Medicine. 13 (4), 341-390 (1992).
- Apea-Bah, F. B., Serem, J. C., Bester, M. J., Duodu, K. G. Phenolic composition and antioxidant properties of Koose, a deep-fat fried cowpea cake. Food Chemistry. 237, 247-256 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon