Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine verallgemeinerte Methode zur Bestimmung der frei löslichen Phenolsäurezusammensetzung und der antioxidativen Kapazität von Getreide und Hülsenfrüchten
In diesem Artikel
Zusammenfassung
Phenolsäuren sind wichtige sekundäre Pflanzenstoffe, die in Vollkornprodukten vorhanden sind. Sie besitzen bioaktive Eigenschaften wie antioxidative Schutzfunktionen. Diese Arbeit zielte darauf ab, über eine verallgemeinerte Methode zur HPLC-Identifizierung, zur Schätzung des Gesamtphenolgehalts und zur Bestimmung der antioxidativen Kapazität von Phenolsäuren in Getreide und Hülsenfrüchten zu berichten.
Zusammenfassung
Phenolsäuren sind eine Klasse organischer Verbindungen, die sowohl eine phenolische Gruppe als auch eine Carbongruppe tragen. Sie kommen in Körnern und Konzentrat in der Kleie von Getreide oder Samenschale von Hülsenfrüchten vor. Sie besitzen antioxidative Eigenschaften, die in den letzten Jahren viel Forschungsinteresse an ihren potenziellen antioxidativen schützenden Gesundheitsfunktionen geweckt haben. Diese Arbeit stellt eine verallgemeinerte Methode zur Extraktion von frei löslichen Phenolsäuren aus Vollkornprodukten und zur Analyse ihrer antioxidativen Kapazität vor. Es wurden fünf Vollkornproben verwendet, die aus zwei Getreidearten (Weizen und gelber Mais) und drei Hülsenfrüchten (Kuhbohnen, Kidneybohnen und Sojabohnen) bestanden. Die Körner wurden zu Mehl gemahlen und ihre frei löslichen Phenolsäuren mit wässrigem Methanol extrahiert. Die Verbindungen wurden dann mit einem Hochdruck-Flüssigkeitschromatographen (HPLC) identifiziert. Die Folin-Ciocalteu-Methode wurde verwendet, um ihren Gesamtphenolgehalt zu bestimmen, während ihre antioxidativen Kapazitäten unter Verwendung der DPPH-Radikalfängerkapazität, der Trolox-äquivalenten antioxidativen Kapazität (TEAC) und der Sauerstoffradikalabsorptionskapazität (ORAC) bestimmt wurden. Zu den identifizierten Phenolsäuren gehörten Vanill-, Kaffee-, p-Cumarsäure und Ferulasäure. Vanillinsäure wurde nur in Kuhbohnen identifiziert, während Kaffeesäure nur in Kidneybohnen identifiziert wurde. p-Coumarsäure wurde in gelbem Mais, Kuhbohnen und Sojabohnen identifiziert, während Ferulasäure in allen Proben identifiziert wurde. Ferulasäure war die vorherrschende Phenolsäure, die identifiziert wurde. Die Gesamtkonzentration der Phenolsäuren in den Proben nahm in der folgenden Reihenfolge ab: Sojabohnen > Kuhbohnenbohnen > gelber Mais = Kidneybohnen > Weizen. Die gesamte antioxidative Kapazität (Summe der Werte von DPPH-, TEAC- und ORAC-Assays) nahm wie folgt ab: Sojabohnen > Kidneybohnen > gelber Mais = Kuhbohnenbohnen > Weizen. Diese Studie kam zu dem Schluss, dass HPLC-Analysen sowie DPPH-, TEAC- und ORAC-Assays nützliche Informationen über die Phenolsäurezusammensetzung und die antioxidativen Eigenschaften von Vollkornprodukten liefern.
Einleitung
Phenolsäuren gehören zu den wichtigsten Phytochemikalien, die in Pflanzen untersucht werden, da sie eine wichtige Rolle bei der Pflanzenabwehr gegen Pflanzenfresser und Pilzinfektionen spielen und die strukturelle Unterstützung und Integrität im Pflanzengewebeaufrechterhalten werden 1,2. Sie sind reichlich in der Kleie von Getreide und Samenmantel von Hülsenfrüchten3. Strukturell werden sie in zwei Gruppen unterteilt: die Hydroxybenzoesäuren (Abbildung 1) und die Hydroxyzimtsäuren (Abbildung 2). Die üblichen Hydroxybenzoesäuren in Getreide und Hülsenfrüchten umfassen Gallus-, p-Hydroxybenzoesäure, 2,4-Dihydroxybenzoe, Protokatechusäure, Vanillsäure und Spritzwassersäure, während die üblichen Hydroxyzimtsäuren Kaffee-, p-Cumarin-, Ferula- und Sinapsäurenenthalten 3. Phenolsäuren besitzen auch antioxidative Eigenschaften, da sie in der Lage sind, freie Radikale abzufangen, die oxidative Ranzigkeit in Fetten verursachen, und radikalinduzierten oxidativen Stress in physiologischen Systemen zu initiieren und zu verbreiten 4,5. Aufgrund dieser lebenswichtigen physiologischen Rolle als Antioxidantien sind sie Gegenstand neuerer Forschungen. Dies liegt daran, dass sie, wenn sie als Bestandteile pflanzlicher Lebensmittel konsumiert werden, einen antioxidativen Schutz ausüben können.
Getreide und Getreideprodukte sind weltweit wichtige Kohlenhydrat-Nahrungsquellen für Mensch und Tier6. Zu den Getreidearten gehören Weizen, Reis, Mais (Mais), Gerste, Triticale, Hirse und Sorghum. Unter ihnen ist Mais mit einer geschätzten globalen Nutzung von 1.135,7 Millionen Tonnen im Jahr 2019/2020 am meistgenutzten, gefolgt von Weizen mit einer geschätzten globalen Nutzung von 757,5 Millionen Tonnen im gleichen Zeitraum7. Getreideprodukte sind großartige Energiequellen für die Verbraucher, da sie reich an Kohlenhydraten sind. Sie liefern auch etwas Protein, Fett, Ballaststoffe, Vitamine und Mineralien6. Neben ihrem Nährwert sind Getreide gute Quellen für phytochemische Antioxidantien, insbesondere Phenolsäuren, die das physiologische System vor radikalinduzierten oxidativen Schäden schützenkönnen 3. Hülsenfrüchte sind auch gute Nährstoffquellen und haben im Allgemeinen einen höheren Proteingehalt als Getreide. Sie enthalten auch Vitamine und Mineralstoffe und werden bei der Zubereitung verschiedener Lebensmittelverwendet 8. Darüber hinaus sind Hülsenfrüchte gute Quellen für eine Vielzahl von phytochemischen Antioxidantien, einschließlich Phenolsäuren, Flavonoiden, Anthocyanen und Proanthocyanidinen 9,10. Verschiedene Getreidesorten und Hülsenfrüchte können eine unterschiedliche Phenolsäurezusammensetzung aufweisen. Es besteht daher die Notwendigkeit, die Phenolsäurezusammensetzung von Getreide und Hülsenfrüchten und deren Sorten zu untersuchen, um ihre potenziellen gesundheitlichen Vorteile in Bezug auf phenolische Antioxidantien zu kennen.
Es wurde eine Reihe von Assays zur Messung der Menge an Phenolsäuren in Getreide- und Hülsenfrüchtekörnern und zur Bestimmung ihrer antioxidativen Aktivitäten berichtet. Die gebräuchlichsten Analysemethoden für Vollkornphenolsäuren sind die Spektrophotometrie und die Flüssigkeitschromatographie11. Das Ziel dieser Arbeit war es, eine generalisierte Hochdruck-Flüssigkeitschromatographiemethode zur Bestimmung der frei löslichen Phenolsäurezusammensetzung und spektralphotometrische Methoden zur Bestimmung des Gesamtphenolgehalts und der antioxidativen Kapazität einiger Vollkorngetreide- und Hülsenfrüchte zu demonstrieren.
Protokoll
1. Art der Proben
- Verwenden Sie für diese Studie fünf Vollkornproben, bestehend aus zwei Getreidearten (z. B. Hartweizen und gelber Mais) und drei Hülsenfrüchten (z. B. Blackeye-Kuhbohnen, Sojabohnen und rote Kidneybohnen).
- Mahlen Sie 50 g jedes Getreides in dreifacher Vervielfältigung mit einer Kaffeemühle zu Mehl und führen Sie sie durch ein 500 μm großes Sieb.
- Lagern Sie sie bei -20 °C.
2. Probenvorbereitung
-
Bestimmung des Trockensubstanzgehalts und Angabe der Trockengewichtsbasis
HINWEIS: Bestimmen Sie den Trockensubstanzgehalt jeder pulverförmigen Probe nach der Methode von AOAC (2000) 12.- Schalten Sie einen Zwangskonvektionsofen ein und stellen Sie die Temperatur auf 130 °C ein.
- Trockenes Trockenmittel (Kieselgel) im Ofen für 30 min bis 1 h und das getrocknete Kieselgel in ein Exsikkator geben.
- Wiegen Sie 2 g jeder Probe genau in eine saubere, vorgetrocknete und gewogene Aluminiumdose.
- Trocknen Sie die gewogenen Proben bei 130 °C für 1 h in einem Zwangskonvektionsofen.
- Die getrocknete Probe in den Exsikkator geben und auf Umgebungstemperatur abkühlen lassen.
- Wiegen Sie die getrocknete, abgekühlte Probe und notieren Sie ihr Gewicht.
- Berechnen Sie den Trockensubstanzgehalt jeder Probe wie folgt:
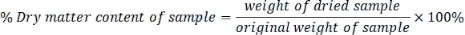
- Drücken Sie jeden in Trockengewicht gemessenen Parameter mit der folgenden Formel aus:

-
Phenolsäure-Extraktion
HINWEIS: Extrahieren Sie die löslichen freien phenolischen Verbindungen in den Getreideproben mit einer Modifikation der Methode von Y. Qiu et al.5, die eine phenolische Extraktion aus Milligrammmengen von Vollkornprodukten ermöglicht.- Genaues Wiegen von 100 mg der Vollkornmehlprobe direkt in ein bernsteinfarbenes Mikrozentrifugenröhrchen mit einer Kapazität von 2 ml. Die dunkle Farbe der Tube hilft, die Lichteinwirkung der Mischung zu verhindern.
- Fügen Sie 1 ml 80% wässriges HPLC-Methanol zu jedem der Röhrchen hinzu, die die Proben enthalten.
- Kurz vorwirbeln, um die Methanollösung und die Proben zu mischen.
- Beschallen Sie die Proben für 60 Minuten, um die frei löslichen phenolischen Verbindungen zu extrahieren. Legen Sie eine Abdeckung über die Proben für die Dauer der Beschallung, um zusätzlichen Schutz vor Licht zu erhalten.
- Nach der Beschallung zentrifugieren Sie die Mischung bei 20.000 × g für 5 Minuten, um die festen Rückstände zu sedimentieren, die den Überstand oben hinterlassen. Freie phenolische Verbindungen werden nach der Zentrifugation im Überstand vorhanden sein.
- Überfüllen Sie den Überstand in ein sauberes Mikrozentrifugenröhrchen.
HINWEIS: Der Überstand muss vor der Injektion in das HPLC-Instrument gefiltert werden. Um den Überstand zu filtern, entfernen Sie den Kolben einer 3-ml-Spritze und befestigen Sie einen Spritzenfilter. Der Filter sollte eine Porengröße von nicht größer als 0,22 μm haben. - Pipette ca. 0,4 ml des Überstands in die Oberseite der Spritze. Setzen Sie den Kolben wieder ein und drücken Sie die Flüssigkeit durch den Filter in eine HPLC-Durchstechflasche, die einen Durchstechflascheneinsatz enthält.
- Sobald das Gerät so eingerichtet wurde, dass es die im Manuskript beschriebene Methode für die HPLC-Analyse ausführt, laden Sie die Fläschchen in das Karussell, um der Probenliste zu entsprechen.
- HPLC-Chromatogramme bei 320 nm und 280 nm mit deutlichen Peaks, die verschiedene phenolische Verbindungen darstellen.
- Quantifizieren Sie Hydroxyzimtsäuren unter Verwendung geeigneter Standardkurven bei 320 nm, da sie bei dieser Wellenlänge eine maximale Absorption aufweisen. Nach dem gleichen Prinzip quantifizieren Sie Hydroxybenzoesäuren bei 280 nm.
- Lagern Sie die restlichen Extrakte bei -20 °C für andere Analysen.
3. Phenolische Zusammensetzung
- Verwenden Sie einen Hochdruck-Flüssigkeitschromatographen (Table of Materials), um die extrahierten phenolischen Verbindungen in den Proben zu identifizieren und zu quantifizieren, basierend auf der Methode von J. Xiang, F.B. Apea-Bah, V. U. Ndolo, M.C. Katundu und T. Beta 4.
- Bereiten Sie Phenolsäurestandards (Vanillinsäure, Kaffeesäure, p-Cumarsäure, Ferulasäure und Sinapsäure) vor, um die phenolischen Verbindungen in den Extrakten zu identifizieren und zu quantifizieren.
- Wiegen Sie dazu 1 mg jedes Standards und lösen Sie es in 1 ml 50% wässrigem Methanol auf, um 1.000 μg / ml jedes Standards zu erhalten.
- Mischen Sie gleiche Volumina aller fünf Standards in einem 2 ml gelben Zentrifugenröhrchen, um einen Cocktail von Standards mit einer Konzentration von jeweils 200 μg / ml zu erzeugen.
- Bereiten Sie serielle Verdünnungen des Standardcocktails vor, indem Sie ein Volumen in ein neues Röhrchen nehmen und mit gleichem Volumen des wässrigen Methanollösungsmittels verdünnen.
- Wiederholen Sie die seriellen Verdünnungen bis zu einer Konzentration von 3,125 μg/ml.
- Verdünnen Sie auch jeden Standard 40 Mal separat mit dem Lösungsmittel, um eine Konzentration von 25 μg / ml für jeden Standard zu erhalten.
- Stellen Sie die Säulentemperatur auf 35 °C und die Temperatur des Probenofens auf 15 °C ein.
- Zur Herstellung der mobilen Phase A (0,1% wässrige Ameisensäure) geben Sie 1 ml Ameisensäure in einen Messkolben mit einer Kapazität von 1 L und fügen Sie der 1-L-Marke Wasser in HPLC-Qualität hinzu. Gut schütteln, um zu mischen.
- Zur Herstellung der mobilen Phase B (0,1 % Ameisensäure in Methanol) wird 1 ml Ameisensäure in einen Messkolben mit einer Kapazität von 1 l gegeben und Methanol in HPLC-Qualität zur 1-L-Marke gegeben. Gut schütteln, um zu mischen.
- Stellen Sie die Volumina bei Bedarf auf die 1-L-Marke ein.
- Filtern Sie beide mobilen Phasen durch ein 0,45 μm hydrophiles Filterpapier.
- Für die Analyse injizieren Sie 10 μL jedes Extrakts oder Standards (25 μg/ml Standards und die Standardcocktails) auf die Umkehrphasensäule.
- Elute mit den mobilen Phasen nach dem linearen Gradientenprogramm für einen 25-minütigen Lauf wie folgt: 0-3,81 min, 9%-14% B; 3,81-4,85 min, 14%-15% B; 4,85-5,89 min, 15%-15% B, 5,89-8,32 min, 15%-17% B; 8,32-9,71 min, 17%-19% B; 9,71-10,40 min, 19%-19% B; 10,40-12,48 min, 19%-26% B; 12,48-13,17 min, 16%-28% B; 13,17-14,21 min, 28%-35% B; 14,21-15,95 min, 35%-40% B; 15,95-16,64 min, 40%-48% B; 16,64-18,37 min, 48%-53% B; 18,37-22,53 min, 53%-70% B; 22,53-22,88 min, 70%-90% B; 22,88-25,00 min, 90% B.
- Vergleichen Sie die Retentionszeiten chromatographischer Peaks, die für die authentischen Standards der Konzentrationen 25 μg/ml bei 280 nm und 320 nm erhalten wurden, mit denen der Extrakte, um die phenolischen Verbindungen in den Proben zu identifizieren.
- Darstellung von Kalibrierkurven für die Phenolsäure-Standardcocktails mit Konzentration der Standards auf der horizontalen Achse und der Peakfläche auf der vertikalen Achse
- Verwenden Sie die Kalibrierkurven, um die Konzentrationen der identifizierten phenolischen Verbindungen zu schätzen, indem Sie die Peakflächen auf der Parzelle mit denen der identifizierten Verbindungen bei 280 nm und 320 nm vergleichen, wie im vorherigen Abschnitt erwähnt.
4. Gesamtphenolgehalt
HINWEIS: Bestimmen Sie den Gesamtphenolgehalt der Extrakte mit der Folin-Ciocalteu-Methode, die von F.B. Apea-Bah et al.13 beschrieben wird.
- Bereiten Sie Ferulasäure- und Gallussäurestandards im Konzentrationsbereich von 0,025 bis 0,150 mg/ml vor, um Kalibrierkurven zum Vergleich für die Abschätzung des gesamten Phenolgehalts darzustellen.
- Wiegen Sie dazu jeweils 1 mg Ferulasäure- und Gallussäurestandards in Zentrifugenröhrchen mit einer Kapazität von 2 ml.
- Fügen Sie 1 ml 50% wässriges Methanol zu jedem Standard hinzu und wirbeln Sie sich auf, wodurch 1 mg / ml Vorrat jedes Standards entsteht.
- Bereiten Sie eine Reihe von Verdünnungen aus jeder Stammlösung in insgesamt 500 μL vor.
- Pipette 18,2 μL von jedem Extrakt oder Standard in eine separate Vertiefung auf einer 96-Well-Mikrotiterplatte.
- 36,4 μL 10% (v/v) wässriges Folin-Ciocalteu-Reagenz zu jedem Extrakt oder Standard hinzufügen.
- Dann fügen Sie 145,4 μL 700 mM Natriumcarbonat zu jeder Reaktionsmischung hinzu.
- Die Reaktionsgemische im Dunkeln bei Raumtemperatur (20-25 °C) für 2 h inkubieren.
- Lesen Sie die Absorption auf einem Mikroplattenleser bei 750 nm.
- Zeichnen Sie Kalibrierkurven der Absorptionsänderung gegen die Konzentration der Phenolsäurestandards auf und verwenden Sie sie, um den Gesamtphenolgehalt zu schätzen.
- Drücken Sie die Ergebnisse als Milligramm Ferulasäureäquivalente pro Gramm gemahlener Probe (mg FAE/g) und Milligramm Gallussäureäquivalente pro Gramm gemahlener Probe (mg GAE/g) auf Trockengewichtsbasis aus.
5. Antioxidative Assays
HINWEIS: Bestimmen Sie die antioxidative Kapazität der Getreideextrakte mit den folgenden drei Assays: 2,2-Diphenyl-1-picrylhydrazyl (DPPH) Radikalfängerkapazität; 2,2'-Azino-Bis(3-ethylbenzothiazolin-6-sulfonsäure (ABTS)-Radikalfängerkapazität, die auch als Trolox-äquivalente antioxidative Kapazität (TEAC) bezeichnet wird; und Sauerstoffradikal-Absorptionskapazität (ORAC).
- Erstellung von Trolox-Standards für Standardkurven
- Verwenden Sie Trolox, ein wasserlösliches Analogon von Vitamin E, als Standard, um die in-vitro-antioxidative Kapazität der Vollkornextrakte zu schätzen.
- Wiegen Sie 1 mg Trolox genau in ein 15 ml Röhrchen. Lösen Sie sich in 4 ml 50% wässrigem Methanol auf. Vortex zum Auflösen, um eine Stammlösung von 1 mM (1000 μM) herzustellen.
- Bereiten Sie sechs Konzentrationen von Trolox vor, d. h. 50, 100, 200, 400, 600 und 800 μM, um Standardkurven für die Schätzung der DPPH-Radikalfängerkapazität und der Trolox-äquivalenten antioxidativen Kapazität (TEAC) darzustellen. In ähnlicher Weise werden 6,25, 12,5, 25 und 50 μM-Konzentrationen von Trolox zur Abschätzung der Sauerstoffradikalabsorptionskapazität (ORAC) vorbereitet. Verteilen Sie das Gesamtvolumen jeder Konzentration auf 500 μL, wie in Tabelle 1 dargestellt.
- Verdünnung von Probenextrakten
- Verdünnen Sie die Probenextrakte vor der Analyse mit Methanol. Hier wurden gelbe Mais- und Kuhbohnenextrakte zweimal verdünnt, der Weizen und die Kidneybohne fünfmal verdünnt, während der Sojabohnenextrakt 10-mal mit Methanol verdünnt wurde.
- Trolox äquivalente antioxidative Kapazität (TEAC) Assay
- Messen Sie die Trolox-äquivalente antioxidative Kapazität (TEAC) der Proben mit der zuvor von F.B. Apea-Bah et al.14 beschriebenen Methode.
- 8,23 mg ABTS werden in ein sauberes gelbes Zentrifugenröhrchen mit einer Kapazität von 2 ml eingewogen.
- Als nächstes wiegen Sie 1,62 mg Kaliumpersulfat in ein weiteres sauberes Bernsteinzentrifugenröhrchen mit einer Kapazität von 2 ml.
- Fügen Sie jedem von ihnen 1 ml destilliertes Wasser hinzu und wirbeln Sie sie auf, um sie aufzulösen.
HINWEIS: Dies führt zu 16 mM ABTS-Stammlösung mit 6 mM wässriger Kaliumpersulfatlösung. - Bereiten Sie die ABTS-Stammlösung vor, indem Sie die ABTS- und Kaliumpersulfatlösungen in gleichen Mengen mischen. Die Lösung ändert sich sofort in eine dunkle Farbe.
- Inkubieren Sie die Reagenzmischung im Dunkeln für 12-16 h.
- Verdünnen Sie die ABTS-Stammlösung 30 Mal mit 200 mM phosphatgepufferter Kochsalzlösung (PBS), um die ABTS-Arbeitslösung zu bilden. Fügen Sie dazu 58 ml 200 mM PBS zu 2 mL der ABTS-Stammlösung hinzu. Die Arbeitslösung enthält 0,27 mM ABTS und 0,1 mM Kaliumpersulfat.
- Für die Analyse 10 μL jedes verdünnten Extrakts oder Trolox in eine 96-Well-Mikrotiterplatte geben.
- Geben Sie 190 μL ABTS-Arbeitslösung in jede Vertiefung und inkubieren Sie die Reaktionsgemische für 60 min.
- Messen Sie die Absorption der Reaktionsgemische bei 750 nm in einem Mikroplattenleser.
- Verwenden Sie die Trolox-Standards in einer Konzentration von 100 bis 800 μmol/L, um eine Kalibrierkurve zu zeichnen.
- Schätzen Sie die ABTS-Radikalfängerkapazität aus der Kalibrierkurve.
- Drücken Sie die Ergebnisse als Mikromol-Trolox-Äquivalente pro Gramm (μmol TE/g) Probe auf Trockengewichtsbasis aus.
- DPPH-Assay
HINWEIS: Bestimmen Sie die DPPH-Radikalfängerkapazität der Proben mit der zuvor von F.B. Apea-Bah et al.13 beschriebenen Methode. Der DPPH-Antioxidans-Assay erfordert eine radikal erzeugende Verbindung, DPPH (2,2-Diphenyl-1-picrylhydrazyl).- Wiegen Sie 1,2 mg DPPH präzise in ein leeres Zentrifugenröhrchen mit einer Kapazität von 50 ml. Lösen Sie den DPPH in 30 ml Methanol auf, um eine 60 μmol/L methanolische Lösung herzustellen.
HINWEIS: Der DPPH-Assay testet die Fähigkeit der Probenextrakte, von DPPH produzierte freie Radikale abzufangen. - Für die Analyse fügen Sie 5 μL der Probenextrakte oder Trolox-Lösung in die Mikrotiterplattenvertiefungen hinzu.
- Als nächstes 195 μL der 60 μmol/L DPPH methanolischen Lösung zugeben und für 60 min inkubieren.
- Messen Sie die Absorption des Reaktionsgemisches bei 515 nm.
- Verwenden Sie die Trolox-Standards (50-800 μmol/L), um eine Kalibrierkurve mit der Änderung der Absorption auf der vertikalen Achse und den Trolox-Konzentrationen auf der horizontalen Achse zu zeichnen.
- Schätzen Sie die DPPH-Aufräumkapazität anhand der Kalibrierkurve.
- Drücken Sie die Ergebnisse als Mikromol-Trolox-Äquivalente pro Gramm (μmol TE/g) Probe auf Trockengewichtsbasis aus.
- Wiegen Sie 1,2 mg DPPH präzise in ein leeres Zentrifugenröhrchen mit einer Kapazität von 50 ml. Lösen Sie den DPPH in 30 ml Methanol auf, um eine 60 μmol/L methanolische Lösung herzustellen.
- Absorptionsvermögen von Sauerstoffradikalen
- Bestimmen Sie die Sauerstoffradikalabsorptionskapazität (ORAC) der Proben basierend auf der Methode von F.B. Apea-Bah et al.13.
- Bereiten Sie zunächst Trolox-Standards der Konzentrationen 6,25, 12,5,25 und 50 μM aus einer 1.000 μM Trolox-Standardstammlösung in 75 mM Kaliumphosphat (K 2 HPO 4 / KH2PO4) -Puffer vor.
- Wiegen Sie dazu 1 mg Trolox-Pulver und lösen Sie es in 4 ml der Pufferlösung unter Ultraschall auf, um eine 1.000 μM Stammlösung herzustellen.
- Nehmen Sie dann 50 μL der Stammlösung in ein Zentrifugenröhrchen mit einer Kapazität von 2 ml und verdünnen Sie es mit 950 μL Pufferlösung, um 1.000 μL 50 μM Trolox-Lösung zu erhalten.
- 500 μL der 50 μM-Lösung in ein neues Röhrchen pipettieren und mit gleichem Puffervolumen verdünnen, um eine 25 μM Trolox-Lösung zu erhalten.
- Wiederholen Sie die serielle Verdünnung der 25 μM, um 12,5 μM zu erhalten, und wiederholen Sie dann in ähnlicher Weise die Verdünnung von 12,5 μM, um 6,25 μM zu erhalten.
- Bereiten Sie geeignete Verdünnungen der Probenextrakte vor.
- Verdünnen Sie die gelben Mais- und Kuhbohnenextrakte 20 Mal, die Weizen- und Kidneybohnenextrakte 50 Mal und den Sojabohnenextrakt 100 Mal mit der Pufferlösung.
- Übertragen Sie 200 μL jeder Probe oder Trolox-Standard in die Vertiefungen einer schwarzen 96-Well-Mikrotiterplatte für die automatische Pipettierung.
- Füllen Sie dann die drei mit der ORAC-Ausrüstung gelieferten Reagenztanks mit Folgendem: (1) die Pufferlösung; (2) 0,816 nM Fluorescein im Puffer; und (3) 153 mM 2,2′-Azobis(2-Amidinopropan)-dihydrochlorid (AAPH) im Puffer.
- Legen Sie sie zum automatischen Pipettieren in ihre Behälter.
- Richten Sie die ORAC-Maschine und das automatische Pipettiersystem für die Analyse ein, basierend auf der Standardarbeitsanweisung.
- Richten Sie für die Analyse das automatisierte Pipettiersystem so ein, dass 25 μL jedes verdünnten Extrakts oder Standards auf die Vertiefungen einer durchsichtigen schwarzen 96-Well-Mikrotiterplatte übertragen werden.
- Dann fügen Sie automatisch 150 μL 0,816 nM Fluorescein in den Puffer hinzu.
- Inkubieren Sie das Reaktionsgemisch bei 37 °C für 15 min in der ORAC-Maschine.
- Danach werden automatisch 25 μL des AAPH zu jeder Reaktionsmischung gegeben.
- Inkubieren Sie sie bei 37 °C für 50 min in der ORAC-Maschine.
- Richten Sie die ORAC-Maschine ein, um den Fluoreszenzzerfall über die Inkubationszeit bei Anregungs- und Emissionswellenlängen von 485 nm bzw. 520 nm zu messen.
- Nach den Messungen zeichnen Sie eine Trolox-Standardkurve mit Trolox (6,25-50 μM) auf der horizontalen Achse und Fluoreszenzzerfall auf der vertikalen Achse.
- Schätzen Sie die Sauerstoffradikalabsorptionskapazität der Extrakte aus der Trolox-Standardkurve.
- Drücken Sie die Ergebnisse als μmol TE/g-Probe auf Trockengewichtsbasis aus.
- Statistische Analyse
- Präsentieren Sie alle Ergebnisse als Mittel ± Standardabweichung von mindestens Verdreifachungen.
- Führen Sie eine Varianzanalyse (ANOVA) durch, um die Auswirkungen des Korntyps auf die Antwortvariablen zu bestimmen.
- Wenn signifikante Unterschiede bei p < 0,05 bestehen, verwenden Sie die geringste signifikante Differenz (LSD), um die Mittelwerte zu vergleichen.
- Führen Sie eine Pearson-Korrelationsanalyse durch, um die Beziehung zwischen dem Phenolgehalt und den antioxidativen Kapazitäten abzuschätzen.
Ergebnisse
Tabelle 2 zeigt die Phenolsäuren, die in den Getreide- und Hülsenfrüchtekörnern identifiziert wurden. Basierend auf den verfügbaren authentischen Standards wurden vier Phenolsäuren in den Proben identifiziert, und sie sind: Vanillsäure, Kaffeesäure, p-Cumarin und Ferulasäure. Vanillsäure ist eine Hydroxybenzoesäure, während die anderen drei Hydroxyzimtsäuren sind. Vanillinsäure wurde nur in der Blackeye-Kuhbohnenbohne identifiziert, während Kaffeesäure nur in der Kidneybohne iden...
Diskussion
Die Vollkornprodukte wurden als repräsentative Getreidekörner und Hülsenfrüchte ausgewählt, die weltweit breite Lebensmittelanwendungen finden. Während Variationen zwischen den Sorten jedes Korns bestehen können, lag der Schwerpunkt dieser Studie auf der Demonstration einer verallgemeinerten Methode zur freien Phenolsäureextraktion und -analyse für Vollkornprodukte. Die Extraktionsmethode wurde modifiziert, indem die Mengen an Proben und Lösungsmitteln erheblich reduziert wurden, um die Menge an Chemikalien zu ...
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Die Autoren danken den Autoren für die technische Unterstützung von Frau Alison Ser und Frau Hannah Oduro-Obeng sowie für die Videobearbeitungsunterstützung durch Frau Janice Fajardo und Herrn Miguel del Rosario.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 mL Falcon conical centrifuge tubes | Fisher Scientific | 05-527-90 | |
| 2 mL Amber glass ID Surestop vial | Thermo Scientific | C5000-2W | |
| 2 mL Amber microcentrifuge tubes | VWR | 20170-084 | |
| 2,2′-Azobis(2-amidinopropane) dihydrochloride (AAPH) | Sigma-Aldrich | 440914-100G | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) (C18H18N4O6S4) ≥98%, | Sigma Aldrich | A1888-2G | |
| 2,2-Diphenyl-1pikrylhydrazyl (DPPH) (C18H12N5O6) | Sigma Aldrich | D913-2 | |
| 6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox) (C14H18O4), ≥98% | Fluka Chemika | 56510 | |
| 9 mm Autosampler Vial Screw Thread Caps | Thermo Scientific | 60180-670 | |
| 96 well flat bottom plates | Fisher Scientific | 12565501 | |
| Agilent BioTek ELx800 microplate reader | Fisher Scientific | BT-ELX800NB | |
| Agilent BioTek Precision 2000 96/384 Automated Microplate Pipetting System | Fisher Scientific | N/A | |
| Agilent BioTek FLx800 Microplate Fluorescence Reader | Fisher Scientific | N/A | |
| Analytical balance SI-114 | Denver Instrument | SI-114.1 | |
| Autosampler, Waters 717 Plus | Waters | WAT078900 | |
| BD 3 mL syringe Luer-Lok Tip | BD | 309657 | |
| Bransonic ultrasonic cleaner, Branson 5510 | Millipore Sigma | Z245143 | |
| Corning LSE Vortex Mixer | Corning | 6775 | |
| Durapore Filter (0.45 µm PVDF Membrane) | Merck Millipore Ltd | HVLP04700 | |
| Durapore Membrane Filters (0.45 µm HV) | Merck Millipore Ltd | HVHP04700 | |
| Eppendorf Research plus, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research plus, 0.5-5 mL | Eppendorf | 3123000071 | |
| Eppendorf Research plus, 100-1000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research plus, 10-100 µL | Eppendorf | 3123000047 | |
| Ethyl acetate, HPLC grade | Fisher Chemical | E195-4 | |
| Ferulic acid standard | Sigma Aldrich | 128708-5G | |
| Fluorescein | Fisher Scientific | AC119245000 | |
| Folin & Ciocalteu phenol reagent | Sigma Aldrich | F9252 | |
| Formic acid, 99% | Acros Organics, Janssen Pharmaceuticalaan 3a | 27048-0010 | |
| Gallic acid standard | Sigma | G7384 | |
| High performance liquid chromatograph (HPLC), Waters 2695 | Waters | 960402 | |
| Methanol, HPLC grade | Fisher Chemical | A452-4 | |
| Micro pipet tips, 0.5-10 µL | Fisherbrand | 21-197-2F | |
| Microcentrifuge Sorvall Legend Micro 21 centrifuge | Thermo Scientific | 75002435 | |
| Multichannel micropipette, Proline Plus, 30-300 µL | Sartorius | 728240 | |
| Photodiode array detector, Waters 2996 | Waters | 720000350EN | |
| Pipet tips, 1000 µL | VWR | 83007-382 | |
| Pipet tips, 1-5 mL | VWR | 82018-840 | |
| Potassium persulfate (K2S2O8), ≥99.0% | Sigma Aldrich | 216224-100G | |
| Potassium phosphate dibasic anhydrous (K2HPO4) | Fisher Scientific | P288-500 | |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | P285-500 | |
| PYREX 250 mL Short Neck Boiling Flask, Round Bottom | Corning | 4321-250 | |
| Reversed phase C18 Analytical Column (100 x 3 mm) Accucore aQ | Thermo Scientific | 17326-103030 | |
| Roto evaporator, IKA RV 10 | IKA | 0010005185 | |
| Sodium carbonate (NaCO3) anhydrous | Fisher Chemical | S263-1 | |
| Sodium chloride (NaCl) | Mallinckrodt AR® | 7581 | |
| Sodium phosphate dibasic anhydrous (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Sodium phosphate monobasic anhydrous (NaH2PO4) | Fisher bioreagents | BP329-500 | |
| Standardization pipet tips 0-200µL | Fisherbrand | 02-681-134 | |
| Syringe Driven Filter unit (0.22 µm) | Millex®-GV | SLGVR04NL | |
| Target micro-serts vial insert (400 µL) | Thermo Scientific | C4011-631 | |
| Ultrapure water (Direct Q-3 UV system with pump) | Millipore | ZRQSVP030 |
Referenzen
- Huitu, O., et al. Silicon, endophytes and secondary metabolites as grass defenses against mammalian herbivores. Frontiers in Plant Science. 5, 478 (2014).
- Joshi, J. R., Burdman, S., Lipsky, A., Yariv, S., Yedidia, I. Plant phenolic acids affect the virulence of Pectobacterium aroidearum and P. carotovorum ssp. brasiliense via quorum sensing regulation. Molecular Plant Pathology. 17 (4), 487-500 (2016).
- Dykes, L., Rooney, L. W. Phenolic compounds in cereal grains and their health benefits. Cereal Foods World. 52 (3), 105-111 (2007).
- Xiang, J., Apea-Bah, F. B., Ndolo, V. U., Katundu, M. C., Beta, T. Profile of phenolic compounds and antioxidant activity of finger millet varieties. Food Chemistry. 275, 361-368 (2019).
- Qiu, Y., Liu, Q., Beta, T. Antioxidant properties of commercial wild rice and analysis of soluble and insoluble phenolic acids. Food Chemistry. 121 (1), 140-147 (2010).
- Beverly, R. L., Motarjemi, Y. . Encyclopedia of Food Safety. 3, 309-314 (2014).
- FAO. Food Outlook - Biannual report on global food markets. Food and Agriculture Organization. , (2020).
- Erbersdobler, H. F., Barth, C. A., Jahreis, G. Legumes in human nutrition. Nutrient content and protein quality of pulses. Ernahrungs Umschau. 64 (9), 134-139 (2017).
- Dueñas, M., Hernández, T., Estrella, I. Assessment of in vitro antioxidant capacity of the seed coat and the cotyledon of legumes in relation to their phenolic contents. Food Chemistry. 98 (1), 95-103 (2006).
- Khang, D. T., Dung, T. N., Elzaawely, A. A., Xuan, T. D. Phenolic profiles and antioxidant activity of germinated legumes. Foods. 5 (2), 27 (2016).
- Hefni, M. E., Amann, L. S., Witthöft, C. M. A HPLC-UV method for the quantification of phenolic acids in cereals. Food Analytical Methods. 12 (12), 2802-2812 (2019).
- AOAC. . Official Methods of Analysis. 17th edn. , (2000).
- Apea-Bah, F. B., Head, D., Scales, R., Bazylo, R., Beta, T. Hydrothermal extraction, a promising method for concentrating phenolic antioxidants from red osier dogwood (Cornus stolonifer) leaves and stems. Heliyon. 6 (10), 05158 (2020).
- Apea-Bah, F. B., Minnaar, A., Bester, M. J., Duodu, K. G. Sorghum-cowpea composite porridge as a functional food, Part II: Antioxidant properties as affected by simulated in vitro gastrointestinal digestion. Food Chemistry. 197, 307-315 (2016).
- Robbins, R. J., Bean, S. R. Development of a quantitative high-performance liquid chromatography-photodiode array detection measurement system for phenolic acids. Journal of Chromatography A. 1038 (1-2), 97-105 (2004).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Prior, R. L., Wu, X., Schaich, K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry. 53 (10), 4290-4302 (2005).
- Ainsworth, E. A., Gillespie, K. M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent. Nature Protocols. 2 (4), 875-877 (2007).
- Waterhouse, A. L. Determination of total phenolics. Current Protocols in Food Analytical Chemistry. 1, 1-8 (2002).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry. 53 (6), 1841-1856 (2005).
- Esterbauer, H., Wäg, G., Puhl, H. Lipid peroxidation and its role in atherosclerosis. British Medical Bulletin. 49 (3), 566-576 (1993).
- Esterbauer, H., Gebicki, J., Puhl, H., Jürgens, G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radical Biology and Medicine. 13 (4), 341-390 (1992).
- Apea-Bah, F. B., Serem, J. C., Bester, M. J., Duodu, K. G. Phenolic composition and antioxidant properties of Koose, a deep-fat fried cowpea cake. Food Chemistry. 237, 247-256 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten