É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um método generalizado para determinar a composição livre de ácido fenólico solúvel e capacidade antioxidante de cereais e leguminosas
Neste Artigo
Resumo
Ácidos fenólicos são fitoquímicos importantes que estão presentes em grãos integrais. Possuem propriedades bioativas, como funções protetoras antioxidantes. Este trabalho teve como objetivo relatar um método generalizado para a identificação do HPLC, estimativa total de teor fenólico e determinação da capacidade antioxidante de ácidos fenólicos em cereais e leguminosas.
Resumo
Ácidos fenólicos são uma classe de compostos orgânicos que carregam tanto um grupo fenólico, quanto um grupo carboxílico. Eles são encontrados em grãos e se concentram no farelo de cereais ou sementes de leguminosas. Possuem propriedades antioxidantes que geraram muito interesse de pesquisa nos últimos anos, sobre suas potenciais funções de proteção antioxidante. Este trabalho apresenta um método generalizado para a extração de ácidos fenólicos solúveis livres de grãos integrais e análise de sua capacidade antioxidante. Foram utilizadas cinco amostras integrais de grãos compostos por dois cereais (trigo e milho amarelo) e três leguminosas (feijão-de-vaca, feijão-rim e soja). Os grãos foram moídos em farinha e seus ácidos fenólicos solúveis livres extraídos usando metanol aquoso. Os compostos foram então identificados por meio de um cromatógrafo líquido de alta pressão (HPLC). O método Folin-Ciocalteu foi usado para determinar seu teor fenólico total, enquanto suas capacidades antioxidantes foram determinadas usando a capacidade radical de limpeza do DPPH, capacidade antioxidante equivalente trolox (TEAC) e ensaios de capacidade de absorção radical de oxigênio (ORAC). Os ácidos fenólicos identificados incluíam ácidos vanlícíacos, cafeíacos, p-coumaricos e ferúlicos. O ácido vanlícía foi identificado apenas em cowpea, enquanto o ácido cafeico foi identificado apenas no feijão renal. p-coumíaco ácido foi identificado em milho amarelo, vaquinha e soja, enquanto o ácido ferúlico foi identificado em todas as amostras. O ácido ferúlico foi o ácido fenólico predominante identificado. A concentração total de ácidos fenólicos nas amostras diminuiu na seguinte ordem: soja > feijão-de-couro > milho amarelo = feijão-rim > trigo. A capacidade antioxidante total (soma dos valores dos ensaios DPPH, TEAC e ORAC) diminuiu da seguinte forma: soja > feijão-rim > milho amarelo = feijão de ervilha > trigo. Este estudo concluiu que a análise do HPLC, bem como os ensaios DPPH, TEAC e ORAC fornecem informações úteis sobre a composição do ácido fenólico e propriedades antioxidantes de grãos integrais.
Introdução
Os ácidos fenólicos estão entre os fitoquímicos mais importantes estudados nas plantas devido ao papel vital que desempenham na defesa vegetal contra a infecção herbívora e fúngica, bem como a manutenção do suporte estrutural e integridade nos tecidos vegetais 1,2. Eles são abundantes no farelo de cereais e sementes de leguminosas3. Estruturalmente, eles são divididos em dois grupos: os ácidos hidroxibenóicos (Figura 1) e os ácidos hidroxicinâmicos (Figura 2). Os ácidos hidroxibenóicos comuns em cereais e leguminosas incluem ácidos gálicos, p-hidroxibenóicos, 2,4-dihidroxibenóicos, protocatecáricos, vanlícías e seringéricos, enquanto os ácidos hidroxicinnômicos comuns incluem ácidos caficos, p-coumaric, ferulicos e sinapicácidos 3. Os ácidos fenólicos também possuem propriedades antioxidantes, pois são capazes de ressarcimento de radicais livres, que causam ranço oxidativo nas gorduras, e iniciam e propagam estresse oxidativo induzido por radicais nos sistemas fisiológicos 4,5. Devido a esse papel fisiológico vital como antioxidantes, eles são objeto de pesquisas recentes. Isso porque quando consumidos como componentes de alimentos vegetais, eles podem exercer proteção antioxidante.
Cereais e produtos cereais são as principais fontes de alimentos carboidratos para humanos e animais em todo o mundo6. Os cereais incluem trigo, arroz, milho (milho), cevada, triticale, milhetas e sorgo. Entre eles, o milho é o mais utilizado, com uma utilização global estimada de 1.135,7 milhões de toneladas em 2019/2020, seguido pelo trigo com uma utilização global estimada de 757,5 milhões de toneladas no mesmo período7. Os alimentos cereais são ótimas fontes de energia para os consumidores, uma vez que são fontes ricas de carboidratos. Eles também fornecem algumas proteínas, gorduras, fibras, vitaminas e minerais6. Além de seu valor nutricional, os cereais são boas fontes de antioxidantes fitoquímicos, particularmente ácidos fenólicos, que têm o potencial de proteger o sistema fisiológico de danos oxidativos induzidos por radicais3. As leguminosas também são boas fontes de nutrientes e geralmente são mais altas em proteínas do que os cereais. Eles também contêm vitaminas e minerais e são usados na preparação de vários alimentos8. Além disso, as leguminosas são boas fontes de uma variedade de antioxidantes fitoquímicos, incluindo ácidos fenólicos, flavonoides, antocianinas e proanthocyanidins 9,10. Diferentes variedades de cereais e leguminosas podem ter uma composição diferente de ácido fenólico. Há, portanto, a necessidade de estudar a composição do ácido fenólico de cereais e leguminosas e suas variedades, a fim de conhecer seus potenciais benefícios para a saúde em relação aos antioxidantes fenólicos.
Uma série de ensaios foram relatados para medir a quantidade de ácidos fenólicos em grãos de cereais e leguminosas, e determinar suas atividades antioxidantes. Os métodos de análise mais comuns para ácidos fenólicos de grãos integrais são espectrofotometria e cromatografia líquida11. O objetivo deste trabalho foi demonstrar um método cromatógrafo líquido de alta pressão generalizado para determinar a composição livre de ácido fenólico solúvel e métodos espectrofotométricos para determinar o teor fenólico total e a capacidade antioxidante de alguns cereais e leguminosas de grãos integrais.
Protocolo
1. Tipo de amostras
- Use cinco amostras integrais de grãos, compreendendo dois cereais (por exemplo, trigo durum e milho amarelo) e três leguminosas (por exemplo, feijão-de-vaca-preto, soja e feijão-rim vermelho) para este estudo.
- Moinho 50 g de cada grão em triplicado em farinha, usando um moedor de café, e passá-los através de uma peneira de 500 μm.
- Armazená-los a -20 °C.
2. Preparação da amostra
-
Determinação do teor de matéria seca e expressão da base de peso seco
NOTA: Determine o teor de matéria seca de cada amostra em pó de acordo com o método aoAC (2000)12.- Ligue um forno de convecção forçada e afina a temperatura para 130 °C.
- Dessecante seco (gel de sílica) no forno por 30 min a 1h e transfira o gel de sílica seca para um dessecador.
- Pesar com precisão 2 g de cada amostra em uma lata de alumínio limpa, pré-seca e pesada.
- Seque as amostras pesadas a 130 °C por 1h em forno de convecção forçada.
- Transfira a amostra seca para o desiccador e deixe esfriar até a temperatura ambiente.
- Pese a amostra seca e resfriada e regissuira seu peso.
- Calcule o teor de matéria seca de cada amostra da seguinte forma:
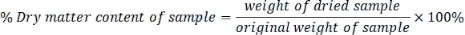
- Expresse cada parâmetro medido na base de peso seco usando a seguinte fórmula:

-
Extração de ácido fenólico
NOTA: Extrair os compostos fenólicos livres solúveis nas amostras de grãos usando uma modificação do método de Y. Qiu et al.5 que permite extração fenólica a partir de quantidades de miligramas de grãos integrais.- Pesar com precisão 100 mg de farinha de grão inteira diretamente em um tubo de microcentrifuge de capacidade de 2 mL de cor âmbar. A cor escura do tubo ajuda a evitar a exposição da mistura à luz.
- Adicione 1 mL de metanol de 80% aquoso de HPLC a cada um dos tubos que contêm as amostras.
- Vórtice brevemente para misturar a solução de metanol e as amostras.
- Sonicar as amostras por 60 minutos para extrair os compostos fenólicos solúveis livres. Coloque uma tampa sobre as amostras durante a sônica para proteção adicional contra a luz.
- Após a sônicação, centrifugar a mistura a 20.000 × g por 5 min para sedimentar os resíduos sólidos deixando o sobrenatário em cima. Compostos fenólicos gratuitos estarão presentes no supernasce após centrifugação.
- Transfira o supernatante para um tubo de microcentrífuga limpo.
NOTA: O supernatante precisa ser filtrado antes de injetar no instrumento HPLC. Para filtrar o supernaspe, remova o êmbolo de uma seringa de 3 mL e conecte um filtro de seringa. O filtro deve ter um tamanho de poros não maior que 0,22 μm. - Pipeta aproximadamente 0,4 mL do supernante no topo da seringa. Reinsira o êmbolo e empurre o líquido através do filtro em um frasco HPLC contendo uma pastilha de frasco.
- Uma vez que o instrumento tenha sido configurado para executar o método descrito no manuscrito para análise hplc, carregue os frascos no carrossel para corresponder à lista de amostras.
- Obtenha cromatógramas HPLC a 320 nm e 280 nm mostrando picos distintos representando diferentes compostos fenólicos.
- Usando curvas padrão apropriadas, quantifique os ácidos hidroxicinâmicos a 320 nm, uma vez que eles têm máxima absorvância neste comprimento de onda. Pelo mesmo princípio, quantifique ácidos hidroxibenóicos a 280 nm.
- Armazene os extratos restantes a -20 °C para outras análises.
3. Composição fenólica
- Use um cromatógrafo líquido de alta pressão (Tabela de Materiais) para identificar e quantificar os compostos fenólicos extraídos nas amostras, com base no método de J. Xiang, F.B. Apea-Bah, V. U. Ndolo, M.C. Katundu, e T. Beta 4.
- Preparar padrões de ácido fenólico (ácido vanlílico, ácido cafeína, ácido p-coumarico, ácido ferúlico e ácido sinapic) para identificar e quantificar compostos fenólicos constituintes nos extratos.
- Para isso, pese 1 mg de cada padrão e dissolva em 1 mL de metanol aquoso de 50% para produzir 1.000 μg/mL de cada padrão.
- Misture volumes iguais de todos os cinco padrões em um tubo de centrífuga âmbar de 2 mL para produzir um coquetel de padrões, cada um com uma concentração de 200 μg/mL.
- Prepare as diluições seriais do coquetel padrão, levando um volume em um novo tubo e diluindo com o mesmo volume do aquoso solvente de metanol.
- Repita as diluições seriais até uma concentração de 3.125 μg/mL.
- Além disso, diluir separadamente cada padrão 40 vezes com o solvente para obter 25 μg/mL de concentração de cada padrão.
- Coloque a temperatura da coluna em 35 °C e a temperatura do forno da amostra a 15 °C.
- Para preparar a fase móvel A (ácido fórmico aquoso de 0,1%), transfira 1 mL de ácido fórmico em um frasco volutrico de capacidade 1 L e adicione água de grau HPLC à marca 1 L. Agite bem para misturar.
- Para preparar a fase móvel B (ácido fórmico de 0,1% no metanol), transfira 1 mL de ácido fórmico em um frasco volutrico de capacidade 1 L e adicione metanol de grau HPLC à marca 1 L. Agite bem para misturar.
- Ajuste os volumes à marca 1 L, se necessário.
- Filtre ambas as fases móveis através de um papel filtro hidrofílico de 0,45 μm.
- Para a análise, injete 10 μL de cada extrato ou padrão (padrões de 25 μg/mL e coquetéis padrão) na coluna de fase inversa.
- Elute com as fases móveis de acordo com o programa de gradiente linear para uma corrida de 25 minutos da seguinte forma: 0-3,81 min, 9%-14% B; 3,81-4,85 min, 14%-15% B; 4,85-5,89 min, 15%-15% B, 5,89-8,32 min, 15%-17% B; 8,32-9,71 min, 17%-19% B; 9,71-10,40 min, 19%-19% B; 10,40-12,48 min, 19%-26% B; 12,48-13,17 min, 16%-28% B; 13,17-14,21 min, 28%-35% B; 14,21-15,95 min, 35%-40% B; 15,95-16,64 min, 40%-48% B; 16,64-18,37 min, 48%-53% B; 18,37-22,53 min, 53%-70% B; 22,53-22,88 min, 70%-90% B; 22,88-25,00 min, 90% B.
- Compare os tempos de retenção dos picos cromatográficos obtidos para os padrões autênticos de concentrações de 25 μg/mL, a 280 nm e 320 nm, com os dos extratos, a fim de identificar os compostos fenólicos constituintes nas amostras.
- Traçar curvas de calibração para os coquetéis padrão de ácido fenólico, com concentração dos padrões no eixo horizontal, e a área de pico no eixo vertical
- Utilize as curvas de calibração para estimar as concentrações dos compostos fenólicos identificados, comparando as áreas de pico no gráfico com as dos compostos identificados em 280 nm e 320 nm como mencionado na seção anterior.
4. Conteúdo fenólico total
NOTA: Determine o teor fenólico total dos extratos utilizando o método Folin-Ciocalteu descrito por F.B. Apea-Bah et al.13.
- Prepare os padrões de ácido ferúlico e ácido gálico dentro da faixa de concentração de 0,025 a 0,150 mg/mL para traçar curvas de calibração em comparação, para a estimativa do teor fenólico total.
- Para isso, pesam com precisão 1 mg cada um dos padrões de ácido ferúlico e ácido gálico em tubos de centrífuga de capacidade de 2 mL.
- Adicione 1 mL de metanol aquoso a cada padrão e vórtice para dissolver, produzindo 1 mg/mL de estoque de cada padrão.
- Prepare uma série de diluições de cada solução de estoque em um total de 500 μL.
- Pipeta 18,2 μL de cada extrato ou padrão em um poço separado em uma microplacão de 96 poços.
- Adicione 36,4 μL de 10% (v/v) reagente folin-ciocalteu a cada extrato ou padrão.
- Em seguida, adicione 145,4 μL de carbonato de sódio de 700 mM a cada mistura de reação.
- Incubar as misturas de reação no escuro à temperatura ambiente (20-25 °C) por 2 h.
- Leia a absorção em um leitor de microplacas a 750 nm.
- Plotar curvas de calibração de mudança na absorvância contra a concentração dos padrões de ácido fenólico e usá-los para estimar o conteúdo fenólico total.
- Expresse os resultados como equivalentes de ácido ferúlico miligrama por grama de amostra moída (mg FAE/g) e equivalentes de ácido gálico miligrama por grama de amostra moída (mg GAE/g) em base de peso seco.
5. Ensaios antioxidantes
NOTA: Determinar a capacidade antioxidante dos extratos de grãos utilizando os seguintes três ensaios: 2,2-difenil-1-picrylhydrazyl (DPPH) capacidade de limpeza radical; 2,2'-azino-bis(3-ethylbenzothiazolina-6-sulfônico capacidade de limpeza radical (ABTS), que também é chamada de capacidade antioxidante equivalente Trolox (TEAC); e capacidade de absorção radical de oxigênio (ORAC).
- Preparação de padrões Trolox para curvas padrão
- Use Trolox, um análogo solúvel em água de vitamina E, como padrão para estimar a capacidade antioxidante in vitro de todos os extratos de grãos.
- Pesar com precisão 1 mg de Trolox em um tubo de 15 mL. Dissolva-se em 4 mL de metanol aquoso de 50%. Vórtice para dissolver para preparar uma solução de estoque de 1 mM (1000 μM).
- Prepare seis concentrações de Trolox, ou seja, 50, 100, 200, 400, 600 e 800 μM para traçar curvas padrão para a estimativa da capacidade radical de limpeza do DPPH e capacidade antioxidante equivalente trolox (TEAC). Da mesma forma, prepare as concentrações de Trolox de 6,25, 12,5, 25 e 50 μM para estimar a capacidade de absorção radical de oxigênio (ORAC). Compõem o volume total de cada concentração para 500 μL, conforme mostrado na Tabela 1.
- Diluição de extratos amostrais
- Diluir os extratos amostrais com metanol antes da análise. Aqui, os extratos de milho amarelo e ervilha foram diluídos duas vezes, o trigo e o feijão-rim foram diluídos cinco vezes enquanto o extrato de soja foi diluído 10 vezes com metanol.
- Ensaio de capacidade antioxidante equivalente trolox (TEAC)
- Meça a capacidade antioxidante equivalente trolox (TEAC) das amostras utilizando o método descrito anteriormente por F.B. Apea-Bah et al.14.
- Pesar 8,23 mg de ABTS em um tubo de centrífuga âmbar de capacidade de 2 mL limpo.
- Em seguida, pese 1,62 mg de persulfato de potássio em outro tubo de centrífuga âmbar de capacidade de 2 mL limpo.
- Adicione 1 mL de água destilada a cada um deles e vórtice para dissolvê-los.
NOTA: Isso resulta em uma solução de estoque ABTS de 16 mM com solução de persulfeto aquoso de potássio de 6 mM. - Prepare a solução de estoque ABTS misturando as soluções de persulfeto de ABTS e potássio em volumes iguais. A solução mudará imediatamente para uma cor escura.
- Incubar a mistura de reagente no escuro por 12-16 h.
- Diluir a solução de estoque ABTS 30 vezes com salina tamponada de fosfato de 200 mM (PBS), para formar a solução de trabalho ABTS. Para isso, adicione 58 mL de PBS de 200 mM a 2 mL da solução de estoque ABTS. A solução de trabalho conterá 0,27 mM ABTS e persulfeto de potássio de 0,1 mM.
- Para a análise, coloque 10 μL de cada extrato diluído ou Trolox em uma microplacão de 96 poços.
- Adicione 190 μL de solução de trabalho ABTS a cada poço e incubar as misturas de reação por 60 min.
- Meça a absorvência das misturas de reação a 750 nm em um leitor de microplaca.
- Use os padrões Trolox em uma concentração que varia de 100 a 800 μmol/L para traçar uma curva de calibração.
- Estime a capacidade radical de limpeza do ABTS a partir da curva de calibração.
- Expresse os resultados como micromole Trolox equivalentes por grama (μmol TE/g) amostra em base de peso seco.
- Ensaio DPPH
NOTA: Determine a capacidade radical de limpeza das amostras usando o método descrito anteriormente por F.B. Apea-Bah et al.13. O ensaio antioxidante DPPH requer um composto gerador radical, DPPH (2,2-diphenyl-1-picrylhydrazyl).- Pesar com precisão 1,2 mg de DPPH em um tubo vazio de centrífuga de capacidade de 50 mL. Dissolva o DPPH em 30 mL de metanol para preparar uma solução methanolica de 60 μmol/L.
NOTA: O ensaio DPPH testa a capacidade dos extratos amostrais de coletar radicais livres produzidos pela DPPH. - Para a análise, adicione 5 μL dos extratos de amostra ou solução Trolox nos poços de microplacão.
- Em seguida, adicione 195 μL da solução methanólica 60 μmol/L DPPH e incubar por 60 min.
- Meça a absorvência da mistura de reação a 515 nm.
- Use as normas Trolox (50-800 μmol/L) para traçar uma curva de calibração, com a mudança de absorção no eixo vertical e as concentrações de Trolox no eixo horizontal.
- Estime a capacidade de limpeza do DPPH a partir da curva de calibração.
- Expresse os resultados como micromole Trolox equivalentes por grama (μmol TE/g) amostra em base de peso seco.
- Pesar com precisão 1,2 mg de DPPH em um tubo vazio de centrífuga de capacidade de 50 mL. Dissolva o DPPH em 30 mL de metanol para preparar uma solução methanolica de 60 μmol/L.
- Capacidade de absorção radical de oxigênio
- Determine a capacidade de absorção radical de oxigênio (ORAC) das amostras com base no método de F.B. Apea-Bah et al.13.
- Para começar, prepare os padrões trolox de concentrações 6.25, 12,5, 25 e 50 μM a partir de uma solução de estoque padrão Trolox de 1.000 μM em fosfato de potássio de 75 mM (K2HPO4/KH2PO4).
- Para isso, pese 1 mg de pó Trolox e dissolva em 4 mL da solução tampão sob sônica para preparar uma solução de estoque de 1.000 μM.
- Em seguida, leve 50 μL da solução de estoque em um tubo de centrífugas de capacidade de 2 mL e dilua com 950 μL de solução tampão para obter 1.000 μL de solução Trolox de 50 μM.
- Pipeta 500 μL da solução de 50 μM em um novo tubo e diluída com igual volume de tampão para obter uma solução Trolox de 25 μM.
- Repita a diluição seriada dos 25 μM para obter 12,5 μM e, em seguida, repita da mesma forma a diluição de 12,5 μM para obter 6,25 μM.
- Prepare as diluições apropriadas dos extratos amostrais.
- Diluir o milho amarelo e a ervilha extrai 20 vezes, o trigo e o feijão-rim extraem 50 vezes, e o extrato de soja 100 vezes com a solução tampão.
- Transfira 200 μL de cada amostra ou padrão Trolox para os poços de uma microplacar preta de 96 poços para tubulação automática.
- Em seguida, encha os três tanques de reagente fornecidos com o equipamento ORAC, com o seguinte: (1) a solução tampão; (2) fluoresceína de 0,816 nM no buffer; e (3) 153 mM de 2,2′-azobis (2-amidinopropne) dihidrocloreto (AAPH) no buffer.
- Coloque-os em seus recipientes para a pipetação automática.
- Configure a máquina ORAC e o sistema automático de pipetização para análise, com base no procedimento operacional padrão.
- Para a análise, configure o sistema automatizado de pipetização para transferir 25 μL de cada extrato diluído ou padrão para os poços de uma microplata preta de 96 poços.
- Em seguida, adicione automaticamente 150 μL de 0,816 nM fluoresceína no buffer.
- Incubar a mistura de reação a 37 °C por 15 min na máquina ORAC.
- Depois, adicione automaticamente 25 μL da AAPH a cada mistura de reação.
- Incuba-os a 37 °C por 50 min na máquina ORAC.
- Configure a máquina ORAC para medir a decadência da fluorescência, durante o período de incubação, em comprimentos de onda de excitação e emissão de 485 nm e 520 nm, respectivamente.
- Após as medições, trace uma curva padrão Trolox, com Trolox (6,25-50 μM) no eixo horizontal e fluorescência decai sobre o eixo vertical.
- Estimar a capacidade de absorção radical de oxigênio dos extratos da curva padrão Trolox.
- Expresse os resultados como amostra de TE/g μmol em base de peso seco.
- Análise estatística
- Apresentar todos os resultados como meios ± desvio padrão de pelo menos triplicados.
- Realizar a análise da variância (ANOVA) para determinar o efeito do tipo de grão nas variáveis de resposta.
- Quando existem diferenças significativas em p < 0,05, use diferença menos significativa (LSD) para comparar as médias.
- Realize a análise de correlação de Pearson para estimar a relação entre o teor fenólico e as capacidades antioxidantes.
Resultados
A Tabela 2 mostra os ácidos fenólicos identificados nos grãos de cereais e leguminosas. Com base nos padrões autênticos disponíveis, foram identificados quatro ácidos fenólicos nas amostras e são eles: ácidos vanlícíacos, cafeíacos, p-coumaricos e ferúlicos. O ácido vanlícía é um ácido hidroxibenómico, enquanto os outros três são ácidos hidroxicinnâmicos. O ácido vanlícía foi identificado apenas no feijão cowpea blackeye, enquanto o ácido cafeína foi identificado a...
Discussão
Os grãos integrais foram selecionados como grãos de cereais e leguminosas representativas que encontram amplas aplicações alimentares em todo o mundo. Embora possam existir variações entre cultivares de cada grão, o foco deste estudo foi demonstrar um método generalizado de extração e análise de ácido fenólico gratuito para grãos integrais. O método de extração foi modificado reduzindo substancialmente as quantidades de amostras e solventes, a fim de reduzir a quantidade de produtos químicos que seriam ...
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Os autores agradecem o apoio técnico da Sra. Alison Ser e da Sra. Hannah Oduro-Obeng, bem como o apoio de edição de vídeo da Sra. Janice Fajardo e do Sr. Miguel del Rosario.
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL Falcon conical centrifuge tubes | Fisher Scientific | 05-527-90 | |
| 2 mL Amber glass ID Surestop vial | Thermo Scientific | C5000-2W | |
| 2 mL Amber microcentrifuge tubes | VWR | 20170-084 | |
| 2,2′-Azobis(2-amidinopropane) dihydrochloride (AAPH) | Sigma-Aldrich | 440914-100G | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) (C18H18N4O6S4) ≥98%, | Sigma Aldrich | A1888-2G | |
| 2,2-Diphenyl-1pikrylhydrazyl (DPPH) (C18H12N5O6) | Sigma Aldrich | D913-2 | |
| 6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox) (C14H18O4), ≥98% | Fluka Chemika | 56510 | |
| 9 mm Autosampler Vial Screw Thread Caps | Thermo Scientific | 60180-670 | |
| 96 well flat bottom plates | Fisher Scientific | 12565501 | |
| Agilent BioTek ELx800 microplate reader | Fisher Scientific | BT-ELX800NB | |
| Agilent BioTek Precision 2000 96/384 Automated Microplate Pipetting System | Fisher Scientific | N/A | |
| Agilent BioTek FLx800 Microplate Fluorescence Reader | Fisher Scientific | N/A | |
| Analytical balance SI-114 | Denver Instrument | SI-114.1 | |
| Autosampler, Waters 717 Plus | Waters | WAT078900 | |
| BD 3 mL syringe Luer-Lok Tip | BD | 309657 | |
| Bransonic ultrasonic cleaner, Branson 5510 | Millipore Sigma | Z245143 | |
| Corning LSE Vortex Mixer | Corning | 6775 | |
| Durapore Filter (0.45 µm PVDF Membrane) | Merck Millipore Ltd | HVLP04700 | |
| Durapore Membrane Filters (0.45 µm HV) | Merck Millipore Ltd | HVHP04700 | |
| Eppendorf Research plus, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research plus, 0.5-5 mL | Eppendorf | 3123000071 | |
| Eppendorf Research plus, 100-1000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research plus, 10-100 µL | Eppendorf | 3123000047 | |
| Ethyl acetate, HPLC grade | Fisher Chemical | E195-4 | |
| Ferulic acid standard | Sigma Aldrich | 128708-5G | |
| Fluorescein | Fisher Scientific | AC119245000 | |
| Folin & Ciocalteu phenol reagent | Sigma Aldrich | F9252 | |
| Formic acid, 99% | Acros Organics, Janssen Pharmaceuticalaan 3a | 27048-0010 | |
| Gallic acid standard | Sigma | G7384 | |
| High performance liquid chromatograph (HPLC), Waters 2695 | Waters | 960402 | |
| Methanol, HPLC grade | Fisher Chemical | A452-4 | |
| Micro pipet tips, 0.5-10 µL | Fisherbrand | 21-197-2F | |
| Microcentrifuge Sorvall Legend Micro 21 centrifuge | Thermo Scientific | 75002435 | |
| Multichannel micropipette, Proline Plus, 30-300 µL | Sartorius | 728240 | |
| Photodiode array detector, Waters 2996 | Waters | 720000350EN | |
| Pipet tips, 1000 µL | VWR | 83007-382 | |
| Pipet tips, 1-5 mL | VWR | 82018-840 | |
| Potassium persulfate (K2S2O8), ≥99.0% | Sigma Aldrich | 216224-100G | |
| Potassium phosphate dibasic anhydrous (K2HPO4) | Fisher Scientific | P288-500 | |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | P285-500 | |
| PYREX 250 mL Short Neck Boiling Flask, Round Bottom | Corning | 4321-250 | |
| Reversed phase C18 Analytical Column (100 x 3 mm) Accucore aQ | Thermo Scientific | 17326-103030 | |
| Roto evaporator, IKA RV 10 | IKA | 0010005185 | |
| Sodium carbonate (NaCO3) anhydrous | Fisher Chemical | S263-1 | |
| Sodium chloride (NaCl) | Mallinckrodt AR® | 7581 | |
| Sodium phosphate dibasic anhydrous (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Sodium phosphate monobasic anhydrous (NaH2PO4) | Fisher bioreagents | BP329-500 | |
| Standardization pipet tips 0-200µL | Fisherbrand | 02-681-134 | |
| Syringe Driven Filter unit (0.22 µm) | Millex®-GV | SLGVR04NL | |
| Target micro-serts vial insert (400 µL) | Thermo Scientific | C4011-631 | |
| Ultrapure water (Direct Q-3 UV system with pump) | Millipore | ZRQSVP030 |
Referências
- Huitu, O., et al. Silicon, endophytes and secondary metabolites as grass defenses against mammalian herbivores. Frontiers in Plant Science. 5, 478 (2014).
- Joshi, J. R., Burdman, S., Lipsky, A., Yariv, S., Yedidia, I. Plant phenolic acids affect the virulence of Pectobacterium aroidearum and P. carotovorum ssp. brasiliense via quorum sensing regulation. Molecular Plant Pathology. 17 (4), 487-500 (2016).
- Dykes, L., Rooney, L. W. Phenolic compounds in cereal grains and their health benefits. Cereal Foods World. 52 (3), 105-111 (2007).
- Xiang, J., Apea-Bah, F. B., Ndolo, V. U., Katundu, M. C., Beta, T. Profile of phenolic compounds and antioxidant activity of finger millet varieties. Food Chemistry. 275, 361-368 (2019).
- Qiu, Y., Liu, Q., Beta, T. Antioxidant properties of commercial wild rice and analysis of soluble and insoluble phenolic acids. Food Chemistry. 121 (1), 140-147 (2010).
- Beverly, R. L., Motarjemi, Y. . Encyclopedia of Food Safety. 3, 309-314 (2014).
- FAO. Food Outlook - Biannual report on global food markets. Food and Agriculture Organization. , (2020).
- Erbersdobler, H. F., Barth, C. A., Jahreis, G. Legumes in human nutrition. Nutrient content and protein quality of pulses. Ernahrungs Umschau. 64 (9), 134-139 (2017).
- Dueñas, M., Hernández, T., Estrella, I. Assessment of in vitro antioxidant capacity of the seed coat and the cotyledon of legumes in relation to their phenolic contents. Food Chemistry. 98 (1), 95-103 (2006).
- Khang, D. T., Dung, T. N., Elzaawely, A. A., Xuan, T. D. Phenolic profiles and antioxidant activity of germinated legumes. Foods. 5 (2), 27 (2016).
- Hefni, M. E., Amann, L. S., Witthöft, C. M. A HPLC-UV method for the quantification of phenolic acids in cereals. Food Analytical Methods. 12 (12), 2802-2812 (2019).
- AOAC. . Official Methods of Analysis. 17th edn. , (2000).
- Apea-Bah, F. B., Head, D., Scales, R., Bazylo, R., Beta, T. Hydrothermal extraction, a promising method for concentrating phenolic antioxidants from red osier dogwood (Cornus stolonifer) leaves and stems. Heliyon. 6 (10), 05158 (2020).
- Apea-Bah, F. B., Minnaar, A., Bester, M. J., Duodu, K. G. Sorghum-cowpea composite porridge as a functional food, Part II: Antioxidant properties as affected by simulated in vitro gastrointestinal digestion. Food Chemistry. 197, 307-315 (2016).
- Robbins, R. J., Bean, S. R. Development of a quantitative high-performance liquid chromatography-photodiode array detection measurement system for phenolic acids. Journal of Chromatography A. 1038 (1-2), 97-105 (2004).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Prior, R. L., Wu, X., Schaich, K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry. 53 (10), 4290-4302 (2005).
- Ainsworth, E. A., Gillespie, K. M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent. Nature Protocols. 2 (4), 875-877 (2007).
- Waterhouse, A. L. Determination of total phenolics. Current Protocols in Food Analytical Chemistry. 1, 1-8 (2002).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry. 53 (6), 1841-1856 (2005).
- Esterbauer, H., Wäg, G., Puhl, H. Lipid peroxidation and its role in atherosclerosis. British Medical Bulletin. 49 (3), 566-576 (1993).
- Esterbauer, H., Gebicki, J., Puhl, H., Jürgens, G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radical Biology and Medicine. 13 (4), 341-390 (1992).
- Apea-Bah, F. B., Serem, J. C., Bester, M. J., Duodu, K. G. Phenolic composition and antioxidant properties of Koose, a deep-fat fried cowpea cake. Food Chemistry. 237, 247-256 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados