È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo generalizzato per determinare la composizione dell'acido fenolico solubile libero e la capacità antiossidante di cereali e legumi
In questo articolo
Riepilogo
Gli acidi fenolici sono importanti sostanze fitochimiche presenti nei cereali integrali. Possiedono proprietà bioattive come le funzioni protettive antiossidanti. Questo lavoro mirava a riportare un metodo generalizzato per l'identificazione dell'HPLC, la stima del contenuto fenolico totale e la determinazione della capacità antiossidante degli acidi fenolici nei cereali e nei legumi.
Abstract
Gli acidi fenolici sono una classe di composti organici che portano sia un gruppo fenolico che un gruppo carbossilico. Si trovano nei cereali e si concentrano nella crusca dei cereali o nel rivestimento dei semi dei legumi. Possiedono proprietà antiossidanti che hanno generato molto interesse di ricerca negli ultimi anni, sulle loro potenziali funzioni antiossidanti protettive per la salute. Questo lavoro presenta un metodo generalizzato per l'estrazione di acidi fenolici solubili liberi da cereali integrali e l'analisi della loro capacità antiossidante. Sono stati utilizzati cinque campioni di cereali integrali comprendenti due cereali (grano e mais giallo) e tre legumi (fagiolo, fagiolo e soia). I grani venivano macinati in farina e i loro acidi fenolici solubili liberi estratti usando metanolo acquoso. I composti sono stati quindi identificati utilizzando un cromatografo liquido ad alta pressione (HPLC). Il metodo Folin-Ciocalteu è stato utilizzato per determinare il loro contenuto fenolico totale, mentre le loro capacità antiossidanti sono state determinate utilizzando i saggi DPPH radical scavenging, Trolox equivalent antioxidant capacity (TEAC) e oxygen radical absorbance capacity (ORAC). Gli acidi fenolici identificati includevano acidi vanillico, caffeico, p-cumarico e ferulico. L'acido vanillico è stato identificato solo nel fagiolo mentre l'acido caffeico è stato identificato solo nel fagiolo. L'acido p-cumarico è stato identificato nel mais giallo, nel fagiolo e nella soia, mentre l'acido ferulico è stato identificato in tutti i campioni. L'acido ferulico era l'acido fenolico predominante identificato. La concentrazione totale di acidi fenolici nei campioni è diminuita nel seguente ordine: soia > fagiolo > mais giallo = fagiolo > grano. La capacità antiossidante totale (somma dei valori dei saggi DPPH, TEAC e ORAC) è diminuita come segue: soia > fagiolo > mais giallo = fagiolo di mucca > grano. Questo studio ha concluso che l'analisi HPLC e i saggi DPPH, TEAC e ORAC forniscono informazioni utili sulla composizione dell'acido fenolico e sulle proprietà antiossidanti dei cereali integrali.
Introduzione
Gli acidi fenolici sono tra i più importanti fitochimici studiati nelle piante a causa del ruolo vitale che svolgono nella difesa delle piante contro le infezioni erbivore e fungine, oltre a mantenere il supporto strutturale e l'integrità nei tessuti vegetali 1,2. Sono abbondanti nella crusca di cereali e nel rivestimento di semi di legumi3. Strutturalmente, sono divisi in due gruppi: gli acidi idrossibenzoici (Figura 1) e gli acidi idrossicinnamici (Figura 2). Gli acidi idrossibenzoici comuni nei cereali e nei legumi includono acido gallico, p-idrossibenzoico, 2,4-diidrossibenzoico, protocatechuico, vanillico e siringico, mentre gli acidi idrossicinnamici comuni includono gli acidi caffeico, p-cumarico, ferulico e sinapico3. Gli acidi fenolici possiedono anche proprietà antiossidanti poiché sono in grado di eliminare i radicali liberi, che causano irrancidimento ossidativo nei grassi, e avviare e propagare lo stress ossidativo indotto dai radicali nei sistemi fisiologici 4,5. A causa di questo ruolo fisiologico vitale come antiossidanti, sono oggetto di recenti ricerche. Questo perché se consumati come componenti di alimenti vegetali, possono esercitare una protezione antiossidante.
I cereali e i prodotti a base di cereali sono le principali fonti di cibo a base di carboidrati per l'uomo e gli animali in tutto il mondo6. I cereali includono grano, riso, mais (mais), orzo, triticale, miglio e sorgo. Tra questi, il mais è il più utilizzato, con un utilizzo globale stimato di 1.135,7 milioni di tonnellate nel 2019/2020, seguito dal grano con un utilizzo globale stimato di 757,5 milioni di tonnellate nello stesso periodo7. Gli alimenti a base di cereali sono grandi fonti di energia per i consumatori poiché sono ricche fonti di carboidrati. Forniscono anche alcune proteine, grassi, fibre, vitamine e minerali6. Oltre al loro valore nutrizionale, i cereali sono buone fonti di antiossidanti fitochimici, in particolare acidi fenolici, che hanno il potenziale per proteggere il sistema fisiologico dal danno ossidativo indotto dai radicali3. I legumi sono anche buone fonti di nutrienti e sono generalmente più ricchi di proteine rispetto ai cereali. Contengono anche vitamine e minerali e sono utilizzati nella preparazione di vari alimenti8. Inoltre, i legumi sono buone fonti di una varietà di antiossidanti fitochimici, tra cui acidi fenolici, flavonoidi, antociani e proantocianidine 9,10. Diverse varietà di cereali e legumi possono avere una diversa composizione di acido fenolico. C'è quindi la necessità di studiare la composizione dell'acido fenolico di cereali e legumi e delle loro varietà, al fine di conoscere i loro potenziali benefici per la salute rispetto agli antiossidanti fenolici.
Sono stati riportati numerosi saggi per misurare la quantità di acidi fenolici nei cereali e nei legumi e determinare le loro attività antiossidanti. I metodi più comuni di analisi per gli acidi fenolici integrali sono la spettrofotometria e la cromatografia liquida11. Lo scopo di questo lavoro era quello di dimostrare un metodo cromatografico liquido generalizzato ad alta pressione per determinare la composizione dell'acido fenolico solubile libero e metodi spettrofotometrici per determinare il contenuto fenolico totale e la capacità antiossidante di alcuni cereali integrali e legumi.
Protocollo
1. Tipo di campioni
- Utilizzare cinque campioni di cereali integrali, comprendenti due cereali (ad esempio, grano duro e mais giallo) e tre legumi (ad esempio, fagiolo di mucca Blackeye, soia e fagiolo rosso) per questo studio.
- Macinare 50 g di ogni chicco in triplicati in farina, usando un macinino da caffè, e passarli attraverso un setaccio da 500 μm.
- Conservarli a -20 °C.
2. Preparazione del campione
-
Determinazione del contenuto di sostanza secca ed espressione della base del peso secco
NOTA: Determinare il contenuto di sostanza secca di ciascun campione in polvere secondo il metodo AOAC (2000)12.- Accendere un forno a convezione forzata e impostare la temperatura a 130 °C.
- Essiccare essiccante (gel di silice) nel forno per 30 minuti a 1 ora e trasferire il gel di silice essiccato in un essiccatore.
- Pesare accuratamente 2 g di ciascun campione in una lattina di alluminio pulita, pre-essiccata e pesata.
- Asciugare i campioni pesati a 130 °C per 1 ora in un forno a convezione forzata.
- Trasferire il campione essiccato all'essiccatore e lasciarlo raffreddare a temperatura ambiente.
- Pesare il campione essiccato e raffreddato e registrarne il peso.
- Calcolare il contenuto di sostanza secca di ciascun campione come segue:
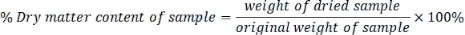
- Esprimere ogni parametro misurato in base al peso secco utilizzando la seguente formula:

-
Estrazione dell'acido fenolico
NOTA: Estrarre i composti fenolici liberi solubili nei campioni di grano utilizzando una modifica del metodo di Y. Qiu et al.5 che consente l'estrazione fenolica da quantità di milligrammi di cereali integrali.- Pesare accuratamente 100 mg del campione di farina integrale direttamente in un tubo microcentrifuga di colore ambrato da 2 mL di capacità. Il colore scuro del tubo aiuta a prevenire l'esposizione della miscela alla luce.
- Aggiungere 1 mL di metanolo acquoso di grado HPLC all'80% a ciascuna delle provette contenenti i campioni.
- Vortice brevemente per mescolare la soluzione di metanolo e i campioni.
- Sonicare i campioni per 60 minuti per estrarre i composti fenolici solubili liberi. Metti una copertura sopra i campioni per tutta la durata della sonicazione per una maggiore protezione dalla luce.
- Dopo la sonicazione, centrifugare la miscela a 20.000 × g per 5 minuti per sedimentare i residui solidi lasciando il surnatante in cima. Composti fenolici liberi saranno presenti nel surnatante dopo la centrifugazione.
- Trasferire il surnatante in un tubo microcentrifuga pulito.
NOTA: Il surnatante deve essere filtrato prima di essere iniettato nello strumento HPLC. Per filtrare il surnatante, rimuovere lo stantuffo di una siringa da 3 ml e collegare un filtro a siringa. Il filtro deve avere una dimensione dei pori non superiore a 0,22 μm. - Pipettare circa 0,4 mL del surnatante nella parte superiore della siringa. Reinserire lo stantuffo e spingere il liquido attraverso il filtro in un flaconcino HPLC contenente un flaconcino.
- Una volta che lo strumento è stato impostato per eseguire il metodo delineato nel manoscritto per l'analisi HPLC, caricare le fiale nel carosello per corrispondere all'elenco dei campioni.
- Ottenere cromatogrammi HPLC a 320 nm e 280 nm che mostrano picchi distinti che rappresentano diversi composti fenolici.
- Utilizzando curve standard appropriate, quantificare gli acidi idrossicinnamici a 320 nm poiché hanno la massima assorbanza a questa lunghezza d'onda. Con lo stesso principio, quantificare gli acidi idrossibenzoici a 280 nm.
- Conservare gli estratti rimanenti a -20 °C per altre analisi.
3. Composizione fenolica
- Utilizzare un cromatografo liquido ad alta pressione (Table of Materials) per identificare e quantificare i composti fenolici estratti nei campioni, sulla base del metodo di J. Xiang, F.B. Apea-Bah, V. U. Ndolo, M.C. Katundu e T. Beta 4.
- Preparare standard di acido fenolico (acido vanillico, acido caffeico, acido p-cumarico, acido ferulico e acido sinapico) per identificare e quantificare i composti fenolici costituenti negli estratti.
- Per fare questo, pesare 1 mg di ogni standard e sciogliere in 1 mL di metanolo acquoso al 50% per produrre 1.000 μg / mL di ogni standard.
- Mescolare volumi uguali di tutti e cinque gli standard in un tubo centrifugo ambrato da 2 ml per produrre un cocktail di standard, ciascuno con una concentrazione di 200 μg / mL.
- Preparare le diluizioni seriali del cocktail standard prendendo un volume in un nuovo tubo e diluendo con lo stesso volume del solvente acquoso di metanolo.
- Ripetere le diluizioni seriali fino ad una concentrazione di 3,125 μg/mL.
- Inoltre, diluire separatamente ogni standard 40 volte con il solvente per ottenere una concentrazione di 25 μg/mL di ciascuno standard.
- Impostare la temperatura della colonna a 35 °C e la temperatura del forno campione a 15 °C.
- Per preparare la fase mobile A (acido formico acquoso allo 0,1%), trasferire 1 mL di acido formico in un matraccio volumetrico da 1 L di capacità e aggiungere acqua di grado HPLC al marchio 1 L. Agitare bene per mescolare.
- Per preparare la fase B mobile (acido formico allo 0,1% in metanolo), trasferire 1 mL di acido formico in un matraccio tarato da 1 L e aggiungere metanolo di grado HPLC al marchio 1 L. Agitare bene per mescolare.
- Se necessario, regolare i volumi al segno di 1 L.
- Filtrare entrambe le fasi mobili attraverso una carta da filtro idrofila da 0,45 μm.
- Per l'analisi, iniettare 10 μL di ciascun estratto o standard (standard 25 μg/mL e cocktail standard) sulla colonna inversa.
- Elute con le fasi mobili secondo il programma di gradiente lineare per una corsa di 25 minuti come segue: 0-3,81 min, 9%-14% B; 3,81-4,85 min, 14%-15% B; 4,85-5,89 min, 15%-15% B, 5,89-8,32 min, 15%-17% B; 8,32-9,71 min, 17%-19% B; 9,71-10,40 min, 19%-19% B; 10,40-12,48 min, 19%-26% B; 12,48-13,17 min, 16%-28% B; 13,17-14,21 min, 28%-35% B; 14,21-15,95 min, 35%-40% B; 15,95-16,64 min, 40%-48% B; 16,64-18,37 min, 48%-53% B; 18,37-22,53 min, 53%-70% B; 22,53-22,88 min, 70%-90% B; 22.88-25.00 min, 90% B.
- Confrontare i tempi di ritenzione dei picchi cromatografici ottenuti per gli standard autentici di concentrazioni 25 μg/mL, a 280 nm e 320 nm, con quelli degli estratti, al fine di identificare i composti fenolici costituenti nei campioni.
- Tracciare le curve di calibrazione per i cocktail standard di acido fenolico, con concentrazione degli standard sull'asse orizzontale e l'area di picco sull'asse verticale
- Utilizzare le curve di calibrazione per stimare le concentrazioni dei composti fenolici identificati, confrontando le aree di picco sul grafico con quelle dei composti identificati a 280 nm e 320 nm come menzionato nella sezione precedente.
4. Contenuto fenolico totale
NOTA: Determinare il contenuto fenolico totale degli estratti utilizzando il metodo Folin-Ciocalteu descritto da F.B. Apea-Bah et al.13.
- Preparare gli standard di acido ferulico e acido gallico entro l'intervallo di concentrazione da 0,025 a 0,150 mg / mL per tracciare le curve di calibrazione in confronto, per la stima del contenuto fenolico totale.
- Per fare ciò, pesare accuratamente 1 mg ciascuno di acido ferulico e acidi gallici in tubi centrifughi da 2 ml di capacità.
- Aggiungere 1 mL di metanolo acquoso al 50% a ciascuno standard e vortice per dissolvere, producendo 1 mg / mL di stock di ogni standard.
- Preparare una serie di diluizioni da ogni soluzione madre per un totale di 500 μL.
- Pipettare 18,2 μL di ogni estratto o standard in un pozzo separato su una micropiastra a 96 pozzetti.
- Aggiungere 36,4 μL di reagente acquoso Folin-Ciocalteu al 10% (v/v) a ciascun estratto o standard.
- Quindi, aggiungere 145,4 μL di 700 mM di carbonato di sodio a ciascuna miscela di reazione.
- Incubare le miscele di reazione al buio a temperatura ambiente (20-25 °C) per 2 ore.
- Leggere l'assorbanza su un lettore di micropiastre a 750 nm.
- Tracciare le curve di calibrazione della variazione dell'assorbanza rispetto alla concentrazione degli standard di acido fenolico e utilizzarle per stimare il contenuto fenolico totale.
- Esprimere i risultati come milligrammi equivalenti di acido ferulico per grammo di campione macinato (mg FAE/g) e milligrammi di acido gallico equivalente per grammo di campione macinato (mg GAE/g) in peso secco.
5. Saggi antiossidanti
NOTA: Determinare la capacità antiossidante degli estratti di grano utilizzando i seguenti tre saggi: capacità di scavenging radicale del 2,2-difenil-1-fotorilidazile (DPPH); Capacità di scavenging radicale dell'acido 2,2'-azino-bis (3-etilbenzotiazolina-6-solfonico( ABTS), che è anche chiamata capacità antiossidante equivalente a Trolox (TEAC); e capacità di assorbimento dei radicali dell'ossigeno (ORAC).
- Preparazione degli standard Trolox per curve standard
- Utilizzare Trolox, un analogo idrosolubile della vitamina E, come standard per stimare la capacità antiossidante in vitro degli estratti di cereali integrali.
- Pesare accuratamente 1 mg di Trolox in un tubo da 15 ml. Sciogliere in 4 ml di metanolo acquoso al 50%. Vortice per dissolvere per preparare una soluzione madre di 1 mM (1000 μM).
- Preparare sei concentrazioni di Trolox, ovvero 50, 100, 200, 400, 600 e 800 μM per tracciare curve standard per la stima della capacità di scavenging dei radicali DPPH e della capacità antiossidante equivalente di Trolox (TEAC). Allo stesso modo, preparare le concentrazioni 6.25, 12.5, 25 e 50 μM di Trolox per stimare la capacità di assorbimento dei radicali dell'ossigeno (ORAC). Portare il volume totale di ciascuna concentrazione a 500 μL come mostrato nella Tabella 1.
- Diluizione di estratti campione
- Diluire gli estratti del campione con metanolo prima dell'analisi. Qui, gli estratti di mais giallo e fagiolo sono stati diluiti due volte, il grano e il fagiolo sono stati diluiti cinque volte mentre l'estratto di soia è stato diluito 10 volte con metanolo.
- Test della capacità antiossidante equivalente (TEAC) di Trolox
- Misurare la capacità antiossidante equivalente a Trolox (TEAC) dei campioni utilizzando il metodo descritto in precedenza da F.B. Apea-Bah et al.14.
- Pesare 8,23 mg di ABTS in un tubo di centrifuga ambrato pulito da 2 ml di capacità.
- Quindi, pesare 1,62 mg di persolfato di potassio in un altro tubo di centrifuga ambrato pulito da 2 ml di capacità.
- Aggiungere 1 mL di acqua distillata a ciascuno di essi e vortice per dissolverli.
NOTA: Ciò si traduce in 16 mM di soluzione madre abTS con 6 mM di soluzione acquosa di persolfato di potassio. - Preparare la soluzione madre ABTS mescolando le soluzioni abTS e di persolfato di potassio in volumi uguali. La soluzione cambierà immediatamente in un colore scuro.
- Incubare la miscela di reagenti al buio per 12-16 ore.
- Diluire la soluzione madre ABTS 30 volte con 200 mM di soluzione salina tamponata con fosfato (PBS), per formare la soluzione di lavoro ABTS. Per fare ciò, aggiungere 58 mL di PBS da 200 mM a 2 mL della soluzione madre ABTS. La soluzione di lavoro conterrà 0,27 mM ABTS e 0,1 mM di persolfato di potassio.
- Per l'analisi, posizionare 10 μL di ciascun estratto diluito o Trolox in una micropiastra a 96 pozzetti.
- Aggiungere 190 μL di soluzione di lavoro ABTS a ciascun pozzo e incubare le miscele di reazione per 60 minuti.
- Misurare l'assorbanza delle miscele di reazione a 750 nm in un lettore di micropiastre.
- Utilizzare gli standard Trolox in una concentrazione compresa tra 100 e 800 μmol/L per tracciare una curva di calibrazione.
- Stimare la capacità di scavenging radicale ABTS dalla curva di calibrazione.
- Esprimere i risultati come micromole Trolox equivalenti per grammo (μmol TE/g) campione in base al peso secco.
- Saggio DPPH
NOTA: Determinare la capacità di scavenging radicale DPPH dei campioni utilizzando il metodo descritto in precedenza da F.B. Apea-Bah et al.13. Il test antiossidante DPPH richiede un composto che genera radicali, DPPH (2,2-difenil-1-picrilidazil).- Pesare accuratamente 1,2 mg di DPPH in un tubo centrifugo vuoto da 50 ml di capacità. Sciogliere il DPPH in 30 ml di metanolo per preparare una soluzione metanolica da 60 μmol/L.
NOTA: Il test DPPH verifica la capacità degli estratti campione di eliminare i radicali liberi prodotti dal DPPH. - Per l'analisi, aggiungere 5 μL degli estratti campione o della soluzione di Trolox nei pozzetti delle micropiastre.
- Quindi, aggiungere 195 μL della soluzione metanolica DPPH da 60 μmol/L e incubare per 60 min.
- Misurare l'assorbanza della miscela di reazione a 515 nm.
- Utilizzare gli standard Trolox (50-800 μmol/L) per tracciare una curva di calibrazione, con la variazione dell'assorbanza sull'asse verticale e le concentrazioni di Trolox sull'asse orizzontale.
- Stimare la capacità di scavenging DPPH dalla curva di calibrazione.
- Esprimere i risultati come micromole Trolox equivalenti per grammo (μmol TE/g) campione in base al peso secco.
- Pesare accuratamente 1,2 mg di DPPH in un tubo centrifugo vuoto da 50 ml di capacità. Sciogliere il DPPH in 30 ml di metanolo per preparare una soluzione metanolica da 60 μmol/L.
- Capacità di assorbimento dei radicali dell'ossigeno
- Determinare la capacità di assorbimento dei radicali dell'ossigeno (ORAC) dei campioni in base al metodo di F.B. Apea-Bah et al.13.
- Per iniziare, preparare gli standard Trolox di concentrazioni 6,25, 12,5, 25 e 50 μM da una soluzione madre standard Trolox da 1.000 μM in tampone di fosfato di potassio da 75 mM (K2HPO4/KH2PO4).
- Per fare ciò, pesare 1 mg di polvere di Trolox e sciogliere in 4 mL della soluzione tampone sotto sonicazione per preparare una soluzione madre da 1.000 μM.
- Quindi, prendere 50 μL della soluzione madre in un tubo centrifugo da 2 mL di capacità e diluire con 950 μL di soluzione tampone per ottenere 1.000 μL di soluzione Trolox da 50 μM.
- Pipettare 500 μL della soluzione da 50 μM in un nuovo tubo e diluire con uguale volume di tampone per ottenere una soluzione trolox da 25 μM.
- Ripetere la diluizione seriale dei 25 μM per ottenere 12,5 μM, quindi ripetere allo stesso modo la diluizione di 12,5 μM per ottenere 6,25 μM.
- Preparare le opportune diluizioni degli estratti campione.
- Diluire gli estratti di mais giallo e fagiolo 20 volte, gli estratti di grano e fagiolo 50 volte e l'estratto di soia 100 volte con la soluzione tampone.
- Trasferire 200 μL di ciascun campione o standard Trolox nei pozzetti di una micropiastra nera a 96 pozzetti per il pipettaggio automatico.
- Quindi, riempire i tre serbatoi di reagenti forniti con l'apparecchiatura ORAC, con quanto segue: (1) la soluzione tampone; (2) 0,816 nM fluoresceina nel tampone; e (3) 153 mM di 2,2′-azobis(2-amidinopropano) dicloridrato (AAPH) in tampone.
- Mettili nei loro recipienti per il pipettaggio automatico.
- Impostare la macchina ORAC e il sistema di pipettaggio automatico per l'analisi, in base alla procedura operativa standard.
- Per l'analisi, impostare il sistema di pipettaggio automatizzato per trasferire 25 μL di ciascun estratto diluito o standard ai pozzetti di una micropiastra nera a 96 pozzetti a fondo trasparente.
- Quindi, aggiungere automaticamente 150 μL di 0,816 nM di fluoresceina nel tampone.
- Incubare la miscela di reazione a 37 °C per 15 minuti nella macchina ORAC.
- Successivamente, aggiungere automaticamente 25 μL di AAPH a ciascuna miscela di reazione.
- Incubarli a 37 °C per 50 minuti nella macchina ORAC.
- Impostare la macchina ORAC per misurare il decadimento della fluorescenza, durante il periodo di incubazione, a lunghezze d'onda di eccitazione ed emissione di 485 nm e 520 nm, rispettivamente.
- Dopo le misurazioni, tracciare una curva standard trolox, con Trolox (6,25-50 μM) sull'asse orizzontale e decadimento di fluorescenza sull'asse verticale.
- Stimare la capacità di assorbimento dei radicali dell'ossigeno degli estratti della curva standard di Trolox.
- Esprimere i risultati come campione μmol TE/g in base al peso secco.
- Analisi statistica
- Presentare tutti i risultati come mezzi ± deviazione standard di almeno triplicati.
- Eseguire l'analisi della varianza (ANOVA) per determinare l'effetto del tipo di granulosità sulle variabili di risposta.
- Laddove esistano differenze significative a p < 0,05, utilizzare la differenza meno significativa (LSD) per confrontare i mezzi.
- Eseguire l'analisi di correlazione di Pearson per stimare la relazione tra il contenuto fenolico e le capacità antiossidanti.
Risultati
La Tabella 2 mostra gli acidi fenolici che sono stati identificati nei cereali e nei legumi. Sulla base degli standard autentici disponibili, quattro acidi fenolici sono stati identificati nei campioni e sono: acido vanillico, caffeico, p-cumarico e ferulico. L'acido vanillico è un acido idrossibenzoico mentre gli altri tre sono acidi idrossicinnamici. L'acido vanillico è stato identificato solo nel fagiolo di mucca Blackeye mentre l'acido caffeico è stato identificato solo nel fagiolo. <...
Discussione
I cereali integrali sono stati selezionati come cereali rappresentativi e legumi che trovano ampie applicazioni alimentari in tutto il mondo. Mentre possono esistere variazioni tra le cultivar di ciascun grano, l'obiettivo di questo studio è stato quello di dimostrare un metodo generalizzato per l'estrazione di acido fenolico libero e l'analisi per i cereali integrali. Il metodo di estrazione è stato modificato riducendo sostanzialmente la quantità di campioni e solventi, al fine di ridurre la quantità di sostanze ch...
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Gli autori riconoscono con gratitudine il supporto tecnico di Alison Ser e Hannah Oduro-Obeng, nonché il supporto al montaggio video di Janice Fajardo e Miguel del Rosario.
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL Falcon conical centrifuge tubes | Fisher Scientific | 05-527-90 | |
| 2 mL Amber glass ID Surestop vial | Thermo Scientific | C5000-2W | |
| 2 mL Amber microcentrifuge tubes | VWR | 20170-084 | |
| 2,2′-Azobis(2-amidinopropane) dihydrochloride (AAPH) | Sigma-Aldrich | 440914-100G | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) (C18H18N4O6S4) ≥98%, | Sigma Aldrich | A1888-2G | |
| 2,2-Diphenyl-1pikrylhydrazyl (DPPH) (C18H12N5O6) | Sigma Aldrich | D913-2 | |
| 6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox) (C14H18O4), ≥98% | Fluka Chemika | 56510 | |
| 9 mm Autosampler Vial Screw Thread Caps | Thermo Scientific | 60180-670 | |
| 96 well flat bottom plates | Fisher Scientific | 12565501 | |
| Agilent BioTek ELx800 microplate reader | Fisher Scientific | BT-ELX800NB | |
| Agilent BioTek Precision 2000 96/384 Automated Microplate Pipetting System | Fisher Scientific | N/A | |
| Agilent BioTek FLx800 Microplate Fluorescence Reader | Fisher Scientific | N/A | |
| Analytical balance SI-114 | Denver Instrument | SI-114.1 | |
| Autosampler, Waters 717 Plus | Waters | WAT078900 | |
| BD 3 mL syringe Luer-Lok Tip | BD | 309657 | |
| Bransonic ultrasonic cleaner, Branson 5510 | Millipore Sigma | Z245143 | |
| Corning LSE Vortex Mixer | Corning | 6775 | |
| Durapore Filter (0.45 µm PVDF Membrane) | Merck Millipore Ltd | HVLP04700 | |
| Durapore Membrane Filters (0.45 µm HV) | Merck Millipore Ltd | HVHP04700 | |
| Eppendorf Research plus, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research plus, 0.5-5 mL | Eppendorf | 3123000071 | |
| Eppendorf Research plus, 100-1000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research plus, 10-100 µL | Eppendorf | 3123000047 | |
| Ethyl acetate, HPLC grade | Fisher Chemical | E195-4 | |
| Ferulic acid standard | Sigma Aldrich | 128708-5G | |
| Fluorescein | Fisher Scientific | AC119245000 | |
| Folin & Ciocalteu phenol reagent | Sigma Aldrich | F9252 | |
| Formic acid, 99% | Acros Organics, Janssen Pharmaceuticalaan 3a | 27048-0010 | |
| Gallic acid standard | Sigma | G7384 | |
| High performance liquid chromatograph (HPLC), Waters 2695 | Waters | 960402 | |
| Methanol, HPLC grade | Fisher Chemical | A452-4 | |
| Micro pipet tips, 0.5-10 µL | Fisherbrand | 21-197-2F | |
| Microcentrifuge Sorvall Legend Micro 21 centrifuge | Thermo Scientific | 75002435 | |
| Multichannel micropipette, Proline Plus, 30-300 µL | Sartorius | 728240 | |
| Photodiode array detector, Waters 2996 | Waters | 720000350EN | |
| Pipet tips, 1000 µL | VWR | 83007-382 | |
| Pipet tips, 1-5 mL | VWR | 82018-840 | |
| Potassium persulfate (K2S2O8), ≥99.0% | Sigma Aldrich | 216224-100G | |
| Potassium phosphate dibasic anhydrous (K2HPO4) | Fisher Scientific | P288-500 | |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | P285-500 | |
| PYREX 250 mL Short Neck Boiling Flask, Round Bottom | Corning | 4321-250 | |
| Reversed phase C18 Analytical Column (100 x 3 mm) Accucore aQ | Thermo Scientific | 17326-103030 | |
| Roto evaporator, IKA RV 10 | IKA | 0010005185 | |
| Sodium carbonate (NaCO3) anhydrous | Fisher Chemical | S263-1 | |
| Sodium chloride (NaCl) | Mallinckrodt AR® | 7581 | |
| Sodium phosphate dibasic anhydrous (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Sodium phosphate monobasic anhydrous (NaH2PO4) | Fisher bioreagents | BP329-500 | |
| Standardization pipet tips 0-200µL | Fisherbrand | 02-681-134 | |
| Syringe Driven Filter unit (0.22 µm) | Millex®-GV | SLGVR04NL | |
| Target micro-serts vial insert (400 µL) | Thermo Scientific | C4011-631 | |
| Ultrapure water (Direct Q-3 UV system with pump) | Millipore | ZRQSVP030 |
Riferimenti
- Huitu, O., et al. Silicon, endophytes and secondary metabolites as grass defenses against mammalian herbivores. Frontiers in Plant Science. 5, 478 (2014).
- Joshi, J. R., Burdman, S., Lipsky, A., Yariv, S., Yedidia, I. Plant phenolic acids affect the virulence of Pectobacterium aroidearum and P. carotovorum ssp. brasiliense via quorum sensing regulation. Molecular Plant Pathology. 17 (4), 487-500 (2016).
- Dykes, L., Rooney, L. W. Phenolic compounds in cereal grains and their health benefits. Cereal Foods World. 52 (3), 105-111 (2007).
- Xiang, J., Apea-Bah, F. B., Ndolo, V. U., Katundu, M. C., Beta, T. Profile of phenolic compounds and antioxidant activity of finger millet varieties. Food Chemistry. 275, 361-368 (2019).
- Qiu, Y., Liu, Q., Beta, T. Antioxidant properties of commercial wild rice and analysis of soluble and insoluble phenolic acids. Food Chemistry. 121 (1), 140-147 (2010).
- Beverly, R. L., Motarjemi, Y. . Encyclopedia of Food Safety. 3, 309-314 (2014).
- FAO. Food Outlook - Biannual report on global food markets. Food and Agriculture Organization. , (2020).
- Erbersdobler, H. F., Barth, C. A., Jahreis, G. Legumes in human nutrition. Nutrient content and protein quality of pulses. Ernahrungs Umschau. 64 (9), 134-139 (2017).
- Dueñas, M., Hernández, T., Estrella, I. Assessment of in vitro antioxidant capacity of the seed coat and the cotyledon of legumes in relation to their phenolic contents. Food Chemistry. 98 (1), 95-103 (2006).
- Khang, D. T., Dung, T. N., Elzaawely, A. A., Xuan, T. D. Phenolic profiles and antioxidant activity of germinated legumes. Foods. 5 (2), 27 (2016).
- Hefni, M. E., Amann, L. S., Witthöft, C. M. A HPLC-UV method for the quantification of phenolic acids in cereals. Food Analytical Methods. 12 (12), 2802-2812 (2019).
- AOAC. . Official Methods of Analysis. 17th edn. , (2000).
- Apea-Bah, F. B., Head, D., Scales, R., Bazylo, R., Beta, T. Hydrothermal extraction, a promising method for concentrating phenolic antioxidants from red osier dogwood (Cornus stolonifer) leaves and stems. Heliyon. 6 (10), 05158 (2020).
- Apea-Bah, F. B., Minnaar, A., Bester, M. J., Duodu, K. G. Sorghum-cowpea composite porridge as a functional food, Part II: Antioxidant properties as affected by simulated in vitro gastrointestinal digestion. Food Chemistry. 197, 307-315 (2016).
- Robbins, R. J., Bean, S. R. Development of a quantitative high-performance liquid chromatography-photodiode array detection measurement system for phenolic acids. Journal of Chromatography A. 1038 (1-2), 97-105 (2004).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Prior, R. L., Wu, X., Schaich, K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry. 53 (10), 4290-4302 (2005).
- Ainsworth, E. A., Gillespie, K. M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent. Nature Protocols. 2 (4), 875-877 (2007).
- Waterhouse, A. L. Determination of total phenolics. Current Protocols in Food Analytical Chemistry. 1, 1-8 (2002).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry. 53 (6), 1841-1856 (2005).
- Esterbauer, H., Wäg, G., Puhl, H. Lipid peroxidation and its role in atherosclerosis. British Medical Bulletin. 49 (3), 566-576 (1993).
- Esterbauer, H., Gebicki, J., Puhl, H., Jürgens, G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radical Biology and Medicine. 13 (4), 341-390 (1992).
- Apea-Bah, F. B., Serem, J. C., Bester, M. J., Duodu, K. G. Phenolic composition and antioxidant properties of Koose, a deep-fat fried cowpea cake. Food Chemistry. 237, 247-256 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon