JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
유리 가용성 페놀산 조성물과 곡물 및 콩과 식물의 항산화 능력을 결정하는 일반화 된 방법
요약
페놀산은 전체 곡물에 존재하는 중요한 식물 화학 물질입니다. 그들은 항산화 보호 기능과 같은 생리 활성 특성을 가지고 있습니다. 이 연구는 HPLC 식별, 총 페놀 함량 추정 및 곡물 및 콩과 식물에서 페놀산의 항산화 능력 결정을위한 일반화 된 방법을보고하는 것을 목표로했습니다.
초록
페놀산은 페놀기와 카르복실기를 모두 포함하는 유기 화합물의 부류이다. 그들은 곡물에서 발견되며 곡물의 밀기울이나 콩과 식물의 종자 코트에 집중됩니다. 그들은 항산화 특성을 가지고 있으며, 최근 몇 년 동안 잠재적 인 항산화 보호 건강 기능에 대한 많은 연구 관심을 불러 일으켰습니다. 이 연구는 전체 곡물에서 유리 가용성 페놀 산을 추출하고 항산화 능력을 분석하기위한 일반화 된 방법을 제시합니다. 두 개의 곡물 (밀과 노란 옥수수)과 세 개의 콩과 식물 (카우완두콩, 신장 콩 및 콩)으로 구성된 다섯 개의 전체 곡물 샘플이 사용되었습니다. 곡물을 밀가루로 분쇄하고 그들의 유리 가용성 페놀산을 수성 메탄올을 사용하여 추출하였다. 이어서, 고압 액체 크로마토그래프(HPLC)를 이용하여 화합물을 동정하였다. Folin-Ciocalteu 방법을 사용하여 총 페놀 함량을 결정하고 항산화 능력은 DPPH 라디칼 소거능, Trolox 등가 항산화 능력 (TEAC) 및 산소 라디칼 흡광도 용량 (ORAC) 분석을 사용하여 결정되었습니다. 확인된 페놀산에는 바닐릭산, 카페인산, p-쿠마르산, 페룰산이 포함되었다. 바닐산은 카우완두에서만 확인되었으며 카페산은 신장 콩에서만 확인되었습니다. p-Coumaric acid는 노란색 옥수수, 카우완두콩 및 콩에서 확인되었으며, 페룰산은 모든 샘플에서 확인되었습니다. 페룰산이 우세한 페놀산이 확인되었다. 샘플에서 페놀산의 총 농도는 다음과 같은 순서로 감소했다 : 콩 > 카우완두> 황색 옥수수 = 신장 콩 > 밀. 총 항산화 능력 (DPPH, TEAC 및 ORAC 분석의 값의 합)은 다음과 같이 감소했다 : 대두 > 신장 콩 > 황색 옥수수 = 카우완두> 밀. 이 연구는 HPLC 분석뿐만 아니라 DPPH, TEAC 및 ORAC 분석이 페놀산 조성 및 전체 곡물의 항산화 특성에 대한 유용한 정보를 제공한다는 결론을 내렸다.
서문
페놀산은 초식 및 곰팡이 감염에 대한 식물 방어뿐만 아니라 식물 조직의 구조적 지원 및 무결성을 유지하는 데 중요한 역할을하기 때문에 식물에서 연구 된 가장 중요한 식물 화학 물질 중 하나입니다 1,2. 그들은 곡물의 밀기울과 콩과 식물의 종자 코트에 풍부합니다3. 구조적으로 그들은 두 그룹으로 나뉩니다 : 히드록시벤조산 (그림 1)과 히드 록시 신남산 (그림 2). 곡물 및 콩과 식물에서 일반적인 히드록시벤조산은 갈릭산, p-히드록시벤조산, 2,4-디히드록시벤조산, 프로토카테추산, 바닐릭산, 시링산을 포함하며, 일반적인 히드록시신남산은 카페인, p-쿠마산, 페룰릭산, 시나프산3을 포함한다. 페놀산은 또한 지방에서 산화적 산패를 일으키는 자유 라디칼을 제거하고 생리 학적 시스템 4,5에서 라디칼로 인한 산화 스트레스를 시작하고 전파 할 수 있기 때문에 항산화 특성을 가지고 있습니다. 항산화 제로서의 중요한 생리적 역할로 인해, 그들은 최근 연구의 주제입니다. 식물성 식품의 구성 요소로 섭취하면 항산화 보호를 발휘할 수 있기 때문입니다.
곡물과 시리얼 제품은 전 세계적으로 인간과 동물을위한 주요 탄수화물 식품 공급원입니다6. 곡물에는 밀, 쌀, 옥수수 (옥수수), 보리, 트리티케일, 기장 및 수수가 포함됩니다. 그 중 옥수수가 가장 많이 활용되고 있으며, 2019/2020 년에 전 세계 사용률이 1,135.7 백만 톤으로 추정되며, 같은 기간 동안 전 세계 사용률이 757.5 백만 톤으로 추정되는 밀이 그 뒤를 잇고있습니다 7. 시리얼 식품은 탄수화물의 풍부한 원천이기 때문에 소비자에게 훌륭한 에너지 원입니다. 그들은 또한 단백질, 지방, 섬유질, 비타민 및 미네랄을 제공합니다6. 그들의 영양 가치 외에도, 곡물은 식물 화학적 항산화 제, 특히 페놀산의 좋은 원천이며, 이는 라디칼로 인한 산화 손상으로부터 생리 학적 시스템을 보호 할 수있는 잠재력을 가지고 있습니다3. 콩과 식물은 또한 영양소의 좋은 원천이며 일반적으로 곡물보다 단백질이 높습니다. 그들은 또한 비타민과 미네랄을 함유하고 있으며 다양한 음식의 준비에 사용됩니다8. 또한 콩과 식물은 페놀산, 플라보노이드, 안토시아닌, 프로안토시아니딘 9,10을 포함한 다양한 식물성 화학 항산화 물질의 좋은 공급원입니다. 곡물과 콩과 식물의 다른 품종은 다른 페놀산 조성을 가질 수 있습니다. 따라서 페놀 산화 방지제와 관련하여 잠재적 인 건강상의 이점을 알기 위해 곡물과 콩과 식물 및 그 품종의 페놀산 조성을 연구 할 필요가 있습니다.
시리얼과 콩과 식물 곡물에서 페놀 산의 양을 측정하고 항산화 활성을 결정하기 위해 많은 분석이보고되었습니다. 전체 곡물 페놀산에 대한 가장 일반적인 분석 방법은 분광 광도법 및 액체 크로마토그래피11입니다. 이 연구의 목적은 유리 가용성 페놀산 조성물을 결정하기위한 일반화 된 고압 액체 크로마토그래피 방법과 일부 전체 곡물 곡물 및 콩과 식물의 총 페놀 함량 및 항산화 능력을 결정하기위한 분광 광도 측정 방법을 입증하는 것이 었습니다.
프로토콜
1. 샘플의 종류
- 이 연구를 위해 두 개의 곡물 (예 : 듀럼 밀 및 노란 옥수수)과 세 개의 콩과 식물 (예 : Blackeye cowpea 콩, 콩 및 붉은 신장 콩)으로 구성된 다섯 개의 전체 곡물 샘플을 사용하십시오.
- 각 곡물 50g을 세 배로 분쇄하여 밀가루로 분쇄하고 커피 분쇄기를 사용하여 500 μm 체로 통과시킵니다.
- -20 °C에서 보관하십시오.
2. 시료 준비
-
건조 물질 함량의 결정 및 건조 중량 기준의 표현
참고: AOAC (2000)12의 방법에 따라 각 분말 샘플의 건조 물질 함량을 결정하십시오.- 강제 대류 오븐을 켜고 온도를 130 °C로 설정하십시오.
- 건조 건조제 (실리카 겔)를 오븐에서 30 분 내지 1 시간 동안 건조시키고 건조 된 실리카 겔을 데시케이터로 옮긴다.
- 각 샘플의 2g을 깨끗하고 미리 건조되고 칭량된 알루미늄 캔에 정확하게 칭량합니다.
- 칭량된 샘플을 강제 대류 오븐에서 1시간 동안 130°C에서 건조시켰다.
- 건조된 샘플을 데시케이터로 옮기고 주위 온도로 냉각시킨다.
- 건조되고 냉각 된 샘플의 무게를 계량하고 무게를 기록하십시오.
- 각 샘플의 건조 물질 함량을 다음과 같이 계산하십시오.
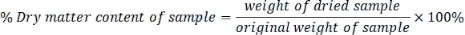
- 다음 공식을 사용하여 건조 중량 기준으로 측정된 각 파라미터를 표현합니다.

-
페놀산 추출
참고 : 밀리그램 양의 전체 곡물에서 페놀 추출을 가능하게하는 Y. Qiu et al.5 의 방법의 변형을 사용하여 곡물 샘플에서 가용성 유리 페놀 화합물을 추출하십시오.- 전체 곡물 가루 샘플 100 mg을 호박색 2 mL 용량의 마이크로 원심분리 튜브에 직접 정확하게 칭량하십시오. 튜브의 어두운 색은 혼합물이 빛에 노출되는 것을 방지하는 데 도움이됩니다.
- 1 mL의 80% 수성 HPLC 등급 메탄올을 샘플을 함유하는 각각의 튜브에 첨가한다.
- 메탄올 용액과 샘플을 혼합하기 위해 간단히 소용돌이친다.
- 샘플을 60분 동안 초음파 처리하여 유리 가용성 페놀 화합물을 추출한다. 빛으로부터의 보호를 강화하기 위해 초음파 처리 기간 동안 샘플 위에 덮개를 놓습니다.
- 초음파 처리 후, 혼합물을 20,000 × g 에서 5분 동안 원심분리하여 상층액을 상부에 남겨둔 고체 잔류물을 침전시킨다. 유리 페놀 화합물은 원심분리 후 상청액에 존재할 것이다.
- 상층액을 깨끗한 마이크로 원심분리 튜브로 옮깁니다.
참고: 상청액은 HPLC 기기에 주입하기 전에 여과해야 합니다. 상층액을 여과하려면 3 mL 주사기의 플런저를 제거하고 주사기 필터를 부착하십시오. 필터는 0.22 μm 이하의 기공 크기를 가져야 합니다. - 상청액의 약 0.4 mL를 주사기의 상부에 피펫팅한다. 플런저를 다시 넣고 필터를 통해 액체를 바이알 인서트가 들어있는 HPLC 바이알 내로 밀어 넣습니다.
- HPLC 분석을 위해 원고에 설명 된 방법을 실행하도록 장비가 설정되면 샘플 목록과 일치하도록 바이알을 회전 목마에로드하십시오.
- 320 nm 및 280 nm에서 상이한 페놀 화합물을 나타내는 뚜렷한 피크를 나타내는 HPLC 크로마토그램을 얻는다.
- 적절한 표준 곡선을 사용하여 하이드록시신남산이 이 파장에서 최대 흡광도를 갖기 때문에 320nm에서 정량화합니다. 동일한 원리에 의해, 280 nm에서 히드록시벤조산을 정량화한다.
- 나머지 추출물을 다른 분석을 위해 -20°C에서 보관한다.
3. 페놀 성분
- 고압 액체 크로마토 그래프 (물질 표)를 사용하여 J. Xiang, F. .B. Apea-Bah, V. U. Ndolo, M.C. Katundu 및 T. Beta 4의 방법에 따라 샘플에서 추출 된 페놀 화합물을 확인하고 정량하십시오.
- 페놀산 표준물질(바닐산, 카페산, 파라쿠마르산, 페룰산, 시냅산)을 준비하여 추출물의 구성 페놀 화합물을 확인하고 정량합니다.
- 이렇게하려면 각 표준의 1mg을 무게고 50 % 수성 메탄올 1 mL에 용해시켜 각 표준의 1,000 μg / mL를 생산하십시오.
- 2mL 호박색 원심분리 튜브에 다섯 가지 표준 모두를 동일한 부피로 혼합하여 각각 200μg/mL의 농도를 갖는 표준 칵테일을 생산합니다.
- 부피를 새로운 튜브로 취하고 동일한 부피의 메탄올 용매로 희석하여 표준 칵테일의 연속 희석물을 준비하십시오.
- 연속 희석을 3.125 μg / mL의 농도로 반복하십시오.
- 또한 각 표준을 용매로 40 번 별도로 희석하여 각 표준의 25 μg / mL 농도를 얻습니다.
- 컬럼 온도를 35°C로 설정하고 샘플 오븐 온도를 15°C로 설정합니다.
- 이동상 A(0.1% 수성 포름산)를 준비하기 위해, 포름산 1 mL를 1 L 용량 용적 플라스크에 옮기고 HPLC 등급 물을 1 L 마크에 첨가한다. 잘 흔들어 섞으십시오.
- 이동상 B(메탄올 중 0.1% 포름산)를 준비하기 위해, 포름산 1 mL를 1 L 용량 부피 플라스크에 옮기고 HPLC 등급 메탄올을 1 L 마크에 첨가한다. 잘 흔들어 섞으십시오.
- 필요한 경우 볼륨을 1L 표시로 조정합니다.
- 두 이동상을 모두 0.45 μm 친수성 여과지를 통해 여과한다.
- 분석을 위해 각 추출물 또는 표준 (25 μg / mL 표준 및 표준 칵테일) 10 μL를 역상 컬럼에 주입하십시오.
- 25분 동안 실행된 선형 구배 프로그램에 따라 이동상을 다음과 같이 에루트한다: 0-3.81 분, 9%-14% B; 3.81-4.85 분, 14 % -15 % B; 4.85-5.89 분, 15 % -15 % B, 5.89-8.32 분, 15 % -17 % B; 8.32-9.71 분, 17 % -19 % B; 9.71-10.40 분, 19 % -19 % B; 10.40-12.48 분, 19 % -26 % B; 12.48-13.17 분, 16 % -28 % B; 13.17-14.21 분, 28 % -35 % B; 14.21-15.95 분, 35 % -40 % B; 15.95-16.64 분, 40 % -48 % B; 16.64-18.37 분, 48 % -53 % B; 18.37-22.53 분, 53 % -70 % B; 22.53-22.88 분, 70 % -90 % B; 22.88-25.00 분, 90 % B.
- 샘플에서 구성 페놀 화합물을 확인하기 위해 280nm 및 320nm에서 농도 25 μg / mL의 확실한 표준에 대해 얻은 크로마토 그래피 피크의 보유 시간을 추출물의 보유 시간과 비교하십시오.
- 페놀산 표준 칵테일에 대한 보정 곡선을 플롯하고, 수평축에 표준의 농도와 세로축의 피크 면적을 표시합니다.
- 보정 곡선을 사용하여 이전 섹션에서 언급한 바와 같이 플롯의 피크 면적을 280nm 및 320nm에서 확인된 화합물의 피크 영역과 비교하여 확인된 페놀 화합물의 농도를 추정합니다.
4. 총 페놀 함량
참고: F.B. Apea-Bah et al.13에 의해 기재된 Folin-Ciocalteu 방법을 사용하여 추출물의 총 페놀 함량을 결정한다.
- 0.025 ~ 0.150 mg/mL의 농도 범위 내에서 페룰산 및 갈산 표준을 준비하여 총 페놀 함량의 추정을 위해 비교 보정 곡선을 플로팅합니다.
- 이를 위해 페룰산 및 갈산 표준물질 각각 1mg을 2mL 용량의 원심분리 튜브에 넣고 정확하게 칭량합니다.
- 각 표준에 50% 수성 메탄올 1mL를 넣고 와류하여 용해시켜 각 표준의 1mg/mL 스톡을 생성합니다.
- 총 500 μL의 각 원액으로부터 일련의 희석물을 준비한다.
- 18.2 μL의 각 추출물 또는 표준물질을 96-웰 마이크로플레이트 상에 별도의 웰에 넣었다.
- 36.4 μL의 10% (v/v) 수성 폴린-시오칼트 시약을 각 추출물 또는 표준에 첨가한다.
- 이어서, 145.4 μL의 700 mM 탄산나트륨을 각각의 반응 혼합물에 첨가한다.
- 반응 혼합물을 실온 (20-25°C)에서 2 h 동안 어둠 속에서 인큐베이션한다.
- 750nm에서 마이크로플레이트 판독기에서 흡광도를 판독한다.
- 페놀산 표준물질의 농도에 대한 흡광도 변화의 보정 곡선을 플롯하고 이를 사용하여 총 페놀 함량을 추정합니다.
- 결과를 분쇄 된 샘플의 그램 당 밀리그램 페룰산 당량 (mg FAE / g) 및 분쇄 된 샘플 그램 당 밀리그램 갈산 당량 (mg GAE / g)으로 건조 중량 기준으로 표현하십시오.
5. 항산화 분석
참고: 다음 세 가지 분석을 사용하여 곡물 추출물의 항산화 능력을 결정하십시오 : 2,2-디페닐-1-피크릴 히드라질 (DPPH) 라디칼 소거능; 2,2'-아지노-비스(3-에틸벤조티아졸린-6-설폰산(ABTS) 라디칼 소거능, 이는 트롤록스 등가 산화방지능(TEAC)이라고도 불린다; and oxygen radical 흡광도 용량(ORAC).
- 표준 곡선에 대한 트롤록스 표준 준비
- 비타민 E의 수용성 유사체인 트롤록스를 표준으로 사용하여 전체 곡물 추출물의 시험관 내 항산화 능력을 추정하십시오.
- 트롤록스 1mg을 15mL 튜브에 정확하게 칭량합니다. 4 mL의 50% 수성 메탄올에 용해시킨다. 소용돌이를 용해시켜 1 mM (1000 μM)의 원액을 제조하였다.
- 6개의 농도의 트롤록스, 즉 50, 100, 200, 400, 600 및 800 μM을 준비하여 DPPH 라디칼 소거능 및 트롤록스 등가 항산화 용량(TEAC)의 추정을 위한 표준 곡선을 플롯한다. 유사하게, 산소 라디칼 흡광도 용량 (ORAC)을 추정하기 위해 6.25, 12.5, 25 및 50 μM 농도의 Trolox를 준비한다. 표 1에 나타낸 바와 같이 각 농도의 총 부피를 500 μL로 구성한다.
- 샘플 추출물의 희석
- 분석 전에 샘플 추출물을 메탄올로 희석하십시오. 여기서, 황색 옥수수와 카우완 추출물은 두 번 희석하였고, 밀과 강낭콩은 다섯 번 희석하였고, 대두 추출물은 메탄올로 10회 희석하였다.
- 트롤록스 등가 항산화 능력 (TEAC) 분석
- F.B. Apea-Bah et al.14에 의해 이전에 기술된 방법을 사용하여 샘플의 Trolox 등가 항산화 능력(TEAC)을 측정한다.
- 8.23 mg의 ABTS를 깨끗한 2 mL 용량의 호박색 원심분리 튜브에 넣고 무게를 재십시오.
- 다음으로, 과황산칼륨 1.62 mg을 또 다른 깨끗한 2 mL 용량의 호박색 원심분리 튜브에 넣는다.
- 각각에 증류수 1 mL를 넣고 와류하여 용해시킵니다.
참고: 이로 인해 6 mM 과황산칼륨 수용액이 있는 16 mM ABTS 원액이 생성됩니다. - ABTS 및 과황산칼륨 용액을 동일한 부피로 혼합하여 ABTS 원액을 제조하였다. 솔루션은 즉시 어두운 색으로 바뀝니다.
- 시약 혼합물을 어둠 속에서 12-16 h 동안 인큐베이션한다.
- ABTS 원액을 200 mM 인산완충식염수(PBS)로 30배 희석하여, ABTS 작동용액을 형성하였다. 이를 위해, 58 mL의 200 mM PBS를 2 mL의 ABTS 원액에 첨가한다. 작업 용액은 0.27 mM ABTS 및 0.1 mM 과황산칼륨을 함유한다.
- 분석을 위해, 희석된 각 추출물 또는 트롤록스 10 μL를 96-웰 마이크로플레이트에 넣는다.
- 190 μL의 ABTS 작동 용액을 각 웰에 첨가하고, 반응 혼합물을 60분 동안 인큐베이션한다.
- 마이크로플레이트 판독기에서 750 nm에서 반응 혼합물의 흡광도를 측정하였다.
- 100 ~ 800 μmol/L 범위의 농도에서 Trolox 표준을 사용하여 보정 곡선을 플로팅하십시오.
- 보정 곡선으로부터 ABTS 라디칼 소거능을 추정한다.
- 그 결과를 건조 중량 기준으로 그램 당 마이크로몰 트롤록스 당량(μmol TE/g) 샘플로 표현한다.
- DPPH 분석
참고: F.B. Apea-Bah et al.13에 의해 이전에 기술된 방법을 사용하여 샘플의 DPPH 라디칼 소거능을 결정한다. DPPH 항산화제 분석은 라디칼 생성 화합물인 DPPH(2,2-디페닐-1-피크릴히드라질)를 필요로 한다.- DPPH 1.2 mg을 빈 50 mL 용량의 원심분리 튜브에 정확하게 칭량하십시오. DPPH를 메탄올 30 mL에 녹여 60 μmol/L 메탄올 용액을 제조하였다.
참고: DPPH 분석은 DPPH에 의해 생성된 자유 라디칼을 제거하는 샘플 추출물의 능력을 시험한다. - 분석을 위해, 5 μL의 샘플 추출물 또는 트롤록스 용액을 마이크로플레이트 웰에 첨가한다.
- 다음으로, 60 μmol/L DPPH 메탄올 용액 중 195 μL를 첨가하고, 60분 동안 인큐베이션한다.
- 515 nm에서 반응 혼합물의 흡광도를 측정하였다.
- Trolox 표준(50-800 μmol/L)을 사용하여 수직축의 흡광도 변화와 수평축의 Trolox 농도에 따른 보정 곡선을 플로팅합니다.
- 보정 곡선에서 DPPH 청소 용량을 추정합니다.
- 그 결과를 건조 중량 기준으로 그램 당 마이크로몰 트롤록스 당량(μmol TE/g) 샘플로 표현한다.
- DPPH 1.2 mg을 빈 50 mL 용량의 원심분리 튜브에 정확하게 칭량하십시오. DPPH를 메탄올 30 mL에 녹여 60 μmol/L 메탄올 용액을 제조하였다.
- 산소 라디칼 흡광도 용량
- F.B. Apea-Bah et al.13의 방법에 기초하여 샘플의 산소 라디칼 흡광도 용량 (ORAC)을 결정한다.
- 시작하려면, 75 mM 인산칼륨 (K2HPO4/KH2PO4) 완충액 중의 1,000 μM 트롤록스 표준 원액으로부터 농도 6.25, 12.5,25및 50 μM의 트롤록스 표준을 준비한다.
- 이렇게 트롤록스 분말 1 mg을 칭량하고 초음파 처리 하에 완충용액 4 mL에 용해시켜 1,000 μM 원액을 제조하였다.
- 그 후, 원액 50 μL를 취하여 2 mL 용량의 원심분리 튜브에 넣고 950 μL의 완충용액으로 희석하여 50 μM 트롤록스 용액 1,000 μL를 얻었다.
- 50 μM 용액 중 500 μL를 새로운 튜브에 넣고 동량의 완충액으로 희석하여 25 μM 트롤록스 용액을 얻었다.
- 25 μM의 연속 희석을 반복하여 12.5 μM을 얻은 다음, 마찬가지로 12.5 μM의 희석을 반복하여 6.25 μM을 얻었다.
- 샘플 추출물의 적절한 희석액을 준비하십시오.
- 노란 옥수수와 카우완 추출물을 20배, 밀과 강낭콩 추출물을 50배, 대두 추출물을 완충용액으로 100배 희석한다.
- 자동 피펫팅을 위해 각 샘플 또는 Trolox 표준의 200μL를 검은색 96웰 마이크로플레이트의 웰로 옮깁니다.
- 이어서, ORAC 장비와 함께 제공된 세 개의 시약 탱크를 다음과 같이 채운다: (1) 완충 용액; (2) 완충제 중의 0.816 nM 플루오레세인; 및 (3) 완충제 중의 153 mM의 2,2'-아조비스(2-아미디노프로판) 디히드로클로라이드 (AAPH).
- 자동 피펫팅을 위해 콘센트에 넣으십시오.
- 표준 작동 절차에 따라 분석을 위해 ORAC 기계 및 자동 피펫팅 시스템을 설정하십시오.
- 분석을 위해, 각각의 희석된 추출물 또는 표준의 25 μL를 투명한 바닥 검정 96-웰 마이크로플레이트의 웰로 옮기도록 자동화된 피펫팅 시스템을 설정한다.
- 이어서, 150 μL의 0.816 nM 플루오레세인을 완충액에 자동으로 첨가한다.
- 반응 혼합물을 ORAC 기계에서 15분 동안 37°C에서 인큐베이션한다.
- 그 후, 25 μL의 AAPH를 각 반응 혼합물에 자동으로 첨가한다.
- 이들을 ORAC 기계에서 50분 동안 37°C에서 인큐베이션한다.
- ORAC 기계를 설치하여 인큐베이션 기간 동안 각각 485nm 및 520nm의 여기 및 방출 파장에서 형광 붕괴를 측정하십시오.
- 측정 후, 수평축에 Trolox (6.25-50 μM)와 수직축에 형광 붕괴를 사용하여 Trolox 표준 곡선을 플로팅합니다.
- Trolox 표준 곡선으로부터 추출물의 산소 라디칼 흡광도 용량을 추정한다.
- 건조 중량 기준으로 μmol TE/g 샘플로 결과를 표현합니다.
- 통계 분석
- 모든 결과를 적어도 삼중±의 표준 편차를 의미하는 것으로 제시한다.
- 분산 분석(ANOVA)을 수행하여 그레인 유형이 반응 변수에 미치는 영향을 결정합니다.
- p < 0.05에 유의한 차이가 존재하는 경우, 최하위 차이(LSD)를 사용하여 평균을 비교하십시오.
- Pearson 상관 분석을 수행하여 페놀 함량과 항산화 용량 간의 관계를 추정합니다.
결과
표 2는 곡류 및 콩과 식물 곡물에서 확인된 페놀산을 나타낸다. 사용 가능한 확실한 표준에 따라 샘플에서 네 개의 페놀산이 확인되었으며 바닐릭, 카페인, p-쿠마르산 및 페룰산입니다. 바닐산은 히드록시벤조산이고 다른 세 가지는 히드록시신남산이다. 바닐산은 Blackeye cowpea 콩에서만 확인되었으며 카페산은 신장 콩에서만 확인되었습니다. p-Coumaric acid는 노란 옥수수, ?...
토론
전체 곡물은 전 세계적으로 광범위한 식품 응용 분야를 찾는 대표적인 시리얼 곡물과 콩과 식물로 선정되었습니다. 각 곡물의 품종 간에는 변형이 존재할 수 있지만,이 연구의 초점은 전체 곡물에 대한 유리 페놀산 추출 및 분석을위한 일반화 된 방법을 입증하는 것이 었습니다. 추출 방법은 그러한 실험이 수행될 때 환경으로 방출될 화학물질의 양을 감소시키기 위해 샘플 및 용매의 양을 실질적...
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
저자는 Alison Ser와 Hannah Oduro-Obeng의 기술 지원과 Janice Fajardo와 Miguel del Rosario의 비디오 편집 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 15 mL Falcon conical centrifuge tubes | Fisher Scientific | 05-527-90 | |
| 2 mL Amber glass ID Surestop vial | Thermo Scientific | C5000-2W | |
| 2 mL Amber microcentrifuge tubes | VWR | 20170-084 | |
| 2,2′-Azobis(2-amidinopropane) dihydrochloride (AAPH) | Sigma-Aldrich | 440914-100G | |
| 2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) (C18H18N4O6S4) ≥98%, | Sigma Aldrich | A1888-2G | |
| 2,2-Diphenyl-1pikrylhydrazyl (DPPH) (C18H12N5O6) | Sigma Aldrich | D913-2 | |
| 6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid (Trolox) (C14H18O4), ≥98% | Fluka Chemika | 56510 | |
| 9 mm Autosampler Vial Screw Thread Caps | Thermo Scientific | 60180-670 | |
| 96 well flat bottom plates | Fisher Scientific | 12565501 | |
| Agilent BioTek ELx800 microplate reader | Fisher Scientific | BT-ELX800NB | |
| Agilent BioTek Precision 2000 96/384 Automated Microplate Pipetting System | Fisher Scientific | N/A | |
| Agilent BioTek FLx800 Microplate Fluorescence Reader | Fisher Scientific | N/A | |
| Analytical balance SI-114 | Denver Instrument | SI-114.1 | |
| Autosampler, Waters 717 Plus | Waters | WAT078900 | |
| BD 3 mL syringe Luer-Lok Tip | BD | 309657 | |
| Bransonic ultrasonic cleaner, Branson 5510 | Millipore Sigma | Z245143 | |
| Corning LSE Vortex Mixer | Corning | 6775 | |
| Durapore Filter (0.45 µm PVDF Membrane) | Merck Millipore Ltd | HVLP04700 | |
| Durapore Membrane Filters (0.45 µm HV) | Merck Millipore Ltd | HVHP04700 | |
| Eppendorf Research plus, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research plus, 0.5-5 mL | Eppendorf | 3123000071 | |
| Eppendorf Research plus, 100-1000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research plus, 10-100 µL | Eppendorf | 3123000047 | |
| Ethyl acetate, HPLC grade | Fisher Chemical | E195-4 | |
| Ferulic acid standard | Sigma Aldrich | 128708-5G | |
| Fluorescein | Fisher Scientific | AC119245000 | |
| Folin & Ciocalteu phenol reagent | Sigma Aldrich | F9252 | |
| Formic acid, 99% | Acros Organics, Janssen Pharmaceuticalaan 3a | 27048-0010 | |
| Gallic acid standard | Sigma | G7384 | |
| High performance liquid chromatograph (HPLC), Waters 2695 | Waters | 960402 | |
| Methanol, HPLC grade | Fisher Chemical | A452-4 | |
| Micro pipet tips, 0.5-10 µL | Fisherbrand | 21-197-2F | |
| Microcentrifuge Sorvall Legend Micro 21 centrifuge | Thermo Scientific | 75002435 | |
| Multichannel micropipette, Proline Plus, 30-300 µL | Sartorius | 728240 | |
| Photodiode array detector, Waters 2996 | Waters | 720000350EN | |
| Pipet tips, 1000 µL | VWR | 83007-382 | |
| Pipet tips, 1-5 mL | VWR | 82018-840 | |
| Potassium persulfate (K2S2O8), ≥99.0% | Sigma Aldrich | 216224-100G | |
| Potassium phosphate dibasic anhydrous (K2HPO4) | Fisher Scientific | P288-500 | |
| Potassium phosphate monobasic (KH2PO4) | Fisher Scientific | P285-500 | |
| PYREX 250 mL Short Neck Boiling Flask, Round Bottom | Corning | 4321-250 | |
| Reversed phase C18 Analytical Column (100 x 3 mm) Accucore aQ | Thermo Scientific | 17326-103030 | |
| Roto evaporator, IKA RV 10 | IKA | 0010005185 | |
| Sodium carbonate (NaCO3) anhydrous | Fisher Chemical | S263-1 | |
| Sodium chloride (NaCl) | Mallinckrodt AR® | 7581 | |
| Sodium phosphate dibasic anhydrous (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Sodium phosphate monobasic anhydrous (NaH2PO4) | Fisher bioreagents | BP329-500 | |
| Standardization pipet tips 0-200µL | Fisherbrand | 02-681-134 | |
| Syringe Driven Filter unit (0.22 µm) | Millex®-GV | SLGVR04NL | |
| Target micro-serts vial insert (400 µL) | Thermo Scientific | C4011-631 | |
| Ultrapure water (Direct Q-3 UV system with pump) | Millipore | ZRQSVP030 |
참고문헌
- Huitu, O., et al. Silicon, endophytes and secondary metabolites as grass defenses against mammalian herbivores. Frontiers in Plant Science. 5, 478 (2014).
- Joshi, J. R., Burdman, S., Lipsky, A., Yariv, S., Yedidia, I. Plant phenolic acids affect the virulence of Pectobacterium aroidearum and P. carotovorum ssp. brasiliense via quorum sensing regulation. Molecular Plant Pathology. 17 (4), 487-500 (2016).
- Dykes, L., Rooney, L. W. Phenolic compounds in cereal grains and their health benefits. Cereal Foods World. 52 (3), 105-111 (2007).
- Xiang, J., Apea-Bah, F. B., Ndolo, V. U., Katundu, M. C., Beta, T. Profile of phenolic compounds and antioxidant activity of finger millet varieties. Food Chemistry. 275, 361-368 (2019).
- Qiu, Y., Liu, Q., Beta, T. Antioxidant properties of commercial wild rice and analysis of soluble and insoluble phenolic acids. Food Chemistry. 121 (1), 140-147 (2010).
- Beverly, R. L., Motarjemi, Y. . Encyclopedia of Food Safety. 3, 309-314 (2014).
- FAO. Food Outlook - Biannual report on global food markets. Food and Agriculture Organization. , (2020).
- Erbersdobler, H. F., Barth, C. A., Jahreis, G. Legumes in human nutrition. Nutrient content and protein quality of pulses. Ernahrungs Umschau. 64 (9), 134-139 (2017).
- Dueñas, M., Hernández, T., Estrella, I. Assessment of in vitro antioxidant capacity of the seed coat and the cotyledon of legumes in relation to their phenolic contents. Food Chemistry. 98 (1), 95-103 (2006).
- Khang, D. T., Dung, T. N., Elzaawely, A. A., Xuan, T. D. Phenolic profiles and antioxidant activity of germinated legumes. Foods. 5 (2), 27 (2016).
- Hefni, M. E., Amann, L. S., Witthöft, C. M. A HPLC-UV method for the quantification of phenolic acids in cereals. Food Analytical Methods. 12 (12), 2802-2812 (2019).
- AOAC. . Official Methods of Analysis. 17th edn. , (2000).
- Apea-Bah, F. B., Head, D., Scales, R., Bazylo, R., Beta, T. Hydrothermal extraction, a promising method for concentrating phenolic antioxidants from red osier dogwood (Cornus stolonifer) leaves and stems. Heliyon. 6 (10), 05158 (2020).
- Apea-Bah, F. B., Minnaar, A., Bester, M. J., Duodu, K. G. Sorghum-cowpea composite porridge as a functional food, Part II: Antioxidant properties as affected by simulated in vitro gastrointestinal digestion. Food Chemistry. 197, 307-315 (2016).
- Robbins, R. J., Bean, S. R. Development of a quantitative high-performance liquid chromatography-photodiode array detection measurement system for phenolic acids. Journal of Chromatography A. 1038 (1-2), 97-105 (2004).
- Singleton, V. L., Rossi, J. A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. 16, 144-158 (1965).
- Prior, R. L., Wu, X., Schaich, K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal of Agricultural and Food Chemistry. 53 (10), 4290-4302 (2005).
- Ainsworth, E. A., Gillespie, K. M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent. Nature Protocols. 2 (4), 875-877 (2007).
- Waterhouse, A. L. Determination of total phenolics. Current Protocols in Food Analytical Chemistry. 1, 1-8 (2002).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. Journal of Agricultural and Food Chemistry. 53 (6), 1841-1856 (2005).
- Esterbauer, H., Wäg, G., Puhl, H. Lipid peroxidation and its role in atherosclerosis. British Medical Bulletin. 49 (3), 566-576 (1993).
- Esterbauer, H., Gebicki, J., Puhl, H., Jürgens, G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL. Free Radical Biology and Medicine. 13 (4), 341-390 (1992).
- Apea-Bah, F. B., Serem, J. C., Bester, M. J., Duodu, K. G. Phenolic composition and antioxidant properties of Koose, a deep-fat fried cowpea cake. Food Chemistry. 237, 247-256 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유