Method Article
Kinetx:流式细胞术检测和分析软件框架,用于实时定量测量和分类血小板活化。
摘要
血小板对一系列刺激反应迅速。本文介绍了一种基于实时流式细胞术的血小板功能测定和新开发的定制开源软件 (Kinetx),用于对血小板颗粒释放、纤维蛋白原结合和细胞内钙通量进行定量动力学测量。
摘要
血小板对血管损伤反应迅速,并在一系列刺激下被激活以限制失血。许多血小板功能测试测量定义时间段后的终点反应,而不是血小板活化率。然而,血小板将细胞外刺激转化为功能反应的速率是决定它们对损伤的反应、与形成的血栓结合以及发出募集其他血小板信号的效率的重要因素。本文描述了一种基于流式细胞术的血小板功能测定,该测定能够同时进行数据采集和样品刺激,并利用新开发的定制开源软件 (Kinetx) 来定量测量血小板颗粒释放、纤维蛋白原结合和细胞内钙通量。Kinetix 的开发目的是让用户可以更改参数,例如平滑度、外围数据点的识别或时间尺度。为了帮助不熟悉 R 环境的用户,可以通过单个命令对数据进行 Kinetix 分析。 总之,这允许准确、可重复地测量和分类实时血小板活化指标,例如速率、加速度、达到峰值速率的时间、达到峰值钙的时间和定性的形状变化。血小板活化的动力学测量可以深入了解血小板在活化第一阶段的行为,并可能提供一种预测血小板募集到形成血栓中的方法。
引言
血小板在止血中起着核心作用,并对血管损伤产生快速和多方面的反应 1,2。目前的血小板功能测试测量血小板反应性的各个方面,代表它们在体内的止血作用。传统上,血小板功能是使用终点测定法来评估的,这些终点测定法测量刺激足够长的时间以达到最大活化的血小板中的纤维蛋白原结合、颗粒释放或血小板聚集 3,4。这些测试没有考虑血小板将细胞外刺激转化为细胞内信号和钙通量,随后脱颗粒并与生长的血栓结合所需的时间。血液在静脉中以高达 20 dynes/cm3 的剪切速率流动,在大动脉中以高达 80 dynes/cm3 的剪切速率流动5,强调血小板需要通过检测、处理和响应细胞外刺激来抵消这种快速流动速率,以结合成形成的血栓并支持其持续生长。
血小板活化的速率可以独立于血小板活化的最大程度而变化。整合素连接激酶 (ILK) 是一种参与调节血小板中 β1 和 β3 整合素的蛋白质 6,7。体内 ILK 的抑制或特异性缺失表明,在没有功能性 ILK 的情况下,血小板活化的速率(而不是最大程度)受到影响8。在缺乏 CALDAG GEFI 9,10 的小鼠中还发现了聚集速率和最大聚集水平之间的差异,CALDAG GEFI 9,10 是一种通过 RAP111 参与调节由内而外信号的信号分子。
这些发现表明,血小板速率和最大活化水平可以是自主的,并且最大活化的测量值可能无法描述到目前为止的血小板行为。血小板被激活所需时间的这些差异可能会深刻影响它们与生长血栓的初始结合,从而影响血栓的结构和整体大小。血小板速率和最大活化之间的这些变化突出表明需要一种检测方法来准确测量血小板活化速率,并可用于检测群体内的差异。
本文介绍了一种准确实时测量血小板活化和钙通量并计算一系列指标的方法,包括血小板被激活的速率以及血小板达到最大活化速率和最大钙通量所需的时间。血小板活化的这些动力学测量可以更好地了解血小板在血栓形成第一阶段的行为,并提供了一种预测血小板被募集到形成血栓中的速度的方法。
研究方案
该方案使用来自健康供体的人类全血和血小板,没有潜在的健康状况,并且在书面知情同意后没有服用任何已知会干扰血小板功能的药物,并获得了雷丁大学研究伦理委员会的批准。
1. 血液采集和制备富血小板血浆
- 在含有 3.2% 柠檬酸钠的真空采血管中收集外周血
- 丢弃前 3 mL。
- 离心前让血液在 30 °C 静置 30 分钟。
- 通过在室温下以 140 x g 离心 20 分钟制备富血小板血浆 (PRP),然后在 37 °C 下孵育测定持续时间,在离心后 60 分钟内完成。
2. 仪器准备
注意:非加压流路系统对于实时流式细胞术至关重要,因为在流式细胞仪记录事件时会同时刺激血小板。
- 使用非加压流式细胞仪进行实时流式细胞术。
- 要在 37 °C 下进行测定,请将小鼠解剖垫连接到载物台上以放置 96 孔板。在测定期间将垫子加热至 37 °C。
- 将 96 孔板放在加热垫的顶部,以便在 37 °C 下连续孵育(图 1)
3. 检测准备
- 纤维蛋白原结合和 P-选择素表达
- 在聚丙烯 96 孔圆底、未经处理的微量滴定板中涂有 5% 牛血清白蛋白 (BSA) 的 Hepes 缓冲盐水(HBS;10 mM Hepes pH 7.4;150 mM NaCl、5 mM KCl、1 mM MgSO4·7H20)在 4°C 下过夜。
- 在含有 5 mM 葡萄糖 (HBS-G) 的 HBS 中制备抗体混合物。将异硫氰酸荧光素 (FITC) 标记的抗纤维蛋白原抗体(FITC-FGN;稀释度 1:37.5 (v/v))和别藻蓝蛋白 (APC) 标记的抗 P-选择素(APC-CD62P;稀释度 1:37.5 (v/v))添加到 HBS-G(终体积:225 μL)中,并在 37 °C 的 96 孔板中孵育。
- 在收集事件之前,将 PRP 以 1:600 (v/v) 的稀释度添加到 HBS-G 抗体混合物中。
注:需要少量的 PRP 以确保不超过事件限值并减少样品中的血小板聚集。在初步研究中检查了血小板稀释度,并且不会影响活化率。 - 在37°C下孵育含有FITC-FGN(稀释度1:37.5(v / v))和APC-CD62P(稀释度1:37.5(v / v))和激动剂的活化混合物。 激动剂包括 Gly-Pro-Arg-Pro 肽 (GPRP;1.18 mM)、交联胶原蛋白相关肽 (CRP-XL;0.004-10 μg/mL)、二磷酸腺苷 (ADP;0.04-4 μM)、肾上腺素 (epi;20-200 μM)、9,11-二脱氧-11α,9α-环氧甲烷前列腺素 F2α (U46619;0.02-5 μM) 和凝血酶受体激活肽 6 (TRAP-6;0.04-10 μM)。
- 钙通量
注:该测定是使用市售钙测定试剂盒进行的(材料表)- 在 4 °C 下用 5% BSA 的 Hepes 缓冲盐水包被聚丙烯 96 孔圆底、未经处理的微量滴定板过夜。
- 要制备钙测定染料,将 100 mL 钙测定缓冲液和 2 mL 丙磺舒储备溶液 (250 mM) 添加到一瓶钙试剂中,以获得 2x 钙试剂加载溶液。
- 为了制备 Fluo-4/HBS-G,用 HBS-G 以 1:1 的比例稀释钙测定染料,通过 0.22 μM 过滤器过滤。在 37 °C 下将 225 μL Fluo-4/HBS-G 添加到 96 孔板的相应孔中。
- 将 PRP 在 37 °C 下以 1:1 稀释度与 Fluo-4/HBS-G 孵育 30 分钟。
- 在 Fluo-4/HBS-G 中制备活化混合物并在 37 °C 下孵育。 激动剂包括 GPRP 存在下的凝血酶 (1 U/mL)、CRP-XL (0.5 μg/mL)、ADP (1 μM)、肾上腺素 (20 μM)、U46619 (1 μM) 和 TRAP-6 (1 μM)。
- 在收集事件之前,立即将 PRP/Fluo-4/HBS-G 添加到 225 μL Fluo-4/HBS-G 混合物中,最终 PRP 稀释度(添加激动剂后)为 1:600(v/v;0.5 mL,最终体积为 300 mL)。
4. 检测程序和数据收集
- 将流式细胞仪设置为“慢速”流速,平均每秒 1000 个事件数 (eps),最大 3000 eps。将阈值设置为 20000 以避免记录细胞碎片。
- 使用前向散射 (FSC) 和侧向散射 (SSC) 图对血小板群进行门控。对于数据收集,绘制 FSC-A 与 SSC-A 的关系图以准确设控血小板群,绘制 FL1 或 FL4 与时间的关系图,以记录随时间变化的荧光事件。
- 流式细胞仪需要 14 秒才能开始记录事件;在此之后,让仪器再记录每个孔中的事件 5 秒,然后使用凝胶加载尖端快速添加 75 μL 活化混合物以确保自发混合(图 1)。
- 收集事件 5 分钟并设置图以记录 488(FL1;533/30 过滤器 - FITC-纤维蛋白原/FLUO-4)通道与时间和 633(FL4;675/25 过滤器 - APC-P-选择素)通道与时间的关系。
- 将每个孔中 488 和 633 通道的绘图数据保存为 CSV 文件。
5. 数据分析
- 下载最新版本的 Kinetx12。
注意:下载内容包括分析生成的数据所需的所有代码,并附有来自十个供体的实验数据测试集和他们分析生成的输出(这些结果可以通过以下程序重新生成和验证)(图 2)。 - 设置 R 环境
- 通过 RStudio 环境使用编程语言 R。安装 R13、RStudio14 和以下软件包:ggplot2、dplyr、plotrix、minpack.lm、tidyverse、psych。确保已成功安装所有必备软件包。
- 创建元数据:将文本文件(称为 wellData.txt)放在与数据相同的目录中。它描述了激动剂、它们的浓度、任何抗体以及用于生成每个 CSV 文件的检测方法(功能或钙)。
- 将第二个文本文件 ('IsotypeData.txt') 放在同一目录中并定义同种型。下载中提供的文件('data/wellData.txt' 和 'data/IsotypeData.txt') 可以用作模板,很容易适应其他激动剂、抑制剂和浓度。
- 分析数据:Kinetx 包含步骤 5.2.5-5.2.7 中定义的三个功能。
- kinetxProcess.R:此函数处理原始功能流式细胞术数据。要运行,请键入 kinetxProcess('数据位置','放置输出的位置','FL1'(用于 FITC 抗纤维蛋白原,或 'FL4'(用于 APC-CD62P)
- kinetxProcessCalcium.R:此函数分析和标记钙通量数据。要运行,键入 kinetxProcessCalcium('数据位置','输出位置','FL1')
- kinetxSummary.R:此函数汇总数据。要运行,键入 kinetxSummary('数据位置','输出位置','FL1')。
- 要对测试数据运行上述所有函数 (5.2.5-5.2.7),请使用脚本 (test.R).
注意:前两个函数为每个供体生成数字,显示原始数据加上拟合曲线。所有输出和汇总数据的电子表格都放置在输出位置。
结果
功能性实时流式细胞术的分析揭示了激动剂之间和供体之间激活曲线形状的差异
使用 Kinetx 对功能数据(P-选择素暴露和纤维蛋白原结合)进行数据分析,去除超出合理范围(>200000 或 <1)和 <2.80 秒(此时设置零时间)的数据点,将数据归一化为同种型的中位数并拟合平滑的移动平均曲线(通过功能黄土)。Kinetx 还根据拟合的平滑线形状、绝对值和变化率分配指标和类别,如下所示:(1) RoC - 前 120 秒平滑线的平均上升;(2) 标签 - 根据 FL1 的 40 和 80 以及 FL4 的 5 和 10 的临界值设置,将响应分为快速、中等或慢速;(3) EarlyRoC - 前 20 秒平滑线的平均上升;(4) 形状 - 低响应者,增加、线性或减少(图 3A) - 低响应者被确定为 FL1 < 4000 或 FL4 < 1000,标签增加、线性和减少的确定依据为:shapeMetric - RoC(120 秒)/EarlyRoC,其中增加 shapeMetric >2,线性 shapeMetric 在 0.9-2 之间,减少 shapeMetric <0.9;(5) 通过提供 0 s、10 s、20 s、30 s、40 s、60 s、90 s、120 s、180 s、同种型中位数、最大和最小变化率和加速度以及所有标签和类别的变化水平和速率来生成数据摘要电子表格。
在 30 名供体中分析了响应单一浓度激动剂 ADP 、 TRAP-6 、 CRP-XL 、肾上腺素和 U46617 的激活后 5 分钟内血小板纤维蛋白原结合和 P-选择素暴露。响应不同激动剂的纤维蛋白原结合和 P-选择素暴露的指标显示响应形状存在相当大的差异(图 3)。用 TRAP-6 和 ADP 刺激的血小板显示纤维蛋白原结合加速更快,对于许多供体来说,这在以后的时间点减慢了(图 3B)。响应 CRP-XL、凝血酶和肾上腺素的纤维蛋白原结合更有可能表现出增加或线性的反应率。许多供体在纤维蛋白原结合速率迅速加速之前,CRP-XL 的滞后时间相对较长。对 U46619 的反应通常被归类为低。相比之下,P-选择素暴露更有可能表现出对所有激动剂的线性或增加的反应率,但 U46619 再次显示出低反应水平(图 3C)。
血小板活化过程中的细胞内钙通量可以使用实时流式细胞术准确测量
钙通量测定的数据分析去除了超出合理范围的数据点(< 2.80 秒零时间设置为该点),然后拟合平滑的移动平均曲线(通过函数黄土)。Kinetx 分配指标,并根据拟合的平滑线形状、绝对值和变化率分配类别,如下所示:(1) 类别 - 根据早期上升、最大值和从最大值的最终下降来描述钙反应的形状,描述为线性、峰值或持续(图 4A);(2) 速率 - 描述快速 30 秒内的变化率,定义为无变化、慢速、中等变化或快速(在 10、40 和 80 处截止)。Kinetx 还通过提供 0 s、10 s、20 s、30 s、40 s、60 s、90 s、120 s、180 s 的变化水平和速率、最大和最小变化速率和加速度以及所有标签和类别来生成一个电子表格,并为每个供体生成数据图。通过这种方法在 30 个个体中测量的钙通量示例再次显示个体和激动剂之间的激活模式不同(图 4B)。CRP-XL 主要提供持续的钙反应,而对 TRAP-6 的反应最常表现出峰值反应。所有其他激动剂产生主要线性反应。
实时流式细胞术可识别响应不同激动剂和浓度的最大激活水平的差异
结果表明,实时流式细胞术测定能够检测纤维蛋白原结合(图 5A)和 P-选择素暴露(图 5D)的最大水平差异,以响应通过不同受体的刺激(10 μg/mL CRP-XL 与 3 U/mL 凝血酶 P < 0.001;10 μg/mL CRP-XL 与 1 U/mL 凝血酶 P < 0.001)。他们还表明,该测定对激动剂浓度的差异很敏感,其中最大纤维蛋白原结合和 P-选择素暴露的水平随着激动剂浓度的增加而增加(纤维蛋白原结合 - CRP-XL - 0.004 μg/mL vs. 0.4、5、10 μg/ mL,P < 0.01;凝血酶 - 0.0012 U/mL vs. 1 和 3 U/mL, P < 0.01;ADP - 0.04 μg/mL vs. 1 和 4 μM,P < 0.05)。
实时流式细胞术检测足够灵敏,可以检测供体之间血小板活化率的差异
通过将平滑移动平均值 (黄土) 拟合到荧光数据,然后使用它来计算纤维蛋白原结合和 P-选择素暴露的最大速率来确定血小板活化的最大速率(图 5B,E)。数据表明个体供体之间存在相当大的差异,流式细胞术测定足够灵敏,可以检测到这种变化。结果表明,增加激动剂浓度对纤维蛋白原结合的最大速率几乎没有影响(图 5B)。相比之下,P-选择素暴露的最大速率随着凝血酶和 CRP-XL 浓度的增加而增加,但不随着 ADP 浓度的增加而增加(图 5E)。
使用实时流式细胞术可以检测血小板活化滞后时间的变化
通过计算达到纤维蛋白原结合和 P-选择素暴露的最大速率的时间点来确定达到血小板活化最大速率的时间(图 5C,F)。纤维蛋白原结合和 P 选择素暴露的最大速率因供体而异,尤其是在较低的激动剂浓度下。用增加的 CRP-XL 浓度刺激血小板表明,较高的激动剂浓度需要更少的时间才能达到纤维蛋白原结合的最大速率,供体之间的变异性较小;然而,这种趋势在凝血酶或 ADP 刺激中都没有看到(图 5C)。该测定表明,在某些情况下,增加激动剂浓度会减少血小板活化开始所需的时间(滞后时间),而不会改变血小板活化的最大速率,并且这两种措施都可以通过该测定进行评估。
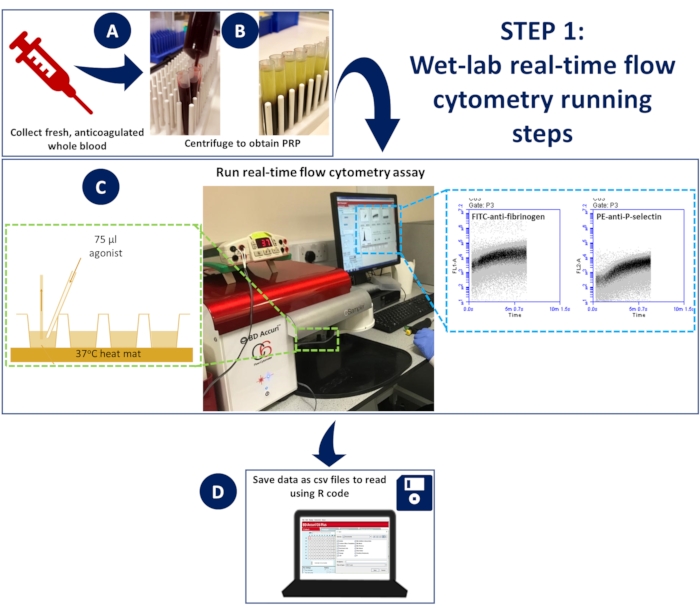
图 1:湿实验室实时流式细胞术。 (A) 将抗凝全血 (B) 离心以获得富血小板血浆 (PRP)。(C) 将含有适当抗体或钙指示剂染料的稀释 PRP 置于 96 孔板中,上样到非加压流式细胞仪上,并使用解剖垫保持在 37 °C。在采集过程中,使用含有抗体或钙染料和激动剂的活化混合物刺激样品,并使用凝胶上样尖端快速添加到孔中以确保自发混合。(D) 收集事件 5 分钟,并保存每个孔数据的 CSV 文件。 请单击此处查看此图的较大版本。
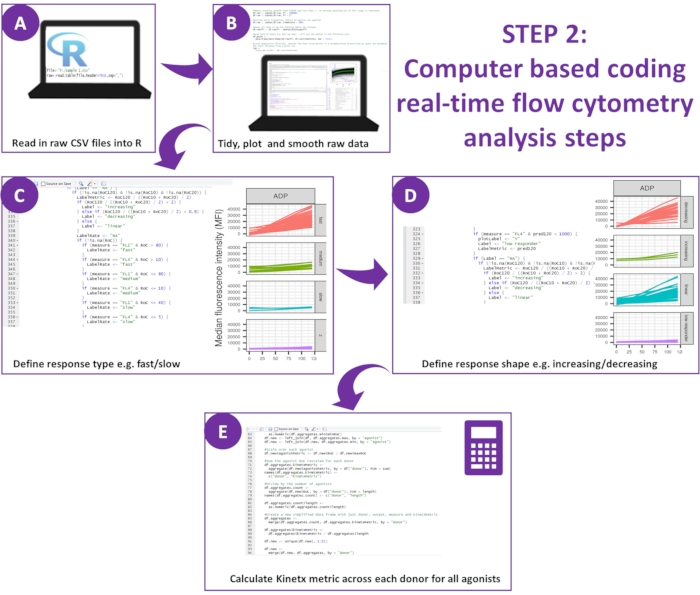
图 2:数据分析示意图。 (A) 配置了 R 环境,并创建了元数据。(B) 删除了外围数据,并拟合了平滑的移动平均线(黄土)曲线。定义了 (C) 响应类型和 (D) 响应形状。(E) 计算、导出每个捐献者的指标并生成数据。 请单击此处查看此图的较大版本。
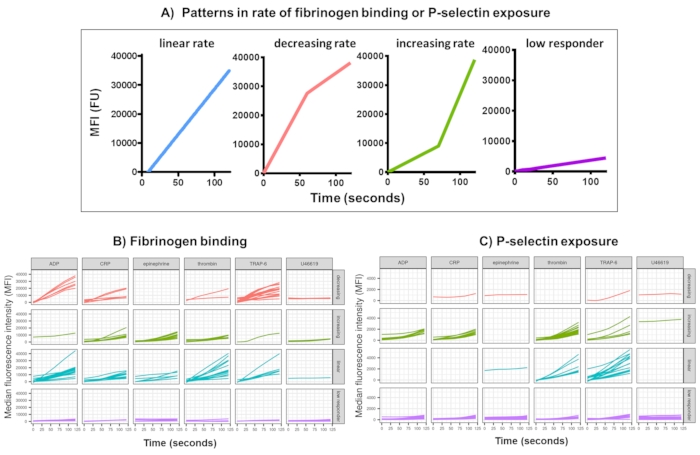
图 3:实时血小板纤维蛋白原结合和 P-选择素表达的 Kinetx 分析的代表性输出。 (A) 除了提供最大变化率 (RoC) 和不同时间点的 RoC 等指标外,Kinetx 还对曲线的形状进行分类,以提供难以在单个指标中捕获的血小板活化的其他信息。30 个个体的代表性数据显示了响应激动剂 ADP、TRAP-6、CRL-XL、肾上腺素和 U46617 的实时血小板 (B) 纤维蛋白原结合和 (C) P-选择素表达的典型变化。 请单击此处查看此图的较大版本。
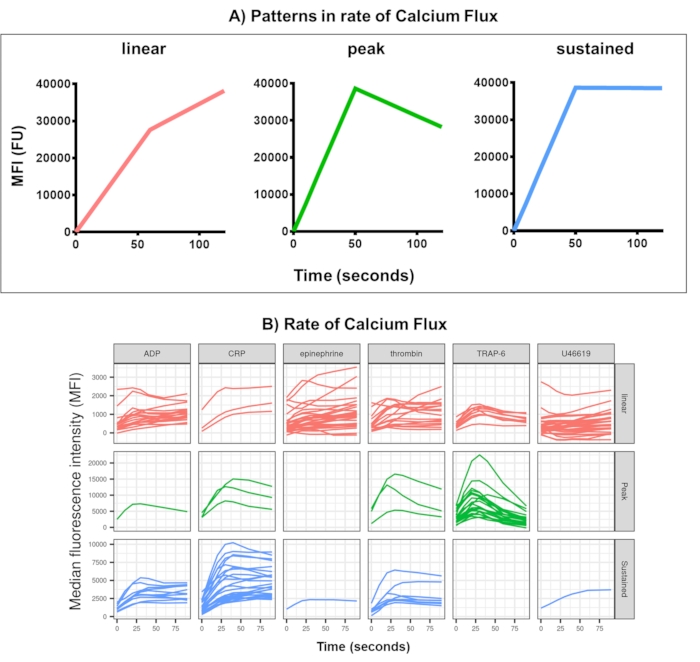
图 4:实时血小板钙通量的 Kinetx 分析的代表性输出。 (A) 除了提供最大变化率 (RoC) 和不同时间点的 RoC 等指标外,Kinetx 还对钙通量曲线的形状进行分类,以提供难以在单个指标中捕获的血小板活化的其他信息。30 个个体的代表性数据显示了实时血小板 (B) 钙通量对激动剂 ADP、TRAP-6、CRL-XL、肾上腺素和 U46617 的典型变化。 请单击此处查看此图的较大版本。
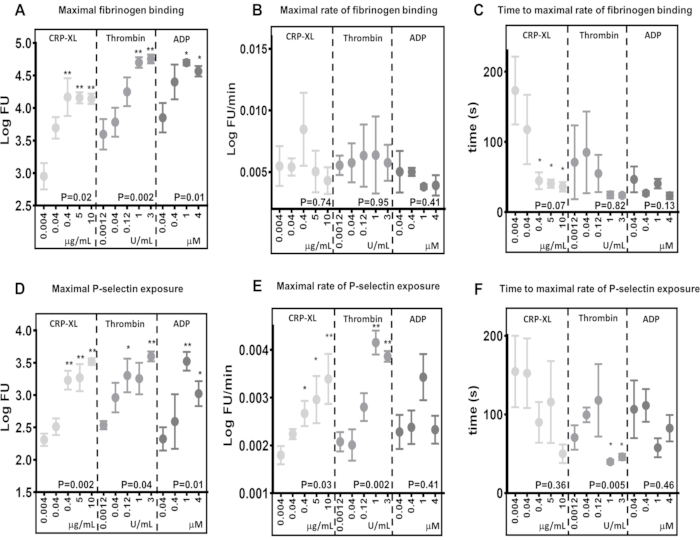
图 5:激动剂浓度决定最大血小板活化,但不确定血小板活化速率。 激动剂 (CRP-XL、凝血酶或 ADP) 浓度显著改变最大血小板活化 - 纤维蛋白原结合 (A) 或 P-选择素暴露 (D) - 显著正向改变。血小板活化速率 (B 和 E) 和达到血小板活化最大速率的时间 (C 和 F) 与激动剂浓度的变化没有关系或关系较弱。P 值表示整个浓度范围内的显著性(Kruskal-Wallis 检验),星号表示单个值与最低浓度的显著差异(多重比较检验)。* P < 0.05,** P < 0.01。 请单击此处查看此图的较大版本。
讨论
血小板检测、处理和响应激活刺激的速率可能是血栓形成的重要决定因素。以前的研究发现,抑制影响血小板活化速率但不影响最终程度的信号转导元件会导致不稳定血栓的形成 8。许多血小板功能测定法测量血小板活化和聚集的程度对不同条件和治疗的反应;然而,这些没有考虑血小板被激活的速度和这个复杂过程发生所需的时间 3,4。这里开发的基于流式细胞术的创新检测方法可重复地监测血小板活化随时间的变化,并将其转化为一系列指标,以计算血小板活化的最大速率以及血小板达到该最大速率并完全激活所需的时间。
提供的数据突出了实时检测识别对激动剂类型和浓度的不同反应之间以及个体之间变化的能力。之前的许多报告表明,正常个体之间的血小板反应性差异很大15,16,这表明血小板活化的速率在人群内也可能有很大差异。这项研究的数据表明,脱颗粒和纤维蛋白原与血小板结合的速率似乎比血小板活化的最大水平更具可变性。这表明实时流式细胞术也可以用作一种有价值且可靠的工具,用于识别人群中血小板率的差异,并检测不同抑制剂或促激活剂对血小板率的影响,作为测量血小板功能的另一种手段。
当使用终点测定法测量血小板功能时,可以比较不同激动剂之间纤维蛋白原结合或颗粒释放的程度。比较血小板活化前 5 分钟内纤维蛋白原结合的黄土曲线表明,实时检测能够梳理出血小板活化动力学差异的更多细节,这是单终点检测无法测量的。
从实时测定中收集的数据表明,纤维蛋白原与血小板结合的速度遵循略有不同的模式,具体取决于激活途径(图 3)。为了准确评估血小板活化动力学,必须使用能够同时进行数据采集和样品刺激的非加压流式细胞仪。快速添加激动剂以确保激动剂和血小板近乎瞬时和完全混合也很重要。用凝血酶 ADP 和肾上腺素刺激产生类似的曲线,代表响应受体致敏而快速启动信号转导,导致纤维蛋白原以快速稳定的速率与血小板结合。相比之下,由 CRP-XL 刺激的血小板在初始受体致敏后最初结合纤维蛋白原的速度非常缓慢;然而,在最初的延迟之后,纤维蛋白原结合的速率会迅速增加。用 TXA2 的模拟物 U46619 刺激血小板导致纤维蛋白原结合的初始速率快速,该速率迅速降低到非常缓慢的速度,导致纤维蛋白原结合随着时间的推移仅略微稳定增加。
Kinetx 被设计为开源、可重现且易于实施,以解决专有软件的问题,例如成本和不灵活性。因此,它需要使用不适当的软件开发。选择 R 是因为它被生物学家广泛使用、易于安装、免费且开源。这种开源环境允许精通 R 的用户更改参数,例如平滑度、外围数据点的识别或时间尺度。但是,为了帮助不熟悉 R 的研究人员,还开发了 Kinetix,以便可以通过单个命令(kinetxProcess 或 kinetxProcessCalcium,取决于正在分析的数据)执行分析。此处演示的 Kinetix 软件可以计算一系列指标,包括纤维蛋白原结合或 P-选择素暴露的最大水平、速率和加速度的值,以及这些最大值出现的时间点。使用这些数字可以更准确地比较响应不同刺激途径的血小板活化动力学。
不同激动剂刺激在纤维蛋白原结合的最大水平和纤维蛋白原与血小板结合速率方面的比较是血小板活化速率可以独立于最大结合而变化的很好的例子。用 0.04 μM ADP (3.85 LogFU) 和 0.04 μg/mL CRP-XL (3.70 LogFU) 刺激 5 分钟后的最大纤维蛋白原结合进行比较,两种激动剂都产生了相似量的结合纤维蛋白原(图 5A)。纤维蛋白原结合的最大速率显示出更微小的差异(0.04 μM ADP - 0.0050 LogFU/分钟;0.04 μg/mL CRP-XL - 0.0054 LogFU/min),表明这两种刺激之间的纤维蛋白原结合的总体速率相似(图 5B)。然而,当比较血小板活化的滞后时间时,存在明显差异,显示 CRP-XL(达到最大速率 117 秒)的加速速度比 ADP(达到最大速率 47 秒)慢得多(图 5C)。因此,很明显,与 CRP-XL 相比,ADP 刺激导致更快的初始反应 (P < 0.001)。当一起观察时,这些响应两种不同激动剂的血小板动力学测量值描述了对 ADP 刺激的快速初始反应,该反应缓慢加速并保持稳定速率。相比之下,CRP-XL 刺激导致初始激活速率缓慢,在更晚的时间迅速加速,最终导致与 ADP 相似的纤维蛋白原结合总速率和水平。纤维蛋白原结合的最大水平、速率和加速度之间的这些差异表明,测量血小板被激活的速度涉及许多参数。实时检测和 Kinetx 分析可以测量和比较这些参数,描述从受体敏化到血小板反应所需的时间,并比较不同信号通路之间的时间。
增加激动剂浓度对纤维蛋白原与血小板结合的速率没有显着影响。然而,达到纤维蛋白原结合最大速率所需的时间随着激动剂浓度的增加而减少,这表明血小板以稳定的速率结合纤维蛋白原,而受体饱和度在血小板结合纤维蛋白原的速度中起着更突出的作用。
所述钙通量测定和分析是一种快速简便的钙测定法,可以作为额外样品纳入实时测定中,从而允许在同一批次样品中分析钙和血小板纤维蛋白原结合以及 P-选择素。定制的分析包提供了对钙通动力学的深入评估,包括响应的形状、最大响应和达到最大响应的时间。然后可以比较这些参数的供体之间的差异以及对各种药物制剂的响应。以前已经使用各种基于流式细胞术的测定法在血小板中研究了血小板中的钙通量 17,18,19。Aliotta 等人14 描述了一种能够分析多种细胞内离子动力学的优雅测定法。这里介绍的钙测定建立在这些先前发表的测定的基础上,包括分析包,允许更大的灵活性,更深入地探索数据,并在短时间内对多个供体进行高通量分析。
先前的研究表明,某些信号分子的抑制或不存在会导致血小板活化率改变,这直接转化为血栓形成 8,9。过去,血小板活化动力学可以通过流式细胞术在许多固定时间点上测量,然后可用于计算和比较,例如,响应不同激动剂的 GPIIbIIIa 外化速率20。本文中描述的实时检测和 Kinetx 分析提供了一种简单、免费且准确的方法来测量静息血小板的血小板活化速率和终点。这对于识别血小板功能的生理相关变化可能很重要,这些变化在仅测量终点读数时可能会被遗漏。
披露声明
作者没有什么可披露的。
致谢
该项目得到了英国心脏基金会 (PG/16/36/31967、RG/20/7/34866 和 RG/15/2/31224) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 9,11-Dideoxy-11α,9α-epoxymethanoprostaglandin F2α - U46619 | Sigma-Aldrich, Poole, UK | D8174-1MG | |
| Accuri C6 flow cytometer with BD Csampler | Beckton Dickinson, UK | 660517 + 660519 | |
| Adenosine diphosphate | Sigma-Aldrich, Poole, UK | A2754-1G | |
| APC-labelled anti-P-selectin (CD62p) | BD Biosciences, UK | 550888 | |
| Corning polypropylene 96-well round-bottomed, non-treated microtitre plate | Sigma-Aldrich, Poole, UK | CLS3879-50EA | |
| Cross-linked collagen related peptide (CRP-XL) | CambCol, UK | ||
| Epinephrine | Sigma-Aldrich, Poole, UK | E4375-1G | |
| FITC-labelled anti-fibrinogen antibody | Dako, Agilent Technologies, UK | F011102-2 | |
| Fluo-4 Direct dye | Thermo-Fisher Scientific | F10472 | |
| Gel loading tips | Starlab, UK | I1022-0600 | |
| Gly-Pro-Arg-Pro peptide | Sigma-Aldrich, Poole, UK | G1895-5MG | |
| Thrombin | Sigma-Aldrich, Poole, UK | SRE0003-10KU | |
| Thrombin receptor activator peptide 6 (TRAP-6) | Bachem, St Helens, UK | H-2936.0005 | |
| Vacuette 9NC coagulation 3.2 % trisodium citrate (0.109 mol/L) | Greiner Bio-one LTD, Stonehouse, UK | 454327 |
参考文献
- Bye, A. P., Unsworth, A. J., Gibbins, J. M. Platelet signaling: a complex interplay between inhibitory and activatory networks. Journal of Thrombosis and Haemostasis: JTH. 14 (5), 918-930 (2016).
- Jones, C. I., Barrett, N. E., Moraes, L. A., Gibbins, J. M., Jackson, D. E. Endogenous inhibitory mechanisms and the regulation of platelet function. Methods in Molecular Biology. 788, 341-366 (2012).
- Paniccia, R., Priora, R., Liotta, A. A., Abbate, R. Platelet function tests: a comparative review. Vascular Health and Risk Management. 11, 133-148 (2015).
- Saboor, M., Moinuddin, M., Ilyas, S. New horizons in platelets flow cytometry. The Malaysian Journal of Medical Sciences : MJMS. 20 (2), 62-66 (2013).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88, 1525-1541 (1996).
- Pasquet, J. M., Noury, M., Nurden, A. T. Evidence that the platelet integrin alphaIIb beta3 is regulated by the integrin-linked kinase, ILK, in a PI3-kinase dependent pathway. Thrombosis and Haemostasis. 88 (1), 115-122 (2002).
- Stevens, J. M., Jordan, P. A., Sage, T., Gibbins, J. M. The regulation of integrin-linked kinase in human platelets: evidence for involvement in the regulation of integrin alpha 2 beta 1. Journal of Thrombosis and Haemostasis: JTH. 2 (8), 1443-1452 (2004).
- Jones, C. I., et al. Integrin-linked kinase regulates the rate of platelet activation and is essential for the formation of stable thrombi. Journal of Thrombosis and Haemostasis: JTH. 12 (8), 1342-1352 (2014).
- Cifuni, S. M., Wagner, D. D., Bergmeier, W. CalDAG-GEFI and protein kinase C represent alternative pathways leading to activation of integrin alphaIIbbeta3 in platelets. Blood. 112 (5), 1696-1703 (2008).
- Stolla, M., et al. The kinetics of alphaIIbbeta3 activation determines the size and stability of thrombi in mice: implications for antiplatelet therapy. Blood. 117 (3), 1005-1013 (2011).
- Kawasaki, H., et al. A Rap guanine nucleotide exchange factor enriched highly in the basal ganglia. Proceedings of the National Academy of Sciences of the United States of America. 95 (22), 13278-13283 (1998).
- . R Available from: https://www.r-project.org/ (2021)
- . R Studio Available from: https://rstudio.com/products/rstudio/download/ (2021)
- Yee, D. L., Sun, C. W., Bergeron, A. L., Dong, J. F., Bray, P. F. Aggregometry detects platelet hyperreactivity in healthy individuals. Blood. 106 (8), 2723-2729 (2005).
- Panzer, S., Hocker, L., Koren, D. Agonists-induced platelet activation varies considerably in healthy male individuals: studies by flow cytometry. Annals of Hematology. 85 (2), 121-125 (2006).
- Aliotta, A., Bertaggia Calderara, D., Alberio, L. Flow cytometric monitoring of dynamic cytosolic calcium, sodium, and potassium fluxes following platelet activation. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 97 (9), 933-944 (2020).
- do Ceu Monteiro, M., Sansonetty, F., Goncalves, M. J., O'Connor, J. E. Flow cytometric kinetic assay of calcium mobilization in whole blood platelets using Fluo-3 and CD41. Cytometry. 35 (4), 302-310 (1999).
- Vines, A., McBean, G. J., Blanco-Fernandez, A. A flow-cytometric method for continuous measurement of intracellular Ca(2+) concentration. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 77 (11), 1091-1097 (2010).
- Weber, A. A., Schror, K. Differential inhibition of adenosine diphosphate- versus thrombin receptor-activating peptide-stimulated platelet fibrinogen binding by abciximab due to different glycoprotein IIb/IIIa activation kinetics. Blood. 98 (5), 1619-1621 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。