Method Article
Kinetx:血小板活性化をリアルタイムで定量的に測定および分類するためのフローサイトメトリーアッセイと解析を組み合わせたソフトウェアフレームワーク。
要約
血小板は、さまざまな刺激に迅速に反応します。この論文では、血小板顆粒の放出、フィブリノーゲン結合、および細胞内カルシウムフラックスの定量的速度論的測定を可能にする、リアルタイムフローサイトメトリーベースの血小板機能アッセイと、新たに開発された特注のオープンソースソフトウェア(Kinetx)について説明します。
要約
血小板は血管損傷に迅速に反応し、さまざまな刺激に反応して活性化して失血を制限します。多くの血小板機能検査では、血小板の活性化速度ではなく、定義された期間後のエンドポイント応答が測定されます。しかし、血小板が細胞外刺激を機能的反応に変換する速度は、血小板が損傷にどれだけ効率的に反応し、形成中の血栓に結合し、他の血小板を動員するシグナルを送ることができるかを決定する上で重要な要素です。この論文では、データ取得とサンプル刺激を同時に可能にし、新たに開発された特注のオープンソースソフトウェア(Kinetx)を利用して、血小板顆粒の放出、フィブリノーゲン結合、および細胞内カルシウムフラックスの定量的な速度論的測定を可能にするフローサイトメトリーベースの血小板機能アッセイについて説明します。Kinetixは、スムージングの度合い、外れたデータポイントの識別、時間スケールなどのパラメータを変更できるように開発されました。R 環境に不慣れなユーザーを支援するために、Kinetix のデータ分析を 1 つのコマンドで実行できます。 これにより、速度、加速度、ピークレートまでの時間、カルシウムのピークまでの時間、定性的な形状変化などのリアルタイムの血小板活性化メトリクスを正確かつ再現性よく測定し、分類することができます。血小板活性化の速度論的測定は、活性化の最初の段階での血小板の挙動に関する独自の洞察を提供し、形成血栓への血小板の動員を予測する方法を提供する可能性があります。
概要
血小板は止血において中心的な役割を果たし、血管損傷に対して迅速かつ多面的な反応を示します1,2。現在の血小板機能試験では、血小板反応性のさまざまな側面を測定し、in vivoでの止血作用を代表しています。従来、血小板の機能は、最大の活性化を達成するのに十分な時間刺激された血小板のフィブリノーゲン結合、顆粒放出、または血小板凝集を測定するエンドポイントアッセイを使用して評価されてきました3,4。これらの検査では、血小板が細胞外刺激を細胞内シグナルやカルシウムフラックスに変換し、その後、成長する血栓に脱顆粒して結合するのにかかる時間は考慮されていません。血液は、静脈では最大20ダイン/cm3、大動脈では80ダイン/cm3のせん断速度で流れます5。これは、細胞外刺激を迅速に検出、処理、および応答して形成中の血栓に結合し、その継続的な成長をサポートすることにより、血小板がこの急速な流れ速度を打ち消す必要性を強調しています。
血小板活性化の速度は、血小板活性化の最大程度とは無関係に変化する可能性があります。.インテグリン結合キナーゼ(ILK)は、血小板中のβ1およびβ3インテグリンの調節に関与するタンパク質です6,7。in vivoでのILKの阻害または特異的な欠失は、機能的なILK8がない場合、血小板活性化の最大程度ではなく、速度が影響を受けることを示しました。凝集速度と最大凝集レベルの差は、RAP111を介したインサイドアウトシグナル伝達の調節に関与するシグナル伝達分子であるCALDAG GEFI 9,10を欠損したマウスでも確認されました。
これらの知見は、血小板率と最大活性化レベルが自律的であり、最大活性化の測定がこの時点までの血小板の挙動を説明していない可能性があることを示しています。血小板が活性化されるのにかかる時間のこれらの違いは、成長する血栓への最初の結合に大きく影響し、血栓の構造と全体的なサイズに影響を与える可能性があります。血小板速度と最大活性化との間のこれらの変動は、血小板活性化の速度を正確に測定し、集団内のばらつきを検出するために使用できるアッセイの必要性を強調しています。
この論文では、血小板の活性化とカルシウムフラックスをリアルタイムで正確に測定し、血小板が活性化する速度や血小板が最大活性化速度と最大カルシウムフラックスに到達するまでの時間など、さまざまな指標を計算する方法について説明します。これらの血小板活性化の速度論的測定は、血栓形成の最初の段階における血小板の挙動についてより深い洞察を与え、血小板が形成血栓にどれだけ速く動員されるかを予測する方法を提供します。
プロトコル
このプロトコルは、基礎疾患がなく、書面によるインフォームドコンセント後に血小板機能を妨げることが知られている薬を服用していない健康なドナーからのヒト全血と血小板を使用し、レディング大学の研究倫理委員会によって承認されました。
1. 採血と多血小板血漿の調製
- 3.2%クエン酸ナトリウムを含むバキューナーで末梢血を採取します
- 最初の3 mLを廃棄します。
- 遠心分離の前に、血液を30°Cで30分間休ませます。
- 多血小板血漿(PRP)を140 x g で室温で20分間遠心分離し、その後、37°Cでインキュベートしてアッセイ時間(遠心分離から60分以内に終了)します。
2. 楽器の準備
注:フローサイトメーターがイベントを記録すると同時に血小板が刺激されるため、リアルタイムのフローサイトメトリーには非加圧流路系が不可欠です。
- 非加圧フローサイトメーターを使用して、リアルタイムのフローサイトメトリーを実施します。
- 37°Cでアッセイを行うには、マウス解剖マットをステージに取り付けて、96ウェルプレートを配置します。アッセイの間、マットを37°Cに加熱します。
- 加熱したマットの上に96ウェルプレートを置き、37°Cで連続インキュベーションできるようにします(図1)
3. アッセイの準備
- フィブリノーゲン結合とP-セレクチン発現
- ポリプロピレン製96ウェル丸底未処理マイクロタイタープレートに、Hepes緩衝生理食塩水(HBS;10 mM Hepes pH 7.4;150 mM NaCl、5 mM KCl、1 mM MgSO4.7H 20)中の5%ウシ血清アルブミン(BSA)を4°Cで一晩コーティングします。
- 5 mMグルコースを含むHBS(HBS-G)で抗体ミックスを調製します。フルオレセインイソチオシアネート(FITC)標識抗フィブリノーゲン抗体(FITC-FGN;希釈1:37.5(v/v))およびアロフィコシアニン(APC)標識抗P-セレクチン(APC-CD62P;希釈1:37.5(v/v))をHBS-G(最終容量:225μL)に添加し、96ウェルプレートで37°Cでインキュベートします。
- イベントを収集する直前に、PRPをHBS-G-抗体ミックスに1:600(v/v)の希釈で添加します。
注:イベント制限を超えないようにし、サンプル中の血小板凝集を減らすには、少量のPRPが必要です。血小板希釈はパイロット研究で検討され、活性化率に影響を与えません。 - FITC-FGN(希釈1:37.5(v/v))とAPC-CD62P(希釈1:37.5(v/v))とアゴニストを含む活性化ミックスを37°Cでインキュベートします。 アゴニストには、Gly-Pro-Arg-Proペプチド(GPRP;1.18 mM)、架橋コラーゲン関連ペプチド(CRP-XL;0.004-10 μg/mL)、アデノシン二リン酸(ADP;0.04-4 μM)、エピネフリン(epi;20-200 μM)、9,11-ジデオキシ-11α,9α-エポキシメタノプロスタグランジンF2α(U46619;0.02-5 μM)、およびトロンビン受容体活性化ペプチド6(TRAP-6;0.04-10 μM)の存在下でのトロンビン(thr;0.0012-1 U/mL)が含まれます。
- カルシウムフラックス
注:このアッセイは、市販のカルシウムアッセイキット(材料の表)を使用して実施されました- ポリプロピレン製96ウェル丸底未処理マイクロタイタープレートに、Hepes緩衝生理食塩水溶液5% BSAを4°Cで一晩コーティングします。
- カルシウムアッセイ色素を調製するには、カルシウム試薬1本にカルシウムアッセイバッファー100 mLとプロベネシド原液2 mL(250 mM)を加えて、カルシウム試薬ローディング溶液2倍を得ます。
- Fluo-4/HBS-Gを調製するには、カルシウムアッセイ色素をHBS-Gで1:1の比率で希釈し、0.22μMフィルターでろ過します。225 μLのFluo-4/HBS-Gを96ウェルプレートの適切なウェルに37°Cで加えます。
- PRPを37°Cで30分間、Fluo-4/HBS-Gと1:1希釈でインキュベートします。
- 活性化ミックスをFluo-4/HBS-Gで調製し、37°Cでインキュベートします。 アゴニストには、GPRP、CRP-XL(0.5μg/mL)、ADP(1μM)、エピネフリン(20μM)、U46619(1μM)、およびTRAP-6(1μM)の存在下でのトロンビン(1U/mL)が含まれます。
- イベントを収集する直前に、225 μLのFluo-4/HBS-GミックスにPRP/Fluo-4/HBS-Gを添加し、最終PRP希釈(アゴニスト添加後)を1:600(v/v;最終容量300 mLに0.5 mL)で加えます。
4. アッセイ手順とデータ収集
- フローサイトメーターの流量を「低速」に設定し、平均イベント数/秒(eps)、最大3000 epsに設定します。しきい値を 20000 に設定して、セルの破片が記録されないようにします。
- 前方散乱(FSC)プロットと側散乱(SSC)プロットを使用して血小板集団をゲートします。データ収集では、FSC-AとSSC-Aをプロットして血小板集団を正確にゲートし、FL1またはFL4と時間をプロットして蛍光イベントを経時的に記録します。
- フローサイトメーターは、イベントの記録を開始するのに14秒かかります。この後、装置で各ウェルのイベントをさらに5秒間記録し、その後、ゲルローディングチップを使用して75μLの活性化ミックスを迅速に追加し、自発的な混合を確保します(図1)。
- 5分間のイベントを収集し、488(FL1;533/30フィルター-FITC-fibrinogen/FLUO-4)チャネル対時間および633(FL4;675/25フィルター-APC-P-selectin)チャネル対時間を記録するようにプロットを設定します。
- 各ウェルの488チャンネルと633チャンネルのプロットデータをCSVファイルとして保存します。
5. データ分析
- Kinetx12 の最新バージョンをダウンロードします。
注:ダウンロードには、アッセイから生成されたデータの分析に必要なすべてのコードが含まれており、10人のドナーからの実験データと彼らの分析から生成された出力のテストセットが付属しています(これらの結果は、次の手順で再生成および検証できます)(図2)。 - R 環境を設定する
- RStudio 環境を介してプログラミング言語 R を使用します。R13、RStudio14 、および次のパッケージをインストールします:ggplot2、dplyr、plotrix、minpack.lm、tidyverse、psych。すべての前提条件パッケージが正常にインストールされていることを確認します。
- メタデータの作成: データと同じディレクトリ内にテキストファイル (wellData.txt) を配置します。アゴニスト、その濃度、抗体、および各CSVファイルの生成に使用されたアッセイ(機能またはカルシウム)について説明します。
- 同じディレクトリに 2 番目のテキスト ファイル ('IsotypeData.txt') を配置し、アイソタイプを定義します。ダウンロードで提供されるファイル(「data/wellData.txt」および「data/IsotypeData.txt」)はテンプレートとして機能し、代替のアゴニスト、阻害剤、および濃度に容易に適応できます。
- データの分析: Kinetx は、手順 5.2.5 から 5.2.7 で定義されている 3 つの関数で構成されています。
- kinetxProcess.R: この機能は、生の機能的フローサイトメトリーデータを処理します。実行するには、kinetxProcess('data location','where to put outputs','FL1' (FITC-anti-fibrinogen, or 'FL4' (APC-CD62P) と入力します。
- kinetxProcessCalcium.R: この関数は、カルシウム フラックス データを解析してラベル付けします。実行するには、「kinetxProcessCalcium('data location','where to put outputs','FL1')」と入力します。
- kinetxSummary.R: この関数はデータを要約します。実行するには、「kinetxSummary('data location','where to put outputs','FL1')」と入力します。
- 上記のすべての関数 (5.2.5-5.2.7) をテスト データに対して実行するには、スクリプト (test.R).
注:最初の2つの関数は、生データとフィット曲線を示す各ドナーの数値を生成します。すべての出力と、データを要約したスプレッドシートが出力場所に配置されます。
結果
機能的リアルタイムフローサイトメトリーの解析により、アゴニスト間およびドナー間の活性化曲線の形状の違いが明らかになりました
Kinetxを使用した機能データ(P-セレクチン曝露とフィブリノーゲン結合)のデータ分析は、妥当な範囲(>200000または<1)および<2.80秒(ゼロ時間がこのポイントに設定される)から外れたデータポイントを削除し、データをアイソタイプの中央値に正規化し、滑らかな移動平均曲線を(関数黄土を介して)適合させます。Kinetxはまた、メトリックとカテゴリを割り当て、次のように適合した平滑化された線の形状、絶対値、および変化率に基づいています:(1)RoC - 最初の120秒間の平滑化された線の平均上昇。(2)ラベル - FL1の場合は40と80、FL4の場合は5と10のカットオフに従って、応答を高速、中、または低速に分類します。(3) EarlyRoC - 最初の20秒間の平滑化された線の平均上昇(4)形状 - 低レスポンダ、増加、線形または減少(図3A) - FL1 < 4000またはFL4 < 1000として決定される低応答者、ラベルの増加、線形および減少は、以下に基づいて決定されます:shapeMetric - RoC(120秒)/EarlyRoC、ここで増加するshapeMetric>2、0.9-2と減少するshapeMetric<0.9;(5) 0 秒、10 秒、20 秒、30 秒、40 秒、60 秒、90 秒、120 秒、180 秒、アイソタイプの中央値、最大および最小の変化率と加速度、およびすべてのラベルとカテゴリでの変化のレベルと速度を提供することにより、データを要約したスプレッドシートを作成します。
アゴニストADP、TRAP-6、CRP-XL、エピネフリン、およびU46617の単一濃度に応答して、活性化後5分間にわたる血小板フィブリノーゲン結合およびP-セレクチン曝露を、30人のドナーで分析しました。さまざまなアゴニストに応答したフィブリノーゲン結合とP-セレクチン曝露の指標は、応答の形状にかなりのばらつきを示しています(図3)。TRAP-6およびADPで刺激された血小板は、フィブリノーゲン結合のより急速な加速を示し、多くのドナーにとって、これは後の時点で遅くなりました(図3B)。CRP-XL、トロンビン、およびエピネフリンに応答したフィブリノーゲン結合は、反応率の増加または線形を示す可能性が高かった。多くのドナーは、フィブリノーゲン結合速度が急速に加速する前に、CRP-XLの比較的長い遅延時間を示しました。U46619に対する反応は、しばしば「低い」に分類されました。対照的に、P-セレクチン曝露は、U46619を除くすべてのアゴニストに対して線形または増加した反応率を示す可能性が高く、U46619は再び低い反応レベルを示しました(図3C)。
血小板活性化中の細胞内カルシウムフラックスは、リアルタイムのフローサイトメトリーを使用して正確に測定できます
カルシウムフラックスアッセイのデータ解析では、妥当な範囲外にあるデータポイント(このポイントに設定されたゼロ時間<2.80秒)が除去され、滑らかな移動平均曲線が(関数黄土を介して)適合します。Kinetxはメトリックを割り当て、カテゴリは、適合した滑らかな線の形状、絶対値、および次のように変化率に基づいて割り当てられます:(1)カテゴリ - 初期の上昇、最大、および最大からの最終低下に基づくカルシウム応答の形状を説明し、線形、ピーク、または持続として記述されます(図4A)。(2)レート - 高速30秒での変化率を表し、変化なし、低速、中程度、または高速(10、40、80でカットオフ)として定義されます。また、Kinetx は、0 秒、10 秒、20 秒、30 秒、40 秒、60 秒、90 秒、120 秒、180 秒での変化のレベルと速度、最大と最小の変化率と加速率、およびすべてのラベルとカテゴリを提供し、各ドナーのデータの図を生成することで、データを要約したスプレッドシートも作成します。この方法で30人の個人で測定されたカルシウムフラックスの例は、個人とアゴニストの間で異なる活性化パターンを再び示しました(図4B)。CRP-XLは主に持続的なカルシウム反応を示しましたが、TRAP-6に対する反応はピーク反応を示すことが最も多かった。他のすべてのアゴニストは、主に線形反応を生成しました。
リアルタイムのフローサイトメトリーにより、さまざまなアゴニストや濃度に応答する最大活性化レベルの違いを同定
結果は、リアルタイムフローサイトメトリーアッセイが、さまざまな受容体(10 μg/mL CRP-XL 対 3 U/mL トロンビン P < 0.001; 10 μg/mL CRP-XL 対 1 U/mL トロンビン P < また、このアッセイはアゴニスト濃度の違いに敏感であり、アゴニスト濃度の増加に応答して最大フィブリノーゲン結合およびP-セレクチン曝露のレベルが増加することも示しています(フィブリノーゲン結合 - CRP-XL - 0.004 μg/mL 対 0.4、5、10 μg/mL、P < 0.01、トロンビン - 0.0012 U/mL 対 1 および 3 U/mL、 P<0.01;ADP - 0.04 μg/mL 対 1 μM および 4 μM、P < 0.05)。
リアルタイムフローサイトメトリーアッセイは、血小板活性化率のドナー間のばらつきを検出するのに十分な感度を備えています
血小板活性化の最大速度は、平滑化移動平均(黄土)を蛍光データに当てはめ、これを使用してフィブリノーゲン結合とP-セレクチン曝露の最大速度を計算することによって決定しました(図5B、E)。このデータは、個々のドナー間でかなりのばらつきがあることを示しており、フローサイトメトリーアッセイはこのばらつきを検出するのに十分な感度を備えています。結果は、アゴニスト濃度の増加がフィブリノーゲン結合の最大速度にほとんど影響を与えないことを示しています(図5B)。対照的に、P-セレクチン曝露の最大率は、トロンビンおよびCRP-XL濃度が高くなると増加しますが、ADPの濃度が増加すると増加しません(図5E)。
血小板活性化の遅延時間の変動は、リアルタイムのフローサイトメトリーを使用して検出できます
血小板活性化の最大速度までの時間は、フィブリノーゲン結合およびP-セレクチン曝露の最大速度に達した時点を計算することによって決定した(図5C、F)。フィブリノーゲン結合およびPセレクチン曝露の最大速度は、特にアゴニスト濃度が低い場合、ドナー間で異なります。CRP-XLの濃度が増加する血小板の刺激は、アゴニスト濃度が高いほど、フィブリノーゲン結合の最大速度に達するまでの時間が短くなり、ドナー間のばらつきが少なくなることを示しています。ただし、この傾向はトロンビン刺激とADP刺激のいずれにも見られません(図5C)。このアッセイは、状況によっては、アゴニスト濃度を上げると、血小板活性化の最大速度を変えることなく血小板活性化が開始されるのにかかる時間(遅延時間)が短縮されること、およびこれらの測定値の両方をこのアッセイで評価できることを示しています。
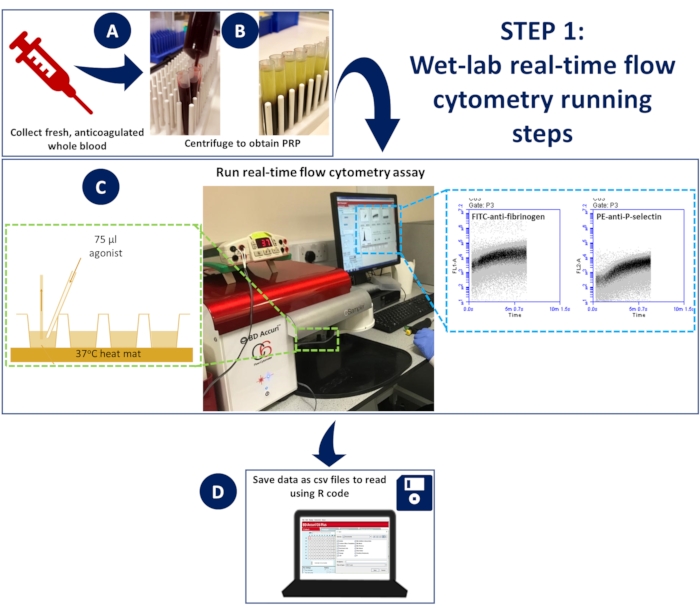
図1:ウェットラボリアルタイムフローサイトメトリー(A)抗凝固全血を遠心分離して多血小板血漿(PRP)を得た。(C)適切な抗体またはカルシウム指示色素を含む希釈PRPを96ウェルプレートに入れ、非加圧フローサイトメーターにロードし、解剖マットを使用して37°Cに維持しました。サンプルは、抗体またはカルシウム色素とアゴニストを含む活性化ミックスで取得中に刺激され、自発的な混合を確実にするためにゲルローディングチップを使用してウェルに迅速に添加されました。(D)5分間のイベントを収集し、各井戸のデータのCSVファイルを保存した。この図の拡大版を表示するには、ここをクリックしてください。
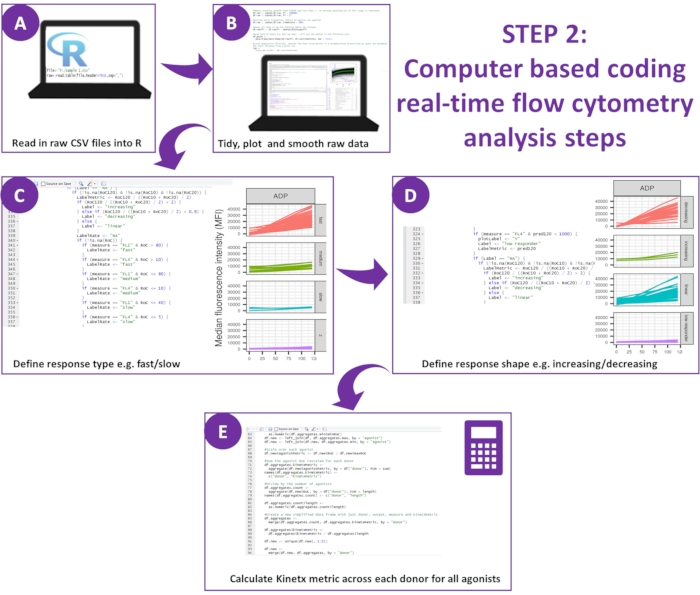
図2:データ分析の概略図。 (A) R環境を設定し、メタデータを作成しました。(B)外れたデータを削除し、滑らかな移動平均(黄土)曲線を適合させました。(C)応答タイプと(D)応答形状を定義した。(E)指標は、各ドナーについて計算され、エクスポートされ、数値が生成されました。 この図の拡大版を表示するには、ここをクリックしてください。
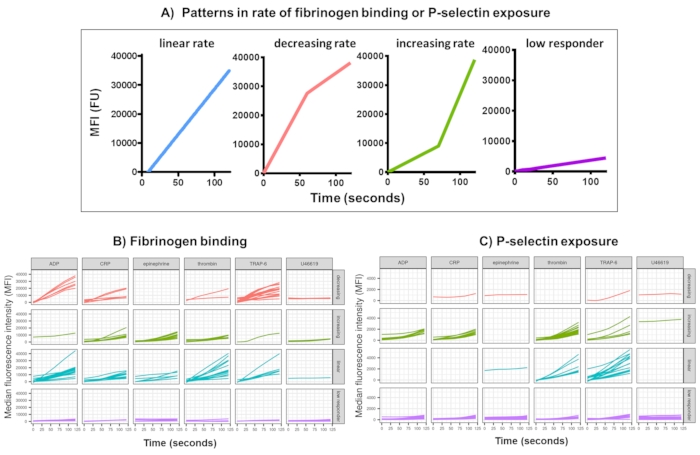
図3:リアルタイムの血小板フィブリノーゲン結合とP-セレクチン発現のKinetix分析の代表的な出力。 (A) Kinetx は、さまざまな時点の最大変化率 (RoC) や RoC などの指標を提供するだけでなく、曲線の形状も分類して、1 つの指標では把握しにくい血小板の活性化に関する追加情報を提供します。30人の代表的なデータは、アゴニストADP、TRAP-6、CRL-XL、エピネフリン、およびU46617に応答して、リアルタイムの血小板(B)フィブリノーゲン結合および(C)P-セレクチン発現に見られる典型的な変動を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
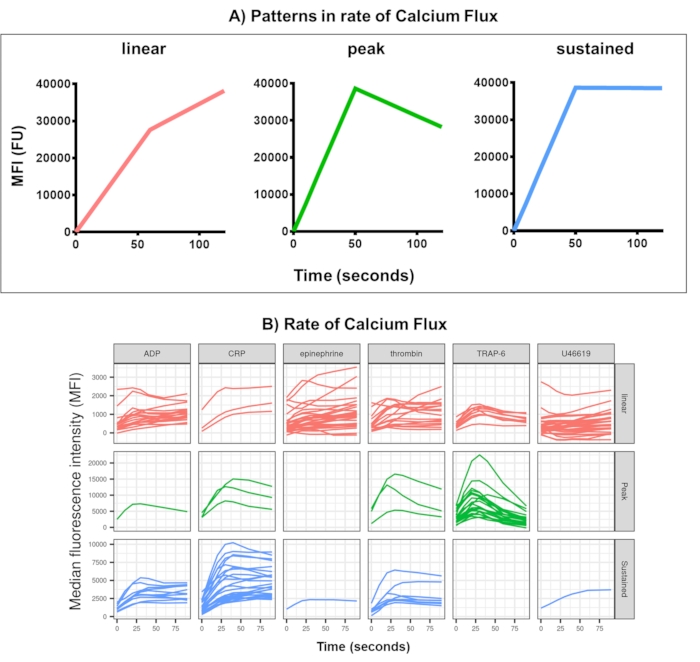
図4:Kinetxによるリアルタイムの血小板カルシウムフラックス分析の代表的な出力 (A) Kinetxは、さまざまな時点での最大変化率(RoC)やRoCなどの指標を提供するだけでなく、カルシウムフラックス曲線の形状も分類して、単一の指標では捉えにくい血小板の活性化に関する追加情報を提供します。30人の代表的なデータは、アゴニストADP、TRAP-6、CRL-XL、エピネフリン、およびU46617に応答したリアルタイムの血小板(B)カルシウムフラックスに見られる典型的な変動を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
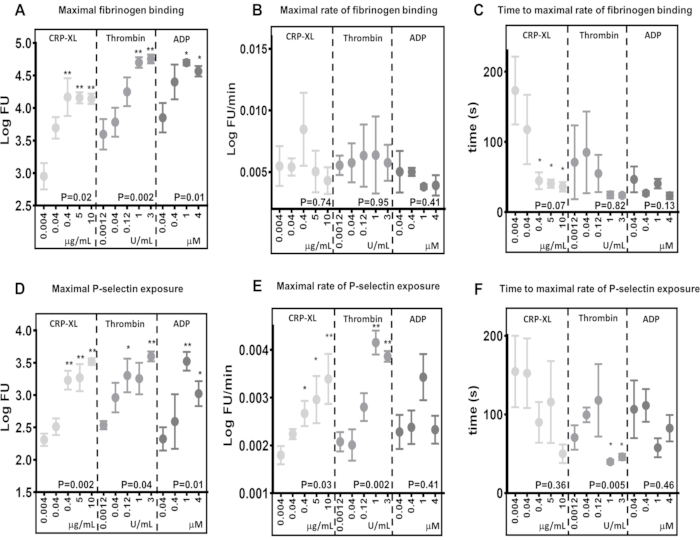
図5:アゴニスト濃度は血小板の最大活性化を決定しますが、血小板の活性化速度は決定しません。 最大血小板活性化 - フィブリノーゲン結合 (A) または P-セレクチン曝露 (D) - は、アゴニスト (CRP-XL、トロンビン、または ADP) 濃度によって有意に正に変化しました。血小板活性化率(B および E)および血小板活性化の最大速度までの時間(C および F)は、アゴニスト濃度の変化と無関係または弱い関係を示した。p値は、全濃度範囲にわたる有意性を示し(Kruskal-Wallis検定)、アスタリスクは、最低濃度からの個々の値の有意差(多重比較検定)を示します。* P < 0.05、** P < 0.01。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
血小板が活性化刺激を検出し、処理し、反応する速度は、血栓形成の重要な決定要因である可能性があります。以前の研究では、血小板活性化の最終的な程度ではなく、速度に影響を与えるシグナル伝達要素の阻害が、不安定な血栓8の形成をもたらすことがわかっています。多くの血小板機能アッセイは、さまざまな条件や治療に応答した血小板の活性化と凝集の程度を測定します。ただし、これらは血小板が活性化する速度と、この複雑なプロセスが発生するのにかかる時間を考慮していません3,4。ここで開発された革新的なフローサイトメトリーベースのアッセイは、血小板の活性化を経時的に再現性よくモニターし、これをさまざまな指標に変換して、血小板の最大活性化速度と血小板がこの最大速度に達して完全に活性化するまでにかかる時間を計算します。
提示されたデータは、アゴニストの種類と濃度に対する異なる反応間、および個人間の変動を特定するリアルタイムアッセイの能力を強調しています。多くの以前の報告は、血小板反応性が正常な個人間で大きく異なることを示しており15,16、血小板活性化の速度も集団内で大きく異なる可能性があることを示しています。この研究のデータは、脱顆粒と血小板へのフィブリノーゲン結合の速度が、血小板活性化の最大レベルよりもさらに変動するように見えることを示しています。このことは、リアルタイムフローサイトメトリーが、集団内の血小板率のばらつきを特定し、血小板機能を測定する追加の手段として、血小板率に対するさまざまな阻害薬または活性化促進剤の影響を検出するための貴重で信頼性の高いツールとしても利用できることを示しています。
エンドポイントアッセイを使用して血小板機能を測定すると、異なるアゴニスト間のフィブリノーゲン結合または顆粒放出の程度を比較できます。血小板活性化の最初の5分間のフィブリノーゲン結合を比較した黄土曲線は、シングルエンドポイントアッセイでは測定できない血小板活性化動態の違いをより詳細に引き出すリアルタイムアッセイの能力を示しています。
リアルタイムアッセイから収集されたデータは、フィブリノーゲンが血小板に結合する速度が、活性化経路によってわずかに異なるパターンをたどることを示しています(図3)。血小板活性化の動態を正確に評価するためには、データ取得とサンプル刺激を同時に行うことができる非加圧フローサイトメーターを使用することが不可欠です。また、アゴニストと血小板がほぼ瞬時に完全に混合されるように、アゴニストを迅速に添加することも不可欠です。トロンビンADPとエピネフリンによる刺激は、受容体感作に応答してシグナル伝達が急速に開始されることを表す同様の曲線を生成し、その結果、フィブリノーゲンが迅速かつ安定した速度で血小板に結合します。対照的に、CRP-XLによって刺激された血小板は、最初の受容体感作後、最初はフィブリノーゲンに結合するのが非常に遅いです。しかし、フィブリノーゲン結合の速度は、この最初の遅延後に急速に増加します。TXA2の模倣物であるU46619による血小板刺激は、フィブリノーゲン結合の迅速な初期速度をもたらし、これは急速に減少し、非常に遅い速度で、時間の経過とともにフィブリノーゲン結合がわずかに着実に増加するだけである。
Kinetx は、コストや柔軟性のなさなど、プロプライエタリなソフトウェアの問題を回避するために、オープンソースで再現可能で、実装が容易になるように設計されています。そのため、非適切なソフトウェアで開発する必要がありました。Rは、生物学者によって広く使用されており、インストールが簡単で、費用がかからず、オープンソースであるために選択されました。このオープンソース環境により、R に精通したユーザーは、スムージングの程度、外れたデータ ポイントの識別、時間スケールなどのパラメーターを変更できます。しかし、R Kinetixに詳しくない研究者を支援するために、Kinetixは単一のコマンド(分析するデータに応じてkinetxProcessまたはkinetxProcessCalcium)で分析を実行できるようにも開発されました。ここで紹介するKinetixソフトウェアは、フィブリノーゲン結合またはP-セレクチン曝露の最大レベル、速度、加速、およびこれらの最大値が発生する時点の値など、さまざまなメトリックを計算できます。さまざまな刺激経路に応答した血小板活性化の動態は、これらの数値を使用してより正確に比較できます。
フィブリノーゲン結合の最大レベルにおけるさまざまなアゴニスト刺激と血小板へのフィブリノーゲン結合速度の比較は、血小板活性化の速度が最大結合とは無関係に変化する可能性がある良い例です。0.04 μM ADP(3.85 LogFU)および0.04 μg/mL CRP-XL(3.70 LogFU)で5分間の刺激後の最大フィブリノーゲン結合を比較すると、両方のアゴニストは同量の結合フィブリノーゲンをもたらしました(図5A)。フィブリノーゲン結合の最大速度はさらに小さな差を示しており(0.04 μM ADP - 0.0050 LogFU/分、0.04 μg/mL CRP-XL - 0.0054 LogFU/分)、これら2つの刺激間でフィブリノーゲン結合の全体的な速度が類似していることを示しています(図5B)。しかし、血小板活性化の遅延時間を比較すると、CRP-XL(最大速度まで117秒)がADP(最大速度まで47秒)よりもはるかに遅い速度で加速していることを示す明確な違いがあります(図5C)。したがって、ADP 刺激は、CRP-XL と比較して、はるかに速い初期反応 (P < 0.001) をもたらすことが明らかになります。一緒に観察すると、2つの異なるアゴニストに応答した血小板動態のこれらの測定値は、ADP刺激に対する迅速な初期反応を示しており、これはゆっくりと加速し、一定の速度で維持されます。対照的に、CRP-XL刺激は、活性化の初期速度が遅く、それがかなり遅い時間に急速に加速し、最終的にはADPと同様の全体的な速度とフィブリノーゲン結合レベルにつながります。フィブリノーゲン結合の最大レベル、速度、および加速の間のこれらの違いは、血小板が活性化される速度の測定に多くのパラメータが関与していることを示しています。リアルタイムアッセイとKinetx解析では、これらのパラメータを測定および比較し、受容体感作から血小板応答までの時間を記述し、これを異なるシグナル伝達経路間で比較することができます。
アゴニスト濃度の増加は、血小板へのフィブリノーゲン結合速度に有意な影響を与えません。しかし、フィブリノーゲン結合の最大速度に達するまでの時間は、アゴニスト濃度が増加するにつれて減少するため、血小板は一定の速度でフィブリノーゲンに結合し、受容体飽和度は血小板がフィブリノーゲンに結合する速度により顕著な役割を果たしていることが示唆されています。
記載されているカルシウムフラックスアッセイと分析は、迅速かつ簡単に実行できるカルシウムアッセイであり、リアルタイムアッセイに追加のサンプルとして組み込むことができ、同じサンプルランでカルシウムと血小板フィブリノーゲンの結合とP-セレクチンの分析を可能にします。特注の分析パッケージは、応答の形状、最大応答、最大応答までの時間など、カルシウムフラックス速度の詳細な評価を提供します。次に、これらのパラメータを、ドナー間の変動やさまざまな医薬品に対する応答性について比較できます。血小板中のカルシウムフラックスは、これまでに、さまざまなフローサイトメトリーベースのアッセイを用いて血小板で研究されてきた17,18,19。Aliottaら14は、複数の細胞内イオンの動態を分析できるエレガントなアッセイについて説明しています。ここで紹介するカルシウムアッセイは、以前に発表されたアッセイをベースに、分析パッケージを追加することで、柔軟性を高め、データをより詳細に探索し、短期間で複数のドナーがハイスループット分析できるという利点を提供します。
これまでの研究では、特定のシグナル伝達分子の阻害または不在が血小板活性化率の変化をもたらし、それが血栓形成に直接つながることが実証されています8,9。過去には、血小板活性化動態は、いくつかの固定された時点にわたるフローサイトメトリーによって測定することができ、その後、例えば、異なるアゴニスト20に対するGPIIbIIIaの外部化の速度を計算し、比較するために使用することができる。この論文で説明されているリアルタイムアッセイとKinetx分析は、安静時血小板からの血小板活性化の速度とエンドポイントの両方を測定するための、シンプルで自由に利用できる正確な方法を提供します。これは、エンドポイントの読み取り値のみが測定された場合に見逃される可能性のある血小板機能の生理学的に関連する変動を特定する上で重要であると思われます。
開示事項
著者は何も開示していません。
謝辞
このプロジェクトは、British Heart Foundation(PG/16/36/31967、RG/20/7/34866、およびRG/15/2/31224)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 9,11-Dideoxy-11α,9α-epoxymethanoprostaglandin F2α - U46619 | Sigma-Aldrich, Poole, UK | D8174-1MG | |
| Accuri C6 flow cytometer with BD Csampler | Beckton Dickinson, UK | 660517 + 660519 | |
| Adenosine diphosphate | Sigma-Aldrich, Poole, UK | A2754-1G | |
| APC-labelled anti-P-selectin (CD62p) | BD Biosciences, UK | 550888 | |
| Corning polypropylene 96-well round-bottomed, non-treated microtitre plate | Sigma-Aldrich, Poole, UK | CLS3879-50EA | |
| Cross-linked collagen related peptide (CRP-XL) | CambCol, UK | ||
| Epinephrine | Sigma-Aldrich, Poole, UK | E4375-1G | |
| FITC-labelled anti-fibrinogen antibody | Dako, Agilent Technologies, UK | F011102-2 | |
| Fluo-4 Direct dye | Thermo-Fisher Scientific | F10472 | |
| Gel loading tips | Starlab, UK | I1022-0600 | |
| Gly-Pro-Arg-Pro peptide | Sigma-Aldrich, Poole, UK | G1895-5MG | |
| Thrombin | Sigma-Aldrich, Poole, UK | SRE0003-10KU | |
| Thrombin receptor activator peptide 6 (TRAP-6) | Bachem, St Helens, UK | H-2936.0005 | |
| Vacuette 9NC coagulation 3.2 % trisodium citrate (0.109 mol/L) | Greiner Bio-one LTD, Stonehouse, UK | 454327 |
参考文献
- Bye, A. P., Unsworth, A. J., Gibbins, J. M. Platelet signaling: a complex interplay between inhibitory and activatory networks. Journal of Thrombosis and Haemostasis: JTH. 14 (5), 918-930 (2016).
- Jones, C. I., Barrett, N. E., Moraes, L. A., Gibbins, J. M., Jackson, D. E. Endogenous inhibitory mechanisms and the regulation of platelet function. Methods in Molecular Biology. 788, 341-366 (2012).
- Paniccia, R., Priora, R., Liotta, A. A., Abbate, R. Platelet function tests: a comparative review. Vascular Health and Risk Management. 11, 133-148 (2015).
- Saboor, M., Moinuddin, M., Ilyas, S. New horizons in platelets flow cytometry. The Malaysian Journal of Medical Sciences : MJMS. 20 (2), 62-66 (2013).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88, 1525-1541 (1996).
- Pasquet, J. M., Noury, M., Nurden, A. T. Evidence that the platelet integrin alphaIIb beta3 is regulated by the integrin-linked kinase, ILK, in a PI3-kinase dependent pathway. Thrombosis and Haemostasis. 88 (1), 115-122 (2002).
- Stevens, J. M., Jordan, P. A., Sage, T., Gibbins, J. M. The regulation of integrin-linked kinase in human platelets: evidence for involvement in the regulation of integrin alpha 2 beta 1. Journal of Thrombosis and Haemostasis: JTH. 2 (8), 1443-1452 (2004).
- Jones, C. I., et al. Integrin-linked kinase regulates the rate of platelet activation and is essential for the formation of stable thrombi. Journal of Thrombosis and Haemostasis: JTH. 12 (8), 1342-1352 (2014).
- Cifuni, S. M., Wagner, D. D., Bergmeier, W. CalDAG-GEFI and protein kinase C represent alternative pathways leading to activation of integrin alphaIIbbeta3 in platelets. Blood. 112 (5), 1696-1703 (2008).
- Stolla, M., et al. The kinetics of alphaIIbbeta3 activation determines the size and stability of thrombi in mice: implications for antiplatelet therapy. Blood. 117 (3), 1005-1013 (2011).
- Kawasaki, H., et al. A Rap guanine nucleotide exchange factor enriched highly in the basal ganglia. Proceedings of the National Academy of Sciences of the United States of America. 95 (22), 13278-13283 (1998).
- . R Available from: https://www.r-project.org/ (2021)
- . R Studio Available from: https://rstudio.com/products/rstudio/download/ (2021)
- Yee, D. L., Sun, C. W., Bergeron, A. L., Dong, J. F., Bray, P. F. Aggregometry detects platelet hyperreactivity in healthy individuals. Blood. 106 (8), 2723-2729 (2005).
- Panzer, S., Hocker, L., Koren, D. Agonists-induced platelet activation varies considerably in healthy male individuals: studies by flow cytometry. Annals of Hematology. 85 (2), 121-125 (2006).
- Aliotta, A., Bertaggia Calderara, D., Alberio, L. Flow cytometric monitoring of dynamic cytosolic calcium, sodium, and potassium fluxes following platelet activation. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 97 (9), 933-944 (2020).
- do Ceu Monteiro, M., Sansonetty, F., Goncalves, M. J., O'Connor, J. E. Flow cytometric kinetic assay of calcium mobilization in whole blood platelets using Fluo-3 and CD41. Cytometry. 35 (4), 302-310 (1999).
- Vines, A., McBean, G. J., Blanco-Fernandez, A. A flow-cytometric method for continuous measurement of intracellular Ca(2+) concentration. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 77 (11), 1091-1097 (2010).
- Weber, A. A., Schror, K. Differential inhibition of adenosine diphosphate- versus thrombin receptor-activating peptide-stimulated platelet fibrinogen binding by abciximab due to different glycoprotein IIb/IIIa activation kinetics. Blood. 98 (5), 1619-1621 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved