Method Article
Kinetx: Ein kombiniertes Software-Framework für Durchflusszytometrie-Assays und -Analysen zur quantitativen Messung und Kategorisierung der Thrombozytenaktivierung in Echtzeit.
In diesem Artikel
Zusammenfassung
Blutplättchen reagieren schnell auf eine Reihe von Reizen. In diesem Artikel werden ein auf Echtzeit-Durchflusszytometrie basierender Thrombozytenfunktionsassay und eine neu entwickelte maßgeschneiderte Open-Source-Software (Kinetx) beschrieben, um quantitative kinetische Messungen der Freisetzung von Thrombozytengranula, der Fibrinogenbindung und des intrazellulären Kalziumflusses zu ermöglichen.
Zusammenfassung
Blutplättchen reagieren schnell auf Gefäßverletzungen und werden als Reaktion auf eine Reihe von Reizen aktiviert, um den Blutverlust zu begrenzen. Viele Thrombozytenfunktionstests messen die Endpunktreaktionen nach einem definierten Zeitraum und nicht die Rate der Thrombozytenaktivierung. Die Geschwindigkeit, mit der Blutplättchen extrazelluläre Reize in eine funktionelle Reaktion umwandeln, ist jedoch ein wesentlicher Faktor bei der Bestimmung, wie effizient sie auf Verletzungen reagieren, an einen sich bildenden Thrombus binden und Signale zur Rekrutierung anderer Blutplättchen geben können. In diesem Artikel wird ein auf Durchflusszytometrie basierender Thrombozytenfunktionsassay beschrieben, der eine gleichzeitige Datenerfassung und Probenstimulation ermöglicht und eine neu entwickelte, maßgeschneiderte Open-Source-Software (Kinetx) verwendet, um quantitative kinetische Messungen der Freisetzung von Thrombozytengranulaten, der Fibrinogenbindung und des intrazellulären Kalziumflusses zu ermöglichen. Kinetix wurde in der Region entwickelt, damit Benutzer Parameter wie den Grad der Glättung, die Identifizierung abgelegener Datenpunkte oder Zeitskalen ändern können. Um Benutzern, die mit der R-Umgebung nicht vertraut sind, zu helfen, kann die Kinetix-Datenanalyse mit einem einzigen Befehl durchgeführt werden. Zusammen ermöglicht dies die genaue und reproduzierbare Messung und Kategorisierung von Thrombozytenaktivierungsmetriken in Echtzeit, wie z. B. Rate, Beschleunigung, Zeit bis zur Spitzenrate, Zeit bis zum Peak-Calcium und qualitative Formänderungen. Kinetische Messungen der Thrombozytenaktivierung geben einen einzigartigen Einblick in das Verhalten von Blutplättchen während der ersten Stadien der Aktivierung und können eine Methode zur Vorhersage der Rekrutierung von Blutplättchen in einen sich bildenden Thrombus liefern.
Einleitung
Blutplättchen spielen eine zentrale Rolle bei der Blutstillung und erzeugen eine schnelle und vielschichtige Reaktion auf Gefäßverletzungen 1,2. Aktuelle Thrombozytenfunktionstests messen verschiedene Aspekte der Thrombozytenreaktivität, die repräsentativ für ihre hämostatische Wirkung in vivo sind. Traditionell wurde die Thrombozytenfunktion mit Endpunkt-Assays bewertet, die die Fibrinogenbindung, die Granulafreisetzung oder die Thrombozytenaggregation in Thrombozyten messen, die lange genug stimuliert wurden, um eine maximale Aktivierung zu erreichen 3,4. Diese Tests berücksichtigen nicht die Zeit, die Blutplättchen benötigen, um extrazelluläre Reize in intrazelluläre Signale und Kalziumfluss umzuwandeln und anschließend zu degranulieren und an den wachsenden Thrombus zu binden. Das Blut fließt mit einer Scherrate von bis zu 20 dyn/cm 3 in Venen und 80 dyn/cm 3 in großen Arterien5, was die Notwendigkeit von Blutplättchen unterstreicht, dieser schnellen Flussrate entgegenzuwirken, indem extrazelluläre Reize schnell erkannt, verarbeitet und darauf reagiert werden, um sich in einen sich bildenden Thrombus zu binden und sein kontinuierliches Wachstum zu unterstützen.
Die Geschwindigkeit der Thrombozytenaktivierung kann unabhängig vom maximalen Ausmaß der Thrombozytenaktivierung variieren. Die Integrin-gebundene Kinase (ILK) ist ein Protein, das an der Regulierung der β1- und β3-Integrine in Blutplättchen beteiligt ist 6,7. Die Hemmung oder spezifische Deletion von ILK in vivo zeigte, dass die Rate, aber nicht das maximale Ausmaß der Thrombozytenaktivierung in Abwesenheit von funktionellem ILK8 beeinflusst wurde. Unterschiede zwischen der Aggregationsrate und dem maximalen Aggregationsniveau wurden auch bei Mäusen mit einem Mangel an CALDAG GEFI 9,10 festgestellt, einem Signalmolekül, das an der Regulation der Inside-Out-Signalübertragung über RAP1 beteiligt ist11.
Diese Ergebnisse zeigen, dass die Thrombozytenrate und die maximalen Aktivierungsniveaus autonom sein können und dass Messungen der maximalen Aktivierung bis zu diesem Zeitpunkt möglicherweise nicht aussagekräftig für das Thrombozytenverhalten sind. Diese Unterschiede in der Zeit, die für die Aktivierung der Blutplättchen benötigt wird, können ihre anfängliche Bindung an den wachsenden Thrombus tiefgreifend beeinflussen und sich auf die Architektur und Gesamtgröße des Thrombus auswirken. Diese Schwankungen zwischen der Thrombozytenrate und der maximalen Aktivierung unterstreichen die Notwendigkeit eines Assays zur genauen Messung der Thrombozytenaktivierungsrate und können zur Erkennung von Varianzen innerhalb der Population verwendet werden.
In diesem Artikel wird eine Methode beschrieben, die die Thrombozytenaktivierung und den Kalziumfluss in Echtzeit genau misst und eine Reihe von Metriken berechnet, einschließlich der Rate, mit der Blutplättchen aktiviert werden, und der Zeit, die Blutplättchen benötigen, um die maximale Aktivierungsrate und den maximalen Kalziumfluss zu erreichen. Diese kinetischen Messungen der Thrombozytenaktivierung geben einen besseren Einblick in das Verhalten von Blutplättchen während der ersten Stadien der Thrombusbildung und bieten eine Methode zur Vorhersage, wie schnell Blutplättchen zu einem sich bildenden Thrombus rekrutiert werden können.
Protokoll
Dieses Protokoll verwendete menschliches Vollblut und Blutplättchen von gesunden Spendern ohne Vorerkrankungen und ohne Medikamente, von denen bekannt ist, dass sie die Thrombozytenfunktion beeinträchtigen, nach schriftlicher Einverständniserklärung und wurde von der Forschungsethikkommission der University of Reading genehmigt.
1. Blutentnahme und Aufbereitung von plättchenreichem Plasma
- Sammeln Sie das periphere Blut in einem Vacutainer, der 3,2 % Natriumcitrat enthält.
- Entsorgen Sie die ersten 3 ml.
- Lassen Sie das Blut vor der Zentrifugation 30 Minuten lang bei 30 °C ruhen.
- Das plättchenreiche Plasma (PRP) wird durch Zentrifugation bei 140 x g für 20 min bei Raumtemperatur vorbereitet, bevor es für die Dauer des Assays bei 37 °C inkubiert wird, die innerhalb von 60 min nach der Zentrifugation abgeschlossen ist.
2. Vorbereitung des Instruments
HINWEIS: Ein druckloses Fluidiksystem ist für die Echtzeit-Durchflusszytometrie unerlässlich, da die Blutplättchen gleichzeitig stimuliert werden, während das Durchflusszytometer Ereignisse aufzeichnet.
- Verwenden Sie ein druckloses Durchflusszytometer, um eine Echtzeit-Durchflusszytometrie durchzuführen.
- Um den Assay bei 37 °C durchzuführen, befestigen Sie eine Maus-Dissektionsmatte an dem Tisch, um die 96-Well-Platte zu platzieren. Erhitzen Sie die Matte für die Dauer des Assays auf 37 °C.
- Legen Sie eine 96-Well-Platte auf die beheizte Matte, um eine kontinuierliche Inkubation bei 37 °C zu ermöglichen (Abbildung 1)
3. Vorbereitung des Assays
- Fibrinogenbindung und P-Selektin-Expression
- Eine unbehandelte Mikrotiterplatte aus Polypropylen mit 96 Well und rundem Boden wird über Nacht bei 4 °C mit 5 % Rinderserumalbumin (BSA) in Hepes-gepufferter Kochsalzlösung (HBS; 10 mM Hepes pH 7,4; 150 mM NaCl, 5 mM KCl, 1 mM MgSO4,7H 20) bestreicht.
- Bereiten Sie die Antikörpermischung in HBS vor, die 5 mM Glukose (HBS-G) enthält. Geben Sie den mit Fluorescein isothiocyanat (FITC) markierten Anti-Fibrinogen-Antikörper (FITC-FGN; Verdünnung 1: 37,5 (v/v)) und das mit Allophycocyanin (APC) markierte Anti-P-Selektin (APC-CD62P; Verdünnung 1: 37,5 (v/v)) zu HBS-G (Endvolumen: 225 μl) und inkubieren Sie in einer 96-Well-Platte bei 37 °C.
- Unmittelbar vor der Entnahme von Ereignissen geben Sie PRP in einer Verdünnung von 1:600 (v/v) zum HBS-G-Antikörpermix.
HINWEIS: Eine geringe Menge an PRP ist erforderlich, um sicherzustellen, dass der Ereignisgrenzwert nicht überschritten wird und die Thrombozytenaggregation in der Probe reduziert wird. Die Thrombozytenverdünnung wurde in Pilotstudien untersucht und hat keinen Einfluss auf die Aktivierungsrate. - Die Aktivierungsmischung aus FITC-FGN (Verdünnung 1: 37,5 (v/v)) und APC-CD62P (Verdünnung 1: 37,5 (v/v)) und Agonist bei 37 °C inkubieren. Zu den Agonisten gehören Thrombin (thr; 0,0012-1 U/ml) in Gegenwart von Gly-Pro-Arg-Pro-Peptid (GPRP; 1,18 mM), vernetztes kollagenverwandtes Peptid (CRP-XL; 0,004-10 μg/ml), Adenosindiphosphat (ADP; 0,04-4 μM), Adrenalin (epi; 20-200 μM), 9,11-Dideoxy-11α,9α-epoxymethanoprostaglandin F2α (U46619; 0,02-5 μM) und Thrombinrezeptor-Aktivatorpeptid 6 (TRAP-6; 0,04-10 μM).
- Calcium-Flussmittel
HINWEIS: Dieser Assay wurde unter Verwendung eines handelsüblichen Calcium-Assay-Kits durchgeführt (Materialtabelle)- Eine unbehandelte Mikrotiterplatte aus Polypropylen mit 96 Well und rundem Boden über Nacht bei 4 °C mit 5 % BSA in Hepes-gepufferter Kochsalzlösung bestreichen.
- Zur Herstellung des Calcium-Assay-Farbstoffs geben Sie 100 ml Calcium-Assay-Puffer und 2 mL Probenecid-Stammlösung (250 mM) in eine Flasche Calciumreagenz, um 2x Calcium-Reagenz-Ladelösung zu erhalten.
- Zur Herstellung von Fluo-4/HBS-G wird der Calcium-Assay-Farbstoff mit HBS-G im Verhältnis 1:1 verdünnt und durch einen 0,22-μM-Filter filtriert. 225 μl Fluo-4/HBS-G werden bei 37 °C in die entsprechenden Vertiefungen einer 96-Well-Platte gegeben.
- PRP bei 37 °C für 30 min in einer 1:1-Verdünnung mit Fluo-4/HBS-G inkubieren.
- Die Aktivierungsmischung in Fluo-4/HBS-G zubereiten und bei 37 °C inkubieren. Zu den Agonisten gehören Thrombin (1 U/ml) in Gegenwart von GPRP, CRP-XL (0,5 μg/ml), ADP (1 μM), Adrenalin (20 μM), U46619 (1 μM) und TRAP-6 (1 μM).
- Unmittelbar vor dem Sammeln von Ereignissen PRP/Fluo-4/HBS-G zu den 225 μl Fluo-4/HBS-G-Mischung in einer abschließenden PRP-Verdünnung (nach Agonistenzugabe) von 1:600 (v/v; 0,5 mL in 300 mL des Endvolumens) hinzufügen.
4. Assay-Verfahren und Datenerhebung
- Stellen Sie das Durchflusszytometer auf eine Flussrate auf "langsam" mit einer durchschnittlichen Anzahl von 1000 Ereignissen pro Sekunde (eps) und einem Maximum von 3000 eps ein. Legen Sie den Schwellenwert auf 20000 fest, um die Aufzeichnung von Zellablagerungen zu vermeiden.
- Gate der Thrombozytenpopulation mit Hilfe von Forward Scatter (FSC) und Side Scatter (SSC) Diagrammen. Für die Datenerfassung ist FSC-A vs. SSC-A zu plotten, um die Thrombozytenpopulation genau zu gaten, und FL1 oder FL4 vs. Zeit, um die Fluoreszenzereignisse im Zeitverlauf aufzuzeichnen.
- Das Durchflusszytometer benötigt 14 s, um mit der Aufzeichnung von Ereignissen zu beginnen. Lassen Sie das Gerät danach weitere 5 s lang Ereignisse in jeder Vertiefung aufzeichnen, bevor Sie schnell 75 μl der Aktivierungsmischung mit einer Gelladespitze hinzufügen, um eine spontane Durchmischung zu gewährleisten (Abbildung 1).
- Sammeln Sie die Ereignisse für 5 Minuten und richten Sie die Diagramme so ein, dass der Kanal 488 (FL1; 533/30 Filter - FITC-Fibrinogen/FLUO-4) über die Zeit und der Kanal 633 (FL4; 675/25 Filter - APC-P-selectin) über die Zeit aufgezeichnet wird.
- Speichern Sie die Diagrammdaten für die Kanäle 488 und 633 aus jedem Well als CSV-Dateien.
5. Datenanalyse
- Laden Sie die neueste Version von Kinetx12 herunter.
HINWEIS: Der Download enthält den gesamten Code, der zur Analyse der aus dem Assay generierten Daten erforderlich ist, und wird von einem Testsatz experimenteller Daten von zehn Spendern und Ergebnissen ihrer Analyse begleitet (diese Ergebnisse können über die folgenden Verfahren regeneriert und validiert werden) (Abbildung 2). - Einrichten der R-Umgebung
- Nutzen Sie die Programmiersprache R über die RStudio-Umgebung. Installieren Sie R13, RStudio14 und die folgenden Pakete: ggplot2, dplyr, plotrix, minpack.lm, tidyverse, psych. Stellen Sie sicher, dass alle erforderlichen Pakete erfolgreich installiert wurden.
- Metadaten erstellen: Platzieren Sie eine Textdatei (genannt wellData.txt) im selben Verzeichnis wie die Daten. Es beschreibt die Agonisten, ihre Konzentrationen, etwaige Antikörper und den Assay (Funktion oder Kalzium), der zur Generierung jeder CSV-Datei verwendet wird.
- Legen Sie eine zweite Textdatei ('IsotypeData.txt') in das gleiche Verzeichnis und definieren Sie die Isotypen. Die im Download bereitgestellten Dateien ("data/wellData.txt" und "data/IsotypeData.txt") können als Vorlage dienen und können leicht an alternative Agonisten, Inhibitoren und Konzentrationen angepasst werden.
- Analysieren Sie die Daten: Kinetx besteht aus drei Funktionen, die in den Schritten 5.2.5-5.2.7 definiert sind.
- kinetxProcess.R: Diese Funktion verarbeitet die Rohdaten der funktionellen Durchflusszytometrie. Geben Sie zum Ausführen den Typ kinetxProcess('data location','where to put outputs','FL1' (für FITC-Antifibrinogen oder 'FL4' (für APC-CD62P) ein.
- kinetxProcessCalcium.R: Diese Funktion analysiert und markiert die Daten des Kalziumflusses. Geben Sie zum Ausführen den Typ kinetxProcessCalcium('data location','where to put outputs','FL1') aus
- kinetxSummary.R: Diese Funktion fasst die Daten zusammen. Geben Sie zum Ausführen den Typ kinetxSummary('data location','where to put outputs','FL1') ein.
- Um alle oben genannten Funktionen (5.2.5-5.2.7) auf den Testdaten auszuführen, verwenden Sie das Skript (test. R).
HINWEIS: Die ersten beiden Funktionen erzeugen für jeden Spender Zahlen, die die Rohdaten plus die angepassten Kurven anzeigen. Alle Ausgaben und eine Tabelle, in der die Daten zusammengefasst sind, werden am Ausgabeort abgelegt.
Ergebnisse
Die Analyse der funktionellen Echtzeit-Durchflusszytometrie zeigt Unterschiede in der Form der Aktivierungskurven zwischen Agonisten und zwischen Spendern
Die Datenanalyse der funktionellen Daten (P-Selektin-Belichtung und Fibrinogenbindung) mit Kinetx entfernt Datenpunkte, die außerhalb des vernünftigen Bereichs (>200000 oder <1) und <2,80 s liegen (die Zeit wird auf diesen Punkt eingestellt), normalisiert die Daten auf den Median der Isotypen und passt eine glatte gleitende Durchschnittskurve an (über die Funktion Loess). Kinetx weist auch Metriken und Kategorien zu, die auf der angepassten geglätteten Linienform, den absoluten Werten und den Änderungsraten wie folgt basieren: (1) RoC - durchschnittlicher Anstieg der geglätteten Linie in den ersten 120 s; (2) Beschriftung - kategorisiert Antworten als schnell, mittel oder langsam, die gemäß den Grenzwerten von 40 und 80 für FL1 und 5 und 10 für FL4 festgelegt werden; (3) EarlyRoC - durchschnittlicher Anstieg der geglätteten Linie in den ersten 20 s; (4) Shape - Low Responder, zunehmend, linear oder abnehmend (Abbildung 3A) - Low Responder werden als FL1 < 4000 oder FL4 < 1000 bestimmt, wobei die Beschriftungen zunehmend, linear und abnehmend basierend auf folgenden Faktoren bestimmt werden: shapeMetric - RoC (120 Sekunden)/EarlyRoC, wobei shapeMetric >2 ansteigt, linear shapeMetric zwischen 0,9 und 2 und shapeMetric <0,9 abnimmt; (5) Erstellt eine Tabelle, in der die Daten zusammengefasst sind, indem das Ausmaß und die Änderungsrate bei 0 s, 10 s, 20 s, 30 s, 40 s, 60 s, 90 s, 120 s, 180 s, der Isotyp-Median, die maximalen und minimalen Änderungs- und Beschleunigungsraten sowie alle Bezeichnungen und Kategorien angegeben werden.
Die Thrombozytenfibrinogenbindung und die P-Selektin-Exposition über 5 Minuten nach der Aktivierung als Reaktion auf eine Einzelkonzentration der Agonisten ADP, TRAP-6, CRP-XL, Adrenalin und U46617 wurden bei 30 Spendern analysiert. Die Metriken für die Fibrinogenbindung und die P-Selektin-Exposition als Reaktion auf verschiedene Agonisten zeigen erhebliche Unterschiede in der Form der Reaktion (Abbildung 3). Thrombozyten, die mit TRAP-6 und ADP stimuliert wurden, zeigten eine schnellere Beschleunigung der Fibrinogenbindung, die sich bei vielen Spendern zu späteren Zeitpunkten verlangsamte (Abbildung 3B). Es war wahrscheinlicher, dass die Fibrinogenbindung als Reaktion auf CRP-XL, Thrombin und Adrenalin eine zunehmende oder lineare Reaktionsrate zeigte. Viele Spender zeigten eine relativ lange Verzögerung für CRP-XL, bevor sich die Rate der Fibrinogenbindung schnell beschleunigte. Die Reaktion auf U46619 wurde oft als niedrig eingestuft. Im Gegensatz dazu zeigte die P-Selektin-Exposition mit größerer Wahrscheinlichkeit eine lineare oder zunehmende Ansprechrate auf alle Agonisten mit Ausnahme von U46619, das wiederum ein niedriges Ansprechverhalten aufwies (Abbildung 3C).
Der intrazelluläre Kalziumfluss während der Thrombozytenaktivierung kann mit Hilfe der Echtzeit-Durchflusszytometrie genau gemessen werden
Bei der Datenanalyse des Calciumfluss-Assays werden Datenpunkte entfernt, die außerhalb des vernünftigen Bereichs liegen (< 2,80 s Nullzeit wird bis zu diesem Punkt eingestellt) und dann eine glatte gleitende Durchschnittskurve angepasst (über die Funktion Loess). Kinetx weist Metriken zu, und Kategorien werden basierend auf der Form der angepassten glatten Linien, den absoluten Werten und den Änderungsraten wie folgt zugewiesen: (1) Kategorie - beschreibt die Form der Kalziumreaktion basierend auf dem frühen Anstieg, dem Maximum und dem endgültigen Abfall vom Maximum, beschrieben als linear, spitz oder anhaltend (Abbildung 4A); (2) Rate - beschreibt die Änderungsrate in den schnellen 30 s und ist definiert als keine Änderung, langsam, mittel oder schnell (mit Cut-off bei 10, 40 und 80). Kinetx erstellt auch eine Tabelle, in der die Daten zusammengefasst sind, indem es das Ausmaß und die Änderungsrate bei 0 s, 10 s, 20 s, 30 s, 40 s, 60 s, 90 s, 120 s, 180 s, die maximalen und minimalen Änderungs- und Beschleunigungsraten sowie alle Bezeichnungen und Kategorien bereitstellt und eine Zahl der Daten für jeden Spender erstellt. Beispiele für den Kalziumfluss, die mit dieser Methode bei 30 Personen gemessen wurden, zeigten wiederum unterschiedliche Aktivierungsmuster zwischen Individuen und Agonisten (Abbildung 4B). CRP-XL zeigte überwiegend eine anhaltende Kalziumreaktion, während die Reaktion auf TRAP-6 am häufigsten eine Spitzenreaktion zeigte. Alle anderen Agonisten erzeugten eine überwiegend lineare Reaktion.
Die Echtzeit-Durchflusszytometrie identifiziert Unterschiede in den maximalen Aktivierungsniveaus als Reaktion auf unterschiedliche Agonisten und Konzentrationen
Die Ergebnisse zeigen, dass der Echtzeit-Durchflusszytometrie-Assay in der Lage ist, Unterschiede in den maximalen Konzentrationen der Fibrinogenbindung (Abbildung 5A) und der P-Selektin-Exposition (Abbildung 5D) als Reaktion auf die Stimulation über verschiedene Rezeptoren zu erkennen (10 μg/mL CRP-XL vs. 3 U/ml Thrombin P < 0,001; 10 μg/mL CRP-XL vs. 1 U/ml Thrombin P < 0,001). Sie zeigen auch, dass der Assay empfindlich auf Unterschiede in der Agonistenkonzentration reagiert, wobei die maximale Fibrinogenbindung und die P-Selektin-Exposition als Reaktion auf höhere Agonistenkonzentrationen erhöht sind (Fibrinogenbindung - CRP-XL - 0,004 μg/ml vs. 0,4, 5, 10 μg/ml, P < 0,01; Thrombin - 0,0012 U/ml vs. 1 und 3 U/ml, P < 0,01; ADP - 0,04 μg/mL vs. 1 und 4 μM, P < 0,05).
Der Echtzeit-Durchflusszytometrie-Assay ist empfindlich genug, um die Variabilität der Thrombozytenaktivierungsrate bei Spendern zu erkennen
Die maximale Rate der Thrombozytenaktivierung wurde bestimmt, indem ein geglätteter gleitender Durchschnitt (Löss) an die Fluoreszenzdaten angepasst und dieser dann zur Berechnung der maximalen Rate der Fibrinogenbindung und der P-Selektin-Exposition verwendet wurde (Abbildung 5B,E). Die Daten zeigen eine beträchtliche Variation zwischen den einzelnen Spendern, und der Durchflusszytometrie-Assay ist empfindlich genug, um diese Variation zu erkennen. Die Ergebnisse deuten darauf hin, dass eine Erhöhung der Agonistenkonzentration nur einen geringen Einfluss auf die maximale Rate der Fibrinogenbindung hat (Abbildung 5B). Im Gegensatz dazu steigt die maximale Rate der P-Selektin-Exposition mit zunehmender Thrombin- und CRP-XL-Konzentration, nicht jedoch mit steigenden ADP-Konzentrationen (Abbildung 5E).
Schwankungen in der Verzögerungszeit der Thrombozytenaktivierung können mit Hilfe der Echtzeit-Durchflusszytometrie nachgewiesen werden
Die Zeit bis zur maximalen Rate der Thrombozytenaktivierung wurde durch Berechnung der Zeitpunkte bestimmt, zu denen die maximale Rate der Fibrinogenbindung und der P-Selektin-Exposition erreicht wurde (Abbildung 5C,F). Die maximale Rate der Fibrinogenbindung und der P-Selektin-Exposition variiert zwischen den Donatoren, insbesondere bei niedrigeren Agonistenkonzentrationen. Die Stimulation von Blutplättchen mit steigenden Konzentrationen von CRP-XL zeigt, dass höhere Agonistenkonzentrationen weniger Zeit benötigen, um die maximale Rate der Fibrinogenbindung zu erreichen, mit geringerer Variabilität zwischen den Spendern; dieser Trend ist jedoch weder bei der Thrombin- noch bei der ADP-Stimulation zu beobachten (Abbildung 5C). Der Assay zeigt, dass unter bestimmten Umständen eine Erhöhung der Agonistenkonzentration die Zeit bis zum Beginn der Thrombozytenaktivierung (Verzögerungszeit) verkürzt, ohne die maximale Rate der Thrombozytenaktivierung zu verändern, und dass beide Messungen mit diesem Assay beurteilt werden können.
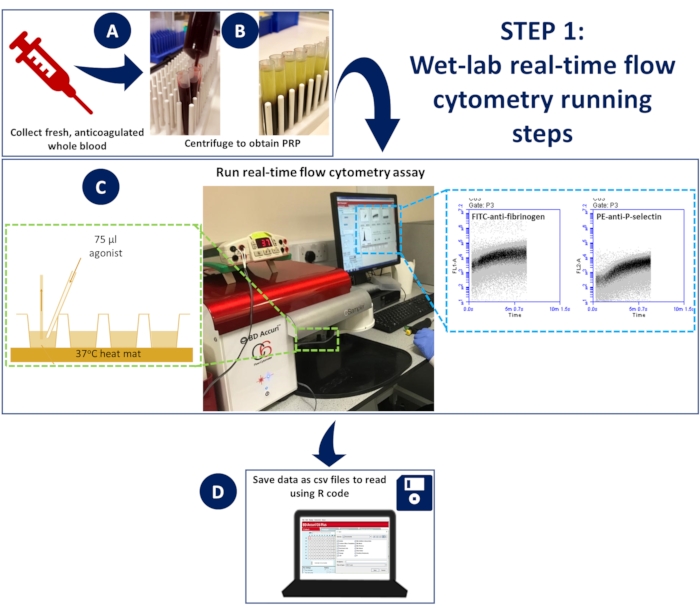
Abbildung 1: Echtzeit-Durchflusszytometrie im Nasslabor. (A) antikoaguliertes Vollblut wurde zentrifugiert, um plättchenreiches Plasma (PRP) zu erhalten. (C) Verdünntes PRP, das geeignete Antikörper oder Kalziumindikatorfarbstoffe enthielt, wurde in eine 96-Well-Platte gegeben, auf ein druckloses Durchflusszytometer geladen und unter Verwendung einer Dissektionsmatte bei 37 °C gehalten. Die Proben wurden während der Entnahme mit einer Aktivierungsmischung stimuliert, die Antikörper oder Kalziumfarbstoff und Agonisten enthielt und mit einer Gelladespitze schnell in die Vertiefung gegeben wurde, um eine spontane Durchmischung zu gewährleisten. (D) Ereignisse wurden 5 Minuten lang erfasst, und es wurden CSV-Dateien mit den Daten für jedes Bohrloch gespeichert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
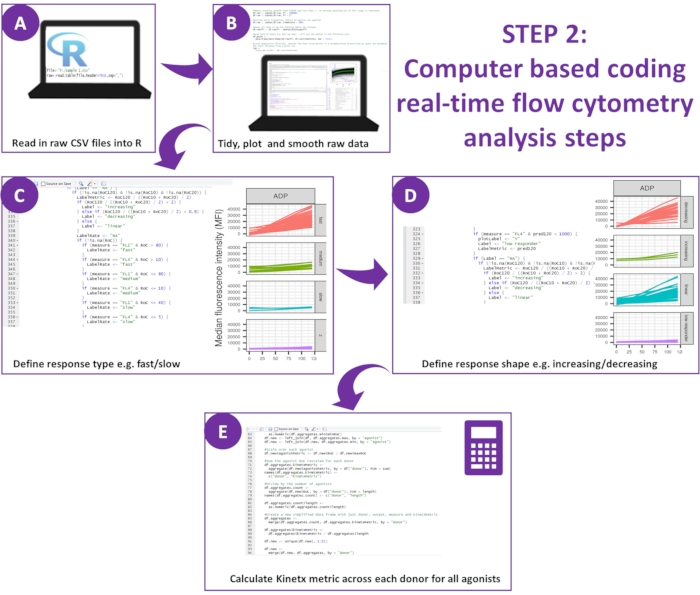
Abbildung 2: Schematische Darstellung der Datenanalyse. (A) Die R-Umgebung wurde konfiguriert, und Metadaten wurden erstellt. (B) Ausgehende Daten wurden entfernt und eine glatte gleitende Durchschnittskurve (Löss) angepasst. (C) Der Antworttyp und (D) die Antwortform wurden definiert. (E) Für jeden Spender wurden Metriken berechnet, exportiert und Zahlen generiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
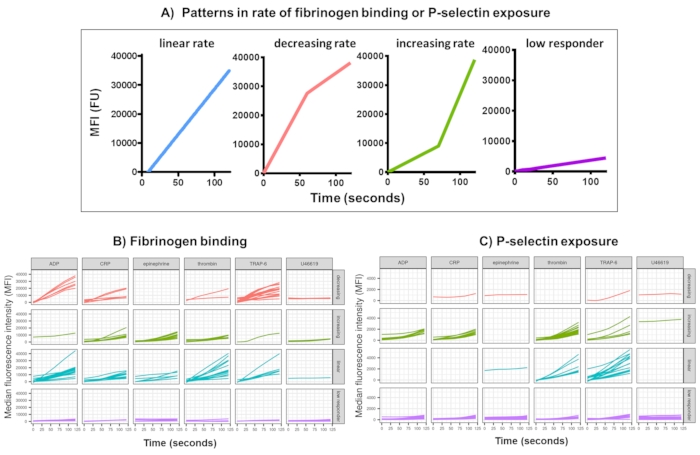
Abbildung 3: Repräsentatives Ergebnis der Kinetx-Analyse der Echtzeit-Thrombozytenfibrinogenbindung und der P-Selektin-Expression. (A) Neben der Bereitstellung von Metriken wie der maximalen Änderungsrate (RoC) und dem RoC zu verschiedenen Zeitpunkten kategorisiert Kinetx auch die Form der Kurve, um zusätzliche Informationen über die Aktivierung von Blutplättchen zu liefern, die nur schwer in einer einzigen Metrik erfasst werden können. Repräsentative Daten für 30 Personen zeigen die typische Variation der Echtzeit-Thrombozytenbindung (B) Fibrinogen und der (C) P-Selektin-Expression als Reaktion auf die Agonisten ADP, TRAP-6, CRL-XL, Adrenalin und U46617. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
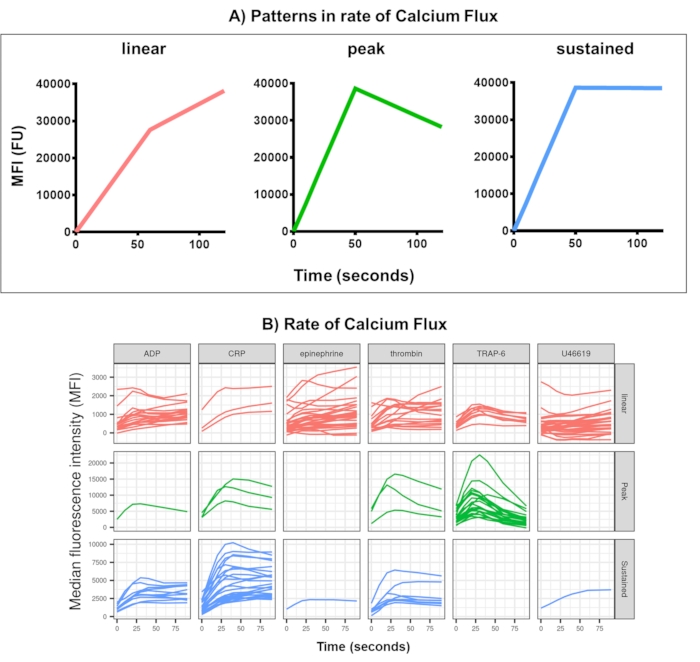
Abbildung 4: Repräsentatives Ergebnis der Kinetx-Analyse des Echtzeit-Thrombozyten-Calciumflusses. (A) Neben Metriken wie der maximalen Änderungsrate (RoC) und dem RoC zu verschiedenen Zeitpunkten kategorisiert Kinetx auch die Form der Calciumflusskurve, um zusätzliche Informationen über die Aktivierung von Thrombozyten zu liefern, die in einer einzigen Metrik schwer zu erfassen sind. Repräsentative Daten für 30 Personen zeigen die typische Variation, die im Echtzeit-Thrombozyten-Kalziumfluss (B) als Reaktion auf die Agonisten ADP, TRAP-6, CRL-XL, Adrenalin und U46617 beobachtet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
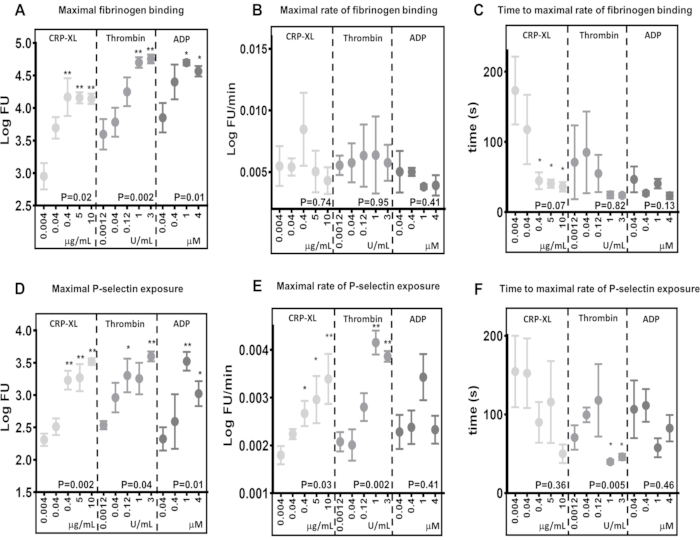
Abbildung 5: Die Agonistenkonzentration bestimmt die maximale Thrombozytenaktivierung, nicht jedoch die Rate der Thrombozytenaktivierung. Die maximale Thrombozytenaktivierung - Fibrinogenbindung (A) oder P-Selektin-Exposition (D) - wurde durch die Agonistenkonzentration (CRP-XL, Thrombin oder ADP) signifikant positiv verändert. Die Rate der Thrombozytenaktivierung (B und E) und die Zeit bis zur maximalen Rate der Thrombozytenaktivierung (C und F) zeigten entweder keinen oder einen schwächeren Zusammenhang mit der sich ändernden Agonistenkonzentration. P-Werte zeigen die Signifikanz über den gesamten Konzentrationsbereich an (Kruskal-Wallis-Test), und Sternchen zeigen eine signifikante Differenz (Mehrfachvergleichstest) von Einzelwerten zur niedrigsten Konzentration an. * P < 0,05, ** P < 0,01. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Geschwindigkeit, mit der Blutplättchen aktivierende Reize erkennen, verarbeiten und darauf reagieren, kann eine wesentliche Determinante für die Thrombusbildung sein. Frühere Studien haben gezeigt, dass die Hemmung von Signalelementen, die die Rate, aber nicht das endgültige Ausmaß der Thrombozytenaktivierung beeinflussen, zur Bildung von instabilen Thrombenführt 8. Viele Thrombozytenfunktionsassays messen das Ausmaß der Thrombozytenaktivierung und -aggregation als Reaktion auf verschiedene Bedingungen und Behandlungen. Dabei wird jedoch nicht berücksichtigt, mit welcher Geschwindigkeit die Blutplättchen aktiviert werden, und wie lange es dauert, bis dieser komplexe Prozess abläuft 3,4. Die hier entwickelten innovativen durchflusszytometrischen Assays überwachen reproduzierbar die Thrombozytenaktivierung im Laufe der Zeit und übersetzen diese in eine Reihe von Metriken, um die maximale Rate der Thrombozytenaktivierung und die Zeit zu berechnen, die die Thrombozyten benötigen, um diese maximale Rate zu erreichen und vollständig aktiviert zu werden.
Die vorgestellten Daten unterstreichen die Fähigkeit des Echtzeit-Assays, Variationen zwischen verschiedenen Reaktionen auf Agonistentyp und -konzentration sowie zwischen Individuen zu identifizieren. Viele frühere Berichte haben gezeigt, dass die Thrombozytenreaktivität bei normalen Personen sehr unterschiedlich ist15,16, was darauf hindeutet, dass die Rate der Thrombozytenaktivierung auch innerhalb der Population erheblich variieren kann. Die Daten aus dieser Studie zeigen, dass die Rate der Degranulation und der Fibrinogenbindung an die Blutplättchen noch variabler zu sein scheint als die maximalen Niveaus der Thrombozytenaktivierung. Dies zeigt, dass die Echtzeit-Durchflusszytometrie auch als wertvolles und zuverlässiges Werkzeug genutzt werden kann, um Varianzen in der Thrombozytenrate in der Bevölkerung zu identifizieren und die Auswirkungen verschiedener inhibitorischer oder proaktivatorischer Wirkstoffe auf die Thrombozytenrate als zusätzliches Mittel zur Messung der Thrombozytenfunktion zu erkennen.
Bei der Messung der Thrombozytenfunktion mit Endpunkt-Assays können Vergleiche über das Ausmaß der Fibrinogenbindung oder der Granulafreisetzung zwischen verschiedenen Agonisten angestellt werden. Die Lösskurven, die die Fibrinogenbindung über die ersten 5 Minuten der Thrombozytenaktivierung vergleichen, zeigen die Fähigkeit des Echtzeit-Assays, mehr Details in den Unterschieden in der Thrombozytenaktivierungskinetik herauszukitzeln, die mit Single-Endpoint-Assays nicht gemessen werden können.
Die mit dem Echtzeit-Assay gesammelten Daten zeigen, dass die Geschwindigkeit, mit der Fibrinogen an Blutplättchen bindet, je nach Aktivierungsweg einem leicht unterschiedlichen Muster folgt (Abbildung 3). Um die Kinetik der Thrombozytenaktivierung genau beurteilen zu können, ist es wichtig, ein druckloses Durchflusszytometer zu verwenden, das eine gleichzeitige Datenerfassung und Probenstimulation ermöglicht. Es ist auch wichtig, dass die Agonisten schnell hinzugefügt werden, um eine nahezu sofortige und vollständige Vermischung von Agonisten und Blutplättchen zu gewährleisten. Die Stimulation mit Thrombin, ADP und Adrenalin erzeugt eine ähnliche Kurve, die eine schnelle Initiierung der Signalübertragung als Reaktion auf die Rezeptorsensibilisierung darstellt, was zu einer schnellen und gleichmäßigen Bindung des Fibrinogens an die Blutplättchen führt. Im Gegensatz dazu binden Blutplättchen, die durch CRP-XL stimuliert werden, nach anfänglicher Rezeptorsensibilisierung zunächst sehr langsam an Fibrinogen; Die Bindungsrate des Fibrinogens wird dann jedoch nach dieser anfänglichen Verzögerung schnell erhöht. Die Thrombozytenstimulation mit U46619, einem Mimetikum von TXA2, führt zu einer schnellen Anfangsrate der Fibrinogenbindung, die schnell auf eine sehr langsame Rate abnimmt, was zu einer nur geringen und stetigen Zunahme der Fibrinogenbindung im Laufe der Zeit führt.
Kinetx wurde so konzipiert, dass es Open Source, reproduzierbar und einfach zu implementieren ist, um Probleme mit proprietärer Software, wie z. B. Kosten und Inflexibilität, zu umgehen. Als solches musste es mit einer Software entwickelt werden, die nicht proprietär war. R wurde ausgewählt, da es von Biologen häufig verwendet wird, einfach zu installieren, kostenlos und Open Source ist. Diese Open-Source-Umgebung ermöglicht es Benutzern, die sich mit R auskennen, Parameter wie den Grad der Glättung, die Identifizierung abgelegener Datenpunkte oder Zeitskalen zu ändern. Um Forschern zu helfen, die mit R nicht vertraut sind, wurde Kinetix jedoch auch so entwickelt, dass die Analyse über einen einzigen Befehl (entweder kinetxProcess oder kinetxProcessCalcium, je nach den zu analysierenden Daten) durchgeführt werden kann. Die hier demonstrierte Kinetix-Software kann eine Reihe von Metriken berechnen, einschließlich der Werte für die maximalen Niveaus, die Rate und die Beschleunigung der Fibrinogenbindung oder der P-Selektin-Exposition sowie die Zeitpunkte, zu denen diese Maximalwerte auftreten. Die Kinetik der Thrombozytenaktivierung als Reaktion auf verschiedene Stimulationswege kann anhand dieser Zahlen genauer verglichen werden.
Vergleiche zwischen verschiedenen agonistischen Stimulationen in den maximalen Konzentrationen der Fibrinogenbindung und den Raten der Fibrinogenbindung an Blutplättchen sind gute Beispiele dafür, wo die Rate der Thrombozytenaktivierung unabhängig von der maximalen Bindung variieren kann. Vergleicht man die maximale Fibrinogenbindung nach 5 Minuten Stimulation mit 0,04 μM ADP (3,85 LogFU) und 0,04 μg/mL CRP-XL (3,70 LogFU), so haben beide Agonisten zu einer ähnlichen Menge an gebundenem Fibrinogen geführt (Abbildung 5A). Die maximalen Bindungsraten von Fibrinogen zeigen einen noch geringeren Unterschied (0,04 μM ADP - 0,0050 LogFU/Minute; 0,04 μg/mL CRP-XL - 0,0054 LogFU/min), was darauf hindeutet, dass die Gesamtrate der Fibrinogenbindung zwischen diesen beiden Stimulationen ähnlich ist (Abbildung 5B). Vergleicht man jedoch die Verzögerungszeit der Thrombozytenaktivierung, so zeigt sich ein deutlicher Unterschied, der zeigt, dass CRP-XL (117 s bis zur maximalen Rate) viel langsamer beschleunigt als ADP (47 s bis zur maximalen Rate) (Abbildung 5C). Somit wird deutlich, dass die ADP-Stimulation im Vergleich zu CRP-XL zu einer viel schnelleren Erstreaktion (P < 0,001) führt. Wenn diese Messungen der Thrombozytenkinetik als Reaktion auf zwei verschiedene Agonisten zusammen betrachtet werden, beschreiben sie eine schnelle anfängliche Reaktion auf die ADP-Stimulation, die sich langsam beschleunigt und mit einer konstanten Rate bleibt. Im Gegensatz dazu führt die CRP-XL-Stimulation zu einer langsamen anfänglichen Aktivierungsrate, die sich zu einem viel späteren Zeitpunkt schnell beschleunigt und schließlich zu einer ähnlichen Gesamtrate und einem ähnlichen Maß an Fibrinogenbindung wie ADP führt. Diese Unterschiede zwischen den maximalen Werten, der Geschwindigkeit und der Beschleunigung der Fibrinogenbindung zeigen, dass eine Reihe von Parametern daran beteiligt sind, zu messen, wie schnell Blutplättchen aktiviert werden. Der Echtzeit-Assay und die Kinetx-Analyse können diese Parameter messen und vergleichen, die Zeit von der Rezeptorsensibilisierung bis zur Thrombozytenantwort beschreiben und zwischen verschiedenen Signalwegen vergleichen.
Eine Erhöhung der Agonistenkonzentration hat keinen signifikanten Einfluss auf die Geschwindigkeit der Fibrinogenbindung an Blutplättchen. Die Zeit, die benötigt wird, um die maximale Rate der Fibrinogenbindung zu erreichen, nimmt jedoch mit zunehmender Agonistenkonzentration ab, was darauf hindeutet, dass Blutplättchen Fibrinogen mit einer konstanten Rate binden und die Rezeptorsättigung eine wichtigere Rolle dabei spielt, wie schnell Blutplättchen Fibrinogen binden.
Bei dem beschriebenen Calciumfluss-Assay und der beschriebenen Analyse handelt es sich um einen schnell und einfach durchzuführenden Calcium-Assay, der als zusätzliche Proben in den Echtzeit-Assay integriert werden kann und die Analyse der Calcium- und Thrombozyten-Fibrinogenbindung und des P-Selektins in demselben Probenlauf ermöglicht. Das maßgeschneiderte Analysepaket bietet eine detaillierte Bewertung der Kinetik des Kalziumflusses, einschließlich der Form der Reaktion, der maximalen Reaktion und der Zeit bis zur maximalen Reaktion. Diese Parameter können dann verglichen werden, um sie zwischen den Spendern zu variieren und auf verschiedene pharmazeutische Wirkstoffe zu reagieren. Der Kalziumfluss in Blutplättchen wurde zuvor in Blutplättchen mit einer Vielzahl von durchflusszytometrischen Assays untersucht 17,18,19. Aliotta et al.14 beschreiben einen eleganten Assay, der in der Lage ist, die Kinetik mehrerer intrazellulärer Ionen zu analysieren. Der hier vorgestellte Calcium-Assay baut auf diesen zuvor veröffentlichten Assays auf, indem er das Analysepaket enthält, das eine größere Flexibilität, eine tiefere Exploration der Daten mit dem Vorteil einer Hochdurchsatz-Analyse für mehrere Spender in einem kurzen Zeitrahmen ermöglicht.
Frühere Studien haben gezeigt, dass die Hemmung oder Abwesenheit bestimmter Signalmoleküle zu einer veränderten Thrombozytenaktivierungsrate führt, was sich direkt in der Thrombusbildung niederschlägt 8,9. In der Vergangenheit konnte die Thrombozytenaktivierungskinetik mittels Durchflusszytometrie über eine Reihe von festen Zeitpunkten gemessen werden, die dann verwendet werden können, um beispielsweise die Rate der GPIIbIIIa-Externalisation als Reaktion auf verschiedene Agonisten zu berechnen und zu vergleichen20. Der in diesem Artikel beschriebene Echtzeit-Assay und die Kinetx-Analyse bieten eine einfache, frei verfügbare und genaue Methode zur Messung sowohl der Rate als auch des Endpunkts der Thrombozytenaktivierung von ruhenden Thrombozyten. Dies ist wahrscheinlich wichtig, um physiologisch relevante Variationen der Thrombozytenfunktion zu identifizieren, die möglicherweise übersehen werden, wenn nur Endpunktwerte gemessen werden.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Dieses Projekt wurde von der British Heart Foundation unterstützt (PG/16/36/31967, RG/20/7/34866 und RG/15/2/31224).
Materialien
| Name | Company | Catalog Number | Comments |
| 9,11-Dideoxy-11α,9α-epoxymethanoprostaglandin F2α - U46619 | Sigma-Aldrich, Poole, UK | D8174-1MG | |
| Accuri C6 flow cytometer with BD Csampler | Beckton Dickinson, UK | 660517 + 660519 | |
| Adenosine diphosphate | Sigma-Aldrich, Poole, UK | A2754-1G | |
| APC-labelled anti-P-selectin (CD62p) | BD Biosciences, UK | 550888 | |
| Corning polypropylene 96-well round-bottomed, non-treated microtitre plate | Sigma-Aldrich, Poole, UK | CLS3879-50EA | |
| Cross-linked collagen related peptide (CRP-XL) | CambCol, UK | ||
| Epinephrine | Sigma-Aldrich, Poole, UK | E4375-1G | |
| FITC-labelled anti-fibrinogen antibody | Dako, Agilent Technologies, UK | F011102-2 | |
| Fluo-4 Direct dye | Thermo-Fisher Scientific | F10472 | |
| Gel loading tips | Starlab, UK | I1022-0600 | |
| Gly-Pro-Arg-Pro peptide | Sigma-Aldrich, Poole, UK | G1895-5MG | |
| Thrombin | Sigma-Aldrich, Poole, UK | SRE0003-10KU | |
| Thrombin receptor activator peptide 6 (TRAP-6) | Bachem, St Helens, UK | H-2936.0005 | |
| Vacuette 9NC coagulation 3.2 % trisodium citrate (0.109 mol/L) | Greiner Bio-one LTD, Stonehouse, UK | 454327 |
Referenzen
- Bye, A. P., Unsworth, A. J., Gibbins, J. M. Platelet signaling: a complex interplay between inhibitory and activatory networks. Journal of Thrombosis and Haemostasis: JTH. 14 (5), 918-930 (2016).
- Jones, C. I., Barrett, N. E., Moraes, L. A., Gibbins, J. M., Jackson, D. E. Endogenous inhibitory mechanisms and the regulation of platelet function. Methods in Molecular Biology. 788, 341-366 (2012).
- Paniccia, R., Priora, R., Liotta, A. A., Abbate, R. Platelet function tests: a comparative review. Vascular Health and Risk Management. 11, 133-148 (2015).
- Saboor, M., Moinuddin, M., Ilyas, S. New horizons in platelets flow cytometry. The Malaysian Journal of Medical Sciences : MJMS. 20 (2), 62-66 (2013).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88, 1525-1541 (1996).
- Pasquet, J. M., Noury, M., Nurden, A. T. Evidence that the platelet integrin alphaIIb beta3 is regulated by the integrin-linked kinase, ILK, in a PI3-kinase dependent pathway. Thrombosis and Haemostasis. 88 (1), 115-122 (2002).
- Stevens, J. M., Jordan, P. A., Sage, T., Gibbins, J. M. The regulation of integrin-linked kinase in human platelets: evidence for involvement in the regulation of integrin alpha 2 beta 1. Journal of Thrombosis and Haemostasis: JTH. 2 (8), 1443-1452 (2004).
- Jones, C. I., et al. Integrin-linked kinase regulates the rate of platelet activation and is essential for the formation of stable thrombi. Journal of Thrombosis and Haemostasis: JTH. 12 (8), 1342-1352 (2014).
- Cifuni, S. M., Wagner, D. D., Bergmeier, W. CalDAG-GEFI and protein kinase C represent alternative pathways leading to activation of integrin alphaIIbbeta3 in platelets. Blood. 112 (5), 1696-1703 (2008).
- Stolla, M., et al. The kinetics of alphaIIbbeta3 activation determines the size and stability of thrombi in mice: implications for antiplatelet therapy. Blood. 117 (3), 1005-1013 (2011).
- Kawasaki, H., et al. A Rap guanine nucleotide exchange factor enriched highly in the basal ganglia. Proceedings of the National Academy of Sciences of the United States of America. 95 (22), 13278-13283 (1998).
- . R Available from: https://www.r-project.org/ (2021)
- . R Studio Available from: https://rstudio.com/products/rstudio/download/ (2021)
- Yee, D. L., Sun, C. W., Bergeron, A. L., Dong, J. F., Bray, P. F. Aggregometry detects platelet hyperreactivity in healthy individuals. Blood. 106 (8), 2723-2729 (2005).
- Panzer, S., Hocker, L., Koren, D. Agonists-induced platelet activation varies considerably in healthy male individuals: studies by flow cytometry. Annals of Hematology. 85 (2), 121-125 (2006).
- Aliotta, A., Bertaggia Calderara, D., Alberio, L. Flow cytometric monitoring of dynamic cytosolic calcium, sodium, and potassium fluxes following platelet activation. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 97 (9), 933-944 (2020).
- do Ceu Monteiro, M., Sansonetty, F., Goncalves, M. J., O'Connor, J. E. Flow cytometric kinetic assay of calcium mobilization in whole blood platelets using Fluo-3 and CD41. Cytometry. 35 (4), 302-310 (1999).
- Vines, A., McBean, G. J., Blanco-Fernandez, A. A flow-cytometric method for continuous measurement of intracellular Ca(2+) concentration. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 77 (11), 1091-1097 (2010).
- Weber, A. A., Schror, K. Differential inhibition of adenosine diphosphate- versus thrombin receptor-activating peptide-stimulated platelet fibrinogen binding by abciximab due to different glycoprotein IIb/IIIa activation kinetics. Blood. 98 (5), 1619-1621 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten