Method Article
Kinetx: Программное обеспечение для комбинированного проточного цитометрического анализа и анализа для количественного измерения и категоризации активации тромбоцитов в режиме реального времени.
В этой статье
Резюме
Тромбоциты быстро реагируют на ряд раздражителей. В этой статье описывается анализ функции тромбоцитов на основе проточной цитометрии в реальном времени и недавно разработанное специальное программное обеспечение с открытым исходным кодом (Kinetx) для количественных кинетических измерений высвобождения гранул тромбоцитов, связывания фибриногена и внутриклеточного потока кальция.
Аннотация
Тромбоциты быстро реагируют на повреждение сосудов и активируются в ответ на ряд стимулов для ограничения кровопотери. Многие функциональные тесты тромбоцитов измеряют конечные реакции через определенный период времени, а не скорость активации тромбоцитов. Тем не менее, скорость, с которой тромбоциты преобразуют внеклеточные стимулы в функциональную реакцию, является важным фактором в определении того, насколько эффективно они могут реагировать на травму, связываться с формирующимся тромбом и сигнализировать о привлечении других тромбоцитов. В этой статье описывается анализ функции тромбоцитов на основе проточной цитометрии, который позволяет одновременно получать данные и стимулировать образец, а также использует недавно разработанное специальное программное обеспечение с открытым исходным кодом (Kinetx) для количественных кинетических измерений высвобождения гранул тромбоцитов, связывания фибриногена и внутриклеточного потока кальция. Kinetix был разработан для того, чтобы пользователи могли изменять такие параметры, как степень сглаживания, идентификация отдаленных точек данных или временные шкалы. Чтобы помочь пользователям, незнакомым со средой R, анализ данных Kinetix может быть выполнен с помощью одной команды. В совокупности это позволяет точно и воспроизводимо измерять и категоризировать показатели активации тромбоцитов в режиме реального времени, такие как скорость, ускорение, время достижения пика, время достижения пика кальция и качественные изменения формы. Кинетические измерения активации тромбоцитов дают уникальное представление о поведении тромбоцитов на первых этапах активации и могут обеспечить метод прогнозирования рекрутирования тромбоцитов в формирующийся тромб.
Введение
Тромбоциты играют центральную роль в гемостазе и вызывают быструю и многогранную реакцию на повреждение сосудов 1,2. Современные тесты функции тромбоцитов измеряют различные аспекты реактивности тромбоцитов, отражающие их гемостатическое действие in vivo. Традиционно функцию тромбоцитов оценивали с помощью конечных анализов, которые измеряли связывание фибриногена, высвобождение гранул или агрегацию тромбоцитов в тромбоцитах, стимулированных достаточно долго для достижения максимальной активации 3,4. Эти тесты не учитывают время, затраченное тромбоцитами на преобразование внеклеточных стимулов во внутриклеточные сигналы и поток кальция, а затем дегранулят и связываются с растущим тромбом. Кровь течет со скоростью сдвига до 20 дин/см3 в венах и 80 дин/см3 в крупных артериях5, что подчеркивает необходимость того, чтобы тромбоциты противодействовали этой быстрой скорости потока путем обнаружения, обработки и реагирования на внеклеточные стимулы, чтобы быстро связываться в формирующемся тромбе и поддерживать его непрерывный рост.
Скорость активации тромбоцитов может варьироваться независимо от максимальной степени активации тромбоцитов. Интегрин-связанная киназа (ILK) — белок, участвующий в регуляции β1 и β3 интегринов в тромбоцитах 6,7. Ингибирование или специфическая делеция ILK in vivo показала, что скорость, но не максимальная степень активации тромбоцитов, изменялась при отсутствии функционального ILK8. Различия между скоростью агрегации и максимальным уровнем агрегации также были выявлены у мышей с дефицитом CALDAG GEFI 9,10, сигнальной молекулы, участвующей в регуляции передачи сигналов изнутри-наружу через RAP111.
Эти результаты показывают, что скорость тромбоцитов и максимальные уровни активации могут быть автономными, и что измерения максимальной активации могут не отражать поведение тромбоцитов до этого момента. Эти различия во времени, необходимом для активации тромбоцитов, могут глубоко повлиять на их первоначальное связывание с растущим тромбом, влияя на архитектуру и общий размер тромба. Эти различия между скоростью тромбоцитов и максимальной активацией подчеркивают необходимость анализа для точного измерения скорости активации тромбоцитов и могут быть использованы для обнаружения различий в популяции.
В этой статье описывается метод, который точно измеряет активацию тромбоцитов и поток кальция в режиме реального времени и рассчитывает ряд показателей, включая скорость, с которой тромбоциты активируются, и время, необходимое для достижения тромбоцитами максимальной скорости активации и максимального потока кальция. Эти кинетические измерения активации тромбоцитов дают лучшее представление о поведении тромбоцитов на первых этапах формирования тромба и обеспечивают метод прогнозирования того, как быстро тромбоциты могут быть рекрутированы в формирующийся тромб.
протокол
В этом протоколе использовалась цельная человеческая кровь и тромбоциты от здоровых доноров без сопутствующих заболеваний и без приема каких-либо лекарств, которые, как известно, нарушают функцию тромбоцитов после письменного информированного согласия, и был одобрен Комитетом по этике исследований Университета Рединга.
1. Забор крови и подготовка обогащенной тромбоцитами плазмы
- Соберите периферическую кровь в вакутайнер, содержащий 3,2% цитрата натрия
- Выбросьте первые 3 мл.
- Дайте крови отдохнуть при температуре 30 °C в течение 30 минут перед центрифугированием.
- Обогащенную тромбоцитами плазму (PRP) готовят центрифугированием при 140 x g в течение 20 мин при комнатной температуре перед инкубацией при 37 °C в течение продолжительности анализа, который был завершен в течение 60 мин после центрифугирования.
2. Подготовка инструмента
ПРИМЕЧАНИЕ: Жидкостная система без давления имеет важное значение для проточной цитометрии в реальном времени, поскольку тромбоциты стимулируются одновременно, когда проточный цитометр регистрирует события.
- Используйте проточный цитометр без давления для проведения проточной цитометрии в режиме реального времени.
- Чтобы провести анализ при температуре 37 °C, прикрепите к предметному столу коврик для вскрытия мышей, чтобы разместить 96-луночный планшет. Нагрейте коврик до 37 °C в течение всего анализа.
- Поместите планшет на 96 лунок поверх нагретого коврика, чтобы обеспечить непрерывную инкубацию при 37 °C (Рисунок 1)
3. Подготовка к анализу
- Связывание фибриногена и экспрессия P-селектина
- Покройте полипропиленовую 96-луночную микротитровую пластину с круглым дном, необработанной микротитровой пластиной 5% бычьего сывороточного альбумина (БСА) в буферизованном физрастворе Hepes (HBS; 10 мМ Hepes pH 7,4; 150 мМ NaCl, 5 мМ KCl, 1 мМ MgSO4·7H20) на ночь при 4 °C.
- Приготовьте смесь антител в HBS, содержащую 5 мМ глюкозы (HBS-G). Добавьте меченое флуоресцеином изотиоцианатом (FITC) антифибриногенное антитело (FITC-FGN; разведение 1: 37,5 (v/v)) и меченые аллофикоцианином (APC) анти-P-селектином (APC-CD62P; разведение 1: 37,5 (v/v)) к HBS-G (конечный объем: 225 μL) и инкубируйте в 96-луночном планшете при 37 °C.
- Непосредственно перед сбором событий добавьте PRP в смесь HBS-G-антител в разведении 1:600 (v/v).
ПРИМЕЧАНИЕ: Требуется небольшой объем PRP, чтобы гарантировать непревышение предела события и снизить агрегацию тромбоцитов в образце. Разведение тромбоцитов изучалось в пилотных исследованиях и не влияет на скорость активации. - Инкубируют активационную смесь, содержащую FITC-FGN, (разведение 1: 37,5 (v/v)) и APC-CD62P (разведение 1: 37,5 (v/v)) и агонист при 37 °C. К агонистам относятся тромбин (thr; 0,0012-1 Ед/мл) в присутствии пептида Gly-Pro-Arg-Pro (GPRP; 1,18 мМ), связанного с перекрестно сшитым коллагеном пептида (CRP-XL; 0,004-10 мкг/мл), аденозиндифосфата (АДФ; 0,04-4 мкм), эпинефрина (эпи; 20-200 мкМ), 9,11-дидезокси-11α, 9α-эпоксиметанопростагландина F2α (U46619; 0,02-5 мкМ) и активатора рецептора тромбина пептида 6 (TRAP-6; 0,04-10 мкМ).
- Кальциевый флюс
ПРИМЕЧАНИЕ: Этот анализ был проведен с использованием коммерческого набора для анализа кальция (Таблица материалов)- Покройте полипропиленовый 96-луночный микротитровый планшет с круглым дном, необработанным микротитровым раствором с 5% BSA в буферизованном физрастворе Hepes на ночь при 4 °C.
- Для приготовления красителя для кальциевого анализа добавьте 100 мл буфера для кальциевого анализа и 2 мл стокового раствора пробенецида (250 мМ) в одну бутылку кальциевого реагента, чтобы получить 2x раствор для загрузки кальциевого реагента.
- Для приготовления Fluo-4/HBS-G разбавьте кальциевый краситель HBS-G в соотношении 1:1, отфильтруйте через фильтр 0,22 мкМ. Добавьте 225 мкл Fluo-4/HBS-G в соответствующие лунки 96-луночного планшета при 37 °C.
- Инкубировать PRP при 37 °C в течение 30 минут при разведении 1:1 с Fluo-4/HBS-G.
- Приготовьте активационную смесь в Fluo-4/HBS-G и инкубируйте при 37 °C. К агонистам относятся тромбин (1 ЕД/мл) в присутствии GPRP, CRP-XL (0,5 мкг/мл), АДФ (1 мкМ), эпинефрина (20 мкМ), U46619 (1 мкМ) и TRAP-6 (1 мкМ).
- Непосредственно перед сбором событий добавьте PRP/Fluo-4/HBS-G к 225 мкл смеси Fluo-4/HBS-G при окончательном разведении PRP (после добавления агониста) 1:600 (v/v; 0,5 мл на 300 мл конечного объема).
4. Процедура анализа и сбор данных
- Установите проточный цитометр на скорость потока на «медленный» со средним числом событий 1000 в секунду (eps) и максимальным 3000 eps. Установите пороговое значение 20000, чтобы избежать записи мусора клетки.
- Затвор популяции тромбоцитов с помощью графиков прямого рассеяния (FSC) и бокового рассеяния (SSC). Для сбора данных построите график зависимости FSC-A от SSC-A, чтобы точно определить популяцию тромбоцитов, и зависимость FL1 или FL4 от времени для регистрации флуоресцентных событий с течением времени.
- Проточному цитометру требуется 14 с, чтобы начать регистрировать события; После этого дайте прибору записывать события в каждой лунке в течение еще 5 секунд, прежде чем быстро добавить 75 μL активационной смеси с помощью наконечника для загрузки геля для обеспечения спонтанного смешивания (Рисунок 1).
- Соберите события за 5 минут и настройте графики для записи зависимости канала 488 (FL1; фильтр 533/30 - FITC-фибриноген/FLUO-4) и канала 633 (FL4; фильтр 675/25 - APC-P-selectin) от времени.
- Сохранение данных графика для каналов 488 и 633 из каждой скважины в виде файлов CSV.
5. Анализ данных
- Загрузите последнюю версию Kinetx12.
ПРИМЕЧАНИЕ: Загрузка включает в себя весь код, необходимый для анализа данных, полученных в результате анализа, и сопровождается тестовым набором экспериментальных данных от десяти доноров и выходных данных, полученных в результате их анализа (эти результаты могут быть восстановлены и проверены с помощью следующих процедур) (Рисунок 2). - Настройка среды R
- Используйте язык программирования R через среду RStudio. Установите R13, RStudio14 и следующие пакеты: ggplot2, dplyr, plotrix, minpack.lm, tidyverse, psych. Убедитесь, что все необходимые пакеты успешно установлены.
- Создание метаданных: Поместите текстовый файл (называемый wellData.txt) в тот же каталог, что и данные. В нем описываются агонисты, их концентрации, антитела и анализ (функция или кальций), используемый для создания каждого файла CSV.
- Поместите второй текстовый файл ('IsotypeData.txt') в тот же каталог и определите изотипы. Файлы, предоставленные в загрузке («data/wellData.txt» и «data/IsotypeData.txt»), могут выступать в качестве шаблона, будучи легко адаптируемыми к альтернативным агонистам, ингибиторам и концентрациям.
- Анализируйте данные: Kinetx включает в себя три функции, определенные в шагах 5.2.5-5.2.7.
- kinetxProcess.R: Эта функция обрабатывает исходные данные функциональной проточной цитометрии. Для запуска введите kinetxProcess ('data location','where to put outputs','FL1' (для FITC-антифибриногена, или 'FL4' (для APC-CD62P)
- kinetxProcessCalcium.R: Эта функция анализирует и маркирует данные о потоке кальция. Чтобы запустить, введите kinetxProcessCalcium('расположение данных','где разместить выходы','FL1')
- kinetxSummary.R: Эта функция обобщает данные. Чтобы запустить, введите kinetxSummary('расположение данных','где разместить выходы','FL1').
- Для запуска всех вышеперечисленных функций (5.2.5-5.2.7) на тестовых данных используется скрипт (test. R).
ПРИМЕЧАНИЕ: Первые две функции генерируют цифры для каждого донора, которые показывают исходные данные и подогнанные кривые. Все выходные данные и электронная таблица, обобщающая данные, размещаются в месте вывода.
Результаты
Анализ функциональной проточной цитометрии в реальном времени выявляет различия в форме кривых активации между агонистами и между донорами
Анализ функциональных данных (экспозиция P-селектина и связывание фибриногена) с помощью Kinetx удаляет точки данных, которые выходят за пределы разумных диапазонов (>200000 или <1) и <2,80 с (для этой точки установлено нулевое время), нормализует данные до медианы изотипов и подгоняет гладкую кривую скользящей средней (через функциональный лёсс). Kinetx также присваивает метрики и категории на основе подогнанной формы сглаженной линии, абсолютных значений и скорости изменения следующим образом: (1) RoC - средний подъем сглаженной линии за первые 120 с; (2) метка - классифицирует ответы как быстрые, средние или медленные, устанавливаемые в соответствии с пороговыми значениями 40 и 80 для FL1 и 5 и 10 для FL4; (3) EarlyRoC - средний подъем сглаженной линии в течение первых 20 с; (4) shape - низко реагирующие, увеличивающиеся, линейные или убывающие (Рисунок 3A) - Низко реагирующие определяются как FL1 < 4000 или FL4 < 1000, увеличивающиеся, линейные и убывающие метки определяются на основе: shapeMetric - RoC (120 секунд)/EarlyRoC, где возрастающая shapeMetric >2, линейная shapeMetric в диапазоне 0,9-2 и убывающая shapeMetric <0,9; (5) Создает электронную таблицу, обобщающую данные, с указанием уровня и скорости изменения при 0 с, 10 с, 20 с, 30 с, 40 с, 60 с, 90 с, 120 с, 180 с, медиану изотипа, максимальную и минимальную скорость изменения и ускорения, а также все метки и категории.
Связывание фибриногена тромбоцитов и экспозиция Р-селектина в течение 5 мин после активации в ответ на однократную концентрацию агонистов ADP, TRAP-6, CRP-XL, эпинефрина и U46617 были проанализированы у 30 доноров. Показатели связывания фибриногена и экспозиции Р-селектина в ответ на различные агонисты показывают значительные различия в форме ответа (Рисунок 3). Тромбоциты, стимулированные TRAP-6 и АДФ, показали более быстрое ускорение связывания фибриногена, которое у многих доноров замедлялось в более поздние моменты времени (рис. 3B). Связывание фибриногена в ответ на CRP-XL, тромбин и адреналин с большей вероятностью демонстрировало возрастающую или линейную скорость ответа. У многих доноров наблюдалось относительно длительное время задержки CRP-XL, прежде чем скорость связывания фибриногена быстро ускорилась. Реакция на U46619 часто оценивалась как низкая. Напротив, экспозиция-селектина с большей вероятностью демонстрировала линейную или увеличивающуюся скорость ответа на все агонисты, за исключением U46619, который также показал низкие уровни ответа (рис. 3C).
Внутриклеточный поток кальция во время активации тромбоцитов может быть точно измерен с помощью проточной цитометрии в реальном времени
Анализ данных анализа потока кальция удаляет точки данных, которые находятся за пределами разумных диапазонов (< 2,80 с нулевое время установлено на эту точку), а затем подгоняет гладкую кривую скользящей средней (с помощью функции loess). Kinetx присваивает метрики, а категории присваиваются на основе подогнанной формы плавных линий, абсолютных значений и скорости изменения следующим образом: (1) категория - которая описывает форму реакции кальция на основе раннего подъема, максимума и последнего падения от максимума, описывается как линейная, пиковая или устойчивая (Рисунок 4A); (2) Скорость - описывает скорость изменения в быстрые 30 с и определяется как отсутствие изменений, медленный, средний или быстрый (с отсечкой на 10, 40 и 80). Kinetx также создает электронную таблицу, обобщающую данные, предоставляя уровень и скорость изменения при 0 с, 10 с, 20 с, 30 с, 40 с, 60 с, 90 с, 120 с, 180 с, максимальную и минимальную скорость изменения и ускорения, а также все метки и категории, а также цифру данных для каждого донора. Примеры потока кальция, измеренные этим методом у 30 человек, снова показали различные паттерны активации у индивидуумов и агонистов (рис. 4B). CRP-XL давал преимущественно устойчивый кальциевый ответ, в то время как ответ на TRAP-6 чаще всего демонстрировал пиковый ответ. Все остальные агонисты генерировали преимущественно линейный ответ.
Проточная цитометрия в реальном времени выявляет различия в максимальных уровнях активации в ответ на различные агонисты и концентрации
Результаты показывают, что анализ проточной цитометрии в реальном времени способен обнаруживать различия в максимальных уровнях связывания фибриногена (рисунок 5A) и экспозиции P-селектина (рисунок 5D) в ответ на стимуляцию через различные рецепторы (10 г/мл CRP-XL против 3 ЕД/мл тромбина P < 0,001; 10 г/мл CRP-XL против 1 ЕД/мл тромбина P< 0,001). Они также показывают, что анализ чувствителен к различиям в концентрации агонистов, где уровни максимального связывания фибриногена и экспозиции Р-селектина увеличиваются в ответ на более высокие концентрации агонистов (связывание фибриногена - CRP-XL - 0,004 мкг/мл против 0,4, 5, 10 мкг/мл, P < 0,01; тромбин - 0,0012 Ед/мл против 1 и 3 Ед/мл, Р < 0,01; АДФ - 0,04 мкг/мл против 1 и 4 мкМ, P < 0,05).
Анализ проточной цитометрии в реальном времени достаточно чувствителен, чтобы выявить вариабельность скорости активации тромбоцитов среди доноров
Максимальную скорость активации тромбоцитов определяли путем подгонки сглаженной скользящей средней (лёсса) к данным флуоресценции, а затем с ее помощью рассчитывали максимальную скорость связывания фибриногена и экспозиции P-селектина (рис. 5B, E). Данные демонстрируют значительные различия между отдельными донорами, и анализ проточной цитометрии достаточно чувствителен для обнаружения этих вариаций. Результаты показывают, что увеличение концентрации агонистов мало влияет на максимальную скорость связывания фибриногена (рисунок 5B). Напротив, максимальная скорость экспозиции Р-селектина увеличивается с увеличением концентрации тромбина и CRP-XL, но не с увеличением концентрации АДФ (рис. 5E).
Изменения во времени задержки активации тромбоцитов могут быть обнаружены с помощью проточной цитометрии в реальном времени
Время до максимальной скорости активации тромбоцитов определяли путем расчета временных точек, в которых достигалась максимальная скорость связывания фибриногена и экспозиции Р-селектина (рис. 5C, F). Максимальная скорость связывания фибриногена и экспозиции P-селектина варьируется у разных доноров, особенно при более низких концентрациях агонистов. Стимуляция тромбоцитов с повышением концентрации CRP-XL показывает, что более высокие концентрации агонистов требуют меньше времени для достижения максимальной скорости связывания фибриногена с меньшей вариабельностью между донорами; однако эта тенденция не наблюдается ни при стимуляции тромбином, ни при АДФ (Рисунок 5C). Анализ показывает, что в некоторых обстоятельствах увеличение концентрации агониста уменьшает время, необходимое для начала активации тромбоцитов (время задержки) без изменения максимальной скорости активации тромбоцитов, и что оба эти показателя могут быть оценены с помощью данного анализа.
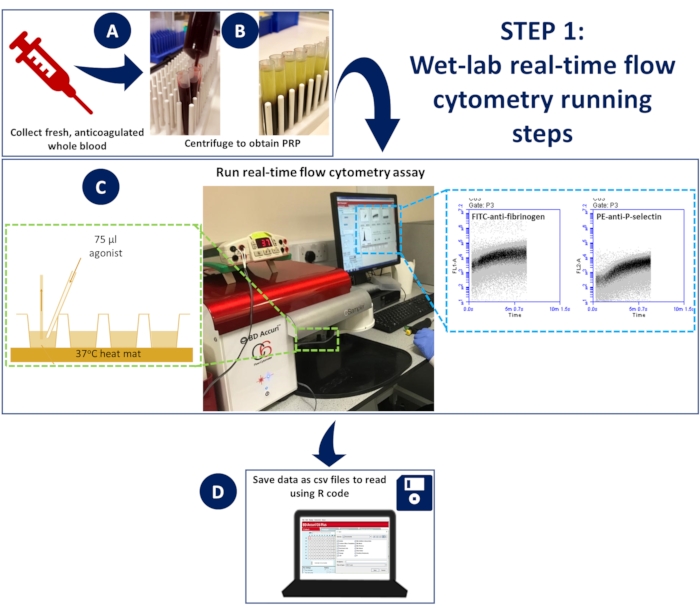
Рисунок 1: Проточная цитометрия в реальном времени в лабораторных условиях. (А) антикоагулированную цельную кровь (В) центрифугировали для получения обогащенной тромбоцитами плазмы (PRP). (C) Разведенный PRP, содержащий соответствующие антитела или индикаторные красители кальция, помещали в 96-луночный планшет, загружали на проточный цитометр без давления и поддерживали при температуре 37 °C с помощью коврика для вскрытия. Образцы стимулировали во время получения с помощью активационной смеси, содержащей антитела или кальциевый краситель и агонист, быстро добавляемой в лунку с помощью наконечника для загрузки геля для обеспечения спонтанного смешивания. (D) События собирались в течение 5 минут, и сохранялись CSV-файлы данных по каждой скважине. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
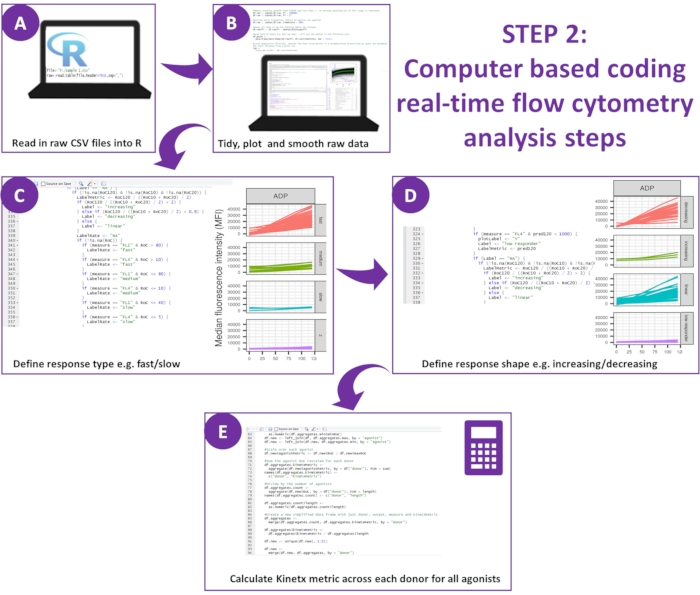
Рисунок 2: Схема анализа данных. (A) Была настроена среда R, и были созданы метаданные. (B) Удалены внешние данные, и подогнана гладкая кривая скользящей средней (лёсс). (C) Тип ответа и (D) форма ответа. (E) Были рассчитаны, экспортированы показатели и получены цифры по каждому донору. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
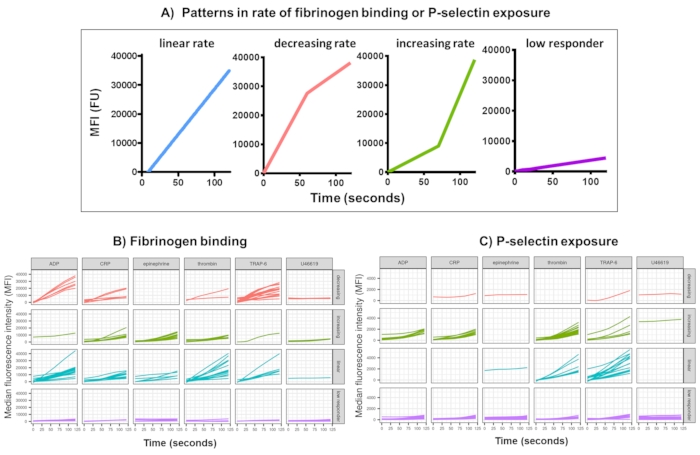
Рисунок 3: Репрезентативные результаты анализа Kinetx связывания фибриногена тромбоцитов в реальном времени и экспрессии P-селектина. (A) Помимо предоставления таких показателей, как максимальная скорость изменения (RoC) и RoC в различные моменты времени, Kinetx также классифицирует форму кривой, чтобы предоставить дополнительную информацию об активации тромбоцитов, которую трудно зафиксировать в одной метрике. Репрезентативные данные для 30 человек показывают типичные вариации, наблюдаемые в реальном времени в связывании тромбоцитов (B) фибриногена и экспрессии (C) P-селектина в ответ на агонисты ADP, TRAP-6, CRL-XL, адреналин и U46617. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
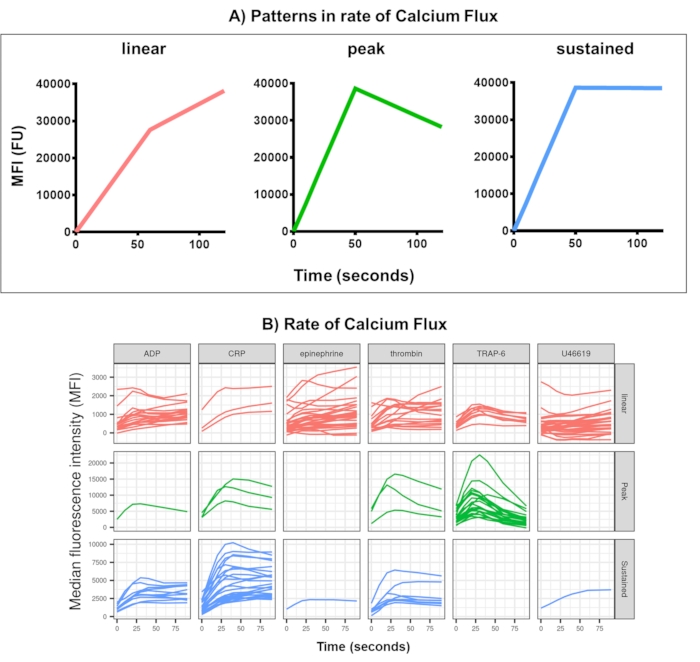
Рисунок 4: Репрезентативные результаты анализа потока тромбоцитов в режиме реального времени Kinetx. (A) Помимо предоставления таких показателей, как максимальная скорость изменения (RoC) и RoC в различные моменты времени, Kinetx также классифицирует форму кривой потока кальция, чтобы предоставить дополнительную информацию об активации тромбоцитов, которую трудно зафиксировать в одной метрике. Репрезентативные данные для 30 человек показывают типичную вариацию, наблюдаемую в реальном времени потока кальция тромбоцитов (B) в ответ на агонисты ADP, TRAP-6, CRL-XL, эпинефрин и U46617. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
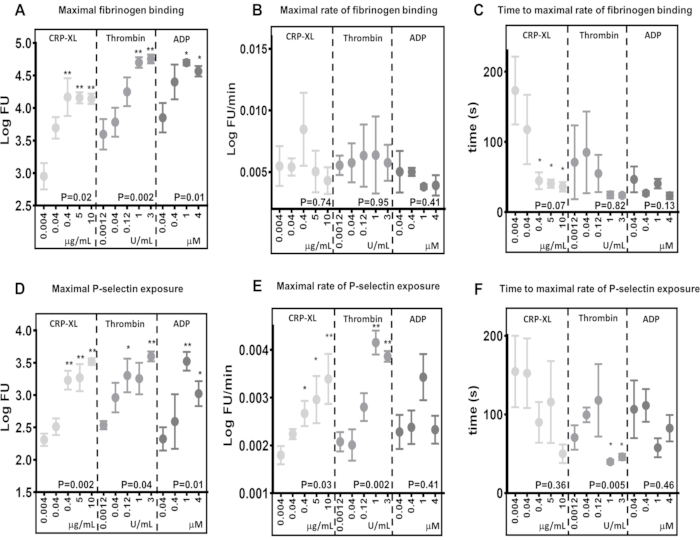
Рисунок 5: Концентрация агонистов определяет максимальную активацию тромбоцитов, но не скорость активации тромбоцитов. Максимальная активация тромбоцитов - связывание с фибриногеном (А) или экспозиция Р-селектина (D) - была значительно положительно изменена концентрацией агонистов (CRP-XL, тромбин или АДФ). Скорость активации тромбоцитов (В и Е) и время достижения максимальной скорости активации тромбоцитов (С и F) не показали никакой связи или более слабую связь с изменением концентрации агонистов. P-значения показывают значимость во всем диапазоне концентраций (критерий Краскела-Уоллиса), а звездочки указывают на значительную разницу (тест многократного сравнения) отдельных значений от самой низкой концентрации. * P < 0,05, ** P < 0,01. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Скорость, с которой тромбоциты обнаруживают, обрабатывают и реагируют на активирующие стимулы, может быть важным фактором, определяющим образование тромбов. Предыдущие исследования показали, что ингибирование сигнальных элементов, влияющих на скорость, но не на конечную степень активации тромбоцитов, приводит к образованию нестабильных тромбов8. Многие анализы функции тромбоцитов измеряют степень активации и агрегации тромбоцитов в ответ на различные состояния и методы лечения; Однако они не учитывают скорость, с которой тромбоциты активируются, и время, необходимоедля протекания этого сложного процесса. Разработанные здесь инновационные анализы на основе проточной цитометрии воспроизводимо отслеживают активацию тромбоцитов с течением времени и переводят ее в ряд показателей для расчета максимальной скорости активации тромбоцитов и времени, необходимого для достижения этой максимальной скорости и полной активации тромбоцитов.
Представленные данные подчеркивают способность анализа в реальном времени выявлять различия между различными реакциями на тип и концентрацию агониста, а также между отдельными людьми. Многие предыдущие исследования показали, что реактивность тромбоцитов сильно варьирует у здоровых людей15,16, что указывает на то, что скорость активации тромбоцитов также может значительно варьироваться в пределах популяции. Данные этого исследования показывают, что скорость дегрануляции и связывания фибриногена с тромбоцитами, по-видимому, даже более изменчива, чем максимальные уровни активации тромбоцитов. Это показывает, что проточная цитометрия в реальном времени также может быть использована в качестве ценного и надежного инструмента для выявления различий в скорости тромбоцитов в популяции и обнаружения влияния различных ингибирующих или проактивирующих агентов на скорость тромбоцитов в качестве дополнительного средства измерения функции тромбоцитов.
Когда функция тромбоцитов измеряется с помощью анализа конечных точек, можно провести сравнение степени связывания фибриногена или высвобождения гранул между различными агонистами. Лессовые кривые, сравнивающие связывание фибриногена в течение первых 5 минут активации тромбоцитов, демонстрируют способность анализа в реальном времени выявлять более детально различия в кинетике активации тромбоцитов, которые не могут быть измерены с помощью анализов на одной конечной точке.
Данные, собранные в ходе анализа в режиме реального времени, показывают, что скорость, с которой фибриноген связывается с тромбоцитами, несколько отличается в зависимости от пути активации (Рисунок 3). Для точной оценки кинетики активации тромбоцитов важно использовать проточный цитометр без давления, который позволяет одновременно получать данные и стимулировать образец. Также важно, чтобы агонисты добавлялись быстро, чтобы обеспечить почти мгновенное и полное смешивание агонистов и тромбоцитов. Стимуляция тромбином, АДФ и адреналином дает аналогичную кривую, представляющую собой быструю инициацию передачи сигналов в ответ на сенсибилизацию рецептора, что приводит к связыванию фибриногена с тромбоцитами с быстрой и устойчивой скоростью. Напротив, тромбоциты, стимулируемые CRP-XL, первоначально очень медленно связываются с фибриногеном после первоначальной сенсибилизации рецепторов; Тем не менее, скорость связывания фибриногена быстро увеличивается после этой первоначальной задержки. Стимуляция тромбоцитов U46619, миметиком TXA2, приводит к быстрой начальной скорости связывания фибриногена, которая быстро снижается до очень медленной, что приводит лишь к незначительному и устойчивому увеличению связывания фибриногена с течением времени.
Kinetx был разработан как открытый исходный код, воспроизводимый и простой в реализации, чтобы обойти проблемы с проприетарным программным обеспечением, такие как стоимость и негибкость. Таким образом, он должен был быть разработан с использованием программного обеспечения, которое было бы неподходящим. R был выбран потому, что он широко используется биологами, прост в установке, бесплатен и имеет открытый исходный код. Эта среда с открытым исходным кодом позволяет пользователям, хорошо владеющим R, изменять такие параметры, как степень сглаживания, идентификация отдаленных точек данных или временные шкалы. Тем не менее, чтобы помочь исследователям, которые не знакомы с R, Kinetix также был разработан таким образом, что анализ может быть выполнен с помощью одной команды (либо kinetxProcess, либо kinetxProcessCalcium, в зависимости от анализируемых данных). Программное обеспечение Kinetix, демонстрируемое здесь, может рассчитывать ряд показателей, включая значения максимальных уровней, скорости и ускорения связывания фибриногена или воздействия P-селектина, а также временные точки, в которых эти максимумы происходят. С помощью этих чисел можно более точно сравнить кинетику активации тромбоцитов в ответ на различные стимулирующие пути.
Сравнения между различными стимуляциями агонистов при максимальных уровнях связывания фибриногена и скорости связывания фибриногена с тромбоцитами являются хорошими примерами того, где скорость активации тромбоцитов может варьироваться независимо от максимального связывания. Сравнивая максимальное связывание фибриногена через 5 минут стимуляции с 0,04 мкМ АДФ (3,85 LogFU) и 0,04 мкг/мл CRP-XL (3,70 LogFU), оба агониста привели к одинаковому количеству связанного фибриногена (рис. 5A). Максимальные скорости связывания фибриногена демонстрируют еще более незначительную разницу (0,04 мкМ АДФ - 0,0050 LogFU/мин; 0,04 мкг/мл CRP-XL - 0,0054 LogFU/мин), что указывает на то, что общая скорость связывания фибриногена одинакова между этими двумя стимуляциями (рис. 5B). Однако, когда сравнивается время задержки активации тромбоцитов, существует явная разница, показывающая, что CRP-XL (117 с от максимальной скорости) ускоряется гораздо медленнее, чем ADP (47 с от максимальной скорости) (Рисунок 5C). Таким образом, становится ясно, что стимуляция АДФ приводит к гораздо более быстрому первоначальному ответу (P < 0,001) по сравнению с CRP-XL. При совместном наблюдении эти измерения кинетики тромбоцитов в ответ на два различных агониста описывают быструю первоначальную реакцию на стимуляцию АДФ, которая медленно ускоряется и остается на постоянной скорости. Напротив, стимуляция CRP-XL приводит к медленной начальной скорости активации, которая быстро ускоряется в гораздо более позднее время, что в конечном итоге приводит к такой же общей скорости и уровню связывания фибриногена, как и АДФ. Эти различия между максимальными уровнями, скоростью и ускорением связывания фибриногена демонстрируют, что ряд параметров участвует в измерении того, как быстро активируются тромбоциты. Анализ в режиме реального времени и анализ Kinetx могут измерить и сравнить эти параметры, описать время, прошедшее от сенсибилизации рецептора до ответа тромбоцитов, и сравнить его между различными сигнальными путями.
Повышение концентрации агонистов не оказывает существенного влияния на скорость связывания фибриногена с тромбоцитами. Тем не менее, время, необходимое для достижения максимальной скорости связывания фибриногена, уменьшается по мере увеличения концентрации агонистов, что позволяет предположить, что тромбоциты связываются с фибриногеном с постоянной скоростью, и насыщение рецепторов играет более заметную роль в том, как быстро тромбоциты связываются с фибриногеном.
Описанный анализ и анализ потока кальция представляет собой быстрый и простой в выполнении анализ кальция, который может быть включен в качестве дополнительных образцов в анализ в режиме реального времени, что позволяет анализировать связывание фибриногена кальция и тромбоцитов и P-селектин в одном и том же цикле образцов. Индивидуальный пакет анализа обеспечивает углубленную оценку кинетики кальциевого потока, включая форму отклика, максимальный отклик и время достижения максимального отклика. Затем эти параметры могут быть сравнены на предмет различий между донорами и в ответ на различные фармацевтические агенты. Поток кальция в тромбоцитах ранее изучался в тромбоцитах с использованием различных анализов, основанных на проточной цитометрии 17,18,19. Aliotta et al.14 описывают элегантный анализ, способный анализировать кинетику множественных внутриклеточных ионов. Представленный здесь анализ кальция основан на ранее опубликованных анализах, включая пакет анализа, обеспечивающий большую гибкость, более глубокое изучение данных с преимуществом высокопроизводительного анализа для нескольких доноров в короткие сроки.
Предыдущие исследования показали, что ингибирование или отсутствие определенных сигнальных молекул приводит к изменению скорости активации тромбоцитов, что напрямую приводит к образованию тромбов 8,9. В прошлом кинетика активации тромбоцитов могла быть измерена с помощью проточной цитометрии в ряде фиксированных временных точек, которые затем могут быть использованы для расчета и сравнения, например, скорости экстернализации GPIIbIIIa в ответ на различные агонисты20. Анализ в режиме реального времени и анализ Kinetx, описанные в этой статье, представляют собой простой, свободно доступный и точный метод измерения как скорости, так и конечной точки активации тромбоцитов из покоящихся тромбоцитов. Это, вероятно, важно для выявления физиологически значимых изменений функции тромбоцитов, которые могут быть пропущены при измерении только конечных показателей.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Этот проект был поддержан Британским фондом сердца (PG/16/36/31967, RG/20/7/34866 и RG/15/2/31224).
Материалы
| Name | Company | Catalog Number | Comments |
| 9,11-Dideoxy-11α,9α-epoxymethanoprostaglandin F2α - U46619 | Sigma-Aldrich, Poole, UK | D8174-1MG | |
| Accuri C6 flow cytometer with BD Csampler | Beckton Dickinson, UK | 660517 + 660519 | |
| Adenosine diphosphate | Sigma-Aldrich, Poole, UK | A2754-1G | |
| APC-labelled anti-P-selectin (CD62p) | BD Biosciences, UK | 550888 | |
| Corning polypropylene 96-well round-bottomed, non-treated microtitre plate | Sigma-Aldrich, Poole, UK | CLS3879-50EA | |
| Cross-linked collagen related peptide (CRP-XL) | CambCol, UK | ||
| Epinephrine | Sigma-Aldrich, Poole, UK | E4375-1G | |
| FITC-labelled anti-fibrinogen antibody | Dako, Agilent Technologies, UK | F011102-2 | |
| Fluo-4 Direct dye | Thermo-Fisher Scientific | F10472 | |
| Gel loading tips | Starlab, UK | I1022-0600 | |
| Gly-Pro-Arg-Pro peptide | Sigma-Aldrich, Poole, UK | G1895-5MG | |
| Thrombin | Sigma-Aldrich, Poole, UK | SRE0003-10KU | |
| Thrombin receptor activator peptide 6 (TRAP-6) | Bachem, St Helens, UK | H-2936.0005 | |
| Vacuette 9NC coagulation 3.2 % trisodium citrate (0.109 mol/L) | Greiner Bio-one LTD, Stonehouse, UK | 454327 |
Ссылки
- Bye, A. P., Unsworth, A. J., Gibbins, J. M. Platelet signaling: a complex interplay between inhibitory and activatory networks. Journal of Thrombosis and Haemostasis: JTH. 14 (5), 918-930 (2016).
- Jones, C. I., Barrett, N. E., Moraes, L. A., Gibbins, J. M., Jackson, D. E. Endogenous inhibitory mechanisms and the regulation of platelet function. Methods in Molecular Biology. 788, 341-366 (2012).
- Paniccia, R., Priora, R., Liotta, A. A., Abbate, R. Platelet function tests: a comparative review. Vascular Health and Risk Management. 11, 133-148 (2015).
- Saboor, M., Moinuddin, M., Ilyas, S. New horizons in platelets flow cytometry. The Malaysian Journal of Medical Sciences : MJMS. 20 (2), 62-66 (2013).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88, 1525-1541 (1996).
- Pasquet, J. M., Noury, M., Nurden, A. T. Evidence that the platelet integrin alphaIIb beta3 is regulated by the integrin-linked kinase, ILK, in a PI3-kinase dependent pathway. Thrombosis and Haemostasis. 88 (1), 115-122 (2002).
- Stevens, J. M., Jordan, P. A., Sage, T., Gibbins, J. M. The regulation of integrin-linked kinase in human platelets: evidence for involvement in the regulation of integrin alpha 2 beta 1. Journal of Thrombosis and Haemostasis: JTH. 2 (8), 1443-1452 (2004).
- Jones, C. I., et al. Integrin-linked kinase regulates the rate of platelet activation and is essential for the formation of stable thrombi. Journal of Thrombosis and Haemostasis: JTH. 12 (8), 1342-1352 (2014).
- Cifuni, S. M., Wagner, D. D., Bergmeier, W. CalDAG-GEFI and protein kinase C represent alternative pathways leading to activation of integrin alphaIIbbeta3 in platelets. Blood. 112 (5), 1696-1703 (2008).
- Stolla, M., et al. The kinetics of alphaIIbbeta3 activation determines the size and stability of thrombi in mice: implications for antiplatelet therapy. Blood. 117 (3), 1005-1013 (2011).
- Kawasaki, H., et al. A Rap guanine nucleotide exchange factor enriched highly in the basal ganglia. Proceedings of the National Academy of Sciences of the United States of America. 95 (22), 13278-13283 (1998).
- . R Available from: https://www.r-project.org/ (2021)
- . R Studio Available from: https://rstudio.com/products/rstudio/download/ (2021)
- Yee, D. L., Sun, C. W., Bergeron, A. L., Dong, J. F., Bray, P. F. Aggregometry detects platelet hyperreactivity in healthy individuals. Blood. 106 (8), 2723-2729 (2005).
- Panzer, S., Hocker, L., Koren, D. Agonists-induced platelet activation varies considerably in healthy male individuals: studies by flow cytometry. Annals of Hematology. 85 (2), 121-125 (2006).
- Aliotta, A., Bertaggia Calderara, D., Alberio, L. Flow cytometric monitoring of dynamic cytosolic calcium, sodium, and potassium fluxes following platelet activation. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 97 (9), 933-944 (2020).
- do Ceu Monteiro, M., Sansonetty, F., Goncalves, M. J., O'Connor, J. E. Flow cytometric kinetic assay of calcium mobilization in whole blood platelets using Fluo-3 and CD41. Cytometry. 35 (4), 302-310 (1999).
- Vines, A., McBean, G. J., Blanco-Fernandez, A. A flow-cytometric method for continuous measurement of intracellular Ca(2+) concentration. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 77 (11), 1091-1097 (2010).
- Weber, A. A., Schror, K. Differential inhibition of adenosine diphosphate- versus thrombin receptor-activating peptide-stimulated platelet fibrinogen binding by abciximab due to different glycoprotein IIb/IIIa activation kinetics. Blood. 98 (5), 1619-1621 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены