Method Article
Kinetx: Uma estrutura combinada de software de análise e ensaio de citometria de fluxo para medir e categorizar quantitativamente a ativação plaquetária em tempo real.
Neste Artigo
Resumo
As plaquetas reagem rapidamente a uma série de estímulos. Este artigo descreve um ensaio de função plaquetária baseado em citometria de fluxo em tempo real e um software de código aberto sob medida (Kinetx) recém-desenvolvido para permitir medições cinéticas quantitativas de liberação de grânulos plaquetários, ligação de fibrinogênio e fluxo de cálcio intracelular.
Resumo
As plaquetas reagem rapidamente à lesão vascular e sofrem ativação em resposta a uma série de estímulos para limitar a perda de sangue. Muitos testes de função plaquetária medem as respostas finais após um período de tempo definido e não a taxa de ativação plaquetária. No entanto, a taxa na qual as plaquetas convertem estímulos extracelulares em uma resposta funcional é um fator essencial para determinar a eficiência com que elas podem responder à lesão, ligar-se a um trombo em formação e sinalizar para recrutar outras plaquetas. Este artigo descreve um ensaio de função plaquetária baseado em citometria de fluxo que permite a aquisição simultânea de dados e estimulação de amostras e utiliza software de código aberto sob medida (Kinetx) recém-desenvolvido para permitir medições cinéticas quantitativas de liberação de grânulos plaquetários, ligação de fibrinogênio e fluxo de cálcio intracelular. O Kinetix foi desenvolvido para que os usuários possam alterar parâmetros como grau de suavização, identificação de pontos de dados periféricos ou escalas de tempo. Para ajudar os usuários não familiarizados com o ambiente R, a análise de dados do Kinetix pode ser executada por um único comando. Juntos, isso permite que as métricas de ativação plaquetária em tempo real, como taxa, aceleração, tempo até o pico, tempo até o pico de cálcio e mudanças qualitativas de forma, sejam medidas e categorizadas com precisão e reprodutibilidade. As medições cinéticas da ativação plaquetária fornecem uma visão única do comportamento das plaquetas durante os primeiros estágios de ativação e podem fornecer um método de prever o recrutamento de plaquetas para um trombo em formação.
Introdução
As plaquetas desempenham um papel central na hemostasia e geram uma resposta rápida e multifacetada à lesão vascular 1,2. Os testes atuais de função plaquetária medem vários aspectos da reatividade plaquetária, representativos de suas ações hemostáticas in vivo. Tradicionalmente, a função plaquetária tem sido avaliada usando ensaios de endpoint que medem a ligação ao fibrinogênio, a liberação de grânulos ou a agregação plaquetária em plaquetas estimuladas por tempo suficiente para atingir a ativação máxima 3,4. Esses testes não levam em consideração o tempo necessário para que as plaquetas convertam estímulos extracelulares em sinais intracelulares e fluxo de cálcio e, posteriormente, degranulem e se liguem ao trombo em crescimento. O sangue flui a uma taxa de cisalhamento de até 20 dinas/cm3 nas veias e 80 dinas/cm3 nas grandes artérias5, enfatizando a necessidade de as plaquetas neutralizarem essa rápida taxa de fluxo, detectando, processando e respondendo rapidamente a estímulos extracelulares para se ligarem a um trombo em formação e apoiar seu crescimento contínuo.
A taxa de ativação plaquetária pode variar independentemente da extensão máxima da ativação plaquetária. A quinase ligada à integrina (ILK) é uma proteína envolvida na regulação das integrinas β1 e β3 nas plaquetas 6,7. A inibição ou deleção específica de ILK in vivo demonstrou que a taxa, mas não a extensão máxima da ativação plaquetária, foi afetada na ausência de ILK funcional8. Diferenças entre a taxa de agregação e o nível máximo de agregação também foram identificadas em camundongos deficientes em CALDAG GEFI 9,10, uma molécula de sinalização envolvida na regulação da sinalização de dentro para fora via RAP111.
Esses achados demonstram que a taxa plaquetária e os níveis máximos de ativação podem ser autônomos e que as medidas de ativação máxima podem não ser descritivas do comportamento plaquetário até este ponto. Essas diferenças no tempo necessário para a ativação das plaquetas podem afetar profundamente sua ligação inicial ao trombo em crescimento, impactando a arquitetura e o tamanho geral do trombo. Essas variações entre a taxa de plaquetas e a ativação máxima destacam a necessidade de um ensaio para medir com precisão a taxa de ativação plaquetária e podem ser usadas para detectar variações na população.
Este artigo descreve um método que mede com precisão a ativação plaquetária e o fluxo de cálcio em tempo real e calcula uma série de métricas, incluindo a taxa na qual as plaquetas são ativadas e o tempo necessário para que as plaquetas atinjam a taxa máxima de ativação e o fluxo máximo de cálcio. Essas medições cinéticas da ativação plaquetária fornecem uma visão melhor do comportamento das plaquetas durante os primeiros estágios da formação do trombo e fornecem um método para prever a rapidez com que as plaquetas podem ser recrutadas para um trombo em formação.
Protocolo
Este protocolo usou sangue total humano e plaquetas de doadores saudáveis sem condições de saúde subjacentes e sem tomar nenhum medicamento conhecido por interferir na função plaquetária após consentimento informado por escrito e foi aprovado pelo Comitê de Ética em Pesquisa da Universidade de Reading.
1. Coleta de sangue e preparação de plasma rico em plaquetas
- Colete o sangue periférico em um vacutainer contendo citrato de sódio a 3,2%
- Descarte os primeiros 3 mL.
- Deixe o sangue descansar a 30 °C por 30 minutos antes da centrifugação.
- Preparar o plasma rico em plaquetas (PRP) por centrifugação a 140 x g durante 20 min à temperatura ambiente antes da incubação a 37 °C durante a duração do ensaio, que terminou 60 min após a centrifugação.
2. Preparação do instrumento
NOTA: Um sistema fluídico não pressurizado é essencial para a citometria de fluxo em tempo real, pois as plaquetas são estimuladas simultaneamente à medida que o citômetro de fluxo registra eventos.
- Use um citômetro de fluxo não pressurizado para realizar a citometria de fluxo em tempo real.
- Para realizar o ensaio a 37 °C, prenda uma esteira de dissecção de camundongo ao estágio para colocar a placa de 96 poços. Aquecer a esteira a 37 °C durante o ensaio.
- Colocar uma placa de 96 poços no topo da esteira aquecida para permitir a incubação contínua a 37 °C (figura 1)
3. Preparação do ensaio
- Ligação ao fibrinogênio e expressão de P-selectina
- Cubra uma placa de microtítulo de polipropileno 96 poços de fundo redondo e não tratada com albumina de soro bovino (BSA) a 5% em solução salina tamponada com hepes (HBS; 10 mM Hepes pH 7,4; 150 mM NaCl, 5 mM KCl, 1 mM MgSO4 · 7H20) durante a noite a 4 ° C.
- Preparar a mistura de anticorpos em HBS contendo 5 mM de glicose (HBS-G). Adicionar o anticorpo anti-fibrinogénio marcado com isotiocianato de fluoresceína (FITC) (FITC-FGN; diluição 1: 37,5 (v/v)) e o anti-P-selectina marcado com aloficocianina (APC) (APC-CD62P; diluição 1: 37,5 (v/v)) ao HBS-G (volume final: 225 μL) e incubar numa placa de 96 poços a 37 °C.
- Imediatamente antes de coletar eventos, adicione PRP à mistura de anticorpos HBS-G a uma diluição de 1:600 (v / v).
NOTA: Um baixo volume de PRP é necessário para garantir que o limite de eventos não seja excedido e reduzir a agregação plaquetária na amostra. A diluição plaquetária foi examinada em estudos piloto e não afeta a taxa de ativação. - Incubar a mistura de activação contendo FITC-FGN (diluição 1: 37,5 (v/v)) e APC-CD62P [diluição 1: 37,5 (v/v)] e agonista a 37 °C. Os agonistas incluem trombina (thr; 0,0012-1 U/mL) na presença do peptídeo Gly-Pro-Arg-Pro (GPRP; 1,18 mM), peptídeo reticulado relacionado ao colágeno (CRP-XL; 0,004-10 μg/mL), difosfato de adenosina (ADP; 0,04-4 μM), epinefrina (epi; 20-200 μM), 9,11-Dideoxi-11α,9α-epoximetanoprostaglandina F2α (U46619; 0,02-5 μM) e peptídeo ativador do receptor de trombina 6 (TRAP-6; 0,04-10 μM).
- Fluxo de cálcio
NOTA: Este ensaio foi realizado usando um kit comercial de ensaio de cálcio (Tabela de Materiais)- Cubra uma placa de microtítulo de polipropileno 96 poços, de fundo redondo, não tratada, com 5% de BSA em solução salina tamponada com hepes durante a noite a 4 ° C.
- Para preparar o corante de ensaio de cálcio, adicione 100 mL de tampão de ensaio de cálcio e 2 mL de solução estoque de probenecida (250 mM) a um frasco de reagente de cálcio para obter 2x solução de carga de reagente de cálcio.
- Para preparar Fluo-4 / HBS-G, dilua o corante de ensaio de cálcio com HBS-G na proporção de 1:1, filtre através de um filtro de 0,22 μM. Adicione 225 μL de Fluo-4/HBS-G aos poços apropriados de uma placa de 96 poços a 37 °C.
- Incube o PRP a 37 °C por 30 min em uma diluição de 1:1 com Fluo-4/HBS-G.
- Preparar a mistura de ativação em Fluo-4/HBS-G e incubar a 37 °C. Os agonistas incluem trombina (1 U/mL) na presença de GPRP, CRP-XL (0,5 μg/mL) ADP (1 μM), epinefrina (20 μM), U46619 (1 μM) e TRAP-6 (1 μM).
- Imediatamente antes da coleta de eventos, adicione PRP / Fluo-4 / HBS-G aos 225 μL da mistura Fluo-4 / HBS-G em uma diluição final de PRP (após adição de agonista) de 1: 600 (v / v; 0,5 mL em 300 mL do volume final).
4. Procedimento de ensaio e coleta de dados
- Defina o citômetro de fluxo para uma taxa de fluxo em 'lento' com um número médio de 1000 eventos por segundo (eps) e um máximo de 3000 eps. Defina o limite para 20000 para evitar o registro de detritos celulares.
- Bloqueie a população de plaquetas usando gráficos de dispersão direta (FSC) e dispersão lateral (SSC). Para a coleta de dados, plote FSC-A vs. SSC-A para bloquear com precisão a população de plaquetas e FL1 ou FL4 vs. tempo para registrar os eventos fluorescentes ao longo do tempo.
- O citômetro de fluxo leva 14 s para começar a registrar eventos; depois disso, deixe o instrumento registrar eventos em cada poço por mais 5 s antes de adicionar 75 μL da mistura de ativação rapidamente usando uma ponta de carregamento de gel para garantir a mistura espontânea (Figura 1).
- Colete os eventos por 5 min e configure os gráficos para registrar o canal 488 (FL1; filtro 533/30 - FITC-fibrinogênio / FLUO-4) vs. tempo e o canal 633 (FL4; filtro 675/25 - APC-P-selectin) vs. tempo.
- Salve os dados de plotagem para os canais 488 e 633 de cada poço como arquivos CSV.
5. Análise dos dados
- Baixe a versão mais recente do Kinetx12.
NOTA: O download inclui todo o código necessário para analisar os dados gerados a partir do ensaio e é acompanhado por um conjunto de testes de dados experimentais de dez doadores e resultados gerados a partir de sua análise (esses resultados podem ser regenerados e validados por meio dos seguintes procedimentos) (Figura 2). - Configurar o ambiente do R
- Use a linguagem de programação R por meio do ambiente RStudio. Instale o R13, RStudio14 e os seguintes pacotes: ggplot2, dplyr, plotrix, minpack.lm, tidyverse, psych. Certifique-se de que todos os pacotes de pré-requisitos tenham sido instalados com êxito.
- Criar metadados: coloque um arquivo de texto (chamado wellData.txt) dentro do mesmo diretório que os dados. Ele descreve os agonistas, suas concentrações, quaisquer anticorpos e o ensaio (função ou cálcio) usado para gerar cada arquivo CSV.
- Coloque um segundo arquivo de texto ('IsotypeData.txt') no mesmo diretório e defina os isotipos. Os arquivos fornecidos no download ('dados/wellData.txt' e 'dados/IsotypeData.txt') podem atuar como um modelo, sendo facilmente adaptáveis a agonistas, inibidores e concentrações alternativas.
- Analise os dados: O Kinetx compreende três funções, conforme definido nas etapas 5.2.5 a 5.2.7.
- kinetxProcess.R: Esta função processa os dados brutos de citometria de fluxo funcional. Para executar, digite kinetxProcess('data location','where to put outputs','FL1' (para FITC-anti-fibrinogen ou 'FL4' (para APC-CD62P)
- kinetxProcessCalcium.R: Esta função analisa e rotula os dados de fluxo de cálcio. Para executar, digite kinetxProcessCalcium('data location','where to put outputs','FL1')
- kinetxSummary.R: essa função resume os dados. Para executar, digite kinetxSummary('data location','where to put outputs','FL1').
- Para executar todas as funções acima (5.2.5-5.2.7) nos dados de teste, use o script (test. R).
NOTA: As duas primeiras funções produzem figuras para cada doador que mostram os dados brutos mais as curvas ajustadas. Todas as saídas e uma planilha que resume os dados são colocadas no local de saída.
Resultados
A análise da citometria de fluxo funcional em tempo real revela diferenças na forma das curvas de ativação entre agonistas e entre doadores
A análise de dados dos dados funcionais (exposição à P-selectina e ligação ao fibrinogênio) usando Kinetx remove pontos de dados que estão fora de intervalos razoáveis (>200000 ou <1) e <2,80 s (tempo zero sendo definido para este ponto), normaliza os dados para a mediana dos isotipos e ajusta uma curva de média móvel suave (via loess de função). A Kinetx também atribui métricas e categorias com base na forma da linha suavizada ajustada, valores absolutos e taxas de mudança da seguinte forma: (1) RoC - aumento médio na linha suavizada nos primeiros 120 s; (2) rótulo - categoriza as respostas como rápidas, médias ou lentas, sendo definidas de acordo com os pontos de corte de 40 e 80 para FL1 e 5 e 10 para FL4; (3) EarlyRoC - aumento médio na linha suavizada nos primeiros 20 s; (4) forma - respondedores baixos, crescentes, lineares ou decrescentes (Figura 3A) - Respondedores baixos sendo determinados como FL1 < 4000 ou FL4 < 1000, os rótulos crescentes, lineares e decrescentes são determinados com base em: shapeMetric - RoC (120 segundos) / EarlyRoC, onde o aumento do shapeMetric >2, o shapeMetric linear entre 0,9-2 e o declínio do shapeMetric <0,9; (5) Produz uma planilha resumindo os dados, fornecendo o nível e a taxa de variação em 0 s, 10 s, 20 s, 30 s, 40 s, 60 s, 90 s, 120 s, 180 s, mediana do isotipo, as taxas máxima e mínima de variação e aceleração e todos os rótulos e categorias.
A ligação plaquetária ao fibrinogênio e a exposição à P-selectina durante 5 min após a ativação em resposta a uma única concentração dos agonistas ADP, TRAP-6, CRP-XL, epinefrina e U46617 foram analisadas em 30 doadores. As métricas de ligação ao fibrinogênio e exposição à P-selectina em resposta a diferentes agonistas mostram uma variação considerável na forma da resposta (Figura 3). As plaquetas estimuladas com TRAP-6 e ADP mostraram uma aceleração mais rápida na ligação ao fibrinogênio, que para muitos doadores diminuiu em momentos posteriores (Figura 3B). A ligação ao fibrinogênio em resposta à PCR-XL, trombina e epinefrina foi mais provável de mostrar uma taxa de resposta crescente ou linear. Muitos doadores mostraram um tempo de atraso relativamente longo para CRP-XL antes que a taxa de ligação ao fibrinogênio acelerasse rapidamente. A resposta ao U46619 foi frequentemente categorizada como baixa. Em contraste, a exposição à P-selectina teve maior probabilidade de mostrar uma taxa linear ou crescente de resposta a todos os agonistas, exceto U46619, que novamente mostrou baixos níveis de resposta (Figura 3C).
O fluxo de cálcio intracelular durante a ativação plaquetária pode ser medido com precisão usando citometria de fluxo em tempo real
A análise de dados do ensaio de fluxo de cálcio remove pontos de dados que estão fora de intervalos razoáveis (< 2,80 s de tempo zero sendo definido para este ponto) e, em seguida, ajusta uma curva de média móvel suave (via loess de função). A Kinetx atribui métricas e as categorias são atribuídas com base na forma das linhas suaves ajustadas, valores absolutos e taxas de mudança da seguinte forma: (1) categoria - que descreve a forma da resposta do cálcio com base no aumento inicial, no máximo e na queda final do máximo, descrita como linear, pico ou sustentada (Figura 4A); (2) taxa - que descreve a taxa de variação nos 30 s rápidos e é definida como sem alteração, lenta, média ou rápida (com corte em 10, 40 e 80). A Kinetx também produz uma planilha resumindo os dados, fornecendo o nível e a taxa de variação em 0 s, 10 s, 20 s, 30 s, 40 s, 60 s, 90 s, 120 s, 180 s, as taxas máxima e mínima de variação e aceleração e todos os rótulos e categorias, além de produzir uma figura dos dados para cada doador. Exemplos de fluxo de cálcio medido por este método em 30 indivíduos mostraram novamente diferentes padrões de ativação entre indivíduos e agonistas (Figura 4B). CRP-XL deu resposta predominantemente sustentada de cálcio, enquanto a resposta ao TRAP-6 na maioria das vezes mostrou uma resposta de pico. Todos os outros agonistas geraram uma resposta predominantemente linear.
A citometria de fluxo em tempo real identifica diferenças nos níveis máximos de ativação em resposta a diferentes agonistas e concentrações
Os resultados demonstram que o ensaio de citometria de fluxo em tempo real tem a capacidade de detectar diferenças nos níveis máximos de ligação ao fibrinogênio (Figura 5A) e exposição à P-selectina (Figura 5D), em resposta à estimulação por diferentes receptores (10 μg/mL DE CRP-XL vs. 3 U/mL de trombina P < 0,001; 10 μg/mL de PCR-XL vs. 1 U/mL de trombina P < 0,001). Eles também mostram que o ensaio é sensível a diferenças na concentração de agonistas, onde os níveis de ligação máxima ao fibrinogênio e exposição à P-selectina são aumentados em resposta a maiores concentrações de agonistas (ligação ao fibrinogênio - CRP-XL - 0,004 μg/mL vs. 0,4, 5, 10 μg/mL, P < 0,01; trombina - 0,0012 U/mL vs. 1 e 3 U/mL, P < 0,01; ADP - 0,04 μg/mL vs. 1 e 4 μM, P < 0,05).
O ensaio de citometria de fluxo em tempo real é sensível o suficiente para detectar variabilidade entre os doadores na taxa de ativação plaquetária
A taxa máxima de ativação plaquetária foi determinada ajustando uma média móvel suavizada (loess) aos dados de fluorescência e, em seguida, usando-a para calcular a taxa máxima de ligação ao fibrinogênio e exposição à P-selectina ( Figura 5B , E ). Os dados demonstram uma variação considerável entre doadores individuais, e o ensaio de citometria de fluxo é sensível o suficiente para detectar essa variação. Os resultados indicam que o aumento da concentração de agonistas tem pouco efeito sobre a taxa máxima de ligação ao fibrinogênio (Figura 5B). Em contraste, a taxa máxima de exposição à P-selectina aumenta com maior concentração de trombina e PCR-XL, mas não com o aumento das concentrações de ADP (Figura 5E).
Variações no tempo de atraso da ativação plaquetária podem ser detectadas usando citometria de fluxo em tempo real
O tempo para a taxa máxima de ativação plaquetária foi determinado calculando os pontos de tempo em que a taxa máxima de ligação ao fibrinogênio e a exposição à P-selectina foram atingidas ( Figura 5C , F ). A taxa máxima de ligação ao fibrinogênio e exposição à P selectina varia entre os doadores, particularmente em concentrações mais baixas de agonistas. A estimulação plaquetária com concentrações crescentes de PCR-XL mostra que concentrações mais altas de agonistas levam menos tempo para atingir a taxa máxima de ligação ao fibrinogênio com menor variabilidade entre os doadores; no entanto, essa tendência não é observada com a estimulação da trombina ou do ADP (Figura 5C). O ensaio demonstra que, em algumas circunstâncias, o aumento da concentração de agonistas diminui o tempo necessário para o início da ativação plaquetária (tempo de atraso) sem alterar a taxa máxima de ativação plaquetária e que ambas as medidas podem ser avaliadas com este ensaio.
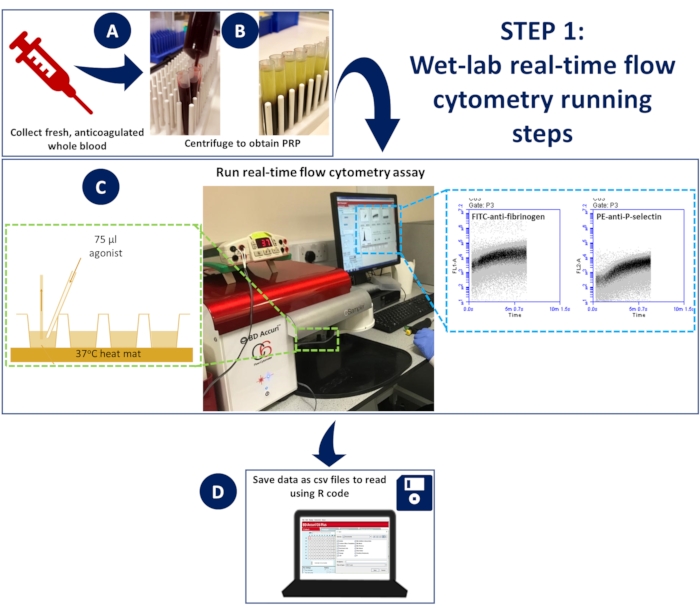
Figura 1: Citometria de fluxo em tempo real em laboratório úmido. (A) sangue total anticoagulado foi (B) centrifugado para obter plasma rico em plaquetas (PRP). (C) O PRP diluído contendo anticorpos apropriados ou corantes indicadores de cálcio foi colocado em uma placa de 96 poços, carregado em um citômetro de fluxo não pressurizado e mantido a 37 ° C usando uma esteira de dissecação. As amostras foram estimuladas durante a aquisição com uma mistura de ativação contendo anticorpos ou corante de cálcio e agonista, rapidamente adicionados ao poço usando uma ponta de carregamento de gel para garantir a mistura espontânea. (D) Os eventos foram coletados por 5 minutos e os arquivos CSV dos dados de cada poço foram salvos. Clique aqui para ver uma versão maior desta figura.
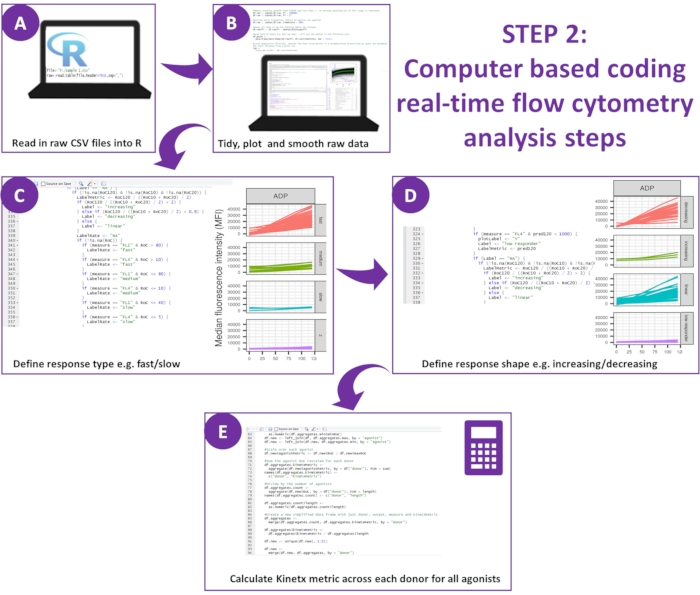
Figura 2: Esquema da análise dos dados. (A) O ambiente R foi configurado e os metadados foram criados. (B) Os dados periféricos foram removidos e uma curva de média móvel suave (loess) foi ajustada. (C) Tipo de resposta e (D) forma de resposta foram definidos. (E) As métricas foram calculadas, exportadas e os números gerados para cada doador. Clique aqui para ver uma versão maior desta figura.
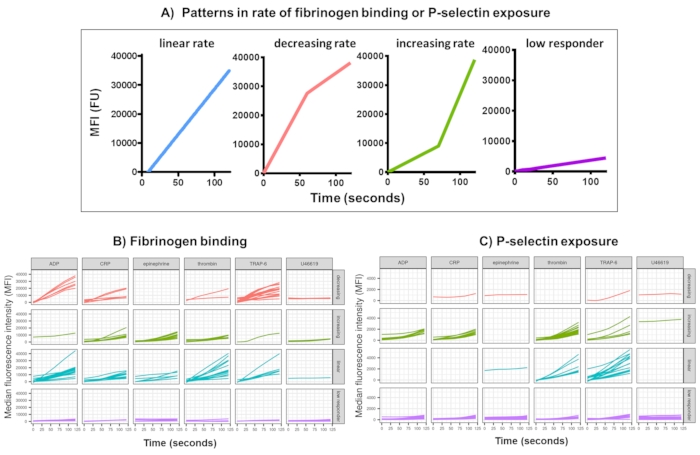
Figura 3: Saída representativa da análise Kinetx da ligação do fibrinogênio plaquetário em tempo real e expressão de P-selectina. (A) Além de fornecer métricas como taxa máxima de mudança (RoC) e RoC em vários momentos, a Kinetx também categoriza a forma da curva para fornecer informações adicionais sobre a ativação de plaquetas que são difíceis de capturar em uma única métrica. Dados representativos de 30 indivíduos mostram a variação típica observada na ligação do fibrinogênio plaquetário em tempo real (B) e (C) expressão de P-selectina em resposta aos agonistas ADP, TRAP-6, CRL-XL, epinefrina e U46617. Clique aqui para ver uma versão maior desta figura.
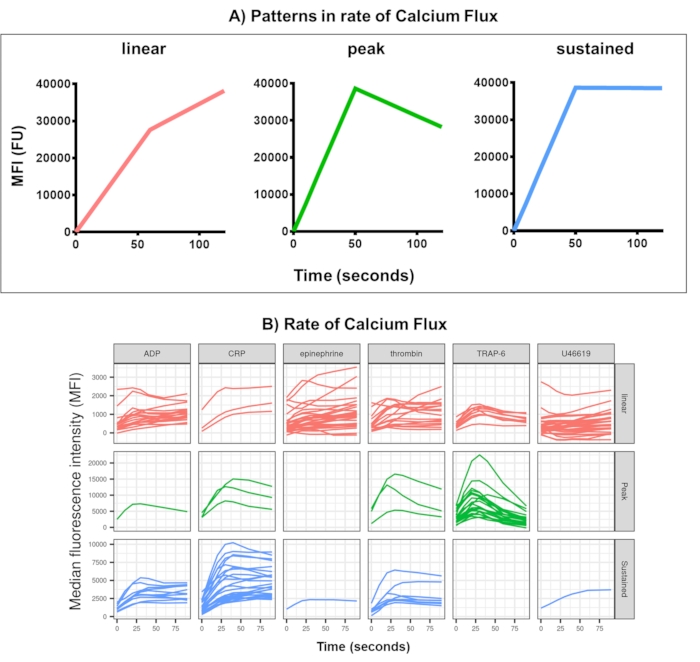
Figura 4: Saída representativa da análise Kinetx do fluxo de cálcio plaquetário em tempo real. (A) Além de fornecer métricas como taxa máxima de mudança (RoC) e RoC em vários pontos de tempo, o Kinetx também categoriza a forma da curva de fluxo de cálcio para fornecer informações adicionais sobre a ativação de plaquetas que são difíceis de capturar em uma única métrica. Dados representativos de 30 indivíduos mostram a variação típica observada no fluxo de cálcio plaquetário (B) em tempo real em resposta aos agonistas ADP, TRAP-6, CRL-XL, epinefrina e U46617. Clique aqui para ver uma versão maior desta figura.
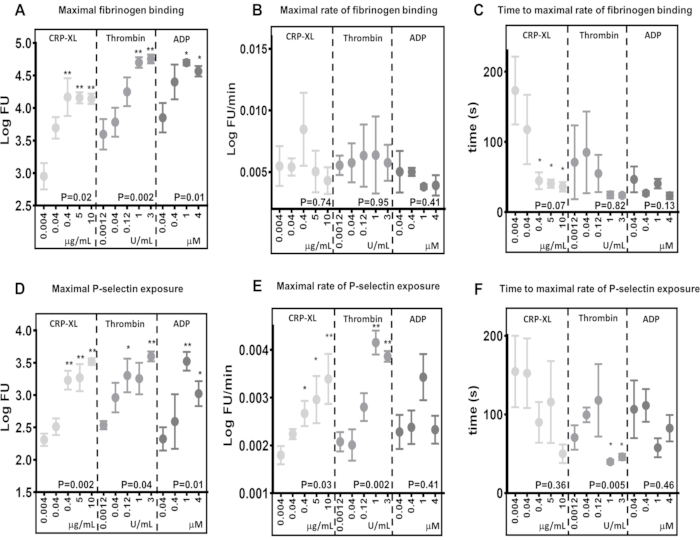
Figura 5: A concentração de agonistas determina a ativação plaquetária máxima, mas não a taxa de ativação plaquetária. A ativação plaquetária máxima - ligação ao fibrinogênio (A) ou exposição à P-selectina (D) - foi significativamente alterada positivamente pela concentração do agonista (PCR-XL, trombina ou ADP). A taxa de ativação plaquetária (B e E) e o tempo para a taxa máxima de ativação plaquetária (C e F) não mostraram relação ou uma relação mais fraca com a mudança da concentração de agonistas. Os valores de p mostram a significância em toda a faixa de concentração (teste de Kruskal-Wallis) e os asteriscos indicam uma diferença significativa (teste de comparação múltipla) dos valores individuais da concentração mais baixa. * P < 0,05, ** P < 0,01. Clique aqui para ver uma versão maior desta figura.
Discussão
A taxa na qual as plaquetas detectam, processam e respondem a estímulos ativadores pode ser um determinante essencial para a formação de trombos. Estudos anteriores descobriram que a inibição de elementos de sinalização que afetam a taxa, mas não a extensão final da ativação plaquetária, resulta na formação de trombos instáveis8. Muitos ensaios de função plaquetária medem a extensão da ativação e agregação plaquetária em resposta a diferentes condições e tratamentos; no entanto, estes não consideram a taxa de ativação das plaquetas e o tempo necessário para que esse processo complexo ocorra 3,4. Os ensaios inovadores baseados em citometria de fluxo desenvolvidos aqui monitoram de forma reprodutível a ativação plaquetária ao longo do tempo e traduzem isso em uma série de métricas para calcular a taxa máxima de ativação plaquetária e o tempo necessário para que as plaquetas atinjam essa taxa máxima e se tornem totalmente ativadas.
Os dados apresentados destacam a capacidade do ensaio em tempo real de identificar variações entre diferentes respostas ao tipo de agonista e concentração e entre indivíduos. Muitos relatos anteriores mostraram que a reatividade plaquetária é altamente variável entre indivíduos normais15,16, indicando que a taxa de ativação plaquetária também pode variar significativamente dentro da população. Os dados deste estudo demonstram que a taxa de degranulação e ligação do fibrinogênio às plaquetas parece ser ainda mais variável do que os níveis máximos de ativação plaquetária. Isso mostra que a citometria de fluxo em tempo real também pode ser utilizada como uma ferramenta valiosa e confiável para identificar variações na taxa de plaquetas na população e detectar os efeitos de diferentes agentes inibitórios ou pró-ativatórios na taxa de plaquetas como um meio adicional de medir a função plaquetária.
Quando a função plaquetária é medida usando ensaios de desfecho, podem ser feitas comparações sobre a extensão da ligação ao fibrinogênio ou liberação de grânulos entre diferentes agonistas. As curvas de loess comparando a ligação do fibrinogênio nos primeiros 5 minutos de ativação plaquetária demonstram a capacidade do ensaio em tempo real de extrair mais detalhes nas diferenças na cinética de ativação plaquetária que os ensaios de ponto final único não podem medir.
Os dados coletados do ensaio em tempo real demonstram que a velocidade com que o fibrinogênio se liga às plaquetas segue um padrão ligeiramente diferente, dependendo da via de ativação (Figura 3). Para avaliar com precisão a cinética de ativação plaquetária, é essencial usar um citômetro de fluxo não pressurizado que permita a aquisição simultânea de dados e estimulação da amostra. Também é essencial que os agonistas sejam adicionados rapidamente para garantir uma mistura quase instantânea e completa de agonistas e plaquetas. A estimulação com trombina ADP e epinefrina produz uma curva semelhante que representa um rápido início da sinalização em resposta à sensibilização do receptor, resultando na ligação do fibrinogênio às plaquetas a uma taxa rápida e constante. Em contraste, as plaquetas estimuladas pela CRP-XL são inicialmente muito lentas para se ligar ao fibrinogênio após a sensibilização inicial do receptor; no entanto, a taxa de ligação do fibrinogênio é rapidamente aumentada após esse atraso inicial. A estimulação plaquetária com U46619, um mimético de TXA2, resulta em uma rápida taxa inicial de ligação ao fibrinogênio, que diminui rapidamente para uma taxa muito lenta, levando a apenas um aumento leve e constante na ligação ao fibrinogênio ao longo do tempo.
O Kinetx foi projetado para ser de código aberto, reproduzível e fácil de implementar, a fim de contornar problemas com software proprietário, como custo e inflexibilidade. Como tal, precisava ser desenvolvido com software que não era proprietário. O R foi escolhido por ser amplamente utilizado por biólogos, fácil de instalar, gratuito e de código aberto. Esse ambiente de código aberto permite que usuários proficientes em R alterem parâmetros como grau de suavização, identificação de pontos de dados periféricos ou escalas de tempo. No entanto, para ajudar os pesquisadores que não estão familiarizados com o R, o Kinetix também foi desenvolvido para que a análise possa ser realizada por meio de um único comando (kinetxProcess ou kinetxProcessCalcium, dependendo dos dados que estão sendo analisados). O software Kinetix demonstrado aqui pode calcular uma variedade de métricas, incluindo valores para os níveis máximos, taxa e aceleração da ligação ao fibrinogênio ou exposição à P-selectina e os pontos de tempo em que esses máximos ocorrem. A cinética da ativação plaquetária em resposta a diferentes vias estimulatórias pode ser comparada com mais precisão usando esses números.
Comparações entre diferentes estímulos agonistas nos níveis máximos de ligação ao fibrinogênio e nas taxas de ligação do fibrinogênio às plaquetas são bons exemplos de onde a taxa de ativação plaquetária pode variar independentemente da ligação máxima. Comparando a ligação máxima ao fibrinogênio após 5 min de estimulação com 0,04 μM de ADP (3,85 LogFU) e 0,04 μg/mL CRP-XL (3,70 LogFU), ambos os agonistas resultaram em uma quantidade semelhante de fibrinogênio ligado (Figura 5A). As taxas máximas de ligação ao fibrinogênio mostram uma diferença ainda menor (0,04 μM ADP - 0,0050 LogFU / minuto; 0,04 μg / mL CRP-XL - 0,0054 LogFU / min), indicando que a taxa geral de ligação ao fibrinogênio é semelhante entre esses dois estímulos (Figura 5B). No entanto, quando o tempo de atraso da ativação plaquetária é comparado, há uma diferença clara mostrando CRP-XL (117 s até a taxa máxima) acelerando a uma taxa muito mais lenta do que o ADP (47 s até a taxa máxima) (Figura 5C). Assim, fica claro que a estimulação com ADP resulta em uma resposta inicial muito mais rápida (P < 0,001) quando comparada à PCR-XL. Quando observadas em conjunto, essas medições da cinética plaquetária em resposta a dois agonistas diferentes descrevem uma resposta inicial rápida à estimulação do ADP que acelera lentamente e permanece em uma taxa constante. Em contraste, a estimulação da PCR-XL resulta em uma taxa inicial lenta de ativação, que acelera rapidamente muito mais tarde, levando a uma taxa geral e níveis semelhantes de ligação ao fibrinogênio como ADP. Essas diferenças entre os níveis máximos, a taxa e a aceleração da ligação ao fibrinogênio demonstram que vários parâmetros estão envolvidos na medição da rapidez com que as plaquetas são ativadas. O ensaio em tempo real e a análise Kinetx podem medir e comparar esses parâmetros, descrever o tempo gasto desde a sensibilização do receptor até a resposta plaquetária e compará-lo entre diferentes vias de sinalização.
O aumento da concentração de agonistas não tem um efeito significativo na taxa de ligação do fibrinogênio às plaquetas. No entanto, o tempo necessário para atingir a taxa máxima de ligação ao fibrinogênio diminui à medida que a concentração de agonistas aumenta, sugerindo que as plaquetas se ligam ao fibrinogênio a uma taxa constante e a saturação do receptor desempenha um papel mais proeminente na rapidez com que as plaquetas se ligam ao fibrinogênio.
O ensaio e a análise do fluxo de cálcio descritos são um ensaio de cálcio rápido e fácil de realizar que pode ser incorporado como amostras extras no ensaio em tempo real, permitindo a análise da ligação do cálcio e do fibrinogênio plaquetário e da P-selectina na mesma série de amostras. O pacote de análise sob medida fornece uma avaliação aprofundada da cinética do fluxo de cálcio, incluindo a forma da resposta, a resposta máxima e o tempo para a resposta máxima. Esses parâmetros podem então ser comparados quanto à variação entre doadores e em resposta a vários agentes farmacêuticos. O fluxo de cálcio nas plaquetas foi previamente estudado em plaquetas usando uma variedade de ensaios baseados em citometria de fluxo 17,18,19. Aliotta et al.14, descrevem um ensaio elegante capaz de analisar a cinética de múltiplos íons intracelulares. O ensaio de cálcio apresentado aqui baseia-se nesses ensaios publicados anteriormente, incluindo o pacote de análise que permite maior flexibilidade, uma exploração mais aprofundada dos dados com o benefício da análise de alto rendimento para vários doadores em um curto espaço de tempo.
Estudos anteriores demonstraram que a inibição ou ausência de certas moléculas sinalizadoras resulta em uma taxa de ativação plaquetária alterada, o que se traduz diretamente na formação de trombos 8,9. No passado, a cinética de ativação plaquetária podia ser medida por citometria de fluxo em vários pontos de tempo fixos, que podem ser usados para calcular e comparar, por exemplo, a taxa de externalização de GPIIbIIIa em resposta a diferentes agonistas20. O ensaio em tempo real e a análise Kinetx descritos neste artigo fornecem um método simples, disponível gratuitamente e preciso para medir a taxa e o ponto final da ativação plaquetária das plaquetas em repouso. Isso provavelmente é importante na identificação de variações fisiologicamente relevantes na função plaquetária que podem ser perdidas quando apenas as leituras finais são medidas.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este projeto foi apoiado pela British Heart Foundation (PG / 16/36/31967, RG / 20/7/34866 e RG / 15/2/31224).
Materiais
| Name | Company | Catalog Number | Comments |
| 9,11-Dideoxy-11α,9α-epoxymethanoprostaglandin F2α - U46619 | Sigma-Aldrich, Poole, UK | D8174-1MG | |
| Accuri C6 flow cytometer with BD Csampler | Beckton Dickinson, UK | 660517 + 660519 | |
| Adenosine diphosphate | Sigma-Aldrich, Poole, UK | A2754-1G | |
| APC-labelled anti-P-selectin (CD62p) | BD Biosciences, UK | 550888 | |
| Corning polypropylene 96-well round-bottomed, non-treated microtitre plate | Sigma-Aldrich, Poole, UK | CLS3879-50EA | |
| Cross-linked collagen related peptide (CRP-XL) | CambCol, UK | ||
| Epinephrine | Sigma-Aldrich, Poole, UK | E4375-1G | |
| FITC-labelled anti-fibrinogen antibody | Dako, Agilent Technologies, UK | F011102-2 | |
| Fluo-4 Direct dye | Thermo-Fisher Scientific | F10472 | |
| Gel loading tips | Starlab, UK | I1022-0600 | |
| Gly-Pro-Arg-Pro peptide | Sigma-Aldrich, Poole, UK | G1895-5MG | |
| Thrombin | Sigma-Aldrich, Poole, UK | SRE0003-10KU | |
| Thrombin receptor activator peptide 6 (TRAP-6) | Bachem, St Helens, UK | H-2936.0005 | |
| Vacuette 9NC coagulation 3.2 % trisodium citrate (0.109 mol/L) | Greiner Bio-one LTD, Stonehouse, UK | 454327 |
Referências
- Bye, A. P., Unsworth, A. J., Gibbins, J. M. Platelet signaling: a complex interplay between inhibitory and activatory networks. Journal of Thrombosis and Haemostasis: JTH. 14 (5), 918-930 (2016).
- Jones, C. I., Barrett, N. E., Moraes, L. A., Gibbins, J. M., Jackson, D. E. Endogenous inhibitory mechanisms and the regulation of platelet function. Methods in Molecular Biology. 788, 341-366 (2012).
- Paniccia, R., Priora, R., Liotta, A. A., Abbate, R. Platelet function tests: a comparative review. Vascular Health and Risk Management. 11, 133-148 (2015).
- Saboor, M., Moinuddin, M., Ilyas, S. New horizons in platelets flow cytometry. The Malaysian Journal of Medical Sciences : MJMS. 20 (2), 62-66 (2013).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88, 1525-1541 (1996).
- Pasquet, J. M., Noury, M., Nurden, A. T. Evidence that the platelet integrin alphaIIb beta3 is regulated by the integrin-linked kinase, ILK, in a PI3-kinase dependent pathway. Thrombosis and Haemostasis. 88 (1), 115-122 (2002).
- Stevens, J. M., Jordan, P. A., Sage, T., Gibbins, J. M. The regulation of integrin-linked kinase in human platelets: evidence for involvement in the regulation of integrin alpha 2 beta 1. Journal of Thrombosis and Haemostasis: JTH. 2 (8), 1443-1452 (2004).
- Jones, C. I., et al. Integrin-linked kinase regulates the rate of platelet activation and is essential for the formation of stable thrombi. Journal of Thrombosis and Haemostasis: JTH. 12 (8), 1342-1352 (2014).
- Cifuni, S. M., Wagner, D. D., Bergmeier, W. CalDAG-GEFI and protein kinase C represent alternative pathways leading to activation of integrin alphaIIbbeta3 in platelets. Blood. 112 (5), 1696-1703 (2008).
- Stolla, M., et al. The kinetics of alphaIIbbeta3 activation determines the size and stability of thrombi in mice: implications for antiplatelet therapy. Blood. 117 (3), 1005-1013 (2011).
- Kawasaki, H., et al. A Rap guanine nucleotide exchange factor enriched highly in the basal ganglia. Proceedings of the National Academy of Sciences of the United States of America. 95 (22), 13278-13283 (1998).
- . R Available from: https://www.r-project.org/ (2021)
- . R Studio Available from: https://rstudio.com/products/rstudio/download/ (2021)
- Yee, D. L., Sun, C. W., Bergeron, A. L., Dong, J. F., Bray, P. F. Aggregometry detects platelet hyperreactivity in healthy individuals. Blood. 106 (8), 2723-2729 (2005).
- Panzer, S., Hocker, L., Koren, D. Agonists-induced platelet activation varies considerably in healthy male individuals: studies by flow cytometry. Annals of Hematology. 85 (2), 121-125 (2006).
- Aliotta, A., Bertaggia Calderara, D., Alberio, L. Flow cytometric monitoring of dynamic cytosolic calcium, sodium, and potassium fluxes following platelet activation. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 97 (9), 933-944 (2020).
- do Ceu Monteiro, M., Sansonetty, F., Goncalves, M. J., O'Connor, J. E. Flow cytometric kinetic assay of calcium mobilization in whole blood platelets using Fluo-3 and CD41. Cytometry. 35 (4), 302-310 (1999).
- Vines, A., McBean, G. J., Blanco-Fernandez, A. A flow-cytometric method for continuous measurement of intracellular Ca(2+) concentration. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 77 (11), 1091-1097 (2010).
- Weber, A. A., Schror, K. Differential inhibition of adenosine diphosphate- versus thrombin receptor-activating peptide-stimulated platelet fibrinogen binding by abciximab due to different glycoprotein IIb/IIIa activation kinetics. Blood. 98 (5), 1619-1621 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados