Method Article
Kinetx: 혈소판 활성화를 실시간으로 정량적으로 측정하고 분류하기 위한 결합된 유세포 분석 및 분석 소프트웨어 프레임워크입니다.
요약
혈소판은 다양한 자극에 빠르게 반응합니다. 이 논문은 실시간 유세포 분석 기반 혈소판 기능 분석과 혈소판 과립 방출, 피브리노겐 결합 및 세포 내 칼슘 플럭스의 정량적 동역학 측정을 가능하게 하는 새로 개발된 맞춤형 오픈 소스 소프트웨어(Kinetx)에 대해 설명합니다.
초록
혈소판은 혈관 손상에 빠르게 반응하고 출혈을 제한하기 위한 다양한 자극에 반응하여 활성화됩니다. 많은 혈소판 기능 검사는 혈소판 활성화 속도가 아닌 정의된 기간 이후의 종말점 반응을 측정합니다. 그러나 혈소판이 세포 외 자극을 기능적 반응으로 전환하는 속도는 혈소판이 손상에 얼마나 효율적으로 반응하고, 형성되는 혈전과 결합하고, 다른 혈소판을 모집하라는 신호를 보낼 수 있는지를 결정하는 데 필수적인 요소입니다. 이 논문은 동시 데이터 수집과 시료 자극을 가능하게 하고 새로 개발된 맞춤형 오픈 소스 소프트웨어(Kinetx)를 활용하여 혈소판 과립 방출, 피브리노겐 결합 및 세포 내 칼슘 플럭스의 정량적 동역학 측정을 가능하게 하는 유세포 분석 기반 혈소판 기능 분석에 대해 설명합니다. Kinetix는 사용자가 평활화 정도, 외곽 데이터 포인트 식별 또는 시간 척도와 같은 매개변수를 변경할 수 있도록 개발되었습니다. R 환경에 익숙하지 않은 사용자를 돕기 위해 단일 명령으로 Kinetix 데이터 분석을 수행할 수 있습니다. 이를 통해 속도, 가속, 피크 속도까지의 시간, 칼슘 피크까지의 시간 및 정성적 형태 변화와 같은 실시간 혈소판 활성화 메트릭을 정확하고 재현 가능하게 측정하고 분류할 수 있습니다. 혈소판 활성화의 동역학적 측정은 활성화의 첫 번째 단계에서 혈소판의 행동에 대한 독특한 통찰력을 제공하며, 혈소판이 형성되는 혈전으로의 동원을 예측하는 방법을 제공할 수 있습니다.
서문
혈소판은 지혈에서 중심적인 역할을 하며 혈관 손상에 대한 빠르고 다각적인 반응을 일으킵니다 1,2. 현재 혈소판 기능 검사는 생체 내 지혈 작용을 대표하는 혈소판 반응성의 다양한 측면을 측정합니다. 전통적으로 혈소판 기능은 최대 활성화를 달성할 수 있을 만큼 충분히 오랫동안 자극된 혈소판에서 피브리노겐 결합, 과립 방출 또는 혈소판 응집을 측정하는 종말점 분석을 사용하여 평가되었습니다 3,4. 이러한 검사는 혈소판이 세포 외 자극을 세포 내 신호 및 칼슘 플럭스로 변환한 후 탈과립화되어 성장하는 혈전에 결합하는 데 걸리는 시간을 고려하지 않습니다. 혈류는 정맥에서 최대 20dynes/cm3, 대동맥에서 80dynes/cm33의 전단 속도로 흐르며5, 혈소판이 세포 외 자극을 빠르게 감지, 처리 및 반응하여 혈전을 형성하고 지속적인 성장을 지원함으로써 이러한 빠른 유속에 대응할 필요가 있음을 강조합니다.
혈소판 활성화 속도는 혈소판 활성화의 최대 범위와 독립적으로 변할 수 있습니다. 인테그린 결합 키나아제(ILK)는 혈소판에서 β1 및 β3 인테그린을 조절하는 데 관여하는 단백질입니다 6,7. in vivo에서 ILK의 억제 또는 특이적 결실은 기능적 ILK8이 없을 때 혈소판 활성화의 최대 정도가 아닌 속도가 영향을 받는 것으로 나타났습니다. 응집 속도와 최대 응집 수준 간의 차이는 RAP111을 통한 인사이드 아웃 신호 조절에 관여하는 신호 분자인 CALDAG GEFI 9,10이 결핍된 마우스에서도 확인되었습니다.
이러한 결과는 혈소판 속도와 최대 활성화 수준이 자율적일 수 있으며 최대 활성화의 측정이 이 시점까지 혈소판 행동을 설명하지 못할 수 있음을 보여줍니다. 혈소판이 활성화되는 데 걸리는 시간의 이러한 차이는 성장하는 혈전체에 대한 초기 결합에 큰 영향을 미칠 수 있으며, 혈전의 구조와 전체 크기에 영향을 미칠 수 있습니다. 혈소판 활성화율과 최대 활성화 사이의 이러한 차이는 혈소판 활성화 속도를 정확하게 측정하기 위한 분석의 필요성을 강조하고 집단 내 차이를 감지하는 데 사용할 수 있습니다.
이 논문은 혈소판 활성화와 칼슘 플럭스를 실시간으로 정확하게 측정하고 혈소판이 활성화되는 속도와 혈소판이 최대 활성화 속도 및 최대 칼슘 플럭스에 도달하는 데 걸리는 시간을 포함한 다양한 지표를 계산하는 방법을 설명합니다. 혈소판 활성화에 대한 이러한 동역학적 측정은 혈전성 형성의 첫 단계에서 혈소판의 거동에 대한 더 나은 통찰력을 제공하고 혈소판이 형성되는 혈전으로 얼마나 빨리 동원될 수 있는지 예측하는 방법을 제공합니다.
프로토콜
이 프로토콜은 기저 질환이 없고 서면 동의 후 혈소판 기능을 방해하는 것으로 알려진 약물을 복용하지 않는 건강한 기증자의 인간 전혈 및 혈소판을 사용했으며 University of Reading Research Ethics Committee의 승인을 받았습니다.
1. 혈액 채취 및 혈소판이 풍부한 혈장 준비
- 3.2% 구연산나트륨이 함유된 액포테이너에 말초 혈액을 수집합니다.
- 처음 3mL는 버립니다.
- 원심분리 전에 혈액을 30°C에서 30분 동안 그대로 두십시오.
- 혈소판이 풍부한 혈장(PRP)을 140 x g 에서 실온에서 20분 동안 원심분리하여 준비한 후 37°C에서 원심분리 후 60분 이내에 완료된 분석 기간 동안 배양했습니다.
2. 악기 준비
참고: 비가압 유체 시스템은 유세포 분석기가 이벤트를 기록하는 동시에 혈소판이 자극되기 때문에 실시간 유세포 분석에 필수적입니다.
- 비가압 유세포 분석기를 사용하여 실시간 유세포 분석을 수행합니다.
- 37°C에서 분석을 수행하려면 마우스 해부 매트를 스테이지에 부착하여 96웰 플레이트를 배치합니다. 분석 기간 동안 매트를 37°C로 가열합니다.
- 37°C에서 지속적으로 배양할 수 있도록 가열된 매트 위에 96웰 플레이트를 놓습니다(그림 1)
3. 분석 준비
- 피브리노겐 결합 및 P-selectin 발현
- 폴리프로필렌 96웰 바닥이 둥글고 처리되지 않은 미세역가 플레이트를 4°C에서 하룻밤 동안 Hepes 완충 식염수(HBS; 10mM Hepes pH 7.4; 150mM NaCl, 5mM KCl, 1mM MgSO4·7H20)에 5% 소 혈청 알부민(BSA)으로 코팅합니다.
- 5mM 포도당(HBS-G)을 함유한 HBS에서 항체 혼합물을 준비합니다. HBS-G(최종 부피: 225 μL)에 플루오레세인 이소티오시아네이트(FITC) 표지 항피브리노겐 항체(FITC-FGN, 희석 1: 37.5 (v/v)) 및 알로피코시아닌(APC) 표지 항-P-셀렉틴(APC-CD62P, 희석 1: 37.5 (v/v))을 추가하고 37°C에서 96웰 플레이트에서 배양합니다.
- 이벤트를 수집하기 직전에 1:600(v/v)의 희석으로 HBS-G-항체 혼합물에 PRP를 추가합니다.
참고: 이벤트 한도를 초과하지 않고 샘플의 혈소판 응집을 줄이기 위해 적은 양의 PRP가 필요합니다. 혈소판 희석은 예비 연구에서 검토되었으며 활성화율에 영향을 미치지 않습니다. - FITC-FGN(희석 1: 37.5(v/v)) 및 APC-CD62P(희석 1: 37.5(v/v))를 함유한 활성화 혼합물과 37°C에서 작용제를 배양합니다. 작용제는 Gly-Pro-Arg-Pro 펩타이드(GPRP, 1.18 mM), 가교 콜라겐 관련 펩타이드(CRP-XL; 0.004-10 μg/mL), 아데노신 이인산염(ADP; 0.04-4 μM), 에피네프린(에피; 20-200 μM), 9,11-Dideoxy-11α,9α-epoxymethanoprostaglandin F2α (U46619; 0.02-5 μM) 및 트롬빈 수용체 활성화 펩타이드 6 (TRAP-6; 0.04-10 μM)을 포함한다.
- 칼슘 플럭스
참고: 이 분석은 상용 칼슘 분석 키트(Table of Materials)를 사용하여 수행되었습니다.- 폴리프로필렌 96웰 바닥이 둥글고 처리되지 않은 미세역가 플레이트를 4°C에서 밤새 Hepes 완충 식염수에 5% BSA로 코팅합니다.
- 칼슘 분석 염료를 준비하려면 칼슘 분석 시약 1병에 칼슘 분석 완충액 100mL와 프로베네시드 원액 2mL(250mM)를 추가하여 2x 칼슘 시약 로딩 용액을 얻습니다.
- Fluo-4/HBS-G를 준비하려면 칼슘 분석 염료를 HBS-G로 1:1 비율로 희석하고 0.22μM 필터를 통해 여과합니다. 37°C에서 96웰 플레이트의 적절한 웰에 225μL의 Fluo-4/HBS-G를 추가합니다.
- PRP를 37°C에서 30분 동안 Fluo-4/HBS-G로 1:1 희석하여 배양합니다.
- Fluo-4/HBS-G에서 활성화 혼합물을 준비하고 37°C에서 배양합니다. 작용제에는 GPRP가 있는 경우 트롬빈(1U/mL), CRP-XL(0.5μg/mL), ADP(1μM), 에피네프린(20μM), U46619(1μM) 및 TRAP-6(1μM)이 포함됩니다.
- 이벤트를 수집하기 직전에 1:600(v/v, 최종 부피 300mL 중 0.5mL)의 최종 PRP 희석(작용제 첨가 후)으로 225μL의 Fluo-4/HBS-G 혼합물에 PRP/Fluo-4/HBS-G를 추가합니다.
4. 분석 절차 및 데이터 수집
- 유세포 분석기를 평균 1000eps(초당 이벤트) 수와 최대 3000eps의 '느림' 유속으로 설정합니다. 세포 파편이 기록되지 않도록 임계값을 20000으로 설정합니다.
- 전방 산란(FSC) 및 측면 산란(SSC) 플롯을 사용하여 혈소판 집단을 게이트합니다. 데이터 수집의 경우 FSC-A 대 SSC-A를 플롯하여 혈소판 집단을 정확하게 게이트하고 FL1 또는 FL4 대 시간을 플롯하여 시간 경과에 따른 형광 이벤트를 기록합니다.
- 유세포 분석기는 이벤트 기록을 시작하는 데 14초가 걸립니다. 그런 다음, 자발적인 혼합을 보장하기 위해 겔 로딩 팁을 사용하여 75μL의 활성화 혼합물을 빠르게 추가하기 전에 기기가 각 웰의 이벤트를 5초 동안 더 기록하도록 합니다(그림 1).
- 5분 동안 이벤트를 수집하고 플롯을 설정하여 488(FL1, 533/30 필터 - FITC-fibrinogen/FLUO-4) 채널 대 시간 및 633(FL4, 675/25 필터 - APC-P-selectin) 채널 대 시간을 기록합니다.
- 각 웰의 488 및 633 채널에 대한 플롯 데이터를 CSV 파일로 저장합니다.
5. 데이터 분석
- 최신 버전의 Kinetx12를 다운로드합니다.
참고: 다운로드에는 분석에서 생성된 데이터를 분석하는 데 필요한 모든 코드가 포함되어 있으며 10개의 공여자의 실험 데이터 및 분석에서 생성된 출력으로 구성된 테스트 세트가 함께 제공됩니다(이러한 결과는 다음 절차를 통해 재생성 및 검증할 수 있음)(그림 2). - R 환경 설정
- RStudio 환경을 통해 프로그래밍 언어 R을 사용합니다. R13, RStudio14 및 ggplot2, dplyr, plotrix, minpack.lm, tidyverse, psych 패키지를 설치합니다. 모든 필수 구성 요소 패키지가 성공적으로 설치되었는지 확인합니다.
- 메타데이터 생성: wellData.txt라고 하는 텍스트 파일을 데이터와 동일한 디렉토리에 배치합니다. 작용제, 농도, 항체 및 각 CSV 파일을 생성하는 데 사용되는 분석(기능 또는 칼슘)에 대해 설명합니다.
- 두 번째 텍스트 파일('IsotypeData.txt')을 동일한 디렉토리에 배치하고 isotype을 정의합니다. 다운로드에 제공된 파일('data/wellData.txt' 및 'data/IsotypeData.txt')은 템플릿 역할을 할 수 있으며, 대체 작용제, 억제제 및 농도에 쉽게 적용할 수 있습니다.
- 데이터 분석: Kinex는 5.2.5-5.2.7단계에서 정의된 세 가지 기능으로 구성됩니다.
- kinetxProcess.R: 이 함수는 원시 기능 유세포 분석 데이터를 처리합니다. kinetxProcess('data location','where to put outputs','FL1' (FITC-anti-fibrinogen의 경우) 또는 'FL4' (APC-CD62P의 경우)를 실행하려면.
- kinetxProcessCalcium.R: 이 함수는 칼슘 플럭스 데이터를 분석하고 레이블을 지정합니다. kinetxProcessCalcium('data location','where to put outputs','FL1')을 실행하려면
- kinetxSummary.R: 이 함수는 데이터를 요약합니다. 실행하려면 kinetxSummary('data location','where to put outputs','FL1')를 입력합니다.
- 테스트 데이터에서 위의 모든 함수(5.2.5-5.2.7)를 실행하려면 스크립트(test. R).
참고: 처음 두 함수는 원시 데이터와 피팅된 곡선을 보여주는 각 기증자에 대한 그림을 생성합니다. 모든 출력과 데이터를 요약하는 스프레드시트가 출력 위치에 배치됩니다.
결과
기능적 실시간 유세포 분석의 분석은 작용제와 공여체 간의 활성화 곡선 모양의 차이를 보여줍니다
Kinetx를 사용한 기능 데이터(P-selectin 노출 및 피브리노겐 결합)의 데이터 분석은 합리적인 범위(>200000 또는 <1) 및 <2.80초(이 지점으로 설정된 0 시간)를 벗어난 데이터 포인트를 제거하고, 데이터를 isotype의 중앙값으로 정규화하고, 부드러운 이동 평균 곡선(함수 loess를 통해)을 맞춥니다. Kinetx는 또한 다음과 같이 피팅된 평활선 모양, 절대값 및 변화율을 기반으로 메트릭 및 범주를 할당합니다: (1) RoC - 처음 120초 동안 평활선의 평균 상승; (2) 레이블 - FL1의 경우 40 및 80, FL4의 경우 5 및 10의 컷오프에 따라 설정된 응답을 빠르게, 중간 또는 느리게 분류합니다. (3) EarlyRoC - 처음 20초 동안 평활 라인의 평균 상승; (4) 형상 - 낮은 반응자, 증가, 선형 또는 감소(그림 3A) - 낮은 반응자는 FL1 < 4000 또는 FL4 < 1000으로 결정되며, 레이블의 증가, 선형 및 감소는 형상 메트릭 - RoC(120초)/EarlyRoC, 여기서 형상 메트릭 > 2 증가, 선형 형상 메트릭 0.9-2 사이 및 형상 메트릭 <0.9 감소; (5) 0 초, 10 초, 20 초, 30 초, 40 초, 60 초, 90 초, 120 초, 180 초, 동형 중앙값, 최대 및 최소 변화율 및 가속도, 모든 레이블 및 범주.
작용제 ADP, TRAP-6, CRP-XL, 에피네프린 및 U46617의 단일 농도에 대한 반응으로 활성화 후 5분 동안 혈소판 피브리노겐 결합 및 P-셀렉틴 노출을 30명의 공여자에서 분석했습니다. 서로 다른 작용제에 대한 반응으로 피브리노겐 결합 및 P-셀렉틴 노출에 대한 지표는 반응의 형태에 상당한 차이가 있음을 보여줍니다(그림 3). TRAP-6 및 ADP로 자극된 혈소판은 피브리노겐 결합이 더 빠르게 가속화되는 것으로 나타났으며, 많은 공여자의 경우 나중에 속도가 느려졌습니다(그림 3B). CRP-XL, 트롬빈, 에피네프린에 대한 피브리노겐 결합은 반응률이 증가하거나 선형적인 것으로 나타날 가능성이 더 높았다. 많은 공여자들은 피브리노겐 결합 속도가 급격히 가속화되기 전에 CRP-XL에 대해 상대적으로 긴 지연 시간을 보였다. U46619에 대한 응답은 종종 낮음으로 분류되었습니다. 대조적으로, P-셀렉틴 노출은 다시 낮은 반응 수준을 보인 U46619를 제외한 모든 작용제에 대해 선형 또는 증가하는 반응률을 보일 가능성이 더 높았습니다(그림 3C).
혈소판 활성화 중 세포 내 칼슘 플럭스는 실시간 유세포 분석을 사용하여 정확하게 측정할 수 있습니다.
칼슘 플럭스 분석의 데이터 분석은 합리적인 범위를 벗어난 데이터 포인트를 제거하고(< 2.80초 0 시간으로 이 지점으로 설정됨) 부드러운 이동 평균 곡선을 맞춥니다(함수 loess를 통해). Kinetx는 메트릭을 할당하고 범주는 다음과 같이 피팅된 부드러운 선 모양, 절대값 및 변화율에 따라 할당됩니다: (1) 범주 - 선형, 피크 또는 지속으로 설명되는 조기 상승, 최대 및 최대로부터의 최종 하락을 기반으로 칼슘 반응의 모양을 설명합니다(그림 4A). (2) 속도 - 빠른 30초의 변화율을 설명하며 변화 없음, 느리음, 중간 또는 빠름(10, 40 및 80에서 차단됨)으로 정의됩니다. Kinetx는 또한 0 s, 10 s, 20 s, 30 s, 40 s, 60 s, 90 s, 120 s, 180 s의 변화 수준 및 속도, 최대 및 최소 변화율 및 가속도, 모든 레이블 및 범주를 제공하여 데이터를 요약하는 스프레드시트를 생성하고 각 기부자에 대한 데이터 수치를 생성합니다. 30명의 개인에서 이 방법으로 측정한 칼슘 플럭스의 예는 다시 개인과 작용제 간에 다른 활성화 패턴을 보여주었습니다(그림 4B). CRP-XL은 주로 지속적인 칼슘 반응을 보인 반면, TRAP-6에 대한 반응은 가장 높은 반응을 보였다. 다른 모든 작용제는 주로 선형 반응을 일으켰습니다.
Real-time 유세포 분석은 다양한 작용제 및 농도에 대한 반응으로 최대 활성화 수준의 차이를 식별합니다.
결과는 실시간 유세포 분석 분석이 서로 다른 수용체(10 μg/mL CRP-XL 대 3 U/mL 트롬빈 P < 0.001; 10 μg/mL CRP-XL 대 1 U/mL 트롬빈 P < 를 통한 자극에 반응하여 피브리노겐 결합(그림 5A)과 P-selectin 노출(그림 5D)의 최대 수준 차이를 감지할 수 있는 능력이 있음을 보여줍니다.0.001). 또한 분석법이 작용제 농도의 차이에 민감하다는 것을 보여주며, 최대 피브리노겐 결합 및 P-셀렉틴 노출 수준은 작용제 농도가 높을수록 증가합니다(피브리노겐 결합 - CRP-XL - 0.004 μg/mL 대 0.4, 5, 10 μg/mL, P < 0.01; 트롬빈 - 0.0012 U/mL 대 1 및 3 U/mL, P < 0.01; ADP - 0.04 μg/mL 대 1 및 4 μM, P < 0.05).
실시간 유세포 분석 분석은 혈소판 활성화율에서 공여자들 간의 변동성을 감지할 수 있을 만큼 민감합니다.
혈소판 활성화의 최대 속도는 형광 데이터에 평활 이동 평균(loess)을 피팅한 다음 이를 사용하여 피브리노겐 결합 및 P-셀렉틴 노출의 최대 속도를 계산하여 결정되었습니다(그림 5B, E). 이 데이터는 개별 공여자들 간에 상당한 차이를 보여주며, 유세포 분석 분석은 이러한 차이를 검출할 수 있을 만큼 민감합니다. 결과는 작용제 농도 증가가 피브리노겐 결합의 최대 속도에 거의 영향을 미치지 않는다는 것을 나타냅니다(그림 5B). 대조적으로, P-셀렉틴 노출의 최대 비율은 트롬빈 및 CRP-XL 농도가 높을수록 증가하지만 ADP 농도가 증가함에 따라 증가하지 않습니다(그림 5E).
혈소판 활성화의 지연 시간 변화는 실시간 유세포 분석을 사용하여 감지할 수 있습니다.
혈소판 활성화의 최대 속도까지의 시간은 피브리노겐 결합 및 P-셀렉틴 노출의 최대 속도에 도달한 시점을 계산하여 결정되었습니다(그림 5C, F). 피브리노겐 결합 및 P 셀렉틴 노출의 최대 비율은 특히 낮은 작용제 농도에서 공여자마다 다릅니다. CRP-XL의 농도가 증가함에 따라 혈소판을 자극하면 작용제 농도가 높을수록 피브리노겐 결합의 최대 속도에 도달하는 데 시간이 덜 걸리고 공여자들 간의 변동성이 적다는 것을 보여줍니다. 그러나 이러한 경향은 트롬빈 자극이나 ADP 자극에서는 나타나지 않습니다(그림 5C). 이 분석은 일부 상황에서 작용제 농도를 높이면 최대 혈소판 활성화 속도를 변경하지 않고 혈소판 활성화가 시작되는 데 걸리는 시간(지연 시간)이 감소하고 이 두 가지 측정을 모두 이 분석으로 평가할 수 있음을 보여줍니다.
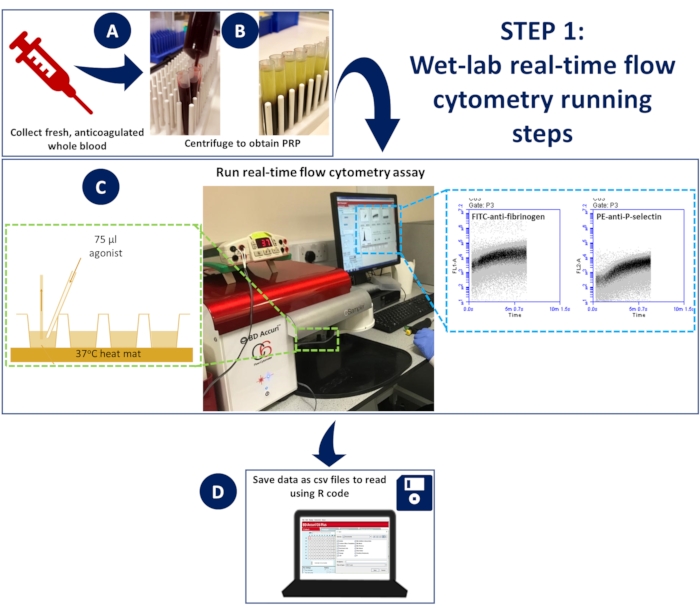
그림 1: 습식 실험실 실시간 유세포 분석. (A) 항응고된 전혈을 (B) 원심분리하여 혈소판이 풍부한 혈장(PRP)을 얻었습니다. (C) 적절한 항체 또는 칼슘 지시약 염료를 함유하는 희석된 PRP를 96-웰 플레이트에 넣고 비가압 유세포 분석기에 로드하고 해부 매트를 사용하여 37°C로 유지했습니다. 항체 또는 칼슘 염료 및 작용제를 포함하는 활성화 혼합물로 샘플을 획득하는 동안 자극하고, 자발적인 혼합을 보장하기 위해 겔 로딩 팁을 사용하여 웰에 빠르게 첨가했습니다. (D) 5분 동안 이벤트를 수집하고, 각 웰에 대한 데이터의 CSV 파일을 저장했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
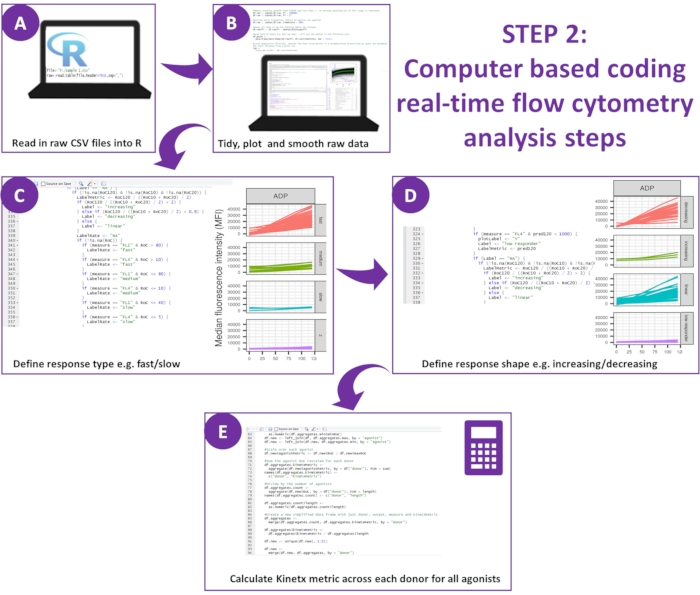
그림 2: 데이터 분석의 개략도. (A) R 환경이 구성되고 메타데이터가 생성되었습니다. (B) 외곽 데이터를 제거하고 부드러운 이동 평균(황토) 곡선을 적합했습니다. (C) 반응 유형 및 (D) 반응 형태가 정의되었습니다. (E) 메트릭을 계산하고, 내보내고, 각 기부자에 대한 수치를 생성했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
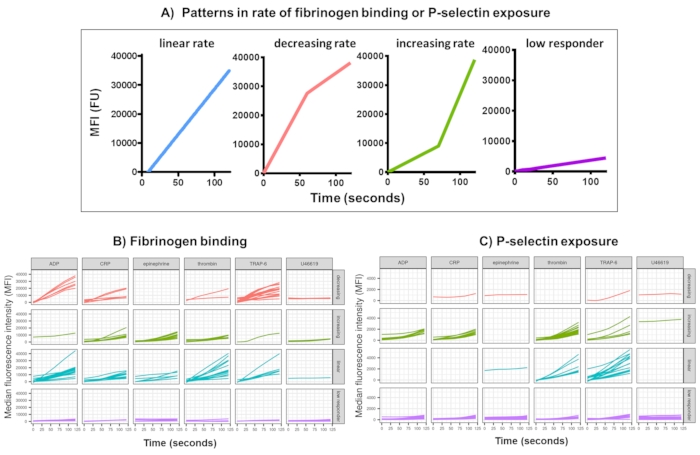
그림 3: 실시간 혈소판 피브리노겐 결합 및 P-selectin 발현에 대한 Kinetx 분석의 대표적인 결과. (A) 다양한 시점에서의 최대 변화율(RoC) 및 RoC와 같은 지표를 제공할 뿐만 아니라 Kinex는 곡선의 모양을 분류하여 단일 지표에서 포착하기 어려운 혈소판 활성화에 대한 추가 정보를 제공합니다. 30명의 개인에 대한 대표 데이터는 작용제 ADP, TRAP-6, CRL-XL, 에피네프린 및 U46617에 대한 반응으로 실시간 혈소판 (B) 피브리노겐 결합 및 (C) P-셀렉틴 발현에서 볼 수 있는 전형적인 변화를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
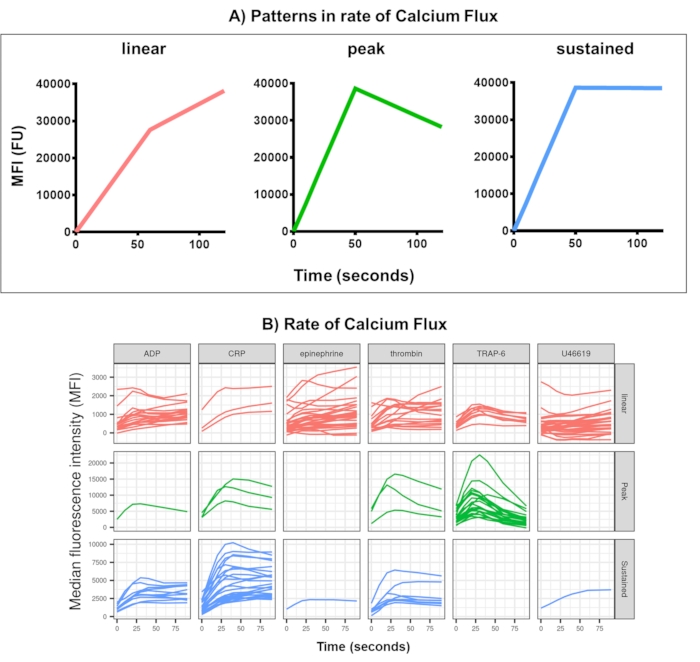
그림 4: 실시간 혈소판 칼슘 플럭스에 대한 Kinetx 분석의 대표적인 결과. (A) Kinetx는 다양한 시점에서의 최대 변화율(RoC) 및 RoC와 같은 지표를 제공할 뿐만 아니라 칼슘 플럭스 곡선의 모양을 분류하여 단일 지표로 포착하기 어려운 혈소판 활성화에 대한 추가 정보를 제공합니다. 30명의 개인에 대한 대표 데이터는 작용제 ADP, TRAP-6, CRL-XL, 에피네프린 및 U46617에 대한 반응으로 실시간 혈소판 (B) 칼슘 플럭스에서 볼 수 있는 전형적인 변화를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
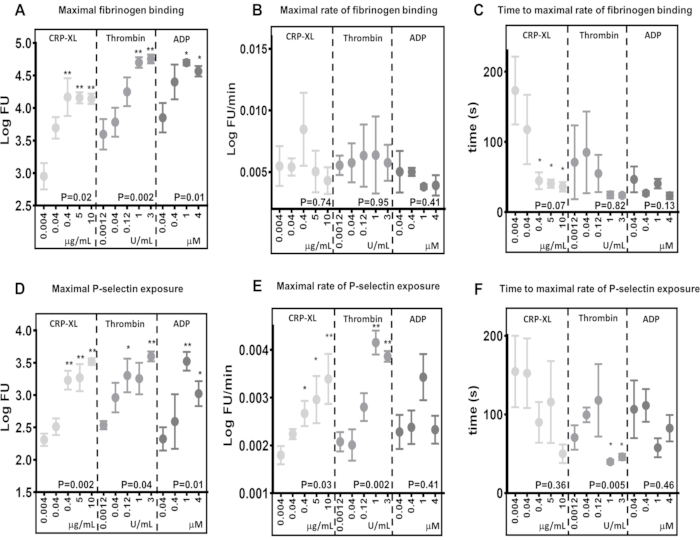
그림 5: 작용제 농도는 최대 혈소판 활성화를 결정하지만 혈소판 활성화 속도는 결정하지 않습니다. 최대 혈소판 활성화(피브리노겐 결합(A) 또는 P-셀렉틴 노출(D))은 작용제(CRP-XL, 트롬빈 또는 ADP) 농도에 의해 유의하게 긍정적으로 변경되었습니다. 혈소판 활성화 속도(B 및 E)와 혈소판 활성화 최대 속도까지의 시간(C 및 F)은 작용제 농도 변화와 관계가 없거나 더 약한 관계를 보여주었습니다. p-값은 전체 농도 범위(Kruskal-Wallis 검정)에 대한 유의성을 나타내고, 별표는 가장 낮은 농도에서 개별 값의 유의한 차이(다중 비교 검정)를 나타냅니다. * P < 0.05, ** P < 0.01. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
혈소판이 활성화 자극을 감지, 처리 및 반응하는 속도는 혈전 형성에 필수적인 결정 요인일 수 있습니다. 이전 연구에서는 혈소판 활성화의 최종 정도가 아닌 속도에 영향을 미치는 신호 요소의 억제가 불안정한 혈전의 형성을 초래한다는 것을 발견했습니다8. 많은 혈소판 기능 분석법은 다양한 상태와 치료에 대한 반응으로 혈소판 활성화 및 응집의 정도를 측정합니다. 그러나 이들은 혈소판이 활성화되는 속도와 이 복잡한 과정이 발생하는 데 걸리는 시간을 고려하지 않습니다 3,4. 여기에서 개발된 혁신적인 유세포 분석 기반 분석은 시간 경과에 따른 혈소판 활성화를 재현성 있게 모니터링하고 이를 다양한 지표로 변환하여 최대 혈소판 활성화 속도와 혈소판이 이 최대 속도에 도달하고 완전히 활성화되는 데 걸리는 시간을 계산합니다.
제시된 데이터는 작용제 유형 및 농도에 대한 다양한 반응 간, 그리고 개인 간의 차이를 식별할 수 있는 실시간 분석의 능력을 강조합니다. 이전의 많은 보고에 따르면 혈소판 반응성은 정상인마다 매우 다양하며, 15,16 이는 혈소판 활성화 속도도 인구 집단 내에서 크게 다를 수 있음을 나타냅니다. 이 연구의 데이터는 탈과립 및 혈소판에 대한 피브리노겐 결합 속도가 혈소판 활성화의 최대 수준보다 훨씬 더 가변적인 것으로 보인다는 것을 보여줍니다. 이는 실시간 유세포 분석이 집단의 혈소판 비율 차이를 식별하고 혈소판 기능을 측정하는 추가 수단으로 혈소판 속도에 대한 다양한 억제 또는 촉진 작용제의 영향을 감지하는 가치 있고 신뢰할 수 있는 도구로 활용될 수 있음을 보여줍니다.
종말점 분석을 사용하여 혈소판 기능을 측정할 때 서로 다른 작용제 간의 피브리노겐 결합 또는 과립 방출 정도를 비교할 수 있습니다. 혈소판 활성화의 첫 5분 동안의 피브리노겐 결합을 비교하는 황토 곡선은 단일 종말점 분석으로 측정할 수 없는 혈소판 활성화 동역학의 차이를 더 자세히 설명할 수 있는 실시간 분석의 능력을 보여줍니다.
실시간 분석에서 수집된 데이터는 피브리노겐이 혈소판에 결합하는 속도가 활성화 경로에 따라 약간 다른 패턴을 따른다는 것을 보여줍니다(그림 3). 혈소판 활성화 동역학을 정확하게 평가하기 위해서는 데이터 수집과 시료 자극을 동시에 수행할 수 있는 비가압 유세포 분석기를 사용하는 것이 필수적입니다. 또한 작용제와 혈소판의 거의 즉각적이고 완전한 혼합을 보장하기 위해 작용제를 신속하게 추가하는 것이 중요합니다. 트롬빈, ADP 및 에피네프린을 사용한 자극은 수용체 감작에 대한 반응으로 신호 전달의 빠른 시작을 나타내는 유사한 곡선을 생성하며, 그 결과 피브리노겐이 빠르고 일정한 속도로 혈소판에 결합하게 됩니다. 대조적으로, CRP-XL에 의해 자극된 혈소판은 초기 수용체 감작 후 초기에 피브리노겐과 결합하는 속도가 매우 느립니다. 그러나, 피브리노겐 결합의 속도는 이러한 초기 지연 후에 급격히 증가한다. TXA2의 모방체인 U46619를 이용한 혈소판 자극은 피브리노겐 결합의 빠른 초기 속도를 초래하며, 이는 매우 느린 속도로 급격히 감소하여 시간이 지남에 따라 피브리노겐 결합의 미미하고 꾸준한 증가로 이어집니다.
Kinetx는 비용 및 경직성과 같은 독점 소프트웨어의 문제를 해결하기 위해 오픈 소스, 재현 가능하고 구현하기 쉽게 설계되었습니다. 따라서 적절하지 않은 소프트웨어로 개발해야 했습니다. R은 생물학자들이 널리 사용하고 설치가 쉽고 비용이 들지 않으며 오픈 소스이기 때문에 선택되었습니다. 이 오픈 소스 환경을 통해 R에 능숙한 사용자는 평활화 정도, 외곽 데이터 포인트 식별 또는 시간 척도와 같은 매개 변수를 변경할 수 있습니다. 그러나 R에 익숙하지 않은 연구자를 돕기 위해 Kinetix도 개발되어 단일 명령(분석 중인 데이터에 따라 kinetxProcess 또는 kinetxProcessCalcium)을 통해 분석을 수행할 수 있습니다. 여기에서 시연된 Kinetix 소프트웨어는 피브리노겐 결합 또는 P-셀렉터링 노출의 최대 수준, 속도 및 가속에 대한 값과 이러한 최대값이 발생하는 시점을 포함한 다양한 메트릭을 계산할 수 있습니다. 다양한 자극 경로에 대한 반응으로 혈소판 활성화의 동역학은 이 수치를 사용하여 보다 정확하게 비교할 수 있습니다.
피브리노겐 결합의 최대 수준에서의 다양한 작용제 자극과 혈소판에 대한 피브리노겐 결합의 속도를 비교하는 것은 혈소판 활성화 속도가 최대 결합과 독립적으로 달라질 수 있는 경우의 좋은 예입니다. 0.04 μM ADP(3.85 LogFU) 및 0.04 μg/mL CRP-XL(3.70 LogFU)과 5분 후 최대 피브리노겐 결합을 비교하면 두 작용제 모두 유사한 양의 결합 피브리노겐을 생성했습니다(그림 5A). 피브리노겐 결합의 최대 속도는 훨씬 더 미미한 차이(0.04 μM ADP - 0.0050 LogFU/분; 0.04 μg/mL CRP-XL - 0.0054 LogFU/분)를 보여주며, 이는 피브리노겐 결합의 전체 속도가 이 두 자극 간에 유사하다는 것을 나타냅니다(그림 5B). 그러나 혈소판 활성화의 지연 시간을 비교하면 CRP-XL(117초에서 최대 속도)이 ADP(47초에서 최대 속도)보다 훨씬 느린 속도로 가속하는 것을 보여주는 분명한 차이가 있습니다(그림 5C). 따라서 ADP 자극이 CRP-XL에 비해 훨씬 빠른 초기 반응(P < 0.001)을 초래한다는 것이 분명해집니다. 함께 관찰할 때, 두 가지 다른 작용제에 대한 반응으로 혈소판 동역학의 이러한 측정은 천천히 가속되고 일정한 속도로 유지되는 ADP 자극에 대한 빠른 초기 반응을 설명합니다. 대조적으로, CRP-XL 자극은 초기 활성화 속도가 느려지다가 훨씬 나중에 빠르게 가속되어 결국 ADP와 유사한 전체 피브리노겐 결합 속도 및 수준으로 이어집니다. 피브리노겐 결합의 최대 수준, 속도 및 가속 간의 이러한 차이는 혈소판이 얼마나 빨리 활성화되는지를 측정하는 데 여러 매개변수가 관련되어 있음을 보여줍니다. 실시간 분석 및 Kinetx 분석은 이러한 매개변수를 측정 및 비교하고, 수용체 감작에서 혈소판 반응까지 걸리는 시간을 설명하고, 이를 서로 다른 신호 경로 간에 비교할 수 있습니다.
작용제 농도의 증가는 피브리노겐이 혈소판에 결합하는 속도에 큰 영향을 미치지 않습니다. 그러나 작용제 농도가 증가함에 따라 피브리노겐 결합의 최대 속도에 도달하는 데 걸리는 시간은 감소하며, 이는 혈소판이 일정한 속도로 피브리노겐과 결합하고 수용체 포화도가 혈소판이 피브리노겐과 얼마나 빨리 결합하는지에 더 중요한 역할을 한다는 것을 시사합니다.
칼슘 플럭스 분석 및 설명된 분석은 칼슘 분석을 빠르고 쉽게 수행할 수 있으며, 실시간 분석에 추가 샘플로 통합할 수 있으며, 동일한 샘플 실행에서 칼슘 및 혈소판 피브리노겐 결합 및 P-셀렉틴을 분석할 수 있습니다. 맞춤형 분석 패키지는 반응의 모양, 최대 반응 및 최대 반응까지의 시간을 포함하여 칼슘 플럭스 역학에 대한 심층적인 평가를 제공합니다. 그런 다음 이러한 매개변수를 공여체 간의 변동 및 다양한 제약 제제에 대한 반응에 대해 비교할 수 있습니다. 혈소판 내 칼슘 플럭스는 이전에 다양한 유세포 분석 기반 분석을 사용하여 혈소판에서 연구되었습니다 17,18,19. Aliotta 등[14]은 여러 세포 내 이온의 동역학을 분석할 수 있는 우아한 분석법을 설명합니다. 여기에 제시된 칼슘 분석은 이전에 발표된 분석을 기반으로 하며, 짧은 시간 내에 여러 공여체에 대한 고처리량 분석의 이점과 함께 더 큰 유연성, 더 심층적인 데이터 탐색을 허용하는 분석 패키지를 포함합니다.
이전 연구에서는 특정 신호 분자의 억제 또는 부재가 혈소판 활성화 속도의 변화를 초래하며, 이는 혈전 형성으로 직접 변환되는 것으로 나타났습니다 8,9. 과거에는 혈소판 활성화 동역학을 여러 고정된 시점에 걸쳐 유세포 분석으로 측정할 수 있었으며, 이를 통해 예를 들어 서로 다른 작용제에 대한 반응으로 GPIIbIIIa 외재화 속도를 계산하고 비교하는 데 사용할 수 있었습니다20. 이 백서에 설명된 Real-Time 분석 및 Kinetx 분석은 휴지 혈소판에서 혈소판 활성화의 속도와 종점을 모두 측정하기 위한 간단하고 자유롭게 사용할 수 있으며 정확한 방법을 제공합니다. 이는 종말점 판독값만 측정할 때 놓칠 수 있는 혈소판 기능의 생리학적으로 관련된 변화를 식별하는 데 중요할 수 있습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 프로젝트는 영국심장재단(British Heart Foundation)의 지원을 받았습니다(PG/16/36/31967, RG/20/7/34866, RG/15/2/31224).
자료
| Name | Company | Catalog Number | Comments |
| 9,11-Dideoxy-11α,9α-epoxymethanoprostaglandin F2α - U46619 | Sigma-Aldrich, Poole, UK | D8174-1MG | |
| Accuri C6 flow cytometer with BD Csampler | Beckton Dickinson, UK | 660517 + 660519 | |
| Adenosine diphosphate | Sigma-Aldrich, Poole, UK | A2754-1G | |
| APC-labelled anti-P-selectin (CD62p) | BD Biosciences, UK | 550888 | |
| Corning polypropylene 96-well round-bottomed, non-treated microtitre plate | Sigma-Aldrich, Poole, UK | CLS3879-50EA | |
| Cross-linked collagen related peptide (CRP-XL) | CambCol, UK | ||
| Epinephrine | Sigma-Aldrich, Poole, UK | E4375-1G | |
| FITC-labelled anti-fibrinogen antibody | Dako, Agilent Technologies, UK | F011102-2 | |
| Fluo-4 Direct dye | Thermo-Fisher Scientific | F10472 | |
| Gel loading tips | Starlab, UK | I1022-0600 | |
| Gly-Pro-Arg-Pro peptide | Sigma-Aldrich, Poole, UK | G1895-5MG | |
| Thrombin | Sigma-Aldrich, Poole, UK | SRE0003-10KU | |
| Thrombin receptor activator peptide 6 (TRAP-6) | Bachem, St Helens, UK | H-2936.0005 | |
| Vacuette 9NC coagulation 3.2 % trisodium citrate (0.109 mol/L) | Greiner Bio-one LTD, Stonehouse, UK | 454327 |
참고문헌
- Bye, A. P., Unsworth, A. J., Gibbins, J. M. Platelet signaling: a complex interplay between inhibitory and activatory networks. Journal of Thrombosis and Haemostasis: JTH. 14 (5), 918-930 (2016).
- Jones, C. I., Barrett, N. E., Moraes, L. A., Gibbins, J. M., Jackson, D. E. Endogenous inhibitory mechanisms and the regulation of platelet function. Methods in Molecular Biology. 788, 341-366 (2012).
- Paniccia, R., Priora, R., Liotta, A. A., Abbate, R. Platelet function tests: a comparative review. Vascular Health and Risk Management. 11, 133-148 (2015).
- Saboor, M., Moinuddin, M., Ilyas, S. New horizons in platelets flow cytometry. The Malaysian Journal of Medical Sciences : MJMS. 20 (2), 62-66 (2013).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88, 1525-1541 (1996).
- Pasquet, J. M., Noury, M., Nurden, A. T. Evidence that the platelet integrin alphaIIb beta3 is regulated by the integrin-linked kinase, ILK, in a PI3-kinase dependent pathway. Thrombosis and Haemostasis. 88 (1), 115-122 (2002).
- Stevens, J. M., Jordan, P. A., Sage, T., Gibbins, J. M. The regulation of integrin-linked kinase in human platelets: evidence for involvement in the regulation of integrin alpha 2 beta 1. Journal of Thrombosis and Haemostasis: JTH. 2 (8), 1443-1452 (2004).
- Jones, C. I., et al. Integrin-linked kinase regulates the rate of platelet activation and is essential for the formation of stable thrombi. Journal of Thrombosis and Haemostasis: JTH. 12 (8), 1342-1352 (2014).
- Cifuni, S. M., Wagner, D. D., Bergmeier, W. CalDAG-GEFI and protein kinase C represent alternative pathways leading to activation of integrin alphaIIbbeta3 in platelets. Blood. 112 (5), 1696-1703 (2008).
- Stolla, M., et al. The kinetics of alphaIIbbeta3 activation determines the size and stability of thrombi in mice: implications for antiplatelet therapy. Blood. 117 (3), 1005-1013 (2011).
- Kawasaki, H., et al. A Rap guanine nucleotide exchange factor enriched highly in the basal ganglia. Proceedings of the National Academy of Sciences of the United States of America. 95 (22), 13278-13283 (1998).
- Kinetx. , Available from: http://github.com/cardiomaths/Kinetx (2021).
- R. , Available from: https://www.r-project.org/ (2021).
- R Studio. , Available from: https://rstudio.com/products/rstudio/download/ (2021).
- Yee, D. L., Sun, C. W., Bergeron, A. L., Dong, J. F., Bray, P. F. Aggregometry detects platelet hyperreactivity in healthy individuals. Blood. 106 (8), 2723-2729 (2005).
- Panzer, S., Hocker, L., Koren, D. Agonists-induced platelet activation varies considerably in healthy male individuals: studies by flow cytometry. Annals of Hematology. 85 (2), 121-125 (2006).
- Aliotta, A., Bertaggia Calderara, D., Alberio, L. Flow cytometric monitoring of dynamic cytosolic calcium, sodium, and potassium fluxes following platelet activation. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 97 (9), 933-944 (2020).
- do Ceu Monteiro, M., Sansonetty, F., Goncalves, M. J., O'Connor, J. E. Flow cytometric kinetic assay of calcium mobilization in whole blood platelets using Fluo-3 and CD41. Cytometry. 35 (4), 302-310 (1999).
- Vines, A., McBean, G. J., Blanco-Fernandez, A. A flow-cytometric method for continuous measurement of intracellular Ca(2+) concentration. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 77 (11), 1091-1097 (2010).
- Weber, A. A., Schror, K. Differential inhibition of adenosine diphosphate- versus thrombin receptor-activating peptide-stimulated platelet fibrinogen binding by abciximab due to different glycoprotein IIb/IIIa activation kinetics. Blood. 98 (5), 1619-1621 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유