Method Article
Kinetx: מסגרת תוכנה משולבת לבדיקת זרימה ציטומטרית וניתוח למדידה כמותית וסיווג הפעלת טסיות בזמן אמת.
In This Article
Summary
טסיות הדם מגיבות במהירות למגוון גירויים. מאמר זה מתאר בדיקת פונקציית טסיות דם מבוססת ציטומטריה בזמן אמת ותוכנת קוד פתוח שפותחה לאחרונה בהתאמה אישית (Kinetx) כדי לאפשר מדידות קינטיות כמותיות של שחרור גרגירי טסיות דם, קשירת פיברינוגן ושטף סידן תוך תאי.
Abstract
טסיות הדם מגיבות במהירות לפגיעה בכלי הדם ועוברות הפעלה בתגובה למגוון גירויים כדי להגביל את איבוד הדם. בדיקות רבות של תפקודי טסיות מודדות את תגובות נקודת הקצה לאחר פרק זמן מוגדר ולא את קצב הפעלת הטסיות. עם זאת, הקצב שבו טסיות ממירות גירויים חוץ-תאיים לתגובה תפקודית הוא גורם חיוני בקביעת מידת היעילות שבה הן יכולות להגיב לפציעה, להיקשר לפקקת נוצרת ולאותת לגייס טסיות אחרות. מאמר זה מתאר בדיקת פונקציית טסיות דם מבוססת ציטומטריית זרימה המאפשרת רכישת נתונים בו זמנית וגירוי דגימה ומשתמשת בתוכנת קוד פתוח שפותחה לאחרונה בהתאמה אישית (Kinetx) כדי לאפשר מדידות קינטיות כמותיות של שחרור גרגירי טסיות דם, קשירת פיברינוגן ושטף סידן תוך תאי. Kinetix פותחה כך שמשתמשים יכולים לשנות פרמטרים כגון מידת החלקה, זיהוי נקודות נתונים מרוחקות או סולמות זמן. כדי לסייע למשתמשים שאינם מכירים את סביבת R, ניתן לבצע ניתוח נתונים של Kinetix על ידי פקודה אחת. יחד, זה מאפשר למדוד ולסווג מדדי הפעלת טסיות בזמן אמת, כגון קצב, תאוצה, זמן עד לקצב שיא, זמן לשיא סידן ושינויי צורה איכותיים, בצורה מדויקת וניתנת לשחזור. מדידות קינטיות של הפעלת טסיות הדם נותנות תובנה ייחודית לגבי התנהגות הטסיות במהלך השלבים הראשונים של ההפעלה ועשויות לספק שיטה לחיזוי גיוס טסיות הדם לפקקת נוצרת.
Introduction
טסיות דם ממלאות תפקיד מרכזי בהמוסטזיס ויוצרות תגובה מהירה ורבת פנים לפגיעה בכלי הדם 1,2. בדיקות תפקוד טסיות הדם הנוכחיות מודדות היבטים שונים של תגובתיות טסיות הדם, המייצגות את פעולותיהן ההמוסטטיות in vivo. באופן מסורתי, תפקוד הטסיות הוערך באמצעות מבחני קצה המודדים קשירת פיברינוגן, שחרור גרגירים או צבירת טסיות דם בטסיות מגורה מספיק זמן כדי להשיג הפעלה מקסימלית 3,4. בדיקות אלו אינן לוקחות בחשבון את הזמן שלוקח לטסיות להמיר גירויים חוץ-תאיים לאותות תוך-תאיים ולשטף סידן ולאחר מכן להתפרק ולהיקשר לפקקת הגדלה. הדם זורם בקצב גזירה של עד 20 דינים/סמ"ק 3 בוורידים ו-80 דינים/סמ"ק בעורקים גדולים5, תוך הדגשת הצורך בטסיות כדי לנטרל את קצב הזרימה המהיר הזה על ידי זיהוי, עיבוד ותגובה לגירויים חוץ-תאיים במהירות כדי להיקשר לפקקת נוצרת ולתמוך בצמיחתו המתמשכת.
קצב הפעלת הטסיות יכול להשתנות ללא תלות בהיקף המקסימלי של הפעלת טסיות הדם. קינאז מקושר לאינטגרין (ILK) הוא חלבון המעורב בוויסות אינטגרינים β1 ו-β3 בטסיות 6,7. עיכוב או מחיקה ספציפית של ILK in vivo הראו כי הקצב, אך לא ההיקף המקסימלי של הפעלת טסיות הדם, הושפע בהיעדר ILK8 תפקודי. הבדלים בין קצב הצבירה לרמת הצבירה המקסימלית זוהו גם בעכברים עם מחסור ב-CALDAG GEFI 9,10, מולקולת איתות המעורבת בוויסות איתות מבפנים החוצה באמצעות RAP111.
ממצאים אלה מראים כי קצב הטסיות ורמות ההפעלה המקסימליות יכולים להיות אוטונומיים וכי מדידות של הפעלה מקסימלית עשויות שלא לתאר את התנהגות הטסיות עד לנקודה זו. הבדלים אלה בזמן שלוקח לטסיות להיות מופעלות עשויים להשפיע עמוקות על הקישור הראשוני שלהן לפקקת הגדלה, ולהשפיע על הארכיטקטורה והגודל הכולל של הפקקת. הבדלים אלה בין קצב הטסיות להפעלה המקסימלית מדגישים את הצורך בבדיקה למדידה מדויקת של קצב הפעלת הטסיות וניתן להשתמש בהם כדי לזהות שונות בתוך האוכלוסייה.
מאמר זה מתאר שיטה המודדת במדויק את הפעלת טסיות הדם ושטף הסידן בזמן אמת ומחשבת מגוון מדדים, כולל הקצב שבו טסיות הדם מופעלות והזמן שלוקח לטסיות להגיע לקצב ההפעלה המקסימלי ולשטף הסידן המקסימלי. מדידות קינטיות אלה של הפעלת טסיות הדם נותנות תובנה טובה יותר לגבי התנהגות הטסיות במהלך השלבים הראשונים של היווצרות פקקת ומספקות שיטה לחיזוי כמה מהר ניתן לגייס טסיות דם לפקקת יוצרת.
Protocol
פרוטוקול זה השתמש בדם מלא אנושי וטסיות דם מתורמים בריאים ללא מחלות רקע ולא נטלו תרופות הידועות כמפריעות לתפקוד טסיות הדם לאחר הסכמה מדעת בכתב ואושר על ידי ועדת האתיקה של מחקר הקריאה של אוניברסיטת רידינג.
1. איסוף דם והכנת פלזמה עשירה בטסיות דם
- אסוף את הדם ההיקפי בוואקטיינר המכיל 3.2% נתרן ציטראט
- השלך את 3 המ"ל הראשונים.
- תן לדם לנוח ב-30 מעלות צלזיוס למשך 30 דקות לפני הצנטריפוגה.
- הכן את הפלזמה העשירה בטסיות דם (PRP) על ידי צנטריפוגה ב-140 x גרם למשך 20 דקות בטמפרטורת החדר לפני הדגירה ב-37 מעלות צלזיוס למשך הבדיקה, שהסתיימה תוך 60 דקות מהצנטריפוגה.
2. הכנת מכשירים
הערה: מערכת נוזלים ללא לחץ חיונית לציטומטריית זרימה בזמן אמת מכיוון שטסיות הדם מגרות בו זמנית כאשר ציטומטר הזרימה מתעד אירועים.
- השתמש בציטומטר זרימה ללא לחץ כדי לבצע ציטומטריית זרימה בזמן אמת.
- כדי לבצע את הבדיקה ב-37 מעלות צלזיוס, חבר מחצלת חיתוך עכבר לבמה כדי למקם את צלחת 96 הבארות. מחממים את המחצלת ל -37 מעלות צלזיוס למשך הבדיקה.
- הנח צלחת של 96 בארות על גבי המחצלת המחוממת כדי לאפשר דגירה רציפה ב-37 מעלות צלזיוס (איור 1)
3. הכנת בדיקה
- קשירת פיברינוגן וביטוי P-selectin
- מצפים צלחת מיקרוטיטר מפוליפרופילן 96 בארות עם תחתית עגולה ולא מטופלת באלבומין סרום בקר 5% (BSA) בתמיסת מלח חוצצת Hepes (HBS; 10 מ"מ Hepes pH 7.4; 150 מ"מ NaCl, 5 מ"מ KCl, 1 מ"מ MgSO4·7H20) למשך הלילה ב-4 מעלות צלזיוס.
- הכן את תערובת הנוגדנים ב-HBS המכילה 5 מ"מ גלוקוז (HBS-G). הוסף נוגדן אנטי-פיברינוגן עם תווית פלואורסצאין איזותיוציאנט (FITC), (FITC-FGN; דילול 1: 37.5 (v/v)) ואנטי-P-סלקטין (APC-CD62P; דילול 1: 37.5 (v/v)) ל-HBS-G (נפח סופי: 225 מיקרוליטר) ודגירה בצלחת של 96 בארות ב-37 מעלות צלזיוס.
- מיד לפני איסוף אירועים, הוסף PRP לתערובת הנוגדנים HBS-G בדילול של 1:600 (v/v).
הערה: נדרש נפח נמוך של PRP כדי להבטיח שלא תחרוג ממגבלת האירועים ולהפחית את צבירת הטסיות בדגימה. דילול טסיות הדם נבדק במחקרי פיילוט ואינו משפיע על קצב ההפעלה. - דגרו את תערובת ההפעלה המכילה FITC-FGN, (דילול 1: 37.5 (v/v)) ו-APC-CD62P (דילול 1: 37.5 (v/v)) ואגוניסט ב-37 מעלות צלזיוס. האגוניסטים כוללים תרומבין (thr; 0.0012-1 U/mL) בנוכחות פפטיד Gly-Pro-Arg-Pro (GPRP; 1.18 מ"מ), פפטיד הקשור לקולגן צולב (CRP-XL; 0.004-10 מיקרוגרם/מ"ל), אדנוזין דיפוספט (ADP; 0.04-4 מיקרומטר), אפינפרין (epi; 20-200 מיקרומטר), 9,11-דידאוקסי-11α,9α-אפוקסימתאנופרוסטגלנדין F2α (U46619; 0.02-5 מיקרומטר), ופפטיד מפעיל קולטן תרומבין 6 (TRAP-6; 0.04-10 מיקרומטר).
- שטף סידן
הערה: בדיקה זו בוצעה באמצעות ערכת בדיקת סידן מסחרית (טבלת חומרים)- מצפים צלחת מיקרוטיטר מפוליפרופילן עם תחתית עגולה ללא תחתית עם 5% BSA בתמיסת מלח חוצצת Hepes למשך הלילה ב-4 מעלות צלזיוס.
- כדי להכין את צבע בדיקת הסידן, הוסף 100 מ"ל של מאגר בדיקת סידן ותמיסת מלאי בדיקה של 2 מ"ל (250 מ"מ) לבקבוק אחד של מגיב סידן כדי לקבל תמיסת טעינת מגיב סידן פי 2.
- להכנת Fluo-4/HBS-G, יש לדלל את צבע בדיקת הסידן עם HBS-G ביחס של 1:1, לסנן דרך מסנן של 0.22 מיקרומטר. הוסף 225 מיקרוליטר של Fluo-4/HBS-G לבארות המתאימות של צלחת של 96 בארות ב-37 מעלות צלזיוס.
- דגירה PRP ב-37 מעלות צלזיוס למשך 30 דקות בדילול של 1:1 עם Fluo-4/HBS-G.
- מכינים את תערובת ההפעלה ב-Fluo-4/HBS-G ודוגרים ב-37 מעלות צלזיוס. האגוניסטים כוללים טרומבין (1 U/mL) בנוכחות GPRP, CRP-XL (0.5 מיקרוגרם/מ"ל), ADP (1 מיקרומטר), אפינפרין (20 מיקרומטר), U46619 (1 מיקרומטר) ו-TRAP-6 (1 מיקרומטר).
- מיד לפני איסוף אירועים, הוסף PRP/Fluo-4/HBS-G ל-225 מיקרוליטר של תערובת Fluo-4/HBS-G בדילול PRP סופי (לאחר תוספת אגוניסטית) של 1: 600 (v/v; 0.5 מ"ל ב-300 מ"ל של הנפח הסופי).
4. נוהל בדיקה ואיסוף נתונים
- הגדר את ציטומטר הזרימה לקצב זרימה 'איטי' עם מספר ממוצע של 1000 אירועים לשנייה (eps) ומקסימום 3000 eps. הגדר את הסף ל-20000 כדי להימנע מרישום פסולת תאים.
- שער את אוכלוסיית הטסיות באמצעות תרשימים של פיזור קדימה (FSC) ופיזור צדדי (SSC). לאיסוף נתונים, שרטט FSC-A לעומת SSC-A כדי לשער במדויק את אוכלוסיית הטסיות ו-FL1 או FL4 לעומת זמן לתיעוד האירועים הפלואורסצנטיים לאורך זמן.
- לציטומטר הזרימה לוקח 14 שניות להתחיל להקליט אירועים; לאחר מכן, הניחו למכשיר לרשום אירועים בכל באר למשך 5 שניות נוספות לפני הוספת 75 מיקרוליטר של תערובת ההפעלה במהירות באמצעות קצה טעינת ג'ל כדי להבטיח ערבוב ספונטני (איור 1).
- אסוף את האירועים למשך 5 דקות והגדר את העלילות כדי להקליט את ערוץ 488 (FL1; מסנן 533/30 - FITC-fibrinogen/FLUO-4) לעומת זמן ואת ערוץ 633 (FL4; מסנן 675/25 - APC-P-selectin) לעומת זמן.
- שמור את נתוני העלילה עבור הערוצים 488 ו-633 מכל באר כקבצי CSV.
5. ניתוח נתונים
- הורד את הגרסה העדכנית ביותר של Kinetx12.
הערה: ההורדה כוללת את כל הקוד הנדרש לניתוח הנתונים שנוצרו מהבדיקה ומלווה במערך בדיקה של נתוני ניסוי מעשרה תורמים ותפוקות שנוצרו מהניתוח שלהם (ניתן ליצור מחדש ולאמת תוצאות אלה באמצעות ההליכים הבאים) (איור 2). - הגדרת סביבת R
- השתמש בשפת התכנות R דרך סביבת RStudio. התקן את R13, RStudio14 והחבילות הבאות: ggplot2, dplyr, plotrix, minpack.lm, tidyverse, psych. ודא שכל החבילות המהוות דרישה מוקדמת הותקנו בהצלחה.
- יצירת מטא-נתונים: מקם קובץ טקסט (הנקרא wellData.txt) בתוך אותה ספרייה כמו הנתונים. הוא מתאר את האגוניסטים, הריכוזים שלהם, כל הנוגדנים והבדיקה (פונקציה או סידן) המשמשת ליצירת כל קובץ CSV.
- מקם קובץ טקסט שני ('IsotypeData.txt') באותה ספרייה ומגדיר את האיזוטיפים. הקבצים המסופקים בהורדה ('data/wellData.txt' ו-'data/IsotypeData.txt') יכולים לשמש כתבנית, ולהיות ניתנים להתאמה בקלות לאגוניסטים, מעכבים וריכוזים חלופיים.
- ניתוח הנתונים: Kinetx מורכבת משלוש פונקציות כפי שהוגדרו בשלבים 5.2.5-5.2.7.
- kinetxProcess.R: פונקציה זו מעבדת את נתוני הזרימה הציטומטרית הפונקציונלית הגולמית. כדי להפעיל הקלד kinetxProcess('מיקום נתונים','היכן לשים פלטים','FL1' (עבור FITC-anti-fibrinogen, או 'FL4' (עבור APC-CD62P)
- kinetxProcessCalcium.R: פונקציה זו מנתחת ומתייגת את נתוני שטף הסידן. כדי להפעיל הקלד kinetxProcessCalcium('מיקום נתונים','היכן לשים פלטים','FL1')
- kinetxSummary.R: פונקציה זו מסכמת את הנתונים. כדי להפעיל הקלד kinetxSummary('data location','where to put outputs','FL1').
- כדי להפעיל את כל הפונקציות לעיל (5.2.5-5.2.7) בנתוני הבדיקה, השתמש בקובץ ה- Script (בדיקה. R).
הערה: שתי הפונקציות הראשונות מייצרות נתונים עבור כל תורם המציגים את הנתונים הגולמיים בתוספת העקומות המותאמות. כל הפלטים וגיליון אלקטרוני המסכם את הנתונים ממוקמים במיקום הפלט.
תוצאות
ניתוח ציטומטריית הזרימה הפונקציונלית בזמן אמת חושף הבדלים בצורת עקומות ההפעלה בין אגוניסטים ובין תורמים
ניתוח נתונים של הנתונים הפונקציונליים (חשיפה ל-P-selectin וקשירת פיברינוגן) באמצעות Kinetx מסיר נקודות נתונים הנמצאות מחוץ לטווחים סבירים (>200000 או <1) ו-<2.80 שניות (זמן אפס מוגדר לנקודה זו), מנרמל נתונים לחציון האיזוטיפים ומתאים לעקומת ממוצע נע חלקה (באמצעות לס פונקציה). Kinetx גם מקצה מדדים וקטגוריות המבוססים על צורת הקו המוחלק המותאם, הערכים המוחלטים ושיעורי השינוי כדלקמן: (1) RoC - עלייה ממוצעת בקו המוחלק במהלך 120 השניות הראשונות; (2) תווית - מסווגת תגובות כמהירות, בינוניות או איטיות המוגדרות על פי החתכים של 40 ו-80 עבור FL1 ו-5 ו-10 עבור FL4; (3) EarlyRoC - עלייה ממוצעת בקו המוחלק במהלך 20 השניות הראשונות; (4) צורה - מגיבים נמוכים, עולים, ליניאריים או יורדים (איור 3A) - מגיבים נמוכים נקבעים כ-FL1 <-4000 או FL4 <-1000, התוויות עולות, ליניאריות ויורדות נקבעות על סמך: shapeMetric - RoC (120 שניות)/EarlyRoC, כאשר הגדלת צורהמטרי >2, צורה ליניאריתמטרי בין 0.9-2 וירידה בצורהמטרי <0.9; (5) מפיק גיליון אלקטרוני המסכם את הנתונים על ידי מתן רמת וקצב השינוי ב-0 שניות, 10 שניות, 20 שניות, 30 שניות, 40 שניות, 60 שניות, 90 שניות, 120 שניות, 180 שניות, חציון איזוטיפי, שיעורי השינוי וההאצה המקסימליים והמינימליים וכל התוויות והקטגוריות.
קשירת פיברינוגן טסיות וחשיפה ל-P-selectin במשך 5 דקות לאחר ההפעלה בתגובה לריכוז יחיד של האגוניסטים ADP, TRAP-6, CRP-XL, אפינפרין ו-U46617, נותחו ב-30 תורמים. המדדים לקשירת פיברינוגן וחשיפה ל-P-selectin בתגובה לאגוניסטים שונים מראים שונות ניכרת בצורת התגובה (איור 3). טסיות דם שגורו עם TRAP-6 ו-ADP הראו האצה מהירה יותר בקשירת פיברינוגן, שעבור תורמים רבים האטה בנקודות זמן מאוחרות יותר (איור 3B). קשירת פיברינוגן בתגובה ל-CRP-XL, תרומבין ואפינפרין הייתה בעלת סיכוי גבוה יותר להראות קצב תגובה עולה או ליניארי. תורמים רבים הראו זמן פיגור ארוך יחסית ל-CRP-XL לפני שקצב קשירת הפיברינוגן הואץ במהירות. התגובה ל-U46619 סווגה לעתים קרובות כנמוכה. לעומת זאת, חשיפה ל-P-selectin הייתה סבירה יותר להראות קצב תגובה ליניארי או הולך וגדל לכל האגוניסטים מלבד U46619 ששוב הראה רמות תגובה נמוכות (איור 3C).
ניתן למדוד במדויק את שטף הסידן התוך-תאי במהלך הפעלת טסיות הדם באמצעות ציטומטריית זרימה בזמן אמת
ניתוח נתונים של בדיקת שטף הסידן מסיר נקודות נתונים שנמצאות מחוץ לטווחים סבירים (< 2.80 שניות זמן אפס מוגדר לנקודה זו) ולאחר מכן מתאים לעקומת ממוצע נע חלקה (באמצעות לס פונקציה). Kinetx מקצה מדדים, וקטגוריות מוקצות על סמך צורת הקווים החלקים המותאמים, הערכים המוחלטים ושיעורי השינוי כדלקמן: (1) קטגוריה - המתארת את צורת תגובת הסידן בהתבסס על העלייה המוקדמת, המקסימום והירידה הסופית מהמקסימום, המתוארת כליניארית, שיא או מתמשכת (איור 4A); (2) קצב - המתאר את קצב השינוי ב-30 שניות המהירות ומוגדר כללא שינוי, איטי, בינוני או מהיר (עם חתך ב-10, 40 ו-80). Kinetx גם מפיקה גיליון אלקטרוני המסכם את הנתונים על ידי מתן רמת וקצב השינוי ב-0 שניות, 10 שניות, 20 שניות, 30 שניות, 40 שניות, 60 שניות, 90 שניות, 120 שניות, 180 שניות, שיעורי השינוי וההאצה המקסימליים והמינימליים וכל התוויות והקטגוריות, כמו גם הפקת נתון של הנתונים עבור כל תורם. דוגמאות לשטף סידן שנמדד בשיטה זו ב-30 אנשים הראו שוב דפוסי הפעלה שונים בין אנשים לאגוניסטים (איור 4B). CRP-XL נתן בעיקר תגובת סידן מתמשכת, בעוד שהתגובה ל-TRAP-6 הראתה לרוב תגובה שיא. כל שאר האגוניסטים יצרו תגובה ליניארית בעיקרה.
ציטומטריית זרימה בזמן אמת מזהה הבדלים ברמות ההפעלה המקסימליות בתגובה לאגוניסטים וריכוזים שונים
התוצאות מדגימות כי לבדיקת ציטומטריית זרימה בזמן אמת יש את היכולת לזהות הבדלים ברמות המקסימליות של קשירת פיברינוגן (איור 5A) וחשיפה ל-P-selectin (איור 5D), בתגובה לגירוי באמצעות קולטנים שונים (10 מיקרוגרם/מ"ל CRP-XL לעומת 3 תרומבין U/mL P < -0.001; 10 מיקרוגרם/מ"ל CRP-XL לעומת 1 תרומבין U/mL P < 0.001). הם גם מראים כי הבדיקה רגישה להבדלים בריכוז האגוניסטים, כאשר רמות הקישור המקסימלי של פיברינוגן וחשיפה ל-P-selectin מוגברות בתגובה לריכוזי אגוניסטים גדולים יותר (קשירת פיברינוגן - CRP-XL - 0.004 מיקרוגרם/מ"ל לעומת 0.4, 5, 10 מיקרוגרם/מ"ל, P < 0.01; טרומבין - 0.0012 U/mL לעומת 1 ו-3 U/mL, P < 0.01; ADP - 0.04 מיקרוגרם/מ"ל לעומת 1 ו-4 מיקרומטר, P < 0.05).
בדיקת ציטומטריית הזרימה בזמן אמת רגישה מספיק כדי לזהות שונות בין תורמים בקצב הפעלת הטסיות
הקצב המקסימלי של הפעלת טסיות הדם נקבע על ידי התאמת ממוצע נע מוחלק (לס) לנתוני הקרינה ולאחר מכן שימוש בו כדי לחשב את הקצב המקסימלי של קשירת פיברינוגן וחשיפה ל-P-selectin (איור 5B,E). הנתונים מדגימים שונות ניכרת בין תורמים בודדים, ובדיקת ציטומטריית הזרימה רגישה מספיק כדי לזהות שונות זו. התוצאות מצביעות על כך שלהגדלת ריכוז האגוניסטים יש השפעה מועטה על הקצב המקסימלי של קשירת פיברינוגן (איור 5B). לעומת זאת, השיעור המקסימלי של חשיפה ל-P-selectin עולה עם ריכוז גבוה יותר של תרומבין ו-CRP-XL, אך לא עם עלייה בריכוזים של ADP (איור 5E).
ניתן לזהות שינויים בזמן ההשהיה של הפעלת טסיות הדם באמצעות ציטומטריית זרימה בזמן אמת
הזמן לקצב המקסימלי של הפעלת טסיות הדם נקבע על ידי חישוב נקודות הזמן שבהן הושגו הקצב המקסימלי של קשירת פיברינוגן וחשיפה ל-P-selectin (איור 5C,F). השיעור המקסימלי של קשירת פיברינוגן וחשיפה ל-P סלקטין משתנה בין תורמים, במיוחד בריכוזים אגוניסטים נמוכים יותר. גירוי טסיות דם עם ריכוזים הולכים וגדלים של CRP-XL מראה שלריכוזי אגוניסטים גבוהים יותר לוקח פחות זמן להגיע לשיעור המקסימלי של קשירת פיברינוגן עם פחות שונות בין תורמים; עם זאת, מגמה זו אינה נראית עם גירוי תרומבין או ADP (איור 5C). הבדיקה מדגימה כי בנסיבות מסוימות, הגדלת ריכוז האגוניסט מפחיתה את הזמן שלוקח להפעלת הטסיות להתחיל (זמן השהיה) מבלי לשנות את הקצב המקסימלי של הפעלת טסיות הדם וכי ניתן להעריך את שני המדדים הללו באמצעות בדיקה זו.
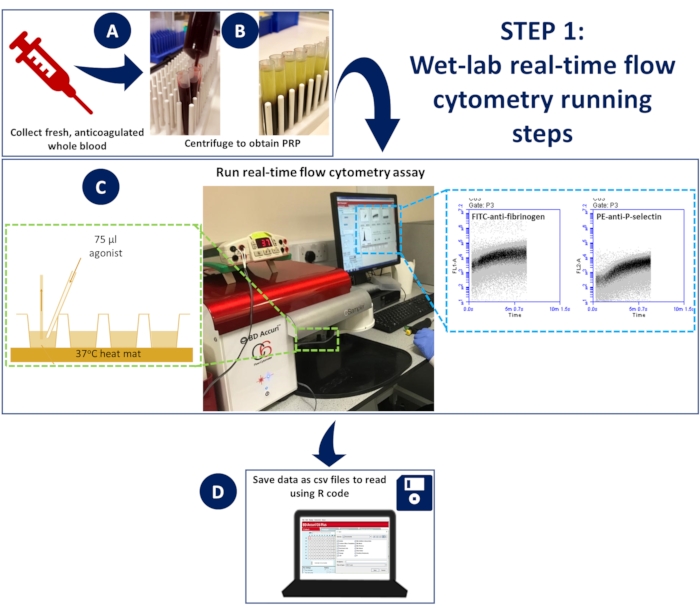
איור 1: ציטומטריית זרימה בזמן אמת במעבדה רטובה. (A) דם מלא נוגד קרישה עבר (B) צנטריפוגה כדי להשיג פלזמה עשירה בטסיות דם (PRP). (ג) PRP מדולל המכיל נוגדנים מתאימים או צבעי אינדיקטור סידן הונח בצלחת של 96 בארות, הועמס על ציטומטר זרימה ללא לחץ, ונשמר ב-37 מעלות צלזיוס באמצעות מחצלת דיסקציה. הדגימות עוררו במהלך הרכישה עם תערובת הפעלה המכילה נוגדנים או צבע סידן ואגוניסט, שנוספו במהירות לבאר באמצעות קצה טעינת ג'ל כדי להבטיח ערבוב ספונטני. (D) האירועים נאספו במשך 5 דקות, וקבצי CSV של הנתונים עבור כל באר נשמרו. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
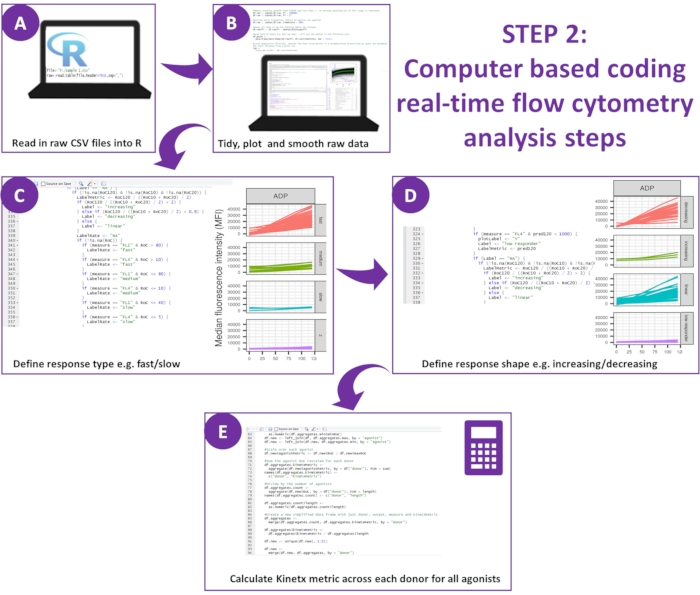
איור 2: סכמטי של ניתוח הנתונים. (A) סביבת R הוגדרה ונוצרו מטא-נתונים. (B) הנתונים החיצוניים הוסרו, והותקנה עקומת ממוצע נע חלק (לס). (C) סוג התגובה ו-(D) צורת התגובה הוגדרו. (ה) חושבו מדדים, יוצאו והופקו נתונים עבור כל תורם. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
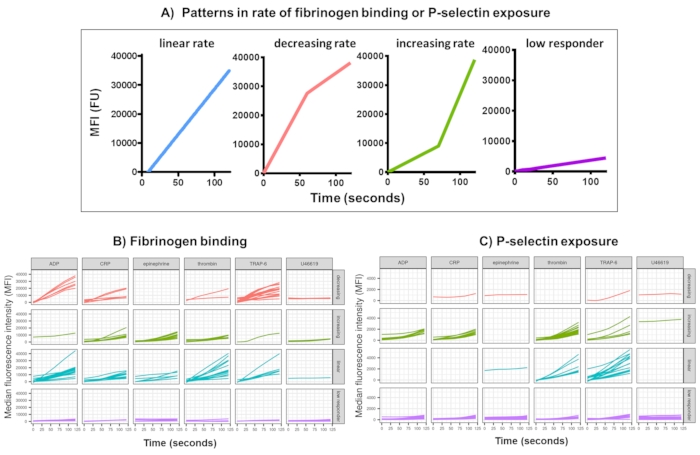
איור 3: פלט מייצג של ניתוח Kinetx של קשירת פיברינוגן טסיות בזמן אמת וביטוי P-selectin. (A) בנוסף למתן מדדים כגון קצב שינוי מקסימלי (RoC) ו-RoC בנקודות זמן שונות, Kinetx גם מסווג את צורת העקומה כדי לספק מידע נוסף על הפעלת טסיות שקשה ללכוד במדד יחיד. נתונים מייצגים עבור 30 אנשים מראים את השונות האופיינית שנראית בקשירת פיברינוגן טסיות (B) בזמן אמת וביטוי P-selectin (C) בתגובה לאגוניסטים ADP, TRAP-6, CRL-XL, אפינפרין ו-U46617. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
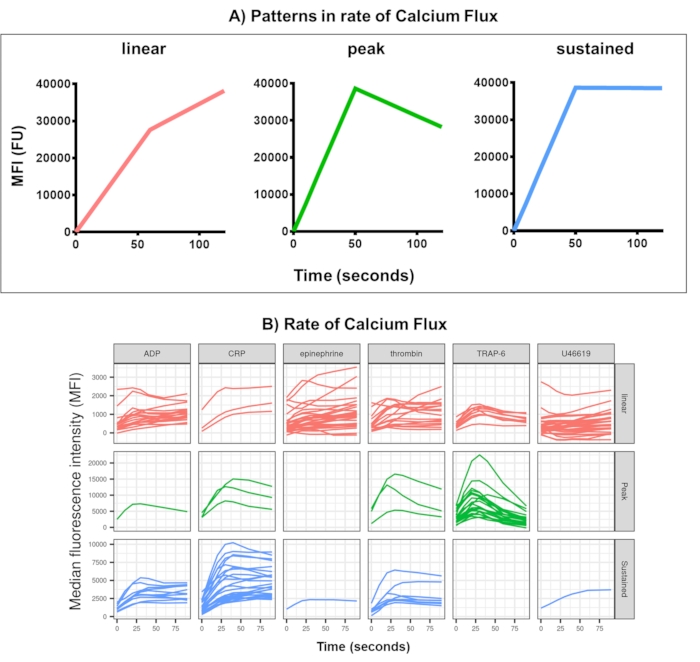
איור 4: פלט מייצג של ניתוח Kinetx של שטף סידן בטסיות בזמן אמת. (A) בנוסף למתן מדדים כגון קצב שינוי מקסימלי (RoC) ו-RoC בנקודות זמן שונות, Kinetx גם מסווג את צורת עקומת שטף הסידן כדי לספק מידע נוסף על הפעלת טסיות שקשה ללכוד במדד יחיד. נתונים מייצגים עבור 30 אנשים מראים את השונות האופיינית שנראית בשטף הסידן של טסיות הדם בזמן אמת (B) בתגובה לאגוניסטים ADP, TRAP-6, CRL-XL, אפינפרין ו-U46617. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
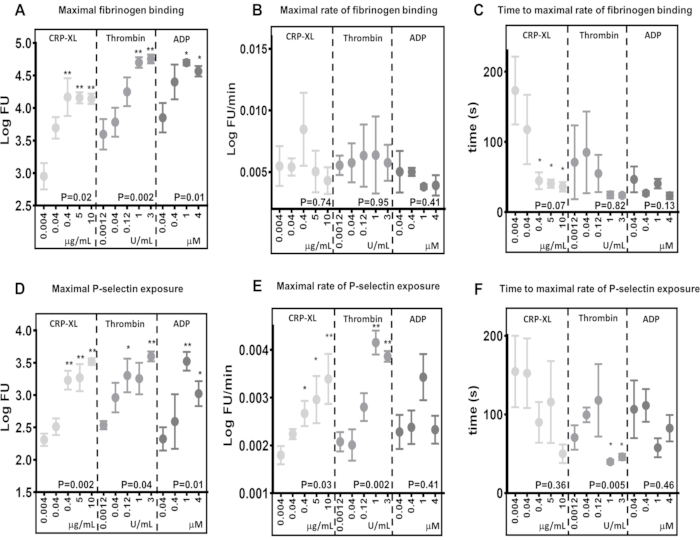
איור 5: ריכוז האגוניסט קובע את הפעלת הטסיות המקסימלית אך לא את קצב הפעלת הטסיות. הפעלת טסיות הדם המקסימלית - קשירת פיברינוגן (A) או חשיפה ל-P-selectin (D) - השתנתה באופן חיובי באופן משמעותי על ידי ריכוז אגוניסט (CRP-XL, תרומבין או ADP). קצב הפעלת הטסיות (B ו-E) והזמן עד לקצב המקסימלי של הפעלת טסיות הדם (C ו-F) הראו שאין קשר או קשר חלש יותר עם שינוי ריכוז האגוניסטים. ערכי P מראים את המובהקות על פני כל טווח הריכוז (מבחן Kruskal-Wallis), וכוכביות מצביעות על הבדל משמעותי (מבחן השוואה מרובה) של ערכים בודדים מהריכוז הנמוך ביותר. * P < 0.05, ** P < 0.01. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
הקצב שבו טסיות הדם מזהות, מעבדות ומגיבות לגירויים מפעילים עשוי להיות גורם מכריע להיווצרות פקקת. מחקרים קודמים מצאו כי עיכוב של מרכיבי איתות המשפיעים על הקצב, אך לא על ההיקף הסופי של הפעלת טסיות הדם, מביא להיווצרות פקקת8 לא יציבה. בדיקות תפקוד טסיות רבות מודדות את מידת ההפעלה והצבירה של טסיות הדם בתגובה למצבים וטיפולים שונים; עם זאת, אלה אינם לוקחים בחשבון את הקצב שבו טסיות הדם מופעלות ואת הזמן שלוקח לתהליך מורכב זה להתרחש 3,4. הבדיקות החדשניות המבוססות על ציטומטריית זרימה שפותחו כאן מנטרות באופן שחזורי את הפעלת הטסיות לאורך זמן ומתרגמות זאת למגוון מדדים כדי לחשב את הקצב המרבי של הפעלת הטסיות ואת הזמן שלוקח לטסיות להגיע לקצב המקסימלי הזה ולהיות מופעלות במלואן.
הנתונים שהוצגו מדגישים את יכולתה של הבדיקה בזמן אמת לזהות וריאציות בין תגובות שונות לסוג אגוניסטי וריכוז ובין אנשים. דיווחים קודמים רבים הראו כי תגובתיות טסיות הדם משתנה מאוד בין פרטים נורמליים15,16, מה שמצביע על כך שקצב הפעלת הטסיות עשוי להשתנות באופן משמעותי גם בתוך האוכלוסייה. נתונים ממחקר זה מראים כי נראה כי קצב הדגרנולציה וקשירת הפיברינוגן לטסיות הדם משתנה אפילו יותר מהרמות המקסימליות של הפעלת טסיות הדם. זה מראה שניתן להשתמש בציטומטריית זרימה בזמן אמת גם ככלי רב ערך ואמין לזיהוי שונות בקצב הטסיות באוכלוסייה וזיהוי ההשפעות של חומרים מעכבים או פרו-אקטיביים שונים על קצב הטסיות כאמצעי נוסף למדידת תפקוד טסיות הדם.
כאשר תפקוד הטסיות נמדד באמצעות מבחני נקודת קצה, ניתן לבצע השוואות לגבי מידת קשירת הפיברינוגן או שחרור הגרגירים בין אגוניסטים שונים. עקומות הלס המשווים קשירת פיברינוגן במהלך 5 הדקות הראשונות של הפעלת טסיות הדם מדגימות את היכולת של הבדיקה בזמן אמת להקניט פרטים נוספים בהבדלים בקינטיקה של הפעלת טסיות שבדיקות קצה בודדות אינן יכולות למדוד.
הנתונים שנאספו מהבדיקה בזמן אמת מדגימים שהמהירות שבה פיברינוגן נקשר לטסיות עוקבת אחר דפוס שונה במקצת, כתלות במסלול ההפעלה (איור 3). על מנת להעריך במדויק את קינטיקה של הפעלת טסיות הדם, חיוני להשתמש בציטומטר זרימה ללא לחץ המאפשר רכישת נתונים בו זמנית וגירוי דגימה. כמו כן, חיוני להוסיף את האגוניסטים במהירות כדי להבטיח ערבוב כמעט מיידי ומוחלט של אגוניסטים וטסיות דם. גירוי עם תרומבין, ADP ואפינפרין מייצר עקומה דומה המייצגת התחלה מהירה של איתות בתגובה לרגישות לקולטן וכתוצאה מכך קשירת פיברינוגן לטסיות בקצב מהיר ויציב. לעומת זאת, טסיות הדם המעוררות על ידי CRP-XL הן בתחילה איטיות מאוד לקשור פיברינוגן לאחר רגישות ראשונית לקולטן; עם זאת, קצב קשירת הפיברינוגן גדל במהירות לאחר עיכוב ראשוני זה. גירוי טסיות דם עם U46619, חיקוי של TXA2, מביא לקצב התחלתי מהיר של קשירת פיברינוגן, שיורד במהירות לקצב איטי מאוד המוביל לעלייה קלה ויציבה בלבד בקשירת פיברינוגן לאורך זמן.
Kinetx תוכנן להיות קוד פתוח, ניתן לשחזור וקל ליישום על מנת לעקוף בעיות עם תוכנה קניינית, כגון עלות וחוסר גמישות. ככזה, היה צורך לפתח אותו עם תוכנה שאינה הולמת. R נבחר מכיוון שהוא נמצא בשימוש נרחב על ידי ביולוגים, קל להתקנה, ללא עלות וקוד פתוח. סביבת קוד פתוח זו מאפשרת למשתמשים הבקיאים ב-R לשנות פרמטרים כגון מידת החלקה, זיהוי נקודות נתונים מרוחקות או סולמות זמן. עם זאת, כדי לסייע לחוקרים שאינם מכירים את R, קינטיקס פותחה גם כך שניתן לבצע ניתוח באמצעות פקודה אחת (kinetxProcess או kinetxProcessCalcium, בהתאם לנתונים המנותחים). תוכנת Kinetix המודגמת כאן יכולה לחשב מגוון מדדים, כולל ערכים עבור הרמות המקסימליות, הקצב וההאצה של קשירת פיברינוגן או חשיפה ל-P-selectin ונקודות הזמן שבהן מתרחשים מקסימום זה. ניתן להשוות בצורה מדויקת יותר את הקינטיקה של הפעלת טסיות הדם בתגובה למסלולי גירוי שונים באמצעות מספרים אלה.
השוואות בין גירויים אגוניסטים שונים ברמות המקסימליות של קשירת פיברינוגן ושיעורי קשירת פיברינוגן לטסיות הן דוגמאות טובות למקומות שבהם קצב הפעלת הטסיות יכול להשתנות ללא תלות בקישור המקסימלי. בהשוואת קשירת פיברינוגן מקסימלית לאחר 5 דקות של גירוי עם 0.04 מיקרומטר ADP (3.85 LogFU) ו-0.04 מיקרוגרם/מ"ל CRP-XL (3.70 LogFU), שני האגוניסטים הביאו לכמות דומה של פיברינוגן קשור (איור 5A). השיעורים המקסימליים של קשירת פיברינוגן מראים הבדל מינורי עוד יותר (0.04 מיקרומטר ADP - 0.0050 LogFU לדקה; 0.04 מיקרוגרם/מ"ל CRP-XL - 0.0054 LogFU לדקה), מה שמצביע על כך שהקצב הכולל של קשירת פיברינוגן דומה בין שני הגירויים הללו (איור 5B). עם זאת, כאשר משווים את זמן ההשהיה של הפעלת טסיות הדם, יש הבדל ברור המראה ש-CRP-XL (קצב מקסימלי של 117 שניות) מאיץ בקצב איטי בהרבה מ-ADP (47 שניות לקצב מקסימלי) (איור 5C). לפיכך, מתברר שגירוי ADP מביא לתגובה ראשונית מהירה בהרבה (P < 0.001) בהשוואה ל-CRP-XL. כאשר נצפים יחד, מדידות אלה של קינטיקה של טסיות דם בתגובה לשני אגוניסטים שונים מתארות תגובה ראשונית מהירה לגירוי ADP שמאיץ לאט ונשאר בקצב קבוע. לעומת זאת, גירוי CRP-XL מביא לקצב הפעלה ראשוני איטי, שמאיץ במהירות בזמן מאוחר בהרבה, מה שמוביל בסופו של דבר לקצב כולל ורמות דומות של קשירת פיברינוגן כמו ADP. הבדלים אלה בין הרמות המקסימליות, הקצב וההאצה של קשירת פיברינוגן מדגימים כי מספר פרמטרים מעורבים במדידת המהירות שבה טסיות הדם מופעלות. הבדיקה בזמן אמת וניתוח Kinetx יכולים למדוד ולהשוות את הפרמטרים הללו, לתאר את הזמן שלוקח מרגישות הקולטן לתגובת טסיות הדם, ולהשוות זאת בין מסלולי איתות שונים.
להגדלת ריכוז האגוניסטים אין השפעה משמעותית על קצב קשירת הפיברינוגן לטסיות הדם. עם זאת, הזמן שלוקח להגיע לקצב המקסימלי של קשירת פיברינוגן פוחת ככל שריכוז האגוניסטים עולה, מה שמצביע על כך שטסיות הדם קושרות פיברינוגן בקצב קבוע ורוויית הקולטן ממלאת תפקיד בולט יותר במהירות שבה טסיות הדם נקשרות פיברינוגן.
הבדיקה והניתוח של שטף הסידן המתוארים הם בדיקת סידן מהירה וקלה לביצוע שניתן לשלב כדגימות נוספות בבדיקה בזמן אמת המאפשרת ניתוח של קשירת סידן וטסיות דם פיברינוגן ו-P-סלקטין באותה ריצה של דגימות. חבילת הניתוח המותאמת אישית מספקת הערכה מעמיקה של קינטיקה של שטף הסידן, כולל צורת התגובה, התגובה המקסימלית והזמן לתגובה מקסימלית. לאחר מכן ניתן להשוות פרמטרים אלה לשונות בין תורמים ובתגובה לתרופות שונות. שטף סידן בטסיות נחקר בעבר בטסיות באמצעות מגוון מבחנים מבוססי ציטומטריית זרימה 17,18,19. Aliotta et al.14, מתארים בדיקה אלגנטית המסוגלת לנתח את הקינטיקה של יונים תוך-תאיים מרובים. בדיקת הסידן המוצגת כאן מתבססת על מבחנים אלה שפורסמו בעבר על ידי הכללת חבילת הניתוח המאפשרת גמישות רבה יותר, חקירה מעמיקה יותר של הנתונים עם היתרון של ניתוח תפוקה גבוהה עבור מספר תורמים במסגרת זמן קצרה.
מחקרים קודמים הראו כי עיכוב או היעדר מולקולות איתות מסוימות מביא לשינוי בקצב הפעלת טסיות הדם, מה שמתורגם ישירות להיווצרות פקקת 8,9. בעבר, ניתן היה למדוד את קינטיקה של הפעלת טסיות הדם על ידי זרימה ציטומטרית על פני מספר נקודות זמן קבועות שניתן להשתמש בהן כדי לחשב ולהשוות, למשל, את קצב החצנת GPIIbIIIa בתגובה לאגוניסטים שונים20. הבדיקה בזמן אמת וניתוח Kinetx המתוארים במאמר זה מספקים שיטה פשוטה, זמינה ומדויקת למדידת קצב ונקודת הקצה של הפעלת טסיות הדם מטסיות במנוחה. סביר להניח שזה חשוב בזיהוי וריאציות רלוונטיות מבחינה פיזיולוגית בתפקוד טסיות הדם שעלולות להחמיץ כאשר נמדדות רק קריאות נקודות קצה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
פרויקט זה נתמך על ידי קרן הלב הבריטית (PG/16/36/31967, RG/20/7/34866 ו-RG/15/2/31224).
Materials
| Name | Company | Catalog Number | Comments |
| 9,11-Dideoxy-11α,9α-epoxymethanoprostaglandin F2α - U46619 | Sigma-Aldrich, Poole, UK | D8174-1MG | |
| Accuri C6 flow cytometer with BD Csampler | Beckton Dickinson, UK | 660517 + 660519 | |
| Adenosine diphosphate | Sigma-Aldrich, Poole, UK | A2754-1G | |
| APC-labelled anti-P-selectin (CD62p) | BD Biosciences, UK | 550888 | |
| Corning polypropylene 96-well round-bottomed, non-treated microtitre plate | Sigma-Aldrich, Poole, UK | CLS3879-50EA | |
| Cross-linked collagen related peptide (CRP-XL) | CambCol, UK | ||
| Epinephrine | Sigma-Aldrich, Poole, UK | E4375-1G | |
| FITC-labelled anti-fibrinogen antibody | Dako, Agilent Technologies, UK | F011102-2 | |
| Fluo-4 Direct dye | Thermo-Fisher Scientific | F10472 | |
| Gel loading tips | Starlab, UK | I1022-0600 | |
| Gly-Pro-Arg-Pro peptide | Sigma-Aldrich, Poole, UK | G1895-5MG | |
| Thrombin | Sigma-Aldrich, Poole, UK | SRE0003-10KU | |
| Thrombin receptor activator peptide 6 (TRAP-6) | Bachem, St Helens, UK | H-2936.0005 | |
| Vacuette 9NC coagulation 3.2 % trisodium citrate (0.109 mol/L) | Greiner Bio-one LTD, Stonehouse, UK | 454327 |
References
- Bye, A. P., Unsworth, A. J., Gibbins, J. M. Platelet signaling: a complex interplay between inhibitory and activatory networks. Journal of Thrombosis and Haemostasis: JTH. 14 (5), 918-930 (2016).
- Jones, C. I., Barrett, N. E., Moraes, L. A., Gibbins, J. M., Jackson, D. E. Endogenous inhibitory mechanisms and the regulation of platelet function. Methods in Molecular Biology. 788, 341-366 (2012).
- Paniccia, R., Priora, R., Liotta, A. A., Abbate, R. Platelet function tests: a comparative review. Vascular Health and Risk Management. 11, 133-148 (2015).
- Saboor, M., Moinuddin, M., Ilyas, S. New horizons in platelets flow cytometry. The Malaysian Journal of Medical Sciences : MJMS. 20 (2), 62-66 (2013).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88, 1525-1541 (1996).
- Pasquet, J. M., Noury, M., Nurden, A. T. Evidence that the platelet integrin alphaIIb beta3 is regulated by the integrin-linked kinase, ILK, in a PI3-kinase dependent pathway. Thrombosis and Haemostasis. 88 (1), 115-122 (2002).
- Stevens, J. M., Jordan, P. A., Sage, T., Gibbins, J. M. The regulation of integrin-linked kinase in human platelets: evidence for involvement in the regulation of integrin alpha 2 beta 1. Journal of Thrombosis and Haemostasis: JTH. 2 (8), 1443-1452 (2004).
- Jones, C. I., et al. Integrin-linked kinase regulates the rate of platelet activation and is essential for the formation of stable thrombi. Journal of Thrombosis and Haemostasis: JTH. 12 (8), 1342-1352 (2014).
- Cifuni, S. M., Wagner, D. D., Bergmeier, W. CalDAG-GEFI and protein kinase C represent alternative pathways leading to activation of integrin alphaIIbbeta3 in platelets. Blood. 112 (5), 1696-1703 (2008).
- Stolla, M., et al. The kinetics of alphaIIbbeta3 activation determines the size and stability of thrombi in mice: implications for antiplatelet therapy. Blood. 117 (3), 1005-1013 (2011).
- Kawasaki, H., et al. A Rap guanine nucleotide exchange factor enriched highly in the basal ganglia. Proceedings of the National Academy of Sciences of the United States of America. 95 (22), 13278-13283 (1998).
- . R Available from: https://www.r-project.org/ (2021)
- . R Studio Available from: https://rstudio.com/products/rstudio/download/ (2021)
- Yee, D. L., Sun, C. W., Bergeron, A. L., Dong, J. F., Bray, P. F. Aggregometry detects platelet hyperreactivity in healthy individuals. Blood. 106 (8), 2723-2729 (2005).
- Panzer, S., Hocker, L., Koren, D. Agonists-induced platelet activation varies considerably in healthy male individuals: studies by flow cytometry. Annals of Hematology. 85 (2), 121-125 (2006).
- Aliotta, A., Bertaggia Calderara, D., Alberio, L. Flow cytometric monitoring of dynamic cytosolic calcium, sodium, and potassium fluxes following platelet activation. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 97 (9), 933-944 (2020).
- do Ceu Monteiro, M., Sansonetty, F., Goncalves, M. J., O'Connor, J. E. Flow cytometric kinetic assay of calcium mobilization in whole blood platelets using Fluo-3 and CD41. Cytometry. 35 (4), 302-310 (1999).
- Vines, A., McBean, G. J., Blanco-Fernandez, A. A flow-cytometric method for continuous measurement of intracellular Ca(2+) concentration. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 77 (11), 1091-1097 (2010).
- Weber, A. A., Schror, K. Differential inhibition of adenosine diphosphate- versus thrombin receptor-activating peptide-stimulated platelet fibrinogen binding by abciximab due to different glycoprotein IIb/IIIa activation kinetics. Blood. 98 (5), 1619-1621 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved