Method Article
Kinetx: Un marco de software combinado de ensayo y análisis de citometría de flujo para medir y categorizar cuantitativamente la activación de plaquetas en tiempo real.
En este artículo
Resumen
Las plaquetas reaccionan rápidamente a una variedad de estímulos. Este artículo describe un ensayo de función plaquetaria basado en citometría de flujo en tiempo real y un software de código abierto a medida recientemente desarrollado (Kinetx) para permitir mediciones cinéticas cuantitativas de la liberación de gránulos plaquetarios, la unión al fibrinógeno y el flujo de calcio intracelular.
Resumen
Las plaquetas reaccionan rápidamente a la lesión vascular y se activan en respuesta a una serie de estímulos para limitar la pérdida de sangre. Muchas pruebas de función plaquetaria miden las respuestas finales después de un período de tiempo definido y no la tasa de activación de las plaquetas. Sin embargo, la velocidad a la que las plaquetas convierten los estímulos extracelulares en una respuesta funcional es un factor esencial para determinar la eficiencia con la que pueden responder a una lesión, unirse a un trombo en formación y enviar señales para reclutar otras plaquetas. Este artículo describe un ensayo de función plaquetaria basado en citometría de flujo que permite la adquisición simultánea de datos y la estimulación de muestras y utiliza un software de código abierto a medida recientemente desarrollado (Kinetx) para permitir mediciones cinéticas cuantitativas de la liberación de gránulos plaquetarios, la unión de fibrinógeno y el flujo de calcio intracelular. Kinetix se desarrolló en área para que los usuarios puedan alterar parámetros como el grado de suavizado, la identificación de puntos de datos periféricos o escalas de tiempo. Para ayudar a los usuarios que no están familiarizados con el entorno de R, el análisis de datos de Kinetix se puede realizar con un solo comando. En conjunto, esto permite que las métricas de activación plaquetaria en tiempo real, como la tasa, la aceleración, el tiempo hasta la tasa máxima, el tiempo hasta el pico de calcio y los cambios cualitativos en la forma, se midan y clasifiquen de manera precisa y reproducible. Las mediciones cinéticas de la activación plaquetaria proporcionan una visión única del comportamiento de las plaquetas durante las primeras etapas de activación y pueden proporcionar un método para predecir el reclutamiento de plaquetas en un trombo en formación.
Introducción
Las plaquetas juegan un papel central en la hemostasia y generan una respuesta rápida y multifacética a la lesión vascular 1,2. Las pruebas actuales de función plaquetaria miden varios aspectos de la reactividad plaquetaria, representativos de sus acciones hemostáticas in vivo. Tradicionalmente, la función plaquetaria se ha evaluado mediante ensayos de punto final que miden la unión al fibrinógeno, la liberación de gránulos o la agregación plaquetaria en las plaquetas estimuladas durante el tiempo suficiente para lograr la máxima activación 3,4. Estas pruebas no tienen en cuenta el tiempo que tardan las plaquetas en convertir los estímulos extracelulares en señales intracelulares y flujo de calcio y, posteriormente, se desgranulan y se unen al trombo en crecimiento. La sangre fluye a una velocidad de cizallamiento de hasta 20 dinas/cm3 en las venas y 80 dinas/cm3 en las arterias grandes5, lo que enfatiza la necesidad de que las plaquetas contrarresten esta rápida tasa de flujo mediante la detección, el procesamiento y la respuesta rápida a los estímulos extracelulares para unirse a un trombo en formación y apoyar su crecimiento continuo.
La tasa de activación plaquetaria puede variar independientemente del grado máximo de activación plaquetaria. La quinasa ligada a integrinas (ILK) es una proteína implicada en la regulación de las integrinas β1 y β3 en las plaquetas 6,7. La inhibición o deleción específica de ILK in vivo demostró que la tasa, pero no el grado máximo de activación plaquetaria, se vio afectada en ausencia de ILKfuncional 8. También se identificaron diferencias entre la tasa de agregación y el nivel máximo de agregación en ratones deficientes en CALDAG GEFI 9,10, una molécula de señalización involucrada en la regulación de la señalización de adentro hacia afuera a través de RAP111.
Estos hallazgos demuestran que la tasa de plaquetas y los niveles máximos de activación pueden ser autónomos y que las mediciones de la activación máxima pueden no ser descriptivas del comportamiento de las plaquetas hasta este momento. Estas diferencias en el tiempo que tardan las plaquetas en activarse pueden afectar profundamente su unión inicial al trombo en crecimiento, afectando la arquitectura y el tamaño general del trombo. Estas variaciones entre la tasa de plaquetas y la activación máxima ponen de manifiesto la necesidad de un ensayo para medir con precisión la tasa de activación de las plaquetas y puede utilizarse para detectar variaciones dentro de la población.
Este artículo describe un método que mide con precisión la activación de las plaquetas y el flujo de calcio en tiempo real y calcula una serie de métricas, incluida la velocidad a la que se activan las plaquetas y el tiempo que tardan las plaquetas en alcanzar la tasa máxima de activación y el flujo máximo de calcio. Estas mediciones cinéticas de la activación plaquetaria proporcionan una mejor comprensión del comportamiento de las plaquetas durante las primeras etapas de la formación de trombos y proporcionan un método para predecir la rapidez con la que las plaquetas pueden ser reclutadas en un trombo en formación.
Protocolo
Este protocolo utilizó sangre entera humana y plaquetas de donantes sanos sin condiciones de salud subyacentes y sin tomar ningún medicamento que se sepa que interfiere con la función plaquetaria después del consentimiento informado por escrito, y fue aprobado por el Comité de Ética de Investigación de la Universidad de Reading.
1. Extracción de sangre y preparación de plasma rico en plaquetas
- Recoger la sangre periférica en un vacutainer que contenga citrato de sodio al 3,2%
- Deseche los primeros 3 mL.
- Deje reposar la sangre a 30 °C durante 30 minutos antes de la centrifugación.
- Preparar el plasma rico en plaquetas (PRP) por centrifugación a 140 x g durante 20 min a temperatura ambiente antes de la incubación a 37 °C durante la duración del ensayo, que finalizó a los 60 min de la centrifugación.
2. Preparación del instrumento
NOTA: Un sistema de fluidos no presurizado es esencial para la citometría de flujo en tiempo real, ya que las plaquetas se estimulan simultáneamente a medida que el citómetro de flujo registra eventos.
- Utilice un citómetro de flujo no presurizado para realizar la citometría de flujo en tiempo real.
- Para realizar el ensayo a 37 °C, coloque una alfombrilla de disección de ratón en la platina para colocar la placa de 96 pocillos. Calentar la esterilla a 37 °C durante todo el ensayo.
- Coloque una placa de 96 pocillos encima de la estera calentada para permitir una incubación continua a 37 °C (Figura 1)
3. Preparación del ensayo
- Unión al fibrinógeno y expresión de P-selectina
- Cubrir una placa de microtitulación de polipropileno de 96 pocillos, de fondo redondo y no tratada, con un 5% de albúmina sérica bovina (BSA) en solución salina tamponada Hepes (HBS; 10 mM Hepes pH 7,4; 150 mM NaCl, 5 mM KCl, 1 mM MgSO4·7H20) durante la noche a 4 °C.
- Prepare la mezcla de anticuerpos en HBS que contenga 5 mM de glucosa (HBS-G). Añadir anticuerpo antifibrinógeno marcado con isotiocianato de fluoresceína (FITC) (FITC-FGN; DILUCIÓN 1: 37,5 (v/v)) y anti-Pselectina marcado con aloficocianina (APC) (APC-CD62P; dilución 1: 37,5 (v/v)) al HBS-G (volumen final: 225 μL) e incubar en una placa de 96 pocillos a 37 °C.
- Inmediatamente antes de recolectar eventos, agregue PRP a la mezcla de anticuerpos HBS-G a una dilución de 1:600 (v/v).
NOTA: Se requiere un volumen bajo de PRP para garantizar que no se exceda el límite de eventos y reducir la agregación plaquetaria en la muestra. La dilución plaquetaria se examinó en estudios piloto y no afecta la tasa de activación. - Incubar la mezcla de activación que contiene FITC-FGN, (dilución 1: 37,5 (v/v)) y APC-CD62P (dilución 1: 37,5 (v/v)) y agonista a 37 °C. Los agonistas incluyen trombina (thr; 0,0012-1 U/mL) en presencia del péptido Gly-Pro-Arg-Pro (GPRP; 1,18 mM), péptido relacionado con el colágeno reticulado (CRP-XL; 0,004-10 μg/mL), difosfato de adenosina (ADP; 0,04-4 μM), epinefrina (epi; 20-200 μM), 9,11-Dideoxi-11α,9α-epoximetanoprostaglandina F2α (U46619; 0,02-5 μM) y péptido activador del receptor de trombina 6 (TRAP-6; 0,04-10 μM).
- Flujo de calcio
NOTA: Este ensayo se realizó utilizando un kit comercial de ensayo de calcio (Tabla de materiales)- Cubrir una placa de microtitulación de polipropileno de 96 pocillos, de fondo redondo y sin tratar, con un 5% de BSA en solución salina tamponada Hepes durante la noche a 4 °C.
- Para preparar el colorante de ensayo de calcio, agregue 100 mL de tampón de ensayo de calcio y 2 mL de solución madre de probenecid (250 mM) a un frasco de reactivo de calcio para obtener 2 veces la solución de carga de reactivo de calcio.
- Para preparar Fluo-4/HBS-G, diluya el colorante de ensayo de calcio con HBS-G en una proporción de 1:1, filtre a través de un filtro de 0,22 μM. Añada 225 μL de Fluo-4/HBS-G a los pocillos apropiados de una placa de 96 pocillos a 37 °C.
- Incubar PRP a 37 °C durante 30 min en una dilución 1:1 con Fluo-4/HBS-G.
- Preparar la mezcla de activación en Fluo-4/HBS-G e incubar a 37 °C. Los agonistas incluyen trombina (1 U/mL) en presencia de GPRP, CRP-XL (0,5 μg/mL), ADP (1 μM), epinefrina (20 μM), U46619 (1 μM) y TRAP-6 (1 μM).
- Inmediatamente antes de recolectar eventos, agregue PRP/Fluo-4/HBS-G a los 225 μL de la mezcla Fluo-4/HBS-G a una dilución final de PRP (después de la adición de agonistas) de 1:600 (v/v; 0,5 mL en 300 mL del volumen final).
4. Procedimiento de ensayo y recopilación de datos
- Ajuste el citómetro de flujo a un caudal en "lento" con un número promedio de 1000 eventos por segundo (eps) y un máximo de 3000 eps. Establezca el umbral en 20000 para evitar el registro de residuos de celda.
- Controle la población de plaquetas mediante gráficos de dispersión directa (FSC) y dispersión lateral (SSC). Para la recopilación de datos, trace FSC-A vs. SSC-A para controlar con precisión la población de plaquetas y FL1 o FL4 frente al tiempo para registrar los eventos fluorescentes a lo largo del tiempo.
- El citómetro de flujo tarda 14 s en comenzar a registrar eventos; después de esto, deje que el instrumento registre los eventos en cada pocillo durante otros 5 s antes de agregar 75 μL de la mezcla de activación rápidamente usando una punta de carga de gel para garantizar la mezcla espontánea (Figura 1).
- Recoja los eventos durante 5 minutos y configure los gráficos para registrar el canal 488 (FL1; filtro 533/30 - FITC-fibrinógeno/FLUO-4) frente al tiempo y el canal 633 (FL4; filtro 675/25 - APC-P-selectin) frente al tiempo.
- Guarde los datos de trazado para los canales 488 y 633 de cada pozo como archivos CSV.
5. Análisis de datos
- Descargue la última versión de Kinetx12.
NOTA: La descarga incluye todo el código necesario para analizar los datos generados a partir del ensayo y va acompañada de un conjunto de prueba de datos experimentales de diez donantes y resultados generados a partir de su análisis (estos resultados se pueden regenerar y validar a través de los siguientes procedimientos) (Figura 2). - Configurar el entorno de R
- Utilice el lenguaje de programación R a través del entorno RStudio. Instale R13, RStudio14 y los siguientes paquetes: ggplot2, dplyr, plotrix, minpack.lm, tidyverse, psych. Asegúrese de que todos los paquetes de requisitos previos se hayan instalado correctamente.
- Crear metadatos: coloque un archivo de texto (llamado wellData.txt) dentro del mismo directorio que los datos. Describe los agonistas, sus concentraciones, los anticuerpos y el ensayo (función o calcio) utilizado para generar cada archivo CSV.
- Coloque un segundo archivo de texto ('IsotypeData.txt') en el mismo directorio y defina los isotipos. Los archivos proporcionados en la descarga ('data/wellData.txt' y 'data/IsotypeData.txt') pueden actuar como plantilla, siendo fácilmente adaptables a agonistas, inhibidores y concentraciones alternativas.
- Analice los datos: Kinetx comprende tres funciones, tal como se definen en los pasos 5.2.5-5.2.7.
- kinetxProcess.R: Esta función procesa los datos brutos de citometría de flujo funcional. Para ejecutar, escriba kinetxProcess('data location','where to put outputs','FL1' (para FITC-anti-fibrinógeno, o 'FL4' (para APC-CD62P)
- kinetxProcessCalcium.R: Esta función analiza y etiqueta los datos de flujo de calcio. Para ejecutar, escriba kinetxProcessCalcium('ubicación de datos','dónde colocar salidas','FL1')
- kinetxSummary.R: Esta función resume los datos. Para ejecutar, escriba kinetxSummary('ubicación de datos','dónde colocar salidas','FL1').
- Para ejecutar todas las funciones anteriores (5.2.5-5.2.7) en los datos de prueba, utilice el script (test. R).
NOTA: Las dos primeras funciones producen cifras para cada donante que muestran los datos brutos más las curvas ajustadas. Todas las salidas y una hoja de cálculo que resume los datos se colocan en la ubicación de salida.
Resultados
El análisis de la citometría de flujo funcional en tiempo real revela diferencias en la forma de las curvas de activación entre agonistas y entre donantes
El análisis de datos de los datos funcionales (exposición a la selectina P y unión al fibrinógeno) utilizando Kinetx elimina los puntos de datos que están fuera de los rangos razonables (>200000 o <1) y <2,80 s (el tiempo cero se establece hasta este punto), normaliza los datos a la mediana de los isotipos y se ajusta a una curva de media móvil suave (a través de la función loess). Kinetx también asigna métricas y categorías que se basan en la forma de la línea suavizada ajustada, los valores absolutos y las tasas de cambio de la siguiente manera: (1) RoC: aumento promedio en la línea suavizada durante los primeros 120 s; (2) etiqueta: categoriza las respuestas como rápidas, medias o lentas y se establece de acuerdo con los límites de 40 y 80 para FL1 y 5 y 10 para FL4; (3) EarlyRoC - aumento promedio en la línea suavizada durante los primeros 20 s; (4) forma: respondedores bajos, crecientes, lineales o decrecientes (Figura 3A) - Los respondedores bajos se determinan como FL1 < 4000 o FL4 < 1000, las etiquetas crecientes, lineales y decrecientes se determinan en función de: shapeMetric - RoC (120 segundos)/EarlyRoC, donde el aumento de shapeMetric >2, lineMetric shapeMetric entre 0.9-2 y shapeMetric decreciente <0.9; (5) Elabora una hoja de cálculo que resume los datos proporcionando el nivel y la tasa de cambio a 0 s, 10 s, 20 s, 30 s, 40 s, 60 s, 90 s, 120 s, 180 s, la mediana del isotipo, las tasas máximas y mínimas de cambio y aceleración y todas las etiquetas y categorías.
Se analizó la unión al fibrinógeno plaquetario y la exposición a la P-selectina durante 5 minutos después de la activación en respuesta a una concentración única de los agonistas ADP, TRAP-6, CRP-XL, epinefrina y U46617 en 30 donantes. Las métricas para la unión al fibrinógeno y la exposición a la P-selectina en respuesta a diferentes agonistas muestran una variación considerable en la forma de la respuesta (Figura 3). Las plaquetas estimuladas con TRAP-6 y ADP mostraron una aceleración más rápida en la unión del fibrinógeno, que para muchos donantes se ralentizó en momentos posteriores (Figura 3B). La unión al fibrinógeno en respuesta a la PCR-XL, la trombina y la epinefrina fue más probable que mostrara una tasa de respuesta creciente o lineal. Muchos donantes mostraron un retraso relativamente largo para CRP-XL antes de que la tasa de unión al fibrinógeno se acelerara rápidamente. La respuesta a U46619 a menudo se categorizó como baja. Por el contrario, la exposición a la P-selectina fue más probable que mostrara una tasa lineal o creciente de respuesta a todos los agonistas, excepto al U46619, que nuevamente mostró niveles de respuesta bajos (Figura 3C).
El flujo de calcio intracelular durante la activación plaquetaria se puede medir con precisión mediante citometría de flujo en tiempo real
El análisis de datos del ensayo de flujo de calcio elimina los puntos de datos que están fuera de los rangos razonables (< 2,80 s el tiempo cero se establece en este punto) y luego se ajusta a una curva de media móvil suave (a través de la función loess). Kinetx asigna métricas, y las categorías se asignan en función de la forma de las líneas suaves ajustadas, los valores absolutos y las tasas de cambio de la siguiente manera: (1) categoría: que describe la forma de la respuesta del calcio en función del aumento temprano, el máximo y la caída final desde el máximo, descrito como lineal, pico o sostenido (Figura 4A); (2) Tasa: que describe la tasa de cambio en los 30 s rápidos y se define como sin cambio, lento, medio o rápido (con corte en 10, 40 y 80). Kinetx también produce una hoja de cálculo que resume los datos proporcionando el nivel y la tasa de cambio a 0 s, 10 s, 20 s, 30 s, 40 s, 60 s, 90 s, 120 s, 180 s, las tasas máximas y mínimas de cambio y aceleración y todas las etiquetas y categorías, así como la producción de una cifra de los datos para cada donante. Los ejemplos de flujo de calcio medidos por este método en 30 individuos mostraron nuevamente diferentes patrones de activación entre individuos y agonistas (Figura 4B). La PCR-XL dio una respuesta predominantemente sostenida al calcio, mientras que la respuesta a TRAP-6 mostró con mayor frecuencia una respuesta máxima. Todos los demás agonistas generaron una respuesta predominantemente lineal.
La citometría de flujo en tiempo real identifica diferencias en los niveles máximos de activación en respuesta a diferentes agonistas y concentraciones
Los resultados demuestran que el ensayo de citometría de flujo en tiempo real tiene la capacidad de detectar diferencias en los niveles máximos de unión al fibrinógeno (Figura 5A) y exposición a la P-selectina (Figura 5D), en respuesta a la estimulación a través de diferentes receptores (10 μg/mL CRP-XL vs. 3 U/mL de trombina P < 0,001; 10 μg/mL CRP-XL vs. 1 U/mL de trombina P < También muestran que el ensayo es sensible a las diferencias en la concentración de agonistas, donde los niveles de unión máxima al fibrinógeno y la exposición a la P-selectina aumentan en respuesta a concentraciones más altas de agonistas (unión al fibrinógeno - CRP-XL - 0,004 μg/mL vs. 0,4, 5, 10 μg/mL, P < 0,01; trombina - 0,0012 U/mL vs. 1 y 3 U/mL, P < 0,01; ADP - 0,04 μg/mL vs. 1 y 4 μM, P < 0,05).
El ensayo de citometría de flujo en tiempo real es lo suficientemente sensible como para detectar la variabilidad entre los donantes en la tasa de activación de plaquetas
La tasa máxima de activación plaquetaria se determinó ajustando una media móvil suavizada (loess) a los datos de fluorescencia y luego utilizándola para calcular la tasa máxima de unión al fibrinógeno y la exposición a la P-selectina (Figura 5B, E). Los datos demuestran una variación considerable entre donantes individuales, y el ensayo de citometría de flujo es lo suficientemente sensible como para detectar esta variación. Los resultados indican que el aumento de la concentración de agonistas tiene poco efecto sobre la tasa máxima de unión al fibrinógeno (Figura 5B). Por el contrario, la tasa máxima de exposición a la P-selectina aumenta con una mayor concentración de trombina y CRP-XL, pero no con el aumento de las concentraciones de ADP (Figura 5E).
Las variaciones en el tiempo de retraso de la activación plaquetaria se pueden detectar mediante citometría de flujo en tiempo real
El tiempo hasta la tasa máxima de activación plaquetaria se determinó calculando los puntos de tiempo en los que se alcanzó la tasa máxima de unión al fibrinógeno y la exposición a la P-selectina (Figura 5C,F). La tasa máxima de unión al fibrinógeno y de exposición a la selectina P varía entre los donantes, especialmente a concentraciones más bajas de agonistas. La estimulación de las plaquetas con concentraciones crecientes de CRP-XL muestra que las concentraciones más altas de agonistas tardan menos tiempo en alcanzar la tasa máxima de unión al fibrinógeno con menos variabilidad entre donantes; sin embargo, esta tendencia no se observa ni con la estimulación con trombina ni con ADP (Figura 5C). El ensayo demuestra que, en algunas circunstancias, el aumento de la concentración de agonistas disminuye el tiempo necesario para que comience la activación plaquetaria (tiempo de retraso) sin alterar la tasa máxima de activación plaquetaria y que ambas medidas pueden evaluarse con este ensayo.
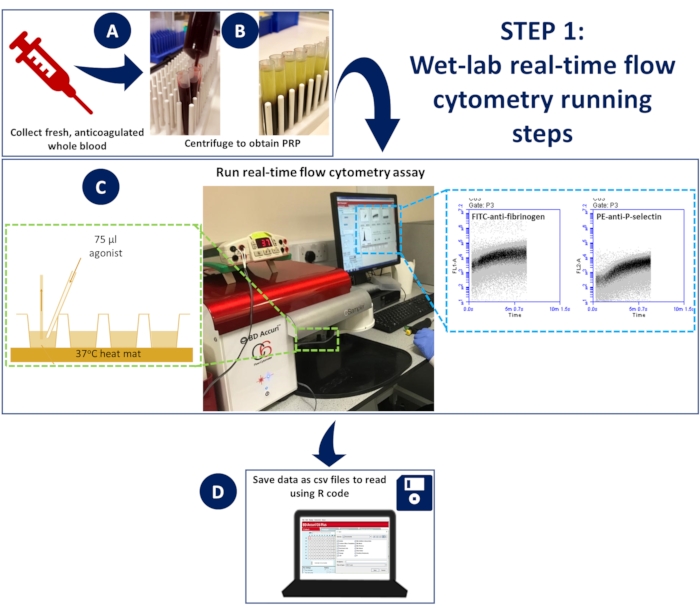
Figura 1: Citometría de flujo en tiempo real en laboratorio húmedo. (A) se centrifugó sangre total anticoagulada (B) para obtener plasma rico en plaquetas (PRP). (C) El PRP diluido que contenía anticuerpos apropiados o colorantes indicadores de calcio se colocó en una placa de 96 pocillos, se cargó en un citómetro de flujo no presurizado y se mantuvo a 37 °C utilizando una estera de disección. Las muestras se estimularon durante la adquisición con una mezcla de activación que contenía anticuerpos o colorante y agonista de calcio, que se añadieron rápidamente al pocillo utilizando una punta de carga de gel para asegurar la mezcla espontánea. (D) Los eventos se recopilaron durante 5 minutos y se guardaron archivos CSV de los datos de cada pozo. Haga clic aquí para ver una versión más grande de esta figura.
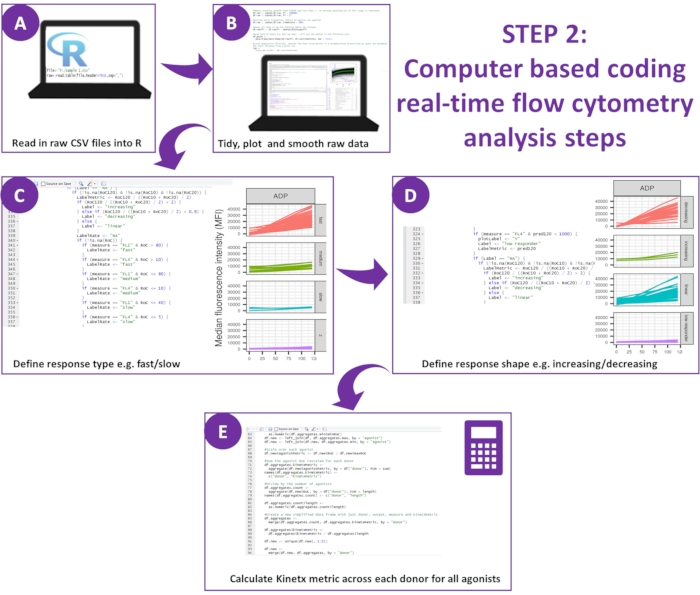
Figura 2: Esquema del análisis de datos. (A) Se configuró el entorno de R y se crearon los metadatos. (B) Se eliminaron los datos periféricos y se ajustó una curva de media móvil suave (loess). (C) Se definió el tipo de respuesta y (D) la forma de respuesta. (E) Se calcularon, exportaron y se generaron cifras para cada donante. Haga clic aquí para ver una versión más grande de esta figura.
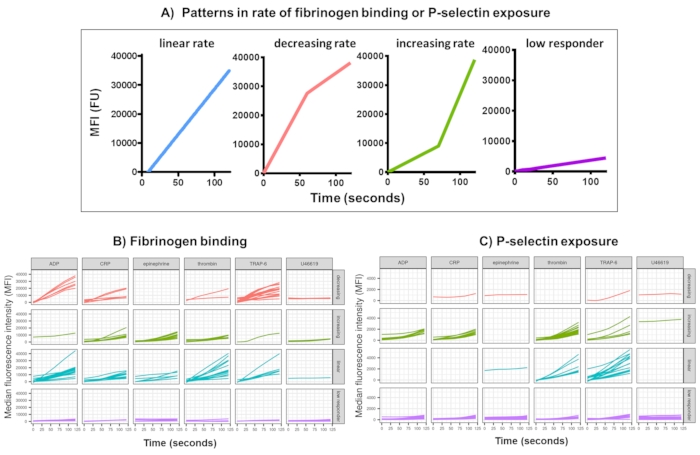
Figura 3: Resultado representativo del análisis Kinetx de la unión de fibrinógeno plaquetario en tiempo real y la expresión de P-selectina. (A) Además de proporcionar métricas como la tasa máxima de cambio (RoC) y la RoC en varios puntos temporales, Kinetx también categoriza la forma de la curva para proporcionar información adicional sobre la activación de las plaquetas que es difícil de capturar en una sola métrica. Los datos representativos de 30 individuos muestran la variación típica observada en la unión de plaquetas (B) fibrinógeno y (C) en tiempo real a la expresión de P-selectina en respuesta a los agonistas ADP, TRAP-6, CRL-XL, epinefrina y U46617. Haga clic aquí para ver una versión más grande de esta figura.
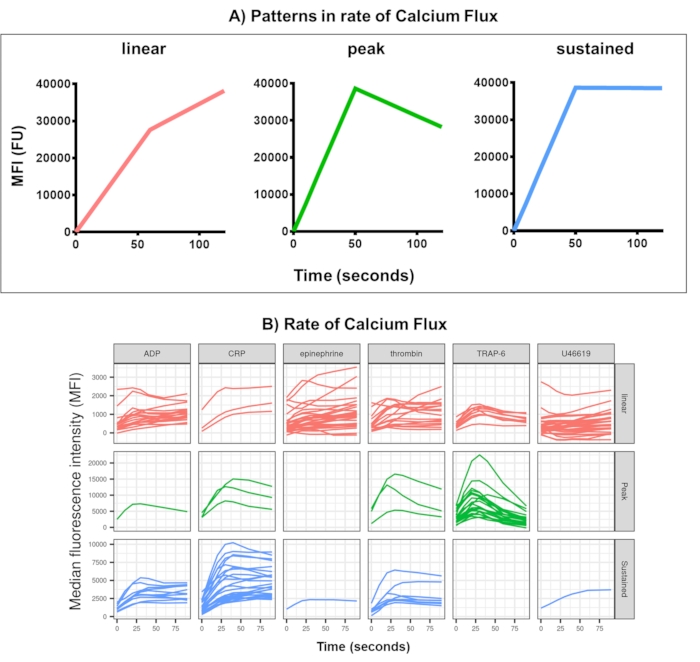
Figura 4: Resultado representativo del análisis de Kinetx del flujo de calcio plaquetario en tiempo real. (A) Además de proporcionar métricas como la tasa máxima de cambio (RoC) y la RoC en varios puntos temporales, Kinetx también categoriza la forma de la curva de flujo de calcio para proporcionar información adicional sobre la activación de las plaquetas que es difícil de capturar en una sola métrica. Los datos representativos de 30 individuos muestran la variación típica observada en el flujo de calcio plaquetario (B) en tiempo real en respuesta a los agonistas ADP, TRAP-6, CRL-XL, epinefrina y U46617. Haga clic aquí para ver una versión más grande de esta figura.
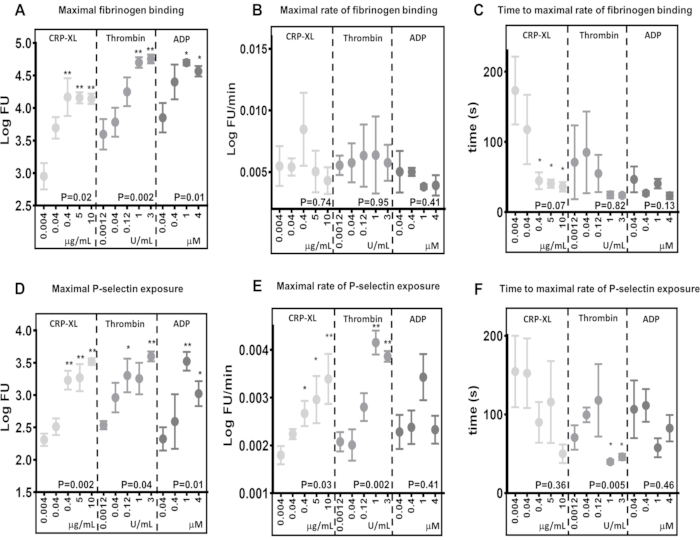
Figura 5: La concentración de agonistas determina la activación máxima de las plaquetas, pero no la tasa de activación de las plaquetas. La activación máxima de las plaquetas - unión al fibrinógeno (A) o exposición a la P-selectina (D) - fue significativamente alterada positivamente por la concentración de agonistas (CRP-XL, trombina o ADP). La tasa de activación plaquetaria (B y E) y el tiempo hasta la tasa máxima de activación plaquetaria (C y F) mostraron ninguna relación o una relación más débil con el cambio de la concentración de agonistas. Los valores P muestran la significación en todo el rango de concentración (prueba de Kruskal-Wallis), y los asteriscos indican una diferencia significativa (prueba de comparación múltiple) de los valores individuales de la concentración más baja. * P < 0,05, ** P < 0,01. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La velocidad a la que las plaquetas detectan, procesan y responden a los estímulos activadores puede ser un determinante esencial para la formación de trombos. Estudios previos han encontrado que la inhibición de los elementos de señalización que impactan en la tasa, pero no en la extensión final de la activación plaquetaria, resulta en la formación de trombos inestables8. Muchos ensayos de función plaquetaria miden el grado de activación y agregación plaquetaria en respuesta a diferentes afecciones y tratamientos; Sin embargo, estos no tienen en cuenta la velocidad a la que las plaquetas se activan y el tiempo que tarda en ocurrir este complejo proceso 3,4. Los innovadores ensayos basados en citometría de flujo desarrollados aquí controlan de forma reproducible la activación plaquetaria a lo largo del tiempo y la traducen en una serie de métricas para calcular la tasa máxima de activación plaquetaria y el tiempo que tardan las plaquetas en alcanzar esta tasa máxima y activarse por completo.
Los datos presentados ponen de manifiesto la capacidad del ensayo en tiempo real para identificar variaciones entre las diferentes respuestas al tipo y la concentración de agonistas y entre individuos. Muchos reportes previos han demostrado que la reactividad plaquetaria es altamente variable entre individuos normales15,16, lo que indica que la tasa de activación plaquetaria también puede variar significativamente dentro de la población. Los datos de este estudio demuestran que la tasa de degranulación y unión del fibrinógeno a las plaquetas parece ser incluso más variable que los niveles máximos de activación plaquetaria. Esto demuestra que la citometría de flujo en tiempo real también se puede utilizar como una herramienta valiosa y confiable para identificar variaciones en la tasa de plaquetas en la población y detectar los efectos de diferentes agentes inhibidores o proactivadores en la tasa plaquetaria como un medio adicional para medir la función plaquetaria.
Cuando se mide la función plaquetaria mediante ensayos de punto final, se pueden hacer comparaciones sobre el grado de unión al fibrinógeno o la liberación de gránulos entre diferentes agonistas. Las curvas de loess que comparan la unión al fibrinógeno durante los primeros 5 minutos de activación plaquetaria demuestran la capacidad del ensayo en tiempo real para desentrañar más detalles en las diferencias en la cinética de activación plaquetaria que los ensayos de un solo criterio de valoración no pueden medir.
Los datos recopilados del ensayo en tiempo real demuestran que la velocidad a la que el fibrinógeno se une a las plaquetas sigue un patrón ligeramente diferente, dependiendo de la vía de activación (Figura 3). Para evaluar con precisión la cinética de activación plaquetaria, es esencial utilizar un citómetro de flujo no presurizado que permita la adquisición simultánea de datos y la estimulación de muestras. También es esencial que los agonistas se añadan rápidamente para garantizar una mezcla casi instantánea y completa del agonista y las plaquetas. La estimulación con trombina, ADP y epinefrina produce una curva similar que representa un inicio rápido de la señalización en respuesta a la sensibilización del receptor, lo que resulta en la unión del fibrinógeno a las plaquetas a un ritmo rápido y constante. Por el contrario, las plaquetas estimuladas por CRP-XL son inicialmente muy lentas para unirse al fibrinógeno después de la sensibilización inicial del receptor; Sin embargo, la tasa de unión del fibrinógeno aumenta rápidamente después de este retraso inicial. La estimulación plaquetaria con U46619, un mimético de TXA2, da como resultado una tasa inicial rápida de unión al fibrinógeno, que disminuye rápidamente a una tasa muy lenta que conduce a un aumento leve y constante en la unión del fibrinógeno con el tiempo.
Kinetx fue diseñado para ser de código abierto, reproducible y fácil de implementar con el fin de sortear los problemas con el software propietario, como el costo y la inflexibilidad. Como tal, necesitaba ser desarrollado con software que no era propietario. Se eligió R porque es ampliamente utilizado por los biólogos, fácil de instalar, gratuito y de código abierto. Este entorno de código abierto permite a los usuarios competentes en R modificar parámetros como el grado de suavizado, la identificación de puntos de datos periféricos o escalas de tiempo. Sin embargo, para ayudar a los investigadores que no están familiarizados con R, Kinetix también se desarrolló para que el análisis se pueda realizar a través de un solo comando (ya sea kinetxProcess o kinetxProcessCalcium, dependiendo de los datos que se estén analizando). El software Kinetix que se muestra aquí puede calcular una variedad de métricas, incluidos los valores de los niveles máximos, la tasa y la aceleración de la unión al fibrinógeno o la exposición a la P-selectina y los puntos de tiempo en los que se producen estos máximos. La cinética de la activación plaquetaria en respuesta a diferentes vías estimuladoras se puede comparar con mayor precisión utilizando estos números.
Las comparaciones entre diferentes estimulaciones agonistas en los niveles máximos de unión al fibrinógeno y las tasas de unión del fibrinógeno a las plaquetas son buenos ejemplos de cómo la tasa de activación plaquetaria puede variar independientemente de la unión máxima. Al comparar la unión máxima de fibrinógeno después de 5 min de estimulación con 0,04 μM de ADP (3,85 LogFU) y 0,04 μg/mL CRP-XL (3,70 LogFU), ambos agonistas han dado lugar a una cantidad similar de fibrinógeno unido (Figura 5A). Las tasas máximas de unión al fibrinógeno muestran una diferencia aún menor (0,04 μM ADP - 0,0050 LogFU/minuto; 0,04 μg/mL CRP-XL - 0,0054 LogFU/min), lo que indica que la tasa general de unión al fibrinógeno es similar entre estas dos estimulaciones (Figura 5B). Sin embargo, cuando se compara el tiempo de retraso de la activación plaquetaria, hay una clara diferencia que muestra que la PCR-XL (117 s a la tasa máxima) se acelera a un ritmo mucho más lento que la ADP (47 s a la tasa máxima) (Figura 5C). Por lo tanto, queda claro que la estimulación con ADP da como resultado una respuesta inicial mucho más rápida (P < 0,001) en comparación con la PCR-XL. Cuando se observan en conjunto, estas mediciones de la cinética de las plaquetas en respuesta a dos agonistas diferentes describen una respuesta inicial rápida a la estimulación de ADP que se acelera lentamente y se mantiene a un ritmo constante. Por el contrario, la estimulación de CRP-XL da lugar a una tasa inicial de activación lenta, que se acelera rápidamente en un momento mucho más tardío, lo que finalmente conduce a una tasa general y niveles de unión al fibrinógeno similares a los de ADP. Estas diferencias entre los niveles máximos, la velocidad y la aceleración de la unión al fibrinógeno demuestran que una serie de parámetros están involucrados en la medición de la rapidez con la que se activan las plaquetas. El ensayo en tiempo real y el análisis Kinetx pueden medir y comparar estos parámetros, describir el tiempo que transcurre desde la sensibilización del receptor hasta la respuesta plaquetaria y compararlo entre diferentes vías de señalización.
El aumento de la concentración de agonistas no tiene un efecto significativo sobre la tasa de unión del fibrinógeno a las plaquetas. Sin embargo, el tiempo necesario para alcanzar la tasa máxima de unión al fibrinógeno disminuye a medida que aumenta la concentración de agonistas, lo que sugiere que las plaquetas se unen al fibrinógeno a un ritmo constante y la saturación del receptor desempeña un papel más destacado en la rapidez con la que las plaquetas se unen al fibrinógeno.
El ensayo y análisis de flujo de calcio descrito es un ensayo de calcio rápido y fácil de realizar que se puede incorporar como muestras adicionales en el ensayo en tiempo real, lo que permite el análisis de la unión de fibrinógeno de calcio y plaquetas y P-selectina en la misma serie de muestras. El paquete de análisis a medida proporciona una evaluación en profundidad de la cinética del flujo de calcio, incluida la forma de la respuesta, la respuesta máxima y el tiempo hasta la respuesta máxima. Estos parámetros se pueden comparar para ver la variación entre donantes y en respuesta a diversos agentes farmacéuticos. El flujo de calcio en las plaquetas se ha estudiado previamente en las plaquetas utilizando una variedad de ensayos basados en citometría de flujo 17,18,19. Aliotta et al.14, describen un elegante ensayo capaz de analizar la cinética de múltiples iones intracelulares. El ensayo de calcio presentado aquí se basa en estos ensayos publicados anteriormente al incluir el paquete de análisis que permite una mayor flexibilidad, una exploración más profunda de los datos con el beneficio de un análisis de alto rendimiento para múltiples donantes en un corto período de tiempo.
Estudios previos han demostrado que la inhibición o ausencia de ciertas moléculas de señalización resulta en una tasa de activación plaquetaria alterada, lo que se traduce directamente en la formación de trombos 8,9. En el pasado, la cinética de activación plaquetaria podía medirse mediante citometría de flujo en un número de puntos de tiempo fijos que luego se pueden utilizar para calcular y comparar, por ejemplo, la tasa de externalización de GPIIbIIIa en respuesta a diferentes agonistas20. El ensayo en tiempo real y el análisis Kinetx descritos en este documento proporcionan un método simple, gratuito y preciso para medir tanto la tasa como el punto final de la activación plaquetaria a partir de plaquetas en reposo. Es probable que esto sea importante para identificar variaciones fisiológicamente relevantes en la función plaquetaria que pueden pasarse por alto cuando solo se miden las lecturas de los puntos finales.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este proyecto contó con el apoyo de la Fundación Británica del Corazón (PG/16/36/31967, RG/20/7/34866 y RG/15/2/31224).
Materiales
| Name | Company | Catalog Number | Comments |
| 9,11-Dideoxy-11α,9α-epoxymethanoprostaglandin F2α - U46619 | Sigma-Aldrich, Poole, UK | D8174-1MG | |
| Accuri C6 flow cytometer with BD Csampler | Beckton Dickinson, UK | 660517 + 660519 | |
| Adenosine diphosphate | Sigma-Aldrich, Poole, UK | A2754-1G | |
| APC-labelled anti-P-selectin (CD62p) | BD Biosciences, UK | 550888 | |
| Corning polypropylene 96-well round-bottomed, non-treated microtitre plate | Sigma-Aldrich, Poole, UK | CLS3879-50EA | |
| Cross-linked collagen related peptide (CRP-XL) | CambCol, UK | ||
| Epinephrine | Sigma-Aldrich, Poole, UK | E4375-1G | |
| FITC-labelled anti-fibrinogen antibody | Dako, Agilent Technologies, UK | F011102-2 | |
| Fluo-4 Direct dye | Thermo-Fisher Scientific | F10472 | |
| Gel loading tips | Starlab, UK | I1022-0600 | |
| Gly-Pro-Arg-Pro peptide | Sigma-Aldrich, Poole, UK | G1895-5MG | |
| Thrombin | Sigma-Aldrich, Poole, UK | SRE0003-10KU | |
| Thrombin receptor activator peptide 6 (TRAP-6) | Bachem, St Helens, UK | H-2936.0005 | |
| Vacuette 9NC coagulation 3.2 % trisodium citrate (0.109 mol/L) | Greiner Bio-one LTD, Stonehouse, UK | 454327 |
Referencias
- Bye, A. P., Unsworth, A. J., Gibbins, J. M. Platelet signaling: a complex interplay between inhibitory and activatory networks. Journal of Thrombosis and Haemostasis: JTH. 14 (5), 918-930 (2016).
- Jones, C. I., Barrett, N. E., Moraes, L. A., Gibbins, J. M., Jackson, D. E. Endogenous inhibitory mechanisms and the regulation of platelet function. Methods in Molecular Biology. 788, 341-366 (2012).
- Paniccia, R., Priora, R., Liotta, A. A., Abbate, R. Platelet function tests: a comparative review. Vascular Health and Risk Management. 11, 133-148 (2015).
- Saboor, M., Moinuddin, M., Ilyas, S. New horizons in platelets flow cytometry. The Malaysian Journal of Medical Sciences : MJMS. 20 (2), 62-66 (2013).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88, 1525-1541 (1996).
- Pasquet, J. M., Noury, M., Nurden, A. T. Evidence that the platelet integrin alphaIIb beta3 is regulated by the integrin-linked kinase, ILK, in a PI3-kinase dependent pathway. Thrombosis and Haemostasis. 88 (1), 115-122 (2002).
- Stevens, J. M., Jordan, P. A., Sage, T., Gibbins, J. M. The regulation of integrin-linked kinase in human platelets: evidence for involvement in the regulation of integrin alpha 2 beta 1. Journal of Thrombosis and Haemostasis: JTH. 2 (8), 1443-1452 (2004).
- Jones, C. I., et al. Integrin-linked kinase regulates the rate of platelet activation and is essential for the formation of stable thrombi. Journal of Thrombosis and Haemostasis: JTH. 12 (8), 1342-1352 (2014).
- Cifuni, S. M., Wagner, D. D., Bergmeier, W. CalDAG-GEFI and protein kinase C represent alternative pathways leading to activation of integrin alphaIIbbeta3 in platelets. Blood. 112 (5), 1696-1703 (2008).
- Stolla, M., et al. The kinetics of alphaIIbbeta3 activation determines the size and stability of thrombi in mice: implications for antiplatelet therapy. Blood. 117 (3), 1005-1013 (2011).
- Kawasaki, H., et al. A Rap guanine nucleotide exchange factor enriched highly in the basal ganglia. Proceedings of the National Academy of Sciences of the United States of America. 95 (22), 13278-13283 (1998).
- Kinetx. , Available from: http://github.com/cardiomaths/Kinetx (2021).
- R. , Available from: https://www.r-project.org/ (2021).
- R Studio. , Available from: https://rstudio.com/products/rstudio/download/ (2021).
- Yee, D. L., Sun, C. W., Bergeron, A. L., Dong, J. F., Bray, P. F. Aggregometry detects platelet hyperreactivity in healthy individuals. Blood. 106 (8), 2723-2729 (2005).
- Panzer, S., Hocker, L., Koren, D. Agonists-induced platelet activation varies considerably in healthy male individuals: studies by flow cytometry. Annals of Hematology. 85 (2), 121-125 (2006).
- Aliotta, A., Bertaggia Calderara, D., Alberio, L. Flow cytometric monitoring of dynamic cytosolic calcium, sodium, and potassium fluxes following platelet activation. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 97 (9), 933-944 (2020).
- do Ceu Monteiro, M., Sansonetty, F., Goncalves, M. J., O'Connor, J. E. Flow cytometric kinetic assay of calcium mobilization in whole blood platelets using Fluo-3 and CD41. Cytometry. 35 (4), 302-310 (1999).
- Vines, A., McBean, G. J., Blanco-Fernandez, A. A flow-cytometric method for continuous measurement of intracellular Ca(2+) concentration. Cytometry. Part A : The Journal of the International Society for Analytical Cytology. 77 (11), 1091-1097 (2010).
- Weber, A. A., Schror, K. Differential inhibition of adenosine diphosphate- versus thrombin receptor-activating peptide-stimulated platelet fibrinogen binding by abciximab due to different glycoprotein IIb/IIIa activation kinetics. Blood. 98 (5), 1619-1621 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados