Method Article
结合眼动仪和脑电图系统的图像空间规划任务
摘要
结合脑电图和眼动追踪系统的认知规划研究提供了一种多模式方法来研究介导人类认知控制和目标导向行为的神经机制。在这里,我们描述了一种研究大脑振荡和眼球运动在规划表现中的作用的协议。
摘要
规划过程的特点是能够制定有组织的计划以实现目标,对于人类目标导向的行为至关重要。由于几种神经精神疾病的计划受到影响,因此实施适当的临床和实验测试来检查计划至关重要。由于规划部署的性质,其中多个认知领域参与其中,规划的评估和行为范式的设计与神经影像学方法相结合是认知神经科学的当前挑战。在 27 名健康成年参与者中,结合脑电图 (EEG) 系统和眼球运动记录评估了计划任务。规划可以分为两个阶段:心理规划阶段,其中内部表示一系列步骤,以及执行阶段,其中使用运动动作来实现先前计划的目标。我们的协议包括一个规划任务和一个控制任务。规划任务涉及解决 36 个迷宫试验,每个试验代表一张动物园地图。该任务有四个阶段:i) 规划,其中指示受试者根据一套规则规划一条访问四只动物位置的路径;ii) 维护,受试者必须在他们的工作记忆中保留计划的路径;iii) 执行,受试者使用眼球运动来追踪眼动仪系统指示的先前计划的路径;iv) 反应,其中受试者报告了访问动物的顺序。控制任务具有类似的结构,但通过修改任务目标删除了认知规划组件。脑电图的时空模式显示,随着时间的推移,计划会诱导额中线 θ 活动 (FMθ) 逐渐和持久地上升。通过来源分析在前额叶皮层中确定了这种活动的来源。我们的结果表明,结合脑电图和眼动仪系统的实验范式是评估认知规划的最佳选择。
引言
在过去的 10 年里,已经进行了广泛的研究,以检查振荡神经动力学对认知和行为的作用。这些研究已经确定,特化和广泛的皮层区域之间的频率特异性相互作用在认知和认知控制中起着至关重要的作用 1,2,3。这种方法突出了大脑活动的节律性,这有助于协调大规模的皮层动力学并支持认知加工和目标导向行为 4,5。有大量证据表明,大脑中的节律性振荡与各种认知过程有关,包括感知 6 (perception6)、注意力 7,8、9、决策 10 (decision-making10)、记忆再激活11 (memory reactivation)、工作记忆12 (working memory) 和认知控制13 (cognitive control)。已经提出了不同的振荡机制来指导目标导向的行为,瞬态大规模频率特异性网络为认知处理提供了框架 1,14,15。例如,最近的研究结果表明,大脑中的特定频带可能反映了调节尖峰活动的反馈机制,提供了一个时间参考框架来协调皮层兴奋性和尖峰时间以产生行为 16,17,18。Helfrich 和 Knight19 提供了评论。
这些证据引发了关于前额叶皮层 (PFC) 如何编码规划任务上下文和相关行为相关规则的问题。长期以来,人们一直认为 PFC 通过其产生的神经活动的振荡模式来支持认知控制和目标导向行为,选择性地偏置远处大脑区域的神经活动并控制大规模神经网络中的信息流20。此外,有人提出,表现出本地同步性的地区更有可能参与区域间活动 21,22,23。特别是,通过头皮脑电图 (EEG) 测量的皮质 θ 带 (4-8 Hz) 振荡已被提议作为在广泛网络中传递自上而下控制的潜在机制13。具体来说,人类的 θ 波段活动反映了高级认知过程,例如记忆编码和检索、工作记忆保留、新奇性检测、决策和自上而下的控制 12,24,25,26。
与此相关,Cavanagh 和 Frank13 提出了控制过程的两种顺序机制:对控制需求的识别和控制实例化。对控制需求的认识可能由源自内侧前额叶皮层 (mPFC) 的额线中线 θ (FMθ) 活动来表示,这已被描述为事件相关电位 (ERP) 成分,这些成分反映了响应各种情况的 mPFC 相关控制过程,例如新信息 27,28,29、冲突的刺激反应要求30、错误反馈31、 和错误检测32.这些 ERP 成分反映了在存在新奇、冲突、惩罚或错误的情况下增加认知控制的需求,在正面中线电极26、27、33、34、35、36、37、38、39、40 处记录的 θ 波段中表现出共同的光谱特征, 41,42,43,44。
FMθ 活动的脑电图响应在 θ 频带26 中显示出相位重置和功率增强的模式。尽管 EEG 方法在空间分辨率方面存在局限性,但已经收集了各种证据来源来证明 FMθ 活动是由中扣带皮层 (MCC) 产生的13。这些 θ 动力学被认为是调节 mPFC 神经元过程的时间框架,随后随着需要加强控制的事件而增强26。这是通过源分析 31,33,45,46,47,同时进行脑电图和功能磁共振成像 (fMRI) 记录 48,49 以及人类 50 和猴子的侵入性脑电图记录51,52,53 确定的。
基于这些观察,额叶中线 theta 被认为是一种通用机制,一种通用语言,用于在行动和结果缺乏确定性的不同情况下执行适应性控制,例如在规划期间。我们在本协议中提出的行为范式已用于研究认知规划及其时间和神经特征。尽管在其他场景中已经报道了各种认知控制机制,但目前的协议允许最近对计划及其相关的神经和时间特性的描述54。规划的认知过程包括两个不同的阶段:心理规划阶段,在此期间发展出一系列计划的内部表示55,以及规划执行阶段,其中执行一组运动动作以实现先前计划的目标56。众所周知,规划需要整合执行功能的各个组成部分,包括工作记忆、注意力控制和反应抑制,这使得这些过程的实验作和孤立测量具有挑战性57,58。
认知规划的神经影像学研究常用行为范式,例如伦敦塔 59,60,61;然而,为了控制混杂因素,用于研究认知规划的任务可能会变得有限和人为,从而导致预测和生态效度降低 62,63,64,65。为了克服神经心理学领域的这个问题,现实世界的规划情境被提议作为生态任务62,63。执行障碍综合症电池行为评估中的动物园地图任务子测试以更自然和相关的方式测量计划和组织技能64,66。该测试是一项纸笔测试,涉及规划一条路线以访问动物园地图上 12 个地点中的 6 个。这些地点是普通动物园中的常见场所,例如大象屋、狮子笼、休息区、咖啡店等。有两个条件可以评估不同级别的计划:i) 制定条件,其中指示受试者按照他们选择的顺序规划一条路线,以访问六个地方,但要根据一套规则;ii) 执行条件,其中受试者被指示按特定顺序访问六个地方并遵循一组规则。这两个条件提供了有关结构不良(制定)和结构良好(执行)问题中的规划技能的信息67.第一个被描述为在开放情况下要求更高的认知任务,因为它要求受试者制定一个逻辑策略来实现目标。在追踪路径之前,必须设计一系列运算符;否则,可能会发生错误。另一方面,执行条件需要较低的认知需求,因为解决涉及遵循特定强加策略的任务只需要受试者监控制定的计划实现目标66 的实施。另一方面,Porteus Maze 是心理学领域的一项知名任务,尤其是在认知心理学和神经心理学领域,它已被广泛用作评估认知各个方面的工具,例如解决问题和规划68,69。Porteus Maze 任务是一项纸笔任务,从简单的视觉刺激分析开始,难度越来越大。受试者必须找到并追踪从起点到出口(在几个选项中)的正确路径,同时遵循规则,例如避免交叉路径和死胡同,并尽快采取行动68。每次在绘制路径时出现分叉时,受试者都会做出决定以达到目标并避免违反给定的规则69。
考虑到常用任务和生态任务的局限性和优势,我们主要基于 Zoo Map Task66 和 Porteus Maze Task68 设计了我们的行为范式。行为范式由四个不同的阶段组成,包括日常生活场景中规划的认知过程。这些阶段如下: 第 1 阶段,规划,参与者的任务是创建一条路线以访问地图上的各个位置,确保遵守既定规则;第 2 阶段,维护,要求参与者将规划的路线保留在他们的工作记忆中;第 3 阶段,执行,参与者通过绘制并密切监控其准确性来执行他们之前计划的路线;和第 4 阶段,响应,参与者报告根据他们计划的路线54 访问的动物顺序。我们的范式能够使用不同阶段来测量规划能力的不同参数,这些阶段以更现实的方式反映了规划的各个组成部分(例如工作记忆、执行注意力和视觉空间技能),因为绘制路线在日常生活中很常见。此外,为了控制混杂因素,该范式包括一个具有规划任务结构和等效刺激的控制任务,它涉及同样参与规划的执行认知成分,但不包括规划过程成分。这允许分离计划过程组件,以比较电生理标志物和行为参数54。
此外,眼动追踪通过提供一种非侵入性方法来测量和分析眼球运动,为认知神经科学研究做出了重大贡献,这可以为感知、注意力和认知功能的认知过程和神经机制提供有价值的见解。使用眼动追踪系统测量不同类型的眼球运动可以提供有关规划中涉及的认知过程和神经机制的宝贵信息。例如,可以测量以下方面:注视,这是获得视觉信息的稳定凝视期70;扫视,这是用于将视线从一个位置转移到另一个位置的快速眼球运动71;Smooth Pursuit,这是一种让眼睛能够平稳地跟随移动物体的眼球运动72;微扫视,这是即使在注视期间也会发生的小而快速的眼球运动73;和眨眼,这是一种反射动作,有助于保持眼睛润滑并保护眼睛免受异物的侵害74。这些眼球运动可以深入了解视觉搜索、注意力分配70、视觉跟踪72、感知73和工作记忆74所涉及的认知过程,这些都是规划和认知控制的重要组成部分。
另一方面,最近对蓝斑-去甲肾上腺素 (LC-NE) 系统的研究表明其在认知控制中的相关作用75。蓝斑 (LC) 投射到多个大脑区域,例如大脑皮层、海马体、丘脑、中脑、脑干、小脑和脊髓 76,77,61。特别密集的 LC-NE 神经支配接收与认知控制相关的 PFC 脑区75。此外,一些研究表明,LC 系统的慢性多动可能会导致躁狂抑郁症的症状,例如冲动和失眠。相比之下,LC 功能的慢性下降与情绪表达减少有关,这是抑郁症患者的普遍特征78。蓝斑对刺激的过度反应可能导致患有压力或焦虑症的个体过度反应79。因此,LC-NE 系统的改变可能导致认知和/或情绪失调的症状。非侵入性技术可用于检查蓝斑活动,其中之一是瞳孔直径变化,这主要由蓝斑释放的去甲肾上腺素控制。去甲肾上腺素通过刺激 α-肾上腺素能受体作用于虹膜扩张肌和 Edinger-Westphal 核,后者向睫状神经节发送信号并通过激活突触后 α-2 肾上腺素能感受器来控制虹膜扩张 66,80,81,82。来自猴子的直接 LC 神经元记录证实了 LC-NE 活性、瞳孔直径和认知能力之间的关系83。在多项认知任务中,由于处理需求增强,已反复观察到瞳孔放大 71,84,85,86,87。
认知控制的电生理标志物与眼动追踪和瞳孔记录相结合,可能会解开关于认知控制和规划如何在大脑中实施的关键问题。使用我们的方案结合 EEG 和 Eye-tracker 系统的重要性是双重的。一方面,认知控制似乎需要分布式大脑活动参与精确的时间关系,这构成了研究大脑网络功能的理想候选者。另一方面,这些能力中的任何一个的异常都会对正常行为产生严重影响,就像各种认知和神经精神疾病一样,例如注意力缺陷/多动障碍88,89、重度抑郁症90,91、双相情感障碍91、精神分裂症92、额颞叶痴呆93,以及额叶病变引起的疾病94.此外,目前的协议允许使用瞳孔测量作为参数,以使用眼动追踪和脑电图比较 LC-NE 活性和振荡。这不仅可能为人类 LC-NE、瞳孔测量和神经标志物之间的理论关系提供证据,而且还可能允许在认知规划期间跟踪与 LC-NE 系统相关的特征的发展轨迹。然而,在我们的模型中,我们专注于测试在规划过程中是否存在可能导致特定振荡变化的特定眼跳模式95。此外,我们在行为范式的执行阶段使用眼动仪系统作为检查计划行为执行的重要组成部分。
总而言之,该协议可能会产生可测试的脑网络动力学模型,这些模型可以作为进一步的基础研究和最终的临床和治疗应用的平台。
研究方案
本协议中的所有程序均已获得智利天主教大学医学院生物伦理学委员会的批准,所有参与者在研究开始前签署了知情同意书(研究项目编号:16-251)。
1. 参与者招募
- 招募视力正常或矫正至正常视力的右撇子健康成年人(男性和女性),并根据纳入/排除标准对他们进行筛选。
注意:在这项研究中,招募了 27 名年龄在 19 岁至 38 岁之间且能流利说话的健康个体。样本量可以根据所需的统计功效水平而变化,年龄范围可能会根据要解决的具体研究问题而变化。在我们的协议中,我们通过考虑统计 Wilcoxon 符号秩检验、效应量 0.7、alpha 水平 0.05 和功效 0.95 来计算样本量,如 Faul 等人 96 所述。我们使用了由训练有素的心理学家应用的 MINI-International Neuropsychiatric Interview97 来评估参与者的纳入/排除标准。仅招募右撇子受试者以减少脑电图信号的可变性,因为左撇子个体可能呈现不同的脑电图活动地形分布 98,99,100。
2. 刺激准备
- 对于规划任务,使用矢量图形编辑器软件创建一组刺激物(参见 材料表)。对于每个刺激,设计一个代表动物园地图的灰度迷宫。在迷宫内,制作一个门户和几条通往动物位置的路径(例如,在这项研究中,有四个动物位置,见 图 1)。
注意:在这项研究中,我们创建了 36 个迷宫,其中每个刺激由一张带有起点门的动物园地图、位于迷宫上的四张动物图像和几条路径组成。迷宫上的路径可能会也可能不会通向动物的位置。使用对比度降低的灰度刺激通常是瞳孔测量的首选,因为它减少了对负责色觉的视网膜视锥细胞的刺激。刺激重点的这种转变允许对瞳孔大小的变化进行更敏感的测量,这些变化被认为反映了唤醒或注意力状态的变化。此外,由于个体之间色觉差异,灰度刺激的使用减少了测量的可变性101。 - 为了在最终任务中获得不同程度的复杂程度,根据既定的目标和规则(特别是,目标是规划一条访问动物位置的路径),根据有效解决方案的数量划分刺激。有效解决方案的数量是指可以按照规则规划的路径数量(参见 图 2 和步骤 5.12.1 中的规则)。将具有 5 种以上可能解决方案的刺激归类为 “简单”,将具有 5 种或更少可能解决方案的刺激归类为 “困难”。然后,为每个类别创建相同数量的试用。
注意:或者,向作者请求为 Domic-Siede 等人创建的刺激物 54 ,因为这些刺激物是按照这些说明创建的。请注意,所有材料均可应要求提供,但规格详见此处。在这项研究中,我们创建了 18 项简单的试验和 18 项困难的试验。评估行为和电生理水平的难度水平差异很重要,因为它将有助于确定您是在测量认知需求/认知努力/难度还是认知规划的内在方面(参见代表性结果和讨论部分)。 - 对于控制任务,使用与计划任务相同的结构(评估期、维护、执行、响应,见 图 2),并使用为计划任务创建的相同刺激,但添加一条绘制的线,代表一条标记路径,用于访问从大门到最后一个位置的动物位置序列(见 图 1B).使标记的路径的颜色比迷宫的主路径略深,使用照度计评估低对比度(请参阅步骤 2.4)。
注意:这背后的想法是保持两种情况(计划和控制任务)的心理物理特征尽可能相似。迷宫的追踪路径可以遵循规则,也可以不遵循规则(有关给参与者的说明的更多详细信息,请参阅协议的第 5 节)。在这项研究中,一半的刺激具有遵循规则的正确访问序列,而另一半则出现错误(例如两次使用相同的路径或穿过死胡同,参见步骤 5.12.1 和步骤 5.12.3 和 图 2)。 - 使用位于受试者将使用的下巴托中的照度计评估刺激的照度(参见步骤 4.5 和步骤 4.6),并与屏幕保持相同的距离。每个条件的每个刺激都会产生一个勒克斯值。手动记录每个值以供进一步分析。
注意:预计不同条件之间的照度没有差异(请参阅步骤 4.6)。否则,请检查刺激的对比度。如果要测量瞳孔直径102,则这是相关的。 - 使用矢量图形编辑器(参见 材料表)创建一个代表正确反馈的刺激(正确时竖起大拇指)和另一个代表错误反馈(不正确时竖起大拇指)的刺激(图 2)。

图 1:实验和控制任务的刺激。 显示了 (A) 计划和 (B) 控制任务刺激的说明性示例。刺激表示一个动物园地图,由一个门、不同位置的四个动物位置和几条路径组成。两种情况的刺激相似;唯一的区别是,对于控制任务,(B) 刺激有一条标记线表示已经存在的路径(此处为黑线以示说明)。真实控制刺激中的这条线略暗,低对比度由照度控制(参见步骤 2.4)。该图是从 Domic-Siede 等人 54 修改而来的。 请单击此处查看此图的较大版本。

图 2:实验设计。 (A) 规划任务试验。在这种情况下的试验从 3 s 固定十字开始。然后,指示参与者按照一组规则(最多 10 秒)规划一条路径以访问所有四个动物位置。接下来,出现了一个移位的注视十字架 (3 s),随后又出现了迷宫。在这个阶段(执行),受试者必须使用他们的眼球和在线视觉反馈(由眼动仪系统给出)来执行上一个计划期计划的轨迹,实时勾勒出他们的眼球运动(黑线)(最长 10 秒)。之后,在反应期内,受试者必须通过对访问的动物进行排序来报告执行过程中所做的顺序。根据他们的回答,反馈得到了。(B) 控制任务试验。在这种情况下的试验从 3 s 固定十字开始。然后,指示参与者评估追踪路径(暗线)是否遵循规则。接下来,出现了一个移位的注视十字架 (3 s),随后又出现了迷宫。在此期间,受试者必须通过在线视觉反馈重新绘制已经追踪的路径,就像在计划执行期间(最多 10 秒)一样。之后,在回复期内,受试者必须回答(是或否)被追踪的序列是否遵循先前规定的规则 根据他们的回答,提供反馈。该图是从 Domic-Siede 等人 54 修改而来的。 请单击此处查看此图的较大版本。
3. 规划与控制任务编程
- 使用刺激呈现/行为实验软件编写一个脚本,基于 Zoo Map Task66 和 Porteus Maze68编写规划任务范式编码(参见 材料表 和 补充文件)。
- 考虑两个条件(规划条件和控制条件)对任务进行编码,其结构与第 2 节和第 4 节中解释的结构相似(参见 图 2 和 补充文件)。
注意:在两种条件下使用相同的结构非常重要,以便控制解决任务需求过程中涉及的混杂因素和感知成分(图 2)。使用相同的结构可以改进对认知规划中涉及的特定认知过程的评估。 - 通过以太网和并行端口通信同步显示计算机、脑电图计算机和主机(眼动跟踪器计算机)之间的通信,从显示计算机发送晶体管-晶体管逻辑 (TTL) 脉冲(见图 3)。
- 编写一个代码,在规划和控制任务开始时以及每完成五次试验后使用眼动仪系统校准眼球运动,因为屏幕上的凝视位置对于执行期间至关重要(参见协议的步骤 3.2.3 和步骤 3.3.3,讨论部分和 补充文件中的代码)。
注意:计算机通信可能存在延迟。有几种方法可以测量两台不同计算机上 TTL 脉冲之间的延迟,但一种常见的方法是使用硬件设备,例如数字示波器或逻辑分析仪。另一种方法是使用基于软件的方法,例如通过网络连接发送 TTL 脉冲并使用网络分析工具来测量延迟。另一种方法是同步两台计算机的时钟,使用全球定位系统 (GPS) 或网络时间协议 (NTP) 服务器,或者使用基于硬件的同步解决方案,计算每个脉冲的时间戳和到达时间之间的延迟,并对结果进行平均以获得两台计算机之间的总体延迟。
- 考虑两个条件(规划条件和控制条件)对任务进行编码,其结构与第 2 节和第 4 节中解释的结构相似(参见 图 2 和 补充文件)。
- 为规划任务编写代码,结构如下:规划期、维护期、规划执行期、响应期和反馈 (图 2, 补充文件).
- 规划期: 通过将 3 s 的固定十字设置为基线来启动计划条件。
- 逐个随机呈现迷宫集(本研究中为 36 个)。
注意:在此计划期间,参与者被要求按照一组规则规划一条访问四个动物地点的路径,最长时间为 10 秒(这些规则之前已向他们解释过;请参阅协议的第 5 节以查看给出的规则,以及 图 2)。 - 在代码中包含一个 TTL 触发器,使用标签代码发出刺激呈现开始的信号,并将此触发器发送到脑电图计算机和眼动仪主机,以进行进一步的更窄和窗口化分析。
- 在代码中写下,每当受试者完成计划或超过最长时间时,一旦按下纵杆/键盘上的按钮,计划期就会达到高潮。反应时间 (RT) 必须记录在日志文件中,以便进一步分析。
注意:在此期间,我们使用了使用数字 1 的触发代码,但建议使用分层事件描述符 (HED) 标签而不是数字代码,因为 HED 标签为内容提供了含义和结构,从而使其他研究人员或合作者更容易理解数据的内容。 - 维护期: 使用放置 3 秒的移位注视十字开始此时期。将移位的注视十字定位在迷宫大门所在的空间位置,以预测动物园地图的起始位置(大门)(见 图 2)。
注意:此时间段的目的有三个。首先,移位的注视十字有助于执行代表下一个时期计划路径的轨迹(参见步骤 3.2.8)。其次,在此期间,参与者将计划期间制定的计划保存在他们的工作记忆中。最后,此期间用作 Trial 间隔,以界定规划期的结束和下一个期的开始 - 规划执行期。 - 规划执行周期: 在维护期间显示移位注视十字 3 秒后,再次呈现迷宫。
- 向脑电图和主机眼动追踪器计算机发送 TTL 触发器,以使用特定的标签代码指示此周期的开始。
- 编写一个代码,在该周期开始后大约 992 毫秒提供受试者注视位置的实时视觉反馈(一条黑线,参见 图 2 中的执行周期)。
注意:以延迟(大约 1,000 毫秒)开始描绘,让受试者有时间在迷宫中定位,允许他们用黑线描绘他们之前计划的路径(在规划期间)。 - 记录路径的坐标,以便进一步重建受试者所做的路径,并离线对性能进行评分(参见步骤 6.1.1, 图 4)。
- 确保最长 10 秒的时间来追踪计划的路径,并允许受试者通过按下按钮来完成此时间段。通过这种方式,主体可以控制他们何时完成绘制的路径。
- 将 RT 保存在日志文件中以供进一步分析。
- 回复期: 为响应期编写代码,该响应期在计划执行 10 秒后开始,或者在计划执行期结束时按下按钮时开始,其中迷宫消失,但动物及其空间位置仍在屏幕上。
- 在响应时段中,将四个空心圆圈水平放置在屏幕底部。
注意:此期间的目的是允许受试者按照他们使用纵杆或键盘访问动物的顺序将动物放入圆圈中,从而指示在计划执行期间访问动物的顺序。 - 配置程序/代码以允许受试者使用纵杆或键盘选择之前介绍的每只动物(本研究中的四只动物),并将它们插入四个圆圈中的每一个(参见 补充文件 和 图 2)。
- 反馈: 编写代码以向参与者提供 3 秒的反馈。如果遵守规则,则应显示竖起大拇指的图像以响应访问过的动物的有效组合,而如果报告的组合无效,则应显示竖起大拇指的图像。
- 使用特定的标签代码发送 TTL 触发器以获得正确的反馈,使用另一个标签代码来获得不正确的反馈,发送到 EEG 和 Eye-tracker 计算机。
注意:提供反馈的原因是为了便于监控绩效并在任务期间保持积极性。这种实时反馈的提供增强了奖励效果并鼓励适当的任务执行103。
- 为控制任务编写一个代码,其结构与规划条件相同:控制期、维护期、控制执行期、响应期和反馈(参见 补充文件, 图 2)。
- 控制期: 为控制条件期间编写代码以减轻混杂因素。此期间的代码必须以 3 秒的注视十字作为基线开始。
注意:由于计划任务主要要求实施计划,但也招募其他认知领域作为执行功能的一部分,例如视觉空间功能、工作记忆、注意力控制、抑制控制等66,88,104,105,控制任务对于减轻混杂因素至关重要。因此,这项任务的主要目标是要求解决规划任务所需的所有认知和感知功能,同时取消认知规划54 的实施。 - 逐个随机呈现控制条件的迷宫(已经追踪了标记路径的迷宫)。编码最大时间为 10 秒。
- 在代码中包含一个 TTL 触发器,使用标签发出刺激呈现开始的信号,并将此触发器发送到脑电图计算机和眼动仪主机。
- 在代码中写入,每当主题完成或超过最大时间时,按下纵杆/键盘上的按钮时,此控制周期达到高潮。
注意:受试者被指示评估标记的路径(无论他们是否遵循规则,有关给参与者的说明的详细信息,请参阅步骤 5.12)。 - 将反应时间 (RT) 保存在日志文件中以供进一步分析。
- 维护期: 一旦控制期结束,呈现一个移动的固定十字 3 秒。
- 作为规划执行期间,将注视十字放置在大门入口所在的位置,以方便下一时期的注视绘制。
- 控件执行周期: 再次呈现迷宫,同时向 EEG 发送 TTL 触发器,并托管眼动器计算机,并带有一个指示执行周期开始的标签。
- 重复与规划执行周期相同的代码,以提供凝视位置的在线反馈,并描绘和重叠他们的凝视与跟踪路径。
- 确保最长 10 秒的时间来追踪路径,并允许受试者通过按下按钮来完成此时间段。
- 将 RT 保存在日志文件中以供进一步分析。
- 控制响应时间: 控制执行期结束后,显示一个指示响应期的问号。
- 分别为受试者编程两个按钮,以使用纵杆或键盘给出响应。
注意:在这里,要求受试者通过选择一个按钮表示正确/是和另一个按钮表示错误/否来回答轨迹标记的序列是否正确。 - 将准确性保存在日志文件中。
- 反馈: 编写一个代码,当受试者回答正确时提供 3 秒的正确反馈(竖起大拇指的图像),当受试者回答不正确时提供 3 秒的错误反馈(竖起大拇指的图像)。
- 与规划条件一样,向脑电图和主机眼动仪计算机发送一个 TTL 触发器,其中包含一个用于正确反馈的标签和另一个用于错误反馈的标签。
- 控制期: 为控制条件期间编写代码以减轻混杂因素。此期间的代码必须以 3 秒的注视十字作为基线开始。
- 训练任务: 创建刺激,编写代码,并在上述规划和控制任务之前进行一次简短的培训课程,每种情况(规划和控制)大约六次试验/迷宫
注意:这个想法是确保熟悉任务设置。建议设置继续的标准。在这项研究中,如果最后三个试验是正确的,并且参与者报告在培训课程结束时理解了目标和程序,则参与者随后继续进行实验课程。
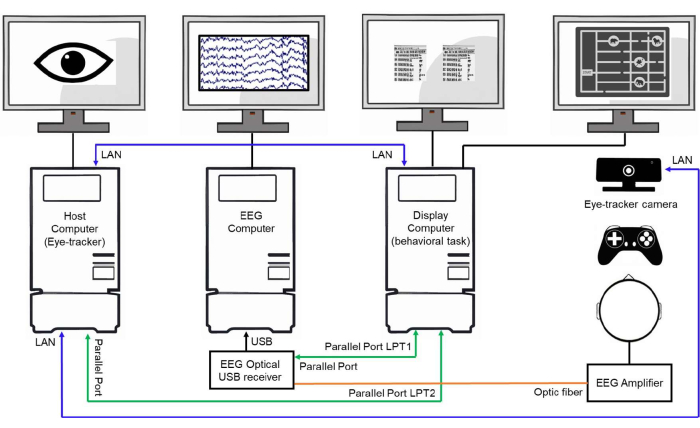
图 3:实验室设置示例。 实验室设置的示意图,显示三台互连的计算机。主机(眼动仪计算机)负责跟踪和存储眼动数据。EEG 计算机获取并存储 EEG 信号。显示计算机控制行为实验,将刺激呈现给受试者,并通过并行端口和 LAN 连接将事件触发器发送到主机和脑电图计算机,以同步数据收集。 请单击此处查看此图的较大版本。

图 4:根据眼动仪系统给出的视觉在线反馈进行路径重建。 从计划(A,紫色,计划执行期)和控制执行期(B,绿色线)的运动执行以及眼动仪数据进行路径重建的说明性示例。在规划执行周期中重建的路径用于评估每个规划任务 Trial 的准确性。 请单击此处查看此图的较大版本。
4. 实验室设置和设备
- 使用脑电图采集系统记录参与者头皮的脑电图活动,根据国际 10-20 系统106 放置脑电图电极。将两个电极放在参与者的乳突上,以便离线重新引用。在目视检查期间,使用眼电图电极识别垂直、水平和眨眼运动信号。
- 使用 EEG 采集软件进行 EEG 数据采集,采样率为 2,048 Hz 或 1,024 Hz,在 EEG 计算机中使用 0.1-100 Hz 之间的带通滤波器。
注:1,024 Hz 和 2,048 Hz 的采样率提供了足够的分辨率来分析低频振荡。在分析低频振荡时,重要的是要以高采样率(例如超过 1,000 Hz)获取 EEG 信号,以确保低频信号没有混叠。 - 使用显示计算机,该计算机 通过 并行端口和以太网与脑电图计算机和主机眼动追踪计算机连接,并在其上安装有运行行为实验的平台,将刺激投射到最小分辨率为 1,920 像素 x 1,080 像素和刷新率为 60 Hz 的扩展监视器上。将此监视器放置在距离对象约 82 厘米的地方。
注意:我们使用了一台 24 英寸显示器,刷新率设置为 144 Hz,距离参与者 82 厘米。建议使用屏幕尺寸至少为 19 英寸的显示器进行涉及记录 EEG 和眼球运动的认知实验。此外,一般建议将监护仪放置在一定距离,使参与者能够舒适地执行任务并保持在屏幕上的稳定注视,同时仍允许准确记录脑电图和眼球运动。建议根据需要测试和调整设置,以确保获得最佳结果。 - 使用眼动追踪系统为参与者提供执行期间眼球运动的实时反馈,并记录瞳孔大小。将采样率设置为 1,000 Hz,以获得足够的时间分辨率。
- 避免头部运动。需要限制左右和上下头部运动,以将眼睛保持在摄像机的视野内。需要前后移动限制,以将眼睛保持在摄像机的焦距范围内。使用前额/下巴托的组合,将运动保持在该范围内。
- 使用数字照度计或类似仪器评估刺激的亮度,以比较规划刺激和控制刺激之间的差异。
注意:统计检验(如 t 检验或 Wilcoxon)可用于评估两种情况的刺激之间的差异。 - 使用至少带有四个按钮的控制纵杆或键盘:两个按钮用于控制条件中的是/否问题;这两个按钮之一用于完成试验;另外两个按钮用于规划条件的响应时间向前或向后移动,以将动物插入屏幕底部的四个圆圈中。
5. 脑电图和眼动追踪记录会议
- 在开始研究之前,让参与者完成书面并签署知情同意书。
- 在录制之前,要求参与者不要化妆(睫毛膏和眼线笔可以被眼动仪系统检测到为瞳孔)、服用药物或咖啡因107,108,或如果他们感到严重疲劳109(压力、睡眠剥夺等)。
- 让参与者完成一项人口统计调查, 通过 由训练有素的心理学家应用的 MINI-International 神经精神病学访谈97 提供有关他们的性别、年龄、惯用手、母语和神经精神病学史的信息。
- 用酒精湿巾清洁受试者的前额、头皮、乳突和眼电图 (EOG) 皮肤位置。
- 将所有外部电极放在参与者身上。将水平 EOG 双极放在双眼的外眦上,将垂直 EOG 放在参与者右眼的上方和下方。将两个外部电极放在左右乳突上,以便以后重新引用。
- 测量受试者的头部,并根据扩展的国际 10-20 系统放置正确尺寸的脑电图帽。为此,请按照以下步骤找到并放置 Cz 电极:
- 通过目视检查发际线和鼻子顶部来确定头皮的中线。确定连接这两点的线以定义中线。
- 找到 Cz。Cz 通常定义为两个耳前点(即位于每只耳朵前面的点)之间的中点。找到这些点,然后确定连接它们的线以确定 Cz 的大致位置。
- 测量并标记 Cz。测量从鼻腔(即鼻子顶部的骨突起)到 Cz 的距离。在 10-20 系统中,从鼻孔到 Cz 的距离通常约为总头围的 53%。使用钢笔或其他标记工具标记 Cz 的位置。
注意:重要的是要遵循一致和标准化的电极放置程序,以最大限度地减少误差并确保 EEG 数据的有效性。建议制定标准放置程序。创建一个标准程序,将电极放置在每个受试者的头皮上,并确保对每个受试者使用相同的程序。如果有团队或工作人员进行记录,请培训技术人员或研究助理正确的放置程序,以确保他们始终如一地准确放置电极。此外,数字化每个对象的电极位置将是一种理想的方法,以便稍后进行源分析。在脑电图研究中,每个电极在受试者头部的精确三维 (3D) 位置通常是在脑电图数据与相应的大脑活动之间建立相关性的要求110。这些信息对于将 EEG 数据与 MRI 或 CT 成像技术得出的解剖图像正确对齐也至关重要111,112。
- 使用带有钝针的注射器将导电凝胶插入瓶盖的每个孔中,用尖端移开参与者的头发。之后,将所有头皮电极放在脑电图帽上。
- 使用脑电图记录软件检查阻抗,并确保它们低于脑电图系统推荐的电阻水平。
- 要求参与者在实验过程中尽可能保持静止。检查脑电图信号,并通过要求参与者眨眼、制作下巴并闭上眼睛保持几秒钟来测试它。
- 让参与者坐在黑暗且隔音的房间里。使用下巴托来稳定他们的头部并尽量减少运动,并检查下巴托和刺激呈现屏幕的中心之间是否有大约 82 厘米的距离。
- 将纵杆或键盘放在参与者前面以接收响应。
- 指示: 在开始每种情况(计划和控制)之前,使用视觉辅助工具给予口头指导。在说明中,包括刺激的视觉示例,并分别解释如何解决规划和控制条件中的迷宫。
- 对于规划任务,指示受试者找到一条路径,以任何顺序并遵循一组规则完成对迷宫不同位置的某些动物位置(本研究中的四个位置)的访问序列:“(1) 在最多 10 秒内尽快规划路径;(2) 从门户开始,在访问的第四只动物处结束路径;(3) 不要两次通过同一条路径或拐角;(4) 不要跨越死胡同;(5) 不要垂直穿过小路“54。
注意:对于规则 2 到规则 5,我们建议向参与者显示直观示例。 - 之后,开始六次试验的规划任务训练课程。
注意:指导被试者在每个眼动仪校准期之前报告执行任务时是否出现任何问题,尤其是在执行期间描绘路径时。记下是否有试验来检查离线/后处理(请参阅步骤 6.1.1)。 - 对于控制条件,指示受试者评估考虑到先前学习的规则,迷宫上已经标记的路径是正确还是错误地制作。
注意:给出示例并提供视觉支持,说明如何在不使用规划策略的情况下评估迷宫,例如在检测到错误时不尝试规划新路径(例如,绘制两次使用同一路径、穿越死胡同等)。发现错误时,重点应仅放在报告错误检测上,而不是更正路径。每次试验后,询问参与者他们实施的策略。然后,提供有关他们绩效的口头反馈,以确保他们评估了绘制的路径并避免规划新的路径。之后,开始六次试验的控制任务训练课程。
- 对于规划任务,指示受试者找到一条路径,以任何顺序并遵循一组规则完成对迷宫不同位置的某些动物位置(本研究中的四个位置)的访问序列:“(1) 在最多 10 秒内尽快规划路径;(2) 从门户开始,在访问的第四只动物处结束路径;(3) 不要两次通过同一条路径或拐角;(4) 不要跨越死胡同;(5) 不要垂直穿过小路“54。
- 检查 EEG 信号以确保所有通道都被正确采集。开始 EEG 记录。
- 校准眼动仪。
注意:验证眼动仪在被试者将视线定向到屏幕各个区域时确定注视位置的能力。- 告诉参与者,眼动仪将被校准,他们将看到一个白色圆圈(带有一个小灰点)随机移动到屏幕的四个角(五点校准程序)。指示他们将视线注视在圆圈上,并告诉他们,当圆圈移动到另一个位置时,他们应该跟随圆圈的位置,并再次将视线注视到该新位置。
- 运行实验,通过单击 输出/记录开始保存眼球运动,然后要求参与者按照之前给出的说明进行作,告诉他们实验现在将开始。
- 将实验室室置于黑暗环境中。瞳孔放大的最大变化发生在亮度变化113 中。在实验环境中保持一致的光照水平。
6. 数据分析
- 行为分析
- 使用统计软件分析行为数据(参见 材料表)。在规划和控制条件下,将准确性(准确响应的百分比)作为定量行为参数进行测量。对于规划条件,使用眼动仪数据(注视位置的 x 和 y 坐标)来重建离线执行期间所采用的路径,并确定与实际追踪路径相比规划路径的准确性(图 4)。为此,请手动检查在响应期间正确/错误地进行的组合与进行的跟踪之间的一致性。
- 计算 RT,即规划期解决迷宫所花费的平均时间以及控制期评估标记路径所用的平均时间。
- 计算计划和控制条件的执行期间的平均 RT。具体来说,仅使用与正确试验相对应的 RT。
注意:作为补充,可以使用 Domic-Siede 等人 54 中描述的线性综合速度-精度分数 (LISAS)114,115,它提供了一个考虑反应时间和准确性的组合测量。由于计划执行期间的反应时间和计划的准确性是相互关联的,因此 LISAS 可用于计算一个指数,该指数考虑了根据所犯错误的数量校正的反应时间。此外,LISAS 指数也可用于评估电生理信号与行为表现之间的相关性。它计算为反应时间 (RT) 和误差比例 (PE) 的线性组合。 - 使用统计检验(如 Levene 检验116,117)评估同方差性,并使用 D'Agostino 和 Pearson 综合正态性分布检验118 或 Shapiro Wilk 检验119 检验正态性,以选择合适的统计检验进行比较(参数或非参数)。
- 使用 Wilcoxon 符号秩检验120 或匹配对 t 检验121 来比较条件之间的行为参数,评估计划条件中的计划组件是否比控制条件中的认知要求更高。
注意:通过这种方式,验证行为范式是评估认知规划的最佳选择。 - 将计划条件中的试验分为“简单”和“困难”类别(请参阅步骤 2.2),然后使用匹配对 t 检验来比较“简单”和“困难”试验在计划和执行期间的准确性和反应时间。
- 脑电图和眼球运动预处理
- 使用自制脚本和/或已建立的工具箱执行以下几点中解释的脑电图数据预处理管道,例如 Delorme 和 Makeig122、Dimigen 等人 123 和 Mognon 等人 124 中描述的那些,在编程语言软件中(见 材料表)。
- 将眼球运动活动与 EEG 记录同步,以导入注视、扫视和眨眼事件,以便更好地进行目视检查或进一步分析(参见步骤 3.1.2 和 补充文件)。
注意:在这项研究中,我们使用了 Domic-Siede 等人 54 和 Dimigen 等人 123 中描述的眼动追踪数据上的时间戳和脑电图数据上的时间戳,将眼动事件导入到编程语言软件中的脑电图数据中。 - 如果数据以 2028 Hz 记录,则将数据下采样到 1024 Hz,以减少计算需求。
注:根据 4-8 Hz 的目标频率范围、预期的频率分辨率和分析的计算要求,1,024 Hz 的采样率就足够了。 - 将 EEG 信号重新参考乳突上电极的平均值。
注意:其他参考资料也是可能的。参考的选择会影响脑电图分析的结果和数据解释,因此仔细考虑不同参考选项的优缺点非常重要。平均乳突参考是脑电图研究的热门选择,因为它提供了一个易于计算的稳定参考,并且已被证明对分析许多不同的脑电图信号有效。将 EEG 数据与乳突的平均值(称为平均乳突参考)进行比较是分析头皮 EEG 数据中额叶 θ 活动的常用方法。乳突电极位于耳朵附近,为 EEG 信号提供参考。参考乳突的平均值有助于减少不感兴趣的噪声和伪影的影响,同时避免消除感兴趣的信号,这有助于用户获得更清晰的脑电图信号表示。 - 使用编程语言软件在扩展信号(无纪元)上应用高通截止频率为 1 Hz、低通截止频率为 40 Hz 的零相位有限脉冲响应 (FIR)。
注意:在这项研究中,我们使用了 Delorme 和 Makeig122 中描述的工具箱。 - 对于每个条件,考虑到试验次数,将数据分别划分为以计划期和控制期开始为中心的纪元。使用迷宫演示开始前 1 秒作为基线,使用计划或控制期后 4 秒作为感兴趣的部分。使用编程语言软件。
注意:在这项研究中,我们使用了 Delorme 和 Makeig122和 36 个时期/试验中描述的工具箱。 - 创建以规划和控制期结束为中心的第二个分段,使用结束前 4 秒和之后 1 秒作为维护期。
注意:选择计划和控制期的前 4 秒和后 4 秒(步骤 6.2.6 和步骤 6.2.7)的原因是,在这两种情况下,每个周期的持续时间都可能不同,分析计划的前几秒和最后一秒可以提供更全面的计划过程视图。因此,这些窗口长度足以分析规划背后的振荡动力学。 - 在分段信号上,运行 Logistic Infomax 独立组件分析 (ICA) 算法125以识别并删除伪影组件。
- 使用 Plöchl 等人 126中推荐的扫视注视方差比标准来自动检测潜在的噪声成分,并使用基于 Mognon 等人 124 中推荐的空间和时间特征的联合使用的自动脑电图伪像检测器。
注意:我们建议使用 Pion-Tonachini 等人 127 中提出的独立成分分类器,该分类器将独立成分分类估计为七个类别的成分向量,有助于识别伪影。 - 检查其他潜在的人为成分,例如 EMG、电极移动或非大脑相关成分。通过目视检查形貌、光谱和活化随时间的变化来验证这些组分的排斥情况。
- 通过使用峰度准则(以 z 分数 5 作为阈值)的自动通道抑制来插值(球形插值)噪声通道。
- 时频分析
- 使用 250 ms 的窗口长度和 5 ms 的时间步长执行短时快速傅里叶变换 (FFT)(1 Hz 至 40 Hz)。使用 Hanning 窗口。使用 z 分数将时频图表标准化为基线(−1 秒到 −0.1 秒)。
注意:光谱的可视化取决于窗口大小和时间分辨率之间的权衡。为了实现整个频谱的全面视图,包括 4 Hz 至 8 Hz 的 theta 范围,我们建议使用窗口大小的下限,即 250 ms,以确保在每次试验和任务期间具有更高的时间分辨率。此外,我们建议使用 Hanning 窗口,因为这被广泛认为是这些情况的常规选择。要获得更好的时间和频率分辨率,请参阅后续步骤。 - 从额中心电极(如 Fz)或平均的额晶电极组中选择一个时频图。
注意:考虑有关认知控制与额叶中线 θ 之间关联的广泛证据θ 12,128,129。 - 从 Pz 和 Oz 电极等电极中选择非正面控制时频图,以进一步进行比较。
- 对于正面电极和对照电极,对配对样品执行基于非参数聚类的排列检验, p 值< 0.05,用于两种条件下的时频图的组级比较。使用 Monte Carlo 方法进行 1,000 次随机抽签。使用集群的 maximum statistic 值执行排列测试130。
- 分别从规划和控制的前 4 秒和最后 4 秒分段平均 θ 频段 (4-8 Hz)。
- 使用匹配对 t 检验或 Wilcoxon 符号秩检验比较条件之间的平均 θ 活度。
- 分析 theta 活动的时间曲线。为此,按受试者对试验的频率范围为 4-8 Hz 进行平均。
- 使用 Wilcoxon 符号秩检验匹配与错误发现率 (FDR) 配对和校正,比较条件之间的 θ 活动动态。
注意:我们在 Wilcoxon 测试中使用了 88 毫秒步长的非重叠窗口。
- 使用 250 ms 的窗口长度和 5 ms 的时间步长执行短时快速傅里叶变换 (FFT)(1 Hz 至 40 Hz)。使用 Hanning 窗口。使用 z 分数将时频图表标准化为基线(−1 秒到 −0.1 秒)。
- 源重建
- 使用工具箱进行源分析重建,例如 Tadel et al.131 中描述的开放访问工具箱或其他类似工具箱。
- 使用标准化低分辨率脑电磁断层扫描 (sLORETA) 132和最小范数成像方法等算法,以及对称边界元方法(对称边界元),从 Gramfort 等人 133中描述的工具箱,从规划的前 4 秒计算预处理的脑电图信号的来源,以解决逆问题。
- 在解剖 MNI 模板上使用源算法(本研究中的 sLORETA 算法)(我们在 Brainstorm “Colin27”中使用了 MNI 模板),并为每个参与者提供默认电极位置,以防没有电极的 3D 数字化(参见步骤 5.6)。
注意:应该注意的是,使用默认电极位置并不是确定大脑活动来源的最有效方法。但是,它仍然可以提供对活动来源的一般理解。请务必记住,通过这些方法获得的定位源是粗略的近似值,在分析结果时应谨慎解释。 - 在预处理的信号上应用 4-8 Hz 带通滤波器。
- 使用试验开始前 −1,000 ms 至 −10 ms 的时间段作为基线,应用 z 分数归一化。
- 使用试验开始后 1 秒到 4 秒之间的感兴趣时间窗口平均 θ 活性。
- 使用非参数排列符号检验和 Monte Carlo 抽样(1,000 个随机化)131 比较条件之间的平均空间源。
- 为了确定感兴趣的区域 (ROIs),使用脑图谱标记皮层。
注意:我们使用了在 Tadel 等人 131 中描述的工具箱中实现的 Destrieux Atlas134。 - 选择感兴趣的大脑区域 (ROI)。
注:我们考虑了前额叶皮层区域的证据,例如双侧额上回 (SF)、双侧横额极回和沟 (FP)、双侧 ACC、双侧 MCC 和双侧背外侧前额叶皮层137,138,参与认知控制功能135,136。 - 对每个 ROI 的先前预处理的 EEG 信号(1-40 Hz 范围)执行主成分分析 (PCA),并为每个 ROI 采用 PCA 分解的第一种模式。
- 使用短时快速傅里叶变换执行光谱分析,并使用非参数、基于聚类的排列测试130 比较左右感兴趣区域之间的结果。
- 提取并表示左侧和右侧 ROI,显示为一个双边时间序列:SF、ACC 和 MCC。然后,绘制时频图,并在条件之间进行比较。
- 根据每个 ROI 的规划任务(简单与困难试验)的复杂程度比较时频图表。
- 镜像 512 个样本中每个样本的信号边缘,并对选定的 ROI 执行 4 Hz 和 8 Hz 之间的带通滤波器。
- 应用希尔伯特变换,使用编程语言软件中的信号处理工具箱获得瞬时振幅139(参见 材料表)。
- 使用 z 分数归一化(-1,000 至 -10 毫秒作为基线)校正信号,并按受试者在试验中取平均值。
- 使用 Wilcoxon 符号秩检验(匹配对,1 s 的非重叠窗口)比较条件之间的每个 ROI θ 频带时间曲线,并使用 FDR 进行校正。
- 脑电活动与行为表现之间的相关性
- 使用 z 分数将 ROI 的源时间序列标准化为基准。选择计划或控制开始后 1 秒到 4 秒的窗口(在时频图中观察到突出的 θ 活动)。
- 要确定与控制条件相比,规划条件下 θ 活度的增加,首先通过工具箱(如 Chronux 工具箱140 )将信号转换为频域 (1-40 Hz),用于感兴趣区域中的每个条件和源。
- 计算 θ 波段的平均频率 (4-8 Hz),并计算 θ 功率的两个测量值:i) 规划期(θ 规划)和控制期(θ 控制)期间的 θ 功率之间的差异,表示为 Δ theta,以及 ii) θ 活性的相对增加,表示为 Δ theta (Δ θ) 与控制期(θ 控制)期间的 θ 活性之比, 如 Domic-Siede 等人 54:
 (1)
(1)

- 计算两个行为参数:iii) Δ LISAS 规划,通过从 LISAS 规划中减去 LISAS 控制,以及 iv) Δ LISAS 规划执行,从 LISAS 规划执行中减去 LISAS 控制执行,如 Domic-Siede 等人54:


- 使用计算的电生理学和行为参数执行 Spearman 的 rho 相关性,然后通过 FDR 进行校正。
- 眼球运动分析: 要控制可能导致不同振荡动态的每种情况下眼球运动的潜在差异,请执行以下分析:
- 从整个试验中以及规划和控制条件下从 0 秒到 3.75 秒确定扫视幅度和扫视峰值速度。
- 使用 Wilcoxon 符号秩检验或匹配对 t 检验(以合适者为准)比较结果。
注意:像 Dimigen et al.123中描述的工具箱可能会有所帮助。 - 计算和评估一个额叶电极(例如,Fz 或平均额叶 ROI 电极)的傅里叶脑电图功率与 Sato 和 Yamaguchi141 中描述的扫视率之间的相干性。
- 使用 Wilcoxon 符号秩检验比较两个条件之间每个试验前 4 秒的相干功率-扫视率值。
结果
在本方案中,将计划期的 RT 与控制期和计划执行期的 RT 进行了比较。计划期间的 RT 大于对照组和计划执行期的 RT。此外,与对照组相比,参与者在计划期间犯的错误更多,准确性较低(图 5)。

图 5:规划任务的反应时间和准确性。 使用匹配配对 t 检验比较计划期(紫色圆圈)和控制期(绿色圆圈)中的 (A) 反应时间。(B) 使用匹配配对 t 检验比较计划期间(紫色圆圈)和计划执行期间(紫色方块)中的反应时间。(C) 使用 Wilcoxon 符号秩检验比较规划条件(紫色菱形)和控制条件(绿色菱形)中的准确率。该图是从 Domic-Siede 等人 54 修改而来的。 请单击此处查看此图的较大版本。
此外,对规划复杂度的分析表明,在规划和执行过程中,“困难”和“简单”级别在准确性和反应时间 (RT) 方面存在显著差异(图 6)。“困难”级别具有较长的 RT 和较低的准确性。这些发现表明,根据有效解决方案的数量划分试验可以区分“简单”和“困难”试验。

图 6:不同复杂度级别的行为表现比较。 使用匹配对 t 检验确定 “easy” 和 “difficult” 复杂度级别的行为表现存在显著差异。与“困难”相比,“简单”级别在计划和执行过程中的反应时间 (RT) 较低,而“简单”级别的准确性更高。误差线表示 SEM (平均值的标准误差)。该图是从 Domic-Siede 等人 54 修改而来的。 请单击此处查看此图的较大版本。
这些结果表明,当规划组件成功地从控制条件中移除(通过 指令作)时,规划任务在认知上更加复杂、要求更高、更具挑战性和耗时。因此,任务引起的神经相关性可以相互比较。
为了分析规划期间的额叶中线 θ 活动,将 Fz 电极规划期间的平均 θ 频带与控制期的平均 θ 频带进行了比较,并在规划期间发现 θ 频带频率显着增加(图 7)。

图 7:认知规划期间的额叶中线 θ 活动。 (A) 地形图,表示在规划任务(左)、控制任务(中)和规划效应(右)期间归一化为 z 分数的所有受试者的 θ 带功率。在认知规划过程中,受试者表现出额叶中线 θ 活动的增加。颜色条显示介于 −0.5 和 1.5 之间的 z 值。(B) 小提琴图,显示计划期间(紫色)与电极 Fz(左)、Pz(中)和 Oz(右)的控制期(绿色)相比,使用匹配对 t 检验。该图是从 Domic-Siede 等人 54 修改而来的。 请单击此处查看此图的较大版本。
此外,为了评估观察到的额叶 θ 活动的时间动态,制定了对应于 θ 波段功率特定时间点(750 毫秒、1,750 毫秒、2,750 毫秒和 3,750 毫秒)的地形图(图 8A)。此外,与对照期相比,时频分析表明,在计划期开始后 1 秒开始,θ 活性显着、渐进和持续增加(图 8B)。

图 8:额中线 theta 时间动力学。 (A) θ 活动的地形时间片。在计划实施 (计划期) 期间观察到额叶中线 θ 活性随着时间的推移逐渐增加。颜色条指示 z 分数单位(−0.5 到 2.2)。(B) 计划期(上)、控制期(中)和计划效果的时频图,计算方法是从计划期(下)中减去控制期。使用配对样本的基于非参数聚类的排列检验确定的非有效像素在计划效应图中显示得更亮。颜色条指示 z 分数单位(−4 到 4)。该图是从 Domic-Siede 等人 54 修改而来的。 请单击此处查看此图的较大版本。
为了重建 θ 活动的源,将大脑模型模板可视化并在条件之间进行比较,这表明 θ 活动起源于前额叶皮层区域(额上皮层,FS;前扣带皮层,ACC;和中扣带皮层,MCC),以及条件之间存在显着差异(在双侧 SF, 双侧 ACC 和双侧 MCC)(图 9),在计划期内观察到更高的 θ 活性(图 9)。

图 9:源重建。 使用 sLORETA 算法来估计来自不同大脑来源的 θ 活动。θ 活性过滤 4-8 Hz 带通,z 评分归一化,由基线校正,分别在计划或控制开始后 1 s 或 4 s 之间平均,并在条件之间进行比较。在双侧额上区、双侧前扣带回皮层和双侧中扣带回皮层发现 θ 活性显着增加。该图显示了置换检验中显著的 t 值。缩写: FS = 额上;ACC = 前扣带皮层;MCC = 中扣带皮层。该图是从 Domic-Siede 等人 54 修改而来的。 请单击此处查看此图的较大版本。
之后,通过计算希尔伯特变换来评估每个源的 theta 随时间变化的时间分布,然后我们比较了两种条件之间 theta 活动的瞬时振幅。我们发现,左额极、双侧 ACC 和双侧 MCC 来源在计划期开始后表现出更高的 θ 活性(图 10)。这些结果表明,我们要求认知规划的实验范式诱导了起源于 PFC 区域的 θ 活动。

图 10:PFC 源的 Theta 活动时间曲线。 使用 Hilbert 变换计算的瞬时振幅应用于每个额叶源的 PCA 分解的第一个分量,并将条件和基线标准化为 z 分数,以显示额叶 θ 活动随时间的变化。灰色阴影区域显示使用非重叠移动窗口确定的显著差异,其步长为 1 s(Wilcoxon 符号秩检验),由 FDR 校正。阴影区域表示 95% 置信区间。左侧 FP 区、双侧 ACC 和双侧 MCC 在计划发病后显示 θ 活性增加。缩写: ACC = 前扣带皮层;MCC = 中扣带皮层。规划条件以紫色显示。控制条件以红色显示。该图是从 Domic-Siede 等人 54 修改而来的。 请单击此处查看此图的较大版本。
此外,我们旨在检查规划过程中频谱特征相对于复杂性水平的变化,如行为结果所示。值得注意的是,仅在 alpha 波段内的左侧 ACC 中发现了显著差异。这支持了这样一种观点,即我们的规划任务通过 θ 振荡的变化来评估规划的内在方面,其程度比认知控制任务中通常遇到的一般认知需求(努力)更大(图 11)。

图 11:跨规划复杂度级别的 EEG。 ROI 时频图显示,仅在左前扣带皮层 (ACC) 的 α 波段中有一个显着的正簇,用于 “困难 ”水平。使用配对样本的基于非参数聚类的排列检验确定的非有效像素在图上以较浅的阴影显示,颜色条表示从 -3 到 3 的 z 分数单位。该图是从 Domic-Siede 等人 54 修改而来的。 请单击此处查看此图的较大版本。
当执行 θ 活动和行为表现之间的相关性时,观察到负相关;具体来说,随着计划期间左额极区域的 θ 活动增加,LISAS 计划执行分数下降(图 12)。这种模式可能反映出在规划制定过程中,左侧 FP 区域可能是必要的,以便之后成功执行计划,并表明 θ 活动的作用。

图 12:θ 活性和行为表现。 来自左侧额极皮层的 theta 活动与 Δ LISAS 计划执行之间的 Spearman rho 相关性显示出显著的负相关。该图是从 Domic-Siede 等人 54 修改而来的。 请单击此处查看此图的较大版本。
此外,每种情况引起的不同认知需求和目标可能导致计划条件和控制条件之间截然不同的眼球运动,从而导致不同的振荡活动模式95。为了解决上述问题,我们分析了各个层面的单受试者、单试验数据。值得注意的是,Fz 通道时间序列和 θ 活动时间动态似乎与扫视率随时间变化无关(图 13A)。

图 13:脑电图和眼球运动记录的结果。 (A) 各行表示计划条件下的脑电图(上)、时频图(中上)、电极 Fz 的 θ 时间曲线(中下)以及受试者 8 和试验 9(下)的扫视率。(B) 显示了条件之间扫视幅度、扫视峰值速度和功率扫视率相干性的 Wilcoxon 符号秩检验比较,揭示了规划和控制条件之间扫视幅度的显着统计差异。SEM 由误差线表示。该图是从 Domic-Siede 等人 54 修改而来的。 请单击此处查看此图的较大版本。
接下来,我们从整个试验中获得扫视幅度和峰值速度,并从 0 秒到 3.75 秒进行比较(图 13B)。我们发现在控制条件下扫视幅度更大。然而,在电极 Fz 处的傅里叶 θ 功率与扫视率之间的相干指数中,没有发现条件之间有统计学上的显着差异(图 10B),表明扫视和 θ 活性之间的任何潜在关系在不同的条件下都是一致的。
综上所述,这些结果支持所描述的实验方案适用于将认知规划作为认知控制功能进行研究。
讨论
此处描述的协议提供了一种创新方法,用于在新颖的生态规划任务期间评估认知规划和认知控制,并与相关和互补的行为和生理测量(例如振荡和瞳孔动力学)相关联。在我们的实验中,参与者在执行计划任务时记录了脑电图活动,其中指示参与者首先详细说明,然后执行计划。控制条件涉及评估动物园地图上预先绘制的路径,旨在消除认知规划方面,同时保持相似的设置和结构。这种方法能够评估认知规划作为一种认知控制功能,是否导致 PFC 区域产生额叶 θ 活动,以及不同的 PFC θ 振荡来源是否与规划表现的不同方面有关。可以使用该协议评估的另一个方面是计划阶段涉及的各种认知过程的差异化,例如计划制定、计划执行、计划实现和反馈处理。我们发现,计划诱导了与认知控制相关的经典额叶 θ 活动,这有助于有效地实现目标。这些结果支持了该协议的兴趣。
尽管认知神经科学取得了长足的发展,但大多数神经影像学实验在感觉运动被剥夺的环境中使用人工任务和过度简化的刺激来控制混杂物,从而检查孤立的认知功能。有问题的是,这些实验可能无法确定在日常情况下(在生态情况下)实现认知功能时所涉及的真正大脑机制138,140。特别是,制定目标、计划和有效执行计划的能力很难评估,因为它们需要各种认知功能(工作记忆、抑制控制、认知灵活性等)。104,144.因此,根据认知神经科学的当前趋势 142,143,145,146 鼓励和建议设计生态行为任务。
尽管我们的规划任务是在实验室环境中进行的(在房间里,刺激物显示在屏幕上),但通过使用有意义的刺激物和目标,他们可以在屏幕上与之互动,从而使参与者具有吸引力和互动性。此外,该任务要求参与者参与现实生活中的情况——规划访问不同地点的路径。要有一个生态任务设计,范式必须挑战被试者以类似于他们在日常生活中必须做的方式执行特定的行为或认知功能 62,63,147。为了开发生态任务设计,这里使用的规划任务涉及规划一条路径,分几个阶段访问不同的地方56。第一阶段涉及参与者创建计划,同时确保其遵循一组规则。第二阶段涉及在工作内存中维护计划,而第三阶段涉及执行计划并监控其对规则的遵守情况。这些阶段代表了计划和其他执行功能编排的不同阶段,例如认知灵活性、抑制控制和工作记忆。为了有一个有效的生态认知任务设计,该任务应该能够检测出在日常生活中难以执行特定认知功能的精神或认知障碍患者的特定认知障碍105。这可以通过使用此协议的未来研究来实现。
通过使用该协议获得的行为结果与实验预测一致。当从控制任务中删除规划组件以形成控制条件时,观察到行为的显着差异,从而促进进一步的比较。发现计划条件在认知上比控制条件更苛刻,反应时间和准确性等参数证明了这一点。这可能反映了高认知功能在规划实施中的参与度增加 23,55,56,57,148,149,150。
考虑到控制条件涉及的认知复杂性较低,更快的反应时间、更好的表现和所需的不同认知过程(规则的评估)证明了这一点,一种可能的替代修改是利用规划任务中存在的复杂度级别,纵它们,并根据不同的复杂度级别参数化地分析规划功能(例如, 增加试验次数,并创造困难、中等和简单的试验条件)。然而,我们方案的结果表明,虽然可以根据行为测量区分 “简单 ” 和 “困难 ”试验,但在电生理测量中没有检测到差异。这表明我们协议中的结果更准确地反映了规划功能的内在特征,而不是认知控制的更广泛方面,例如注意力、脑力劳动、难度级别或高水平的认知需求54。尽管如此,进一步的研究可能会考虑其他类型的控制条件,例如沿着访问四个动物位置的标记路径,但也要记住序列顺序。这样,可以更好地控制难度级别,并且可以将计划与工作记忆区分开来,但这样做的一个可能的缺点是疲劳,因为受试者将不得不执行两项要求很高的任务。
几项研究将不同的眼球运动参数与特定的认知事件联系起来。一方面,某些研究发现,在认知任务中,θ 振荡与瞳孔直径之间存在相关性,这表明这两种认知功能指标之间存在关系。例如,Lin 等人152 发现额中 θ 活动与瞳孔大小的变化之间存在相关性,反映了不同程度的主观冲突。他们的研究结果表明,这些信号代表了冲突处理、注意力增加和灵活的行为反应。因此,中额叶 θ 活动与瞳孔反应之间的关系似乎在决策过程中权衡成本和收益方面发挥作用。在另一项研究中,Yu 等人153 研究了任务时间参与如何通过调节控制抑制反应的工作记忆任务在神经生理学上影响认知控制。他们研究了瞳孔直径数据与额叶 theta 活动之间的关系,结果表明,随着任务持续时间的增加,表现会下降,这伴随着瞳孔扩张调节和额叶 theta 活动的减少。在任务开始时,他们发现任务参与、θ 活动和认知控制之间存在很强的相关性,如瞳孔扩张调制所示,主要用于需要高工作记忆和抑制控制的苛刻任务。然而,这种关系在结束时消散了,标志着投入的努力与用于执行任务的认知控制之间的脱节,这是前额叶任务时间效应的标志153。另一方面,其他研究调查了扫视和振荡。例如,Nakatani 等人 154 揭示了,在感知任务中,来自枕部区域的 α 波段振幅预测了眨眼和扫视效应。此外,Velasques 等人 155 表明,在扫视注意力任务中,扫视振幅与额叶 γ 变化有关。此外,Bodala 等人156 发现额叶中线 θ 的降低伴随着持续注意力的降低,以及扫视的幅度和速度的降低。这些发现表明,眼球运动,尤其是扫视,可能反映了认知过程,而不仅仅是导致脑电图信号中的背景噪声。在目前的研究中,我们使用 ICA 算法和扫视-注视方差比标准126 增强了与眼球运动相关的伪影的消除。该标准增强了免费观看任务157 的伪影去除。在我们的研究中,在不同条件下的扫视峰值速度以及 theta 功率和扫视率之间的相干性没有观察到差异。然而,需要更多的研究来解决这些问题。
使用该协议的一个关键步骤是在实验过程中不断校准眼动仪,因为相机的注视数据丢失可能会导致错误,从而污染任务并难以获得准确的响应。因此,尽可能频繁地校准至关重要。然而,使用校准眼动仪的试验数量和实验时间长度之间存在权衡。在我们的研究中,我们决定每 5 次试验校准一次。
在此规划任务期间,应进行进一步的研究,探索 θ 振荡与瞳孔直径之间的关系。规划是执行控制的一个关键方面,需要分配注意力资源和协调多个认知过程。在规划任务中了解 θ 振荡与瞳孔直径之间的关系可以为执行控制的潜在神经机制以及它们如何随时间变化提供有价值的见解。此外,此类研究可以更深入地了解认知功能的变化,例如疲劳或注意力丧失,如何影响规划任务的表现和有效分配资源的能力。这些信息可能对制定旨在提高规划绩效的干预措施具有重要意义,例如认知训练计划或针对注意力缺陷/多动障碍 (ADHD) 等疾病的治疗。
先前的研究表明,PFC 在认知规划中起着至关重要的作用,我们的结果证实了这一点。这些结果表明,认知规划在 PFC 中诱导 FMθ 活动,特别是在前扣带皮层、中扣带皮层和额上区54。这些发现与先前关于执行功能的研究一致。有大量证据支持这样的观点,即 FMθ 活动是一个自上而下的过程,在要求苛刻的任务中启动控制和促进大脑区域之间的交流13。虽然只有少数研究检查了与认知控制相关的 FMθ 活动的时间动态,但人们普遍认为 FMθ 的时间曲线可以提供有关认知控制各个方面和不同 PFC 区域参与的信息。使用我们的协议来评估认知计划使我们能够描述计划期间 FMθ 活动的时间概况。具体来说,规划条件下的 FMθ 活动呈逐渐增加。通过实施该协议,首次证明 FMθ 也存在于规划实施过程中,就像在其他高阶认知功能中一样,其时间动态可以作为认知控制的指标。
我们的结果和方案在神经科学领域具有潜在应用,包括改进虚拟神经心理学评估和治疗具有相关认知规划问题的神经精神疾病,例如抑郁症和注意力缺陷/多动障碍。例如,评估可能涉及检查行为表现水平的不同错误模式、电生理水平的不同振荡模式以及不同的眼球运动。此外,这项工作的结果可能为旨在提高认知规划能力的脑机接口和认知训练程序的开发提供信息。
本方案可能有助于理解支撑神经典型和神经精神病人群中认知规划难以捉摸的认知控制功能的神经机制。此外,我们的行为范式可能会通过检查电生理学、瞳孔测量学和行为测量以及实际规划任务来提供对认知控制和规划神经生物学的见解,该任务检查规划的内在方面,而不是认知控制任务中通常存在的一般认知需求,如θ振荡的变化所反映的那样。
披露声明
作者没有什么可披露的。
致谢
这项研究得到了 ANID 21150295 博士奖学金计划 Becas de Doctorado Nacional año 2015、FONDECYT 常规助学金1180932、 FONDECYT 常规助学金1230383、FONDECYT de Iniciación 助学金11220009、博士后助学金 Universidad de O'Higgins 和法兰西大学研究所 (IUF) 的财政支持。我们要感谢 Pablo Billeke 教授对范式设计的反馈。我们感谢 Eugenio Rodríguez 教授慷慨地分享他的时频分析代码。最后,我们感谢 Milan Domic、Vicente Medel、Josefina Ihnen、Andrea Sánchez、Gonzalo Boncompte、Catalina Fabar 和 Daniela Santander 的反馈。
材料
| Name | Company | Catalog Number | Comments |
| EEG System | Biosemi | ActiveTwo Base system, 64 channels | |
| Eye-tracker System | Eyelink SR Research | EyeLink 1000 Plus Core Unit, High-speed camera, Host PC/Monitor, | |
| CPU display | Intel | Hard drive 221 GB, Processor Intel Core i7-4790 3.60 Hz, OS Windows 7, 4GB RAM | |
| CPU EEG | Intel | Hard drive 223 GB, Processor Intel Core i7-4790 3.60 Hz, OS Windows 7, 4GB RAM | |
| Monitor | ASUS | ASUS VG248QE 24" LCD monitor | |
| Joytsick | Logitech | Model F310 | |
| Luxmeter | Focket | LCD screen (0-200.000 lux) model Liebe WH LX1330B | |
| Statistics software | GraphPad Prism | GraphPad Prism version 8 for Windows | |
| MATLAB Programming Software | The MathWorks | MATLAB R2014a and R2018b | |
| SVG tool Inkscape | Inkscape Project | vector graphic editor software | |
| Presentation Software | Neurobehavioral Systems | stimulus delivery and experiment control program for neuroscience |
参考文献
- Siegel, M., Donner, T. H., Engel, A. K. Spectral fingerprints of large-scale neuronal interactions. Nature Reviews Neuroscience. 13 (2), 121-134 (2012).
- Fries, P. A mechanism for cognitive dynamics: Neuronal communication through neuronal coherence. Trends in Cognitive Sciences. 9 (10), 474-480 (2005).
- Fries, P. Rhythms for cognition: Communication through coherence. Neuron. 88 (1), 220-235 (2015).
- Thut, G., Miniussi, C., Gross, J. The functional importance of rhythmic activity in the brain. Current Biology. 22 (16), 658-663 (2012).
- Fröhlich, F., McCormick, D. A. Endogenous electric fields may guide neocortical network activity. Neuron. 67 (1), 129-143 (2010).
- Spaak, E., de Lange, F. P., Jensen, O. Local entrainment of alpha oscillations by visual stimuli causes cyclic modulation of perception. Journal of Neuroscience. 34 (10), 3536-3544 (2014).
- Fiebelkorn, I. C., Saalmann, Y. B., Kastner, S. Rhythmic sampling within and between objects despite sustained attention at a cued location. Current Biology. 23 (24), 2553-2558 (2013).
- Landau, A. N., Fries, P. Attention samples stimuli rhythmically. Current Biology. 22 (11), 1000-1004 (2012).
- Song, K., Meng, M., Lin, C., Zhou, K., Luo, H. Behavioral oscillations in attention: Rhythmic α pulses mediated through θ band. Journal of Neuroscience. 34 (14), 4837-4844 (2014).
- Wyart, V., Nobre, A. C., Summerfield, C. Dissociable prior influences of signal probability and relevance on visual contrast sensitivity. Proceedings of the National Academy of Sciences of the United States of America. 109 (9), 3593-3598 (2012).
- Leszczyński, M., Fell, J., Axmacher, N. Rhythmic working memory activation in the human hippocampus. Cell Reports. 13 (6), 1272-1282 (2015).
- Onton, J., Delorme, A., Makeig, S. Frontal midline EEG dynamics during working memory. NeuroImage. 27 (2), 341-356 (2005).
- Cavanagh, J. F., Frank, M. J. Frontal theta as a mechanism for cognitive control. Trends in Cognitive Sciences. 18 (8), 414-421 (2014).
- Siegel, M., Buschman, T. J., Miller, E. K. Cortical information flow during flexible sensorimotor decisions. Science. 348 (6241), 1352-1355 (2015).
- Weisz, N., et al. Prestimulus oscillatory power and connectivity patterns predispose conscious somatosensory perception. Proceedings of the National Academy of Sciences of the United States of America. 111 (4), 417-425 (2014).
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Cohen, M. X. A neural microcircuit for cognitive conflict detection and signaling. Trends in Neurosciences. 37 (9), 480-490 (2014).
- Yuste, R. From the neuron doctrine to neural networks. Nature Reviews Neuroscience. 16 (8), 487-497 (2015).
- Helfrich, R. F., Knight, R. T. Oscillatory dynamics of prefrontal cognitive control. Trends in Cognitive Sciences. 20 (12), 916-930 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annual Review of Neurosciences. 24 (1), 167-202 (2001).
- von Nicolai, C., et al. Corticostriatal coordination through coherent phase-amplitude coupling. Journal of Neuroscience. 34 (17), 5938-5948 (2014).
- Sweeney-Reed, C. M., et al. Thalamic theta phase alignment predicts human memory formation and anterior thalamic cross-frequency coupling. ELife. 4, 07578 (2015).
- Voytek, B., et al. Oscillatory dynamics coordinating human frontal networks in support of goal maintenance. Nature Neuroscience. 18 (9), 1318-1324 (2015).
- Raghavachari, S., et al. Theta oscillations in human cortex during a working-memory task: Evidence for local generators. Journal of Neurophysiology. 95 (3), 1630-1638 (2006).
- Jacobs, J., Hwang, G., Curran, T., Kahana, M. J. EEG oscillations and recognition memory: Theta correlates of memory retrieval and decision making. NeuroImage. 32 (2), 978-987 (2006).
- Itthipuripat, S., Wessel, J. R., Aron, A. R. Frontal theta is a signature of successful working memory manipulation. Experimental Brain Research. 224 (2), 255-262 (2013).
- Cavanagh, J. F., Zambrano-Vazquez, L., Allen, J. J. B. Theta lingua franca: A common mid-frontal substrate for action monitoring processes. Psychophysiology. 49 (2), 220-238 (2012).
- Mas-Herrero, E., Marco-Pallarés, J. Frontal theta oscillatory activity is a common mechanism for the computation of unexpected outcomes and learning rate. Journal of Cognitive Neuroscience. 26 (3), 447-458 (2014).
- Folstein, J. R., Van Petten, C. Influence of cognitive control and mismatch on the N2 component of the ERP: A review. Psychophysiology. 45 (1), 152-170 (2008).
- Cohen, M. X., Donner, T. H. Midfrontal conflict-related theta-band power reflects neural oscillations that predict behavior. Journal of Neurophysiology. 110 (12), 2752-2263 (2013).
- Walsh, M. M., Anderson, J. R. Modulation of the feedback-related negativity by instruction and experience. Proceedings of the National Academy of Sciences of the United States of America. 108 (47), 19048-19053 (2011).
- Luu, P., Tucker, D. M., Makeig, S. Frontal midline theta and the error-related negativity: Neurophysiological mechanisms of action regulation. Clinical Neurophysiology. 115 (8), 1821-1835 (2004).
- Hanslmayr, S., et al. The electrophysiological dynamics of interference during the Stroop task. Journal of Cognitive Neuroscience. 20 (2), 215-225 (2008).
- Cavanagh, J. F., Cohen, M. X., Allen, J. J. B. Prelude to and resolution of an error: EEG phase synchrony reveals cognitive control dynamics during action monitoring. Journal of Neuroscience. 29 (1), 98-105 (2009).
- Cohen, M. X., van Gaal, S., Ridderinkhof, K. R., Lamme, V. A. F. Unconscious errors enhance prefrontal-occipital oscillatory synchrony. Frontiers in Human Neuroscience. 3, 54 (2009).
- Cavanagh, J. F., Frank, M. J., Klein, T. J., Allen, J. J. B. Frontal theta links prediction errors to behavioral adaptation in reinforcement learning. NeuroImage. 49 (4), 3198-3209 (2010).
- Cohen, M. X., Cavanagh, J. F. Single-trial regression elucidates the role of prefrontal theta oscillations in response conflict. Frontiers in Psychology. 2, 30 (2011).
- Cohen, M. X., Van Gaal, S. Dynamic interactions between large-scale brain networks predict behavioral adaptation after perceptual errors. Cerebral Cortex. 23 (5), 1061-1072 (2013).
- Nigbur, R., Cohen, M. X., Ridderinkhof, K. R., Stürmer, B. Theta dynamics reveal domain-specific control over stimulus and response conflict. Journal of Cognitive Neuroscience. 24 (5), 1264-1274 (2012).
- van Driel, J., Swart, J. C., Egner, T., Ridderinkhof, K. R., Cohen, M. X. No) time for control: Frontal theta dynamics reveal the cost of temporally guided conflict anticipation. Cognitive, Affective, and Behavioral Neuroscience. 15 (4), 787-807 (2015).
- van de Vijver, I., Ridderinkhof, K. R., Cohen, M. X. Frontal oscillatory dynamics predict feedback learning and action adjustment. Journal of Cognitive Neuroscience. 23 (12), 4106-4121 (2011).
- Narayanan, N. S., Cavanagh, J. F., Frank, M. J., Laubach, M. Common medial frontal mechanisms of adaptive control in humans and rodents. Nature Neuroscience. 16 (12), 1888-1895 (2013).
- Anguera, J. A., et al. Video game training enhances cognitive control in older adults. Nature. 501 (7465), 97-101 (2013).
- Smit, A. S., Eling, P. A. T. M., Hopman, M. T., Coenen, A. M. L. Mental and physical effort affect vigilance differently. International Journal of Psychophysiology. 57 (3), 211-217 (2005).
- Cohen, M. X., Ranganath, C. Reinforcement learning signals predict future decisions. Journal of Neuroscience. 27 (2), 371-378 (2007).
- Gehring, W. J., Goss, B., Coles, M. G. H., Meyer, D. E., Donchin, E. A neural system for error detection and compensation. Psychological Science. 4 (6), 385-390 (1993).
- Yeung, N., Botvinick, M. M., Cohen, J. D. The neural basis of error detection: Conflict monitoring and the error-related negativity. Psychological Review. 111 (4), 931-959 (2004).
- Debener, S., et al. Trial-by-trial coupling of concurrent electroencephalogram and functional magnetic resonance imaging identifies the dynamics of performance monitoring. Journal of Neuroscience. 25 (50), 11730-11737 (2005).
- Hauser, T. U., et al. The feedback-related negativity (FRN) revisited: New insights into the localization, meaning, and network organization. NeuroImage. 84, 159-168 (2014).
- Wang, C., Ulbert, I., Schomer, D. L., Marinkovic, K., Halgren, E. Responses of human anterior cingulate cortex microdomains to error detection, conflict monitoring, stimulus-response mapping, familiarity, and orienting. Journal of Neuroscience. 25 (3), 604-613 (2005).
- Tsujimoto, S., Genovesio, A. Firing variability of frontal pole neurons during a cued strategy task. Journal of Cognitive Neuroscience. 29 (1), 25-36 (2017).
- Womelsdorf, T., Johnston, K., Vinck, M., Everling, S. Theta-activity in anterior cingulate cortex predicts task rules and their adjustments following errors. Proceedings of the National Academy of Sciences of the United States of America. 107 (11), 5248-5253 (2010).
- Womelsdorf, T., Vinck, M., Stan Leung, L., Everling, S. Selective theta synchronization of choice-relevant information subserves goal-directed behavior. Frontiers in Human Neuroscience. 4, 2010 (2010).
- Domic-Siede, M., Irani, M., Valdés, J., Perrone-Bertolotti, M., Ossandón, T. Theta activity from frontopolar cortex, mid-cingulate cortex and anterior cingulate cortex shows different roles in cognitive planning performance. NeuroImage. 226, 117557 (2021).
- Wilensky, R. . Planning and Understanding: A Computational Approach to Human Reasoning. , (1983).
- Grafman, J., Hendler, J. Planning and the brain. Behavioral and Brain Sciences. 14, 563-564 (1991).
- Hayes-Roth, B., Hayes-Roth, F. A cognitive model of planning. Cognitive Science. 3 (4), 275-310 (1979).
- Tremblay, M., et al. Brain activation with a maze test: An EEG coherence analysis study in healthy subjects. Neuroreport. 5 (18), 2449-2453 (1994).
- Shallice, T. Specific impairments of planning. Philosophical Transactions of the Royal Society B: Biological Sciences. 298 (1089), 199-209 (1982).
- Unterrainer, J. M., Owen, A. M. Planning and problem solving: From neuropsychology to functional neuroimaging. Journal of Physiology. 99 (4-6), 308-317 (2006).
- Domic-Siede, M., et al. La planificación cognitiva en el contexto de la evaluación neuropsicológica e investigación en neurociencia cognitiva: Una revisión sistemática. Terapia Psicológica. 40 (3), 367-395 (2022).
- Miotto, E. C., Morris, R. G. Virtual planning in patients with frontal lobe lesions. Cortex. 34 (5), 639-657 (1998).
- Burgess, P. W., Simons, J. S., Coates, L. M. A., Channon, S., Morris, R., Ward, G. The search for specific planning processes. The Cognitive Psychology of Planning. , 199-227 (2005).
- Oosterman, J. M., Wijers, M., Kessels, R. P. C. Planning or something else? Examining neuropsychological predictors of zoo map performance. Applied Neuropsychology. 20 (2), 103-109 (2013).
- Campbell, Z., et al. Utilizing virtual reality to improve the ecological validity of clinical neuropsychology: An fMRI case study elucidating the neural basis of planning by comparing the Tower of London with a three-dimensional navigation task. Applied Neuropsychology. 16 (4), 295-306 (2009).
- Wilson, B. A., Alderman, N., Burgess, P. W., Emslie, H., Evans, J. J. . Behavioural Assessment of the Dysexecutive Syndrome. , (1996).
- Spector, L., Grafman, J., Boller, F., Grafman, J. Planning, neuropsychology, and artificial intelligence: Cross fertilization. Handbook of Neuropsychology. 9, 377-392 (1994).
- Porteus, S. D. . The Maze Test and Clinical Psychology. , (1959).
- Lis, S., Krieger, S., Wilhelm, J., Gallhofer, B. Feedback about previous action improves executive functioning in schizophrenia: An analysis of maze solving behaviour. Schizophrenia Research. 78 (2-3), 243-250 (2005).
- Zelinsky, G. J. A theory of eye movements during target acquisition. Psychological Review. 115 (4), 787-835 (2008).
- Wurtz, R. H., Goldberg, M. E., Robinson, D. L. Brain mechanisms of visual attention. Scientific American. 246 (6), 124-135 (1982).
- Burr, D., Morrone, M. C. Eye movements: Building a stable world from glance to glance. Current Biology. 15 (20), 839-840 (2005).
- Rolfs, M. Microsaccades: Small steps on a long way. Vision Research. 49 (20), 2415-2441 (2009).
- Ortega, J., Plaska, C. R., Gomes, B. A., Ellmore, T. M. Spontaneous eye blink rate during the working memory delay period predicts task accuracy. Frontiers in Psychology. 13, 788231 (2022).
- Grueschow, M., Kleim, B., Ruff, C. C. Role of the locus coeruleus arousal system in cognitive control. Journal of Neuroendocrinology. 32 (12), 12890 (2020).
- Aston-Jones, G., Shaver, R., Dinan, T. Cortically projecting nucleus basalis neurons in rat are physiologically heterogeneous. Neuroscience Letters. 46 (1), 19-24 (1984).
- Foote, S. L., Bloom, F. E., Aston-Jones, G. Nucleus locus coeruleus: New evidence of anatomical and physiological specificity. Physiological Reviews. 63 (3), 844-914 (1983).
- Siever, L. J., Davis, K. L. Overview: Toward a dysregulation hypothesis of depression. The American Journal of Psychiatry. 142 (9), 1017-1031 (1985).
- Aston-Jones, G., Gold, J. I. How we say no: Norepinephrine, inferior frontal gyrus, and response inhibition. Biological Psychiatry. 65 (7), 548-549 (2009).
- Aston-Jones, G., Cohen, J. D. An integrative theory of locus coeruleus norepinephrine function: adaptive gain and optimal performance. Annual Review of Neurosciences. 28, 403-450 (2005).
- Einhauser, W., Stout, J., Koch, C., Carter, O. Pupil dilation reflects perceptual selection and predicts subsequent stability in perceptual rivalry. Proceedings of the National Academy of Sciences of the United States of America. 105 (5), 1704-1709 (2008).
- Yoshitomi, T., Ito, Y., Inomata, H. Adrenergic excitatory and cholinergic inhibitory innervations in the human iris dilator. Experimental Eye Research. 40 (3), 453-459 (1985).
- Rajkowski, J., Kubiak, P., Aston-Jones, G. Locus coeruleus activity in monkey: Phasic and tonic changes are associated with altered vigilance. Brain Research Bulletin. 35 (5-6), 607-616 (1994).
- Beatty, J. Task-evoked pupillary responses, processing load, and the structure of processing resources. Psychological Bulletin. 91 (2), 276-292 (1982).
- Beatty, J., Kahneman, D. Pupillary changes in two memory tasks. Psychonomic Science. 5, 371-372 (1966).
- Hess, E. H., Polt, J. M. Pupil size in relation to mental activity during simple problem-solving. Science. 143 (3611), 1190-1192 (1964).
- Kuchinke, L., Vo, M. L., Hofmann, M., Jacobs, A. M. Pupillary responses during lexical decisions vary with word frequency but not emotional valence. International Journal of Psychophysiology. 65 (2), 132-140 (2007).
- Barkley, R. A. Adolescents with attention-deficit/hyperactivity disorder: An overview of empirically based treatments. Journal of Psychiatric Practice. 10 (1), 39-56 (2004).
- Gau, S. S. F. e. m. 8. 9., Shang, C. Y. Executive functions as endophenotypes in ADHD: Evidence from the Cambridge Neuropsychological Test Battery (CANTAB). Journal of Child Psychology and Psychiatry and Allied Disciplines. 51 (7), 838-849 (2010).
- Bora, E., Harrison, B. J., Yücel, M., Pantelis, C. Cognitive impairment in euthymic major depressive disorder: A meta-analysis. Psychological Medicine. 43 (10), 2017-2026 (2013).
- Rive, M. M., Koeter, M. W. J., Veltman, D. J., Schene, A. H., Ruhé, H. G. Visuospatial planning in unmedicated major depressive disorder and bipolar disorder: Distinct and common neural correlates. Psychological Medicine. 46 (11), 2313-2328 (2016).
- Holt, D. V., Wolf, J., Funke, J., Weisbrod, M., Kaiser, S. Planning impairments in schizophrenia: Specificity, task independence and functional relevance. Schizophrenia Research. 149 (1-13), 174-179 (2013).
- Lima-Silva, T. B., et al. Functional profile of patients with behavioral variant frontotemporal dementia (bvFTD) compared to patients with Alzheimer's disease and normal controls. Dementia and Neuropsychologia. 7 (1), 96-103 (2013).
- Karnath, H. O., Wallesch, C. W., Zimmermann, P. Mental planning and anticipatory processes with acute and chronic frontal lobe lesions: A comparison of maze performance in routine and non-routine situations. Neuropsychologia. 29 (4), 271-290 (1991).
- Staudigl, T., Hartl, E., Noachtar, S., Doeller, C. F., Jensen, O. Saccades are phase-locked to alpha oscillations in the occipital and medial temporal lobe during successful memory encoding. PLoS Biology. 15 (12), 2003404 (2017).
- Faul, F., Erdfelder, E., Lang, A. G., Buchner, A. G*Power 3: A flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behavior Research Methods. 39 (2), 175-191 (2007).
- Ferrando, L., Bobes, J., Gibert, J., Soto, M. MINI Entrevista Neuropsiquiátrica Internacional (MINI International Neuropsychiatric Interview, MINI). Instrumentos de Detección y Orientación Diagnóstica. , (2000).
- McAssey, M., Dowsett, J., Kirsch, V., Brandt, T., Dieterich, M. Different EEG brain activity in right and left-handers during visually induced self-motion perception. Journal of Neurology. 267 (1), 79-90 (2020).
- Kelly, R., Mizelle, J. C., Wheaton, L. A. Distinctive laterality of neural networks supporting action understanding in left- and right-handed individuals: An EEG coherence study. Neuropsychologia. 75, 20-29 (2015).
- O'Hare, A. J., Atchley, R. A., Young, K. M. Central and divided visual field presentation of emotional images to measure hemispheric differences in motivated attention. Journal of Visualized Experiments. (129), 56257 (2017).
- Beatty, J. Task-evoked pupillary responses, processing load, and the structure of processing resources. Psychological Bulletin. 91 (2), 276-292 (1982).
- Wainstein, G., et al. Pupil size tracks attentional performance in attention-deficit/hyperactivity disorder. Scientific Reports. 7 (1), 8228 (2017).
- Drueke, B., et al. Neural correlates of positive and negative performance feedback in younger and older adults. Behavioral and Brain Functions. 11, 17 (2015).
- Lezak, M. D. The problem of assessing executive functions. International Journal of Psychology. 17 (1-4), 281-297 (1982).
- Oosterman, J. M., Wijers, M., Kessels, R. P. C. Planning or something else? Examining neuropsychological predictors of zoo map performance. Applied Neuropsychology. 20 (2), 103-109 (2013).
- Keil, A., et al. Committee report: Publication guidelines and recommendations for studies using electroencephalography and magnetoencephalography. Psychophysiology. 51 (1), 1-21 (2014).
- Abokyi, S., Owusu-Mensah, J., Osei, K. A. Caffeine intake is associated with pupil dilation and enhanced accommodation. Eye. 31 (4), 615-619 (2017).
- Wilhelm, B., Stuiber, G., Lüdtke, H., Wilhelm, H. The effect of caffeine on spontaneous pupillary oscillations. Ophthalmic & Physiological Optics. 34 (1), 73-81 (2014).
- McGinley, M. J., David, S. V., McCormick, D. A. Cortical membrane potential signature of optimal states for sensory signal detection. Neuron. 87 (1), 179-192 (2015).
- Slotnick, S. D. High density event-related potential data acquisition in cognitive neuroscience. Journal of Visualized Experiments. (38), 1945 (2010).
- Lamm, C., Windischberger, C., Leodolter, U., Moser, E., Bauer, H. Co-registration of EEG and MRI data using matching of spline interpolated and MRI-segmented reconstructions of the scalp surface. Brain Topography. 14 (2), 93-100 (2001).
- Schwartz, D., et al. Registration of MEG/EEG data with 3D MRI: Methodology and precision issues. Brain Topography. 9, 101-116 (1996).
- Laeng, B., Sirois, S., Gredebäck, G. Pupillometry: A window to the preconscious? Perspectives on psychological science. Journal of the Association for Psychological Science. 7 (1), 18-27 (2012).
- Vandierendonck, A. A comparison of methods to combine speed and accuracy measures of performance: A rejoinder on the binning procedure. Behavior Research Methods. 49 (2), 653-673 (2017).
- Vandierendonck, A. Further tests of the utility of integrated speed-accuracy measures in task switching. Journal of Cognition. 1 (1), 8 (2018).
- Levene, H., Olkin, I. Robust tests for equality of variances. In Contributions to Probability and Statistics: Essays in Honor of Harold Hotelling. , 278-292 (1960).
- Zimmerman, D. W. A note on preliminary tests of equality of variances. The British Journal of Mathematical and Statistical Psychology. 57, 173-181 (2004).
- D'Agostino, R. B., Belanger, A., D'Agostino, R. B. A suggestion for using powerful and informative tests of normality). The American Statistician. 44 (4), 316 (1990).
- Shapiro, S. S., Wilk, M. B. An analysis of variance test for normality (complete samples). Biometrika. 52 (3-4), 591-611 (1965).
- Wilcoxon, F. Individual comparisons by ranking methods. Biometrics Bulletin. 1 (6), 80 (1945).
- Fay, M. P., Proschan, M. A. Wilcoxon-Mann-Whitney or t-test? On assumptions for hypothesis tests and multiple interpretations of decision rules. Statistics Surveys. 4, 1-39 (2010).
- Delorme, A., Makeig, S. EEGLAB: An open-source toolbox for analysis of single-trial EEG dynamics including independent component analysis. Journal of Neuroscience Methods. 134 (1), 9-21 (2004).
- Dimigen, O., Sommer, W., Hohlfeld, A., Jacobs, A. M., Kliegl, R. Coregistration of eye movements and EEG in natural reading: Analyses and review. Journal of Experimental Psychology. 140 (4), 552-572 (2011).
- Mognon, A., Jovicich, J., Bruzzone, L., Buiatti, M. ADJUST: An automatic EEG artifact detector based on the joint use of spatial and temporal features. Psychophysiology. 48 (2), 229-240 (2011).
- Bell, A. J., Sejnowski, T. J., Leen, T. K., Tesauro, G., Touretsky, D. S. A non-linear information maximization algorithm that performs blind separation. Advances in Neural Information Processing Systems 7. , (1995).
- Plöchl, M., Ossandón, J. P., König, P. Combining EEG and eye tracking: Identification, characterization, and correction of eye movement artifacts in electroencephalographic data. Frontiers in Human Neuroscience. 6, 278 (2012).
- Pion-Tonachini, L., Kreutz-Delgado, K., Makeig, S. ICLabel: An automated electroencephalographic independent component classifier, dataset, and website. NeuroImage. 198, 181-197 (2019).
- Gartner, M., Grimm, S., Bajbouj, M. Frontal midline theta oscillations during mental arithmetic: Effects of stress. Frontiers in Behavioral Neuroscience. 9, 96 (2015).
- Wang, W., Viswanathan, S., Lee, T., Grafton, S. T. Coupling between theta oscillations and cognitive control network during cross-modal visual and auditory attention: Supramodal vs modality-specific mechanisms. PLoS One. 11 (7), 0158465 (2016).
- Maris, E., Oostenveld, R. Nonparametric statistical testing of EEG- and MEG-data. Journal of Neuroscience Methods. 164 (1), 177-190 (2007).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Computational Intelligence and Neuroscience. 2011, 879716 (2011).
- Pascual-Marqui, R. D. Standardized low-resolution brain electromagnetic tomography (sLORETA): Technical details. Methods and Findings in Experimental and Clinical Pharmacology. 24, 5-12 (2002).
- Gramfort, A., Papadopoulo, T., Olivi, E., Clerc, M. OpenMEEG: Opensource software for quasistatic bioelectromagnetics). Biomedical Engineering Online. 9, 45 (2010).
- Destrieux, C., Fischl, B., Dale, A., Halgren, E. Automatic parcellation of human cortical gyri and sulci using standard anatomical nomenclature. Neuroimage. 53 (1), 1-15 (2010).
- Orr, J. M., Weissman, D. H. Anterior cingulate cortex makes 2 contributions to minimizing distraction. Cerebral Cortex. 9 (3), 703-711 (2009).
- Christoff, K., Gabrieli, J. D. E. The frontopolar cortex and human cognition: Evidence for a rostrocaudal hierarchical organization within the human prefrontal cortex. Psychobiology. 28 (2), 168-186 (2000).
- Nitschke, K., Köstering, L., Finkel, L., Weiller, C., Kaller, C. P. A meta-analysis on the neural basis of planning: Activation likelihood estimation of functional brain imaging results in the Tower of London task. Human Brain Mapping. 38 (1), 396-413 (2017).
- Barbey, A. K., Koenigs, M., Grafman, J. Dorsolateral prefrontal contributions to human working memory. Cortex. 49 (5), 1195-1205 (2013).
- Le Van Quyen, M., et al. Comparison of Hilbert transform and wavelet methods for the analysis of neuronal synchrony. Journal of Neuroscience Methods. 111 (2), 83-98 (2001).
- Bokil, H., Andrews, P., Kulkarni, J. E., Mehta, S., Mitra, P. P. Chronux: A platform for analyzing neural signals. Journal of Neuroscience Methods. 192 (1), 146-151 (2010).
- Sato, N., Yamaguchi, Y. EEG theta regulates eye saccade generation during human object-place memory encoding. Advances in Cognitive Neurodynamics ICCN 2007. , 429-434 (2008).
- Zaki, J., Ochsner, K. The need for a cognitive neuroscience of naturalistic social cognition. Annals of the New York Academy of Sciences. 1167, 16-30 (2009).
- Shamay-Tsoory, S. G., Mendelsohn, A. Real-life neuroscience: An ecological approach to brain and behavior research. Perspectives on Psychological Science. 14 (5), 841-859 (2019).
- Diamond, A. Executive functions. Annual Review of Psychology. 64, 135-168 (2013).
- Dudai, Y. . Memory from A to Z: Keywords, Concepts and Beyond. , (2002).
- Kingstone, A., Smilek, D., Ristic, J., Friesen, C. K., Eastwood, J. D. Attention, researchers! It is time to take a look at the real world. Current Directions in Psychological Science. 12 (5), 176-180 (2003).
- Morris, R. G., Ward, G., Morris, R., Ward, G. Introduction to the psychology of planning. The Cognitive Psychology of Planning. , (2005).
- Zwosta, K., Ruge, H., Wolfensteller, U. Neural mechanisms of goal-directed behavior: Outcome-based response selection is associated with increased functional coupling of the angular gyrus. Frontiers in Human Neuroscience. 9, 180 (2015).
- Owen, A. M., Doyon, J., Petrides, M., Evans, A. C. Planning and spatial working memory: A positron emission tomography study in humans. European Journal of Neuroscience. 8 (2), 353-364 (1996).
- Ossandon, T., et al. Efficient "pop-out" visual search elicits sustained broadband gamma activity in the dorsal attention network. Journal of Neuroscience. 32 (10), 3414-3421 (2012).
- Lezak, M. D. . Neuropsychological Assessment., 3rd edition. , (1995).
- Lin, H., Saunders, B., Hutcherson, C. A., Inzlicht, M. Midfrontal theta and pupil dilation parametrically track subjective conflict (but also surprise) during intertemporal choice. NeuroImage. 172, 838-852 (2018).
- Yu, S., Mückschel, M., Beste, C. Superior frontal regions reflect the dynamics of task engagement and theta band-related control processes in time-on task effects. Scientific Reports. 12 (1), 846 (2022).
- Nakatani, H., van Leeuwen, C. Antecedent occipital alpha band activity predicts the impact of oculomotor events in perceptual switching. Frontiers in Systems Neuroscience. 7, 19 (2013).
- Velasques, B., et al. Changes in saccadic eye movement (SEM) and quantitative EEG parameter in bipolar patients. Journal of Affective Disorders. 145 (3), 378-385 (2013).
- Bodala, I. P., Li, J., Thakor, N. V., Al-Nashash, H. EEG and eye tracking demonstrate vigilance enhancement with challenge integration. Frontiers in Human Neuroscience. 10, 273 (2016).
- Dimigen, O. Optimizing the ICA-based removal of ocular EEG artifacts from free viewing experiments. NeuroImage. 207, 116117 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。