Method Article
Eine visuell-räumliche Planungsaufgabe gekoppelt mit Eye-Tracker- und Elektroenzephalogramm-Systemen
In diesem Artikel
Zusammenfassung
Die Untersuchung der kognitiven Planung durch die Kombination von EEG- und Eye-Tracking-Systemen bietet einen multimodalen Ansatz zur Untersuchung der neuronalen Mechanismen, die kognitive Kontrolle und zielgerichtetes Verhalten beim Menschen vermitteln. Hier beschreiben wir ein Protokoll zur Untersuchung der Rolle von Gehirnschwingungen und Augenbewegungen bei der Planung der Leistung.
Zusammenfassung
Der Planungsprozess, der durch die Fähigkeit gekennzeichnet ist, einen organisierten Plan zu formulieren, um ein Ziel zu erreichen, ist essentiell für das zielgerichtete Verhalten des Menschen. Da die Planung bei mehreren neuropsychiatrischen Erkrankungen beeinträchtigt ist, ist die Durchführung geeigneter klinischer und experimenteller Tests zur Überprüfung der Planung von entscheidender Bedeutung. Aufgrund der Art des Einsatzes von Planung, an der mehrere kognitive Domänen beteiligt sind, sind die Bewertung der Planung und das Design von Verhaltensparadigmen in Verbindung mit bildgebenden Verfahren aktuelle Herausforderungen in den kognitiven Neurowissenschaften. Eine Planungsaufgabe wurde in Kombination mit einem Elektroenzephalogramm (EEG)-System und Augenbewegungsaufzeichnungen bei 27 gesunden erwachsenen Teilnehmern evaluiert. Die Planung kann in zwei Phasen unterteilt werden: eine mentale Planungsphase, in der eine Abfolge von Schritten intern dargestellt wird, und eine Ausführungsphase, in der motorisches Handeln eingesetzt wird, um ein zuvor geplantes Ziel zu erreichen. Unser Protokoll beinhaltete eine Planungsaufgabe und eine Steuerungsaufgabe. Die Planungsaufgabe bestand darin, 36 Labyrinthversuche zu lösen, die jeweils eine Zookarte darstellten. Die Aufgabe bestand aus vier Perioden: i) Planung, bei der die Probanden angewiesen wurden, einen Weg zu planen, um die Standorte von vier Tieren nach einem Satz von Regeln zu besuchen; ii) Instandhaltung, bei der die Probanden den geplanten Weg in ihrem Arbeitsgedächtnis behalten mussten; iii) Ausführung, bei der die Probanden mit Augenbewegungen den zuvor geplanten Weg verfolgten, wie er vom Eye-Tracker-System angezeigt wurde; und iv) Antwort, bei der die Probanden die Reihenfolge der besuchten Tiere angaben. Die Kontrollaufgabe hatte eine ähnliche Struktur, aber die kognitive Planungskomponente wurde entfernt, indem das Aufgabenziel geändert wurde. Die räumlichen und zeitlichen Muster des EEGs zeigten, dass die Planung im Laufe der Zeit einen allmählichen und dauerhaften Anstieg der frontalen Mittellinien-Theta-Aktivität (FMθ) induziert. Die Quelle dieser Aktivität wurde im präfrontalen Kortex durch Quellenanalysen identifiziert. Unsere Ergebnisse deuten darauf hin, dass das experimentelle Paradigma, das EEG- und Eye-Tracker-Systeme kombiniert, optimal für die Bewertung der kognitiven Planung ist.
Einleitung
In den letzten 10 Jahren wurden umfangreiche Forschungen durchgeführt, um die Rolle der oszillatorischen neuronalen Dynamik sowohl auf die Kognition als auch auf das Verhalten zu untersuchen. Diese Studien haben gezeigt, dass frequenzspezifische Interaktionen zwischen spezialisierten und weit verbreiteten kortikalen Regionen eine entscheidende Rolle bei der Kognition und kognitiven Kontrolle spielen 1,2,3. Dieser Ansatz unterstreicht die rhythmische Natur der Gehirnaktivität, die dazu beiträgt, großräumige kortikale Dynamiken zu koordinieren und die kognitive Verarbeitung und das zielgerichtete Verhalten zu untermauern 4,5. Es gibt substanzielle Hinweise darauf, dass rhythmische Oszillationen im Gehirn an verschiedenen kognitiven Prozessen beteiligt sind, darunter Wahrnehmung6, Attentio 7,8,9, Entscheidungsfindung10, Gedächtnisreaktivierung11, Arbeitsgedächtnis12 und kognitive Kontrolle13. Es wurden verschiedene oszillatorische Mechanismen vorgeschlagen, um zielgerichtetes Verhalten zu steuern, wobei transiente großskalige frequenzspezifische Netzwerke einen Rahmen für die kognitive Verarbeitung bieten 1,14,15. Zum Beispiel deuten neuere Befunde darauf hin, dass bestimmte Frequenzbänder im Gehirn einen Rückkopplungsmechanismus widerspiegeln können, der die Spike-Aktivität reguliert und einen zeitlichen Bezugsrahmen bietet, um die kortikale Erregbarkeit und das Spike-Timing für die Produktion von Verhalten zu koordinieren 16,17,18. Eine Rezension gibt es von Helfrich und Knight19.
Diese Evidenz wirft die Frage auf, wie der präfrontale Kortex (PFC) Planungsaufgabenkontexte und damit verbundene verhaltensrelevante Regeln kodiert. Lange Zeit wurde angenommen, dass der PFC die kognitive Kontrolle und das zielgerichtete Verhalten durch die oszillatorischen Muster der neuronalen Aktivität, die er erzeugt, unterstützt, die neuronale Aktivität in entfernten Gehirnregionen selektiv verzerrt und den Informationsfluss in großen neuronalen Netzen steuert20. Darüber hinaus wurde vorgeschlagen, dass Regionen, die lokale Synchronität aufweisen, mit größerer Wahrscheinlichkeit an interregionalen Aktivitäten teilnehmen 21,22,23. Insbesondere kortikale Thetaband-Oszillationen (4-8 Hz), gemessen durch ein Kopfhaut-Elektroenzephalogramm (EEG), wurden als potenzieller Mechanismus für die Übertragung von Top-Down-Kontrolle über breite Netzwerke vorgeschlagen13. Insbesondere spiegelt die Theta-Band-Aktivität beim Menschen kognitive Prozesse auf hoher Ebene wider, wie z. B. Gedächtniskodierung und -abruf, Arbeitsgedächtniserhaltung, Neuheitserkennung, Entscheidungsfindung und Top-Down-Kontrolle 12,24,25,26.
In diesem Zusammenhang schlugen Cavanagh und Frank13 zwei sequentielle Mechanismen von Kontrollprozessen vor: das Erkennen des Bedürfnisses nach Kontrolle und die Instanziierung von Kontrolle. Das Erkennen des Kontrollbedarfs kann durch die frontale Midline-Theta-Aktivität (FMθ) angezeigt werden, die vom medialen präfrontalen Kortex (mPFC) ausgeht und in Form von ereigniskorrelierten Potentialkomponenten (ERP) beschrieben wurde, die mPFC-bezogene Kontrollprozesse als Reaktion auf verschiedene Situationen widerspiegeln, wie z. B. neuartige Informationen 27,28,29, widersprüchliche Reiz-Reaktions-Anforderungen 30, Fehlerrückkopplung31, und Fehlererkennung32. Diese ERP-Komponenten, die den Bedarf an erhöhter kognitiver Kontrolle in Gegenwart von Neuheit, Konflikt, Bestrafung oder Irrtum widerspiegeln, weisen eine gemeinsame spektrale Signatur in der Theta-Bande auf, die an den frontalen Mittellinienelektroden 26,27,33,34,35,36,37,38,39,40 aufgezeichnet wurde. 41,42,43,44.
Die EEG-Antworten der FMθ-Aktivität zeigen ein Muster von Phasenrückstellung und Leistungssteigerung im Theta-Frequenzband26. Trotz der Einschränkungen der EEG-Methode in Bezug auf ihre räumliche Auflösung wurden verschiedene Evidenzquellen gesammelt, die zeigen, dass die FMθ-Aktivität durch den mittleren cingulären Kortex (MCC) erzeugt wird13. Es wird angenommen, dass diese Theta-Dynamik als zeitliche Gerüste dient, die die neuronalen Prozesse des mPFC regulieren, die anschließend als Reaktion auf Ereignisse, die eine erhöhte Kontrolle erfordern, verstärkt werden26. Dies wurde durch Quellenanalyse 31,33,45,46,47, gleichzeitige EEG- und funktionelle Magnetresonanztomographie (fMRT)-Aufzeichnungen 48,49 und invasive EEG-Aufzeichnungen bei Menschen 50 und Affen51,52,53 festgestellt.
Basierend auf diesen Beobachtungen wird davon ausgegangen, dass das Theta der frontalen Mittellinie als universeller Mechanismus, als gemeinsame Sprache für die Durchführung adaptiver Kontrolle in verschiedenen Situationen dient, in denen es an Gewissheit über die Handlungen und Ergebnisse mangelt, z. B. während der Planung. Das Verhaltensparadigma, das wir in diesem Protokoll vorschlagen, wurde verwendet, um die kognitive Planung und ihre zeitlichen und neuronalen Eigenschaften zu untersuchen. Obwohl in anderen Szenarien über verschiedene Mechanismen der kognitiven Kontrolle berichtet wurde, hat das aktuelle Protokoll die jüngste Beschreibung der Planung und der damit verbundenen neuronalen und zeitlichen Eigenschaften ermöglicht54. Der kognitive Planungsprozess umfasst zwei unterschiedliche Phasen: die mentale Planungsphase, in der eine interne Repräsentation einer Abfolge von Plänenentwickelt wird 55, und die Planungsausführungsphase, in der eine Reihe von motorischen Aktionen ausgeführt wird, um das zuvor geplante Ziel56 zu erreichen. Es ist bekannt, dass die Planung die Integration verschiedener Komponenten exekutiver Funktionen erfordert, einschließlich des Arbeitsgedächtnisses, der Aufmerksamkeitskontrolle und der Reaktionshemmung, was die experimentelle Manipulation und isolierte Messung dieser Prozesse schwierig macht57,58.
Neuroimaging-Studien zur kognitiven Planung haben häufig Verhaltensparadigmen wie den Tower of London 59,60,61; Um jedoch die Störfaktoren zu kontrollieren, können die Aufgaben, die zur Untersuchung der kognitiven Planung verwendet werden, begrenzt und künstlich werden, was zu einer geringeren prädiktiven und ökologischen Validität führt 62,63,64,65. Um dieses Problem im Bereich der Neuropsychologie zu lösen, wurden reale Planungssituationen als ökologische Aufgaben vorgeschlagen62,63. Der Zoo Map Task-Subtest in der Behavioral Assessment of the Dysexecutive Syndrome Battery misst Planungs- und Organisationsfähigkeiten auf eine natürlichere und relevantere Weise64,66. Bei diesem Test handelt es sich um einen Bleistift-und-Papier-Test, bei dem eine Route geplant wird, um 6 von 12 Orten auf einer Zookarte zu besuchen. Bei den Orten handelt es sich um gängige Orte, die in einem normalen Zoo zu finden sind, wie z. B. ein Elefantenhaus, einen Löwenkäfig, einen Ruhebereich, ein Café usw. Es gibt zwei Bedingungen, die unterschiedliche Planungsebenen bewerten: i) die Formulierungsbedingung, bei der die Probanden angewiesen werden, eine Route zu planen, um sechs Orte in der Reihenfolge ihrer Wahl, aber nach einem Satz von Regeln zu besuchen; und ii) die Hinrichtungsbedingung, bei der die Probanden angewiesen werden, sechs Orte in einer bestimmten Reihenfolge und nach einem Satz von Regeln zu besuchen. Diese beiden Bedingungen geben Aufschluss über Planungsfähigkeiten bei schlecht strukturierten (Formulierung) und gut strukturierten (Ausführungs-) Problemen67. Die erste wird als anspruchsvollere kognitive Aufgabe in einer offenen Situation dargestellt, da sie von den Probanden verlangt, eine logische Strategie zu entwickeln, um das Ziel zu erreichen. Vor der Verfolgung eines Pfades muss eine Abfolge von Operatoren entwickelt werden. Andernfalls sind Fehler wahrscheinlich. Auf der anderen Seite erfordert die Ausführungsbedingung eine geringere kognitive Anforderung, da die Lösung einer Aufgabe, die die Befolgung einer bestimmten auferlegten Strategie beinhaltet, nur erfordert, dass das Subjekt die Umsetzung des formulierten Plans überwacht, um das Zielzu erreichen 66. Auf der anderen Seite ist das Porteus-Labyrinth eine bekannte Aufgabe auf dem Gebiet der Psychologie, insbesondere in den Bereichen der kognitiven Psychologie und der Neuropsychologie, und es wurde häufig als Werkzeug zur Bewertung verschiedener Aspekte der Kognition verwendet, wie z. B. Problemlösung und Planung68,69. Die Porteus-Maze-Aufgabe ist eine Bleistift-und-Papier-Aufgabe, die mit einer einfachen visuellen Reizanalyse beginnt und immer schwieriger wird. Das Subjekt muss den korrekten Weg von einem Startpunkt zu einem Ausgang (unter mehreren Optionen) finden und verfolgen, während es Regeln befolgt, wie z. B. sich kreuzende Wege und Sackgassen zu vermeiden und so schnell wie möglich zu handeln68. Jedes Mal, wenn beim Zeichnen des Pfades eine Gabelung auftaucht, treffen die Probanden Entscheidungen, um das Ziel zu erreichen und zu vermeiden, die gegebenen Regelnzu brechen 69.
Unter Berücksichtigung der Grenzen und Stärken der häufig verwendeten und ökologischen Aufgaben haben wir unser Verhaltensparadigma hauptsächlich auf der Grundlage der Zoo Map Task66 und der Porteus Maze Task68 entwickelt. Das Verhaltensparadigma besteht aus vier verschiedenen Phasen, die den kognitiven Prozess der Planung in einem Szenario des täglichen Lebens umfassen. Diese Phasen sind wie folgt: Phase 1, Planung, in der die Teilnehmer die Aufgabe haben, eine Route zu erstellen, um verschiedene Orte auf einer Karte zu besuchen und die Einhaltung der festgelegten Regeln sicherzustellen; Stufe 2, Instandhaltung, bei der die Teilnehmer die geplante Route in ihrem Arbeitsgedächtnis behalten müssen; Stufe 3, Ausführung, in der die Teilnehmer ihre zuvor geplante Route ausführen, indem sie ihre Genauigkeit zeichnen und genau überwachen; und Stufe 4, Reaktion, in der die Teilnehmer die Reihenfolge der besuchten Tiere gemäß ihrer geplanten Route54 melden. Unser Paradigma ermöglicht die Messung verschiedener Parameter der Planungsfähigkeit anhand verschiedener Phasen, die die verschiedenen Komponenten der Planung (wie Arbeitsgedächtnis, exekutive Aufmerksamkeit und visuell-räumliche Fähigkeiten) realistischer widerspiegeln, da das Abstecken von Routen ein häufiges Ereignis im täglichen Leben ist. Zusätzlich beinhaltet das Paradigma zur Kontrolle von Störfaktoren eine Kontrollaufgabe mit einer Planungsaufgabenstruktur und äquivalenten Stimuli, die die exekutiven kognitiven Komponenten einbezieht, die ebenfalls an der Planung beteiligt sind, aber die Planungsprozesskomponente ausschließt. Dies ermöglicht die Trennung der Planungsprozesskomponente für den Vergleich sowohl elektrophysiologischer Marker als auch von Verhaltensparametern54.
Darüber hinaus hat Eye-Tracking einen bedeutenden Beitrag zu Studien der kognitiven Neurowissenschaften geleistet, indem es eine nicht-invasive Methode zur Messung und Analyse von Augenbewegungen bereitstellt, die wertvolle Einblicke in die kognitiven Prozesse und neuronalen Mechanismen liefern kann, die der Wahrnehmung, Aufmerksamkeit und kognitiven Funktionen zugrunde liegen. Die Messung verschiedener Arten von Augenbewegungen mit einem Eye-Tracking-System kann wertvolle Informationen über die kognitiven Prozesse und neuronalen Mechanismen liefern, die an der Planung beteiligt sind. Zum Beispiel können die folgenden Aspekte gemessen werden: Fixierungen, d. h. die Perioden des stabilen Blicks, in denen visuelle Informationen erworben werden70; Sakkaden, d. h. die schnellen Augenbewegungen, mit denen der Blick von einem Ort zum anderen verschobenwird 71; sanfte Verfolgung, bei der es sich um eine Art von Augenbewegung handelt, die es den Augen ermöglicht, einem sich bewegenden Objekt reibungslos zu folgen72; Mikrosakkaden sind kleine, schnelle Augenbewegungen, die auch während der Fixationen auftreten73; und Blinzeln, bei dem es sich um eine Reflexwirkung handelt, die dazu beiträgt, die Augen mit Feuchtigkeit zu versorgen und sie vor Fremdkörpern zu schützen74. Diese Augenbewegungen können Einblicke in die kognitiven Prozesse geben, die an der visuellen Suche, der Aufmerksamkeitszuweisung70, der visuellen Verfolgung72, der Wahrnehmung73 und dem Arbeitsgedächtnis74 beteiligt sind, die wichtige Komponenten für die Planung und kognitive Kontrolle sind.
Auf der anderen Seite haben neuere Studien über das Locus coeruleus-Noradrenalin (LC-NE)-System seine relevante Rolle bei der kognitiven Kontrolle gezeigt75. Der Locus coeruleus (LC) projiziert auf mehrere Hirnregionen, wie z.B. die Großhirnrinde, den Hippocampus, den Thalamus, das Mittelhirn, den Hirnstamm, das Kleinhirn und das Rückenmark 76,77,61. Besonders dichte LC-NE-Innervationen erhalten PFC-Hirnareale, die mit kognitiver Kontrolle assoziiert sind75. Darüber hinaus deuten einige Studien darauf hin, dass eine chronische Hyperaktivität des LC-Systems zu Symptomen einer manisch-depressiven Störung wie Impulsivität und Schlaflosigkeit beitragen kann. Im Gegensatz dazu wurde eine chronische Abnahme der LC-Funktion mit einem verminderten emotionalen Ausdruck in Verbindung gebracht, ein weit verbreitetes Merkmal bei Patienten, die an Depressionen leiden78. Eine überaktive Reaktion des Locus coeruleus auf Reize kann bei Personen mit Stress- oder Angststörungen zu einer überschießenden Reaktion führen79. Daher können Veränderungen im LC-NE-System zu den Symptomen einer kognitiven und/oder emotionalen Dysregulation beitragen. Nicht-invasive Techniken können verwendet werden, um die Aktivität des Locus coeruleus zu untersuchen, zu denen auch Veränderungen des Pupillendurchmessers gehören, die hauptsächlich durch Noradrenalin kontrolliert werden, das aus dem Locus coeruleus freigesetzt wird. Noradrenalin wirkt auf den Irisdilatator, indem es die Alpha-Adrenozeptoren stimuliert, und auf den Edinger-Westphal-Kern, der Signale an das Ziliarganglion sendet und die Irisdilatation durch die Aktivierung der postsynaptischen Alpha-2-Adrenozeptoren steuert 66,80,81,82. Direkte neuronale LC-Aufzeichnungen von Affen haben den Zusammenhang zwischen LC-NE-Aktivität, Pupillendurchmesser und kognitiver Leistungsfähigkeit bestätigt83. Eine Pupillenerweiterung wurde wiederholt als Reaktion auf erhöhte Verarbeitungsanforderungen bei mehreren kognitiven Aufgaben beobachtet 71,84,85,86,87.
Elektrophysiologische Marker der kognitiven Kontrolle in Kombination mit Eye-Tracking und Pupillenaufzeichnungen könnten entscheidende Fragen darüber klären, wie kognitive Kontrolle und Planung im Gehirn implementiert werden. Die Verwendung unseres Protokolls, das EEG- und Eye-Tracker-Systeme kombiniert, ist zweifach. Auf der einen Seite scheint die kognitive Kontrolle die Beteiligung der verteilten Gehirnaktivität an präzisen zeitlichen Beziehungen zu erfordern, die ideale Kandidaten für die Untersuchung der Funktion des Gehirnnetzwerks darstellen. Auf der anderen Seite haben Anomalien in einer dieser Fähigkeiten einen schwerwiegenden Einfluss auf das normale Verhalten, wie dies bei einer Vielzahl von kognitiven und neuropsychiatrischen Störungen der Fall sein kann, wie z. B. Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung88,89, schwere depressive Störung90,91, bipolare Störung91, Schizophrenie92, frontotemporale Demenz93 sowie Störungen aufgrund von frontalen Läsionen94. Darüber hinaus ermöglicht das aktuelle Protokoll die Verwendung der Pupillometrie als Parameter zum Vergleich der LC-NE-Aktivität und der Oszillationen mittels Eye-Tracking und Elektroenzephalographie. Dies könnte nicht nur Beweise für die theoretische Beziehung zwischen LC-NE, Pupillometrie und neuronalen Markern beim Menschen liefern, sondern auch die Verfolgung des Entwicklungsverlaufs von Merkmalen im Zusammenhang mit dem LC-NE-System während der kognitiven Planung ermöglichen. In unserem Modell konzentrierten wir uns jedoch darauf, zu testen, ob es während der Planung ein spezifisches Muster von Sakkaden gab, das möglicherweise zu spezifischen Oszillationsänderungen führen könnte95. Darüber hinaus haben wir ein Eye-Tracker-System als wichtigen Teil der Untersuchung der Verhaltensausführung eines Plans in der Ausführungsphase unseres Verhaltensparadigmas verwendet.
Zusammenfassend lässt sich sagen, dass dieses Protokoll testbare Modelle der Netzwerkdynamik des Gehirns hervorbringen könnte, die als Plattform sowohl für die weitere Grundlagenforschung als auch für mögliche klinische und therapeutische Anwendungen dienen könnten.
Protokoll
Alle Verfahren in diesem Protokoll wurden von der Bioethikkommission der Medizinischen Fakultät der Pontificia Universidad Católica de Chile genehmigt, und alle Teilnehmer unterschrieben vor Beginn der Studie eine Einverständniserklärung (Forschungsprojektnummer: 16-251).
1. Rekrutierung von Teilnehmern
- Rekrutieren Sie rechtshändige gesunde Erwachsene (Männer und Frauen) mit normalem oder korrigiertem Sehvermögen und untersuchen Sie sie anhand der Einschluss-/Ausschlusskriterien.
HINWEIS: In dieser Studie wurden 27 gesunde Personen im Alter zwischen 19 und 38 Jahren rekrutiert, die fließend sprachen. Die Stichprobengröße kann je nach gewünschter statistischer Aussagekraft variieren, und die Altersspanne kann je nach der zu beantwortenden Forschungsfrage variieren. In unserem Protokoll berechneten wir die Stichprobengröße unter Berücksichtigung des statistischen Wilcoxon-Vorzeichen-Rang-Tests, einer Effektstärke von 0,7, einem Alpha-Level von 0,05 und einer Trennschärfe von 0,95, wie in Faul et al.96 beschrieben. Wir nutzten das MINI-International Neuropsychiatric Interview97, das von einem ausgebildeten Psychologen durchgeführt wurde, um die Teilnehmer hinsichtlich der Ein-/Ausschlusskriterien zu beurteilen. Rekrutieren Sie nur rechtshändige Probanden, um die Variabilität des EEG-Signals zu reduzieren, da Linkshänder möglicherweise eine andere topographische Verteilung der EEG-Aktivität aufweisen 98,99,100.
2. Vorbereitung der Reize
- Erstellen Sie für die Planungsaufgabe eine Reihe von Stimuli mit einer Vektorgrafik-Editor-Software (siehe Materialtabelle). Entwerfen Sie für jeden Stimulus ein Graustufenlabyrinth, das eine Zookarte darstellt. Im Inneren des Labyrinths errichtest du ein Tor und mehrere Wege, die zu den Tierstandorten führen (in dieser Studie gab es z. B. vier Tierstandorte, siehe Abbildung 1).
HINWEIS: In dieser Studie haben wir 36 Labyrinthe erstellt, in denen jeder Stimulus aus einer Zookarte mit einem Starttor, vier Bildern von Tieren, die sich im Labyrinth befinden, und mehreren Pfaden bestand. Die Wege im Labyrinth können zu den Tierstandorten führen oder auch nicht. Die Verwendung von Graustufenreizen mit reduziertem Kontrast wird für die Pupillometrie oft bevorzugt, da sie die Stimulation der Netzhautzapfen, die für das Farbsehen verantwortlich sind, reduziert. Diese Verschiebung des Reizschwerpunkts ermöglicht eine empfindlichere Messung von Veränderungen in der Größe der Pupille, von denen angenommen wird, dass sie Veränderungen des Erregungs- oder Aufmerksamkeitszustands widerspiegeln. Zusätzlich reduziert die Verwendung von Graustufenreizen die Variabilität in der Messung aufgrund von Unterschieden im Farbsehen zwischen Individuen101. - Um unterschiedliche Komplexitätsstufen in der abschließenden Aufgabe zu erhalten, teilen Sie die Stimuli nach der Anzahl der gültigen Lösungen in Übereinstimmung mit dem festgelegten Ziel und den Regeln auf (insbesondere besteht das Ziel darin, einen Weg zum Besuch von Tierstandorten zu planen). Die Anzahl der gültigen Lösungen bezieht sich auf die Anzahl der Wege, die nach den Regeln geplant werden können (siehe Regeln in Abbildung 2 und Schritt 5.12.1.). Klassifizieren Sie Reize mit mehr als fünf möglichen Lösungen als "leicht" und solche mit fünf oder weniger möglichen Lösungen als "schwierig". Erstellen Sie dann für jede Kategorie die gleiche Anzahl von Testversionen.
HINWEIS: Alternativ können Sie die für Domic-Siede et al.54 erstellten Stimuli von den Autoren anfordern, da diese Stimuli gemäß diesen Anweisungen erstellt wurden. Beachten Sie, dass alle Materialien auf Anfrage erhältlich sind, aber die Spezifikationen sind hier aufgeführt. In dieser Studie haben wir 18 einfache und 18 schwierige Versuche erstellt. Die Bewertung der Unterschiede in den Schwierigkeitsstufen auf verhaltensbezogener und elektrophysiologischer Ebene ist wichtig, da sie hilft festzustellen, ob Sie die kognitive Anforderung/kognitive Anstrengung/Schwierigkeit oder intrinsische Aspekte der kognitiven Planung messen (siehe repräsentative Ergebnisse und Diskussionsabschnitte). - Verwenden Sie für die Kontrollaufgabe die gleiche Struktur wie für die Planungsaufgabe (Auswertungszeitraum, Wartung, Ausführung, Reaktion, siehe Abbildung 2) und verwenden Sie die gleichen Stimuli, die für die Planungsaufgabe erstellt wurden, fügen Sie jedoch eine gezeichnete Linie hinzu, die einen markierten Pfad für den Besuch der Abfolge der Tierstandorte vom Tor bis zum letzten Ort darstellt (siehe Abbildung 1B). Machen Sie den markierten Pfad etwas dunkler als die Hauptpfade des Labyrinths, mit niedrigem Kontrast, der mit einem Luxmeter bewertet wird (siehe Schritt 2.4).
HINWEIS: Die Idee dahinter ist, die psychophysischen Merkmale beider Zustände (Planungs- und Steuerungsaufgaben) so ähnlich wie möglich zu halten. Die nachgezeichneten Pfade der Labyrinthe konnten entweder den Regeln folgen oder nicht (siehe Abschnitt 5 des Protokolls für weitere Einzelheiten zu den Anweisungen, die den Teilnehmern gegeben wurden). In dieser Studie wies die Hälfte der Stimuli eine korrekte Besuchssequenz auf, die den Regeln folgte, während die andere Hälfte Fehler aufwies (z. B. die zweimalige Verwendung desselben Weges oder das Überqueren von Sackgassen, siehe Schritt 5.12.1 und Schritt 5.12.3 und Abbildung 2). - Beurteilen Sie die Beleuchtungsstärke der Reize mit einem Luxmeter, das in der Kinnstütze positioniert ist, die die Probanden verwenden werden (siehe Schritt 4.5 und Schritt 4.6) und in gleichem Abstand zum Bildschirm. Jeder Stimulus jeder Bedingung erzeugt einen Lux-Wert. Notieren Sie jeden Wert manuell für weitere Analysen.
HINWEIS: Es sind keine Unterschiede in der Beleuchtungsstärke zwischen den Bedingungen zu erwarten (siehe Schritt 4.6). Andernfalls überprüfen Sie den Kontrast der Reize. Dies ist relevant, wenn der Pupillendurchmesser102 gemessen wird. - Erstellen Sie einen Stimulus, der korrektes Feedback darstellt (Daumen hoch, wenn korrekt), und einen anderen Stimulus, der falsches Feedback darstellt (Daumen runter, wenn falsch), ebenfalls mit einem Vektorgrafikeditor (siehe Materialtabelle) (Abbildung 2).

Abbildung 1: Stimuli der Experimentier- und Kontrollaufgabe. Es werden anschauliche Beispiele für die (A) Planungs- und (B) Kontrollaufgaben-Stimuli gezeigt. Die Stimuli stellen eine Zookarte dar, die aus einem Tor, vier Tierstandorten an verschiedenen Orten und mehreren Wegen besteht. Die Stimuli für beide Erkrankungen waren ähnlich; der einzige Unterschied bestand darin, dass die Stimuli für die Kontrollaufgabe (B) eine markierte Linie hatten, die einen bereits vorhandenen Pfad anzeigte (hier schwarze Linie zur Veranschaulichung). Diese Linie in den realen Kontrollreizen war etwas dunkler, mit niedrigem Kontrast, der durch die Beleuchtungsstärke gesteuert wurde (siehe Schritt 2.4). Diese Abbildung wurde von Domic-Siede et al.54 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Versuch mit experimentellen Versuchen. (A) Versuch mit Planungsaufgaben. Die Versuche in diesem Zustand begannen mit einer 3 s Fixationskreuzung. Dann wurden die Teilnehmer angewiesen, einen Weg zu planen, um alle vier Tierstandorte nach einem Regelwerk (maximal 10 Sekunden) zu besuchen. Als nächstes erschien ein verschobenes Fixationskreuz (3 s), gefolgt von der erneuten Erscheinung des Labyrinths. In diesem Zeitraum (Ausführung) mussten die Probanden die in der vorangegangenen Planungsperiode geplante Spur unter Verwendung ihres Blicks mit visuellem Online-Feedback (durch das Eye-Tracker-System) ausführen, das ihre Blickbewegung in Echtzeit (dunkle Linie) (maximal 10 s) abgrenzte. Danach, in der Reaktionszeit, mussten die Probanden die während der Hinrichtung gemachte Sequenz melden, indem sie den Besuch der Tiere befahlen. Entsprechend ihren Antworten wurde Feedback gegeben. (B) Versuch mit Kontrollaufgaben. Die Versuche in diesem Zustand begannen mit einer 3 s Fixationskreuzung. Dann wurden die Teilnehmer angewiesen zu bewerten, ob ein nachgezeichneter Pfad (dunkle Linie) den Regeln folgte oder nicht. Als nächstes erschien ein verschobenes Fixationskreuz (3 s), gefolgt von der erneuten Erscheinung des Labyrinths. In diesem Zeitraum mussten die Probanden den bereits gezeichneten Pfad mit visuellem Online-Feedback neu zeichnen, wie in der Planungsausführungsphase (maximal 10 s). Danach, in der Antwortphase, mussten die Probanden antworten (ja oder nein), ob die verfolgte Sequenz den zuvor genannten Regeln folgte. Entsprechend ihren Antworten wurde Feedback gegeben. Diese Abbildung wurde von Domic-Siede et al.54 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Planung und Steuerung der Aufgabenprogrammierung
- Schreiben Sie ein Skript, das ein Planungsaufgabenparadigma auf der Grundlage der Zoo Map Task66 und Porteus Maze68mit einer Software für Stimulipräsentations-/Verhaltensexperimente programmiert (siehe Materialtabelle und die ergänzende Datei).
- Codieren Sie die Aufgabe unter Berücksichtigung von zwei Bedingungen (einer Planungsbedingung und einer Kontrollbedingung) mit einer ähnlichen Struktur wie in Abschnitt 2 und Abschnitt 4 (siehe Abbildung 2 und die ergänzende Datei).
HINWEIS: Es ist wichtig, unter beiden Bedingungen die gleiche Struktur zu verwenden, um die Störfaktoren und Wahrnehmungskomponenten zu kontrollieren, die am Prozess der Lösung der Aufgabenanforderungen beteiligt sind (Abbildung 2). Die Verwendung der gleichen Struktur verbessert die Bewertung des spezifischen kognitiven Prozesses, der an der kognitiven Planung beteiligt ist. - Synchronisieren Sie die Kommunikation zwischen dem Anzeigecomputer, dem EEG-Computer und dem Host-Computer (Eye-Tracker-Computer) über Ethernet und Parallelport-Kommunikation, bei der TTL-Impulse (Transistor-Transistor-Logik) vom Anzeigecomputer gesendet werden (siehe Abbildung 3).
- Schreiben Sie einen Code zur Kalibrierung der Augenbewegungen mit dem Eye-Tracker-System zu Beginn der Planung und der Steuerungsaufgaben und nach jeweils fünf abgeschlossenen Versuchen, da die Blickposition auf dem Bildschirm für den Ausführungszeitraum entscheidend ist (siehe Schritt 3.2.3 und Schritt 3.3.3 des Protokolls, den Diskussionsteil und den Code in der Ergänzungsdatei).
HINWEIS: Es kann zu Verzögerungen bei der Computerkommunikation kommen. Es gibt mehrere Methoden, um die Verzögerung zwischen TTL-Impulsen auf zwei verschiedenen Computern zu messen, aber ein gängiger Ansatz ist die Verwendung eines Hardwaregeräts wie eines digitalen Oszilloskops oder eines Logikanalysators. Ein anderer Ansatz ist die Verwendung softwarebasierter Methoden, wie z. B. das Senden der TTL-Impulse über eine Netzwerkverbindung und die Verwendung von Netzwerkanalysetools zur Messung der Verzögerung. Ein anderer Ansatz besteht darin, die Uhren der beiden Computer zu synchronisieren, entweder unter Verwendung eines GPS- (Global Positioning System) oder NTP-Servers (Network Time Protocol) oder unter Verwendung einer hardwarebasierten Synchronisationslösung, die Verzögerung zwischen dem Zeitstempel und der Ankunftszeit für jeden Impuls zu berechnen und den Durchschnitt der Ergebnisse zu ermitteln, um die Gesamtverzögerung zwischen den beiden Computern zu erhalten.
- Codieren Sie die Aufgabe unter Berücksichtigung von zwei Bedingungen (einer Planungsbedingung und einer Kontrollbedingung) mit einer ähnlichen Struktur wie in Abschnitt 2 und Abschnitt 4 (siehe Abbildung 2 und die ergänzende Datei).
- Schreiben Sie einen Code für die Planungsaufgabe mit der folgenden Struktur: dem Planungszeitraum, dem Wartungszeitraum, dem Ausführungszeitraum der Planung, dem Reaktionszeitraum und der Rückmeldung (Abbildung 2, Ergänzende Datei).
- Der Planungszeitraum: Initiieren Sie die Planungsbedingung, indem Sie ein Fixationskreuz setzen, das für 3 s als Basislinie dargestellt wird.
- Präsentieren Sie die Reihe von Labyrinthen nach dem Zufallsprinzip nacheinander (36 in dieser Studie).
HINWEIS: In diesem Planungszeitraum werden die Teilnehmer gebeten, einen Pfad zu planen, um die vier Tierstandorte zu besuchen, mit einer maximalen Zeit von 10 Sekunden, und zwar nach einem Regelwerk (die Regeln werden ihnen zuvor erklärt; siehe Abschnitt 5 des Protokolls, um die angegebenen Regeln zu sehen, sowie Abbildung 2). - Fügen Sie einen TTL-Trigger in den Code ein, der den Beginn der Stimuluspräsentation mit einem Tag-Code signalisiert, und senden Sie diesen Trigger an den EEG-Computer und den Eye-Tracker-Host-Computer für weitere engere und fenstergesteuerte Analysen.
- Schreiben Sie in den Code, dass der Planungszeitraum seinen Höhepunkt erreicht, sobald eine Taste von einem Joystick/einer Tastatur gedrückt wird, wenn das Subjekt die Planung beendet oder wenn die maximale Zeit überschritten wird. Die Reaktionszeit (RT) muss für weitere Analysen im Logfile aufgezeichnet werden.
HINWEIS: Für diesen Zeitraum haben wir einen Trigger-Code mit der Zahl 1 verwendet, aber die Verwendung von hierarchischen Ereignisdeskriptoren (HED)-Tags wird anstelle von numerischen Codes empfohlen, da HED-Tags dem Inhalt Bedeutung und Struktur verleihen und es so für andere Forscher oder Mitarbeiter einfacher machen, den Inhalt der Daten zu verstehen. - Die Wartungsperiode: Beginnen Sie diese Periode mit einem verschobenen Fixationskreuz, das für 3 s präsentiert wird. Platzieren Sie das verschobene Fixationskreuz an der räumlichen Position, an der sich das Tor des Labyrinths befindet, um die Startposition (Tor) der Zookarte zu antizipieren (siehe Abbildung 2).
HINWEIS: Dieser Zeitraum dient in dreifacher Hinsicht. Erstens erleichtert das verschobene Fixationskreuz die Ausführung der Leiterbahn, die den geplanten Pfad für die nächste Periode darstellt (siehe Schritt 3.2.8). Zweitens behalten die Teilnehmer in dieser Zeit den während der Planungszeit erarbeiteten Plan in ihrem Arbeitsgedächtnis. Schließlich dient dieser Zeitraum als Intervall zwischen den Versuchen, um das Ende des Planungszeitraums und den Beginn des nächsten Zeitraums, des Planungsausführungszeitraums, abzugrenzen. - Der Ausführungszeitraum der Planung: Nachdem das verschobene Fixationskreuz während der Wartungszeit 3 s lang angezeigt wurde, stellen Sie das Labyrinth erneut dar.
- Senden Sie einen TTL-Auslöser an das EEG und den Host-Eyetracker-Computer, um den Beginn dieser Periode mit einem bestimmten Tag-Code anzuzeigen.
- Schreiben Sie einen Code, um in Echtzeit visuelles Feedback (eine dunkle Linie, siehe Ausführungszeitraum in Abbildung 2) der Blickposition des Probanden etwa 992 ms nach Beginn dieses Zeitraums zu geben.
HINWEIS: Wenn Sie mit einer Verzögerung (ca. 1.000 ms) mit der Abgrenzung beginnen, haben die Probanden Zeit, sich im Labyrinth zu orientieren, sodass sie ihren zuvor geplanten Weg (während des Planungszeitraums) mit einer dunklen Linie abstecken können. - Notieren Sie die Koordinaten der Pfade, um die von den Probanden zurückgelegten Pfade weiter zu rekonstruieren, und bewerten Sie die Leistung offline (siehe Schritt 6.1.1, Abbildung 4).
- Stellen Sie sicher, dass die Zeit für die Verfolgung des geplanten Pfades maximal 10 s beträgt, und lassen Sie die Probanden diesen Zeitraum per Knopfdruck abschließen. Auf diese Weise können die Probanden steuern, wann sie ihren gezeichneten Pfad beendet haben.
- Speichern Sie den RT in der Logdatei für weitere Analysen.
- Der Antwortzeitraum: Schreiben Sie einen Code für die Antwortperiode, die nach 10 s der Planungsausführung oder nach einem Knopfdruck am Ende der Planungsausführungsperiode beginnt, in der das Labyrinth verschwindet, aber die Tiere und ihre räumlichen Positionen auf dem Bildschirm bleiben.
- Platzieren Sie im Antwortzeitraum vier leere Kreise horizontal am unteren Rand des Bildschirms.
ANMERKUNG: Der Zweck dieses Zeitraums besteht darin, den Probanden die Möglichkeit zu geben, die Reihenfolge der während des geplanten Ausführungszeitraums besuchten Tiere anzugeben, indem sie die Tiere in der gleichen Reihenfolge, in der sie sie besucht haben, mit einem Joystick oder einer Tastatur in die Kreise setzen. - Konfigurieren Sie das Programm/den Code so, dass die Probanden mit dem Joystick oder der Tastatur jedes der zuvor vorgestellten Tiere (vier Tiere in dieser Studie) auswählen und in jeden der vier Kreise einfügen können (siehe Zusatzdatei und Abbildung 2).
- Feedback: Schreiben Sie einen Code, um den Teilnehmern 3 Sekunden Feedback zu geben. Ein Daumen-hoch-Bild sollte als Reaktion auf gültige Kombinationen von besuchten Tieren angezeigt werden, wenn die Regeln befolgt werden, während ein Daumen-runter-Bild angezeigt werden sollte, wenn die gemeldete Kombination ungültig ist.
- Senden Sie einen TTL-Trigger, der einen bestimmten Tag-Code für korrektes Feedback und einen anderen Tag-Code für falsches Feedback verwendet, an die EEG- und Eye-Tracker-Computer.
HINWEIS: Der Grund für das Geben von Feedback besteht darin, die Überwachung der Leistung zu erleichtern und die Motivation während der Aufgabe aufrechtzuerhalten. Diese Bereitstellung von Echtzeit-Feedback verstärkt den Belohnungseffekt und fördert die ordnungsgemäße Aufgabenausführung103.
- Schreiben Sie einen Code für die Kontrollaufgabe mit der gleichen Struktur wie die Planungsbedingung: eine Kontrollperiode, eine Wartungsperiode, eine Kontrollausführungsperiode, eine Reaktionsperiode und eine Rückmeldung (siehe Ergänzende Datei, Abbildung 2).
- Der Kontrollzeitraum: Schreiben Sie einen Code für den Zeitraum der Kontrollbedingung, um Störfaktoren zu mindern. Der Code für diese Periode muss mit einem Fixationskreuz beginnen, das für 3 s als Grundlinie dargestellt wird.
HINWEIS: Da die Planungsaufgabe in erster Linie die Umsetzung der Planung erfordert, aber auch andere kognitive Bereiche als Teil der exekutiven Funktion rekrutiert, wie z. B. die visuell-räumliche Funktion, das Arbeitsgedächtnis, die Aufmerksamkeitskontrolle, die hemmende Kontrolle usw.66,88,104,105, ist eine Kontrollaufgabe entscheidend, um Störfaktoren zu mildern. Das Hauptziel dieser Aufgabe besteht also darin, alle kognitiven und wahrnehmungsbezogenen Funktionen zu fordern, die zur Lösung der Planungsaufgabe erforderlich sind, während die Implementierung der kognitiven Planung beseitigtwird 54. - Präsentieren Sie nach dem Zufallsprinzip die Labyrinthe der Kontrollbedingung nacheinander (Labyrinthe mit einem markierten Pfad, der bereits verfolgt wurde). Codieren Sie eine maximale Zeit von 10 s.
- Fügen Sie einen TTL-Trigger in den Code ein, der den Beginn der Stimuluspräsentation mithilfe eines Tags signalisiert, und senden Sie diesen Trigger an den EEG-Computer und den Eye-Tracker-Host-Computer.
- Schreiben Sie in den Code, dass diese Kontrollperiode ihren Höhepunkt erreicht, sobald eine Taste auf einem Joystick/einer Tastatur gedrückt wird, wenn das Motiv beendet ist oder wenn die maximale Zeit überschritten wird.
HINWEIS: Die Probanden werden angewiesen, die markierten Pfade zu bewerten (unabhängig davon, ob sie sich an die Regeln halten oder nicht, siehe Schritt 5.12 für Details zu den Anweisungen, die den Teilnehmern gegeben werden). - Speichern Sie die Reaktionszeit (RT) in der Protokolldatei für weitere Analysen.
- Die Wartungsperiode: Nach Ablauf der Kontrollperiode wird ein verschobenes Fixationskreuz für 3 s präsentiert.
- Als Ausführungszeitraum der Planung platzieren Sie das Befestigungskreuz an der Stelle, an der sich der Toreingang befindet, um das Blickzeichnen für die nächste Periode zu erleichtern.
- Der Ausführungszeitraum der Kontrolle: Präsentieren Sie das Labyrinth erneut und senden Sie gleichzeitig einen TTL-Trigger an das EEG und hosten Sie Eye-Tracker-Computer mit einem Tag, das den Beginn der Ausführungsperiode signalisiert.
- Wiederholen Sie den gleichen Code wie für den Ausführungszeitraum der Planung, um Online-Feedback zur Blickposition zu geben und den Blick mit dem verfolgten Pfad abzugrenzen und zu überlappen.
- Stellen Sie sicher, dass die Zeit für die Verfolgung des Pfades maximal 10 s beträgt, und lassen Sie die Probanden diesen Zeitraum per Knopfdruck abschließen.
- Speichern Sie den RT in der Logdatei für weitere Analysen.
- Die Reaktionszeit der Kontrolle: Wenn der Ausführungszeitraum des Steuerelements abgelaufen ist, stellen Sie ein Fragezeichen ein, das den Antwortzeitraum angibt.
- Programmieren Sie jeweils zwei Tasten, damit die Probanden mit einem Joystick oder einer Tastatur eine Antwort geben können.
HINWEIS: Hier werden die Probanden gebeten zu beantworten, ob die durch die Spur markierte Sequenz korrekt war oder nicht, indem sie eine Taste für richtig/JA und eine andere für falsch/NEIN auswählen. - Speichern Sie die Genauigkeit in der Protokolldatei.
- Feedback: Schreiben Sie einen Code, der 3 Sekunden korrektes Feedback liefert, wenn die Probanden richtig antworten (ein Daumen-hoch-Bild) und 3 s falsches Feedback liefert, wenn die Probanden falsch antworten (ein Daumen-runter-Bild).
- Senden Sie wie in der Planungsbedingung einen TTL-Trigger an das EEG und hosten Sie Eyetracker-Computer mit einem Tag für korrektes Feedback und einem weiteren Tag für falsches Feedback.
- Der Kontrollzeitraum: Schreiben Sie einen Code für den Zeitraum der Kontrollbedingung, um Störfaktoren zu mindern. Der Code für diese Periode muss mit einem Fixationskreuz beginnen, das für 3 s als Grundlinie dargestellt wird.
- Aufgaben der Ausbildung: Erstellen Sie Reize, schreiben Sie einen Code und präsentieren Sie vor den oben genannten Planungs- und Steuerungsaufgaben eine kurze Trainingseinheit von ca. sechs Versuchen/Labyrinthen für jede Bedingung (Planung und Steuerung)
HINWEIS: Die Idee ist, sich mit der Aufgabenstellung vertraut zu machen. Es wird empfohlen, Kriterien für das weitere Vorgehen festzulegen. Wenn in dieser Studie die letzten drei Versuche korrekt waren und die Teilnehmer am Ende der Trainingssitzung angaben, das Ziel und die Vorgehensweise verstanden zu haben, gingen die Teilnehmer zur experimentellen Sitzung über.
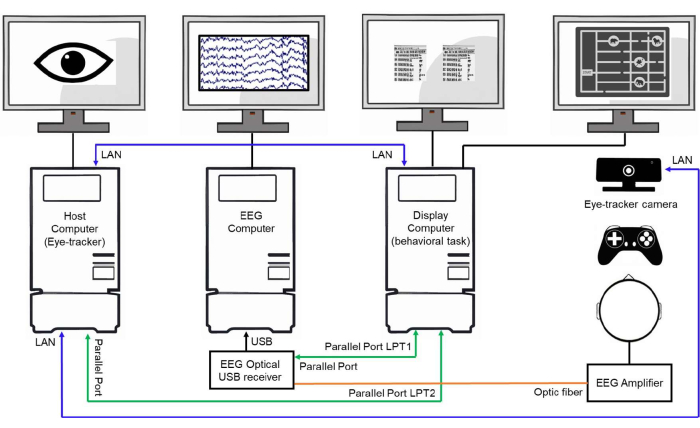
Abbildung 3: Beispiel für einen Laboraufbau. Schematische Darstellung eines Laboraufbaus mit drei miteinander verbundenen Rechnern. Der Host-Computer (Eye-Tracker-Computer) ist für die Verfolgung und Speicherung der Augenbewegungsdaten verantwortlich. Der EEG-Rechner erfasst und speichert die EEG-Signale. Der Anzeigecomputer steuert das Verhaltensexperiment, präsentiert den Probanden die Reize und sendet Ereignisauslöser über parallele Ports und LAN-Verbindungen an den Host und die EEG-Computer, um die Datenerfassung zu synchronisieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Pfadrekonstruktion aus visuellem Online-Feedback, das vom Eye-Tracker-System gegeben wird. Anschauliche Beispiele für eine Pfadrekonstruktion aus der motorischen Ausführung eines Plans (A, in lila, Planungsausführungsperiode) und einer Kontrollausführungsperiode (B, Linie in grün) und mit Eye-Tracker-Daten. Der im Ausführungszeitraum der Planung rekonstruierte Pfad wird verwendet, um die Genauigkeit der einzelnen Planungsaufgabenverläufe zu bewerten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Laboreinrichtung und -ausstattung
- Verwendung eines EEG-Erfassungssystems zur Aufzeichnung der EEG-Aktivität von der Kopfhaut des Teilnehmers, wobei die EEG-Elektroden gemäß dem internationalen 10-20-System106 platziert werden. Positionieren Sie zwei Elektroden auf den Mastoiden des Teilnehmers, um sie offline neu zu referenzieren. Verwenden Sie Elektrookulogramm-Elektroden, um vertikale, horizontale und blinzelnde Bewegungssignale während der visuellen Inspektion zu identifizieren.
- Verwenden Sie für die EEG-Datenerfassung eine EEG-Erfassungssoftware mit einer Abtastrate von 2.048 Hz oder 1.024 Hz und einem Bandpassfilter zwischen 0,1-100 Hz im EEG-Computer.
HINWEIS: Abtastraten von 1.024 Hz und 2.048 Hz bieten eine ausreichende Auflösung, um niederfrequente Schwingungen zu analysieren. Bei der Analyse niederfrequenter Schwingungen ist es wichtig, EEG-Signale mit einer hohen Abtastrate, wie z. B. über 1.000 Hz, zu erfassen, um sicherzustellen, dass die niederfrequenten Signale nicht gealiasert werden. - Verwenden Sie einen Anzeigecomputer, der über parallele Schnittstellen und Ethernet mit dem EEG-Computer und dem Host-Eyetracker-Computer verbunden ist und auf dem eine Plattform zum Ausführen von Verhaltensexperimenten installiert ist, um die Reize auf einen erweiterten Monitor mit einer Mindestauflösung von 1.920 x 1.080 Pixeln und einer Bildwiederholfrequenz von 60 Hz zu projizieren. Platzieren Sie diesen Monitor ca. 82 cm vom Probanden entfernt.
HINWEIS: Wir haben einen 24-Zoll-Monitor mit einer Bildwiederholfrequenz von 144 Hz verwendet, der sich 82 cm vom Teilnehmer entfernt befindet. Es wird empfohlen, einen Monitor mit einer Bildschirmdiagonale von mindestens 19 Zoll für kognitive Experimente zu verwenden, bei denen EEG und Augenbewegungen aufgezeichnet werden. Darüber hinaus wird allgemein empfohlen, den Monitor in einem Abstand zu platzieren, der es dem Teilnehmer ermöglicht, die Aufgabe bequem auszuführen und einen stabilen Blick auf den Bildschirm zu behalten, während gleichzeitig genaue Aufzeichnungen von EEG und Augenbewegungen möglich sind. Es ist ratsam, das Setup zu testen und bei Bedarf anzupassen, um die besten Ergebnisse zu erzielen. - Verwenden Sie ein Eye-Tracking-System, um den Teilnehmern in Echtzeit Feedback zu ihren Augenbewegungen während der Ausführungszeiten zu geben, und erfassen Sie die Pupillengröße. Stellen Sie die Abtastrate auf 1.000 Hz ein, um eine angemessene zeitliche Auflösung zu erzielen.
- Vermeiden Sie Kopfbewegungen. Bewegungseinschränkungen nach links und rechts sowie nach oben und unten sind erforderlich, um das Auge im Sichtfeld der Videokamera zu halten. Eine Vorwärts- und Rückwärtsbewegungsbeschränkung ist erforderlich, um das Auge im Brennweitenbereich der Videokamera zu halten. Verwenden Sie eine Kombination aus Stirn-/Kinnstützen, um die Bewegungen in diesem Bereich zu halten.
- Werten Sie die Leuchtdichte der Stimuli mit einem digitalen Luxmeter oder ähnlichem aus, um Unterschiede zwischen den Planungs- und Kontrollreizen zu vergleichen.
HINWEIS: Ein statistischer Test wie ein t-Test oder Wilcoxon kann verwendet werden, um die Unterschiede zwischen den Stimuli der beiden Bedingungen zu bewerten. - Verwenden Sie einen Steuer-Joystick oder eine Tastatur mit mindestens vier Tasten: zwei Tasten für Ja/Nein-Fragen aus der Steuerungsbedingung; eine dieser beiden Tasten, um Prüfungen zu beenden; und zwei weitere Schaltflächen für die Reaktionszeit der Planungsbedingung, um sich vorwärts oder rückwärts zu bewegen, um die Tiere in jeden der vier Kreise am unteren Bildschirmrand einzufügen.
5. Elektroenzephalographie und Eye-Tracking-Aufnahmesitzungen
- Lassen Sie die Teilnehmer vor Beginn der Studie eine schriftliche und unterschriebene Einverständniserklärung ausfüllen.
- Bitten Sie die Teilnehmer vor der Aufnahmesitzung, kein Make-up zu tragen (Mascara und Eyeliner können vom Eye-Tracker-System als Pupille erkannt werden), Drogen oder Koffeineingenommen zu haben 107,108 oder wenn sie starke Müdigkeit109 verspüren (Stress, Schlafentzug usw.).
- Lassen Sie die Teilnehmer eine demografische Umfrage ausfüllen, um Informationen über ihr Geschlecht, Alter, Händigkeit, Muttersprache und neuropsychiatrische Vorgeschichte über das MINI-International neuropsychiatrische Interview97 zu erhalten, das von einem ausgebildeten Psychologen durchgeführt wird.
- Reinigen Sie die Stirn, die Kopfhaut, die Mastoide und die Hautposition des Elektrookulogramms (EOG) des Probanden mit einem Alkoholtupfer.
- Platzieren Sie alle externen Elektroden auf dem Teilnehmer. Platzieren Sie den horizontalen EOG bipolar auf den äußeren Canthi beider Augen und den vertikalen EOG über und unter dem rechten Auge des Teilnehmers. Setzen Sie zwei externe Elektroden auf den rechten und linken Mastoid für eine spätere erneute Referenzierung.
- Messen Sie den Kopf des Probanden und platzieren Sie die EEG-Kappe in der richtigen Größe gemäß dem erweiterten internationalen 10-20-System. Um dies zu tun, suchen und platzieren Sie die Cz-Elektrode wie folgt:
- Identifizieren Sie die Mittellinie der Kopfhaut, indem Sie den Haaransatz und die Oberseite der Nase visuell inspizieren. Identifizieren Sie eine Linie, die diese beiden Punkte verbindet, um die Mittellinie zu definieren.
- Suchen Sie die Datei Cz. Der Cz ist typischerweise definiert als der Mittelpunkt zwischen den beiden präaurikulären Punkten (d. h. den Punkten, die sich direkt vor jedem Ohr befinden). Lokalisieren Sie diese Punkte, und identifizieren Sie dann eine Linie, die sie verbindet, um die ungefähre Position der Cz zu identifizieren.
- Messen und markieren Sie die Cz. Messen Sie den Abstand von der Nase (d.h. der knöchernen Ausstülpung an der Nasenspitze) zur Cz. Der Abstand von der Nase zum Cz beträgt typischerweise etwa 53 % des gesamten Kopfumfangs im 10-20-System. Markieren Sie die Position des Cz mit einem Stift oder einem anderen Markierungswerkzeug.
HINWEIS: Es ist wichtig, ein konsistentes und standardisiertes Verfahren für die Elektrodenplatzierung zu befolgen, um Fehler zu minimieren und die Gültigkeit der EEG-Daten sicherzustellen. Es wird empfohlen, ein Standard-Einstufungsverfahren zu entwickeln. Erstellen Sie ein Standardverfahren für die Platzierung der Elektroden auf der Kopfhaut jedes Probanden und stellen Sie sicher, dass für jedes Subjekt das gleiche Verfahren angewendet wird. Falls ein Team oder Personal die Aufnahmen durchführt, schulen Sie die Techniker oder Forschungsassistenten in der richtigen Platzierungsprozedur, um sicherzustellen, dass sie die Elektroden konsistent und genau platzieren. Darüber hinaus wäre die Digitalisierung der Elektrodenpositionen für jedes Subjekt ein wünschenswerter Ansatz, um später eine Quellenanalyse durchführen zu können. In EEG-Studien ist die genaue dreidimensionale (3D) Position jeder Elektrode am Kopf des Probanden häufig eine Voraussetzung, um eine Korrelation zwischen den EEG-Daten und der entsprechenden Gehirnaktivität herzustellen110. Diese Informationen sind auch entscheidend für die korrekte Ausrichtung der EEG-Daten mit anatomischen Bildern, die aus MRT- oder CT-Bildgebungsverfahren abgeleitet wurden111,112.
- Führen Sie mit einer Spritze mit einer stumpfen Nadel leitfähiges Gel in jedes Loch der Kappe ein und entfernen Sie die Haare des Teilnehmers mit der Spitze. Setzen Sie anschließend alle Kopfhautelektroden auf die EEG-Kappe.
- Überprüfen Sie die Impedanzen mit der EEG-Aufzeichnungssoftware und stellen Sie sicher, dass sie unter dem vom EEG-System empfohlenen Widerstandsniveau liegen.
- Bitten Sie den Teilnehmer, während des Experiments so ruhig wie möglich zu bleiben. Untersuchen Sie das EEG-Signal und testen Sie es, indem Sie den Teilnehmer bitten, zu blinzeln, einen Kiefer zu machen und einige Sekunden mit geschlossenen Augen zu bleiben.
- Setzen Sie den Teilnehmer in einen dunklen und schallgedämpften Raum. Verwenden Sie eine Kinnstütze, um den Kopf zu stabilisieren und Bewegungen zu minimieren, und überprüfen Sie, ob zwischen der Kinnstütze und der Mitte des Reiz-Präsentationsbildschirms ein Abstand von ca. 82 cm besteht.
- Platzieren Sie einen Joystick oder eine Tastatur vor dem Teilnehmer, um die Antworten zu erhalten.
- Anweisungen: Geben Sie mündliche Anweisungen mit visuellen Hilfsmitteln, bevor Sie mit jeder Bedingung beginnen (Planung und Kontrolle). Fügen Sie in die Anleitung visuelle Beispiele für die Reize ein und erklären Sie, wie die Labyrinthe in den Planungs- bzw. Kontrollbedingungen gelöst werden können.
- Für die Planungsaufgabe weisen Sie die Probanden an, einen Weg zu finden, um eine Abfolge von Besuchen zu bestimmten Tierorten (vier Orte in dieser Studie) an verschiedenen Orten des Labyrinths in beliebiger Reihenfolge und nach einer Reihe von Regeln durchzuführen: "(1) Planen Sie den Weg so schnell wie möglich innerhalb von maximal 10 s; (2) Beginne am Tor und beende den Weg beim vierten besuchten Tier; (3) Passieren Sie nicht zweimal denselben Weg oder dieselbe Ecke. (4) Überqueren Sie keine Sackgasse; (5) Überquere keinen Weg senkrecht"54.
HINWEIS: Für Regel 2 bis Regel 5 empfehlen wir, dem Teilnehmer visuelle Beispiele zu zeigen. - Starten Sie anschließend die Schulungssitzung für Planungsaufgaben mit sechs Versuchen.
HINWEIS: Weisen Sie die Teilnehmer an, vor jeder Eye-Tracker-Kalibrierungsperiode zu melden, wenn es Probleme bei der Ausführung der Aufgabe gab, insbesondere bei der Abgrenzung des Pfades während des Ausführungszeitraums. Notieren Sie, ob es eine Testversion gab, um die Offline-/Nachbearbeitung zu überprüfen (siehe Schritt 6.1.1). - Weisen Sie die Probanden an, für die Kontrollbedingung zu bewerten, ob der bereits markierte Pfad im Labyrinth unter Berücksichtigung der zuvor gelernten Regeln korrekt oder falsch erstellt wurde.
HINWEIS: Geben Sie Beispiele mit visueller Unterstützung, wie die Labyrinthe ohne Planungsstrategien bewertet werden können, z. B. nicht zu versuchen, einen neuen Pfad zu planen, wenn Fehler erkannt werden (z. B. Zeichnungen, die denselben Pfad zweimal verwenden, eine Sackgasse überqueren usw.). Wenn ein Fehler gefunden wird, sollte der Fokus ausschließlich auf der Meldung der Erkennung des Fehlers und nicht auf der Korrektur des Pfads liegen. Fragen Sie die Teilnehmer nach jedem Versuch nach den Strategien, die sie umgesetzt haben. Geben Sie dann mündliches Feedback zu ihrer Leistung, um sicherzustellen, dass sie die gezeichneten Pfade bewertet und die Planung neuer Wege vermieden haben. Starten Sie anschließend die Trainingssitzung für Kontrollaufgaben mit sechs Versuchen.
- Für die Planungsaufgabe weisen Sie die Probanden an, einen Weg zu finden, um eine Abfolge von Besuchen zu bestimmten Tierorten (vier Orte in dieser Studie) an verschiedenen Orten des Labyrinths in beliebiger Reihenfolge und nach einer Reihe von Regeln durchzuführen: "(1) Planen Sie den Weg so schnell wie möglich innerhalb von maximal 10 s; (2) Beginne am Tor und beende den Weg beim vierten besuchten Tier; (3) Passieren Sie nicht zweimal denselben Weg oder dieselbe Ecke. (4) Überqueren Sie keine Sackgasse; (5) Überquere keinen Weg senkrecht"54.
- Überprüfen Sie das EEG-Signal, um sicherzustellen, dass alle Kanäle korrekt erfasst werden. Starten Sie die EEG-Aufzeichnung.
- Kalibrieren Sie den Eyetracker.
HINWEIS: Überprüfen Sie, ob der Eyetracker in der Lage ist, die Blickposition zu bestimmen, wenn der Teilnehmer seinen Blick auf verschiedene Bereiche des Bildschirms richtet.- Informieren Sie den Teilnehmer darüber, dass der Eyetracker kalibriert wird und dass er einen weißen Kreis (mit einem kleinen grauen Punkt) sehen wird, der sich zufällig zu den vier Ecken des Bildschirms bewegt (Fünf-Punkt-Kalibrierungsverfahren). Weisen Sie sie an, ihren Blick auf den Kreis zu fixieren, und weisen Sie sie darauf hin, dass sie, wenn er sich an eine andere Stelle bewegt, der Position des Kreises folgen und ihren Blick wieder auf diese neue Position richten sollen.
- Führen Sie das Experiment durch, beginnen Sie mit dem Speichern der Augenbewegungen, indem Sie auf Ausgabe/Aufzeichnung klicken, und bitten Sie den Teilnehmer, den zuvor gegebenen Anweisungen zu folgen, um ihn darüber zu informieren, dass das Experiment nun beginnen wird.
- Bewahren Sie den Laborraum in einer dunklen Umgebung auf. Die größten Veränderungen der Pupillenerweiterung treten als Reaktion auf Änderungen der Leuchtdichteauf 113. Halten Sie ein konstantes Lichtniveau in der Versuchsumgebung aufrecht.
6. Datenanalysen
- Verhaltensanalysen
- Analysieren Sie die Verhaltensdaten mit Hilfe von Statistiksoftware (siehe Materialtabelle). Messen Sie die Genauigkeit (prozentuale Rate genauer Antworten) als quantitativen Verhaltensparameter sowohl unter den Planungs- als auch unter den Kontrollbedingungen. Verwenden Sie für die Planungsbedingung Eye-Tracker-Daten (x- und y-Koordinaten der Blickposition), um die während des Ausführungszeitraums zurückgelegten Pfade offline nachzubilden und die Genauigkeit der geplanten Pfade im Vergleich zu den tatsächlich verfolgten Pfaden zu ermitteln (Abbildung 4). Überprüfen Sie dazu manuell die Kongruenz zwischen den im Antwortzeitraum richtig/falsch vorgenommenen Kombinationen und der vorgenommenen Ablaufverfolgung.
- Berechnen Sie die RT, d. h. die durchschnittliche Zeit, die für das Lösen der Labyrinthe für den Planungszeitraum aufgewendet wurde, und die durchschnittliche Zeit, die für die Auswertung der markierten Pfade für den Kontrollzeitraum aufgewendet wurde.
- Berechnen Sie den mittleren RT der Ausführungszeiträume für die Planungs- und Steuerungsbedingungen. Verwenden Sie insbesondere die RT, die nur den richtigen Studien entspricht.
HINWEIS: Ergänzend ist es möglich, den in Domic-Siede et al.54 beschriebenen linearen integrierten Geschwindigkeits-Genauigkeits-Score (LISAS)114,115 zu verwenden, der ein kombiniertes Maß bietet, das Reaktionszeit und Genauigkeit berücksichtigt. Da die Reaktionszeit während des Ausführungszeitraums der Planung und die Genauigkeit der Planung miteinander zusammenhängen, kann der LISAS verwendet werden, um einen Index zu berechnen, der die Reaktionszeit berücksichtigt, die um die Anzahl der gemachten Fehler korrigiert wurde. Darüber hinaus kann der LISASS-Index auch verwendet werden, um die Korrelation zwischen elektrophysiologischen Signalen und der Verhaltensleistung zu bewerten. Sie wird als lineare Kombination aus Reaktionszeit (RT) und Fehleranteil (PE) berechnet. - Bewerten Sie die Homoskedastizität mit einem statistischen Test wie dem Levene-Test116,117 und testen Sie die Normalität mit dem D'Agostino- und Pearson-Omnibus-Normalitätsverteilungstest118 oder dem Shapiro-Wilk-Test119, um den richtigen statistischen Test für Vergleiche (parametrisch oder nicht-parametrisch) auszuwählen.
- Bewerten, ob die Planungskomponente in der Planungsbedingung kognitiv anspruchsvoller ist als die Kontrollbedingung, indem entweder der Wilcoxon-Vorzeichen-Rang-Test120 oder der Matched-Pair-t-Test121 verwendet wird, um die Verhaltensparameter zwischen den Bedingungen zu vergleichen.
HINWEIS: Überprüfen Sie auf diese Weise, ob das Verhaltensparadigma optimal ist, um die kognitive Planung zu bewerten. - Trennen Sie die Versuche in der Planungsbedingung in die Kategorien "leicht" und "schwierig" (siehe Schritt 2.2) und verwenden Sie dann einen Matched-Pair-t-Test, um die Genauigkeit und die Reaktionszeiten in den Planungs- und Ausführungszeiträumen zwischen den "leichten" und "schwierigen" Versuchen zu vergleichen.
- EEG und Vorverarbeitung von Augenbewegungen
- Führen Sie die in den folgenden Punkten erläuterte EEG-Datenvorverarbeitungspipeline mit selbst erstellten Skripten und/oder etablierten Werkzeugkästen, wie sie in Delorme und Makeig122, in Dimigen et al.123 und in Mognon et al.124 beschrieben sind, in einer Programmiersprachensoftware durch (siehe Materialtabelle).
- Synchronisieren Sie die Augenbewegungsaktivität mit den EEG-Aufzeichnungen, um die Fixationen, Sakkaden und Blinzelereignisse für eine bessere visuelle Inspektion oder weitere Analysen zu importieren (siehe Schritt 3.1.2 und die Ergänzungsdatei).
HINWEIS: In dieser Studie haben wir die Zeitstempel auf den Eye-Tracking-Daten und die Zeitstempel auf den EEG-Daten, wie in Domic-Siede et al.54 und in Dimigen et al.123 beschrieben, verwendet, um die Augenbewegungsereignisse in die EEG-Daten in einer Programmiersprachensoftware zu importieren. - Reduzieren Sie die Daten auf 1.024 Hz, falls sie bei 2.028 Hz aufgezeichnet wurden, um den Rechenaufwand zu reduzieren.
HINWEIS: Eine Abtastrate von 1.024 Hz ist entsprechend dem interessierenden Frequenzbereich von 4-8 Hz, der erwarteten Frequenzauflösung und den Rechenanforderungen der Analyse ausreichend. - Beziehen Sie das EEG-Signal auf den Durchschnitt der Elektroden auf den Mastoiden.
HINWEIS: Andere Referenzen sind möglich. Die Wahl der Referenz kann sich auf die Ergebnisse der EEG-Analyse und die Interpretation der Daten auswirken, daher ist es wichtig, die Vor- und Nachteile der verschiedenen Referenzierungsoptionen sorgfältig abzuwägen. Die Referenz für den durchschnittlichen Mastoid ist eine beliebte Wahl für EEG-Studien, da sie eine stabile Referenz bietet, die leicht zu berechnen ist, und sich bei der Analyse vieler verschiedener EEG-Signale als wirksam erwiesen hat. Die Bezugnahme der EEG-Daten auf den Durchschnitt der Mastoide (bekannt als durchschnittliche Mastoidreferenz) ist ein gängiger Ansatz zur Analyse der frontalen Thetaaktivität in EEG-Daten der Kopfhaut. Die Mastoidelektroden befinden sich in der Nähe des Ohres und dienen als Referenz für die EEG-Signale. Die Bezugnahme auf den Durchschnitt der Mastoide kann dazu beitragen, den Einfluss von Rauschen und Artefakten, die nicht von Interesse sind, zu reduzieren und gleichzeitig eine Auslöschung des interessierenden Signals zu vermeiden, was dem Benutzer hilft, eine klarere Darstellung der EEG-Signale zu erhalten. - Wenden Sie mit einer Programmiersoftware eine Nullphasen-Endimpulsantwort (FIR) mit einer Hochpass-Grenzfrequenz von 1 Hz und einer Tiefpass-Grenzfrequenz von 40 Hz auf das erweiterte Signal (ohne Epochierung) an.
HINWEIS: In dieser Studie haben wir die in Delorme und Makeig122 beschriebene Toolbox verwendet. - Unterteilen Sie die Daten für jede Bedingung unter Berücksichtigung der Anzahl der Versuche in Epochen, die sich um den Beginn der Planungs- bzw. Kontrollperioden drehen. Verwenden Sie die 1 s vor dem Start der Labyrinthpräsentation als Basislinie und 4 s nach dem Planungs- oder Kontrollzeitraum als die interessierenden Segmente. Verwenden Sie eine Programmiersprache.
HINWEIS: In dieser Studie haben wir die in Delorme und Makeig122und 36 Epochen/Versuche beschriebene Toolbox verwendet. - Erstellen Sie eine zweite Segmentierung, die sich um das Ende der Planungs- und Kontrollperioden dreht, wobei 4 s vor dem Ende und 1 s danach als Wartungszeitraum verwendet wird.
HINWEIS: Der Grund für die Auswahl der ersten und letzten 4 s der Planungs- und Kontrollperioden (Schritt 6.2.6 und Schritt 6.2.7) besteht darin, dass die Dauer jeder Periode unter beiden Bedingungen variieren kann und die Analyse der ersten und letzten Sekunden der Planung einen umfassenderen Überblick über den Planungsprozess bieten kann. Somit sind diese Fensterlängen ausreichend und ausreichend, um die der Planung zugrunde liegende oszillatorische Dynamik zu analysieren. - Führen Sie über das segmentierte Signal den Logistic Infomax-ICA-Algorithmus (Independent Components Analysis)125aus, um künstliche Komponenten zu identifizieren und zu entfernen.
- Verwenden Sie das in Plöchl et al.126empfohlene Kriterium des Sakkaden-zu-Fixations-Varianzverhältnisses, um potenzielle verrauschte Komponenten automatisch zu erkennen, und verwenden Sie den automatischen EEG-Artefaktdetektor, der auf der gemeinsamen Verwendung von räumlichen und zeitlichen Merkmalen basiert, die in Mognon et al.124 empfohlen werden.
ANMERKUNG: Wir empfehlen die Verwendung des unabhängigen Komponentenklassifikators, der in Pion-Tonachini et al.127 vorgeschlagen wurde und unabhängige Komponentenklassifikationen als Zusammensetzungsvektoren in sieben Kategorien schätzt, was bei der Identifizierung von Artefakten hilft. - Untersuchen Sie andere potenzielle künstliche Komponenten wie EMG, Elektrodenbewegungen oder Komponenten, die nichts mit dem Gehirn zu tun haben. Validieren Sie die Ablehnung dieser Komponenten, indem Sie die Topographien, Spektren und Aktivierungen im Zeitverlauf visuell überprüfen.
- Interpolieren (sphärische Interpolation) verrauschter Kanäle durch automatische Kanalunterdrückung unter Verwendung des Kurtosis-Kriteriums (mit einem Z-Score von 5 als Schwellenwert).
- Zeit-Häufigkeits-Analysen
- Führen Sie eine kurzzeitige schnelle Fourier-Transformation (FFT) (1 Hz bis 40 Hz) mit einer Fensterlänge von 250 ms und einem Zeitschritt von 5 ms durch. Verwenden Sie ein Hanning-Fenster. Verwenden Sie den Z-Wert, um die Zeit-Häufigkeits-Diagramme auf die Grundlinie (-1 s bis -0,1 s) zu normalisieren.
HINWEIS: Die Visualisierung des Spektrums unterliegt einem Kompromiss zwischen der Fenstergröße und der zeitlichen Auflösung. Um einen umfassenden Überblick über das gesamte Spektrum einschließlich des Theta-Bereichs von 4 Hz bis 8 Hz zu erhalten, empfehlen wir, die untere Grenze der Fenstergröße von 250 ms zu verwenden, um bei jedem Versuch und jeder Aufgabe eine höhere zeitliche Auflösung zu gewährleisten. Zusätzlich empfehlen wir die Verwendung eines Hanning-Fensters, da dies in diesen Fällen weithin als herkömmliche Wahl angesehen wird. Für eine bessere Auflösung in Zeit und Häufigkeit sehen Sie sich die weiteren Schritte an. - Wählen Sie ein Zeit-Frequenz-Diagramm aus einer frontozentralen Elektrode, z. B. Fz, oder einer gemittelten Gruppe von Frontalelektroden aus.
ANMERKUNG: Betrachten Sie die breite Evidenz bezüglich des Zusammenhangs zwischen kognitiver Kontrolle und frontaler Mittellinien-Theta 12,128,129. - Wählen Sie Zeit-Frequenz-Diagramme ohne frontale Steuerung von Elektroden wie den Pz- und Oz-Elektroden aus, um die Vergleiche fortzusetzen.
- Führen Sie für die Front- und Steuerelektroden einen nichtparametrischen clusterbasierten Permutationstest für gepaarte Stichproben mit einem p-Wert < 0,05 für die Vergleiche der Zeit-Frequenz-Diagramme auf Gruppenebene aus beiden Bedingungen durch. Verwenden Sie die Monte-Carlo-Methode mit 1.000 zufälligen Ziehungen. Verwenden Sie den maximalen Statistikwert des Clusters, um den Permutationstest130 durchzuführen.
- Mittelwerte das Theta-Frequenzband (4-8 Hz) aus den ersten 4 s der Planung bzw. Steuerung bzw. der letzten 4 s Segmente.
- Vergleichen Sie die gemittelte Theta-Aktivität zwischen den Bedingungen mit einem Matched-Pair-t-Test oder einem Wilcoxon-Test mit vorzeichenbehaftetem Rang.
- Analysieren Sie das Zeitprofil der Theta-Aktivität. Um dies zu erreichen, wird der Frequenzbereich von 4-8 Hz über die Versuche nach Probanden gemittelt.
- Vergleichen Sie die Theta-Aktivitätsdynamik zwischen den Bedingungen mithilfe eines Wilcoxon-Tests mit Vorzeichenrang, der mit der False Discovery Rate (FDR) gepaart und korrigiert wurde.
HINWEIS: Wir haben im Wilcoxon-Test 88-ms-Schritte mit nicht überlappenden Fenstern verwendet.
- Führen Sie eine kurzzeitige schnelle Fourier-Transformation (FFT) (1 Hz bis 40 Hz) mit einer Fensterlänge von 250 ms und einem Zeitschritt von 5 ms durch. Verwenden Sie ein Hanning-Fenster. Verwenden Sie den Z-Wert, um die Zeit-Häufigkeits-Diagramme auf die Grundlinie (-1 s bis -0,1 s) zu normalisieren.
- Rekonstruktion der Quelle
- Verwenden Sie eine Toolbox für die Rekonstruktion der Quellenanalyse, wie z.B. die in Tadel et al.131 beschriebene Open-Access-Toolbox oder eine ähnliche Toolbox.
- Berechnen Sie die Quellen des vorverarbeiteten EEG-Signals aus den ersten 4 s der Planung unter Verwendung eines Algorithmus wie der standardisierten niedrig aufgelösten elektromagnetischen Hirntomographie (sLORETA)132und der Minimum-Norm-Bildgebungsmethode sowie der symmetrischen Randelementmethode (symmetrisches BEM) mit Hilfe eines Werkzeugkastens, wie er in Gramfort et al.133beschrieben ist, um das inverse Problem zu lösen.
- Verwenden Sie den Quellalgorithmus (sLORETA-Algorithmus in dieser Studie) auf einer anatomischen MNI-Vorlage (wir haben die MNI-Vorlage in Brainstorm "Colin27" verwendet) mit den Standard-Elektrodenpositionen für jeden Teilnehmer, falls es keine 3D-Digitalisierung der Elektroden gibt (siehe Schritt 5.6).
HINWEIS: Es ist zu beachten, dass die Verwendung der Standard-Elektrodenpositionen nicht die effizienteste Methode zur Bestimmung der Quellen der Gehirnaktivität ist. Es kann jedoch immer noch ein allgemeines Verständnis für den Ursprung der Aktivität vermitteln. Es ist wichtig zu bedenken, dass es sich bei den mit diesen Methoden erhaltenen Lokalisierungsquellen um grobe Annäherungen handelt, die bei der Analyse der Ergebnisse mit Vorsicht interpretiert werden sollten. - Wenden Sie einen 4-8 Hz Bandpassfilter auf das vorverarbeitete Signal an.
- Wenden Sie eine Z-Score-Normalisierung an, indem Sie den Zeitraum von -1.000 ms bis -10 ms vor Beginn der Studie als Ausgangswert verwenden.
- Berechnen Sie den Durchschnitt der Theta-Aktivität in einem interessierenden Zeitfenster zwischen 1 s und 4 s nach Beginn der Studie.
- Vergleichen Sie die durchschnittlichen Raumquellen zwischen den Bedingungen unter Verwendung eines nicht-parametrischen Permutationszeichentests mit Monte-Carlo-Stichproben (1.000 Randomisierungen)131.
- Um die Regions of Interest (ROIs) zu bestimmen, beschriften Sie den Kortex mit einem Gehirnatlas.
HINWEIS: Wir haben den Destrieux Atlas134 verwendet, der in der in Tadel et al.131 beschriebenen Toolbox implementiert ist. - Wählen Sie die interessierenden Hirnregionen (ROIs) aus.
HINWEIS: Wir berücksichtigten die Evidenz, die berichtet, dass die präfrontalen Kortexregionen, wie z. B. die bilateralen oberen frontalen Gyri (SF), die bilateralen transversalen frontopolaren Gyri und Sulci (FP), die bilaterale ACC, die bilaterale MCC und der bilaterale dorsolaterale präfrontale Kortex137,138, an kognitiven Kontrollfunktionen beteiligt sind135, 136. - Führen Sie für jede ROI eine Hauptkomponentenanalyse (PCA) für das vorherige vorverarbeitete EEG-Signal (Bereich von 1-40 Hz) durch und verwenden Sie den ersten Modus der PCA-Zerlegung für jede ROI.
- Führen Sie eine Spektralanalyse unter Verwendung einer kurzzeitigen schnellen Fourier-Transformation durch und vergleichen Sie die Ergebnisse zwischen dem linken und dem rechten interessierenden Bereich unter Verwendung eines nicht-parametrischen, clusterbasierten Permutationstests130.
- Extrahieren Sie die linken und rechten ROIs, die keine Unterschiede aufweisen, und stellen Sie sie als eine bilaterale Zeitreihe dar: SF, ACC und MCC. Zeichnen Sie dann Zeit-Häufigkeits-Diagramme, und vergleichen Sie die Bedingungen.
- Vergleichen Sie die Zeit-Häufigkeits-Diagramme entsprechend dem Komplexitätsgrad der Planungsaufgabe (einfache versus schwierige Versuche) für jeden ROI.
- Spiegeln Sie den Rand des Signals für jedes der 512 Samples und führen Sie einen Bandpassfilter zwischen 4 Hz und 8 Hz für die ausgewählten ROIs durch.
- Wenden Sie eine Hilbert-Transformation an, um die momentane Amplitude139unter Verwendung einer Signalverarbeitungs-Toolbox aus einer Programmiersprachensoftware zu erhalten (siehe Materialtabelle).
- Korrigieren Sie das Signal mit Hilfe der Z-Score-Normalisierung (-1.000 bis -10 ms als Ausgangswert) und mitteln Sie den Durchschnitt der Studien nach Proband.
- Vergleichen Sie jedes ROI-Thetaband-Zeitprofil zwischen den Bedingungen mit dem Wilcoxon-Vorzeichen-Rang-Test (übereinstimmende Paare, 1 s nicht überlappende Fenster) und korrigieren Sie es mit dem FDR.
- Zusammenhänge zwischen EEG-Aktivität und Verhaltensleistung
- Normalisieren Sie die Quellzeitreihe der ROIs mithilfe des Z-Scores auf die Baseline. Wählen Sie ein Fenster zwischen 1 s und 4 s nach dem Planungs- oder Kontrollbeginn (in dem eine ausgeprägte Theta-Aktivität in den Zeit-Frequenz-Diagrammen beobachtet wird).
- Um die Zunahme der Theta-Aktivität in der Planungsbedingung im Vergleich zur Kontrollbedingung zu bestimmen, transformieren Sie zunächst das Signal in den Frequenzbereich (1-40 Hz) unter Verwendung des Multitaper-Verfahrens durch eine Toolbox wie die Chronux-Toolbox140 für jede Bedingung und Quelle in den interessierenden Regionen.
- Berechnen Sie die durchschnittliche Frequenz des Theta-Bandes (4-8 Hz) und berechnen Sie zwei Maße der Theta-Leistung: i) die Differenz zwischen der Theta-Leistung während des Planungszeitraums (θ Planung) und der Kontrollperiode (θ Kontrolle), bezeichnet als Δ Theta, und ii) die relative Zunahme der Theta-Aktivität, ausgedrückt als Verhältnis von Δ Theta (Δ θ) und der Theta-Aktivität während der Kontrollperiode (θ Kontrolle), wie in Domic-Siede et al.54:
 (1)
(1)

- Berechnen Sie zwei Verhaltensparameter: iii) Δ LISAS-Planung, indem LISAS-Steuerung von der LIAS-Planung subtrahiert wird, und iv) Δ LISAS-Planungsausführung, indem Sie die LINAS-Kontrollausführung von der LINAS-Planungsausführung subtrahieren, wie in Domic-Siede et al.54:


- Führen Sie Spearmans Rho-Korrelationen mit den elektrophysiologischen und Verhaltensparametern durch, die berechnet und dann durch den FDR korrigiert werden.
- Analyse der Augenbewegungen: Führen Sie die folgende Analyse durch, um die potenziellen Unterschiede in den Augenbewegungen für jede Bedingung zu kontrollieren, die zu unterschiedlichen Schwingungsdynamiken führen können:
- Bestimmen Sie die Sakkadenamplitude und die Spitzengeschwindigkeit der Sakkade aus dem gesamten Versuch und von 0 s bis 3,75 s während der Planungs- und Steuerungsbedingungen.
- Vergleichen Sie die Ergebnisse entweder mit dem Wilcoxon-Test mit Vorzeichenrang oder dem t-Test mit übereinstimmenden Paaren, je nachdem, welcher Wert geeignet ist.
HINWEIS: Eine Toolbox, wie sie in Dimigen et al.123beschrieben ist, kann hilfreich sein. - Berechnen und bewerten Sie die Kohärenz zwischen der Fourier-EEG-Leistung an einer frontalen Elektrode (z. B. der Fz oder einer gemittelten frontalen ROI-Elektrode) und der Sakkadenrate, wie in Sato und Yamaguchi141 beschrieben.
- Verwenden Sie den Wilcoxon-Vorzeichen-Rang-Test, um die Kohärenz-Power-Sakkaden-Ratenwerte der ersten 4 s jedes Versuchs zwischen den beiden Bedingungen zu vergleichen.
Ergebnisse
Im vorliegenden Protokoll wurde die RT der Planungsperiode mit den RTs der Kontrollperiode und der Planungsausführungsperiode verglichen. Die Planungs-RT war größer als die Kontroll- und die Planungsausführungsperiode. Darüber hinaus machten die Teilnehmer im Vergleich zur Kontrollbedingung während der Planungsperiode mehr Fehler und wiesen eine geringere Genauigkeit auf (Abbildung 5).

Abbildung 5: Reaktionszeit und Genauigkeit für die Planungsaufgabe. Vergleich zwischen den (A) Reaktionszeiten im Planungszeitraum (violette Kreise) und im Kontrollzeitraum (grüne Kreise) mittels eines Matched-Paired-Paired-t-Tests. (B) Vergleich zwischen den Reaktionszeiten im Planungszeitraum (violette Kreise) und dem Planungsausführungszeitraum (violette Quadrate) unter Verwendung eines matched-paired t-Tests. (C) Vergleich der Genauigkeitsrate in der Planungsbedingung (violette Rauten) und der Kontrollbedingung (grüne Rauten) unter Verwendung eines Wilcoxon-Vorzeichen-Rang-Tests. Diese Abbildung wurde von Domic-Siede et al.54 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Darüber hinaus zeigte die Analyse der Planungskomplexitätsstufen signifikante Unterschiede in der Genauigkeit und den Reaktionszeiten (RTs) zwischen den "schwierigen" und "einfachen" Stufen während der Planung und Ausführung (Abbildung 6). Das "schwierige" Level hatte längere RTs und eine geringere Genauigkeit. Diese Ergebnisse deuten darauf hin, dass die Aufteilung der Versuche anhand der Anzahl gültiger Lösungen zwischen "leichten" und "schwierigen" Versuchen unterscheiden kann.

Abbildung 6: Vergleich der Verhaltensleistung auf den verschiedenen Komplexitätsstufen. Signifikante Unterschiede in der Verhaltensleistung auf den Komplexitätsstufen "leicht" und "schwierig" wurden mit Hilfe eines Matched-Pair-t-Tests identifiziert. Während der Planung und Ausführung wurden für die "leichte" Stufe im Vergleich zur "schweren" Stufe niedrigere Reaktionszeiten (RTs) festgestellt, und die Genauigkeit war für die "leichte" Stufe höher. Die Fehlerbalken stellen das SEM (Standardfehler des Mittelwerts) dar. Diese Abbildung wurde von Domic-Siede et al.54 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diese Ergebnisse deuteten darauf hin, dass die Planungsaufgabe kognitiv komplexer, anspruchsvoller, herausfordernder und zeitaufwändiger war, wenn die Planungskomponente erfolgreich aus der Kontrollbedingung entfernt wurde (durch Instruktionsmanipulation). So konnten die durch die Aufgaben induzierten neuronalen Korrelate miteinander verglichen werden.
Um die frontale Theta-Aktivität der Mittellinie während der Planung zu analysieren, wurde das durchschnittliche Theta-Frequenzband während der Planung für die Fz-Elektrode mit dem der Kontrollperiode verglichen, und es wurde ein signifikanter Anstieg der Theta-Band-Frequenz während der Planung festgestellt (Abbildung 7).

Abbildung 7: Frontale Theta-Aktivität in der Mittellinie während der kognitiven Planung. (A) Topographische Karten, die die Theta-Band-Leistung aller Probanden darstellen, normiert auf die Z-Werte während der Planungsaufgabe (links), der Kontrollaufgabe (Mitte) und des Planungseffekts (rechts). Während der kognitiven Planung zeigten die Probanden eine Zunahme der Theta-Aktivität in der frontalen Mittellinie. Der Farbbalken zeigt die Z-Werte zwischen -0,5 und 1,5 an. (B) Ein Violin-Diagramm, das die minimalen, Quartile, Median- und maximalen Z-Score-Werte der Theta-Aktivität bei den Probanden während der Planung (violett) im Vergleich zum Kontrollzeitraum (grün) für die Elektroden Fz (links), Pz (Mitte) und Oz (rechts) unter Verwendung eines Matched-Pair-t-Tests zeigt. Diese Abbildung wurde von Domic-Siede et al.54 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um die zeitliche Dynamik der beobachteten frontalen Thetaaktivität zu bewerten, wurden zusätzlich topographische Karten erstellt, die bestimmten Zeitpunkten der Thetabandleistung (750 ms, 1.750 ms, 2.750 ms und 3.750 ms) entsprechen (Abbildung 8A). Darüber hinaus zeigte die Zeit-Frequenz-Analyse im Vergleich zum Kontrollzeitraum einen signifikanten, progressiven und anhaltenden Anstieg der Theta-Aktivität, der 1 s nach Beginn des Planungszeitraums begann (Abbildung 8B).

Abbildung 8: Frontale Theta-Dynamik der Mittellinie. (A) Topographische Zeitscheiben der Theta-Aktivität. Es wurde ein progressiver Anstieg der Theta-Aktivität in der Frontalmittellinie über die Zeit während der Planungsdurchführung (Planungszeitraum) beobachtet. Der Farbbalken zeigt die Z-Score-Einheiten (-0,5 bis 2,2) an. (B) Zeit-Häufigkeits-Diagramme für den Planungszeitraum (oben), den Kontrollzeitraum (Mitte) und den Planungseffekt, berechnet durch Subtraktion des Kontrollzeitraums vom Planungszeitraum (unten). Nicht signifikante Pixel, die mit einem nicht-parametrischen clusterbasierten Permutationstest für gepaarte Stichproben bestimmt wurden, werden im Planungseffektdiagramm heller dargestellt. Der Farbbalken zeigt die Z-Score-Einheiten (-4 bis 4) an. Diese Abbildung wurde von Domic-Siede et al.54 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Für die Quellenrekonstruktion der Theta-Aktivität wurde eine Gehirnmodellvorlage visualisiert und zwischen den Bedingungen verglichen, und dies deutete darauf hin, dass die Theta-Aktivität in den Bereichen des präfrontalen Kortex (frontaler oberer Kortex, FS; anteriorer cingulärer Kortex, ACC; und mittlerer cingulärer Kortex, MCC) entstand, sowie dass es signifikante Unterschiede zwischen den Bedingungen gab (in der bilateralen SF, B. die bilaterale ACC und die bilaterale MCC) (Abbildung 9), wobei im Planungszeitraum eine höhere Theta-Aktivität beobachtet wurde (Abbildung 9).

Abbildung 9: Rekonstruktion der Quelle. Ein sLORETA-Algorithmus wurde verwendet, um die Theta-Aktivität aus verschiedenen Gehirnquellen zu schätzen. Die Theta-Aktivität wurde mit einem 4-8 Hz-Bandpass filtriert, der Z-Score normalisiert, nach dem Ausgangswert korrigiert, zwischen 1 s und 4 s nach Beginn der Planung bzw. des Kontrollbeginns gemittelt und zwischen den Bedingungen verglichen. Eine signifikante Zunahme der Theta-Aktivität wurde im bilateralen frontalen superioren Bereich, im bilateralen anterioren cingulären Kortex und im bilateralen mittleren cingulären Kortex festgestellt. Die Abbildung zeigt signifikante t-Werte aus dem Permutationstest. Abkürzungen: FS = frontal superior; ACC = anteriorer cingulärer Kortex; MCC = mittlerer cingulärer Kortex. Diese Abbildung wurde von Domic-Siede et al.54 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Anschließend wurde das Zeitprofil der Theta-Änderungen im Laufe der Zeit für jede Quelle durch die Berechnung einer Hilbert-Transformation ausgewertet und dann verglichen wir die momentane Amplitude der Theta-Aktivität zwischen den Bedingungen. Wir fanden heraus, dass die linksfrontopolaren, bilateralen ACC- und bilateralen MCC-Quellen nach Beginn des Planungszeitraums eine höhere Theta-Aktivität aufwiesen (Abbildung 10). Diese Ergebnisse deuten darauf hin, dass unser experimentelles Paradigma, das kognitive Planung erfordert, Theta-Aktivität induziert, die ihren Ursprung in den PFC-Regionen hat.

Abbildung 10: Theta-Aktivitätszeitprofil der PFC-Quellen. Die mit der Hilbert-Transformation berechnete momentane Amplitude wurde auf die erste Komponente der PCA-Zerlegung für jede frontale Quelle angewendet und sowohl die Bedingungen als auch die Basislinie auf den z-Score normalisiert, um die frontale Theta-Aktivität über die Zeit zu zeigen. Die grau schattierten Bereiche zeigen signifikante Unterschiede, die anhand eines nicht überlappenden gleitenden Fensters mit Schritten von 1 s (Wilcoxon-Vorzeichen-Rang-Test) bestimmt wurden, die durch den FDR korrigiert wurden. Die schattierten Bereiche stellen Konfidenzintervalle von 95 % dar. Die linke FP-Region, die bilaterale ACC und die bilaterale MCC zeigten eine Zunahme der Theta-Aktivität nach dem geplanten Beginn. Abkürzungen: ACC = anterior cingulärer Kortex; MCC = mittlerer cingulärer Kortex. Die Planungsbedingung wird violett dargestellt. Die Kontrollbedingung wird rot dargestellt. Diese Abbildung wurde von Domic-Siede et al.54 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Darüber hinaus wollten wir die Variation der spektralen Merkmale während der Planung in Bezug auf den Komplexitätsgrad untersuchen, wie sie sich aus den Verhaltensergebnissen ergibt. Bemerkenswert ist, dass eine signifikante Diskrepanz nur im linken ACC innerhalb des Alpha-Bandes festgestellt wurde. Dies unterstützt die Vorstellung, dass unsere Planungsaufgabe die intrinsischen Facetten der Planung durch Veränderungen der Theta-Oszillationen in größerem Maße bewertet als die allgemeinen kognitiven Anforderungen (Anstrengung), die typischerweise bei kognitiven Kontrollaufgaben anzutreffen sind (Abbildung 11).

Abbildung 11: EEG über die Komplexitätsstufen der Planung hinweg. Die ROI-Zeit-Häufigkeits-Diagramme zeigten einen signifikanten positiven Cluster im Alpha-Band, ausschließlich im linken anterioren cingulären Kortex (ACC) für die Stufe "schwierig". Nicht signifikante Pixel, die mit einem nicht-parametrischen clusterbasierten Permutationstest für gepaarte Stichproben bestimmt wurden, werden im Diagramm in einem helleren Farbton dargestellt, wobei der Farbbalken die Z-Score-Einheiten von -3 bis 3 anzeigt. Diese Abbildung wurde von Domic-Siede et al.54 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Wenn Korrelationen zwischen Theta-Aktivität und Verhaltensleistung durchgeführt wurden, wurde eine negative Korrelation beobachtet; Insbesondere mit zunehmender Theta-Aktivität in der linken frontopolaren Region während des Planungszeitraums sank der LISAS-Wert für die Planungsausführung (Abbildung 12). Dieses Muster kann widerspiegeln, dass die linke FP-Region während der Planungsausarbeitung notwendig sein kann, um einen Plan anschließend erfolgreich auszuführen, und deutet auf eine Rolle für die Theta-Aktivität hin.

Abbildung 12: Theta-Aktivität und Verhaltensleistung. Die Spearman-Rho-Korrelation zwischen der Theta-Aktivität des linken frontopolaren Kortex und der Δ LISAS-Planungsausführung zeigte eine signifikant negative Korrelation. Diese Abbildung wurde von Domic-Siede et al.54 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Darüber hinaus könnten die unterschiedlichen kognitiven Anforderungen und Ziele, die durch jede Bedingung induziert wurden, zu gegensätzlichen Augenbewegungen zwischen den Planungs- und Kontrollbedingungen geführt haben, was zu unterschiedlichen oszillatorischen Aktivitätsmustern führte95. Um das oben genannte Problem zu lösen, analysierten wir die Daten von einzelnen Probanden und einzelnen Studien auf verschiedenen Ebenen. Bemerkenswert ist, dass die Zeitreihen des Fz-Kanals und die Zeitdynamik der Theta-Aktivität keinen Zusammenhang mit der Rate der Sakkaden im Laufe der Zeit zu haben schienen (Abbildung 13A).

Abbildung 13: Ergebnisse von EEG- und Augenbewegungsaufzeichnungen. (A) Die Zeilen zeigen das EEG (oben), das Zeit-Frequenz-Diagramm (Mitte oben), das Theta-Zeitprofil der Elektrode Fz (Mitte unten) und die Sakkadenrate von Probande 8 und Versuch 9 (unten) in der Planungsbedingung. (B) Es wird ein Wilcoxon-Vorzeichen-Grad-Test gezeigt, der die Sakkadenamplitude, die Spitzengeschwindigkeit der Sakkade und die Kohärenz der Leistungssakkadenrate zwischen den Bedingungen darstellt und signifikante statistische Unterschiede in der Sakkadenamplitude zwischen den Planungs- und Kontrollbedingungen aufzeigt. Das SEM wird durch die Fehlerbalken dargestellt. Diese Abbildung wurde von Domic-Siede et al.54 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Als nächstes erhielten wir die Sakkadenamplitude und die Spitzengeschwindigkeit aus dem gesamten Versuch und von 0 s bis 3,75 s zum Vergleich (Abbildung 13B). Wir stellten fest, dass die Amplitude der Sakkade in der Kontrollbedingung größer war. Es wurden jedoch keine statistisch signifikanten Unterschiede zwischen den Bedingungen im Kohärenzindex zwischen der Fourier-Theta-Leistung an der Elektrode Fz und der Sakkadenrate gefunden (Abbildung 10B), was darauf hindeutet, dass eine mögliche Beziehung zwischen Sakkaden und Theta-Aktivität unter allen Bedingungen konsistent war.
Zusammengenommen unterstützen diese Ergebnisse, dass das beschriebene Versuchsprotokoll geeignet ist, die kognitive Planung als kognitive Kontrollfunktion zu untersuchen.
Diskussion
Das hier beschriebene Protokoll bietet einen innovativen Ansatz zur Bewertung der kognitiven Planung und kognitiven Kontrolle während einer neuartigen und ökologischen Planungsaufgabe in Verbindung mit relevanten und komplementären Verhaltens- und physiologischen Messungen, wie z.B. oszillatorischer und pupillenärer Dynamik. Während unserer Experimente wurde die EEG-Aktivität aufgezeichnet, während die Teilnehmer die Planungsaufgabe durchführten, bei der die Teilnehmer angewiesen wurden, zunächst einen Plan auszuarbeiten und dann auszuführen. Die Kontrollbedingung, bei der ein zuvor gezeichneter Pfad auf der Zookarte bewertet wurde, wurde so festgelegt, dass der kognitive Planungsaspekt eliminiert wird, während eine ähnliche Umgebung und Struktur beibehalten wird. Dieser Ansatz ermöglicht die Beurteilung, ob die kognitive Planung als kognitive Kontrollfunktion zur Erzeugung von frontaler Thetaaktivität aus PFC-Regionen führt und ob verschiedene PFC-Theta-Oszillationsquellen mit verschiedenen Aspekten der Planungsleistung verbunden sind. Ein weiterer Aspekt, der mit diesem Protokoll bewertet werden kann, ist die Unterscheidung der verschiedenen kognitiven Prozesse, die in Planungsphasen ablaufen, wie z. B. die Ausarbeitung des Plans, die Ausführung des Plans, die Planerreichung und die Verarbeitung des Feedbacks. Wir fanden heraus, dass Planung eine kanonische frontale Theta-Aktivität induzierte, die mit kognitiver Kontrolle verbunden war und dazu beitrug, ein Ziel effizient zu erreichen. Diese Ergebnisse untermauern das Interesse dieses Protokolls.
Trotz der enormen Entwicklungen in den kognitiven Neurowissenschaften untersuchen die meisten Neuroimaging-Experimente isolierte kognitive Funktionen mit künstlichen Aufgaben in sensomotorisch benachteiligten Umgebungen und übermäßig vereinfachten Reizen zur Kontrolle von Störfaktoren. Problematisch ist, dass diese Experimente möglicherweise nicht in der Lage sind, die tatsächlichen Mechanismen des Gehirns zu identifizieren, die beteiligt sind, wenn eine kognitive Funktion in einer alltäglichen Situation (in ökologischen Situationen) implementiert wird138,140. Insbesondere die Fähigkeiten, Ziele zu formulieren, zu planen und effektiv auszuführen, sind schwer einzuschätzen, da sie verschiedene kognitive Funktionen (Arbeitsgedächtnis, hemmende Kontrolle, kognitive Flexibilität usw.) erfordern.104.144. Daher wird die Gestaltung einer ökologischen Verhaltensaufgabe auf der Grundlage der aktuellen Trends in den kognitiven Neurowissenschaften gefördert und vorgeschlagen 142,143,145,146.
Obwohl unsere Planungsaufgabe in einer Laborumgebung stattfand (in einem Raum, in dem die Reize auf einem Bildschirm angezeigt wurden), wurde sie für die Teilnehmer durch den Einsatz von sinnvollen Reizen und Zielen, mit denen sie auf dem Bildschirm interagieren konnten, ansprechend und interaktiv gestaltet. Darüber hinaus erfordert die Aufgabe, dass sich die Teilnehmer auf eine reale Situation einlassen und einen Weg planen, um verschiedene Orte zu besuchen. Um ein ökologisches Aufgabendesign zu erhalten, muss das Paradigma die Probanden herausfordern, ein bestimmtes Verhalten oder eine kognitive Funktion in einer Weise auszuführen, die dem ähnelt, was sie im Alltag tun müssten 62,63,147. Um ein ökologisches Aufgabendesign zu entwickeln, beinhaltet die hier verwendete Planungsaufgabe die Planung eines Weges zum Besuch verschiedener Orte in mehreren Stufen56. In der ersten Phase erstellen die Teilnehmer einen Plan und stellen sicher, dass er einem Reihe von Regeln folgt. In der zweiten Phase wird der Plan im Arbeitsspeicher aufbewahrt, während in der dritten Phase der Plan ausgeführt und die Einhaltung der Regeln überwacht wird. Diese Stadien repräsentieren verschiedene Phasen der Planung und der Orchestrierung anderer exekutiver Funktionen, wie z. B. kognitive Flexibilität, hemmende Kontrolle und Arbeitsgedächtnis. Um ein valides ökologisches kognitives Aufgabendesign zu erhalten, sollte die Aufgabe in der Lage sein, spezifische kognitive Beeinträchtigungen bei Patienten mit psychiatrischen oder kognitiven Störungen zu erkennen, die Schwierigkeiten haben, diese spezifische kognitive Funktion in ihrem täglichen Leben auszuführen105. Dies kann durch zukünftige Forschung unter Verwendung dieses Protokolls erreicht werden.
Die Verhaltensergebnisse, die durch die Verwendung dieses Protokolls erzielt wurden, wurden mit den experimentellen Vorhersagen abgeglichen. Ein signifikanter Unterschied im Verhalten wurde beobachtet, wenn die Planungskomponente aus der Steuerungsaufgabe entfernt wurde, um eine Kontrollbedingung zu bilden, was weitere Vergleiche erleichtert. Es wurde festgestellt, dass die Planungsbedingung kognitiv anspruchsvoller ist als die Kontrollbedingung, was sich in Parametern wie der Reaktionszeit und der Genauigkeit zeigt. Dies könnte die erhöhte Beteiligung hoher kognitiver Funktionen an der Umsetzung der Planungwiderspiegeln 23,55,56,57,148,149,150.
In Anbetracht der Tatsache, dass die Kontrollbedingung eine weniger komplexe Kognition beinhaltete, was sich in schnelleren Reaktionszeiten, besseren Leistungen und verschiedenen erforderlichen kognitiven Prozessen (der Bewertung von Regeln) zeigt, besteht eine mögliche alternative Modifikation darin, die in der Planungsaufgabe vorhandenen Komplexitätsstufen auszunutzen, sie zu manipulieren und die Planungsfunktion parametrisch entsprechend verschiedenen Komplexitätsstufen zu analysieren (z. Erhöhung der Anzahl der Versuche und Schaffung schwieriger, mittlerer und leichter Prüfungsbedingungen). Die Ergebnisse unseres Protokolls zeigten jedoch, dass es zwar möglich war, zwischen "leichten" und "schwierigen" Versuchen auf der Grundlage von Verhaltensmessungen zu unterscheiden, während bei den elektrophysiologischen Messungen keine Unterschiede festgestellt wurden. Dies deutet darauf hin, dass die Ergebnisse in unserem Protokoll die intrinsischen Merkmale der Planungsfunktion genauer widerspiegeln als breitere Aspekte der kognitiven Kontrolle, wie Aufmerksamkeit, geistige Anstrengung, Schwierigkeitsgrad oder ein hohes Maß an kognitiver Anforderung54. Nichtsdestotrotz können weitere Forschungen andere Arten von Kontrollbedingungen berücksichtigen, wie z. B. das Folgen eines markierten Pfades, der die vier Tierstandorte besucht, aber auch das Erinnern an die Reihenfolge der Sequenzen. Auf diese Weise konnte der Schwierigkeitsgrad besser kontrolliert und die Planung vom Arbeitsgedächtnis unterschieden werden, aber ein möglicher Nachteil davon ist die Ermüdung, da die Probanden zwei sehr anspruchsvolle Aufgaben erfüllen müssten.
Mehrere Studien haben verschiedene Augenbewegungsparameter mit spezifischen kognitiven Ereignissen in Verbindung gebracht. Einerseits haben bestimmte Studien Korrelationen zwischen Theta-Oszillationen und dem Pupillendurchmesser bei kognitiven Aufgaben gefunden, was auf einen Zusammenhang zwischen diesen beiden Maßen der kognitiven Funktion hindeutet. Zum Beispiel fanden Lin et al.152 eine Korrelation zwischen der Aktivität des mittelfrontalen Thetas und Veränderungen der Pupillengröße, was unterschiedliche Grade subjektiver Konflikte widerspiegelt. Ihre Ergebnisse deuten darauf hin, dass diese Signale für Konfliktverarbeitung, erhöhte Aufmerksamkeit und flexible Verhaltensreaktionen stehen. Daher scheint die Beziehung zwischen der midfrontalen Theta-Aktivität und den Pupillenreaktionen eine Rolle bei der Abwägung von Kosten und Nutzen während der Entscheidungsfindung zu spielen. In einer anderen Studie untersuchten Yu et al.153 , wie die neurophysiologische Beschäftigung mit der Zeit bei der Aufgabe die kognitive Kontrolle durch eine Arbeitsgedächtnisaufgabe beeinflusst, die die kontrollhemmenden Reaktionen modulierte. Sie untersuchten die Beziehung zwischen den Daten des Pupillendurchmessers und der frontalen Theta-Aktivität und zeigten, dass mit zunehmender Aufgabendauer die Leistung abnahm, und dies ging mit einer Abnahme der Pupillenerweiterungsmodulation und der frontalen Theta-Aktivität einher. Zu Beginn der Aufgabe fanden sie eine starke Korrelation zwischen Aufgabenengagement, Theta-Aktivität und kognitiver Kontrolle, was durch die Modulation der Pupillendilatation angezeigt wird, hauptsächlich bei anspruchsvollen Aufgaben, die ein hohes Arbeitsgedächtnis und eine hemmende Kontrolle erfordern. Diese Beziehung löste sich jedoch gegen Ende auf, was auf eine Diskrepanz zwischen dem investierten Aufwand und der kognitiven Kontrolle, die für die Ausführung der Aufgabe verwendet wird, signalisiert, was ein Kennzeichen der präfrontalen Time-on-Task-Effekte ist153. Auf der anderen Seite haben andere Studien Sakkaden und Oszillationen untersucht. Zum Beispiel zeigten Nakatani et al.154 , dass in einer Wahrnehmungsaufgabe die Alpha-Band-Amplitude aus okzipitalen Regionen Blinzeln und Sakkadeneffekte vorhersagte. Darüber hinaus zeigten Velasques et al.155 , dass während einer prosakkadischen Aufmerksamkeitsaufgabe die Ssakkadenamplitude mit frontalen Gammaveränderungen verbunden war. Darüber hinaus fanden Bodala et al.156 heraus, dass eine Abnahme der frontalen Mittellinien-Theta mit einer Abnahme der anhaltenden Aufmerksamkeit sowie der Amplitude und Geschwindigkeit der Sakkaden einherging. Diese Ergebnisse deuten darauf hin, dass Augenbewegungen, insbesondere Sakkaden, kognitive Prozesse widerspiegeln und nicht nur zum Hintergrundrauschen in EEG-Signalen beitragen. In der aktuellen Studie haben wir die Eliminierung von Artefakten, die mit Augenbewegungen zusammenhängen, mit dem ICA-Algorithmus mit dem Kriterium126 des Sakkaden-zu-Fixations-Varianzverhältnisses verbessert. Dieses Kriterium verbessert das Entfernen von Artefakten für Aufgaben zum freien Anzeigen157. In unserer Studie wurden keine Unterschiede in der Spitzengeschwindigkeit der Sakkade und der Kohärenz zwischen Theta-Kraft und Sakkadenrate unter verschiedenen Bedingungen beobachtet. Um diese Fragen zu beantworten, sind jedoch weitere Studien erforderlich.
Ein kritischer Schritt bei der Verwendung dieses Protokolls ist die ständige Kalibrierung des Eyetrackers während des Experiments, da der Verlust von Blickdaten von der Kamera zu Fehlern führen kann, die die Aufgabe beeinträchtigen und es schwierig machen, genaue Antworten zu erhalten. Daher ist es wichtig, so oft wie möglich zu kalibrieren. Es gibt jedoch einen Kompromiss zwischen der Anzahl der Versuche mit einem kalibrierten Eyetracker und der Länge des Experiments. In unserer Studie haben wir uns entschieden, alle fünf Studien zu kalibrieren.
Zukünftige Forschungen, die den Zusammenhang zwischen Theta-Oszillationen und Pupillendurchmesser während dieser Planungsaufgabe untersuchen, sollten durchgeführt werden. Planung ist ein kritischer Aspekt der exekutiven Kontrolle, der die Zuweisung von Aufmerksamkeitsressourcen und die Koordination mehrerer kognitiver Prozesse erfordert. Das Verständnis der Beziehung zwischen Theta-Oszillationen und Pupillendurchmesser während der Planung von Aufgaben könnte wertvolle Einblicke in die zugrunde liegenden neuronalen Mechanismen der exekutiven Kontrolle und deren Veränderung im Laufe der Zeit liefern. Darüber hinaus könnten solche Studien zu einem tieferen Verständnis darüber führen, wie sich Veränderungen der kognitiven Funktionen, wie z. B. Müdigkeit oder Aufmerksamkeitslücken, auf die Leistung bei der Planung von Aufgaben und die Fähigkeit, Ressourcen effektiv einzusetzen, auswirken. Diese Informationen könnten wichtige Auswirkungen auf die Entwicklung von Interventionen zur Verbesserung der Planungsleistung haben, wie z. B. kognitive Trainingsprogramme oder Behandlungen für Erkrankungen wie Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS).
Frühere Forschungen haben gezeigt, dass der PFC eine entscheidende Rolle bei der kognitiven Planung spielt, wie unsere Ergebnisse bestätigen. Diese Ergebnisse zeigen, dass die kognitive Planung die FMθ-Aktivität im PFC induziert, insbesondere im anterioren cingulären Kortex, im mittleren cingulären Kortex und in den oberen frontalen Regionen54. Diese Ergebnisse stimmen mit früheren Forschungen zu exekutiven Funktionen überein. Es gibt substanzielle Beweise für die Annahme, dass die FMθ-Aktivität als Top-Down-Prozess zur Initiierung der Kontrolle und zur Erleichterung der Kommunikation zwischen Gehirnregionen bei anspruchsvollen Aufgaben fungiert13. Obwohl nur wenige Studien die zeitliche Dynamik der FMθ-Aktivität im Zusammenhang mit kognitiver Kontrolle untersucht haben, besteht weitgehende Einigkeit darüber, dass das Zeitprofil von FMθ Informationen über verschiedene Facetten der kognitiven Kontrolle und die Beteiligung verschiedener PFC-Regionen liefern kann. Die Verwendung unseres Protokolls zur Bewertung der kognitiven Planung ermöglichte es uns, das Zeitprofil der FMθ-Aktivität während der Planung zu charakterisieren. Insbesondere zeigte die FMθ-Aktivität während der Planungsbedingung einen progressiven Anstieg. Durch die Implementierung dieses Protokolls konnte zum ersten Mal gezeigt werden, dass FMθ auch während der Planungsimplementierung vorhanden ist, wie bei anderen kognitiven Funktionen höherer Ordnung, und seine zeitliche Dynamik als Indikator für die kognitive Kontrolle dienen kann.
Unsere Ergebnisse und unser Protokoll haben potenzielle Anwendungen im Bereich der Neurowissenschaften, einschließlich zur Verbesserung virtueller neuropsychologischer Bewertungen und der Behandlung von neuropsychiatrischen Störungen mit damit verbundenen kognitiven Planungsproblemen wie Depressionen und Aufmerksamkeitsdefizit-/Hyperaktivitätsstörungen. Zum Beispiel könnten Assessments die Untersuchung verschiedener Fehlermuster auf der Verhaltensleistungsebene, verschiedener oszillatorischer Muster auf elektrophysiologischer Ebene und verschiedener Augenbewegungen umfassen. Darüber hinaus können die Ergebnisse dieser Arbeit in die Entwicklung von Gehirn-Computer-Schnittstellen und kognitiven Trainingsprogrammen einfließen, die darauf abzielen, die kognitiven Planungsfähigkeiten zu verbessern.
Das vorliegende Protokoll kann neue Erkenntnisse zum Verständnis der neuronalen Mechanismen liefern, die der schwer fassbaren kognitiven Kontrollfunktion der kognitiven Planung in neurotypischen und neuropsychiatrischen Populationen zugrunde liegen. Darüber hinaus könnte unser Verhaltensparadigma Einblicke in die Neurobiologie der kognitiven Kontrolle und Planung bieten, indem es elektrophysiologische, pupillometrische und verhaltensbezogene Messungen mit einer praktischen Planungsaufgabe untersucht, die intrinsische Aspekte der Planung untersucht und nicht die allgemeinen kognitiven Anforderungen, die typischerweise bei kognitiven Kontrollaufgaben auftreten, wie sie sich in den Veränderungen der Theta-Oszillationen widerspiegeln.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Forschung wurde finanziell unterstützt durch das Promotionsstipendienprogramm Becas de Doctorado Nacional año 2015 von ANID 21150295, FONDECYT regular grant 1180932, FONDECYT regular grant 1230383, FONDECYT de Iniciación grant 11220009, Postdoc grant Universidad de O'Higgins und das Institut Universitaire de France (IUF). Wir danken Professor Pablo Billeke für sein Feedback zum Paradigmendesign. Wir danken Professor Eugenio Rodríguez für die freundliche Bereitstellung seiner Zeit-Frequenz-Analyse-Codes. Abschließend danken wir Milan Domic, Vicente Medel, Josefina Ihnen, Andrea Sánchez, Gonzalo Boncompte, Catalina Fabar und Daniela Santander für ihr Feedback.
Materialien
| Name | Company | Catalog Number | Comments |
| EEG System | Biosemi | ActiveTwo Base system, 64 channels | |
| Eye-tracker System | Eyelink SR Research | EyeLink 1000 Plus Core Unit, High-speed camera, Host PC/Monitor, | |
| CPU display | Intel | Hard drive 221 GB, Processor Intel Core i7-4790 3.60 Hz, OS Windows 7, 4GB RAM | |
| CPU EEG | Intel | Hard drive 223 GB, Processor Intel Core i7-4790 3.60 Hz, OS Windows 7, 4GB RAM | |
| Monitor | ASUS | ASUS VG248QE 24" LCD monitor | |
| Joytsick | Logitech | Model F310 | |
| Luxmeter | Focket | LCD screen (0-200.000 lux) model Liebe WH LX1330B | |
| Statistics software | GraphPad Prism | GraphPad Prism version 8 for Windows | |
| MATLAB Programming Software | The MathWorks | MATLAB R2014a and R2018b | |
| SVG tool Inkscape | Inkscape Project | vector graphic editor software | |
| Presentation Software | Neurobehavioral Systems | stimulus delivery and experiment control program for neuroscience |
Referenzen
- Siegel, M., Donner, T. H., Engel, A. K. Spectral fingerprints of large-scale neuronal interactions. Nature Reviews Neuroscience. 13 (2), 121-134 (2012).
- Fries, P. A mechanism for cognitive dynamics: Neuronal communication through neuronal coherence. Trends in Cognitive Sciences. 9 (10), 474-480 (2005).
- Fries, P. Rhythms for cognition: Communication through coherence. Neuron. 88 (1), 220-235 (2015).
- Thut, G., Miniussi, C., Gross, J. The functional importance of rhythmic activity in the brain. Current Biology. 22 (16), 658-663 (2012).
- Fröhlich, F., McCormick, D. A. Endogenous electric fields may guide neocortical network activity. Neuron. 67 (1), 129-143 (2010).
- Spaak, E., de Lange, F. P., Jensen, O. Local entrainment of alpha oscillations by visual stimuli causes cyclic modulation of perception. Journal of Neuroscience. 34 (10), 3536-3544 (2014).
- Fiebelkorn, I. C., Saalmann, Y. B., Kastner, S. Rhythmic sampling within and between objects despite sustained attention at a cued location. Current Biology. 23 (24), 2553-2558 (2013).
- Landau, A. N., Fries, P. Attention samples stimuli rhythmically. Current Biology. 22 (11), 1000-1004 (2012).
- Song, K., Meng, M., Lin, C., Zhou, K., Luo, H. Behavioral oscillations in attention: Rhythmic α pulses mediated through θ band. Journal of Neuroscience. 34 (14), 4837-4844 (2014).
- Wyart, V., Nobre, A. C., Summerfield, C. Dissociable prior influences of signal probability and relevance on visual contrast sensitivity. Proceedings of the National Academy of Sciences of the United States of America. 109 (9), 3593-3598 (2012).
- Leszczyński, M., Fell, J., Axmacher, N. Rhythmic working memory activation in the human hippocampus. Cell Reports. 13 (6), 1272-1282 (2015).
- Onton, J., Delorme, A., Makeig, S. Frontal midline EEG dynamics during working memory. NeuroImage. 27 (2), 341-356 (2005).
- Cavanagh, J. F., Frank, M. J. Frontal theta as a mechanism for cognitive control. Trends in Cognitive Sciences. 18 (8), 414-421 (2014).
- Siegel, M., Buschman, T. J., Miller, E. K. Cortical information flow during flexible sensorimotor decisions. Science. 348 (6241), 1352-1355 (2015).
- Weisz, N., et al. Prestimulus oscillatory power and connectivity patterns predispose conscious somatosensory perception. Proceedings of the National Academy of Sciences of the United States of America. 111 (4), 417-425 (2014).
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Cohen, M. X. A neural microcircuit for cognitive conflict detection and signaling. Trends in Neurosciences. 37 (9), 480-490 (2014).
- Yuste, R. From the neuron doctrine to neural networks. Nature Reviews Neuroscience. 16 (8), 487-497 (2015).
- Helfrich, R. F., Knight, R. T. Oscillatory dynamics of prefrontal cognitive control. Trends in Cognitive Sciences. 20 (12), 916-930 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annual Review of Neurosciences. 24 (1), 167-202 (2001).
- von Nicolai, C., et al. Corticostriatal coordination through coherent phase-amplitude coupling. Journal of Neuroscience. 34 (17), 5938-5948 (2014).
- Sweeney-Reed, C. M., et al. Thalamic theta phase alignment predicts human memory formation and anterior thalamic cross-frequency coupling. ELife. 4, 07578 (2015).
- Voytek, B., et al. Oscillatory dynamics coordinating human frontal networks in support of goal maintenance. Nature Neuroscience. 18 (9), 1318-1324 (2015).
- Raghavachari, S., et al. Theta oscillations in human cortex during a working-memory task: Evidence for local generators. Journal of Neurophysiology. 95 (3), 1630-1638 (2006).
- Jacobs, J., Hwang, G., Curran, T., Kahana, M. J. EEG oscillations and recognition memory: Theta correlates of memory retrieval and decision making. NeuroImage. 32 (2), 978-987 (2006).
- Itthipuripat, S., Wessel, J. R., Aron, A. R. Frontal theta is a signature of successful working memory manipulation. Experimental Brain Research. 224 (2), 255-262 (2013).
- Cavanagh, J. F., Zambrano-Vazquez, L., Allen, J. J. B. Theta lingua franca: A common mid-frontal substrate for action monitoring processes. Psychophysiology. 49 (2), 220-238 (2012).
- Mas-Herrero, E., Marco-Pallarés, J. Frontal theta oscillatory activity is a common mechanism for the computation of unexpected outcomes and learning rate. Journal of Cognitive Neuroscience. 26 (3), 447-458 (2014).
- Folstein, J. R., Van Petten, C. Influence of cognitive control and mismatch on the N2 component of the ERP: A review. Psychophysiology. 45 (1), 152-170 (2008).
- Cohen, M. X., Donner, T. H. Midfrontal conflict-related theta-band power reflects neural oscillations that predict behavior. Journal of Neurophysiology. 110 (12), 2752-2263 (2013).
- Walsh, M. M., Anderson, J. R. Modulation of the feedback-related negativity by instruction and experience. Proceedings of the National Academy of Sciences of the United States of America. 108 (47), 19048-19053 (2011).
- Luu, P., Tucker, D. M., Makeig, S. Frontal midline theta and the error-related negativity: Neurophysiological mechanisms of action regulation. Clinical Neurophysiology. 115 (8), 1821-1835 (2004).
- Hanslmayr, S., et al. The electrophysiological dynamics of interference during the Stroop task. Journal of Cognitive Neuroscience. 20 (2), 215-225 (2008).
- Cavanagh, J. F., Cohen, M. X., Allen, J. J. B. Prelude to and resolution of an error: EEG phase synchrony reveals cognitive control dynamics during action monitoring. Journal of Neuroscience. 29 (1), 98-105 (2009).
- Cohen, M. X., van Gaal, S., Ridderinkhof, K. R., Lamme, V. A. F. Unconscious errors enhance prefrontal-occipital oscillatory synchrony. Frontiers in Human Neuroscience. 3, 54 (2009).
- Cavanagh, J. F., Frank, M. J., Klein, T. J., Allen, J. J. B. Frontal theta links prediction errors to behavioral adaptation in reinforcement learning. NeuroImage. 49 (4), 3198-3209 (2010).
- Cohen, M. X., Cavanagh, J. F. Single-trial regression elucidates the role of prefrontal theta oscillations in response conflict. Frontiers in Psychology. 2, 30 (2011).
- Cohen, M. X., Van Gaal, S. Dynamic interactions between large-scale brain networks predict behavioral adaptation after perceptual errors. Cerebral Cortex. 23 (5), 1061-1072 (2013).
- Nigbur, R., Cohen, M. X., Ridderinkhof, K. R., Stürmer, B. Theta dynamics reveal domain-specific control over stimulus and response conflict. Journal of Cognitive Neuroscience. 24 (5), 1264-1274 (2012).
- van Driel, J., Swart, J. C., Egner, T., Ridderinkhof, K. R., Cohen, M. X. No) time for control: Frontal theta dynamics reveal the cost of temporally guided conflict anticipation. Cognitive, Affective, and Behavioral Neuroscience. 15 (4), 787-807 (2015).
- van de Vijver, I., Ridderinkhof, K. R., Cohen, M. X. Frontal oscillatory dynamics predict feedback learning and action adjustment. Journal of Cognitive Neuroscience. 23 (12), 4106-4121 (2011).
- Narayanan, N. S., Cavanagh, J. F., Frank, M. J., Laubach, M. Common medial frontal mechanisms of adaptive control in humans and rodents. Nature Neuroscience. 16 (12), 1888-1895 (2013).
- Anguera, J. A., et al. Video game training enhances cognitive control in older adults. Nature. 501 (7465), 97-101 (2013).
- Smit, A. S., Eling, P. A. T. M., Hopman, M. T., Coenen, A. M. L. Mental and physical effort affect vigilance differently. International Journal of Psychophysiology. 57 (3), 211-217 (2005).
- Cohen, M. X., Ranganath, C. Reinforcement learning signals predict future decisions. Journal of Neuroscience. 27 (2), 371-378 (2007).
- Gehring, W. J., Goss, B., Coles, M. G. H., Meyer, D. E., Donchin, E. A neural system for error detection and compensation. Psychological Science. 4 (6), 385-390 (1993).
- Yeung, N., Botvinick, M. M., Cohen, J. D. The neural basis of error detection: Conflict monitoring and the error-related negativity. Psychological Review. 111 (4), 931-959 (2004).
- Debener, S., et al. Trial-by-trial coupling of concurrent electroencephalogram and functional magnetic resonance imaging identifies the dynamics of performance monitoring. Journal of Neuroscience. 25 (50), 11730-11737 (2005).
- Hauser, T. U., et al. The feedback-related negativity (FRN) revisited: New insights into the localization, meaning, and network organization. NeuroImage. 84, 159-168 (2014).
- Wang, C., Ulbert, I., Schomer, D. L., Marinkovic, K., Halgren, E. Responses of human anterior cingulate cortex microdomains to error detection, conflict monitoring, stimulus-response mapping, familiarity, and orienting. Journal of Neuroscience. 25 (3), 604-613 (2005).
- Tsujimoto, S., Genovesio, A. Firing variability of frontal pole neurons during a cued strategy task. Journal of Cognitive Neuroscience. 29 (1), 25-36 (2017).
- Womelsdorf, T., Johnston, K., Vinck, M., Everling, S. Theta-activity in anterior cingulate cortex predicts task rules and their adjustments following errors. Proceedings of the National Academy of Sciences of the United States of America. 107 (11), 5248-5253 (2010).
- Womelsdorf, T., Vinck, M., Stan Leung, L., Everling, S. Selective theta synchronization of choice-relevant information subserves goal-directed behavior. Frontiers in Human Neuroscience. 4, 2010 (2010).
- Domic-Siede, M., Irani, M., Valdés, J., Perrone-Bertolotti, M., Ossandón, T. Theta activity from frontopolar cortex, mid-cingulate cortex and anterior cingulate cortex shows different roles in cognitive planning performance. NeuroImage. 226, 117557 (2021).
- Wilensky, R. . Planning and Understanding: A Computational Approach to Human Reasoning. , (1983).
- Grafman, J., Hendler, J. Planning and the brain. Behavioral and Brain Sciences. 14, 563-564 (1991).
- Hayes-Roth, B., Hayes-Roth, F. A cognitive model of planning. Cognitive Science. 3 (4), 275-310 (1979).
- Tremblay, M., et al. Brain activation with a maze test: An EEG coherence analysis study in healthy subjects. Neuroreport. 5 (18), 2449-2453 (1994).
- Shallice, T. Specific impairments of planning. Philosophical Transactions of the Royal Society B: Biological Sciences. 298 (1089), 199-209 (1982).
- Unterrainer, J. M., Owen, A. M. Planning and problem solving: From neuropsychology to functional neuroimaging. Journal of Physiology. 99 (4-6), 308-317 (2006).
- Domic-Siede, M., et al. La planificación cognitiva en el contexto de la evaluación neuropsicológica e investigación en neurociencia cognitiva: Una revisión sistemática. Terapia Psicológica. 40 (3), 367-395 (2022).
- Miotto, E. C., Morris, R. G. Virtual planning in patients with frontal lobe lesions. Cortex. 34 (5), 639-657 (1998).
- Burgess, P. W., Simons, J. S., Coates, L. M. A., Channon, S., Morris, R., Ward, G. The search for specific planning processes. The Cognitive Psychology of Planning. , 199-227 (2005).
- Oosterman, J. M., Wijers, M., Kessels, R. P. C. Planning or something else? Examining neuropsychological predictors of zoo map performance. Applied Neuropsychology. 20 (2), 103-109 (2013).
- Campbell, Z., et al. Utilizing virtual reality to improve the ecological validity of clinical neuropsychology: An fMRI case study elucidating the neural basis of planning by comparing the Tower of London with a three-dimensional navigation task. Applied Neuropsychology. 16 (4), 295-306 (2009).
- Wilson, B. A., Alderman, N., Burgess, P. W., Emslie, H., Evans, J. J. . Behavioural Assessment of the Dysexecutive Syndrome. , (1996).
- Spector, L., Grafman, J., Boller, F., Grafman, J. Planning, neuropsychology, and artificial intelligence: Cross fertilization. Handbook of Neuropsychology. 9, 377-392 (1994).
- Porteus, S. D. . The Maze Test and Clinical Psychology. , (1959).
- Lis, S., Krieger, S., Wilhelm, J., Gallhofer, B. Feedback about previous action improves executive functioning in schizophrenia: An analysis of maze solving behaviour. Schizophrenia Research. 78 (2-3), 243-250 (2005).
- Zelinsky, G. J. A theory of eye movements during target acquisition. Psychological Review. 115 (4), 787-835 (2008).
- Wurtz, R. H., Goldberg, M. E., Robinson, D. L. Brain mechanisms of visual attention. Scientific American. 246 (6), 124-135 (1982).
- Burr, D., Morrone, M. C. Eye movements: Building a stable world from glance to glance. Current Biology. 15 (20), 839-840 (2005).
- Rolfs, M. Microsaccades: Small steps on a long way. Vision Research. 49 (20), 2415-2441 (2009).
- Ortega, J., Plaska, C. R., Gomes, B. A., Ellmore, T. M. Spontaneous eye blink rate during the working memory delay period predicts task accuracy. Frontiers in Psychology. 13, 788231 (2022).
- Grueschow, M., Kleim, B., Ruff, C. C. Role of the locus coeruleus arousal system in cognitive control. Journal of Neuroendocrinology. 32 (12), 12890 (2020).
- Aston-Jones, G., Shaver, R., Dinan, T. Cortically projecting nucleus basalis neurons in rat are physiologically heterogeneous. Neuroscience Letters. 46 (1), 19-24 (1984).
- Foote, S. L., Bloom, F. E., Aston-Jones, G. Nucleus locus coeruleus: New evidence of anatomical and physiological specificity. Physiological Reviews. 63 (3), 844-914 (1983).
- Siever, L. J., Davis, K. L. Overview: Toward a dysregulation hypothesis of depression. The American Journal of Psychiatry. 142 (9), 1017-1031 (1985).
- Aston-Jones, G., Gold, J. I. How we say no: Norepinephrine, inferior frontal gyrus, and response inhibition. Biological Psychiatry. 65 (7), 548-549 (2009).
- Aston-Jones, G., Cohen, J. D. An integrative theory of locus coeruleus norepinephrine function: adaptive gain and optimal performance. Annual Review of Neurosciences. 28, 403-450 (2005).
- Einhauser, W., Stout, J., Koch, C., Carter, O. Pupil dilation reflects perceptual selection and predicts subsequent stability in perceptual rivalry. Proceedings of the National Academy of Sciences of the United States of America. 105 (5), 1704-1709 (2008).
- Yoshitomi, T., Ito, Y., Inomata, H. Adrenergic excitatory and cholinergic inhibitory innervations in the human iris dilator. Experimental Eye Research. 40 (3), 453-459 (1985).
- Rajkowski, J., Kubiak, P., Aston-Jones, G. Locus coeruleus activity in monkey: Phasic and tonic changes are associated with altered vigilance. Brain Research Bulletin. 35 (5-6), 607-616 (1994).
- Beatty, J. Task-evoked pupillary responses, processing load, and the structure of processing resources. Psychological Bulletin. 91 (2), 276-292 (1982).
- Beatty, J., Kahneman, D. Pupillary changes in two memory tasks. Psychonomic Science. 5, 371-372 (1966).
- Hess, E. H., Polt, J. M. Pupil size in relation to mental activity during simple problem-solving. Science. 143 (3611), 1190-1192 (1964).
- Kuchinke, L., Vo, M. L., Hofmann, M., Jacobs, A. M. Pupillary responses during lexical decisions vary with word frequency but not emotional valence. International Journal of Psychophysiology. 65 (2), 132-140 (2007).
- Barkley, R. A. Adolescents with attention-deficit/hyperactivity disorder: An overview of empirically based treatments. Journal of Psychiatric Practice. 10 (1), 39-56 (2004).
- Gau, S. S. F. e. m. 8. 9., Shang, C. Y. Executive functions as endophenotypes in ADHD: Evidence from the Cambridge Neuropsychological Test Battery (CANTAB). Journal of Child Psychology and Psychiatry and Allied Disciplines. 51 (7), 838-849 (2010).
- Bora, E., Harrison, B. J., Yücel, M., Pantelis, C. Cognitive impairment in euthymic major depressive disorder: A meta-analysis. Psychological Medicine. 43 (10), 2017-2026 (2013).
- Rive, M. M., Koeter, M. W. J., Veltman, D. J., Schene, A. H., Ruhé, H. G. Visuospatial planning in unmedicated major depressive disorder and bipolar disorder: Distinct and common neural correlates. Psychological Medicine. 46 (11), 2313-2328 (2016).
- Holt, D. V., Wolf, J., Funke, J., Weisbrod, M., Kaiser, S. Planning impairments in schizophrenia: Specificity, task independence and functional relevance. Schizophrenia Research. 149 (1-13), 174-179 (2013).
- Lima-Silva, T. B., et al. Functional profile of patients with behavioral variant frontotemporal dementia (bvFTD) compared to patients with Alzheimer's disease and normal controls. Dementia and Neuropsychologia. 7 (1), 96-103 (2013).
- Karnath, H. O., Wallesch, C. W., Zimmermann, P. Mental planning and anticipatory processes with acute and chronic frontal lobe lesions: A comparison of maze performance in routine and non-routine situations. Neuropsychologia. 29 (4), 271-290 (1991).
- Staudigl, T., Hartl, E., Noachtar, S., Doeller, C. F., Jensen, O. Saccades are phase-locked to alpha oscillations in the occipital and medial temporal lobe during successful memory encoding. PLoS Biology. 15 (12), 2003404 (2017).
- Faul, F., Erdfelder, E., Lang, A. G., Buchner, A. G*Power 3: A flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behavior Research Methods. 39 (2), 175-191 (2007).
- Ferrando, L., Bobes, J., Gibert, J., Soto, M. MINI Entrevista Neuropsiquiátrica Internacional (MINI International Neuropsychiatric Interview, MINI). Instrumentos de Detección y Orientación Diagnóstica. , (2000).
- McAssey, M., Dowsett, J., Kirsch, V., Brandt, T., Dieterich, M. Different EEG brain activity in right and left-handers during visually induced self-motion perception. Journal of Neurology. 267 (1), 79-90 (2020).
- Kelly, R., Mizelle, J. C., Wheaton, L. A. Distinctive laterality of neural networks supporting action understanding in left- and right-handed individuals: An EEG coherence study. Neuropsychologia. 75, 20-29 (2015).
- O'Hare, A. J., Atchley, R. A., Young, K. M. Central and divided visual field presentation of emotional images to measure hemispheric differences in motivated attention. Journal of Visualized Experiments. (129), 56257 (2017).
- Beatty, J. Task-evoked pupillary responses, processing load, and the structure of processing resources. Psychological Bulletin. 91 (2), 276-292 (1982).
- Wainstein, G., et al. Pupil size tracks attentional performance in attention-deficit/hyperactivity disorder. Scientific Reports. 7 (1), 8228 (2017).
- Drueke, B., et al. Neural correlates of positive and negative performance feedback in younger and older adults. Behavioral and Brain Functions. 11, 17 (2015).
- Lezak, M. D. The problem of assessing executive functions. International Journal of Psychology. 17 (1-4), 281-297 (1982).
- Oosterman, J. M., Wijers, M., Kessels, R. P. C. Planning or something else? Examining neuropsychological predictors of zoo map performance. Applied Neuropsychology. 20 (2), 103-109 (2013).
- Keil, A., et al. Committee report: Publication guidelines and recommendations for studies using electroencephalography and magnetoencephalography. Psychophysiology. 51 (1), 1-21 (2014).
- Abokyi, S., Owusu-Mensah, J., Osei, K. A. Caffeine intake is associated with pupil dilation and enhanced accommodation. Eye. 31 (4), 615-619 (2017).
- Wilhelm, B., Stuiber, G., Lüdtke, H., Wilhelm, H. The effect of caffeine on spontaneous pupillary oscillations. Ophthalmic & Physiological Optics. 34 (1), 73-81 (2014).
- McGinley, M. J., David, S. V., McCormick, D. A. Cortical membrane potential signature of optimal states for sensory signal detection. Neuron. 87 (1), 179-192 (2015).
- Slotnick, S. D. High density event-related potential data acquisition in cognitive neuroscience. Journal of Visualized Experiments. (38), 1945 (2010).
- Lamm, C., Windischberger, C., Leodolter, U., Moser, E., Bauer, H. Co-registration of EEG and MRI data using matching of spline interpolated and MRI-segmented reconstructions of the scalp surface. Brain Topography. 14 (2), 93-100 (2001).
- Schwartz, D., et al. Registration of MEG/EEG data with 3D MRI: Methodology and precision issues. Brain Topography. 9, 101-116 (1996).
- Laeng, B., Sirois, S., Gredebäck, G. Pupillometry: A window to the preconscious? Perspectives on psychological science. Journal of the Association for Psychological Science. 7 (1), 18-27 (2012).
- Vandierendonck, A. A comparison of methods to combine speed and accuracy measures of performance: A rejoinder on the binning procedure. Behavior Research Methods. 49 (2), 653-673 (2017).
- Vandierendonck, A. Further tests of the utility of integrated speed-accuracy measures in task switching. Journal of Cognition. 1 (1), 8 (2018).
- Levene, H., Olkin, I. Robust tests for equality of variances. In Contributions to Probability and Statistics: Essays in Honor of Harold Hotelling. , 278-292 (1960).
- Zimmerman, D. W. A note on preliminary tests of equality of variances. The British Journal of Mathematical and Statistical Psychology. 57, 173-181 (2004).
- D'Agostino, R. B., Belanger, A., D'Agostino, R. B. A suggestion for using powerful and informative tests of normality). The American Statistician. 44 (4), 316 (1990).
- Shapiro, S. S., Wilk, M. B. An analysis of variance test for normality (complete samples). Biometrika. 52 (3-4), 591-611 (1965).
- Wilcoxon, F. Individual comparisons by ranking methods. Biometrics Bulletin. 1 (6), 80 (1945).
- Fay, M. P., Proschan, M. A. Wilcoxon-Mann-Whitney or t-test? On assumptions for hypothesis tests and multiple interpretations of decision rules. Statistics Surveys. 4, 1-39 (2010).
- Delorme, A., Makeig, S. EEGLAB: An open-source toolbox for analysis of single-trial EEG dynamics including independent component analysis. Journal of Neuroscience Methods. 134 (1), 9-21 (2004).
- Dimigen, O., Sommer, W., Hohlfeld, A., Jacobs, A. M., Kliegl, R. Coregistration of eye movements and EEG in natural reading: Analyses and review. Journal of Experimental Psychology. 140 (4), 552-572 (2011).
- Mognon, A., Jovicich, J., Bruzzone, L., Buiatti, M. ADJUST: An automatic EEG artifact detector based on the joint use of spatial and temporal features. Psychophysiology. 48 (2), 229-240 (2011).
- Bell, A. J., Sejnowski, T. J., Leen, T. K., Tesauro, G., Touretsky, D. S. A non-linear information maximization algorithm that performs blind separation. Advances in Neural Information Processing Systems 7. , (1995).
- Plöchl, M., Ossandón, J. P., König, P. Combining EEG and eye tracking: Identification, characterization, and correction of eye movement artifacts in electroencephalographic data. Frontiers in Human Neuroscience. 6, 278 (2012).
- Pion-Tonachini, L., Kreutz-Delgado, K., Makeig, S. ICLabel: An automated electroencephalographic independent component classifier, dataset, and website. NeuroImage. 198, 181-197 (2019).
- Gartner, M., Grimm, S., Bajbouj, M. Frontal midline theta oscillations during mental arithmetic: Effects of stress. Frontiers in Behavioral Neuroscience. 9, 96 (2015).
- Wang, W., Viswanathan, S., Lee, T., Grafton, S. T. Coupling between theta oscillations and cognitive control network during cross-modal visual and auditory attention: Supramodal vs modality-specific mechanisms. PLoS One. 11 (7), 0158465 (2016).
- Maris, E., Oostenveld, R. Nonparametric statistical testing of EEG- and MEG-data. Journal of Neuroscience Methods. 164 (1), 177-190 (2007).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Computational Intelligence and Neuroscience. 2011, 879716 (2011).
- Pascual-Marqui, R. D. Standardized low-resolution brain electromagnetic tomography (sLORETA): Technical details. Methods and Findings in Experimental and Clinical Pharmacology. 24, 5-12 (2002).
- Gramfort, A., Papadopoulo, T., Olivi, E., Clerc, M. OpenMEEG: Opensource software for quasistatic bioelectromagnetics). Biomedical Engineering Online. 9, 45 (2010).
- Destrieux, C., Fischl, B., Dale, A., Halgren, E. Automatic parcellation of human cortical gyri and sulci using standard anatomical nomenclature. Neuroimage. 53 (1), 1-15 (2010).
- Orr, J. M., Weissman, D. H. Anterior cingulate cortex makes 2 contributions to minimizing distraction. Cerebral Cortex. 9 (3), 703-711 (2009).
- Christoff, K., Gabrieli, J. D. E. The frontopolar cortex and human cognition: Evidence for a rostrocaudal hierarchical organization within the human prefrontal cortex. Psychobiology. 28 (2), 168-186 (2000).
- Nitschke, K., Köstering, L., Finkel, L., Weiller, C., Kaller, C. P. A meta-analysis on the neural basis of planning: Activation likelihood estimation of functional brain imaging results in the Tower of London task. Human Brain Mapping. 38 (1), 396-413 (2017).
- Barbey, A. K., Koenigs, M., Grafman, J. Dorsolateral prefrontal contributions to human working memory. Cortex. 49 (5), 1195-1205 (2013).
- Le Van Quyen, M., et al. Comparison of Hilbert transform and wavelet methods for the analysis of neuronal synchrony. Journal of Neuroscience Methods. 111 (2), 83-98 (2001).
- Bokil, H., Andrews, P., Kulkarni, J. E., Mehta, S., Mitra, P. P. Chronux: A platform for analyzing neural signals. Journal of Neuroscience Methods. 192 (1), 146-151 (2010).
- Sato, N., Yamaguchi, Y. EEG theta regulates eye saccade generation during human object-place memory encoding. Advances in Cognitive Neurodynamics ICCN 2007. , 429-434 (2008).
- Zaki, J., Ochsner, K. The need for a cognitive neuroscience of naturalistic social cognition. Annals of the New York Academy of Sciences. 1167, 16-30 (2009).
- Shamay-Tsoory, S. G., Mendelsohn, A. Real-life neuroscience: An ecological approach to brain and behavior research. Perspectives on Psychological Science. 14 (5), 841-859 (2019).
- Diamond, A. Executive functions. Annual Review of Psychology. 64, 135-168 (2013).
- Dudai, Y. . Memory from A to Z: Keywords, Concepts and Beyond. , (2002).
- Kingstone, A., Smilek, D., Ristic, J., Friesen, C. K., Eastwood, J. D. Attention, researchers! It is time to take a look at the real world. Current Directions in Psychological Science. 12 (5), 176-180 (2003).
- Morris, R. G., Ward, G., Morris, R., Ward, G. Introduction to the psychology of planning. The Cognitive Psychology of Planning. , (2005).
- Zwosta, K., Ruge, H., Wolfensteller, U. Neural mechanisms of goal-directed behavior: Outcome-based response selection is associated with increased functional coupling of the angular gyrus. Frontiers in Human Neuroscience. 9, 180 (2015).
- Owen, A. M., Doyon, J., Petrides, M., Evans, A. C. Planning and spatial working memory: A positron emission tomography study in humans. European Journal of Neuroscience. 8 (2), 353-364 (1996).
- Ossandon, T., et al. Efficient "pop-out" visual search elicits sustained broadband gamma activity in the dorsal attention network. Journal of Neuroscience. 32 (10), 3414-3421 (2012).
- Lezak, M. D. . Neuropsychological Assessment., 3rd edition. , (1995).
- Lin, H., Saunders, B., Hutcherson, C. A., Inzlicht, M. Midfrontal theta and pupil dilation parametrically track subjective conflict (but also surprise) during intertemporal choice. NeuroImage. 172, 838-852 (2018).
- Yu, S., Mückschel, M., Beste, C. Superior frontal regions reflect the dynamics of task engagement and theta band-related control processes in time-on task effects. Scientific Reports. 12 (1), 846 (2022).
- Nakatani, H., van Leeuwen, C. Antecedent occipital alpha band activity predicts the impact of oculomotor events in perceptual switching. Frontiers in Systems Neuroscience. 7, 19 (2013).
- Velasques, B., et al. Changes in saccadic eye movement (SEM) and quantitative EEG parameter in bipolar patients. Journal of Affective Disorders. 145 (3), 378-385 (2013).
- Bodala, I. P., Li, J., Thakor, N. V., Al-Nashash, H. EEG and eye tracking demonstrate vigilance enhancement with challenge integration. Frontiers in Human Neuroscience. 10, 273 (2016).
- Dimigen, O. Optimizing the ICA-based removal of ocular EEG artifacts from free viewing experiments. NeuroImage. 207, 116117 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten