Method Article
Una tarea de planificación visoespacial junto con sistemas de seguimiento ocular y electroencefalograma
En este artículo
Resumen
El estudio de la planificación cognitiva que combina sistemas de EEG y seguimiento ocular proporciona un enfoque multimodal para investigar los mecanismos neuronales que median el control cognitivo y el comportamiento dirigido a objetivos en los seres humanos. Aquí, describimos un protocolo para investigar el papel de las oscilaciones cerebrales y los movimientos oculares en la planificación del rendimiento.
Resumen
El proceso de planificación, caracterizado por la capacidad de formular un plan organizado para alcanzar una meta, es esencial para el comportamiento humano dirigido a una meta. Dado que la planificación se ve comprometida en varios trastornos neuropsiquiátricos, es fundamental la implementación de pruebas clínicas y experimentales adecuadas para examinar la planificación. Debido a la naturaleza del despliegue de la planificación, en el que participan varios dominios cognitivos, la evaluación de la planificación y el diseño de paradigmas conductuales junto con los métodos de neuroimagen son desafíos actuales en la neurociencia cognitiva. Se evaluó una tarea de planificación en combinación con un sistema de electroencefalograma (EEG) y registros de movimientos oculares en 27 participantes adultos sanos. La planificación se puede dividir en dos etapas: una etapa de planificación mental en la que se representa internamente una secuencia de pasos y una etapa de ejecución en la que se utiliza la acción motora para lograr un objetivo previamente planeado. Nuestro protocolo incluía una tarea de planificación y una tarea de control. La tarea de planificación implicó resolver 36 pruebas de laberinto, cada una de las cuales representaba un mapa del zoológico. La tarea tuvo cuatro períodos: i) planificación, donde se instruyó a los sujetos a planificar un camino para visitar las ubicaciones de cuatro animales de acuerdo con un conjunto de reglas; ii) mantenimiento, donde los sujetos debían retener el camino planificado en su memoria de trabajo; iii) ejecución, en la que los sujetos utilizaban los movimientos oculares para trazar la trayectoria previamente planificada según lo indicado por el sistema de seguimiento ocular; y iv) respuesta, donde los sujetos informaron el orden de los animales visitados. La tarea de control tenía una estructura similar, pero el componente de planificación cognitiva se eliminó modificando el objetivo de la tarea. Los patrones espaciales y temporales del EEG revelaron que la planificación induce un aumento gradual y duradero de la actividad theta frontal-de la línea media (FMθ) a lo largo del tiempo. La fuente de esta actividad se identificó dentro de la corteza prefrontal mediante análisis de fuentes. Nuestros resultados sugirieron que el paradigma experimental que combina sistemas de EEG y seguimiento ocular fue óptimo para evaluar la planificación cognitiva.
Introducción
Durante los últimos 10 años, se han llevado a cabo numerosas investigaciones para examinar el papel de la dinámica neuronal oscilatoria tanto en la cognición como en el comportamiento. Estos estudios han establecido que las interacciones frecuencias específicas entre regiones corticales especializadas y extendidas juegan un papel crucial en la cognición y el control cognitivo 1,2,3. Este enfoque pone de relieve la naturaleza rítmica de la actividad cerebral, que ayuda a coordinar la dinámica cortical a gran escala y sustenta el procesamiento cognitivo y el comportamiento dirigido a objetivos 4,5. Existe evidencia sustancial que muestra que las oscilaciones rítmicas en el cerebro están involucradas en varios procesos cognitivos, incluyendo la percepción6, la atención 7,8,9, la toma de decisiones10, la reactivación de la memoria11, la memoria de trabajo12 y el control cognitivo13. Se han propuesto diferentes mecanismos oscilatorios para guiar el comportamiento dirigido a objetivos, con redes transitorias específicas de frecuencia a gran escala que proporcionan un marco para el procesamiento cognitivo 1,14,15. Por ejemplo, hallazgos recientes sugieren que bandas de frecuencia específicas en el cerebro pueden reflejar un mecanismo de retroalimentación que regula la actividad de picos, proporcionando un marco de referencia temporal para coordinar la excitabilidad cortical y el momento de los picos para producir el comportamiento 16,17,18. Una reseña es proporcionada por Helfrich y Knight19.
Este conjunto de pruebas plantea preguntas sobre cómo la corteza prefrontal (PFC) codifica los contextos de las tareas de planificación y las reglas relacionadas con el comportamiento relevante. Durante mucho tiempo se ha pensado que el PFC apoya el control cognitivo y el comportamiento dirigido a objetivos a través de los patrones oscilatorios de actividad neuronal que genera, sesgando selectivamente la actividad neuronal en regiones cerebrales distantes y controlando el flujo de informaciónen redes neuronales a gran escala. Además, se ha propuesto que las regiones que exhiben sincronía local son más propensas a participar en la actividad interregional 21,22,23. En particular, las oscilaciones corticales de la banda theta (4-8 Hz), medidas por electroencefalograma (EEG) del cuero cabelludo, se han propuesto como un mecanismo potencial para transmitir el control de arriba hacia abajo a través de redes amplias13. Específicamente, la actividad de la banda theta en los seres humanos refleja procesos cognitivos de alto nivel, como la codificación y recuperación de la memoria, la retención de la memoria de trabajo, la detección de novedades, la toma de decisiones y el control de arriba hacia abajo 12,24,25,26.
En relación con esto, Cavanagh y Frank13 propusieron dos mecanismos secuenciales de los procesos de control: el reconocimiento de la necesidad de control y la instanciación del control. El reconocimiento de la necesidad de control puede estar indicado por la actividad theta de la línea media frontal (FMθ) que se origina en la corteza prefrontal medial (mPFC), que se ha descrito en términos de componentes de potencial relacionado con eventos (ERP) que reflejan los procesos de control relacionados con mPFC en respuesta a diversas situaciones, como información novedosa27,28,29, requisitos de estímulo-respuesta conflictivos30, retroalimentación de error31, y detección de errores32. Estos componentes del ERP, que reflejan la necesidad de un mayor control cognitivo en presencia de novedad, conflicto, castigo o error, exhiben una firma espectral común en la banda theta registrada en los electrodos de la línea media frontal 26,27,33,34,35,36,37,38,39,40, 41,42,43,44.
Las respuestas EEG de la actividad FMθ muestran un patrón de restablecimiento de fase y mejora de potencia en la banda de frecuencia theta26. A pesar de las limitaciones del método EEG en cuanto a su resolución espacial, se han recogido diversas fuentes de evidencia para demostrar que la actividad de FMθ es generada por la corteza cingulada media (MCC)13. Se cree que estas dinámicas theta sirven como marcos temporales que regulan los procesos neuronales de la CPFm, que posteriormente se incrementan en respuesta a eventos que requieren un mayor control26. Esto se ha establecido a través del análisis de la fuente 31,33,45,46,47, registros concurrentes de EEG e imágenes de resonancia magnética funcional (fMRI) 48,49, y registros de EEG invasivos en humanos50 y monos 51,52,53.
Sobre la base de estas observaciones, se considera que la línea media frontal theta sirve como un mecanismo universal, un lenguaje común, para ejecutar el control adaptativo en diferentes situaciones donde hay una falta de certeza con respecto a las acciones y los resultados, como durante la planificación. El paradigma conductual que proponemos en este protocolo se ha utilizado para estudiar la planificación cognitiva y sus características temporales y neuronales. Aunque en otros escenarios se han descrito diversos mecanismos de control cognitivo, el protocolo actual ha permitido la descripción reciente de la planificación y sus propiedades neuronales y temporales asociadas54. El proceso cognitivo de la planificación comprende dos fases distintas: la fase de planificación mental, durante la cual se desarrolla una representación interna de una secuencia de planes55, y la fase de ejecución de la planificación, en la que se ejecutan un conjunto de acciones motrices para alcanzar el objetivo previamente planificado56. Se sabe que la planificación requiere la integración de varios componentes de las funciones ejecutivas, incluyendo la memoria de trabajo, el control atencional y la inhibición de la respuesta, lo que hace que la manipulación experimental y la medición aislada de estos procesos sean un desafío57,58.
Los estudios de neuroimagen sobre la planificación cognitiva han utilizado comúnmente paradigmas conductuales como la Torre de Londres 59,60,61; Sin embargo, con el fin de controlar los factores de confusión, las tareas utilizadas para el estudio de la planificación cognitiva pueden volverse limitadas y artificiales, lo que lleva a una menor validez predictiva y ecológica 62,63,64,65. Para superar este problema en el campo de la neuropsicología, se han propuesto situaciones de planificación del mundo real como tareas ecológicas62,63. La subprueba de la tarea del mapa zoológico en la batería de evaluación conductual del síndrome disejecutivo mide las habilidades de planificación y organización de una manera más natural y relevante64,66. Esta prueba es una prueba de lápiz y papel que consiste en planificar una ruta para visitar 6 de los 12 lugares en un mapa del zoológico. Las ubicaciones son lugares comunes que se pueden encontrar en un zoológico normal, como una casa de elefantes, una jaula de leones, un área de descanso, una cafetería, etc. Existen dos condiciones que evalúan diferentes niveles de planificación: i) la condición de formulación, donde se instruye a los sujetos a planificar una ruta para visitar seis lugares en el orden de su elección pero de acuerdo con un conjunto de reglas; y ii) la condición de ejecución, donde se instruye a los sujetos a visitar seis lugares en un orden específico y siguiendo también un conjunto de reglas. Estas dos condiciones proporcionan información sobre las habilidades de planificación en problemas mal estructurados (formulación) y bien estructurados (ejecución)67. La primera se presenta como una tarea cognitiva más exigente en una situación abierta porque requiere que los sujetos desarrollen una estrategia lógica para lograr el objetivo. Antes de trazar una ruta, se debe idear una secuencia de operadores; de lo contrario, es probable que se produzcan errores. Por otro lado, la condición de ejecución requiere una menor demanda cognitiva porque resolver una tarea que implica seguir una estrategia impuesta específica solo requiere que el sujeto monitoree la implementación del plan formulado para lograr el objetivo66. Por otro lado, el Laberinto de Porteus es una tarea bien conocida en el campo de la psicología, particularmente en las áreas de la psicología cognitiva y la neuropsicología, y ha sido ampliamente utilizada como herramienta para evaluar diversos aspectos de la cognición, como la resolución de problemas y la planificación68,69. La tarea del Laberinto de Porteus es una tarea de lápiz y papel que comienza con un simple análisis de estímulos visuales y se vuelve cada vez más difícil. El sujeto debe encontrar y trazar el camino correcto desde un punto de partida hasta una salida (entre varias opciones) mientras sigue reglas, como evitar caminos que se cruzan y callejones sin salida, y actuar lo más rápido posible68. Cada vez que aparece una bifurcación mientras dibujan el camino, los sujetos toman decisiones para llegar a la meta y evitar infringir las reglas dadas69.
Teniendo en cuenta las limitaciones y fortalezas de las tareas de uso común y ecológicas, diseñamos nuestro paradigma de comportamiento basado principalmente en la Tarea66 del Mapa del Zoológico y la Tarea68 del Laberinto de Porteus. El paradigma conductual consta de cuatro etapas distintas que abarcan el proceso cognitivo de planificación en un escenario de la vida diaria. Estas etapas son las siguientes: Etapa 1, planificación, donde los participantes tienen la tarea de crear una ruta para visitar varios lugares en un mapa, asegurando el cumplimiento de las reglas establecidas; Etapa 2, mantenimiento, donde se requiere que los participantes mantengan la ruta planificada en su memoria de trabajo; Etapa 3, ejecución, donde los participantes ejecutan su ruta previamente planificada dibujando y monitoreando de cerca su precisión; y Etapa 4, respuesta, donde los participantes reportan la secuencia de animales visitados de acuerdo a su ruta54 planificada. Nuestro paradigma permite la medición de diferentes parámetros de la capacidad de planificación utilizando diferentes etapas, que reflejan los diversos componentes de la planificación (como la memoria de trabajo, la atención ejecutiva y las habilidades visoespaciales) de una manera más realista, ya que el trazado de rutas es un hecho común en la vida diaria. Además, para controlar los factores de confusión, el paradigma incluye una tarea de control con una estructura de tarea de planificación y estímulos equivalentes, que involucra a los componentes cognitivos ejecutivos que también participan en la planificación, pero excluye el componente del proceso de planificación. Esto permite separar el componente del proceso de planificación para la comparación de los marcadores electrofisiológicos y los parámetros de comportamiento54.
Además, el seguimiento ocular ha hecho contribuciones significativas a los estudios de neurociencia cognitiva al proporcionar un método no invasivo para medir y analizar los movimientos oculares, que puede proporcionar información valiosa sobre los procesos cognitivos y los mecanismos neuronales que subyacen a la percepción, la atención y las funciones cognitivas. La medición de diferentes tipos de movimientos oculares con un sistema de seguimiento ocular puede proporcionar información valiosa sobre los procesos cognitivos y los mecanismos neuronales implicados en la planificación. Por ejemplo, se pueden medir los siguientes aspectos: las fijaciones, que son los periodos de mirada estable durante los cuales se adquiere información visual70; los movimientos sacádicos, que son los movimientos oculares rápidos que se utilizan para desplazar la mirada de un lugar a otro71; persecución suave, que es un tipo de movimiento ocular que permite a los ojos seguir un objeto en movimiento sin problemas72; microsacádicos, que son movimientos oculares pequeños y rápidos que ocurren incluso durante las fijaciones73; y los parpadeos, que son una acción refleja que ayuda a mantener los ojos lubricados y protegerlos de objetos extraños74. Estos movimientos oculares pueden proporcionar información sobre los procesos cognitivos involucrados en la búsqueda visual, la asignación de atención70, el seguimiento visual72, la percepción73 y la memoria de trabajo74, que son componentes importantes para la planificación y el control cognitivo.
Por otro lado, estudios recientes sobre el sistema locus coeruleus-norepinefrina (LC-NE) han demostrado su relevante papel en el control cognitivo75. El locus coeruleus (LC) se proyecta a varias regiones cerebrales, como la corteza cerebral, el hipocampo, el tálamo, el mesencéfalo, el tronco encefálico, el cerebelo y la médula espinal 76,77,61. Las inervaciones LC-NE particularmente densas reciben áreas cerebrales PFC asociadas con el control cognitivo75. Además, algunos estudios indican que la hiperactividad crónica del sistema LC puede contribuir a los síntomas del trastorno maníaco-depresivo, como la impulsividad y el insomnio. Por el contrario, una disminución crónica de la función de la LC se ha relacionado con una reducción de la expresión emocional, una característica prevalente entre los pacientes que sufren de depresión78. Una respuesta hiperactiva del locus coeruleus a los estímulos puede conducir a una respuesta excesiva en individuos con trastornos de estrés o ansiedad79. Por lo tanto, las alteraciones en el sistema LC-NE pueden contribuir a los síntomas de desregulación cognitiva y/o emocional. Se pueden utilizar técnicas no invasivas para examinar la actividad del locus coeruleus, uno de los cuales son los cambios en el diámetro de la pupila, que en su mayoría están controlados por la noradrenalina liberada por el locus coeruleus. La noradrenalina actúa sobre el músculo dilatador del iris estimulando los receptores alfa-adrenérgicos y sobre el núcleo de Edinger-Westphal, que envía señales al ganglio ciliar y controla la dilatación del iris a través de la activación de los receptores adrenérgicos alfa-2 postsinápticos 66,80,81,82. Las grabaciones directas de las neuronas LC de los monos han confirmado la relación entre la actividad de la LC-NE, el diámetro de la pupila y el rendimiento cognitivo83. La dilatación de la pupila se ha observado repetidamente en respuesta a mayores demandas de procesamiento en varias tareas cognitivas 71,84,85,86,87.
Los marcadores electrofisiológicos de control cognitivo combinados con el seguimiento ocular y los registros pupilares podrían desentrañar preguntas cruciales sobre cómo se implementan el control cognitivo y la planificación en el cerebro. La importancia de utilizar nuestro protocolo que combina sistemas de EEG y seguimiento ocular es doble. Por un lado, el control cognitivo parece requerir la participación de la actividad cerebral distribuida en relaciones temporales precisas, que constituyen candidatos ideales para estudiar la función de la red cerebral. Por otro lado, las anormalidades en cualquiera de estas capacidades tienen un impacto severo en el comportamiento normal, como podría ser en el caso de una variedad de trastornos cognitivos y neuropsiquiátricos, como el trastorno por déficit de atención e hiperactividad88,89, el trastorno depresivo mayor90,91, el trastorno bipolar91, la esquizofrenia92, la demencia frontotemporal93, así como los trastornos debidos a lesiones frontales94. Además, el protocolo actual permite utilizar la pupilometría como parámetro para comparar la actividad y las oscilaciones de LC-NE mediante seguimiento ocular y electroencefalografía. Esto no solo podría proporcionar evidencia de la relación teórica entre LC-NE, pupilometría y marcadores neuronales en humanos, sino que también podría permitir el seguimiento de la trayectoria de desarrollo de las características relacionadas con el sistema LC-NE durante la planificación cognitiva. Sin embargo, en nuestro modelo, nos centramos en probar si había un patrón específico de movimientos sacádicos durante la planificación que podría dar lugar a cambios específicos en la oscilación95. Además, utilizamos un sistema de seguimiento ocular como una parte importante del examen de la ejecución conductual de un plan en la fase de ejecución de nuestro paradigma conductual.
En resumen, este protocolo podría producir modelos comprobables de la dinámica de las redes cerebrales que podrían servir como plataforma tanto para futuras investigaciones básicas como para eventuales aplicaciones clínicas y terapéuticas.
Protocolo
Todos los procedimientos de este protocolo fueron aprobados por el comité de bioética de la Facultad de Medicina de la Pontificia Universidad Católica de Chile, y todos los participantes firmaron un consentimiento informado antes del inicio del estudio (proyecto de investigación número: 16-251).
1. Reclutamiento de participantes
- Reclutar a adultos diestros sanos (hombres y mujeres) con visión normal o corregida a normal, y evaluarlos según los criterios de inclusión/exclusión.
NOTA: En este estudio, se reclutaron 27 individuos sanos con edades comprendidas entre los 19 y los 38 años de edad y que hablaban con fluidez. El tamaño de la muestra puede variar en función del nivel deseado de potencia estadística, y el rango de edad puede variar en función de la pregunta de investigación específica que se vaya a abordar. En nuestro protocolo calculamos el tamaño de la muestra teniendo en cuenta la prueba estadística de rangos con signo de Wilcoxon, un tamaño del efecto de 0,7, un nivel de alfa de 0,05 y una potencia de 0,95, como se describe en Faul et al.96. Se utilizó la MINI-International Neuropsychiatric Interview97, aplicada por un psicólogo entrenado, para evaluar a los participantes en cuanto a los criterios de inclusión/exclusión. Reclutar solo sujetos diestros para reducir la variabilidad en la señal de EEG porque los individuos zurdos podrían presentar una distribución topográfica diferente de la actividad de EEG 98,99,100.
2. Preparación de estímulos
- Para la tarea de planificación, cree un conjunto de estímulos utilizando un software de edición de gráficos vectoriales (ver Tabla de Materiales). Para cada estímulo, diseña un laberinto en escala de grises que represente un mapa del zoológico. Dentro del laberinto, haga una puerta de entrada y varios caminos que conduzcan a las ubicaciones de los animales (por ejemplo, en este estudio, había cuatro ubicaciones de animales, ver Figura 1).
NOTA: En este estudio, creamos 36 laberintos en los que cada estímulo consistía en un mapa del zoológico con una puerta de inicio, cuatro imágenes de animales ubicados en el laberinto y varios caminos. Los caminos en el laberinto pueden o no conducir a las ubicaciones de los animales. A menudo se prefiere el uso de estímulos en escala de grises con contraste reducido para la pupilometría porque reduce la estimulación de los conos de la retina, que son responsables de la visión del color. Este cambio en el énfasis del estímulo permite una medición más sensible de los cambios en el tamaño de la pupila, que se cree que reflejan cambios en el estado de excitación o atención. Además, el uso de estímulos en escala de grises reduce la variabilidad en la medición debido a las diferencias en la visión del color entre individuos101. - Con el fin de obtener diferentes niveles de complejidad en la tarea final, divida los estímulos en función del número de soluciones válidas de acuerdo con el objetivo y las reglas establecidas (en particular, el objetivo es planificar un camino para visitar las ubicaciones de los animales). El número de soluciones válidas se refiere al número de rutas posibles para planificar siguiendo las reglas (véanse las reglas en la Figura 2 y el paso 5.12.1.). Clasifique los estímulos con más de cinco soluciones posibles como "fáciles" y aquellos con cinco o menos soluciones posibles como "difíciles". A continuación, cree un número igual de pruebas para cada categoría.
NOTA: Alternativamente, solicite a los autores los estímulos creados para Domic-Siede et al.54 , ya que dichos estímulos fueron creados siguiendo estas instrucciones. Tenga en cuenta que todos los materiales están disponibles bajo pedido, pero las especificaciones se detallan aquí. En este estudio, creamos 18 ensayos fáciles y 18 ensayos difíciles. Evaluar las diferencias en los niveles de dificultad a nivel conductual y electrofisiológico es importante porque ayudará a determinar si se está midiendo la demanda cognitiva/esfuerzo cognitivo/dificultad o aspectos intrínsecos de la planificación cognitiva (ver resultados representativos y secciones de discusión). - Para la tarea de control, utilice la misma estructura que la tarea de planificación (período de evaluación, mantenimiento, ejecución, respuesta, véase la Figura 2) y utilice los mismos estímulos creados para la tarea de planificación, pero añada una línea dibujada que represente un camino marcado para visitar la secuencia de ubicaciones de animales desde la puerta hasta la última ubicación (véase la Figura 1B). Haga que el camino marcado sea de un color ligeramente más oscuro que los caminos principales del laberinto, con un contraste bajo evaluado con un luxómetro (consulte el paso 2.4).
NOTA: La idea detrás de esto es mantener las características psicofísicas de ambas condiciones (tareas de planificación y control) lo más similares posible. Los caminos trazados de los laberintos pueden seguir las reglas o no (ver sección 5 del protocolo para más detalles sobre las instrucciones dadas a los participantes). En este estudio, la mitad de los estímulos tenían una secuencia de visita correcta siguiendo las reglas, mientras que la otra mitad presentaba errores (como usar el mismo camino dos veces o cruzar callejones sin salida, ver paso 5.12.1 y paso 5.12.3 y Figura 2). - Evalúe la iluminancia de los estímulos utilizando un luxómetro colocado en la mentonera que usarán los sujetos (ver paso 4.5 y paso 4.6) y a la misma distancia de la pantalla. Cada estímulo de cada condición produce un valor lux. Registre cada valor manualmente para realizar análisis posteriores.
NOTA: No se esperan diferencias en la iluminancia entre condiciones (ver paso 4.6). De lo contrario, comprueba el contraste de los estímulos. Esto es relevante si se va a medir el diámetro de la pupila102. - Cree un estímulo que represente la retroalimentación correcta (pulgar hacia arriba cuando sea correcto) y otro estímulo que represente la retroalimentación incorrecta (pulgar hacia abajo cuando sea incorrecto) utilizando también un editor de gráficos vectoriales (ver Tabla de Materiales) (Figura 2).

Figura 1: Estímulos de la tarea experimental y de control. Se muestran ejemplos ilustrativos de los estímulos de la tarea de (A) planificación y (B) control. Los estímulos representan un mapa del zoológico que consta de una puerta, cuatro ubicaciones de animales en diferentes lugares y varios caminos. Los estímulos para ambas condiciones fueron similares; la única diferencia era que para la tarea de control, (B) los estímulos tenían una línea marcada que indicaba un camino ya existente (línea negra aquí con fines ilustrativos). Esta línea en los estímulos de control reales era ligeramente más oscura, con un contraste bajo controlado por la iluminancia (ver paso 2.4). Esta figura ha sido modificada a partir de Domic-Siede et al.54. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diseño experimental. (A) Ensayo de tareas de planificación. Los ensayos en esta condición comenzaron con una cruz de fijación de 3 s. Luego, se instruyó a los participantes para planificar un camino para visitar las cuatro ubicaciones de animales siguiendo un conjunto de reglas (10 s como máximo). A continuación, apareció una cruz de fijación desplazada (3 s), seguida de la aparición del laberinto de nuevo. En este período (ejecución), los sujetos debían ejecutar el trazado planificado en el período de planificación anterior utilizando su mirada con retroalimentación visual en línea (dada por el sistema de seguimiento ocular), que delineaba el movimiento de su mirada en tiempo real (línea oscura) (10 s máximo). Posteriormente, en el período de respuesta, los sujetos debían informar sobre la secuencia realizada durante la ejecución ordenando la visita de los animales. De acuerdo con sus respuestas, se entregaron retroalimentación. (B) Prueba de tarea de control. Los ensayos en esta condición comenzaron con una cruz de fijación de 3 s. Luego, se instruyó a los participantes para que evaluaran si un camino trazado (línea oscura) seguía las reglas o no. A continuación, apareció una cruz de fijación desplazada (3 s), seguida de la aparición del laberinto de nuevo. En este período, los sujetos tuvieron que volver a dibujar el camino ya trazado con retroalimentación visual en línea, como en el período de ejecución de la planificación (10 s como máximo). Posteriormente, en el período de respuesta, los sujetos debían responder (sí o no) si la secuencia trazada seguía las reglas establecidas anteriormente. Esta figura ha sido modificada a partir de Domic-Siede et al.54. Haga clic aquí para ver una versión más grande de esta figura.
3. Planificación y control de la programación de tareas
- Escribir un guión que codifique un paradigma de tarea de planificación basado en la Tarea66 del Mapa del Zoológico y el Laberinto de Porteus68utilizando un software de presentación de estímulos/experimentos conductuales (ver Tabla de Materiales y el Archivo Suplementario).
- Codifique la tarea considerando dos condiciones (una condición de planificación y una condición de control) con una estructura similar a la explicada en la sección 2 y la sección 4 (ver Figura 2 y el Archivo Complementario).
NOTA: Es importante utilizar la misma estructura en ambas condiciones para controlar los factores de confusión y los componentes perceptivos involucrados en el proceso de resolución de las demandas de la tarea (Figura 2). El uso de la misma estructura mejora la evaluación del proceso cognitivo específico implicado en la planificación cognitiva. - Sincronice la comunicación entre la computadora de visualización, la computadora de EEG y la computadora host (computadora de seguimiento ocular) a través de Ethernet y comunicación de puerto paralelo que envía impulsos lógicos de transistor-transistor (TTL) desde la computadora de visualización (consulte la Figura 3).
- Escriba un código para calibrar los movimientos oculares con el sistema de seguimiento ocular al comienzo de las tareas de planificación y control y después de cada cinco ensayos completados, ya que la posición de la mirada en la pantalla es crucial para el período de ejecución (consulte los pasos 3.2.3 y 3.3.3 del protocolo, la sección de discusión y el código en el archivo complementario).
NOTA: Puede haber retrasos en la comunicación con la computadora. Existen varios métodos para medir el retraso entre pulsos TTL en dos computadoras diferentes, pero un enfoque común es usar un dispositivo de hardware como un osciloscopio digital o un analizador lógico. Otro enfoque consiste en utilizar métodos basados en software, como el envío de los impulsos TTL a través de una conexión de red y el uso de herramientas de análisis de red para medir el retraso. Otro enfoque consiste en sincronizar los relojes de los dos ordenadores, ya sea mediante un sistema de posicionamiento global (GPS) o un servidor de protocolo de tiempo de red (NTP) o mediante una solución de sincronización basada en hardware, calcular el retraso entre la marca de tiempo y la hora de llegada de cada pulso, y promediar los resultados para obtener el retraso general entre los dos ordenadores.
- Codifique la tarea considerando dos condiciones (una condición de planificación y una condición de control) con una estructura similar a la explicada en la sección 2 y la sección 4 (ver Figura 2 y el Archivo Complementario).
- Escriba un código para la tarea de planificación con la siguiente estructura: el período de planificación, el período de mantenimiento, el período de ejecución de la planificación, el período de respuesta y comentarios (Figura 2, Expediente Complementario).
- El período de planificación: Inicie la condición de planificación estableciendo una cruz de fijación presentada durante 3 s como línea base.
- Presentar aleatoriamente el conjunto de laberintos uno por uno (36 en este estudio).
NOTA: En este período de planificación, se pide a los participantes que planifiquen un camino para visitar las cuatro ubicaciones de animales, con un tiempo máximo de 10 s, siguiendo una serie de reglas (las reglas se les explican previamente; ver la sección 5 del protocolo para ver las reglas dadas, así como la Figura 2). - Incluya un disparador TTL en el código que señale el inicio de la presentación del estímulo mediante un código de etiqueta, y envíe este disparador a la computadora de EEG y a la computadora host del rastreador ocular para análisis más estrechos y en ventanas.
- Escriba en el código que el período de planificación culmina una vez que se presiona un botón de un joystick/teclado cada vez que el sujeto termina de planificar o si se excede el tiempo máximo. El tiempo de reacción (RT) debe registrarse en el archivo de registro para su posterior análisis.
NOTA: Para este período, utilizamos un código de activación con el número 1, pero se recomienda el uso de etiquetas de descriptores de eventos jerárquicos (HED) sobre códigos numéricos, ya que las etiquetas HED proporcionan significado y estructura al contenido, lo que facilita a otros investigadores o colaboradores la comprensión del contenido de los datos. - El período de mantenimiento: Inicie este período utilizando una cruz de fijación desplazada durante 3 s. Ubique la cruz de fijación desplazada en la posición espacial donde se encuentra la puerta del laberinto para anticipar la posición inicial (puerta) del mapa del zoológico (ver Figura 2).
NOTA: El propósito de este período es triple. En primer lugar, la cruz de fijación desplazada facilita la ejecución de la traza que representa el trayecto previsto para el siguiente período (véase el paso 3.2.8). En segundo lugar, durante este período, los participantes mantienen en su memoria de trabajo el plan elaborado durante el período de planificación. Finalmente, este período sirve como un intervalo entre juicios para delimitar el final del período de planificación y el comienzo del siguiente período: el período de ejecución de la planificación. - El plazo de ejecución del planeamiento: Después de que se muestre la cruz de fijación desplazada durante 3 s durante el período de mantenimiento, vuelva a presentar el laberinto.
- Envíe un disparador TTL al EEG y a la computadora de seguimiento ocular host para indicar el comienzo de este período mediante un código de etiqueta específico.
- Escriba un código para proporcionar información visual en tiempo real (una línea oscura, consulte el período de ejecución en la Figura 2) de la posición de la mirada del sujeto aproximadamente 992 ms después del inicio de este período.
NOTA: Comenzar a delinear con un retraso (1.000 ms aproximadamente) da tiempo a los sujetos para orientarse en el laberinto, lo que les permite delinear su ruta planificada anteriormente (durante el período de planificación) con una línea oscura. - Registre las coordenadas de las rutas para una mayor reconstrucción de las rutas realizadas por los sujetos y puntúe el rendimiento fuera de línea (consulte el paso 6.1.1, Figura 4).
- Asegure un tiempo máximo de 10 s para trazar la ruta planificada y permita que los sujetos finalicen este período presionando un botón. De esta manera, los sujetos pueden controlar cuándo han terminado su ruta dibujada.
- Guarde el RT en el archivo de registro para realizar análisis posteriores.
- El período de respuesta: Escriba un código para el período de respuesta, que comienza después de 10 segundos de la ejecución de la planificación o al presionar un botón al final del período de ejecución de la planificación, en el que el laberinto desaparece pero los animales y sus posiciones espaciales permanecen en la pantalla.
- Coloque cuatro círculos vacíos horizontalmente en la parte inferior de la pantalla en el período de respuesta.
NOTA: El propósito de este período es permitir que los sujetos indiquen la secuencia de animales visitados durante el período de ejecución de la planificación colocando los animales en los círculos en el mismo orden en que los visitaron usando un joystick o teclado. - Configure el programa/código para permitir que los sujetos usen el joystick o el teclado para seleccionar cada uno de los animales (cuatro animales en este estudio) presentados anteriormente e insertarlos en cada uno de los cuatro círculos (ver Archivo Suplementario y Figura 2).
- Retroalimentación: Escriba un código para entregar 3 s de retroalimentación a los participantes. Se debe mostrar una imagen con el pulgar hacia arriba en respuesta a las combinaciones válidas de animales visitados si se siguen las reglas, mientras que se debe mostrar una imagen con el pulgar hacia abajo si la combinación informada no es válida.
- Envíe un disparador TTL, utilizando un código de etiqueta específico para la retroalimentación correcta y otro código de etiqueta para la incorrecta, a las computadoras de EEG y seguimiento ocular.
NOTA: La razón para dar retroalimentación es facilitar el seguimiento del rendimiento y mantener la motivación durante la tarea. Esta provisión de retroalimentación en tiempo real mejora el efecto de recompensa y fomenta el rendimiento adecuado de la tarea103.
- Escriba un código para la tarea de control con la misma estructura que la condición de planificación: un período de control, un período de mantenimiento, un período de ejecución de control, un período de respuesta y comentarios (consulte el archivo complementario, figura 2).
- El período de control: Escriba un código para el período de condición de control para mitigar los factores de confusión. El código para este período debe comenzar con una cruz de fijación presentada durante 3 s como línea de base.
NOTA: Dado que la tarea de planificación exige predominantemente la implementación de la planificación, pero también recluta otros dominios cognitivos como parte de la función ejecutiva, como la función visoespacial, la memoria de trabajo, el control atencional, el control inhibitorio, etc.66,88,104,105, una tarea de control es crucial para mitigar los factores de confusión. Por lo tanto, el objetivo principal de esta tarea es exigir todas las funciones cognitivas y perceptivas necesarias para resolver la tarea de planificación mientras se elimina la implementación de la planificación cognitiva54. - Presente aleatoriamente los laberintos de la condición de control uno por uno (laberintos con un camino marcado ya trazado). Codifique un tiempo máximo de 10 s.
- Incluya un disparador TTL en el código que señale el inicio de la presentación del estímulo mediante una etiqueta, y envíe este disparador a la computadora de EEG y a la computadora host del rastreador ocular.
- Escriba en el código que este período de control culmina una vez que se presiona un botón de un joystick/teclado cada vez que el sujeto termina o si se excede el tiempo máximo.
NOTA: Se instruye a los sujetos para que evalúen los caminos marcados (ya sea que estén siguiendo las reglas o no, consulte el paso 5.12 para obtener detalles sobre las instrucciones dadas a los participantes). - Guarde el tiempo de reacción (RT) en el archivo de registro para análisis posteriores.
- El período de mantenimiento: Una vez finalizado el periodo de control, presentar una cruz de fijación desplazada durante 3 s.
- Como período de ejecución de la planificación, coloque la cruz de fijación donde se encuentra la entrada de la puerta para facilitar el dibujo de la mirada para el siguiente período.
- El período de ejecución del control: Vuelva a presentar el laberinto y envíe simultáneamente un disparador TTL al EEG y a los ordenadores de seguimiento ocular del host con una etiqueta que señale el inicio del período de ejecución.
- Repita el mismo código que para el período de ejecución de la planificación para proporcionar información en línea sobre la posición de la mirada y para delinear y superponer su mirada con la ruta trazada.
- Asegure un tiempo máximo de 10 s para trazar el camino y permita que los sujetos finalicen este período presionando un botón.
- Guarde el RT en el archivo de registro para realizar análisis posteriores.
- El período de respuesta del control: Una vez finalizado el periodo de ejecución del control, presente un signo de interrogación que indique el plazo de respuesta.
- Programe dos botones, respectivamente, para que los sujetos den una respuesta mediante un joystick o un teclado.
NOTA: Aquí, se pide a los sujetos que respondan si la secuencia marcada por el trazo era correcta o no seleccionando un botón para correcto/SÍ y otro para incorrecto/NO. - Guarde la precisión en el archivo de registro.
- Retroalimentación: Escriba un código para entregar 3 s de retroalimentación correcta cada vez que los sujetos respondan correctamente (una imagen con el pulgar hacia arriba) y entregue 3 s de retroalimentación incorrecta cuando los sujetos respondan incorrectamente (una imagen con el pulgar hacia abajo).
- Al igual que en la condición de planificación, envíe un disparador TTL al EEG y a las computadoras de seguimiento ocular host con una etiqueta para la retroalimentación correcta y otra etiqueta para la retroalimentación incorrecta.
- El período de control: Escriba un código para el período de condición de control para mitigar los factores de confusión. El código para este período debe comenzar con una cruz de fijación presentada durante 3 s como línea de base.
- Tareas formativas: Crear estímulos, escribir un código, y presentar antes de las tareas de planificación y control antes mencionadas una breve sesión de entrenamiento de aproximadamente seis ensayos/laberintos para cada condición (planificación y control)
NOTA: La idea es garantizar la familiarización con la configuración de la tarea. Se recomienda establecer criterios para proceder. En este estudio, si los últimos tres ensayos eran correctos, y los participantes informaron comprender el objetivo y el procedimiento al final de la sesión de entrenamiento, los participantes procedían a la sesión experimental.
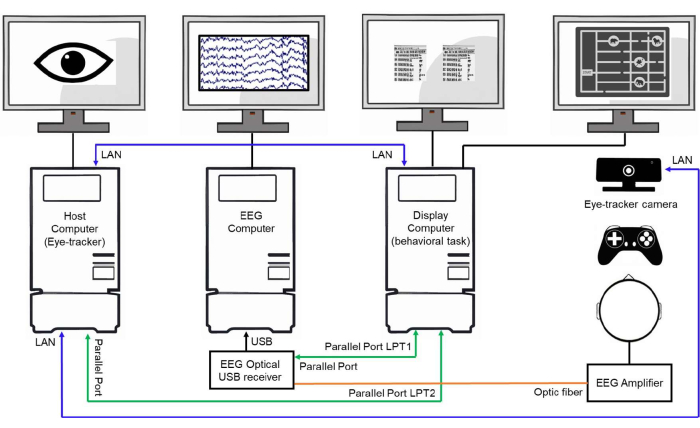
Figura 3: Ejemplo de una configuración de laboratorio. Representación esquemática de una configuración de laboratorio que muestra tres computadoras interconectadas. La computadora host (computadora de seguimiento ocular) es responsable de rastrear y almacenar los datos de movimiento ocular. La computadora de EEG adquiere y almacena las señales de EEG. La computadora de visualización controla el experimento de comportamiento, presenta los estímulos a los sujetos y envía disparadores de eventos a las computadoras host y EEG a través de puertos paralelos y conexiones LAN para sincronizar la recopilación de datos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Reconstrucción de la ruta a partir de la retroalimentación visual en línea proporcionada por el sistema de seguimiento ocular. Ejemplos ilustrativos de una reconstrucción de ruta a partir de la ejecución motora de un plan (A, en morado, período de ejecución de planificación) y un período de ejecución de control (B, línea en verde) y con datos de seguimiento ocular. La ruta reconstruida en el período de ejecución de la planificación se utiliza para evaluar la precisión de cada prueba de tarea de planificación. Haga clic aquí para ver una versión más grande de esta figura.
4. Entorno y equipo de laboratorio
- Utilice un sistema de adquisición de EEG para registrar la actividad de EEG del cuero cabelludo del participante, con los electrodos de EEG colocados de acuerdo con el sistema internacional 10-20106. Coloque dos electrodos en las mastoides del participante para volver a referenciarlos sin conexión. Utilice electrodos de electrooculograma para identificar señales de movimiento vertical, horizontal y de parpadeo durante la inspección visual.
- Utilice un software de adquisición de EEG para la adquisición de datos de EEG con una frecuencia de muestreo de 2.048 Hz o 1.024 Hz y un filtro de paso de banda entre 0,1 y 100 Hz en la computadora de EEG.
NOTA: Las frecuencias de muestreo de 1.024 Hz y 2.048 Hz proporcionan suficiente resolución para analizar oscilaciones de baja frecuencia. Es importante adquirir señales de EEG con una alta frecuencia de muestreo, como más de 1.000 Hz, al analizar oscilaciones de baja frecuencia para asegurarse de que las señales de baja frecuencia no se alialicen. - Utilice un ordenador de visualización, que esté conectado con el ordenador de EEG y el ordenador de seguimiento ocular anfitrión a través de puertos paralelos y Ethernet y que tenga una plataforma para realizar experimentos de comportamiento instalada en él, para proyectar los estímulos en un monitor extendido con una resolución mínima de 1.920 píxeles x 1.080 píxeles y una frecuencia de actualización de 60 Hz. Coloque este monitor a una distancia aproximada de 82 cm del sujeto.
NOTA: Utilizamos un monitor de 24 pulgadas con una frecuencia de actualización establecida en 144 Hz ubicado a 82 cm de distancia del participante. Se recomienda utilizar un monitor con un tamaño de pantalla de al menos 19 pulgadas para experimentos cognitivos que impliquen el registro de EEG y movimientos oculares. Además, una recomendación general es colocar el monitor a una distancia que permita al participante realizar cómodamente la tarea y mantener una mirada estable en la pantalla, al tiempo que permite registros precisos de EEG y movimientos oculares. Es aconsejable probar y ajustar la configuración según sea necesario para garantizar los mejores resultados. - Utilice un sistema de seguimiento ocular para dar a los participantes información en tiempo real sobre sus movimientos oculares durante los períodos de ejecución y registre el tamaño de la pupila. Ajuste la frecuencia de muestreo a 1.000 Hz para una resolución temporal adecuada.
- Evite los movimientos de la cabeza. Se necesitan restricciones de movimiento de la cabeza hacia la izquierda y hacia la derecha y hacia arriba y hacia abajo para mantener el ojo dentro del campo de visión de la cámara de video. La restricción de movimiento hacia adelante y hacia atrás es necesaria para mantener el ojo en el rango focal de la cámara de video. Use una combinación de apoyos para la frente y la barbilla para mantener los movimientos dentro de este rango.
- Evalúe la luminancia de los estímulos utilizando un luxómetro digital o similar para comparar las diferencias entre los estímulos de planificación y los estímulos de control.
NOTA: Se puede utilizar una prueba estadística como una prueba t o Wilcoxon para evaluar las diferencias entre los estímulos de las dos condiciones. - Utilice un joystick o teclado de control con al menos cuatro botones: dos botones para las preguntas Sí/No de la condición de control; uno de estos dos botones para finalizar las pruebas; y otros dos botones para el período de respuesta de la condición de planificación para avanzar o retroceder para insertar los animales en cada uno de los cuatro círculos en la parte inferior de la pantalla.
5. Sesiones de grabación de electroencefalografía y seguimiento ocular
- Antes de comenzar el estudio, pida a los participantes que completen el consentimiento informado por escrito y firmado.
- Antes de la sesión de grabación, pida a los participantes que no asistan con maquillaje (el rímel y el delineador de ojos pueden ser detectados como una pupila por el sistema de seguimiento de ojos), que hayan tomado drogas o cafeína107,108, o si sienten fatiga severa109 (estrés, falta de sueño, etc.).
- Pida a los participantes que completen una encuesta demográfica para proporcionar información sobre su sexo, edad, lateralidad, lengua materna e historial neuropsiquiátrico a través de la entrevista neuropsiquiátrica MINI-International97 aplicada por un psicólogo capacitado.
- Limpie la frente, el cuero cabelludo, las mastoides y la posición de la piel del electrooculograma (EOG) del sujeto con una toallita con alcohol.
- Coloque todos los electrodos externos en el participante. Coloque el EOG horizontal bipolarmente en el canto exterior de ambos ojos y el EOG vertical por encima y por debajo del ojo derecho del participante. Coloque dos electrodos externos en la mastoides derecha e izquierda para una rereferenciación posterior.
- Mida la cabeza del sujeto y coloque el gorro de EEG del tamaño correcto de acuerdo con el sistema internacional extendido 10-20. Para hacer esto, busque y coloque el electrodo Cz siguiendo estos pasos:
- Identifique la línea media del cuero cabelludo inspeccionando visualmente la línea del cabello y la parte superior de la nariz. Identifica una línea que conecte estos dos puntos para definir la línea media.
- Localiza el Cz. El Cz se define típicamente como el punto medio entre los dos puntos preauriculares (es decir, los puntos ubicados justo delante de cada oreja). Localice estos puntos y luego identifique una línea que los conecte para identificar la ubicación aproximada de la Cz.
- Mida y marque la Cz. Mida la distancia desde la nasion (es decir, la protuberancia ósea en la parte superior de la nariz) hasta la Cz. La distancia desde el nasion hasta el Cz es típicamente alrededor del 53% de la circunferencia total de la cabeza en el sistema 10-20. Marque la ubicación de la Cz con un bolígrafo u otra herramienta de marcado.
NOTA: Es importante seguir un procedimiento coherente y estandarizado para la colocación de electrodos con el fin de minimizar los errores y garantizar la validez de los datos del EEG. Se recomienda desarrollar un procedimiento de colocación estándar. Cree un procedimiento estándar para colocar los electrodos en el cuero cabelludo de cada sujeto y asegúrese de que se utilice el mismo procedimiento para todos los sujetos. En caso de que haya un equipo o personal que realice las grabaciones, capacite a los técnicos o asistentes de investigación sobre el procedimiento de colocación adecuado para asegurarse de que coloquen los electrodos de manera consistente y precisa. Además, la digitalización de las posiciones de los electrodos para cada sujeto sería un enfoque deseable para realizar un análisis de la fuente más adelante. En los estudios de EEG, la ubicación tridimensional (3D) precisa de cada electrodo en la cabeza del sujeto es frecuentemente un requisito para establecer una correlación entre los datos del EEG y la actividad cerebral correspondiente110. Esta información también es crítica para la correcta alineación de los datos del EEG con las imágenes anatómicas derivadas de las técnicas de imagen de RM o TC111,112.
- Inserte gel conductor en cada orificio de la gorra con una jeringa con una aguja desafilada, alejando el cabello del participante con la punta. Después, coloque todos los electrodos del cuero cabelludo en el gorro de electroencefalograma.
- Verifique las impedancias con el software de registro de EEG y asegúrese de que estén por debajo del nivel de resistencia recomendado por el sistema de EEG.
- Pida al participante que permanezca lo más quieto posible durante el experimento. Inspeccione la señal de EEG y pruébela pidiéndole al participante que parpadee, haga una mandíbula y permanezca unos segundos con los ojos cerrados.
- Siente al participante en una habitación oscura y con atenuación del sonido. Utilice una mentonera para estabilizar su cabeza y minimizar el movimiento, y compruebe que hay una distancia aproximada de 82 cm entre la mentonera y el centro de la pantalla de presentación de estímulos.
- Coloque un joystick o teclado frente al participante para las respuestas.
- Instrucciones: Dar instrucciones orales con ayudas visuales antes de comenzar cada afección (planificación y control). En las instrucciones, incluya ejemplos visuales de los estímulos y explique cómo resolver los laberintos en las condiciones de planificación y control, respectivamente.
- Para la tarea de planificación, instruya a los sujetos a encontrar un camino para completar una secuencia de visitas a ciertos lugares de animales (cuatro lugares en este estudio) en diferentes lugares del laberinto en cualquier orden y siguiendo un conjunto de reglas: "(1) Planifique el camino lo más rápido posible dentro de un máximo de 10 s; (2) Comienza desde la puerta y concluye el camino en el cuarto animal visitado; (3) No pase por el mismo camino o esquina dos veces; (4) No cruces un callejón sin salida; (5) No cruzar un camino perpendicularmente"54.
NOTA: Para la regla 2 a la regla 5, recomendamos mostrar ejemplos visuales al participante. - Después, comience la sesión de entrenamiento de tareas de planificación de seis ensayos.
NOTA: Instruya a los participantes para que informen antes de cada período de calibración del rastreador ocular si hubo algún problema al realizar la tarea, especialmente durante la delineación de la ruta en el período de ejecución. Tome nota de si ha habido una prueba para comprobar el procesamiento sin conexión/posconexión (consulte el paso 6.1.1). - Para la condición de control, instruya a los sujetos para que evalúen si el camino ya marcado en el laberinto se ha hecho correcta o incorrectamente considerando las reglas aprendidas previamente.
NOTA: Dé ejemplos con apoyo visual de cómo evaluar los laberintos sin usar estrategias de planificación, como no tratar de planificar un nuevo camino cuando se detectan errores (como dibujos usando el mismo camino dos veces, cruzando un callejón sin salida, etc.). Cuando se encuentra un error, la atención debe centrarse únicamente en informar de la detección del error en lugar de corregir la ruta de acceso. Después de cada ensayo, pregunte a los participantes sobre las estrategias que implementaron. Luego, proporcione comentarios orales sobre su desempeño para asegurarse de que evaluaron los caminos trazados y evitaron planificar nuevos caminos. Después, comience la sesión de entrenamiento de tareas de control de seis ensayos.
- Para la tarea de planificación, instruya a los sujetos a encontrar un camino para completar una secuencia de visitas a ciertos lugares de animales (cuatro lugares en este estudio) en diferentes lugares del laberinto en cualquier orden y siguiendo un conjunto de reglas: "(1) Planifique el camino lo más rápido posible dentro de un máximo de 10 s; (2) Comienza desde la puerta y concluye el camino en el cuarto animal visitado; (3) No pase por el mismo camino o esquina dos veces; (4) No cruces un callejón sin salida; (5) No cruzar un camino perpendicularmente"54.
- Verifique la señal de EEG para asegurarse de que todos los canales se adquieran correctamente. Inicie el registro de EEG.
- Calibra el rastreador ocular.
NOTA: Verifique la capacidad del rastreador ocular para determinar la posición de la mirada cuando el participante dirige su mirada a varias regiones de la pantalla.- Informe al participante que el rastreador ocular se calibrará y que verá un círculo blanco (con un pequeño punto gris) que se mueve aleatoriamente a las cuatro esquinas de la pantalla (procedimiento de calibración de cinco puntos). Indíqueles que fijen su mirada en el círculo e infórmeles que, cuando se mueva a otro lugar, deben seguir la posición del círculo y volver a fijar su mirada en esa nueva posición.
- Ejecute el experimento, comience a guardar los movimientos oculares haciendo clic en Salida/Registro, y pida al participante que siga las instrucciones dadas anteriormente, informándole que el experimento ahora comenzará.
- Mantenga la sala del laboratorio en un ambiente oscuro. Los mayores cambios en la dilatación de la pupila ocurren en respuesta a cambios en la luminancia113. Mantenga un nivel de luz constante en el entorno experimental.
6. Análisis de datos
- Análisis conductuales
- Analice los datos de comportamiento utilizando software estadístico (ver Tabla de Materiales). Medir la precisión (tasa porcentual de respuestas precisas) como parámetro cuantitativo de comportamiento tanto en las condiciones de planificación como en las de control. Para la condición de planificación, utilice los datos del seguimiento ocular (coordenadas x e y de la posición de la mirada) para recrear las rutas tomadas durante el período de ejecución sin conexión y determine la precisión de las rutas planificadas en comparación con las rutas trazadas reales (Figura 4). Para ello, compruebe manualmente la congruencia entre las combinaciones correctas/incorrectas realizadas en el período de respuesta y el seguimiento realizado.
- Calcule el RT, que es el tiempo medio empleado en resolver los laberintos durante el período de planificación y el tiempo medio dedicado a evaluar los caminos marcados para el período de control.
- Calcular el RT medio de los plazos de ejecución para las condiciones de planificación y control. En concreto, utilice el RT correspondiente solo a los ensayos correctos.
NOTA: Complementariamente, es posible utilizar la puntuación lineal integrada de velocidad-precisión (LISAS)114,115 descrita en Domic-Siede et al.54, que proporciona una medida combinada que considera el tiempo de reacción y la precisión. Dado que el tiempo de reacción durante el período de ejecución de la planificación y la precisión de la planificación están interrelacionados, el LISAS se puede utilizar para calcular un índice que tenga en cuenta el tiempo de reacción corregido por el número de errores cometidos. Además, el índice LISAS se puede utilizar para evaluar la correlación entre las señales electrofisiológicas y el rendimiento conductual. Se calcula como una combinación lineal de tiempo de reacción (RT) y proporción de error (PE). - Evalúe la homocedasticidad utilizando una prueba estadística como la prueba de Levene116,117, y pruebe la normalidad utilizando la prueba de distribución de normalidad ómnibus de D'Agostinoy Pearson 118 o la prueba de Shapiro Wilk119 para elegir la prueba estadística adecuada para las comparaciones (paramétricas o no paramétricas).
- Evalúe si el componente de planificación en la condición de planificación es cognitivamente más exigente que la condición de control utilizando la prueba de rango con signo de Wilcoxon120 o la prueba t de pares emparejados121 para comparar los parámetros de comportamiento entre las condiciones.
NOTA: De esta manera, validar que el paradigma conductual es óptimo para evaluar la planificación cognitiva. - Separe los ensayos en la condición de planificación en categorías "fáciles" y "difíciles" (consulte el paso 2.2) y, a continuación, utilice una prueba t de pares emparejados para comparar la precisión y los tiempos de reacción en los períodos de planificación y ejecución entre los ensayos "fáciles" y "difíciles".
- Preprocesamiento de EEG y movimientos oculares
- Realizar el proceso de preprocesamiento de datos de EEG explicado en los siguientes puntos utilizando scripts de elaboración propia y/o cajas de herramientas establecidas, como las descritas en Delorme y Makeig122, en Dimigen et al.123 y en Mognon et al.124, en un software de lenguaje de programación (ver Tabla de Materiales).
- Sincronice la actividad del movimiento ocular con los registros de EEG para importar las fijaciones, los movimientos sacádicos y los eventos de parpadeo para una mejor inspección visual o análisis adicionales (consulte el paso 3.1.2 y el archivo complementario).
NOTA: En este estudio, utilizamos las marcas de tiempo en los datos de seguimiento ocular y las marcas de tiempo en los datos de EEG como se describe en Domic-Siede et al.54 y en Dimigen et al.123 para importar los eventos de movimiento ocular a los datos de EEG en un software de lenguaje de programación. - Reduzca la muestra de los datos a 1.024 Hz en caso de que se hayan registrado a 2.028 Hz para reducir las demandas computacionales.
NOTA: Una frecuencia de muestreo de 1.024 Hz es suficiente de acuerdo con el rango de frecuencia de interés de 4-8 Hz, la resolución de frecuencia esperada y los requisitos computacionales del análisis. - Vuelva a referenciar la señal de EEG al promedio de los electrodos en las mastoides.
NOTA: Otras referencias son posibles. La elección de la referencia puede afectar los resultados del análisis de EEG y la interpretación de los datos, por lo que es importante considerar cuidadosamente los pros y los contras de las diferentes opciones de referencia. La referencia mastoidea promedio es una opción popular para los estudios de EEG porque proporciona una referencia estable que es fácil de calcular y se ha demostrado que es eficaz para analizar muchas señales de EEG diferentes. Hacer referencia a los datos del EEG con el promedio de las mastoides (conocido como la referencia de la mastoides promedio) es un enfoque común para analizar la actividad theta frontal en los datos del EEG del cuero cabelludo. Los electrodos mastoides se encuentran cerca del oído y proporcionan una referencia para las señales de EEG. Hacer referencia a la media de las mastoides puede ayudar a reducir la influencia del ruido y de los artefactos que no son de interés, evitando al mismo tiempo cancelar la señal de interés, lo que ayuda al usuario a obtener una representación más clara de las señales del EEG. - Aplique una respuesta de impulso finito (FIR) de fase cero con una frecuencia de corte de paso alto de 1 Hz y una frecuencia de corte de paso bajo de 40 Hz sobre la señal extendida (sin epoching) utilizando un software de lenguaje de programación.
NOTA: En este estudio, utilizamos la caja de herramientas descrita en Delorme y Makeig122. - Para cada condición, teniendo en cuenta el número de ensayos, divida los datos en épocas centradas en el inicio de los períodos de planificación y control, respectivamente. Utilice los 1 s anteriores al inicio de la presentación del laberinto como línea de base y los 4 s posteriores al período de planificación o control como segmentos de interés. Utiliza un software de lenguaje de programación.
NOTA: En este estudio, utilizamos la caja de herramientas descrita en Delorme y Makeig122y 36 épocas/ensayos. - Cree una segunda segmentación centrada en el final de los períodos de planificación y control, utilizando 4 s antes del final y 1 s después como período de mantenimiento.
NOTA: La razón para seleccionar los primeros y los últimos 4 s de los períodos de planificación y control (paso 6.2.6 y paso 6.2.7) es que la duración de cada período en ambas condiciones puede variar, y el análisis de los primeros y últimos segundos de la planificación puede proporcionar una visión más completa del proceso de planificación. Por lo tanto, estas longitudes de ventana son adecuadas y suficientes para analizar la dinámica oscilatoria que subyace a la planificación. - Sobre la señal segmentada, ejecute el algoritmo125de análisis de componentes independientes (ICA) de Logistic Infomax para identificar y eliminar los componentes artefactos.
- Utilice el criterio de relación entre la varianza sacádico y la fijación recomendado en Plöchl et al.126para detectar automáticamente los componentes potencialmente ruidosos, y utilice el detector automático de artefactos EEG basado en el uso conjunto de las características espaciales y temporales recomendado en Mognon et al.124.
NOTA: Recomendamos el uso del clasificador de componentes independientes propuesto en Pion-Tonachini et al.127, que estima las clasificaciones de componentes independientes como vectores de composición en siete categorías, lo que ayuda a identificar artefactos. - Inspeccione otros posibles componentes artefactos, como EMG, movimiento de electrodos o componentes no relacionados con el cerebro. Valide el rechazo de estos componentes mediante la inspección visual de las topografías, los espectros y las activaciones a lo largo del tiempo.
- Interpolar (interpolación esférica) canales ruidosos mediante el rechazo automático de canales utilizando el criterio de curtosis (con una puntuación z de 5 como umbral).
- Análisis de tiempo-frecuencia
- Realice una transformada rápida de Fourier (FFT) de corto tiempo (1 Hz a 40 Hz) utilizando una longitud de ventana de 250 ms y un paso de tiempo de 5 ms. Utilice una ventana de Hanning. Utilice la puntuación z para normalizar los gráficos de tiempo-frecuencia a la línea de base (de −1 s a −0,1 s).
NOTA: La visualización del espectro está sujeta a un compromiso entre el tamaño de la ventana y la resolución temporal. Para lograr una vista completa de todo el espectro, incluido el rango theta de 4 Hz a 8 Hz, recomendamos utilizar el límite inferior del tamaño de la ventana, que es de 250 ms, para garantizar una resolución temporal más alta durante cada prueba y tarea. Además, recomendamos utilizar una ventana Hanning, ya que se considera una opción convencional para estos casos. Para una mejor resolución en tiempo y frecuencia, consulte los pasos siguientes. - Seleccione un gráfico de tiempo-frecuencia de un electrodo frontocentral, como el Fz, o un grupo promediado de electrodos frontales.
NOTA: Considere la amplia evidencia con respecto a la asociación entre el control cognitivo y la línea media frontal theta 12,128,129. - Seleccione gráficos de tiempo-frecuencia de control no frontal de electrodos como los electrodos Pz y Oz para ampliar las comparaciones.
- Para los electrodos frontales y de control, realice una prueba de permutación no paramétrica basada en clústeres para muestras pareadas, con un valor p < 0,05 para las comparaciones a nivel de grupo de los gráficos de tiempo-frecuencia de ambas condiciones. Utiliza el método Monte Carlo con 1.000 sorteos aleatorios. Utilice el valor estadístico máximo del clúster para realizar la prueba de permutación130.
- Promedie la banda de frecuencia theta (4-8 Hz) de los primeros 4 s de planificación y control, respectivamente, y también del último segmento de 4 s.
- Compare la actividad theta promediada entre las condiciones utilizando una prueba t de pares emparejados o una prueba de rangos con signo de Wilcoxon.
- Analice el perfil temporal de la actividad theta. Para hacer esto, promedie el rango de frecuencia de 4-8 Hz en los ensayos por tema.
- Compare la dinámica de la actividad theta entre las condiciones utilizando una prueba de Wilcoxon con signo, emparejada y corregida con la tasa de falsos descubrimientos (FDR).
NOTA: Utilizamos pasos de 88 ms de ventanas no superpuestas en la prueba de Wilcoxon.
- Realice una transformada rápida de Fourier (FFT) de corto tiempo (1 Hz a 40 Hz) utilizando una longitud de ventana de 250 ms y un paso de tiempo de 5 ms. Utilice una ventana de Hanning. Utilice la puntuación z para normalizar los gráficos de tiempo-frecuencia a la línea de base (de −1 s a −0,1 s).
- Reconstrucción de la fuente
- Utilice una caja de herramientas para la reconstrucción del análisis de fuentes, como la caja de herramientas de acceso abierto descrita en Tadel et al.131 u otra similar.
- Calcular las fuentes de la señal de EEG preprocesada de los primeros 4 s de planificación utilizando un algoritmo como la tomografía electromagnética cerebral estandarizada de baja resolución (sLORETA)132y el método de imagen de norma mínima, así como el método de elementos de contorno simétricos (BEM simétrico), con la ayuda de una caja de herramientas como la descrita en Gramfort et al.133para resolver el problema inverso.
- Utilice el algoritmo fuente (algoritmo sLORETA en este estudio) en una plantilla MNI anatómica (utilizamos la plantilla MNI en Brainstorm "Colin27") con las ubicaciones de electrodos predeterminadas para cada participante en caso de que no haya digitalización 3D de los electrodos (consulte el paso 5.6).
NOTA: Cabe señalar que el uso de las ubicaciones predeterminadas de los electrodos no es el método más eficiente para determinar las fuentes de actividad cerebral. Sin embargo, aún puede proporcionar una comprensión general del origen de la actividad. Es importante tener en cuenta que las fuentes de localización obtenidas a través de estos métodos son aproximaciones aproximadas y deben interpretarse con precaución durante el análisis de los resultados. - Aplique un filtro de paso de banda de 4-8 Hz sobre la señal preprocesada.
- Aplique una normalización de la puntuación z utilizando el período de −1.000 ms a −10 ms antes del inicio del ensayo como referencia.
- Promedie la actividad theta utilizando una ventana de tiempo de interés entre 1 s y 4 s después del inicio de la prueba.
- Comparar las fuentes de espacio promedio entre las condiciones utilizando una prueba de signo de permutación no paramétrica con muestreo de Monte Carlo (1.000 aleatorizaciones)131.
- Para determinar las regiones de interés (ROI), etiquete la corteza con un atlas cerebral.
NOTA: Se utilizó el Destrieux Atlas134 implementado en la caja de herramientas descrita en Tadel et al.131. - Seleccione las regiones cerebrales de interés (ROI).
NOTA: Consideramos la evidencia que informa que las regiones de la corteza prefrontal, como los giros frontales superiores (SF) bilaterales, los giros frontopolares transversales bilaterales y los surcos (FP), el ACC bilateral, el CCM bilateral y la corteza prefrontal dorsolateral bilateral137,138, están involucradas en las funciones de control cognitivo135,136. - Realice un análisis de componentes principales (PCA) sobre la señal de EEG preprocesada anterior (rango de 1-40 Hz) para cada ROI y tome el primer modo de descomposición del PCA para cada ROI.
- Realice un análisis espectral utilizando una transformada rápida de Fourier de corto tiempo y compare los resultados entre las regiones de interés izquierda y derecha utilizando una prueba de permutación no paramétrica basada en clústeres130.
- Extraiga y represente los ROI izquierdo y derecho que no muestran diferencias como una serie temporal bilateral: SF, ACC y MCC. A continuación, traza gráficos de tiempo-frecuencia y compara entre las condiciones.
- Compare los gráficos de tiempo-frecuencia según el nivel de complejidad de la tarea de planificación (ensayos fáciles frente a difíciles) para cada ROI.
- Refleje el borde de la señal para cada una de las 512 muestras y realice un filtro de paso de banda entre 4 Hz y 8 Hz para los ROI seleccionados.
- Aplique una transformada de Hilbert para obtener la amplitud instantánea139utilizando una caja de herramientas de procesamiento de señales de un software de lenguaje de programación (consulte la Tabla de materiales).
- Corrija la señal utilizando la normalización de la puntuación z (de −1.000 a −10 ms como referencia) y promedie los ensayos por sujeto.
- Compare cada perfil de tiempo de banda theta de ROI entre las condiciones utilizando la prueba de rango con signo de Wilcoxon (pares emparejados, 1 s de ventanas no superpuestas) y corríjalo con el FDR.
- Correlaciones entre la actividad del EEG y el rendimiento conductual
- Normalice las series temporales de origen de los ROI a la línea de base mediante la puntuación z. Seleccione una ventana de 1 s a 4 s después del inicio de la planificación o del control (donde se observe una actividad theta prominente en los gráficos de tiempo-frecuencia).
- Para determinar el aumento de la actividad theta en la condición de planificación en comparación con la condición de control, primero transforme la señal en el dominio de la frecuencia (1-40 Hz) utilizando el método multitaper a través de una caja de herramientas como la caja de herramientas Chronux140 para cada condición y fuente en las regiones de interés.
- Calcule la frecuencia promedio de la banda theta (4-8 Hz) y calcule dos medidas de la potencia theta: i) la diferencia entre la potencia theta durante el período de planificación (planificación θ) y el período de control (control θ), denotada como Δ theta, y ii) el aumento relativo de la actividad theta, expresado como la relación entre Δ theta (Δ θ) y la actividad theta durante el período de control (control θ), como en Domic-Siede et al.54:
 (1)
(1)

- Calcule dos parámetros de comportamiento: iii) Δ planificación de LISAS, restando el control de LISAS de la planificación de LISAS, y iv) Δ ejecución de la planificación de LISAS, restando la ejecución de control de LISAS de la ejecución de la planificación de LISAS, como en Domic-Siede et al.54:


- Realizar correlaciones rho de Spearman utilizando los parámetros electrofisiológicos y conductuales calculados, y luego corregidos por el FDR.
- Análisis del movimiento ocular: Para controlar las posibles diferencias en los movimientos oculares para cada condición que podrían dar lugar a una dinámica oscilatoria diferente, realice el siguiente análisis:
- Determine la amplitud sacádica y la velocidad máxima sacádica de todo el ensayo y de 0 s a 3,75 s durante las condiciones de planificación y control.
- Compare los resultados utilizando la prueba de rangos con signo de Wilcoxon o la prueba t de pares emparejados, lo que sea apropiado.
NOTA: Una caja de herramientas como la descrita en Dimigen et al.123puede ser útil. - Calcule y evalúe la coherencia entre la potencia del EEG de Fourier en un electrodo frontal (por ejemplo, el Fz o un electrodo ROI frontal promediado) y la tasa sacádica como se describe en Sato y Yamaguchi141.
- Utilice la prueba de rangos con signo de Wilcoxon para comparar los valores de la tasa de potencia sacádica de coherencia de los primeros 4 s de cada ensayo entre las dos condiciones.
Resultados
En el presente protocolo, se comparó el RT del período de planificación con los RT del período de control y del período de ejecución de la planificación. El RT de planificación fue mayor que los RT de control y de período de ejecución de planificación. Además, en comparación con la condición de control, los participantes cometieron más errores y tuvieron menor precisión durante el período de planificación (Figura 5).

Figura 5: Tiempo de reacción y precisión para la tarea de planificación. Comparación entre los tiempos de reacción (A) en el período de planificación (círculos morados) y el período de control (círculos verdes) utilizando una prueba t pareada emparejada. (B) Comparación entre los tiempos de reacción en el período de planificación (círculos morados) y el período de ejecución de la planificación (cuadrados morados) utilizando una prueba t pareada emparejada. (C) Comparación de la tasa de precisión en la condición de planificación (diamantes púrpuras) y la condición de control (diamantes verdes) utilizando una prueba de rangos con signo de Wilcoxon. Esta figura ha sido modificada a partir de Domic-Siede et al.54. Haga clic aquí para ver una versión más grande de esta figura.
Además, el análisis de los niveles de complejidad de la planificación mostró diferencias significativas en la precisión y los tiempos de reacción (RT) entre los niveles "difícil" y "fácil" durante la planificación y la ejecución (Figura 6). El nivel "difícil" tenía RT más largos y menor precisión. Estos hallazgos sugieren que la división de los ensayos en función del número de soluciones válidas puede distinguir los ensayos "fáciles" de los "difíciles".

Figura 6: Comparación del rendimiento conductual en los diferentes niveles de complejidad. Se identificaron diferencias significativas en el rendimiento conductual en los niveles de complejidad "fácil" y "difícil" mediante una prueba t de pares emparejados. Se observaron tiempos de reacción (RT) más bajos durante la planificación y ejecución para el nivel "fácil" en comparación con el nivel "difícil", y la precisión fue mayor para el nivel "fácil". Las barras de error representan el SEM (error estándar de la media). Esta figura ha sido modificada a partir de Domic-Siede et al.54. Haga clic aquí para ver una versión más grande de esta figura.
Estos resultados indicaron que cuando el componente de planificación se eliminó con éxito de la condición de control (a través de la manipulación de instrucciones), la tarea de planificación era cognitivamente más compleja, exigente, desafiante y requería más tiempo. Por lo tanto, los correlatos neuronales inducidos por las tareas podrían compararse entre sí.
Para analizar la actividad theta de la línea media frontal durante la planificación, se comparó la banda de frecuencia theta promedio durante la planificación para el electrodo Fz con la del período de control, y se encontró un aumento significativo en la frecuencia de la banda theta durante la planificación (Figura 7).

Figura 7: Actividad theta de la línea media frontal durante la planificación cognitiva. (A) Mapas topográficos que representan la potencia de la banda theta en todos los sujetos normalizados a las puntuaciones z durante la tarea de planificación (izquierda), la tarea de control (centro) y el efecto de planificación (derecha). Durante la planificación cognitiva, los sujetos mostraron un aumento en la actividad theta de la línea media frontal. La barra de color muestra los valores z entre -0,5 y 1,5. (B) Un diagrama de violín que muestra los valores mínimos, cuartiles, medianos y máximos de la puntuación z de la actividad theta en los sujetos durante la planificación (púrpura) en comparación con el período de control (verde) para los electrodos Fz (izquierda), Pz (centro) y Oz (derecha) utilizando una prueba t de pares emparejados. Esta figura ha sido modificada a partir de Domic-Siede et al.54. Haga clic aquí para ver una versión más grande de esta figura.
Además, para evaluar la dinámica temporal de la actividad theta frontal observada, se formularon mapas topográficos correspondientes a puntos temporales específicos de potencia de la banda theta (750 ms, 1.750 ms, 2.750 ms y 3.750 ms) (Figura 8A). Además, en comparación con el período de control, el análisis de tiempo-frecuencia demostró un aumento significativo, progresivo y sostenido en la actividad theta a partir de 1 s después del inicio del período de planificación (Figura 8B).

Figura 8: Dinámica temporal theta de la línea media frontal. (A) Cortes de tiempo topográficos de la actividad theta. Se observó un aumento progresivo en la actividad theta de la línea media frontal a lo largo del tiempo durante la implementación de la planificación (período de planificación). La barra de color indica las unidades de puntuación z (de −0,5 a 2,2). (B) Gráficos de tiempo-frecuencia para el período de planificación (arriba), el período de control (medio) y el efecto de planificación, calculados restando el período de control del período de planificación (abajo). Los píxeles no significativos, determinados mediante una prueba de permutación no paramétrica basada en clústeres para muestras pareadas, se muestran más claros en el gráfico de efectos de planificación. La barra de color indica las unidades de puntuación z (−4 a 4). Esta figura ha sido modificada a partir de Domic-Siede et al.54. Haga clic aquí para ver una versión más grande de esta figura.
Para la reconstrucción de la fuente de la actividad theta, se visualizó un modelo cerebral y se comparó entre las condiciones, y esto indicó que la actividad theta se originó dentro de las áreas de la corteza prefrontal (corteza frontal superior, FS; corteza cingulada anterior, ACC; y corteza cingulada media, MCC), así como que había diferencias significativas entre las condiciones (en la SF bilateral, el ACC bilateral y el CCM bilateral) (Figura 9), observándose una mayor actividad theta en el período de planificación (Figura 9).

Figura 9: Reconstrucción de la fuente. Se utilizó un algoritmo sLORETA para estimar la actividad theta de diferentes fuentes cerebrales. La actividad theta fue de paso de banda de 4-8 Hz filtrada, puntuación z normalizada, corregida por línea de base, promediada entre 1 s o 4 s después del inicio de la planificación o del control, respectivamente, y comparada entre condiciones. Se encontró un aumento significativo en la actividad theta en el área frontal superior bilateral, la corteza cingulada anterior bilateral y la corteza cingulada media bilateral. La figura muestra valores t significativos de la prueba de permutación. Abreviaturas: FS = frontal superior; ACC = corteza cingulada anterior; MCC = corteza cingulada media. Esta figura ha sido modificada a partir de Domic-Siede et al.54. Haga clic aquí para ver una versión más grande de esta figura.
Posteriormente, se evaluó el perfil temporal de los cambios theta a lo largo del tiempo para cada fuente mediante el cálculo de una transformada de Hilbert, y luego comparamos la amplitud instantánea de la actividad theta entre las condiciones. Encontramos que las fuentes frontopolar izquierda, ACC bilateral y MCC bilateral presentaron una mayor actividad theta después del inicio del período de planificación (Figura 10). Estos resultados sugirieron que nuestro paradigma experimental, que exige planificación cognitiva, indujo actividad theta originada en las regiones PFC.

Figura 10: Perfil de tiempo de actividad Theta de las fuentes PFC. La amplitud instantánea calculada con la transformada de Hilbert se aplicó al primer componente de la descomposición del PCA para cada fuente frontal y tanto las condiciones como la línea de base se normalizaron a la puntuación z para mostrar la actividad theta frontal a lo largo del tiempo. Las áreas sombreadas en gris muestran diferencias significativas determinadas utilizando una ventana móvil no superpuesta con pasos de 1 s (prueba de rango con signo de Wilcoxon) corregida por el FDR. Las regiones sombreadas representan intervalos de confianza del 95%. La región FP izquierda, el ACC bilateral y el CCM bilateral mostraron aumentos en la actividad theta después del inicio de la planificación. Abreviaturas: ACC = corteza cingulada anterior; MCC = corteza cingulada media. La condición de planificación se muestra en púrpura. La condición de control se muestra en rojo. Esta figura ha sido modificada a partir de Domic-Siede et al.54. Haga clic aquí para ver una versión más grande de esta figura.
Además, nos propusimos examinar la variación en las características espectrales durante la planificación con respecto al nivel de complejidad, según lo indicado por los resultados de comportamiento. Cabe destacar que se encontró una discrepancia significativa solo en el ACC izquierdo dentro de la banda alfa. Esto apoya la noción de que nuestra tarea de planificación evalúa las facetas intrínsecas de la planificación a través de cambios en las oscilaciones theta en mayor medida que las demandas cognitivas generales (esfuerzo) que se encuentran típicamente en las tareas de control cognitivo (Figura 11).

Figura 11: EEG en los niveles de complejidad de la planificación. Los gráficos de tiempo-frecuencia de ROI mostraron un grupo positivo significativo en la banda alfa exclusivamente en la corteza cingulada anterior izquierda (ACC) para el nivel "difícil". Los píxeles no significativos, determinados mediante una prueba de permutación no paramétrica basada en clústeres para muestras emparejadas, se muestran en un tono más claro en el gráfico, con la barra de color que indica las unidades de puntuación z de -3 a 3. Esta figura ha sido modificada a partir de Domic-Siede et al.54. Haga clic aquí para ver una versión más grande de esta figura.
Cuando se realizaron correlaciones entre la actividad theta y el rendimiento conductual, se observó una correlación negativa; específicamente, a medida que aumentó la actividad theta en la región frontopolar izquierda durante el período de planificación, la puntuación de ejecución de planificación de LISAS disminuyó (Figura 12). Este patrón puede reflejar que la región FP izquierda puede ser necesaria durante la elaboración de la planificación para ejecutar un plan con éxito después y sugiere un papel para la actividad theta.

Figura 12: Actividad Theta y rendimiento conductual. La correlación rho de Spearman entre la actividad theta de la corteza frontopolar izquierda y la ejecución de la planificación Δ LISAS mostró una correlación negativa significativa. Esta figura ha sido modificada a partir de Domic-Siede et al.54. Haga clic aquí para ver una versión más grande de esta figura.
Además, las diferentes demandas cognitivas y metas inducidas por cada condición pueden haber causado movimientos oculares contrastantes entre las condiciones de planificación y control, lo que lleva a diferentes patrones de actividad oscilatoria95. Para abordar el problema anterior, analizamos los datos de un solo sujeto y un solo ensayo en varios niveles. En particular, las series temporales del canal Fz y la dinámica del tiempo de actividad theta no parecían tener ninguna conexión con la tasa de movimientos sacádicos a lo largo del tiempo (Figura 13A).

Figura 13: Resultados de los registros de EEG y movimientos oculares. (A) Las filas presentan el EEG (arriba), el gráfico de tiempo-frecuencia (medio arriba), el perfil de tiempo theta del electrodo Fz (medio abajo) y la tasa sacádica del sujeto 8 y el ensayo 9 (abajo) en la condición de planificación. (B) Se muestra una comparación de la amplitud sacádica, la velocidad máxima sacádica y la coherencia de la tasa potencia-sacádico entre las condiciones, revelando diferencias estadísticas significativas en la amplitud sacádica entre las condiciones de planificación y control. El SEM está representado por las barras de error. Esta figura ha sido modificada a partir de Domic-Siede et al.54. Haga clic aquí para ver una versión más grande de esta figura.
A continuación, obtuvimos la amplitud sacádica y la velocidad máxima de todo el ensayo y de 0 s a 3,75 s para la comparación (Figura 13B). Descubrimos que la amplitud sacádica era mayor en la condición control. Sin embargo, no se encontraron diferencias estadísticamente significativas entre las condiciones en el índice de coherencia entre la potencia theta de Fourier en el electrodo Fz y la tasa sacádica (Figura 10B), lo que indica que cualquier relación potencial entre las sacadas y la actividad theta fue consistente en todas las condiciones.
Tomados en conjunto, estos resultados apoyan que el protocolo experimental descrito es adecuado para estudiar la planificación cognitiva como una función de control cognitivo.
Discusión
El protocolo descrito aquí ofrece un enfoque innovador para evaluar la planificación cognitiva y el control cognitivo durante una tarea de planificación novedosa y ecológica en asociación con mediciones conductuales y fisiológicas pertinentes y complementarias, como la dinámica oscilatoria y pupilar. Durante nuestros experimentos, se registró la actividad del EEG mientras los participantes realizaban la tarea de planificación, en la que se instruyó a los participantes para que primero elaboraran y luego ejecutaran un plan. La condición de control, que consistía en evaluar un camino predibujado en el mapa del zoológico, se estableció para eliminar el aspecto de la planificación cognitiva mientras se mantenía un entorno y una estructura similares. Este enfoque permite evaluar si la planificación cognitiva, como función de control cognitivo, conduce a la generación de actividad theta frontal a partir de regiones PFC y si las diferentes fuentes de oscilación theta de PFC están vinculadas a diferentes aspectos del rendimiento de la planificación. Otro aspecto que podría evaluarse utilizando este protocolo es la diferenciación de los diversos procesos cognitivos involucrados durante las fases de la planificación, como la elaboración del plan, la ejecución del plan, el logro del plan y el procesamiento de la retroalimentación. Encontramos que la planificación indujo una actividad theta frontal canónica asociada con el control cognitivo, lo que contribuyó a lograr un objetivo de manera eficiente. Estos resultados apuntalan el interés de este protocolo.
A pesar de los vastos avances en neurociencia cognitiva, la mayoría de los experimentos de neuroimagen examinan funciones cognitivas aisladas utilizando tareas artificiales en entornos privados de sensoriomotores y estímulos demasiado simplificados para controlar los factores de confusión. Problemáticamente, esos experimentos podrían no ser capaces de identificar los mecanismos cerebrales reales involucrados cuando se implementa una función cognitiva en una situación cotidiana (durante situaciones ecológicas)138,140. En particular, las capacidades para formular metas, planificar y ejecutar planes de manera efectiva son difíciles de evaluar, ya que requieren varias funciones cognitivas (memoria de trabajo, control inhibitorio, flexibilidad cognitiva, etc.)104.144. Por lo tanto, se fomenta y sugiere el diseño de una tarea ecológica conductual con base en las tendencias actuales de la neurociencia cognitiva 142,143,145,146.
Nuestra tarea de planificación, a pesar de tener lugar en un entorno de laboratorio (dentro de una habitación con los estímulos mostrados en una pantalla), se hizo atractiva e interactiva para los participantes mediante el uso de estímulos y objetivos significativos con los que podían interactuar en la pantalla. Además, la tarea requiere que los participantes se involucren en una situación de la vida real, planificando un camino para visitar varios lugares. Para tener un diseño de tarea ecológica, el paradigma debe desafiar a los sujetos a realizar un comportamiento específico o una función cognitiva de una manera similar a lo que tendrían que hacer en la vida cotidiana 62,63,147. Para desarrollar un diseño de tarea ecológica, la tarea de planificación utilizada aquí implica planificar un camino para visitar diferentes lugares en varias etapas56. La primera etapa consiste en que los participantes creen un plan mientras se aseguran de que siga un conjunto de reglas. La segunda etapa consiste en mantener el plan en la memoria de trabajo, mientras que la tercera etapa consiste en ejecutar el plan y supervisar su cumplimiento de las reglas. Estas etapas representan diferentes fases de la planificación y la orquestación de otras funciones ejecutivas, como la flexibilidad cognitiva, el control inhibitorio y la memoria de trabajo. Para tener un diseño de tarea cognitiva ecológica válido, la tarea debe ser capaz de detectar deficiencias cognitivas específicas en pacientes con trastornos psiquiátricos o cognitivos que tienen dificultades para realizar esa función cognitiva específica en su vida diaria105. Esto se puede lograr a través de futuras investigaciones que utilicen este protocolo.
Los resultados conductuales obtenidos mediante el uso de este protocolo se alinearon con las predicciones experimentales. Se observó una diferencia significativa en el comportamiento cuando el componente de planificación se eliminó de la tarea de control para formar una condición de control, lo que facilitó comparaciones adicionales. Se encontró que la condición de planificación era cognitivamente más exigente que la condición de control, como lo demuestran parámetros como el tiempo de reacción y la precisión. Esto puede reflejar la mayor participación de las funciones cognitivas superiores en la implementación de la planificación 23,55,56,57,148,149,150.
Teniendo en cuenta que la condición de control implicaba una cognición menos compleja, como lo demuestran los tiempos de reacción más rápidos, los mejores rendimientos y los diferentes procesos cognitivos requeridos (la evaluación de reglas), una posible modificación alternativa es explotar los niveles de complejidad presentes en la tarea de planificación, manipularlos y analizar la función de planificación paramétricamente de acuerdo con diferentes niveles de complejidad (por ejemplo, aumentar el número de ensayos, y crear condiciones de ensayo difíciles, medias y fáciles). Sin embargo, los resultados de nuestro protocolo mostraron que, si bien era posible distinguir entre ensayos "fáciles" y "difíciles" en función de las medidas conductuales, no se detectaron diferencias en las medidas electrofisiológicas. Esto sugiere que los resultados de nuestro protocolo reflejan con mayor precisión las características intrínsecas de la función de planificación en lugar de aspectos más amplios del control cognitivo, como la atención, el esfuerzo mental, el nivel de dificultad o un alto nivel de demanda cognitiva54. Sin embargo, investigaciones posteriores pueden considerar otros tipos de condiciones de control, como seguir un camino marcado que visite las cuatro ubicaciones de los animales, pero también recordar el orden de la secuencia. De esta manera, se podría controlar mejor el nivel de dificultad y distinguir la planificación de la memoria de trabajo, pero una posible desventaja de esto es la fatiga, ya que los sujetos tendrían que realizar dos tareas muy exigentes.
Varios estudios han relacionado diferentes parámetros de movimiento ocular con eventos cognitivos específicos. Por un lado, ciertos estudios han encontrado correlaciones entre las oscilaciones theta y el diámetro de la pupila durante las tareas cognitivas, lo que sugiere una relación entre estas dos medidas de la función cognitiva. Por ejemplo, Lin et al.152 encontraron una correlación entre la actividad theta del frontfrontal medio y los cambios en el tamaño de la pupila, lo que refleja diversos grados de conflicto subjetivo. Sus hallazgos sugieren que estas señales representan el procesamiento de conflictos, el aumento de la atención y las respuestas conductuales flexibles. Por lo tanto, la relación entre la actividad theta del frontfrontal medio y las respuestas de los alumnos parece desempeñar un papel en la ponderación de costos y beneficios durante los procesos de toma de decisiones. En otro estudio, Yu et al.153 examinaron cómo el compromiso del tiempo en la tarea afecta neurofisiológicamente el control cognitivo a través de una tarea de memoria de trabajo que moduló las respuestas inhibitorias del control. Estudiaron la relación entre los datos del diámetro de la pupila y la actividad theta frontal y demostraron que a medida que aumentaba la duración de la tarea, el rendimiento disminuía, y esto se acompañaba de una disminución en la modulación de la dilatación de la pupila y la actividad theta frontal. Al comienzo de la tarea, encontraron una fuerte correlación entre la participación en la tarea, la actividad theta y el control cognitivo, como lo indica la modulación de la dilatación de la pupila, principalmente para tareas exigentes que requerían una alta memoria de trabajo y control inhibitorio. Sin embargo, esta relación se disipó hacia el final, lo que indica una desconexión entre el esfuerzo invertido y el control cognitivo utilizado para realizar la tarea, que es un sello distintivo delos efectos prefrontales del tiempo en la tarea. Por otro lado, otros estudios han investigado las sacadas y las oscilaciones. Por ejemplo, Nakatani et al.154 revelaron que, en una tarea perceptiva, la amplitud de la banda alfa de las regiones occipitales predecía parpadeos y efectos sacádicos. Por otra parte, Velasques et al.155 demostraron que, durante una tarea de atención prosacádica, la amplitud sacádica se asoció con cambios gamma frontales. Además, Bodala et al.156 encontraron que las disminuciones en la theta de la línea media frontal se acompañaban de disminuciones en la atención sostenida, así como en la amplitud y velocidad de los movimientos sacádicos. Estos hallazgos sugieren que los movimientos oculares, especialmente los sacádicos, pueden reflejar procesos cognitivos en lugar de solo contribuir al ruido de fondo en las señales de EEG. En el presente estudio, mejoramos la eliminación de artefactos relacionados con el movimiento ocular utilizando el algoritmo ICA con el criterio de relación de varianza sacádico-fijación126. Este criterio mejora la eliminación de artefactos para las tareas de visualización libre157. En nuestro estudio, no se observaron diferencias en la velocidad máxima sacádica y la coherencia entre la potencia theta y la tasa sacádica en todas las condiciones. Sin embargo, se necesitan más estudios para abordar estas preguntas.
Un paso crítico en el uso de este protocolo es calibrar constantemente el rastreador ocular durante el experimento, ya que la pérdida de datos de mirada de la cámara podría resultar en errores que contaminarían la tarea y dificultarían la obtención de respuestas precisas. Por lo tanto, es crucial calibrar con la mayor frecuencia posible. Sin embargo, existe un equilibrio entre el número de ensayos con un rastreador ocular calibrado y la duración del experimento. En nuestro estudio, decidimos calibrar cada cinco ensayos.
Se deben realizar investigaciones futuras que exploren la relación entre las oscilaciones theta y el diámetro de la pupila durante esta tarea de planificación. La planificación es un aspecto crítico del control ejecutivo que requiere la asignación de recursos atencionales y la coordinación de múltiples procesos cognitivos. Comprender la relación entre las oscilaciones theta y el diámetro de la pupila durante las tareas de planificación podría proporcionar información valiosa sobre los mecanismos neuronales subyacentes del control ejecutivo y cómo cambian con el tiempo. Además, estos estudios podrían conducir a una comprensión más profunda de cómo los cambios en la función cognitiva, como la fatiga o los lapsos de atención, afectan el rendimiento en las tareas de planificación y la capacidad de asignar recursos de manera efectiva. Esta información podría tener implicaciones importantes para el desarrollo de intervenciones destinadas a mejorar el rendimiento de la planificación, como programas de entrenamiento cognitivo o tratamientos para afecciones como el trastorno por déficit de atención con hiperactividad (TDAH), entre otras.
Investigaciones anteriores han indicado que el PFC juega un papel crucial en la planificación cognitiva, como lo confirman nuestros resultados. Estos resultados demuestran que la planificación cognitiva induce la actividad de FMθ en el CPF, particularmente en la corteza cingulada anterior, la corteza cingulada media y las regiones frontales superiores54. Estos hallazgos se alinean con investigaciones previas sobre las funciones ejecutivas. Existe evidencia sustancial que apoya la idea de que la actividad FMθ actúa como un proceso de arriba hacia abajo para iniciar el control y facilitar la comunicación entre las regiones del cerebro durante tareas exigentes13. Si bien solo unos pocos estudios han examinado la dinámica temporal de la actividad de FMθ asociada con el control cognitivo, existe un acuerdo generalizado de que el perfil temporal de FMθ puede proporcionar información sobre varias facetas del control cognitivo y la participación de distintas regiones de PFC. El uso de nuestro protocolo para evaluar la planificación cognitiva nos permitió caracterizar el perfil temporal de la actividad de FMθ durante la planificación. En concreto, la actividad de FMθ durante la condición de planificación mostró un aumento progresivo. Al implementar este protocolo, por primera vez, se demostró que FMθ, también está presente durante la implementación de la planificación, al igual que en otras funciones cognitivas de orden superior, y su dinámica temporal puede servir como un indicador de control cognitivo.
Nuestros resultados y protocolo tienen aplicaciones potenciales en el campo de la neurociencia, incluso para mejorar las evaluaciones neuropsicológicas virtuales y el tratamiento de trastornos neuropsiquiátricos con problemas de planificación cognitiva asociados, como la depresión y el trastorno por déficit de atención con hiperactividad. Por ejemplo, las evaluaciones podrían implicar el examen de diferentes patrones de errores en el nivel de rendimiento conductual, diferentes patrones oscilatorios en el nivel electrofisiológico y diferentes movimientos oculares. Además, los resultados de este trabajo pueden informar el desarrollo de interfaces cerebro-computadora y programas de entrenamiento cognitivo que tienen como objetivo mejorar las habilidades de planificación cognitiva.
El presente protocolo puede aportar nuevas evidencias para comprender los mecanismos neuronales que sustentan la elusiva función de control cognitivo de la planificación cognitiva en poblaciones neurotípicas y neuropsiquiátricas. Además, nuestro paradigma conductual podría ofrecer información sobre la neurobiología del control cognitivo y la planificación a través del examen de las mediciones electrofisiológicas, pupilométricas y conductuales con una tarea de planificación práctica que examina los aspectos intrínsecos de la planificación en lugar de las demandas cognitivas generales típicamente presentes en las tareas de control cognitivo, como se refleja en los cambios en las oscilaciones theta.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación contó con el apoyo financiero del programa de becas de doctorado Becas de Doctorado Nacional año 2015 de ANID 21150295, 1180932 de becas regulares FONDECYT, 1230383 de becas FONDECYT, 11220009 de becas FONDECYT de Iniciación, beca Postdoc Universidad de O'Higgins y el Institut Universitaire de France (IUF). Queremos agradecer al profesor Pablo Billeke por sus comentarios sobre el diseño del paradigma. Agradecemos al Profesor Eugenio Rodríguez por compartir amablemente sus códigos de análisis tiempo-frecuencia. Por último, agradecemos a Milan Domic, Vicente Medel, Josefina Ihnen, Andrea Sánchez, Gonzalo Boncompte, Catalina Fabar y Daniela Santander por sus comentarios.
Materiales
| Name | Company | Catalog Number | Comments |
| EEG System | Biosemi | ActiveTwo Base system, 64 channels | |
| Eye-tracker System | Eyelink SR Research | EyeLink 1000 Plus Core Unit, High-speed camera, Host PC/Monitor, | |
| CPU display | Intel | Hard drive 221 GB, Processor Intel Core i7-4790 3.60 Hz, OS Windows 7, 4GB RAM | |
| CPU EEG | Intel | Hard drive 223 GB, Processor Intel Core i7-4790 3.60 Hz, OS Windows 7, 4GB RAM | |
| Monitor | ASUS | ASUS VG248QE 24" LCD monitor | |
| Joytsick | Logitech | Model F310 | |
| Luxmeter | Focket | LCD screen (0-200.000 lux) model Liebe WH LX1330B | |
| Statistics software | GraphPad Prism | GraphPad Prism version 8 for Windows | |
| MATLAB Programming Software | The MathWorks | MATLAB R2014a and R2018b | |
| SVG tool Inkscape | Inkscape Project | vector graphic editor software | |
| Presentation Software | Neurobehavioral Systems | stimulus delivery and experiment control program for neuroscience |
Referencias
- Siegel, M., Donner, T. H., Engel, A. K. Spectral fingerprints of large-scale neuronal interactions. Nature Reviews Neuroscience. 13 (2), 121-134 (2012).
- Fries, P. A mechanism for cognitive dynamics: Neuronal communication through neuronal coherence. Trends in Cognitive Sciences. 9 (10), 474-480 (2005).
- Fries, P. Rhythms for cognition: Communication through coherence. Neuron. 88 (1), 220-235 (2015).
- Thut, G., Miniussi, C., Gross, J. The functional importance of rhythmic activity in the brain. Current Biology. 22 (16), 658-663 (2012).
- Fröhlich, F., McCormick, D. A. Endogenous electric fields may guide neocortical network activity. Neuron. 67 (1), 129-143 (2010).
- Spaak, E., de Lange, F. P., Jensen, O. Local entrainment of alpha oscillations by visual stimuli causes cyclic modulation of perception. Journal of Neuroscience. 34 (10), 3536-3544 (2014).
- Fiebelkorn, I. C., Saalmann, Y. B., Kastner, S. Rhythmic sampling within and between objects despite sustained attention at a cued location. Current Biology. 23 (24), 2553-2558 (2013).
- Landau, A. N., Fries, P. Attention samples stimuli rhythmically. Current Biology. 22 (11), 1000-1004 (2012).
- Song, K., Meng, M., Lin, C., Zhou, K., Luo, H. Behavioral oscillations in attention: Rhythmic α pulses mediated through θ band. Journal of Neuroscience. 34 (14), 4837-4844 (2014).
- Wyart, V., Nobre, A. C., Summerfield, C. Dissociable prior influences of signal probability and relevance on visual contrast sensitivity. Proceedings of the National Academy of Sciences of the United States of America. 109 (9), 3593-3598 (2012).
- Leszczyński, M., Fell, J., Axmacher, N. Rhythmic working memory activation in the human hippocampus. Cell Reports. 13 (6), 1272-1282 (2015).
- Onton, J., Delorme, A., Makeig, S. Frontal midline EEG dynamics during working memory. NeuroImage. 27 (2), 341-356 (2005).
- Cavanagh, J. F., Frank, M. J. Frontal theta as a mechanism for cognitive control. Trends in Cognitive Sciences. 18 (8), 414-421 (2014).
- Siegel, M., Buschman, T. J., Miller, E. K. Cortical information flow during flexible sensorimotor decisions. Science. 348 (6241), 1352-1355 (2015).
- Weisz, N., et al. Prestimulus oscillatory power and connectivity patterns predispose conscious somatosensory perception. Proceedings of the National Academy of Sciences of the United States of America. 111 (4), 417-425 (2014).
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Cohen, M. X. A neural microcircuit for cognitive conflict detection and signaling. Trends in Neurosciences. 37 (9), 480-490 (2014).
- Yuste, R. From the neuron doctrine to neural networks. Nature Reviews Neuroscience. 16 (8), 487-497 (2015).
- Helfrich, R. F., Knight, R. T. Oscillatory dynamics of prefrontal cognitive control. Trends in Cognitive Sciences. 20 (12), 916-930 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annual Review of Neurosciences. 24 (1), 167-202 (2001).
- von Nicolai, C., et al. Corticostriatal coordination through coherent phase-amplitude coupling. Journal of Neuroscience. 34 (17), 5938-5948 (2014).
- Sweeney-Reed, C. M., et al. Thalamic theta phase alignment predicts human memory formation and anterior thalamic cross-frequency coupling. ELife. 4, 07578 (2015).
- Voytek, B., et al. Oscillatory dynamics coordinating human frontal networks in support of goal maintenance. Nature Neuroscience. 18 (9), 1318-1324 (2015).
- Raghavachari, S., et al. Theta oscillations in human cortex during a working-memory task: Evidence for local generators. Journal of Neurophysiology. 95 (3), 1630-1638 (2006).
- Jacobs, J., Hwang, G., Curran, T., Kahana, M. J. EEG oscillations and recognition memory: Theta correlates of memory retrieval and decision making. NeuroImage. 32 (2), 978-987 (2006).
- Itthipuripat, S., Wessel, J. R., Aron, A. R. Frontal theta is a signature of successful working memory manipulation. Experimental Brain Research. 224 (2), 255-262 (2013).
- Cavanagh, J. F., Zambrano-Vazquez, L., Allen, J. J. B. Theta lingua franca: A common mid-frontal substrate for action monitoring processes. Psychophysiology. 49 (2), 220-238 (2012).
- Mas-Herrero, E., Marco-Pallarés, J. Frontal theta oscillatory activity is a common mechanism for the computation of unexpected outcomes and learning rate. Journal of Cognitive Neuroscience. 26 (3), 447-458 (2014).
- Folstein, J. R., Van Petten, C. Influence of cognitive control and mismatch on the N2 component of the ERP: A review. Psychophysiology. 45 (1), 152-170 (2008).
- Cohen, M. X., Donner, T. H. Midfrontal conflict-related theta-band power reflects neural oscillations that predict behavior. Journal of Neurophysiology. 110 (12), 2752-2263 (2013).
- Walsh, M. M., Anderson, J. R. Modulation of the feedback-related negativity by instruction and experience. Proceedings of the National Academy of Sciences of the United States of America. 108 (47), 19048-19053 (2011).
- Luu, P., Tucker, D. M., Makeig, S. Frontal midline theta and the error-related negativity: Neurophysiological mechanisms of action regulation. Clinical Neurophysiology. 115 (8), 1821-1835 (2004).
- Hanslmayr, S., et al. The electrophysiological dynamics of interference during the Stroop task. Journal of Cognitive Neuroscience. 20 (2), 215-225 (2008).
- Cavanagh, J. F., Cohen, M. X., Allen, J. J. B. Prelude to and resolution of an error: EEG phase synchrony reveals cognitive control dynamics during action monitoring. Journal of Neuroscience. 29 (1), 98-105 (2009).
- Cohen, M. X., van Gaal, S., Ridderinkhof, K. R., Lamme, V. A. F. Unconscious errors enhance prefrontal-occipital oscillatory synchrony. Frontiers in Human Neuroscience. 3, 54 (2009).
- Cavanagh, J. F., Frank, M. J., Klein, T. J., Allen, J. J. B. Frontal theta links prediction errors to behavioral adaptation in reinforcement learning. NeuroImage. 49 (4), 3198-3209 (2010).
- Cohen, M. X., Cavanagh, J. F. Single-trial regression elucidates the role of prefrontal theta oscillations in response conflict. Frontiers in Psychology. 2, 30 (2011).
- Cohen, M. X., Van Gaal, S. Dynamic interactions between large-scale brain networks predict behavioral adaptation after perceptual errors. Cerebral Cortex. 23 (5), 1061-1072 (2013).
- Nigbur, R., Cohen, M. X., Ridderinkhof, K. R., Stürmer, B. Theta dynamics reveal domain-specific control over stimulus and response conflict. Journal of Cognitive Neuroscience. 24 (5), 1264-1274 (2012).
- van Driel, J., Swart, J. C., Egner, T., Ridderinkhof, K. R., Cohen, M. X. No) time for control: Frontal theta dynamics reveal the cost of temporally guided conflict anticipation. Cognitive, Affective, and Behavioral Neuroscience. 15 (4), 787-807 (2015).
- van de Vijver, I., Ridderinkhof, K. R., Cohen, M. X. Frontal oscillatory dynamics predict feedback learning and action adjustment. Journal of Cognitive Neuroscience. 23 (12), 4106-4121 (2011).
- Narayanan, N. S., Cavanagh, J. F., Frank, M. J., Laubach, M. Common medial frontal mechanisms of adaptive control in humans and rodents. Nature Neuroscience. 16 (12), 1888-1895 (2013).
- Anguera, J. A., et al. Video game training enhances cognitive control in older adults. Nature. 501 (7465), 97-101 (2013).
- Smit, A. S., Eling, P. A. T. M., Hopman, M. T., Coenen, A. M. L. Mental and physical effort affect vigilance differently. International Journal of Psychophysiology. 57 (3), 211-217 (2005).
- Cohen, M. X., Ranganath, C. Reinforcement learning signals predict future decisions. Journal of Neuroscience. 27 (2), 371-378 (2007).
- Gehring, W. J., Goss, B., Coles, M. G. H., Meyer, D. E., Donchin, E. A neural system for error detection and compensation. Psychological Science. 4 (6), 385-390 (1993).
- Yeung, N., Botvinick, M. M., Cohen, J. D. The neural basis of error detection: Conflict monitoring and the error-related negativity. Psychological Review. 111 (4), 931-959 (2004).
- Debener, S., et al. Trial-by-trial coupling of concurrent electroencephalogram and functional magnetic resonance imaging identifies the dynamics of performance monitoring. Journal of Neuroscience. 25 (50), 11730-11737 (2005).
- Hauser, T. U., et al. The feedback-related negativity (FRN) revisited: New insights into the localization, meaning, and network organization. NeuroImage. 84, 159-168 (2014).
- Wang, C., Ulbert, I., Schomer, D. L., Marinkovic, K., Halgren, E. Responses of human anterior cingulate cortex microdomains to error detection, conflict monitoring, stimulus-response mapping, familiarity, and orienting. Journal of Neuroscience. 25 (3), 604-613 (2005).
- Tsujimoto, S., Genovesio, A. Firing variability of frontal pole neurons during a cued strategy task. Journal of Cognitive Neuroscience. 29 (1), 25-36 (2017).
- Womelsdorf, T., Johnston, K., Vinck, M., Everling, S. Theta-activity in anterior cingulate cortex predicts task rules and their adjustments following errors. Proceedings of the National Academy of Sciences of the United States of America. 107 (11), 5248-5253 (2010).
- Womelsdorf, T., Vinck, M., Stan Leung, L., Everling, S. Selective theta synchronization of choice-relevant information subserves goal-directed behavior. Frontiers in Human Neuroscience. 4, 2010 (2010).
- Domic-Siede, M., Irani, M., Valdés, J., Perrone-Bertolotti, M., Ossandón, T. Theta activity from frontopolar cortex, mid-cingulate cortex and anterior cingulate cortex shows different roles in cognitive planning performance. NeuroImage. 226, 117557 (2021).
- Wilensky, R. . Planning and Understanding: A Computational Approach to Human Reasoning. , (1983).
- Grafman, J., Hendler, J. Planning and the brain. Behavioral and Brain Sciences. 14, 563-564 (1991).
- Hayes-Roth, B., Hayes-Roth, F. A cognitive model of planning. Cognitive Science. 3 (4), 275-310 (1979).
- Tremblay, M., et al. Brain activation with a maze test: An EEG coherence analysis study in healthy subjects. Neuroreport. 5 (18), 2449-2453 (1994).
- Shallice, T. Specific impairments of planning. Philosophical Transactions of the Royal Society B: Biological Sciences. 298 (1089), 199-209 (1982).
- Unterrainer, J. M., Owen, A. M. Planning and problem solving: From neuropsychology to functional neuroimaging. Journal of Physiology. 99 (4-6), 308-317 (2006).
- Domic-Siede, M., et al. La planificación cognitiva en el contexto de la evaluación neuropsicológica e investigación en neurociencia cognitiva: Una revisión sistemática. Terapia Psicológica. 40 (3), 367-395 (2022).
- Miotto, E. C., Morris, R. G. Virtual planning in patients with frontal lobe lesions. Cortex. 34 (5), 639-657 (1998).
- Burgess, P. W., Simons, J. S., Coates, L. M. A., Channon, S., Morris, R., Ward, G. The search for specific planning processes. The Cognitive Psychology of Planning. , 199-227 (2005).
- Oosterman, J. M., Wijers, M., Kessels, R. P. C. Planning or something else? Examining neuropsychological predictors of zoo map performance. Applied Neuropsychology. 20 (2), 103-109 (2013).
- Campbell, Z., et al. Utilizing virtual reality to improve the ecological validity of clinical neuropsychology: An fMRI case study elucidating the neural basis of planning by comparing the Tower of London with a three-dimensional navigation task. Applied Neuropsychology. 16 (4), 295-306 (2009).
- Wilson, B. A., Alderman, N., Burgess, P. W., Emslie, H., Evans, J. J. . Behavioural Assessment of the Dysexecutive Syndrome. , (1996).
- Spector, L., Grafman, J., Boller, F., Grafman, J. Planning, neuropsychology, and artificial intelligence: Cross fertilization. Handbook of Neuropsychology. 9, 377-392 (1994).
- Porteus, S. D. . The Maze Test and Clinical Psychology. , (1959).
- Lis, S., Krieger, S., Wilhelm, J., Gallhofer, B. Feedback about previous action improves executive functioning in schizophrenia: An analysis of maze solving behaviour. Schizophrenia Research. 78 (2-3), 243-250 (2005).
- Zelinsky, G. J. A theory of eye movements during target acquisition. Psychological Review. 115 (4), 787-835 (2008).
- Wurtz, R. H., Goldberg, M. E., Robinson, D. L. Brain mechanisms of visual attention. Scientific American. 246 (6), 124-135 (1982).
- Burr, D., Morrone, M. C. Eye movements: Building a stable world from glance to glance. Current Biology. 15 (20), 839-840 (2005).
- Rolfs, M. Microsaccades: Small steps on a long way. Vision Research. 49 (20), 2415-2441 (2009).
- Ortega, J., Plaska, C. R., Gomes, B. A., Ellmore, T. M. Spontaneous eye blink rate during the working memory delay period predicts task accuracy. Frontiers in Psychology. 13, 788231 (2022).
- Grueschow, M., Kleim, B., Ruff, C. C. Role of the locus coeruleus arousal system in cognitive control. Journal of Neuroendocrinology. 32 (12), 12890 (2020).
- Aston-Jones, G., Shaver, R., Dinan, T. Cortically projecting nucleus basalis neurons in rat are physiologically heterogeneous. Neuroscience Letters. 46 (1), 19-24 (1984).
- Foote, S. L., Bloom, F. E., Aston-Jones, G. Nucleus locus coeruleus: New evidence of anatomical and physiological specificity. Physiological Reviews. 63 (3), 844-914 (1983).
- Siever, L. J., Davis, K. L. Overview: Toward a dysregulation hypothesis of depression. The American Journal of Psychiatry. 142 (9), 1017-1031 (1985).
- Aston-Jones, G., Gold, J. I. How we say no: Norepinephrine, inferior frontal gyrus, and response inhibition. Biological Psychiatry. 65 (7), 548-549 (2009).
- Aston-Jones, G., Cohen, J. D. An integrative theory of locus coeruleus norepinephrine function: adaptive gain and optimal performance. Annual Review of Neurosciences. 28, 403-450 (2005).
- Einhauser, W., Stout, J., Koch, C., Carter, O. Pupil dilation reflects perceptual selection and predicts subsequent stability in perceptual rivalry. Proceedings of the National Academy of Sciences of the United States of America. 105 (5), 1704-1709 (2008).
- Yoshitomi, T., Ito, Y., Inomata, H. Adrenergic excitatory and cholinergic inhibitory innervations in the human iris dilator. Experimental Eye Research. 40 (3), 453-459 (1985).
- Rajkowski, J., Kubiak, P., Aston-Jones, G. Locus coeruleus activity in monkey: Phasic and tonic changes are associated with altered vigilance. Brain Research Bulletin. 35 (5-6), 607-616 (1994).
- Beatty, J. Task-evoked pupillary responses, processing load, and the structure of processing resources. Psychological Bulletin. 91 (2), 276-292 (1982).
- Beatty, J., Kahneman, D. Pupillary changes in two memory tasks. Psychonomic Science. 5, 371-372 (1966).
- Hess, E. H., Polt, J. M. Pupil size in relation to mental activity during simple problem-solving. Science. 143 (3611), 1190-1192 (1964).
- Kuchinke, L., Vo, M. L., Hofmann, M., Jacobs, A. M. Pupillary responses during lexical decisions vary with word frequency but not emotional valence. International Journal of Psychophysiology. 65 (2), 132-140 (2007).
- Barkley, R. A. Adolescents with attention-deficit/hyperactivity disorder: An overview of empirically based treatments. Journal of Psychiatric Practice. 10 (1), 39-56 (2004).
- Gau, S. S. F. e. m. 8. 9., Shang, C. Y. Executive functions as endophenotypes in ADHD: Evidence from the Cambridge Neuropsychological Test Battery (CANTAB). Journal of Child Psychology and Psychiatry and Allied Disciplines. 51 (7), 838-849 (2010).
- Bora, E., Harrison, B. J., Yücel, M., Pantelis, C. Cognitive impairment in euthymic major depressive disorder: A meta-analysis. Psychological Medicine. 43 (10), 2017-2026 (2013).
- Rive, M. M., Koeter, M. W. J., Veltman, D. J., Schene, A. H., Ruhé, H. G. Visuospatial planning in unmedicated major depressive disorder and bipolar disorder: Distinct and common neural correlates. Psychological Medicine. 46 (11), 2313-2328 (2016).
- Holt, D. V., Wolf, J., Funke, J., Weisbrod, M., Kaiser, S. Planning impairments in schizophrenia: Specificity, task independence and functional relevance. Schizophrenia Research. 149 (1-13), 174-179 (2013).
- Lima-Silva, T. B., et al. Functional profile of patients with behavioral variant frontotemporal dementia (bvFTD) compared to patients with Alzheimer's disease and normal controls. Dementia and Neuropsychologia. 7 (1), 96-103 (2013).
- Karnath, H. O., Wallesch, C. W., Zimmermann, P. Mental planning and anticipatory processes with acute and chronic frontal lobe lesions: A comparison of maze performance in routine and non-routine situations. Neuropsychologia. 29 (4), 271-290 (1991).
- Staudigl, T., Hartl, E., Noachtar, S., Doeller, C. F., Jensen, O. Saccades are phase-locked to alpha oscillations in the occipital and medial temporal lobe during successful memory encoding. PLoS Biology. 15 (12), 2003404 (2017).
- Faul, F., Erdfelder, E., Lang, A. G., Buchner, A. G*Power 3: A flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behavior Research Methods. 39 (2), 175-191 (2007).
- Ferrando, L., Bobes, J., Gibert, J., Soto, M. MINI Entrevista Neuropsiquiátrica Internacional (MINI International Neuropsychiatric Interview, MINI). Instrumentos de Detección y Orientación Diagnóstica. , (2000).
- McAssey, M., Dowsett, J., Kirsch, V., Brandt, T., Dieterich, M. Different EEG brain activity in right and left-handers during visually induced self-motion perception. Journal of Neurology. 267 (1), 79-90 (2020).
- Kelly, R., Mizelle, J. C., Wheaton, L. A. Distinctive laterality of neural networks supporting action understanding in left- and right-handed individuals: An EEG coherence study. Neuropsychologia. 75, 20-29 (2015).
- O'Hare, A. J., Atchley, R. A., Young, K. M. Central and divided visual field presentation of emotional images to measure hemispheric differences in motivated attention. Journal of Visualized Experiments. (129), 56257 (2017).
- Beatty, J. Task-evoked pupillary responses, processing load, and the structure of processing resources. Psychological Bulletin. 91 (2), 276-292 (1982).
- Wainstein, G., et al. Pupil size tracks attentional performance in attention-deficit/hyperactivity disorder. Scientific Reports. 7 (1), 8228 (2017).
- Drueke, B., et al. Neural correlates of positive and negative performance feedback in younger and older adults. Behavioral and Brain Functions. 11, 17 (2015).
- Lezak, M. D. The problem of assessing executive functions. International Journal of Psychology. 17 (1-4), 281-297 (1982).
- Oosterman, J. M., Wijers, M., Kessels, R. P. C. Planning or something else? Examining neuropsychological predictors of zoo map performance. Applied Neuropsychology. 20 (2), 103-109 (2013).
- Keil, A., et al. Committee report: Publication guidelines and recommendations for studies using electroencephalography and magnetoencephalography. Psychophysiology. 51 (1), 1-21 (2014).
- Abokyi, S., Owusu-Mensah, J., Osei, K. A. Caffeine intake is associated with pupil dilation and enhanced accommodation. Eye. 31 (4), 615-619 (2017).
- Wilhelm, B., Stuiber, G., Lüdtke, H., Wilhelm, H. The effect of caffeine on spontaneous pupillary oscillations. Ophthalmic & Physiological Optics. 34 (1), 73-81 (2014).
- McGinley, M. J., David, S. V., McCormick, D. A. Cortical membrane potential signature of optimal states for sensory signal detection. Neuron. 87 (1), 179-192 (2015).
- Slotnick, S. D. High density event-related potential data acquisition in cognitive neuroscience. Journal of Visualized Experiments. (38), 1945 (2010).
- Lamm, C., Windischberger, C., Leodolter, U., Moser, E., Bauer, H. Co-registration of EEG and MRI data using matching of spline interpolated and MRI-segmented reconstructions of the scalp surface. Brain Topography. 14 (2), 93-100 (2001).
- Schwartz, D., et al. Registration of MEG/EEG data with 3D MRI: Methodology and precision issues. Brain Topography. 9, 101-116 (1996).
- Laeng, B., Sirois, S., Gredebäck, G. Pupillometry: A window to the preconscious? Perspectives on psychological science. Journal of the Association for Psychological Science. 7 (1), 18-27 (2012).
- Vandierendonck, A. A comparison of methods to combine speed and accuracy measures of performance: A rejoinder on the binning procedure. Behavior Research Methods. 49 (2), 653-673 (2017).
- Vandierendonck, A. Further tests of the utility of integrated speed-accuracy measures in task switching. Journal of Cognition. 1 (1), 8 (2018).
- Levene, H., Olkin, I. Robust tests for equality of variances. In Contributions to Probability and Statistics: Essays in Honor of Harold Hotelling. , 278-292 (1960).
- Zimmerman, D. W. A note on preliminary tests of equality of variances. The British Journal of Mathematical and Statistical Psychology. 57, 173-181 (2004).
- D'Agostino, R. B., Belanger, A., D'Agostino, R. B. A suggestion for using powerful and informative tests of normality). The American Statistician. 44 (4), 316 (1990).
- Shapiro, S. S., Wilk, M. B. An analysis of variance test for normality (complete samples). Biometrika. 52 (3-4), 591-611 (1965).
- Wilcoxon, F. Individual comparisons by ranking methods. Biometrics Bulletin. 1 (6), 80 (1945).
- Fay, M. P., Proschan, M. A. Wilcoxon-Mann-Whitney or t-test? On assumptions for hypothesis tests and multiple interpretations of decision rules. Statistics Surveys. 4, 1-39 (2010).
- Delorme, A., Makeig, S. EEGLAB: An open-source toolbox for analysis of single-trial EEG dynamics including independent component analysis. Journal of Neuroscience Methods. 134 (1), 9-21 (2004).
- Dimigen, O., Sommer, W., Hohlfeld, A., Jacobs, A. M., Kliegl, R. Coregistration of eye movements and EEG in natural reading: Analyses and review. Journal of Experimental Psychology. 140 (4), 552-572 (2011).
- Mognon, A., Jovicich, J., Bruzzone, L., Buiatti, M. ADJUST: An automatic EEG artifact detector based on the joint use of spatial and temporal features. Psychophysiology. 48 (2), 229-240 (2011).
- Bell, A. J., Sejnowski, T. J., Leen, T. K., Tesauro, G., Touretsky, D. S. A non-linear information maximization algorithm that performs blind separation. Advances in Neural Information Processing Systems 7. , (1995).
- Plöchl, M., Ossandón, J. P., König, P. Combining EEG and eye tracking: Identification, characterization, and correction of eye movement artifacts in electroencephalographic data. Frontiers in Human Neuroscience. 6, 278 (2012).
- Pion-Tonachini, L., Kreutz-Delgado, K., Makeig, S. ICLabel: An automated electroencephalographic independent component classifier, dataset, and website. NeuroImage. 198, 181-197 (2019).
- Gartner, M., Grimm, S., Bajbouj, M. Frontal midline theta oscillations during mental arithmetic: Effects of stress. Frontiers in Behavioral Neuroscience. 9, 96 (2015).
- Wang, W., Viswanathan, S., Lee, T., Grafton, S. T. Coupling between theta oscillations and cognitive control network during cross-modal visual and auditory attention: Supramodal vs modality-specific mechanisms. PLoS One. 11 (7), 0158465 (2016).
- Maris, E., Oostenveld, R. Nonparametric statistical testing of EEG- and MEG-data. Journal of Neuroscience Methods. 164 (1), 177-190 (2007).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Computational Intelligence and Neuroscience. 2011, 879716 (2011).
- Pascual-Marqui, R. D. Standardized low-resolution brain electromagnetic tomography (sLORETA): Technical details. Methods and Findings in Experimental and Clinical Pharmacology. 24, 5-12 (2002).
- Gramfort, A., Papadopoulo, T., Olivi, E., Clerc, M. OpenMEEG: Opensource software for quasistatic bioelectromagnetics). Biomedical Engineering Online. 9, 45 (2010).
- Destrieux, C., Fischl, B., Dale, A., Halgren, E. Automatic parcellation of human cortical gyri and sulci using standard anatomical nomenclature. Neuroimage. 53 (1), 1-15 (2010).
- Orr, J. M., Weissman, D. H. Anterior cingulate cortex makes 2 contributions to minimizing distraction. Cerebral Cortex. 9 (3), 703-711 (2009).
- Christoff, K., Gabrieli, J. D. E. The frontopolar cortex and human cognition: Evidence for a rostrocaudal hierarchical organization within the human prefrontal cortex. Psychobiology. 28 (2), 168-186 (2000).
- Nitschke, K., Köstering, L., Finkel, L., Weiller, C., Kaller, C. P. A meta-analysis on the neural basis of planning: Activation likelihood estimation of functional brain imaging results in the Tower of London task. Human Brain Mapping. 38 (1), 396-413 (2017).
- Barbey, A. K., Koenigs, M., Grafman, J. Dorsolateral prefrontal contributions to human working memory. Cortex. 49 (5), 1195-1205 (2013).
- Le Van Quyen, M., et al. Comparison of Hilbert transform and wavelet methods for the analysis of neuronal synchrony. Journal of Neuroscience Methods. 111 (2), 83-98 (2001).
- Bokil, H., Andrews, P., Kulkarni, J. E., Mehta, S., Mitra, P. P. Chronux: A platform for analyzing neural signals. Journal of Neuroscience Methods. 192 (1), 146-151 (2010).
- Sato, N., Yamaguchi, Y. EEG theta regulates eye saccade generation during human object-place memory encoding. Advances in Cognitive Neurodynamics ICCN 2007. , 429-434 (2008).
- Zaki, J., Ochsner, K. The need for a cognitive neuroscience of naturalistic social cognition. Annals of the New York Academy of Sciences. 1167, 16-30 (2009).
- Shamay-Tsoory, S. G., Mendelsohn, A. Real-life neuroscience: An ecological approach to brain and behavior research. Perspectives on Psychological Science. 14 (5), 841-859 (2019).
- Diamond, A. Executive functions. Annual Review of Psychology. 64, 135-168 (2013).
- Dudai, Y. . Memory from A to Z: Keywords, Concepts and Beyond. , (2002).
- Kingstone, A., Smilek, D., Ristic, J., Friesen, C. K., Eastwood, J. D. Attention, researchers! It is time to take a look at the real world. Current Directions in Psychological Science. 12 (5), 176-180 (2003).
- Morris, R. G., Ward, G., Morris, R., Ward, G. Introduction to the psychology of planning. The Cognitive Psychology of Planning. , (2005).
- Zwosta, K., Ruge, H., Wolfensteller, U. Neural mechanisms of goal-directed behavior: Outcome-based response selection is associated with increased functional coupling of the angular gyrus. Frontiers in Human Neuroscience. 9, 180 (2015).
- Owen, A. M., Doyon, J., Petrides, M., Evans, A. C. Planning and spatial working memory: A positron emission tomography study in humans. European Journal of Neuroscience. 8 (2), 353-364 (1996).
- Ossandon, T., et al. Efficient "pop-out" visual search elicits sustained broadband gamma activity in the dorsal attention network. Journal of Neuroscience. 32 (10), 3414-3421 (2012).
- Lezak, M. D. . Neuropsychological Assessment., 3rd edition. , (1995).
- Lin, H., Saunders, B., Hutcherson, C. A., Inzlicht, M. Midfrontal theta and pupil dilation parametrically track subjective conflict (but also surprise) during intertemporal choice. NeuroImage. 172, 838-852 (2018).
- Yu, S., Mückschel, M., Beste, C. Superior frontal regions reflect the dynamics of task engagement and theta band-related control processes in time-on task effects. Scientific Reports. 12 (1), 846 (2022).
- Nakatani, H., van Leeuwen, C. Antecedent occipital alpha band activity predicts the impact of oculomotor events in perceptual switching. Frontiers in Systems Neuroscience. 7, 19 (2013).
- Velasques, B., et al. Changes in saccadic eye movement (SEM) and quantitative EEG parameter in bipolar patients. Journal of Affective Disorders. 145 (3), 378-385 (2013).
- Bodala, I. P., Li, J., Thakor, N. V., Al-Nashash, H. EEG and eye tracking demonstrate vigilance enhancement with challenge integration. Frontiers in Human Neuroscience. 10, 273 (2016).
- Dimigen, O. Optimizing the ICA-based removal of ocular EEG artifacts from free viewing experiments. NeuroImage. 207, 116117 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados