Method Article
Une tâche de planification visuospatiale couplée à des systèmes d’oculométrie et d’électroencéphalogramme
Dans cet article
Résumé
L’étude de la planification cognitive combinant des systèmes d’EEG et d’oculométrie fournit une approche multimodale pour étudier les mécanismes neuronaux qui médient le contrôle cognitif et le comportement orienté vers un but chez l’homme. Nous décrivons ici un protocole permettant d’étudier le rôle des oscillations cérébrales et des mouvements oculaires dans la performance de la planification.
Résumé
Le processus de planification, caractérisé par la capacité de formuler un plan organisé pour atteindre un objectif, est essentiel pour le comportement humain dirigé vers un but. Étant donné que la planification est compromise dans plusieurs troubles neuropsychiatriques, la mise en œuvre de tests cliniques et expérimentaux appropriés pour examiner la planification est essentielle. Du fait de la nature du déploiement de la planification, auquel participent plusieurs domaines cognitifs, l’évaluation de la planification et la conception de paradigmes comportementaux couplés à des méthodes de neuroimagerie sont des défis actuels en neurosciences cognitives. Une tâche de planification a été évaluée en combinaison avec un système d’électroencéphalogramme (EEG) et des enregistrements de mouvements oculaires chez 27 participants adultes en bonne santé. La planification peut être séparée en deux étapes : une étape de planification mentale dans laquelle une séquence d’étapes est représentée en interne et une étape d’exécution dans laquelle l’action motrice est utilisée pour atteindre un objectif préalablement planifié. Notre protocole comprenait une tâche de planification et une tâche de contrôle. La tâche de planification a consisté à résoudre 36 épreuves de labyrinthe, chacune représentant une carte du zoo. La tâche comportait quatre périodes : i) la planification, où les sujets devaient planifier un chemin pour visiter les emplacements de quatre animaux selon un ensemble de règles ; ii) la maintenance, où les sujets devaient conserver le chemin prévu dans leur mémoire de travail ; iii) l’exécution, où les sujets ont utilisé des mouvements oculaires pour tracer le chemin précédemment planifié comme indiqué par le système de suivi oculaire ; et iv) la réponse, lorsque les sujets ont signalé l’ordre des animaux visités. La tâche de contrôle avait une structure similaire, mais la composante de planification cognitive a été supprimée en modifiant l’objectif de la tâche. Les modèles spatiaux et temporels de l’EEG ont révélé que la planification induit une augmentation progressive et durable de l’activité thêta frontale-médiane (FMθ) au fil du temps. La source de cette activité a été identifiée dans le cortex préfrontal par des analyses de sources. Nos résultats suggèrent que le paradigme expérimental combinant les systèmes EEG et eye-tracker est optimal pour évaluer la planification cognitive.
Introduction
Au cours des 10 dernières années, des recherches approfondies ont été menées pour examiner le rôle de la dynamique neuronale oscillatoire sur la cognition et le comportement. Ces études ont établi que les interactions spécifiques à la fréquence entre les régions corticales spécialisées et étendues jouent un rôle crucial dans la cognition et le contrôle cognitif 1,2,3. Cette approche met en évidence la nature rythmique de l’activité cérébrale, qui aide à coordonner la dynamique corticale à grande échelle et sous-tend le traitement cognitif et le comportement orienté vers un but 4,5. Il existe des preuves substantielles montrant que les oscillations rythmiques dans le cerveau sont impliquées dans divers processus cognitifs, notamment la perception6, l’attentio 7,8,9, la prise de décision10, la réactivation de la mémoire11, la mémoire de travail12 et le contrôle cognitif13. Différents mécanismes oscillatoires ont été proposés pour guider le comportement orienté vers un but, avec des réseaux transitoires à grande échelle spécifiques à la fréquence fournissant un cadre pour le traitement cognitif 1,14,15. Par exemple, des découvertes récentes suggèrent que des bandes de fréquences spécifiques dans le cerveau peuvent refléter un mécanisme de rétroaction qui régule l’activité de pointe, fournissant un cadre de référence temporel pour coordonner l’excitabilité corticale et le moment des pointes pour produire le comportement 16,17,18. Une critique est fournie par Helfrich et Knight19.
Cet ensemble de preuves soulève des questions sur la façon dont le cortex préfrontal (PFC) encode les contextes de tâches de planification et les règles comportementales associées. On a longtemps pensé que le PFC soutenait le contrôle cognitif et le comportement orienté vers un but grâce aux modèles oscillatoires de l’activité neuronale qu’il génère, biaisant sélectivement l’activité neuronale dans les régions cérébrales distantes et contrôlant le flux d’informations dans les réseaux neuronaux à grande échelle20. De plus, il a été proposé que les régions présentant une synchronie locale soient plus susceptibles de participer à des activités interrégionales 21,22,23. En particulier, les oscillations corticales de la bande thêta (4-8 Hz), mesurées par électroencéphalogramme (EEG) du cuir chevelu, ont été proposées comme un mécanisme potentiel de transmission du contrôle descendant à travers de vastes réseaux13. Plus précisément, l’activité de la bande thêta chez l’homme reflète des processus cognitifs de haut niveau, tels que l’encodage et la récupération de la mémoire, la rétention de la mémoire de travail, la détection de nouveautés, la prise de décision et le contrôle descendant 12,24,25,26.
Dans le même ordre d’idées, Cavanagh et Frank13 ont proposé deux mécanismes séquentiels des processus de contrôle : la reconnaissance du besoin de contrôle et l’instanciation du contrôle. La reconnaissance de la nécessité d’un contrôle peut être indiquée par l’activité thêta frontale médiane (FMθ) provenant du cortex préfrontal médian (mPFC), qui a été décrite en termes de composants de potentiel lié à l’événement (ERP) qui reflètent les processus de contrôle liés au mPFC en réponse à diverses situations, telles que de nouvelles informations 27,28,29, des exigences de stimulus-réponse conflictuelles 30, une rétroaction d’erreur31, et détection d’erreurs32. Ces composants ERP, qui reflètent la nécessité d’un contrôle cognitif accru en présence de nouveauté, de conflit, de punition ou d’erreur, présentent une signature spectrale commune dans la bande thêta enregistrée aux électrodes médianes frontales 26,27,33,34,35,36,37,38,39,40, 41,42,43,44.
Les réponses EEG de l’activité FMθ présentent un modèle de réinitialisation de phase et d’augmentation de puissance dans la bande de fréquencethêta 26. Malgré les limites de la méthode EEG en termes de résolution spatiale, diverses sources de preuves ont été recueillies pour démontrer que l’activité FMθ est générée par le cortex cingulaire moyen (MCC)13. On pense que ces dynamiques thêta servent de cadres temporels qui régulent les processus neuronaux du mPFC, qui sont ensuite augmentés en réponse à des événements nécessitant un contrôle accru26. Cela a été établi par l’analyse des sources 31,33,45,46,47, les enregistrements simultanés de l’EEG et de l’imagerie par résonance magnétique fonctionnelle (IRMf) 48,49, et les enregistrements EEG invasifs chez l’homme50 et les singes 51,52,53.
Sur la base de ces observations, la ligne médiane frontale thêta est considérée comme un mécanisme universel, un langage commun, pour exécuter un contrôle adaptatif dans différentes situations où il y a un manque de certitude concernant les actions et les résultats, comme lors de la planification. Le paradigme comportemental que nous proposons dans ce protocole a été utilisé pour étudier la planification cognitive et ses caractéristiques temporelles et neuronales. Bien que divers mécanismes de contrôle cognitif aient été rapportés dans d’autres scénarios, le protocole actuel a permis de décrire récemment la planification et ses propriétés neuronales et temporelles associées54. Le processus cognitif de planification comprend deux phases distinctes : la phase de planification mentale, au cours de laquelle une représentation interne d’une séquence de plans est développée55, et la phase d’exécution de la planification, au cours de laquelle un ensemble d’actions motrices est exécuté pour atteindre l’objectif précédemment planifié56. La planification est connue pour nécessiter l’intégration de divers composants des fonctions exécutives, y compris la mémoire de travail, le contrôle attentionnel et l’inhibition de la réponse, ce qui rend la manipulation expérimentale et la mesure isolée de ces processus difficiles57,58.
Les études de neuroimagerie sur la planification cognitive ont couramment utilisé des paradigmes comportementaux tels que la Tour de Londres 59,60,61 ; Cependant, afin de contrôler les facteurs de confusion, les tâches utilisées pour l’étude de la planification cognitive peuvent devenir limitées et artificielles, conduisant à une validité prédictive et écologique moindre 62,63,64,65. Pour surmonter ce problème dans le domaine de la neuropsychologie, des situations de planification du monde réel ont été proposées comme des tâches écologiques62,63. Le sous-test Zoo Map Task de la batterie d’évaluation comportementale du syndrome de dysexecutive mesure les compétences de planification et d’organisation de manière plus naturelle et plus pertinente64,66. Il s’agit d’un test au crayon et au papier qui consiste à planifier un itinéraire pour visiter 6 des 12 lieux sur la carte d’un zoo. Les lieux sont des lieux communs que l’on peut trouver dans un zoo ordinaire, comme une maison d’éléphants, une cage à lion, une aire de repos, un café, etc. Il y a deux conditions qui évaluent différents niveaux de planification : i) la condition de formulation, où les sujets sont invités à planifier un itinéraire pour visiter six lieux dans l’ordre de leur choix mais selon un ensemble de règles ; et ii) la condition d’exécution, où les sujets sont invités à visiter six lieux dans un ordre spécifique et en suivant également un ensemble de règles. Ces deux conditions fournissent des informations sur les compétences de planification dans les problèmes mal structurés (formulation) et bien structurés (exécution)67. La première est présentée comme une tâche cognitive plus exigeante en situation ouverte car elle demande aux sujets de développer une stratégie logique pour atteindre l’objectif. Avant de tracer un chemin, il faut concevoir une séquence d’opérateurs ; Dans le cas contraire, des erreurs risquent de se produire. D’autre part, la condition d’exécution nécessite une demande cognitive plus faible car la résolution d’une tâche impliquant le suivi d’une stratégie spécifique imposée ne nécessite que le sujet qu’un suivi de la mise en œuvre du plan formulé pour atteindre l’objectif66. D’autre part, le labyrinthe de Porteus est une tâche bien connue dans le domaine de la psychologie, en particulier dans les domaines de la psychologie cognitive et de la neuropsychologie, et il a été largement utilisé comme outil pour évaluer divers aspects de la cognition, tels que la résolution de problèmes et la planification68,69. La tâche du labyrinthe de Porteus est une tâche au crayon et au papier qui commence par une simple analyse des stimuli visuels et devient de plus en plus difficile. Le sujet doit trouver et tracer le bon chemin d’un point de départ à une sortie (parmi plusieurs options) tout en suivant des règles, telles que d’éviter les chemins qui se croisent et les impasses, et d’agir le plus rapidement possible68. Chaque fois qu’une bifurcation apparaît pendant le dessin du chemin, les sujets prennent des décisions pour atteindre l’objectif et éviter d’enfreindre les règles69 données.
Compte tenu des limites et des forces des tâches couramment utilisées et écologiques, nous avons conçu notre paradigme comportemental principalement basé sur la Zoo Map Task66 et la Porteus MazeTask 68. Le paradigme comportemental se compose de quatre étapes distinctes qui englobent le processus cognitif de planification dans un scénario de la vie quotidienne. Ces étapes sont les suivantes : Étape 1, la planification, où les participants sont chargés de créer un itinéraire pour visiter divers endroits sur une carte, en veillant au respect des règles établies ; Étape 2, la maintenance, où les participants sont tenus de garder l’itinéraire prévu dans leur mémoire de travail ; Étape 3, l’exécution, où les participants exécutent leur itinéraire préalablement planifié en dessinant et en surveillant de près sa précision ; et l’étape 4, l’intervention, où les participants signalent la séquence des animaux visités selon leur itinéraireprévu 54. Notre paradigme permet de mesurer différents paramètres de la capacité de planification à l’aide de différentes étapes, qui reflètent les différentes composantes de la planification (telles que la mémoire de travail, l’attention exécutive et les compétences visuospatiales) de manière plus réaliste, car la cartographie des itinéraires est un phénomène courant dans la vie quotidienne. De plus, pour contrôler les facteurs de confusion, le paradigme comprend une tâche de contrôle avec une structure de tâche de planification et des stimuli équivalents, qui engage les composantes cognitives exécutives également impliquées dans la planification, mais exclut la composante du processus de planification. Cela permet de séparer la composante du processus de planification pour la comparaison des marqueurs électrophysiologiques et des paramètres comportementaux54.
De plus, l’oculométrie a apporté des contributions importantes aux études en neurosciences cognitives en fournissant une méthode non invasive pour mesurer et analyser les mouvements oculaires, qui peut fournir des informations précieuses sur les processus cognitifs et les mécanismes neuronaux sous-jacents à la perception, à l’attention et aux fonctions cognitives. La mesure de différents types de mouvements oculaires à l’aide d’un système de suivi oculaire peut fournir des informations précieuses sur les processus cognitifs et les mécanismes neuronaux impliqués dans la planification. Par exemple, les aspects suivants peuvent être mesurés : les fixations, qui sont les périodes de regard stable pendant lesquelles l’information visuelle est acquise70 ; les saccades, qui sont les mouvements oculaires rapides qui sont utilisés pour déplacer le regard d’un endroit à un autre71 ; poursuite en douceur, qui est un type de mouvement oculaire qui permet aux yeux de suivre un objet en mouvementen douceur 72 ; les microsaccades, qui sont de petits mouvements oculaires rapides qui se produisent même pendant les fixations73 ; et les clignements, qui sont une action réflexe qui aide à garder les yeux lubrifiés et à les protéger des corps étrangers74. Ces mouvements oculaires peuvent fournir des informations sur les processus cognitifs impliqués dans la recherche visuelle, l’allocation de l’attention70, le suivi visuel72, la perception73 et la mémoire de travail74, qui sont des composants importants pour la planification et le contrôle cognitif.
D’autre part, des études récentes sur le système locus coeruleus-noradrénaline (LC-NE) ont montré son rôle pertinent dans le contrôle cognitif75. Le locus coeruleus (LC) se projette vers plusieurs régions du cerveau, telles que le cortex cérébral, l’hippocampe, le thalamus, le mésencéphale, le tronc cérébral, le cervelet et la moelle épinière 76,77,61. Les innervations LC-NE particulièrement denses reçoivent des zones cérébrales PFC associées au contrôle cognitif75. En outre, certaines études indiquent que l’hyperactivité chronique du système LC peut contribuer aux symptômes du trouble maniaco-dépressif, tels que l’impulsivité et l’insomnie. En revanche, une diminution chronique de la fonction LC a été associée à une réduction de l’expression émotionnelle, une caractéristique répandue chez les patients souffrant de dépression78. Une réponse hyperactive du locus coeruleus aux stimuli peut entraîner une réponse excessive chez les personnes souffrant de stress ou de troubles anxieux79. Par conséquent, les altérations du système LC-NE peuvent contribuer aux symptômes de la dysrégulation cognitive et/ou émotionnelle. Des techniques non invasives peuvent être utilisées pour examiner l’activité du locus coeruleus, dont les modifications du diamètre de la pupille, qui sont principalement contrôlées par la noradrénaline libérée par le locus coeruleus. La noradrénaline agit sur le muscle dilatateur de l’iris en stimulant les récepteurs alpha-adrénergiques et sur le noyau d’Edinger-Westphal, qui envoie des signaux au ganglion ciliaire et contrôle la dilatation de l’iris par l’activation des récepteurs alpha-2 adrénergiques postsynaptiques 66,80,81,82. Des enregistrements neuronaux LC directs de singes ont confirmé la relation entre l’activité LC-NE, le diamètre de la pupille et les performances cognitives83. La dilatation de la pupille a été observée à plusieurs reprises en réponse à des exigences de traitement accrues dans plusieurs tâches cognitives 71,84,85,86,87.
Les marqueurs électrophysiologiques du contrôle cognitif combinés au suivi oculaire et aux enregistrements pupillaires pourraient démêler des questions cruciales sur la façon dont le contrôle cognitif et la planification sont mis en œuvre dans le cerveau. L’importance d’utiliser notre protocole combinant des systèmes EEG et oculaires est double. D’une part, le contrôle cognitif semble exiger la participation d’une activité cérébrale distribuée dans des relations temporelles précises, qui constituent des candidats idéaux pour étudier le fonctionnement des réseaux cérébraux. D’autre part, des anomalies dans l’une de ces capacités ont un impact sévère sur le comportement normal, comme cela pourrait être le cas dans le cas de divers troubles cognitifs et neuropsychiatriques, tels que le trouble déficitaire de l’attention/hyperactivité88,89, le trouble dépressif majeur90,91, le trouble bipolaire91, la schizophrénie92, la démence frontotemporale93, ainsi que les troubles dus à des lésions frontales94. De plus, le protocole actuel permet d’utiliser la pupillométrie comme paramètre pour comparer l’activité et les oscillations de la LC-NE à l’aide de l’oculométrie et de l’électroencéphalographie. Cela pourrait non seulement fournir des preuves de la relation théorique entre la LC-EN, la pupillométrie et les marqueurs neuronaux chez l’homme, mais pourrait également permettre de suivre la trajectoire de développement des caractéristiques liées au système LC-NE pendant la planification cognitive. Cependant, dans notre modèle, nous nous sommes concentrés sur le test s’il y avait un modèle spécifique de saccades pendant la planification qui pourrait potentiellement entraîner des changements d’oscillation spécifiques95. De plus, nous avons utilisé un système de suivi oculaire comme une partie importante de l’examen de l’exécution comportementale d’un plan dans la phase d’exécution de notre paradigme comportemental.
En résumé, ce protocole pourrait produire des modèles testables de la dynamique des réseaux cérébraux qui pourraient servir de plate-forme pour d’autres recherches fondamentales et d’éventuelles applications cliniques et thérapeutiques.
Protocole
Toutes les procédures de ce protocole ont été approuvées par le comité de bioéthique de la Faculté de médecine de la Pontificia Universidad Católica de Chile, et tous les participants ont signé un formulaire de consentement éclairé avant le début de l’étude (numéro de projet de recherche : 16-251).
1. Recrutement des participants
- Recruter des adultes droitiers en bonne santé (mâles et femelles) ayant une vision normale ou corrigée à normale, et les dépister sur les critères d’inclusion/exclusion.
REMARQUE : Dans cette étude, 27 individus en bonne santé, âgés de 19 à 38 ans et parlant couramment la langue, ont été recrutés. La taille de l’échantillon peut varier en fonction du niveau de puissance statistique souhaité, et la tranche d’âge peut varier en fonction de la question de recherche spécifique à aborder. Dans notre protocole, nous avons calculé la taille de l’échantillon en tenant compte du test statistique de Wilcoxon à rang signé, d’une taille d’effet de 0,7, d’un niveau alpha de 0,05 et d’une puissance de 0,95, comme décrit dans Faul et al.96. Nous avons utilisé l’entretien neuropsychiatriqueMINI-International 97, appliqué par un psychologue qualifié, pour évaluer les participants en termes de critères d’inclusion/exclusion. Ne recrutez que des sujets droitiers pour réduire la variabilité du signal EEG, car les gauchers pourraient présenter une distribution topographique différente de l’activité EEG 98,99,100.
2. Préparation des stimuli
- Pour la tâche de planification, créez un ensemble de stimuli à l’aide d’un logiciel d’édition de graphiques vectoriels (voir Table des matériaux). Pour chaque stimulus, concevez un labyrinthe en niveaux de gris qui représente une carte du zoo. À l’intérieur du labyrinthe, faites une passerelle et plusieurs chemins menant aux emplacements des animaux (par exemple, dans cette étude, il y avait quatre emplacements d’animaux, voir la figure 1).
REMARQUE : Dans cette étude, nous avons créé 36 labyrinthes dans lesquels chaque stimulus se composait d’une carte du zoo avec une porte de départ, quatre images d’animaux situés sur le labyrinthe et plusieurs chemins. Les chemins du labyrinthe peuvent ou non mener à l’emplacement des animaux. L’utilisation de stimuli en niveaux de gris avec un contraste réduit est souvent préférée pour la pupillométrie car elle réduit la stimulation des cônes rétiniens, qui sont responsables de la vision des couleurs. Ce changement dans l’accent du stimulus permet une mesure plus sensible des changements dans la taille de la pupille, qui sont censés refléter des changements dans l’état d’éveil ou d’attention. De plus, l’utilisation de stimuli en niveaux de gris réduit la variabilité de la mesure en raison des différences de vision des couleurs entre les individus101. - Afin d’obtenir différents niveaux de complexité dans la tâche finale, divisez les stimuli en fonction du nombre de solutions valides conformément à l’objectif et aux règles établis (en particulier, l’objectif est de planifier un chemin pour visiter les lieux des animaux). Le nombre de solutions valides fait référence au nombre de chemins possibles à prévoir en suivant les règles (voir règles à la Figure 2 et à l’étape 5.12.1.). Classez les stimuli avec plus de cinq solutions possibles comme « faciles » et ceux avec cinq solutions possibles ou moins comme « difficiles ». Ensuite, créez un nombre égal d’essais pour chaque catégorie.
REMARQUE : Vous pouvez également demander aux auteurs les stimuli créés pour Domic-Siede et al.54 , car ces stimuli ont été créés en suivant ces instructions. Considérez que tous les matériaux sont disponibles sur demande, mais les spécifications sont détaillées ici. Dans cette étude, nous avons créé 18 essais faciles et 18 essais difficiles. Il est important d’évaluer les différences de niveaux de difficulté aux niveaux comportemental et électrophysiologique, car cela aidera à déterminer si vous mesurez la demande cognitive, l’effort cognitif, la difficulté ou les aspects intrinsèques de la planification cognitive (voir les résultats représentatifs et les sections de discussion). - Pour la tâche de contrôle, utilisez la même structure que la tâche de planification (période d’évaluation, maintenance, exécution, réponse, voir figure 2), et utilisez les mêmes stimuli créés pour la tâche de planification, mais ajoutez une ligne tracée représentant un chemin balisé pour visiter la séquence des emplacements des animaux à partir de la porte jusqu’au dernier emplacement (voir figure 1B). Faites en sorte que le chemin balisé soit d’une couleur légèrement plus foncée que les chemins principaux du labyrinthe, avec un faible contraste évalué à l’aide d’un luxmètre (voir étape 2.4).
REMARQUE : L’idée sous-jacente est de garder les caractéristiques psychophysiques des deux conditions (tâches de planification et de contrôle) aussi similaires que possible. Les parcours tracés des labyrinthes pouvaient soit suivre les règles, soit ne pas suivre (voir la section 5 du protocole pour plus de détails sur les instructions données aux participants). Dans cette étude, la moitié des stimuli avaient une séquence de visite correcte suivant les règles, tandis que l’autre moitié présentait des erreurs (comme utiliser deux fois le même chemin ou traverser des impasses, voir étape 5.12.1 et étape 5.12.3 et figure 2). - Évaluez l’éclairement des stimuli à l’aide d’un luxmètre placé dans la mentonnière que les sujets utiliseront (voir étape 4.5 et étape 4.6) et à la même distance de l’écran. Chaque stimulus de chaque condition produit une valeur de lux. Enregistrez chaque valeur manuellement pour des analyses plus approfondies.
REMARQUE : Aucune différence d’éclairement n’est attendue entre les conditions (voir étape 4.6). Sinon, vérifiez le contraste des stimuli. Ceci est pertinent si le diamètre de la pupille est mesuréà 102. - Créez un stimulus représentant une rétroaction correcte (pouce levé lorsque la réponse est correcte) et un autre stimulus représentant une rétroaction incorrecte (pouce vers le bas lorsque la réponse est incorrecte) à l’aide d’un éditeur graphique vectoriel (voir la Table des matériaux) (Figure 2).

Figure 1 : Stimuli de la tâche expérimentale et de contrôle. Des exemples illustratifs des stimuli de la tâche de planification (A) et de la tâche de contrôle (B) sont présentés. Les stimuli représentent une carte du zoo composée d’une porte, de quatre emplacements d’animaux à différents endroits et de plusieurs chemins. Les stimuli pour les deux conditions étaient similaires ; la seule différence était que pour la tâche de contrôle, (B) les stimuli avaient une ligne marquée indiquant un chemin déjà existant (ligne noire ici à des fins d’illustration). Cette ligne dans les stimuli de contrôle réels était légèrement plus sombre, avec un faible contraste contrôlé par l’éclairement (voir étape 2.4). Cette figure a été modifiée à partir de Domic-Siede et al.54. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Conception expérimentale. (A) Essai de la tâche de planification. Les essais dans cette condition ont commencé avec une croix de fixation de 3 s. Ensuite, les participants ont été invités à planifier un parcours pour visiter les quatre lieux d’animaux en suivant un ensemble de règles (10 s maximum). Ensuite, une croix de fixation décalée est apparue (3 s), suivie de l’apparition du labyrinthe à nouveau. Au cours de cette période (exécution), les sujets devaient exécuter le tracé prévu dans la période de planification précédente en utilisant leur regard avec un retour visuel en ligne (fourni par le système de suivi oculaire), qui délimitait le mouvement de leur regard en temps réel (ligne sombre) (10 s maximum). Par la suite, au cours de la période de réponse, les sujets devaient rendre compte de la séquence réalisée lors de l’exécution en ordonnant la visite des animaux. Selon leurs réponses, des commentaires ont été formulés. (B) Essai de la tâche de contrôle. Les essais dans cette condition ont commencé avec une croix de fixation de 3 s. Ensuite, les participants ont été invités à évaluer si un chemin tracé (ligne sombre) suivait les règles ou non. Ensuite, une croix de fixation décalée est apparue (3 s), suivie de l’apparition du labyrinthe à nouveau. Dans cette période, les sujets devaient redessiner le chemin déjà tracé avec un retour visuel en ligne, comme dans la période d’exécution du planning (10 s maximum). Ensuite, au cours de la période de réponse, les sujets devaient répondre (oui ou non) si la séquence tracée suivait les règles précédemment énoncées. Cette figure a été modifiée à partir de Domic-Siede et al.54. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Planification et programmation des tâches de contrôle
- Rédiger un script codant un paradigme de tâche de planification basé sur la Zoo Map Task66 et le Porteus Maze68à l’aide d’un logiciel de présentation de stimuli / expériences comportementales (voir la Table des matériaux et le Fichier supplémentaire).
- Codez la tâche en tenant compte de deux conditions (une condition de planification et une condition de contrôle) avec une structure similaire à celle expliquée dans la section 2 et la section 4 (voir la figure 2 et le fichier supplémentaire).
REMARQUE : Il est important d’utiliser la même structure dans les deux conditions afin de contrôler les facteurs de confusion et les composants perceptifs impliqués dans le processus de résolution des exigences de la tâche (Figure 2). L’utilisation de la même structure améliore l’évaluation du processus cognitif spécifique impliqué dans la planification cognitive. - Synchronisez la communication entre l’ordinateur d’affichage, l’ordinateur EEG et l’ordinateur hôte (ordinateur de suivi oculaire) via Ethernet et une communication de port parallèle envoyant des impulsions de logique transistor-transistor (TTL) à partir de l’ordinateur d’affichage (voir Figure 3).
- Écrivez un code pour calibrer les mouvements oculaires avec le système de suivi oculaire au début de la planification et des tâches de contrôle et après tous les cinq essais terminés, car la position du regard sur l’écran est cruciale pour la période d’exécution (voir les étapes 3.2.3 et 3.3.3 du protocole, la section de discussion et le code dans le fichier supplémentaire).
REMARQUE : Il peut y avoir des retards dans la communication de l’ordinateur. Il existe plusieurs méthodes pour mesurer le retard entre les impulsions TTL sur deux ordinateurs différents, mais une approche courante consiste à utiliser un dispositif matériel tel qu’un oscilloscope numérique ou un analyseur logique. Une autre approche consiste à utiliser des méthodes logicielles, telles que l’envoi des impulsions TTL sur une connexion réseau et l’utilisation d’outils d’analyse de réseau pour mesurer le retard. Une autre approche consiste à synchroniser les horloges des deux ordinateurs, soit à l’aide d’un système de positionnement global (GPS) ou d’un serveur NTP (Network Time Protocol), soit à l’aide d’une solution de synchronisation matérielle, à calculer le délai entre l’horodatage et l’heure d’arrivée de chaque impulsion, et à faire la moyenne des résultats pour obtenir le retard global entre les deux ordinateurs.
- Codez la tâche en tenant compte de deux conditions (une condition de planification et une condition de contrôle) avec une structure similaire à celle expliquée dans la section 2 et la section 4 (voir la figure 2 et le fichier supplémentaire).
- Écrivez un code pour la tâche de planification avec la structure suivante : la période de planification, la période de maintenance, la période d’exécution de la planification, la période de réponse et le retour d’information (Graphique 2, Dossier supplémentaire).
- La période de planification : Lancez la condition de planification en posant une croix de fixation présentée pendant 3 s comme ligne de base.
- Présentez au hasard l’ensemble des labyrinthes un par un (36 dans cette étude).
REMARQUE : Au cours de cette période de planification, les participants sont invités à planifier un parcours pour visiter les quatre lieux d’animaux, avec un temps maximum de 10 s, en suivant un ensemble de règles (les règles leur sont expliquées au préalable ; voir la section 5 du protocole pour voir les règles données, ainsi que la figure 2). - Incluez un déclencheur TTL dans le code signalant le début de la présentation du stimulus à l’aide d’un code d’étiquette, et envoyez ce déclencheur à l’ordinateur EEG et à l’ordinateur hôte de l’eye-tracker pour des analyses plus étroites et fenêtrées.
- Écrivez dans le code que la période de planification culmine une fois qu’un bouton d’un joystick/clavier est enfoncé chaque fois que le sujet termine la planification ou si le temps maximum est dépassé. Le temps de réaction (RT) doit être enregistré dans le fichier journal pour des analyses ultérieures.
REMARQUE : Pour cette période, nous avons utilisé un code déclencheur utilisant le chiffre 1, mais l’utilisation de balises HED (hierarchical event descriptors) plutôt que de codes numériques est recommandée, car les balises HED donnent un sens et une structure au contenu, ce qui permet à d’autres chercheurs ou collaborateurs de comprendre plus facilement le contenu des données. - La période de maintenance : Amorcez cette période à l’aide d’une croix de fixation décalée présentée pendant 3 s. Localisez la croix de fixation décalée dans la position spatiale où se trouve la porte du labyrinthe afin d’anticiper la position de départ (porte) de la carte du zoo (voir Figure 2).
REMARQUE : L’objectif de cette période est triple. Tout d’abord, la croix de fixation décalée facilite l’exécution de la trace représentant le chemin prévu pour la période suivante (voir étape 3.2.8). Deuxièmement, pendant cette période, les participants tiennent dans leur mémoire de travail le plan élaboré au cours de la période de planification. Enfin, cette période sert d’intervalle entre les procès pour délimiter la fin de la période de planification et le début de la période suivante, la période d’exécution de la planification. - La période d’exécution de la planification : Après que la croix de fixation décalée soit montrée pendant 3 s pendant la période de maintenance, présentez à nouveau le labyrinthe.
- Envoyez un déclencheur TTL à l’EEG et à l’ordinateur de suivi oculaire de l’hôte pour indiquer le début de cette période à l’aide d’un code de balise spécifique.
- Écrivez un code pour donner un retour visuel en temps réel (une ligne sombre, voir la période d’exécution dans la figure 2) de la position du regard du sujet environ 992 ms après le début de cette période.
REMARQUE : Commencer à délimiter avec un retard (1 000 ms environ) donne aux sujets le temps de s’orienter dans le labyrinthe, leur permettant de délimiter leur chemin prévu précédemment (pendant la période de planification) avec une ligne sombre. - Enregistrez les coordonnées des chemins pour une reconstruction ultérieure des chemins effectués par les sujets, et notez la performance hors ligne (voir étape 6.1.1, Figure 4).
- Assurez-vous d’un temps maximum de 10 s pour tracer le chemin prévu, et permettez aux sujets de finaliser cette période en appuyant sur un bouton. De cette façon, les sujets peuvent contrôler quand ils ont terminé leur chemin dessiné.
- Enregistrez le RT dans le fichier journal pour des analyses plus approfondies.
- La période de réponse : Écrivez un code pour la période de réponse, qui commence après 10 s d’exécution de la planification ou lors d’une pression sur un bouton à la fin de la période d’exécution de la planification, dans laquelle le labyrinthe disparaît mais les animaux et leurs positions spatiales restent à l’écran.
- Placez quatre cercles vides horizontalement au bas de l’écran dans la période de réponse.
REMARQUE : Le but de cette période est de permettre aux sujets d’indiquer la séquence des animaux visités pendant la période d’exécution de la planification en plaçant les animaux dans les cercles dans le même ordre qu’ils les ont visités à l’aide d’une manette ou d’un clavier. - Configurez le programme/code pour permettre aux sujets d’utiliser le joystick ou le clavier pour sélectionner chacun des animaux (quatre animaux dans cette étude) présentés précédemment et insérez-les dans chacun des quatre cercles (voir le fichier supplémentaire et la figure 2).
- Rétroaction: Rédigez un code pour livrer 3 s de feedback aux participants. Une image du pouce vers le haut doit être affichée en réponse aux combinaisons valides d’animaux visités si les règles sont respectées, tandis qu’une image du pouce vers le bas doit être affichée si la combinaison signalée n’est pas valide.
- Envoyez un déclencheur TTL, à l’aide d’un code de balise spécifique pour un retour correct et d’un autre code de balise pour un retour incorrect, aux ordinateurs EEG et Eye-Tracker.
REMARQUE : La raison de donner du feedback est de faciliter le suivi des performances et de maintenir la motivation pendant la tâche. Cette fourniture d’un retour d’information en temps réel renforce l’effet de récompense et encourage l’exécution correcte des tâches103.
- Écrivez un code pour la tâche de contrôle avec la même structure que la condition de planification : une période de contrôle, une période de maintenance, une période d’exécution de contrôle, une période de réponse et un retour d’information (voir Fichier supplémentaire, Figure 2).
- La période de contrôle : Écrivez un code pour la période de condition de contrôle afin d’atténuer les facteurs de confusion. Le code pour cette période doit commencer par une croix de fixation présentée pendant 3 s comme référence.
REMARQUE : Étant donné que la tâche de planification exige principalement la mise en œuvre de la planification, mais recrute également d’autres domaines cognitifs dans le cadre de la fonction exécutive, tels que la fonction visuospatiale, la mémoire de travail, le contrôle attentionnel, le contrôle inhibiteur, etc.66,88,104,105, une tâche de contrôle est cruciale pour atténuer les facteurs de confusion. Ainsi, l’objectif principal de cette tâche est d’exiger toutes les fonctions cognitives et perceptuelles nécessaires pour résoudre la tâche de planification tout en supprimant la mise en œuvre de la planification cognitive54. - Présentez au hasard les labyrinthes de la condition de contrôle un par un (labyrinthes avec un chemin balisé déjà tracé). Coder une durée maximale de 10 s.
- Incluez un déclencheur TTL dans le code signalant le début de la présentation du stimulus à l’aide d’une balise, et envoyez ce déclencheur à l’ordinateur EEG et à l’ordinateur hôte de l’eye-tracker.
- Écrivez dans le code que cette période de contrôle culmine une fois qu’un bouton d’un joystick/clavier est enfoncé chaque fois que le sujet a terminé ou si le temps maximum est dépassé.
REMARQUE : Les sujets sont invités à évaluer les chemins balisés (qu’ils respectent les règles ou non, voir l’étape 5.12 pour plus de détails sur les instructions données aux participants). - Enregistrez le temps de réaction (RT) dans le fichier journal pour des analyses ultérieures.
- La période de maintenance : Une fois la période de contrôle terminée, présentez une croix de fixation décalée pendant 3 s.
- Comme période d’exécution de la planification, placez la croix de fixation à l’endroit où se trouve l’entrée de la porte pour faciliter l’attraction du regard pour la période suivante.
- La période d’exécution du contrôle : Présentez à nouveau le labyrinthe et envoyez simultanément un déclencheur TTL à l’EEG et aux ordinateurs de suivi oculaire hôtes avec une balise signalant le début de la période d’exécution.
- Répétez le même code que pour la période d’exécution de la planification pour donner un retour en ligne sur la position du regard et pour délimiter et chevaucher leur regard avec le chemin tracé.
- Assurer un temps maximum de 10 s pour tracer le chemin, et laisser les sujets finaliser cette période en appuyant sur un bouton.
- Enregistrez le RT dans le fichier journal pour des analyses plus approfondies.
- Le délai de réponse du contrôle : Une fois la période d’exécution du contrôle terminée, présentez un point d’interrogation indiquant la période de réponse.
- Programmez deux boutons, respectivement, pour que les sujets donnent une réponse à l’aide d’un joystick ou d’un clavier.
REMARQUE : Ici, les sujets sont invités à répondre si la séquence marquée par la trace était correcte ou non en sélectionnant un bouton pour correct/OUI et un autre pour incorrect/NON. - Enregistrez la précision dans le fichier journal.
- Rétroaction: Écrivez un code pour fournir 3 s de retour correct chaque fois que les sujets répondent correctement (une image de pouce vers le haut) et 3 s de retour incorrect lorsque les sujets répondent de manière incorrecte (une image de pouce vers le bas).
- Comme dans la condition de planification, envoyez un déclencheur TTL à l’EEG et aux ordinateurs de suivi oculaire hôtes avec une balise pour un retour d’information correct et une autre balise pour un retour d’information incorrect.
- La période de contrôle : Écrivez un code pour la période de condition de contrôle afin d’atténuer les facteurs de confusion. Le code pour cette période doit commencer par une croix de fixation présentée pendant 3 s comme référence.
- Tâches de formation : Créez des stimuli, écrivez un code et présentez avant les tâches de planification et de contrôle susmentionnées une brève séance d’entraînement d’environ six essais/labyrinthes pour chaque condition (planification et contrôle)
REMARQUE : L’idée est de s’assurer de se familiariser avec le réglage de la tâche. Il est recommandé de fixer des critères pour la procédure. Dans cette étude, si les trois derniers essais étaient corrects et que les participants rapportaient comprendre l’objectif et la procédure à la fin de la session d’entraînement, les participants passaient ensuite à la session expérimentale.
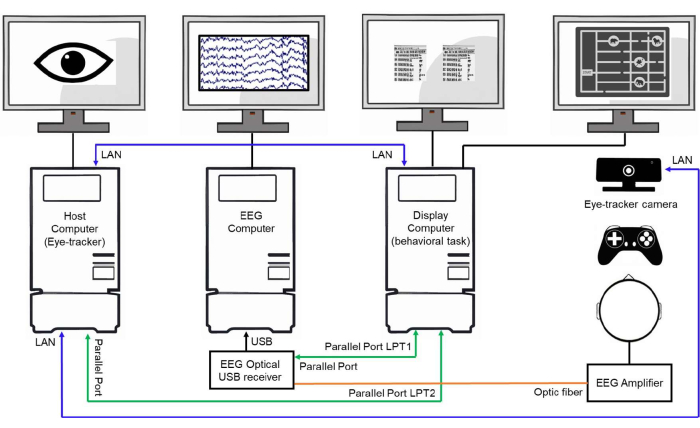
Figure 3 : Exemple d’installation d’un laboratoire. Représentation schématique d’une configuration de laboratoire montrant trois ordinateurs interconnectés. L’ordinateur hôte (ordinateur de suivi oculaire) est responsable du suivi et du stockage des données de mouvement oculaire. L’ordinateur EEG acquiert et stocke les signaux EEG. L’ordinateur d’affichage contrôle l’expérience comportementale, présente les stimuli aux sujets et envoie des déclencheurs d’événements à l’hôte et aux ordinateurs EEG via des ports parallèles et des connexions LAN pour synchroniser la collecte de données. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Reconstruction du chemin à partir d’un retour visuel en ligne donné par le système de suivi oculaire. Exemples illustratifs de reconstruction d’un chemin à partir de l’exécution motrice d’un plan (A, en violet, période d’exécution de la planification) et d’une période d’exécution de contrôle (B, ligne en vert) et avec des données d’eye-tracker. Le chemin reconstruit au cours de la période d’exécution de la planification est utilisé pour évaluer la précision de chaque essai de tâche de planification. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Cadre et équipement du laboratoire
- Utilisez un système d’acquisition EEG pour enregistrer l’activité EEG du cuir chevelu du participant, avec les électrodes EEG placées selon le système international 10-20106. Positionnez deux électrodes sur les mastoïdes du participant pour un reréférencement hors ligne. Utilisez des électrodes d’électrooculogramme pour identifier les signaux de mouvement verticaux, horizontaux et clignotants lors de l’inspection visuelle.
- Utilisez un logiciel d’acquisition EEG pour l’acquisition de données EEG avec une fréquence d’échantillonnage de 2 048 Hz ou 1 024 Hz et un filtre passe-bande entre 0,1 et 100 Hz dans l’ordinateur EEG.
REMARQUE : Les fréquences d’échantillonnage de 1 024 Hz et 2 048 Hz offrent une résolution suffisante pour analyser les oscillations à basse fréquence. Il est important d’acquérir des signaux EEG avec un taux d’échantillonnage élevé, par exemple supérieur à 1 000 Hz, lors de l’analyse des oscillations à basse fréquence afin de s’assurer que les signaux à basse fréquence ne sont pas aliasés. - Utilisez un ordinateur d’affichage, qui est connecté à l’ordinateur EEG et à l’ordinateur de suivi oculaire hôte via des ports parallèles et Ethernet et qui dispose d’une plate-forme pour exécuter des expériences comportementales installées sur celui-ci, pour projeter les stimuli sur un moniteur étendu avec une résolution minimale de 1 920 pixels x 1 080 pixels et un taux de rafraîchissement de 60 Hz. Placez ce moniteur à environ 82 cm du sujet.
REMARQUE : Nous avons utilisé un moniteur de 24 pouces avec un taux de rafraîchissement réglé à 144 Hz situé à 82 cm du participant. Il est recommandé d’utiliser un moniteur avec une taille d’écran d’au moins 19 pouces pour les expériences cognitives impliquant l’enregistrement de l’EEG et des mouvements oculaires. De plus, il est généralement recommandé de placer le moniteur à une distance qui permet au participant d’effectuer confortablement la tâche et de maintenir un regard stable sur l’écran tout en permettant des enregistrements précis de l’EEG et des mouvements oculaires. Il est conseillé de tester et d’ajuster la configuration si nécessaire pour garantir les meilleurs résultats. - Utilisez un système de suivi oculaire pour donner aux participants un retour en temps réel sur leurs mouvements oculaires pendant les périodes d’exécution, et enregistrez la taille de la pupille. Réglez la fréquence d’échantillonnage à 1 000 Hz pour une résolution temporelle adéquate.
- Évitez les mouvements de la tête. Des restrictions de mouvement de la tête à gauche et à droite et de haut en bas sont nécessaires pour garder l’œil dans le champ de vision de la caméra vidéo. Une restriction des mouvements vers l’avant et vers l’arrière est nécessaire pour maintenir l’œil dans la plage focale de la caméra vidéo. Utilisez une combinaison de repose-front/menton pour maintenir les mouvements dans cette plage.
- Évaluez la luminance des stimuli à l’aide d’un luxmètre numérique ou d’un appareil similaire pour comparer les différences entre les stimuli de planification et les stimuli de contrôle.
REMARQUE : Un test statistique tel qu’un test t ou Wilcoxon peut être utilisé pour évaluer les différences entre les stimuli des deux conditions. - Utilisez un joystick ou un clavier de contrôle avec au moins quatre boutons : deux boutons pour les questions Oui/Non à partir de la condition de contrôle ; l’un de ces deux boutons pour terminer les épreuves ; et deux autres boutons pour la période de réponse de la condition de planification pour avancer ou reculer afin d’insérer les animaux dans chacun des quatre cercles en bas de l’écran.
5. Séances d’enregistrement d’électroencéphalographie et d’oculométrie
- Avant de commencer l’étude, demandez aux participants de remplir un consentement éclairé écrit et signé.
- Avant la séance d’enregistrement, demandez aux participants de ne pas se présenter en se maquillant (le mascara et l’eye-liner peuvent être détectés comme une pupille par le système de suivi oculaire), après avoir pris des drogues ou de la caféine107,108, ou s’ils ressentent une fatigue sévère109 (stress, privation de sommeil, etc.).
- Demandez aux participants de répondre à une enquête démographique pour fournir des informations sur leur sexe, leur âge, leur gauche, leur langue maternelle et leurs antécédents neuropsychiatriques au moyen de l’entretien neuropsychiatriqueMINI-International 97 réalisé par un psychologue qualifié.
- Nettoyez le front, le cuir chevelu, les mastoïdes et la position de la peau de l’électrooculogramme (EOG) du sujet avec une lingette imbibée d’alcool.
- Placez toutes les électrodes externes sur le participant. Placez l’EOG horizontal bipolairement sur la partie externe des deux yeux et l’EOG vertical au-dessus et en dessous de l’œil droit du participant. Mettez deux électrodes externes sur la mastoïde droite et gauche pour un reréférencement ultérieur.
- Mesurez la tête du sujet et placez le capuchon EEG de la bonne taille selon le système international étendu 10-20. Pour ce faire, trouvez et placez l’électrode Cz en suivant ces étapes :
- Identifiez la ligne médiane du cuir chevelu en inspectant visuellement la racine des cheveux et le haut du nez. Identifiez une ligne reliant ces deux points pour définir la ligne médiane.
- Localisez le Cz. Le Cz est généralement défini comme le point médian entre les deux points préauriculaires (c’est-à-dire les points situés juste devant chaque oreille). Localisez ces points, puis identifiez une ligne qui les relie pour identifier l’emplacement approximatif de la Cz.
- Mesurez et marquez le Cz. Mesurez la distance entre la nasion (c’est-à-dire la protubérance osseuse au sommet du nez) et le Cz. La distance entre la nasion et la Cz est généralement d’environ 53 % de la circonférence totale de la tête dans le système 10-20. Marquez l’emplacement du Cz à l’aide d’un stylo ou d’un autre outil de marquage.
REMARQUE : Il est important de suivre une procédure cohérente et standardisée pour le placement des électrodes afin de minimiser les erreurs et d’assurer la validité des données EEG. Il est recommandé d’élaborer une procédure de placement standard. Créez une procédure standard pour placer les électrodes sur le cuir chevelu de chaque sujet et assurez-vous que la même procédure est utilisée pour chaque sujet. Dans le cas où une équipe ou du personnel effectue les enregistrements, formez les techniciens ou les assistants de recherche sur la procédure de placement appropriée pour s’assurer qu’ils placent les électrodes de manière cohérente et précise. De plus, la numérisation des positions des électrodes pour chaque sujet serait une approche souhaitable afin d’effectuer une analyse de source plus tard. Dans les études EEG, l’emplacement précis en trois dimensions (3D) de chaque électrode sur la tête du sujet est souvent une exigence pour établir une corrélation entre les données EEG et l’activité cérébralecorrespondante 110. Ces informations sont également essentielles pour l’alignement correct des données EEG avec les images anatomiques dérivées des techniques d’imagerie IRM ou CT111,112.
- Insérez du gel conducteur dans chaque trou du capuchon à l’aide d’une seringue avec une aiguille émoussée, en éloignant les cheveux du participant avec la pointe. Ensuite, placez toutes les électrodes du cuir chevelu sur le capuchon EEG.
- Vérifiez les impédances à l’aide du logiciel d’enregistrement EEG et assurez-vous qu’elles sont inférieures au niveau de résistance recommandé par le système EEG.
- Demandez au participant de rester aussi immobile que possible pendant l’expérience. Inspectez le signal EEG et testez-le en demandant au participant de cligner des yeux, de faire une mâchoire et de rester quelques secondes les yeux fermés.
- Asseyez le participant dans une pièce sombre et insonorisée. Utilisez une mentonnière pour stabiliser sa tête et minimiser les mouvements, et vérifiez qu’il y a une distance d’environ 82 cm entre la mentonnière et le centre de l’écran de présentation du stimulus.
- Placez un joystick ou un clavier devant le participant pour les réponses.
- Instructions: Donnez des instructions orales à l’aide d’aides visuelles avant de commencer chaque condition (planification et contrôle). Dans les instructions, incluez des exemples visuels des stimuli et expliquez comment résoudre les labyrinthes dans les conditions de planification et de contrôle, respectivement.
- Pour la tâche de planification, demandez aux sujets de trouver un chemin pour compléter une séquence de visites à certains endroits d’animaux (quatre emplacements dans cette étude) à différents endroits du labyrinthe dans n’importe quel ordre et en suivant un ensemble de règles : « (1) Planifiez le chemin le plus rapidement possible dans un maximum de 10 s ; (2) Partez de la porte et terminez le chemin au quatrième animal visité ; (3) Ne passez pas deux fois par le même chemin ou le même coin ; (4) Ne traversez pas une impasse ; (5) Ne pas croiser un chemin perpendiculairement »54.
REMARQUE : Pour les règles 2 à 5, nous vous recommandons de montrer des exemples visuels au participant. - Ensuite, commencez la session d’entraînement aux tâches de planification de six essais.
REMARQUE : Demandez aux participants de signaler avant chaque période d’étalonnage de l’eye-tracker s’il y a eu un problème lors de l’exécution de la tâche, en particulier lors de la délimitation du chemin pendant la période d’exécution. Notez s’il y a eu un essai pour vérifier hors ligne/post-traitement (voir étape 6.1.1). - Pour la condition de contrôle, demandez aux sujets d’évaluer si le chemin déjà balisé sur le labyrinthe a été fait correctement ou incorrectement compte tenu des règles précédemment apprises.
REMARQUE : Donnez des exemples avec support visuel de la façon d’évaluer les labyrinthes sans utiliser de stratégies de planification, comme ne pas essayer de planifier un nouveau chemin lorsque des erreurs sont détectées (comme des dessins utilisant deux fois le même chemin, traversant une impasse, etc.). Lorsqu’une erreur est détectée, l’accent doit être mis uniquement sur le signalement de la détection de l’erreur plutôt que sur la correction du chemin. Après chaque essai, demandez aux participants quelles sont les stratégies qu’ils ont mises en œuvre. Ensuite, donnez un retour oral sur leur performance pour vous assurer qu’ils ont évalué les chemins tracés et évité de planifier de nouveaux chemins. Ensuite, commencez la session d’entraînement aux tâches de contrôle de six essais.
- Pour la tâche de planification, demandez aux sujets de trouver un chemin pour compléter une séquence de visites à certains endroits d’animaux (quatre emplacements dans cette étude) à différents endroits du labyrinthe dans n’importe quel ordre et en suivant un ensemble de règles : « (1) Planifiez le chemin le plus rapidement possible dans un maximum de 10 s ; (2) Partez de la porte et terminez le chemin au quatrième animal visité ; (3) Ne passez pas deux fois par le même chemin ou le même coin ; (4) Ne traversez pas une impasse ; (5) Ne pas croiser un chemin perpendiculairement »54.
- Vérifiez le signal EEG pour vous assurer que tous les canaux sont correctement acquis. Démarrez l’enregistrement EEG.
- Calibrez l’eye tracker.
REMARQUE : Vérifiez la capacité de l’oculomètre à déterminer la position du regard lorsque le participant dirige son regard vers différentes régions de l’écran.- Informez le participant que l’eye tracker sera calibré et qu’il va voir un cercle blanc (avec un petit point gris) se déplacer de manière aléatoire vers les quatre coins de l’écran (procédure de calibrage en cinq points). Demandez-leur de fixer leur regard sur le cercle et informez-les que, lorsqu’il se déplace vers un autre endroit, ils doivent suivre la position du cercle et fixer à nouveau leur regard dans cette nouvelle position.
- Lancez l’expérience, commencez à enregistrer les mouvements oculaires en cliquant sur Output/Record, et demandez au participant de suivre les instructions précédemment données, en l’informant que l’expérience va maintenant commencer.
- Gardez la salle de laboratoire dans un environnement sombre. Les changements les plus importants dans la dilatation de la pupille se produisent en réponse aux changements de luminance113. Maintenez un niveau de lumière constant dans l’environnement expérimental.
6. Analyses de données
- Analyses comportementales
- Analyser les données comportementales à l’aide d’un logiciel statistique (voir Table des matériaux). Mesurer la précision (pourcentage de réponses précises) en tant que paramètre comportemental quantitatif dans les conditions de planification et de contrôle. Pour la condition de planification, utilisez les données de l’eye-tracker (coordonnées x et y de la position du regard) pour recréer les chemins empruntés pendant la période d’exécution hors ligne et déterminer la précision des chemins planifiés par rapport aux chemins tracés réels (Figure 4). Pour ce faire, vérifiez manuellement la congruence entre les combinaisons correctes/incorrectes effectuées dans la période de réponse et le tracé effectué.
- Calculez le RT, c’est-à-dire le temps moyen passé à résoudre les labyrinthes pour la période de planification et le temps moyen passé à évaluer les chemins marqués pour la période de contrôle.
- Calculez le RT moyen des périodes d’exécution pour les conditions de planification et de contrôle. Plus précisément, utilisez le RT correspondant uniquement aux essais appropriés.
REMARQUE : En complément, il est possible d’utiliser le score de vitesse-précision linéaire intégré (LISAS)114,115 décrit dans Domic-Siede et al.54, qui fournit une mesure combinée qui tient compte du temps de réaction et de la précision. Étant donné que le temps de réaction pendant la période d’exécution de la planification et la précision de la planification sont interdépendants, le LISAS peut être utilisé pour calculer un indice qui tient compte du temps de réaction corrigé du nombre d’erreurs commises. De plus, l’indice LISAS peut être utilisé pour évaluer la corrélation entre les signaux électrophysiologiques et les performances comportementales. Il est calculé comme une combinaison linéaire du temps de réaction (RT) et de la proportion d’erreur (PE). - Évaluez l’homoscédasticité à l’aide d’un test statistique tel que le test de Levene116,117, et testez la normalité à l’aide du test de distribution de normalité omnibus de D’Agostino et Pearson118 ou du test de Shapiro Wilk119 pour choisir le test statistique approprié pour les comparaisons (paramétrique ou non paramétrique).
- Évaluez si la composante de planification de la condition de planification est plus exigeante sur le plan cognitif que la condition de contrôle à l’aide du test de rang signé de Wilcoxon120 ou du test t de paire appariée121 pour comparer les paramètres de comportement entre les conditions.
REMARQUE : De cette façon, validez que le paradigme comportemental est optimal pour évaluer la planification cognitive. - Séparez les essais dans la condition de planification en catégories « facile » et « difficile » (reportez-vous à l’étape 2.2), puis utilisez un test t par paires appariées pour comparer la précision et les temps de réaction dans les périodes de planification et d’exécution entre les essais « facile » et « difficile ».
- Prétraitement de l’EEG et des mouvements oculaires
- Effectuez le pipeline de prétraitement des données EEG expliqué dans les points suivants à l’aide de scripts faits maison et/ou de boîtes à outils établies, telles que celles décrites dans Delorme et Makeig122, dans Dimigen et al.123, et dans Mognon et al.124, dans un logiciel de langage de programmation (voir Tableau des matériaux).
- Synchronisez l’activité des mouvements oculaires avec les enregistrements EEG pour importer les fixations, les saccades et les événements de clignement des yeux pour une meilleure inspection visuelle ou des analyses plus approfondies (voir l’étape 3.1.2 et le fichier supplémentaire).
REMARQUE : Dans cette étude, nous avons utilisé les horodatages sur les données de suivi oculaire et les horodatages sur les données EEG tels que décrits dans Domic-Siede et al.54 et dans Dimigen et al.123 pour importer les événements de mouvement oculaire dans les données EEG dans un logiciel de langage de programmation. - Sous-échantillonnez les données à 1 024 Hz si elles ont été enregistrées à 2 028 Hz afin de réduire les exigences de calcul.
REMARQUE : Une fréquence d’échantillonnage de 1 024 Hz est suffisante en fonction de la gamme de fréquences d’intérêt de 4 à 8 Hz, de la résolution de fréquence attendue et des exigences de calcul de l’analyse. - Référencez le signal EEG à la moyenne des électrodes sur les mastoïdes.
REMARQUE : D’autres références sont possibles. Le choix de la référence peut avoir un impact sur les résultats de l’analyse EEG et l’interprétation des données, il est donc important d’examiner attentivement les avantages et les inconvénients des différentes options de référencement. La référence mastoïdienne moyenne est un choix populaire pour les études EEG car elle fournit une référence stable et facile à calculer, et elle s’est avérée efficace pour analyser de nombreux signaux EEG différents. La référence des données EEG à la moyenne des mastoïdes (connue sous le nom de référence mastoïdienne moyenne) est une approche courante pour analyser l’activité thêta frontale dans les données EEG du cuir chevelu. Les électrodes mastoïdiennes sont situées près de l’oreille et servent de référence pour les signaux EEG. Le référencement à la moyenne des mastoïdes peut aider à réduire l’influence du bruit et des artefacts qui ne sont pas d’intérêt tout en évitant d’annuler le signal d’intérêt, ce qui aide l’utilisateur à obtenir une représentation plus claire des signaux EEG. - Appliquez une réponse impulsionnelle finie (FIR) de phase zéro avec une fréquence de coupure passe-haut de 1 Hz et une fréquence de coupure passe-bas de 40 Hz sur le signal étendu (sans époque) à l’aide d’un logiciel de langage de programmation.
REMARQUE : Dans cette étude, nous avons utilisé la boîte à outils décrite dans Delorme et Makeig122. - Pour chaque condition, en tenant compte du nombre d’essais, divisez les données en périodes centrées autour du début des périodes de planification et de contrôle, respectivement. Utilisez les 1 s avant le début de la présentation du labyrinthe comme référence et les 4 s après la période de planification ou de contrôle comme segments d’intérêt. Utilisez un logiciel de langage de programmation.
REMARQUE : Dans cette étude, nous avons utilisé la boîte à outils décrite dans Delorme et Makeig122et 36 époques/essais. - Créez une deuxième segmentation centrée autour de la fin des périodes de planification et de contrôle en utilisant 4 s avant la fin et 1 s après comme période de maintenance.
REMARQUE : La raison de la sélection du premier et des 4 derniers s des périodes de planification et de contrôle (étape 6.2.6 et étape 6.2.7) est que la durée de chaque période dans les deux conditions peut varier, et que l’analyse de la première et de la dernière seconde de la planification peut fournir une vue plus complète du processus de planification. Ainsi, ces longueurs de fenêtre sont adéquates et suffisantes pour analyser la dynamique oscillatoire sous-jacente à la planification. - Sur le signal segmenté, exécutez l’algorithme d’analyse des composants indépendants (ICA) Logistic Infomax125pour identifier et supprimer les composants artificiels.
- Utilisez le critère du rapport de variance saccade-fixation recommandé dans Plöchl et al.126pour détecter automatiquement les composants bruyants potentiels, et utilisez le détecteur automatique d’artefacts EEG basé sur l’utilisation conjointe des caractéristiques spatiales et temporelles recommandée dans Mognon et al.124.
REMARQUE : Nous recommandons l’utilisation du classificateur de composants indépendants proposé dans Pion-Tonachini et al.127, qui estime les classifications de composants indépendants en tant que vecteurs de composition dans sept catégories, aidant ainsi à identifier les artefacts. - Inspectez d’autres composants artificiels potentiels tels que l’EMG, le mouvement des électrodes ou des composants non liés au cerveau. Validez le rejet de ces composants en inspectant visuellement les topographies, les spectres et les activations au fil du temps.
- Interpoler (interpolation sphérique) les canaux bruyants par rejet automatique des canaux à l’aide du critère d’aplatissement (avec un score z de 5 comme seuil).
- Analyses temps-fréquence
- Effectuez une transformée de Fourier rapide (FFT) de courte durée (1 Hz à 40 Hz) en utilisant une longueur de fenêtre de 250 ms et un pas de temps de 5 ms. Utilisez une fenêtre Hanning. Utilisez le score z pour normaliser les graphiques temps-fréquence par rapport à la ligne de base (−1 s à −0,1 s).
REMARQUE : La visualisation du spectre est soumise à un compromis entre la taille de la fenêtre et la résolution temporelle. Pour obtenir une vue complète de l’ensemble du spectre, y compris la gamme thêta de 4 Hz à 8 Hz, nous vous recommandons d’utiliser la limite inférieure de la taille de la fenêtre, qui est de 250 ms, afin d’assurer une résolution temporelle plus élevée lors de chaque essai et tâche. De plus, nous vous recommandons d’utiliser une fenêtre Hanning, car elle est largement considérée comme un choix conventionnel dans ces cas. Pour une meilleure résolution en termes de temps et de fréquence, voir les étapes suivantes. - Sélectionnez un graphique temps-fréquence à partir d’une électrode frontocentrale, telle que la Fz, ou d’un groupe moyenné d’électrodes frontales.
REMARQUE : Considérez les nombreuses preuves concernant l’association entre le contrôle cognitif et le thêta médian frontal 12,128,129. - Sélectionnez des tableaux temps-fréquence de contrôle non frontal à partir d’électrodes telles que les électrodes Pz et Oz pour approfondir les comparaisons.
- Pour les électrodes frontales et de contrôle, effectuez un test de permutation non paramétrique basé sur des grappes pour des échantillons appariés, avec une valeur p < 0,05 pour les comparaisons au niveau du groupe des courbes temps-fréquence des deux conditions. Utilisez la méthode de Monte Carlo avec 1 000 tirages au sort. Utilisez la valeur statistique maximale du cluster pour effectuer le test de permutation130.
- Faites la moyenne de la bande de fréquences thêta (4-8 Hz) à partir des 4 premières secondes de planification et de contrôle, respectivement, et du segment des 4 dernières secondes également.
- Comparez l’activité thêta moyenne entre les conditions à l’aide d’un test t par paires appariées ou d’un test de rang signé de Wilcoxon.
- Analysez le profil temporel de l’activité thêta. Pour ce faire, faites la moyenne de la gamme de fréquences de 4 à 8 Hz dans les essais par sujet.
- Comparez la dynamique de l’activité thêta entre les conditions à l’aide d’un test de Wilcoxon à rang signé, apparié et corrigé avec le taux de fausses découvertes (FDR).
REMARQUE : Nous avons utilisé des pas de 88 ms de fenêtres non superposées dans le test de Wilcoxon.
- Effectuez une transformée de Fourier rapide (FFT) de courte durée (1 Hz à 40 Hz) en utilisant une longueur de fenêtre de 250 ms et un pas de temps de 5 ms. Utilisez une fenêtre Hanning. Utilisez le score z pour normaliser les graphiques temps-fréquence par rapport à la ligne de base (−1 s à −0,1 s).
- Reconstruction de la source
- Utilisez une boîte à outils pour la reconstruction de l’analyse de source, telle que la boîte à outils en libre accès décrite dans Tadel et al.131 ou une autre similaire.
- Calculez les sources du signal EEG prétraité à partir des 4 premières secondes de planification à l’aide d’un algorithme tel que la tomographie électromagnétique cérébrale standardisée à basse résolution (sLORETA)132et la méthode d’imagerie de norme minimale, ainsi que la méthode des éléments de frontière symétriques (BEM symétrique), à l’aide d’une boîte à outils telle que celle décrite dans Gramfort et al.133pour résoudre le problème inverse.
- Utilisez l’algorithme source (algorithme sLORETA dans cette étude) sur un modèle MNI anatomique (nous avons utilisé le modèle MNI dans Brainstorm « Colin27 ») avec les emplacements d’électrodes par défaut pour chaque participant au cas où il n’y aurait pas de numérisation 3D des électrodes (voir étape 5.6).
REMARQUE : Il convient de noter que l’utilisation des emplacements d’électrodes par défaut n’est pas la méthode la plus efficace pour déterminer les sources d’activité cérébrale. Cependant, il peut tout de même fournir une compréhension générale de l’origine de l’activité. Il est important de garder à l’esprit que les sources de localisation obtenues par ces méthodes sont des approximations grossières et doivent être interprétées avec prudence lors de l’analyse des résultats. - Appliquez un filtre passe-bande 4-8 Hz sur le signal prétraité.
- Appliquez une normalisation du score z en utilisant la période de -1 000 ms à -10 ms avant le début de l’essai comme référence.
- Faites la moyenne de l’activité thêta en utilisant une fenêtre de temps d’intérêt entre 1 s et 4 s après le début de l’essai.
- Comparez les sources spatiales moyennes entre les conditions à l’aide d’un test de signe de permutation non paramétrique avec échantillonnage de Monte Carlo (1 000 randomisations)131.
- Afin de déterminer les régions d’intérêt (ROI), étiquetez le cortex à l’aide d’un atlas cérébral.
NOTE : Nous avons utilisé l’Atlas Destrieux134 implémenté dans la boîte à outils décrite dans Tadel et al.131. - Sélectionnez les régions cérébrales d’intérêt (ROI).
REMARQUE : Nous avons examiné les preuves indiquant que les régions du cortex préfrontal, telles que le gyri frontal supérieur bilatéral (SF), le gyri et les sillons frontopolaires transverses bilatéraux (FP), l’ACC bilatéral, le MCC bilatéral et le cortex préfrontal dorsolatéral bilatéral137,138, sont impliquées dans les fonctions de contrôle cognitif135,136. - Effectuez une analyse en composantes principales (ACP) sur le signal EEG prétraité précédent (plage de 1 à 40 Hz) pour chaque retour sur investissement, et utilisez le premier mode de décomposition du module PCA pour chaque point d’intérêt.
- Effectuez une analyse spectrale à l’aide d’une transformée de Fourier rapide à court terme et comparez les résultats entre les régions d’intérêt gauche et droite à l’aide d’un test de permutation non paramétrique basé sur des grappes130.
- Extraire et représenter les retours d’investissement de gauche et de droite ne montrant aucune différence sous la forme d’une seule série chronologique bilatérale : SF, ACC et MCC. Ensuite, tracez des graphiques temps-fréquence et comparez les conditions.
- Comparez les graphiques temps-fréquence en fonction du niveau de complexité de la tâche de planification (essais faciles ou difficiles) pour chaque retour sur investissement.
- Mettez en miroir le bord du signal pour chacun des 512 échantillons et effectuez un filtre passe-bande entre 4 Hz et 8 Hz pour les ROI sélectionnés.
- Appliquer une transformée de Hilbert pour obtenir l’amplitude instantanée139à l’aide d’une boîte à outils de traitement du signal d’un logiciel de langage de programmation (voir Tableau des matériaux).
- Corrigez le signal à l’aide de la normalisation du score z (-1 000 à -10 ms comme référence) et faites la moyenne des essais par sujet.
- Comparez chaque profil temporel de bande thêta ROI entre les conditions à l’aide du test de rang signé de Wilcoxon (paires appariées, 1 s de fenêtres non chevauchantes) et corrigez avec le FDR.
- Corrélations entre l’activité EEG et les performances comportementales
- Normalisez la série chronologique source des ROI par rapport à la ligne de base à l’aide du score z. Sélectionnez une fenêtre de 1 s à 4 s après le début de la planification ou du contrôle (où l’on observe une activité thêta proéminente dans les cartes temps-fréquence).
- Pour déterminer l’augmentation de l’activité thêta dans la condition de planification par rapport à la condition de contrôle, transformez d’abord le signal dans le domaine fréquentiel (1-40 Hz) en utilisant la méthode multitaper à l’aide d’une boîte à outils telle que la boîte à outils Chronux140 pour chaque condition et source dans les régions d’intérêt.
- Calculez la fréquence moyenne de la bande thêta (4-8 Hz) et calculez deux mesures de la puissance thêta : i) la différence entre la puissance thêta pendant la période de planification (θ planification) et la période de contrôle (θ contrôle), notée Δ thêta, et ii) l’augmentation relative de l’activité thêta, exprimée par le rapport entre Δ thêta (Δ θ) et l’activité thêta pendant la période de contrôle (θ contrôle), comme dans Domic-Siede et al.54 :
 (1)
(1)

- Calculez deux paramètres comportementaux : iii) Δ la planification LISAS, en soustrayant le contrôle LISAS de la planification LISAS, et iv) Δ l’exécution de la planification LISAS, en soustrayant l’exécution du contrôle LISAS de l’exécution de la planification LISAS, comme dans Domic-Siede et al.54 :


- Effectuer les corrélations rho de Spearman à l’aide des paramètres électrophysiologiques et comportementaux calculés, puis corriger par le FDR.
- Analyse des mouvements oculaires : Pour contrôler les différences de potentiel dans les mouvements oculaires pour chaque condition qui peut entraîner une dynamique oscillatoire différente, effectuez l’analyse suivante :
- Déterminez l’amplitude de la saccade et la vitesse de crête de la saccade sur l’ensemble de l’essai et de 0 s à 3,75 s dans les conditions de planification et de contrôle.
- Comparez les résultats à l’aide du test de rang signé de Wilcoxon ou du test t de paire appariée, selon le cas.
REMARQUE : Une boîte à outils telle que celle décrite dans Dimigen et al.123peut être utile. - Calculez et évaluez la cohérence entre la puissance de l’EEG de Fourier à une électrode frontale (par exemple, le Fz ou une électrode ROI frontale moyenne) et la fréquence de saccade décrite dans Sato et Yamaguchi141.
- Utilisez le test de Wilcoxon pour comparer les valeurs de cohérence puissance-vitesse de saccade des 4 premières secondes de chaque essai entre les deux conditions.
Résultats
Dans le protocole actuel, les RT de la période de planification ont été comparés aux RT de la période de contrôle et de la période d’exécution de la planification. De plus, par rapport à la condition de contrôle, les participants ont commis plus d’erreurs et ont eu une précision moindre pendant la période de planification (Figure 5).

Figure 5 : Temps de réaction et précision de la tâche de planification. Comparaison entre les temps de réaction (A) au cours de la période de planification (cercles violets) et de la période de contrôle (cercles verts) à l’aide d’un test t apparié. (B) Comparaison entre les temps de réaction au cours de la période de planification (cercles violets) et de la période d’exécution de la planification (carrés violets) à l’aide d’un test t apparié. (C) Comparaison du taux de précision dans la condition de planification (losanges violets) et la condition de contrôle (losanges verts) à l’aide d’un test de rang signé Wilcoxon. Cette figure a été modifiée à partir de Domic-Siede et al.54. Veuillez cliquer ici pour voir une version agrandie de cette figure.
De plus, l’analyse des niveaux de complexité de la planification a montré des différences significatives en termes de précision et de temps de réaction (RT) entre les niveaux « difficile » et « facile » pendant la planification et l’exécution (Figure 6). Le niveau « difficile » avait des RT plus longs et une précision plus faible. Ces résultats suggèrent que le fait de diviser les essais en fonction du nombre de solutions valides permet de distinguer les essais « faciles » des essais « difficiles ».

Figure 6 : Comparaison des performances comportementales aux différents niveaux de complexité. Des différences significatives dans les performances comportementales aux niveaux de complexité « facile » et « difficile » ont été identifiées à l’aide d’un test t par paires appariées. Des temps de réaction (RT) plus faibles ont été observés lors de la planification et de l’exécution pour le niveau « facile » par rapport au niveau « difficile », et la précision était plus élevée pour le niveau « facile ». Les barres d’erreur représentent le SEM (erreur type de la moyenne). Cette figure a été modifiée à partir de Domic-Siede et al.54. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ces résultats ont indiqué que lorsque la composante de planification était retirée avec succès de la condition de contrôle (via la manipulation des instructions), la tâche de planification était cognitivement plus complexe, exigeante, stimulante et chronophage. Par conséquent, les corrélats neuronaux induits par les tâches ont pu être comparés les uns aux autres.
Pour analyser l’activité thêta frontale médiane pendant la planification, la bande de fréquence thêta moyenne pendant la planification de l’électrode Fz a été comparée à celle de la période de contrôle, et une augmentation significative de la fréquence de la bande thêta a été observée pendant la planification (Figure 7).

Figure 7 : Activité thêta frontale médiane pendant la planification cognitive. (A) Cartes topographiques représentant la puissance de la bande thêta chez tous les sujets normalisés aux scores z pendant la tâche de planification (à gauche), la tâche de contrôle (au milieu) et l’effet de planification (à droite). Au cours de la planification cognitive, les sujets ont montré une augmentation de l’activité thêta frontale médiane. La barre de couleur indique les valeurs z comprises entre -0,5 et 1,5. (B) Un graphique en violon montrant les valeurs minimales, quartiles, médiane et maximale du score z de l’activité thêta chez les sujets pendant la planification (violet) par rapport à la période de contrôle (vert) pour les électrodes Fz (à gauche), Pz (au milieu) et Oz (à droite) à l’aide d’un test t à paires appariées. Cette figure a été modifiée à partir de Domic-Siede et al.54. Veuillez cliquer ici pour voir une version agrandie de cette figure.
De plus, pour évaluer la dynamique temporelle de l’activité thêta frontale observée, des cartes topographiques correspondant à des points temporels spécifiques de la puissance de la bande thêta (750 ms, 1 750 ms, 2 750 ms et 3 750 ms) ont été formulées (Figure 8A). De plus, par rapport à la période de contrôle, l’analyse temps-fréquence a démontré une augmentation significative, progressive et soutenue de l’activité thêta commençant 1 s après le début de la période de planification (figure 8B).

Figure 8 : Dynamique temporelle thêta frontale médiane. (A) Tranches de temps topographiques de l’activité thêta. Une augmentation progressive de l’activité thêta de la ligne médiane frontale au fil du temps au cours de la mise en œuvre de la planification (période de planification) a été observée. La barre de couleur indique les unités du score z (-0,5 à 2,2). (B) Graphiques temps-fréquence pour la période de planification (en haut), la période de contrôle (au milieu) et l’effet de la planification, calculés en soustrayant la période de contrôle de la période de planification (en bas). Les pixels non significatifs, tels que déterminés à l’aide d’un test de permutation non paramétrique basé sur des grappes pour des échantillons appariés, sont affichés plus clairs dans le graphique de l’effet de planification. La barre de couleur indique les unités du score z (−4 à 4). Cette figure a été modifiée à partir de Domic-Siede et al.54. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour la reconstruction de la source de l’activité thêta, un modèle de modèle cérébral a été visualisé et comparé entre les conditions, ce qui a indiqué que l’activité thêta provenait des zones du cortex préfrontal (cortex frontal supérieur, FS ; cortex cingulaire antérieur, ACC ; et cortex cingulaire moyen, MCC), ainsi que des différences significatives entre les conditions (dans le SF bilatéral, l’ACC bilatéral et le MCC bilatéral) (figure 9), avec une activité thêta plus élevée observée au cours de la période de planification (figure 9).

Figure 9 : Reconstitution des sources. Un algorithme sLORETA a été utilisé pour estimer l’activité thêta de différentes sources cérébrales. L’activité thêta était filtrée de 4 à 8 Hz, normalisée par le score z, corrigée par la ligne de base, moyennée entre 1 s et 4 s après le début de la planification ou du contrôle, respectivement, et comparée entre les conditions. Une augmentation significative de l’activité thêta a été observée dans la zone frontale supérieure bilatérale, le cortex cingulaire antérieur bilatéral et le cortex cingulaire moyen bilatéral. La figure montre les valeurs t significatives du test de permutation. Abréviations : FS = frontal supérieur ; ACC = cortex cingulaire antérieur ; MCC = cortex cingulaire moyen. Cette figure a été modifiée à partir de Domic-Siede et al.54. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ensuite, le profil temporel des changements thêta au fil du temps pour chaque source a été évalué en calculant une transformée de Hilbert, puis nous avons comparé l’amplitude instantanée de l’activité thêta entre les conditions. Nous avons constaté que les sources frontopolaires gauches, ACC bilatérales et MCC bilatérales présentaient une activité thêta plus élevée après le début de la période de planification (Figure 10). Ces résultats suggèrent que notre paradigme expérimental exigeant une planification cognitive induit une activité thêta provenant des régions PFC.

Figure 10 : Profil temporel de l’activité thêta des sources de PFC. L’amplitude instantanée calculée avec la transformée de Hilbert a été appliquée à la première composante de la décomposition de l’ACP pour chaque source frontale et les deux conditions et la ligne de base ont été normalisées au score z pour montrer l’activité thêta frontale au fil du temps. Les zones ombrées en gris montrent des différences significatives déterminées à l’aide d’une fenêtre mobile non chevauchante avec des pas de 1 s (test de Wilcoxon signed-rank) corrigée par le RAD. Les régions ombrées représentent des intervalles de confiance à 95 %. La région PF gauche, l’ACC bilatéral et le MCC bilatéral ont montré une augmentation de l’activité thêta après le début de la planification. Abréviations : ACC = cortex cingulaire antérieur ; MCC = cortex cingulaire moyen. La condition de planification est indiquée en violet. La condition de contrôle est indiquée en rouge. Cette figure a été modifiée à partir de Domic-Siede et al.54. Veuillez cliquer ici pour voir une version agrandie de cette figure.
De plus, nous avons cherché à examiner la variation des caractéristiques spectrales au cours de la planification en ce qui concerne le niveau de complexité, comme l’indiquent les résultats comportementaux. Il convient de noter qu’un écart significatif n’a été constaté que dans l’ACC gauche à l’intérieur de la bande alpha. Cela soutient l’idée que notre tâche de planification évalue les facettes intrinsèques de la planification à travers des changements dans les oscillations thêta dans une plus grande mesure que les exigences cognitives générales (effort) généralement rencontrées dans les tâches de contrôle cognitif (Figure 11).

Figure 11 : EEG à travers les niveaux de complexité de la planification. Les graphiques temps-fréquence du retour sur investissement ont montré un cluster positif significatif dans la bande alpha exclusivement dans le cortex cingulaire antérieur gauche (ACC) pour le niveau « difficile ». Les pixels non significatifs, tels que déterminés à l’aide d’un test de permutation non paramétrique basé sur des grappes pour les échantillons appariés, sont représentés dans une teinte plus claire sur le graphique, la barre de couleur indiquant les unités de score z de −3 à 3. Cette figure a été modifiée à partir de Domic-Siede et al.54. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Lorsque des corrélations entre l’activité thêta et la performance comportementale ont été effectuées, une corrélation négative a été observée ; plus précisément, à mesure que l’activité thêta dans la région frontopolaire gauche au cours de la période de planification augmentait, le score d’exécution de la planification LISAS diminuait (figure 12). Ce modèle peut refléter que la région gauche de la PF peut être nécessaire lors de l’élaboration de la planification pour exécuter un plan avec succès par la suite et suggère un rôle pour l’activité thêta.

Figure 12 : Activité thêta et performances comportementales. La corrélation rho de Spearman entre l’activité thêta du cortex frontopolaire gauche et l’exécution de la planification Δ LISAS a montré une corrélation négative significative. Cette figure a été modifiée à partir de Domic-Siede et al.54. Veuillez cliquer ici pour voir une version agrandie de cette figure.
De plus, les exigences et les objectifs cognitifs variables induits par chaque condition peuvent avoir provoqué des mouvements oculaires contrastés entre les conditions de planification et de contrôle, conduisant à des modèles d’activité oscillatoire différents95. Pour résoudre le problème ci-dessus, nous avons analysé les données d’un seul sujet et d’un seul essai à différents niveaux. Notamment, la série temporelle du canal Fz et la dynamique temporelle de l’activité thêta semblaient n’avoir aucun lien avec le taux de saccades au cours du temps (Figure 13A).

Figure 13 : Résultats des enregistrements de l’EEG et des mouvements oculaires. (A) Les rangées présentent l’EEG (en haut), le graphique temps-fréquence (au milieu en haut), le profil temporel thêta de l’électrode Fz (au milieu en bas) et le taux de saccade du sujet 8 et de l’essai 9 (en bas) dans la condition de planification. (B) Une comparaison de l’amplitude de la saccade, de la vitesse de crête de la saccade et de la cohérence du taux de puissance de la saccade entre les conditions est présentée, révélant des différences statistiques significatives dans l’amplitude de la saccade entre les conditions de planification et de contrôle. Le SEM est représenté par les barres d’erreur. Cette figure a été modifiée à partir de Domic-Siede et al.54. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ensuite, nous avons obtenu l’amplitude de la saccade et la vitesse de crête de l’ensemble de l’essai et de 0 s à 3,75 s à des fins de comparaison (Figure 13B). Nous avons découvert que l’amplitude de la saccade était plus grande dans la condition de contrôle. Cependant, aucune différence statistiquement significative n’a été observée entre les conditions de l’indice de cohérence entre la puissance thêta de Fourier à l’électrode Fz et la vitesse de saccade (figure 10B), ce qui indique que toute relation potentielle entre les saccades et l’activité thêta était cohérente dans toutes les conditions.
Pris ensemble, ces résultats soutiennent que le protocole expérimental décrit est adapté à l’étude de la planification cognitive en tant que fonction de contrôle cognitif.
Discussion
Le protocole décrit ici propose une approche innovante pour évaluer la planification cognitive et le contrôle cognitif au cours d’une tâche de planification nouvelle et écologique, en association avec des mesures comportementales et physiologiques pertinentes et complémentaires, telles que la dynamique oscillatoire et pupillaire. Au cours de nos expériences, l’activité EEG a été enregistrée pendant que les participants effectuaient la tâche de planification, au cours de laquelle les participants ont été invités à élaborer puis à exécuter un plan. La condition de contrôle, qui impliquait l’évaluation d’un chemin pré-dessiné sur la carte du zoo, a été établie pour éliminer l’aspect de la planification cognitive tout en maintenant un cadre et une structure similaires. Cette approche permet d’évaluer si la planification cognitive, en tant que fonction de contrôle cognitif, conduit à la génération d’une activité thêta frontale à partir de régions PFC et si différentes sources d’oscillation thêta PFC sont liées à différents aspects de la performance de planification. Un autre aspect qui pourrait être évalué à l’aide de ce protocole est la différenciation des différents processus cognitifs impliqués au cours des phases de planification, telles que l’élaboration et l’exécution du plan, la réalisation du plan et le traitement de la rétroaction. Nous avons constaté que la planification induisait une activité thêta frontale canonique associée au contrôle cognitif, ce qui contribuait à l’atteinte efficace d’un objectif. Ces résultats sous-tendent l’intérêt de ce protocole.
Malgré les vastes développements en neurosciences cognitives, la plupart des expériences de neuroimagerie examinent des fonctions cognitives isolées à l’aide de tâches artificielles dans des environnements sensorimoteurs dépourvus et de stimuli simplifiés à l’extrême pour contrôler les facteurs de confusion. De manière problématique, ces expériences pourraient ne pas être en mesure d’identifier les mécanismes cérébraux réels impliqués lorsqu’une fonction cognitive est mise en œuvre dans une situation quotidienne (lors de situations écologiques)138,140. En particulier, les capacités à formuler des objectifs, à planifier et à exécuter efficacement des plans sont difficiles à évaluer puisqu’elles nécessitent diverses fonctions cognitives (mémoire de travail, contrôle inhibiteur, flexibilité cognitive, etc.)104 144. Ainsi, la conception d’une tâche comportementale écologique est encouragée et suggérée sur la base des tendances actuelles en neurosciences cognitives 142,143,145,146.
Notre tâche de planification, bien qu’elle se soit déroulée dans un environnement de laboratoire (à l’intérieur d’une pièce avec les stimuli affichés sur un écran), a été rendue attrayante et interactive pour les participants grâce à l’utilisation de stimuli et d’objectifs significatifs avec lesquels ils pouvaient interagir à l’écran. De plus, la tâche exige que les participants s’engagent dans une situation réelle, en planifiant un chemin pour visiter divers endroits. Pour avoir une conception de tâche écologique, le paradigme doit mettre les sujets au défi d’effectuer un comportement spécifique ou une fonction cognitive d’une manière similaire à ce qu’ils devraient faire dans la vie quotidienne 62,63,147. Pour élaborer une conception de tâches écologiques, la tâche de planification utilisée ici consiste à planifier un parcours pour visiter différents lieux en plusieurs étapes56. La première étape consiste pour les participants à créer un plan tout en s’assurant qu’il suit un ensemble de règles. La deuxième étape consiste à maintenir le plan en mémoire de travail, tandis que la troisième étape consiste à exécuter le plan et à surveiller son respect des règles. Ces étapes représentent différentes phases de la planification et de l’orchestration d’autres fonctions exécutives, telles que la flexibilité cognitive, le contrôle inhibiteur et la mémoire de travail. Afin d’avoir une conception de tâche cognitive écologique valide, la tâche doit être capable de détecter des déficiences cognitives spécifiques chez les patients atteints de troubles psychiatriques ou cognitifs qui ont des difficultés à exécuter cette fonction cognitive spécifique dans leur vie quotidienne105. Cela peut être réalisé par le biais de recherches futures utilisant ce protocole.
Les résultats comportementaux obtenus grâce à l’utilisation de ce protocole ont été alignés avec les prédictions expérimentales. Une différence significative de comportement a été observée lorsque la composante de planification a été retirée de la tâche de contrôle pour former une condition de contrôle, facilitant ainsi d’autres comparaisons. La condition de planification s’est avérée plus exigeante sur le plan cognitif que la condition de contrôle, comme en témoignent des paramètres tels que le temps de réaction et la précision. Cela peut refléter l’implication accrue des fonctions cognitives élevées dans la mise en œuvre de la planification 23,55,56,57,148,149,150.
Étant donné que la condition de contrôle impliquait une cognition moins complexe, comme en témoignent les temps de réaction plus rapides, les meilleures performances et les différents processus cognitifs requis (l’évaluation des règles), une modification alternative possible consiste à exploiter les niveaux de complexité présents dans la tâche de planification, à les manipuler et à analyser la fonction de planification de manière paramétrique en fonction de différents niveaux de complexité (par exemple, l’augmentation du nombre d’essais et la création de conditions d’essai difficiles, moyennes et faciles). Cependant, les résultats de notre protocole ont montré que s’il était possible de distinguer les essais « faciles » et « difficiles » basés sur des mesures comportementales, aucune différence n’a été détectée dans les mesures électrophysiologiques. Cela suggère que les résultats de notre protocole reflètent plus précisément les caractéristiques intrinsèques de la fonction de planification plutôt que des aspects plus larges du contrôle cognitif, tels que l’attention, l’effort mental, le niveau de difficulté ou un niveau élevé d’exigence cognitive54. Néanmoins, des recherches ultérieures pourraient envisager d’autres types de conditions de contrôle, comme suivre un chemin balisé qui visite les quatre emplacements des animaux, mais aussi se souvenir de l’ordre de séquence. De cette façon, le niveau de difficulté pourrait être mieux contrôlé et la planification pourrait être distinguée de la mémoire de travail, mais un inconvénient possible est la fatigue, car les sujets devraient effectuer deux tâches très exigeantes.
Plusieurs études ont lié différents paramètres des mouvements oculaires à des événements cognitifs spécifiques. D’une part, certaines études ont trouvé des corrélations entre les oscillations thêta et le diamètre de la pupille lors de tâches cognitives, suggérant une relation entre ces deux mesures de la fonction cognitive. Par exemple, Lin et al.152 ont trouvé une corrélation entre l’activité thêta médio-frontale et les changements dans la taille de la pupille, reflétant divers degrés de conflit subjectif. Leurs résultats suggèrent que ces signaux représentent le traitement des conflits, une attention accrue et des réponses comportementales flexibles. Par conséquent, la relation entre l’activité thêta médio-frontale et les réponses des pupilles semble jouer un rôle dans la pesée des coûts et des avantages lors des processus de prise de décision. Dans une autre étude, Yu et coll.153 ont examiné comment l’engagement dans le temps consacré à la tâche affecte neurophysiologiquement le contrôle cognitif par le biais d’une tâche de mémoire de travail qui module les réponses inhibitrices de contrôle. Ils ont étudié la relation entre les données de diamètre de la pupille et l’activité thêta frontale et ont montré que plus la durée de la tâche augmentait, plus les performances diminuaient, ce qui s’accompagnait d’une diminution de la modulation de la dilatation de la pupille et de l’activité thêta frontale. Au début de la tâche, ils ont trouvé une forte corrélation entre l’engagement dans la tâche, l’activité thêta et le contrôle cognitif, comme indiqué par la modulation de la dilatation de la pupille, principalement pour les tâches exigeantes qui nécessitaient une mémoire de travail élevée et un contrôle inhibiteur. Cependant, cette relation s’est dissipée vers la fin, signalant une déconnexion entre l’effort investi et le contrôle cognitif utilisé pour effectuer la tâche, ce qui est une caractéristique des effets préfrontaux du temps sur la tâche153. D’autre part, d’autres études ont porté sur les saccades et les oscillations. Par exemple, Nakatani et al.154 ont révélé que, dans une tâche perceptuelle, l’amplitude de la bande alpha des régions occipitales prédisait les clignements et les effets de saccade. De plus, Velasques et al.155 ont montré que, lors d’une tâche d’attention prosaccadique, l’amplitude de la saccade était associée à des changements gamma frontaux. De plus, Bodala et al.156 ont constaté que les diminutions de thêta frontal sur la ligne médiane étaient accompagnées d’une diminution de l’attention soutenue, ainsi que de l’amplitude et de la vitesse des saccades. Ces résultats suggèrent que les mouvements oculaires, en particulier les saccades, peuvent refléter des processus cognitifs plutôt que de simplement contribuer au bruit de fond dans les signaux EEG. Dans la présente étude, nous avons amélioré l’élimination des artefacts liés aux mouvements oculaires à l’aide de l’algorithme ICA avec le critère de variance du rapport saccade/fixation126. Ce critère améliore la suppression des artefacts pour les tâches de visualisation libre157. Dans notre étude, aucune différence n’a été observée dans la vitesse de crête de la saccade et la cohérence entre la puissance thêta et le taux de saccade dans toutes les conditions. Cependant, d’autres études sont nécessaires pour répondre à ces questions.
Une étape critique de l’utilisation de ce protocole est l’étalonnage constant de l’eye tracker pendant l’expérience, car la perte de données de regard de la caméra pourrait entraîner des erreurs qui contamineraient la tâche et rendraient difficile l’obtention de réponses précises. Par conséquent, il est crucial de calibrer aussi souvent que possible. Cependant, il y a un compromis entre le nombre d’essais avec un oculomètre calibré et la durée de l’expérience. Dans notre étude, nous avons décidé de calibrer tous les cinq essais.
Des recherches futures explorant la relation entre les oscillations thêta et le diamètre de la pupille au cours de cette tâche de planification devraient être menées. La planification est un aspect essentiel du contrôle exécutif qui nécessite l’allocation de ressources attentionnelles et la coordination de plusieurs processus cognitifs. Comprendre la relation entre les oscillations thêta et le diamètre de la pupille pendant les tâches de planification pourrait fournir des informations précieuses sur les mécanismes neuronaux sous-jacents du contrôle exécutif et sur la façon dont ils changent au fil du temps. De plus, de telles études pourraient mener à une meilleure compréhension de la façon dont les changements dans la fonction cognitive, tels que la fatigue ou les pertes d’attention, affectent le rendement des tâches de planification et la capacité d’allouer efficacement les ressources. Cette information pourrait avoir des implications importantes pour l’élaboration d’interventions visant à améliorer la performance de planification, telles que des programmes d’entraînement cognitif ou des traitements pour des conditions telles que le trouble déficitaire de l’attention/hyperactivité (TDAH), entre autres.
Des recherches antérieures ont indiqué que le PFC joue un rôle crucial dans la planification cognitive, comme le confirment nos résultats. Ces résultats démontrent que la planification cognitive induit l’activité de FMθ dans le PFC, en particulier dans le cortex cingulaire antérieur, le cortex cingulaire moyen et les régions frontales supérieures54. Ces résultats s’alignent sur des recherches antérieures sur les fonctions exécutives. Il existe des preuves substantielles à l’appui de l’idée que l’activité FMθ agit comme un processus descendant pour initier le contrôle et faciliter la communication entre les régions du cerveau pendant des tâches exigeantes13. Bien que seules quelques études aient examiné la dynamique temporelle de l’activité de FMθ associée au contrôle cognitif, il est largement admis que le profil temporel de FMθ peut fournir des informations sur diverses facettes du contrôle cognitif et l’implication de régions PFC distinctes. L’utilisation de notre protocole d’évaluation de la planification cognitive nous a permis de caractériser le profil temporel de l’activité FMθ pendant la planification. Plus précisément, l’activité FMθ au cours de la condition de planification a montré une augmentation progressive. En mettant en œuvre ce protocole, pour la première fois, il a été démontré que FMθ est également présent lors de la mise en œuvre de la planification, comme dans d’autres fonctions cognitives d’ordre supérieur, et que sa dynamique temporelle peut servir d’indicateur de contrôle cognitif.
Nos résultats et notre protocole ont des applications potentielles dans le domaine des neurosciences, notamment pour améliorer les évaluations neuropsychologiques virtuelles et le traitement des troubles neuropsychiatriques avec des problèmes de planification cognitive associés, tels que la dépression et le trouble déficitaire de l’attention/hyperactivité. Par exemple, les évaluations pourraient impliquer l’examen de différents modèles d’erreurs au niveau de la performance comportementale, de différents modèles oscillatoires au niveau électrophysiologique et de différents mouvements oculaires. De plus, les résultats de ce travail pourraient éclairer le développement d’interfaces cerveau-ordinateur et de programmes d’entraînement cognitif visant à améliorer les capacités de planification cognitive.
Le présent protocole pourrait apporter de nouvelles preuves à la compréhension des mécanismes neuronaux qui sous-tendent la fonction de contrôle cognitif insaisissable de la planification cognitive dans les populations neurotypiques et neuropsychiatriques. De plus, notre paradigme comportemental pourrait offrir des aperçus de la neurobiologie du contrôle cognitif et de la planification grâce à l’examen des mesures électrophysiologiques, pupillométriques et comportementales avec une tâche de planification pratique qui examine les aspects intrinsèques de la planification plutôt que les exigences cognitives générales généralement présentes dans les tâches de contrôle cognitif, comme en témoignent les changements dans les oscillations thêta.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été soutenue financièrement par le programme de bourses doctorales Becas de Doctorado Nacional año 2015 de l’ANID 21150295, le 1180932 de bourses régulières FONDECYT, le 1230383 de bourses régulières FONDECYT, la bourse FONDECYT de Iniciación 11220009, la bourse postdoctorale Universidad de O’Higgins et l’Institut universitaire de France (IUF). Nous tenons à remercier le professeur Pablo Billeke pour ses commentaires sur la conception du paradigme. Nous remercions le professeur Eugenio Rodríguez de nous avoir aimablement partagé ses codes d’analyse temps-fréquence. Enfin, nous remercions Milan Domic, Vicente Medel, Josefina Ihnen, Andrea Sánchez, Gonzalo Boncompte, Catalina Fabar et Daniela Santander pour leurs commentaires.
matériels
| Name | Company | Catalog Number | Comments |
| EEG System | Biosemi | ActiveTwo Base system, 64 channels | |
| Eye-tracker System | Eyelink SR Research | EyeLink 1000 Plus Core Unit, High-speed camera, Host PC/Monitor, | |
| CPU display | Intel | Hard drive 221 GB, Processor Intel Core i7-4790 3.60 Hz, OS Windows 7, 4GB RAM | |
| CPU EEG | Intel | Hard drive 223 GB, Processor Intel Core i7-4790 3.60 Hz, OS Windows 7, 4GB RAM | |
| Monitor | ASUS | ASUS VG248QE 24" LCD monitor | |
| Joytsick | Logitech | Model F310 | |
| Luxmeter | Focket | LCD screen (0-200.000 lux) model Liebe WH LX1330B | |
| Statistics software | GraphPad Prism | GraphPad Prism version 8 for Windows | |
| MATLAB Programming Software | The MathWorks | MATLAB R2014a and R2018b | |
| SVG tool Inkscape | Inkscape Project | vector graphic editor software | |
| Presentation Software | Neurobehavioral Systems | stimulus delivery and experiment control program for neuroscience |
Références
- Siegel, M., Donner, T. H., Engel, A. K. Spectral fingerprints of large-scale neuronal interactions. Nature Reviews Neuroscience. 13 (2), 121-134 (2012).
- Fries, P. A mechanism for cognitive dynamics: Neuronal communication through neuronal coherence. Trends in Cognitive Sciences. 9 (10), 474-480 (2005).
- Fries, P. Rhythms for cognition: Communication through coherence. Neuron. 88 (1), 220-235 (2015).
- Thut, G., Miniussi, C., Gross, J. The functional importance of rhythmic activity in the brain. Current Biology. 22 (16), 658-663 (2012).
- Fröhlich, F., McCormick, D. A. Endogenous electric fields may guide neocortical network activity. Neuron. 67 (1), 129-143 (2010).
- Spaak, E., de Lange, F. P., Jensen, O. Local entrainment of alpha oscillations by visual stimuli causes cyclic modulation of perception. Journal of Neuroscience. 34 (10), 3536-3544 (2014).
- Fiebelkorn, I. C., Saalmann, Y. B., Kastner, S. Rhythmic sampling within and between objects despite sustained attention at a cued location. Current Biology. 23 (24), 2553-2558 (2013).
- Landau, A. N., Fries, P. Attention samples stimuli rhythmically. Current Biology. 22 (11), 1000-1004 (2012).
- Song, K., Meng, M., Lin, C., Zhou, K., Luo, H. Behavioral oscillations in attention: Rhythmic α pulses mediated through θ band. Journal of Neuroscience. 34 (14), 4837-4844 (2014).
- Wyart, V., Nobre, A. C., Summerfield, C. Dissociable prior influences of signal probability and relevance on visual contrast sensitivity. Proceedings of the National Academy of Sciences of the United States of America. 109 (9), 3593-3598 (2012).
- Leszczyński, M., Fell, J., Axmacher, N. Rhythmic working memory activation in the human hippocampus. Cell Reports. 13 (6), 1272-1282 (2015).
- Onton, J., Delorme, A., Makeig, S. Frontal midline EEG dynamics during working memory. NeuroImage. 27 (2), 341-356 (2005).
- Cavanagh, J. F., Frank, M. J. Frontal theta as a mechanism for cognitive control. Trends in Cognitive Sciences. 18 (8), 414-421 (2014).
- Siegel, M., Buschman, T. J., Miller, E. K. Cortical information flow during flexible sensorimotor decisions. Science. 348 (6241), 1352-1355 (2015).
- Weisz, N., et al. Prestimulus oscillatory power and connectivity patterns predispose conscious somatosensory perception. Proceedings of the National Academy of Sciences of the United States of America. 111 (4), 417-425 (2014).
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Cohen, M. X. A neural microcircuit for cognitive conflict detection and signaling. Trends in Neurosciences. 37 (9), 480-490 (2014).
- Yuste, R. From the neuron doctrine to neural networks. Nature Reviews Neuroscience. 16 (8), 487-497 (2015).
- Helfrich, R. F., Knight, R. T. Oscillatory dynamics of prefrontal cognitive control. Trends in Cognitive Sciences. 20 (12), 916-930 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annual Review of Neurosciences. 24 (1), 167-202 (2001).
- von Nicolai, C., et al. Corticostriatal coordination through coherent phase-amplitude coupling. Journal of Neuroscience. 34 (17), 5938-5948 (2014).
- Sweeney-Reed, C. M., et al. Thalamic theta phase alignment predicts human memory formation and anterior thalamic cross-frequency coupling. ELife. 4, 07578 (2015).
- Voytek, B., et al. Oscillatory dynamics coordinating human frontal networks in support of goal maintenance. Nature Neuroscience. 18 (9), 1318-1324 (2015).
- Raghavachari, S., et al. Theta oscillations in human cortex during a working-memory task: Evidence for local generators. Journal of Neurophysiology. 95 (3), 1630-1638 (2006).
- Jacobs, J., Hwang, G., Curran, T., Kahana, M. J. EEG oscillations and recognition memory: Theta correlates of memory retrieval and decision making. NeuroImage. 32 (2), 978-987 (2006).
- Itthipuripat, S., Wessel, J. R., Aron, A. R. Frontal theta is a signature of successful working memory manipulation. Experimental Brain Research. 224 (2), 255-262 (2013).
- Cavanagh, J. F., Zambrano-Vazquez, L., Allen, J. J. B. Theta lingua franca: A common mid-frontal substrate for action monitoring processes. Psychophysiology. 49 (2), 220-238 (2012).
- Mas-Herrero, E., Marco-Pallarés, J. Frontal theta oscillatory activity is a common mechanism for the computation of unexpected outcomes and learning rate. Journal of Cognitive Neuroscience. 26 (3), 447-458 (2014).
- Folstein, J. R., Van Petten, C. Influence of cognitive control and mismatch on the N2 component of the ERP: A review. Psychophysiology. 45 (1), 152-170 (2008).
- Cohen, M. X., Donner, T. H. Midfrontal conflict-related theta-band power reflects neural oscillations that predict behavior. Journal of Neurophysiology. 110 (12), 2752-2263 (2013).
- Walsh, M. M., Anderson, J. R. Modulation of the feedback-related negativity by instruction and experience. Proceedings of the National Academy of Sciences of the United States of America. 108 (47), 19048-19053 (2011).
- Luu, P., Tucker, D. M., Makeig, S. Frontal midline theta and the error-related negativity: Neurophysiological mechanisms of action regulation. Clinical Neurophysiology. 115 (8), 1821-1835 (2004).
- Hanslmayr, S., et al. The electrophysiological dynamics of interference during the Stroop task. Journal of Cognitive Neuroscience. 20 (2), 215-225 (2008).
- Cavanagh, J. F., Cohen, M. X., Allen, J. J. B. Prelude to and resolution of an error: EEG phase synchrony reveals cognitive control dynamics during action monitoring. Journal of Neuroscience. 29 (1), 98-105 (2009).
- Cohen, M. X., van Gaal, S., Ridderinkhof, K. R., Lamme, V. A. F. Unconscious errors enhance prefrontal-occipital oscillatory synchrony. Frontiers in Human Neuroscience. 3, 54 (2009).
- Cavanagh, J. F., Frank, M. J., Klein, T. J., Allen, J. J. B. Frontal theta links prediction errors to behavioral adaptation in reinforcement learning. NeuroImage. 49 (4), 3198-3209 (2010).
- Cohen, M. X., Cavanagh, J. F. Single-trial regression elucidates the role of prefrontal theta oscillations in response conflict. Frontiers in Psychology. 2, 30 (2011).
- Cohen, M. X., Van Gaal, S. Dynamic interactions between large-scale brain networks predict behavioral adaptation after perceptual errors. Cerebral Cortex. 23 (5), 1061-1072 (2013).
- Nigbur, R., Cohen, M. X., Ridderinkhof, K. R., Stürmer, B. Theta dynamics reveal domain-specific control over stimulus and response conflict. Journal of Cognitive Neuroscience. 24 (5), 1264-1274 (2012).
- van Driel, J., Swart, J. C., Egner, T., Ridderinkhof, K. R., Cohen, M. X. No) time for control: Frontal theta dynamics reveal the cost of temporally guided conflict anticipation. Cognitive, Affective, and Behavioral Neuroscience. 15 (4), 787-807 (2015).
- van de Vijver, I., Ridderinkhof, K. R., Cohen, M. X. Frontal oscillatory dynamics predict feedback learning and action adjustment. Journal of Cognitive Neuroscience. 23 (12), 4106-4121 (2011).
- Narayanan, N. S., Cavanagh, J. F., Frank, M. J., Laubach, M. Common medial frontal mechanisms of adaptive control in humans and rodents. Nature Neuroscience. 16 (12), 1888-1895 (2013).
- Anguera, J. A., et al. Video game training enhances cognitive control in older adults. Nature. 501 (7465), 97-101 (2013).
- Smit, A. S., Eling, P. A. T. M., Hopman, M. T., Coenen, A. M. L. Mental and physical effort affect vigilance differently. International Journal of Psychophysiology. 57 (3), 211-217 (2005).
- Cohen, M. X., Ranganath, C. Reinforcement learning signals predict future decisions. Journal of Neuroscience. 27 (2), 371-378 (2007).
- Gehring, W. J., Goss, B., Coles, M. G. H., Meyer, D. E., Donchin, E. A neural system for error detection and compensation. Psychological Science. 4 (6), 385-390 (1993).
- Yeung, N., Botvinick, M. M., Cohen, J. D. The neural basis of error detection: Conflict monitoring and the error-related negativity. Psychological Review. 111 (4), 931-959 (2004).
- Debener, S., et al. Trial-by-trial coupling of concurrent electroencephalogram and functional magnetic resonance imaging identifies the dynamics of performance monitoring. Journal of Neuroscience. 25 (50), 11730-11737 (2005).
- Hauser, T. U., et al. The feedback-related negativity (FRN) revisited: New insights into the localization, meaning, and network organization. NeuroImage. 84, 159-168 (2014).
- Wang, C., Ulbert, I., Schomer, D. L., Marinkovic, K., Halgren, E. Responses of human anterior cingulate cortex microdomains to error detection, conflict monitoring, stimulus-response mapping, familiarity, and orienting. Journal of Neuroscience. 25 (3), 604-613 (2005).
- Tsujimoto, S., Genovesio, A. Firing variability of frontal pole neurons during a cued strategy task. Journal of Cognitive Neuroscience. 29 (1), 25-36 (2017).
- Womelsdorf, T., Johnston, K., Vinck, M., Everling, S. Theta-activity in anterior cingulate cortex predicts task rules and their adjustments following errors. Proceedings of the National Academy of Sciences of the United States of America. 107 (11), 5248-5253 (2010).
- Womelsdorf, T., Vinck, M., Stan Leung, L., Everling, S. Selective theta synchronization of choice-relevant information subserves goal-directed behavior. Frontiers in Human Neuroscience. 4, 2010 (2010).
- Domic-Siede, M., Irani, M., Valdés, J., Perrone-Bertolotti, M., Ossandón, T. Theta activity from frontopolar cortex, mid-cingulate cortex and anterior cingulate cortex shows different roles in cognitive planning performance. NeuroImage. 226, 117557 (2021).
- Wilensky, R. . Planning and Understanding: A Computational Approach to Human Reasoning. , (1983).
- Grafman, J., Hendler, J. Planning and the brain. Behavioral and Brain Sciences. 14, 563-564 (1991).
- Hayes-Roth, B., Hayes-Roth, F. A cognitive model of planning. Cognitive Science. 3 (4), 275-310 (1979).
- Tremblay, M., et al. Brain activation with a maze test: An EEG coherence analysis study in healthy subjects. Neuroreport. 5 (18), 2449-2453 (1994).
- Shallice, T. Specific impairments of planning. Philosophical Transactions of the Royal Society B: Biological Sciences. 298 (1089), 199-209 (1982).
- Unterrainer, J. M., Owen, A. M. Planning and problem solving: From neuropsychology to functional neuroimaging. Journal of Physiology. 99 (4-6), 308-317 (2006).
- Domic-Siede, M., et al. La planificación cognitiva en el contexto de la evaluación neuropsicológica e investigación en neurociencia cognitiva: Una revisión sistemática. Terapia Psicológica. 40 (3), 367-395 (2022).
- Miotto, E. C., Morris, R. G. Virtual planning in patients with frontal lobe lesions. Cortex. 34 (5), 639-657 (1998).
- Burgess, P. W., Simons, J. S., Coates, L. M. A., Channon, S., Morris, R., Ward, G. The search for specific planning processes. The Cognitive Psychology of Planning. , 199-227 (2005).
- Oosterman, J. M., Wijers, M., Kessels, R. P. C. Planning or something else? Examining neuropsychological predictors of zoo map performance. Applied Neuropsychology. 20 (2), 103-109 (2013).
- Campbell, Z., et al. Utilizing virtual reality to improve the ecological validity of clinical neuropsychology: An fMRI case study elucidating the neural basis of planning by comparing the Tower of London with a three-dimensional navigation task. Applied Neuropsychology. 16 (4), 295-306 (2009).
- Wilson, B. A., Alderman, N., Burgess, P. W., Emslie, H., Evans, J. J. . Behavioural Assessment of the Dysexecutive Syndrome. , (1996).
- Spector, L., Grafman, J., Boller, F., Grafman, J. Planning, neuropsychology, and artificial intelligence: Cross fertilization. Handbook of Neuropsychology. 9, 377-392 (1994).
- Porteus, S. D. . The Maze Test and Clinical Psychology. , (1959).
- Lis, S., Krieger, S., Wilhelm, J., Gallhofer, B. Feedback about previous action improves executive functioning in schizophrenia: An analysis of maze solving behaviour. Schizophrenia Research. 78 (2-3), 243-250 (2005).
- Zelinsky, G. J. A theory of eye movements during target acquisition. Psychological Review. 115 (4), 787-835 (2008).
- Wurtz, R. H., Goldberg, M. E., Robinson, D. L. Brain mechanisms of visual attention. Scientific American. 246 (6), 124-135 (1982).
- Burr, D., Morrone, M. C. Eye movements: Building a stable world from glance to glance. Current Biology. 15 (20), 839-840 (2005).
- Rolfs, M. Microsaccades: Small steps on a long way. Vision Research. 49 (20), 2415-2441 (2009).
- Ortega, J., Plaska, C. R., Gomes, B. A., Ellmore, T. M. Spontaneous eye blink rate during the working memory delay period predicts task accuracy. Frontiers in Psychology. 13, 788231 (2022).
- Grueschow, M., Kleim, B., Ruff, C. C. Role of the locus coeruleus arousal system in cognitive control. Journal of Neuroendocrinology. 32 (12), 12890 (2020).
- Aston-Jones, G., Shaver, R., Dinan, T. Cortically projecting nucleus basalis neurons in rat are physiologically heterogeneous. Neuroscience Letters. 46 (1), 19-24 (1984).
- Foote, S. L., Bloom, F. E., Aston-Jones, G. Nucleus locus coeruleus: New evidence of anatomical and physiological specificity. Physiological Reviews. 63 (3), 844-914 (1983).
- Siever, L. J., Davis, K. L. Overview: Toward a dysregulation hypothesis of depression. The American Journal of Psychiatry. 142 (9), 1017-1031 (1985).
- Aston-Jones, G., Gold, J. I. How we say no: Norepinephrine, inferior frontal gyrus, and response inhibition. Biological Psychiatry. 65 (7), 548-549 (2009).
- Aston-Jones, G., Cohen, J. D. An integrative theory of locus coeruleus norepinephrine function: adaptive gain and optimal performance. Annual Review of Neurosciences. 28, 403-450 (2005).
- Einhauser, W., Stout, J., Koch, C., Carter, O. Pupil dilation reflects perceptual selection and predicts subsequent stability in perceptual rivalry. Proceedings of the National Academy of Sciences of the United States of America. 105 (5), 1704-1709 (2008).
- Yoshitomi, T., Ito, Y., Inomata, H. Adrenergic excitatory and cholinergic inhibitory innervations in the human iris dilator. Experimental Eye Research. 40 (3), 453-459 (1985).
- Rajkowski, J., Kubiak, P., Aston-Jones, G. Locus coeruleus activity in monkey: Phasic and tonic changes are associated with altered vigilance. Brain Research Bulletin. 35 (5-6), 607-616 (1994).
- Beatty, J. Task-evoked pupillary responses, processing load, and the structure of processing resources. Psychological Bulletin. 91 (2), 276-292 (1982).
- Beatty, J., Kahneman, D. Pupillary changes in two memory tasks. Psychonomic Science. 5, 371-372 (1966).
- Hess, E. H., Polt, J. M. Pupil size in relation to mental activity during simple problem-solving. Science. 143 (3611), 1190-1192 (1964).
- Kuchinke, L., Vo, M. L., Hofmann, M., Jacobs, A. M. Pupillary responses during lexical decisions vary with word frequency but not emotional valence. International Journal of Psychophysiology. 65 (2), 132-140 (2007).
- Barkley, R. A. Adolescents with attention-deficit/hyperactivity disorder: An overview of empirically based treatments. Journal of Psychiatric Practice. 10 (1), 39-56 (2004).
- Gau, S. S. F. e. m. 8. 9., Shang, C. Y. Executive functions as endophenotypes in ADHD: Evidence from the Cambridge Neuropsychological Test Battery (CANTAB). Journal of Child Psychology and Psychiatry and Allied Disciplines. 51 (7), 838-849 (2010).
- Bora, E., Harrison, B. J., Yücel, M., Pantelis, C. Cognitive impairment in euthymic major depressive disorder: A meta-analysis. Psychological Medicine. 43 (10), 2017-2026 (2013).
- Rive, M. M., Koeter, M. W. J., Veltman, D. J., Schene, A. H., Ruhé, H. G. Visuospatial planning in unmedicated major depressive disorder and bipolar disorder: Distinct and common neural correlates. Psychological Medicine. 46 (11), 2313-2328 (2016).
- Holt, D. V., Wolf, J., Funke, J., Weisbrod, M., Kaiser, S. Planning impairments in schizophrenia: Specificity, task independence and functional relevance. Schizophrenia Research. 149 (1-13), 174-179 (2013).
- Lima-Silva, T. B., et al. Functional profile of patients with behavioral variant frontotemporal dementia (bvFTD) compared to patients with Alzheimer's disease and normal controls. Dementia and Neuropsychologia. 7 (1), 96-103 (2013).
- Karnath, H. O., Wallesch, C. W., Zimmermann, P. Mental planning and anticipatory processes with acute and chronic frontal lobe lesions: A comparison of maze performance in routine and non-routine situations. Neuropsychologia. 29 (4), 271-290 (1991).
- Staudigl, T., Hartl, E., Noachtar, S., Doeller, C. F., Jensen, O. Saccades are phase-locked to alpha oscillations in the occipital and medial temporal lobe during successful memory encoding. PLoS Biology. 15 (12), 2003404 (2017).
- Faul, F., Erdfelder, E., Lang, A. G., Buchner, A. G*Power 3: A flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behavior Research Methods. 39 (2), 175-191 (2007).
- Ferrando, L., Bobes, J., Gibert, J., Soto, M. MINI Entrevista Neuropsiquiátrica Internacional (MINI International Neuropsychiatric Interview, MINI). Instrumentos de Detección y Orientación Diagnóstica. , (2000).
- McAssey, M., Dowsett, J., Kirsch, V., Brandt, T., Dieterich, M. Different EEG brain activity in right and left-handers during visually induced self-motion perception. Journal of Neurology. 267 (1), 79-90 (2020).
- Kelly, R., Mizelle, J. C., Wheaton, L. A. Distinctive laterality of neural networks supporting action understanding in left- and right-handed individuals: An EEG coherence study. Neuropsychologia. 75, 20-29 (2015).
- O'Hare, A. J., Atchley, R. A., Young, K. M. Central and divided visual field presentation of emotional images to measure hemispheric differences in motivated attention. Journal of Visualized Experiments. (129), 56257 (2017).
- Beatty, J. Task-evoked pupillary responses, processing load, and the structure of processing resources. Psychological Bulletin. 91 (2), 276-292 (1982).
- Wainstein, G., et al. Pupil size tracks attentional performance in attention-deficit/hyperactivity disorder. Scientific Reports. 7 (1), 8228 (2017).
- Drueke, B., et al. Neural correlates of positive and negative performance feedback in younger and older adults. Behavioral and Brain Functions. 11, 17 (2015).
- Lezak, M. D. The problem of assessing executive functions. International Journal of Psychology. 17 (1-4), 281-297 (1982).
- Oosterman, J. M., Wijers, M., Kessels, R. P. C. Planning or something else? Examining neuropsychological predictors of zoo map performance. Applied Neuropsychology. 20 (2), 103-109 (2013).
- Keil, A., et al. Committee report: Publication guidelines and recommendations for studies using electroencephalography and magnetoencephalography. Psychophysiology. 51 (1), 1-21 (2014).
- Abokyi, S., Owusu-Mensah, J., Osei, K. A. Caffeine intake is associated with pupil dilation and enhanced accommodation. Eye. 31 (4), 615-619 (2017).
- Wilhelm, B., Stuiber, G., Lüdtke, H., Wilhelm, H. The effect of caffeine on spontaneous pupillary oscillations. Ophthalmic & Physiological Optics. 34 (1), 73-81 (2014).
- McGinley, M. J., David, S. V., McCormick, D. A. Cortical membrane potential signature of optimal states for sensory signal detection. Neuron. 87 (1), 179-192 (2015).
- Slotnick, S. D. High density event-related potential data acquisition in cognitive neuroscience. Journal of Visualized Experiments. (38), 1945 (2010).
- Lamm, C., Windischberger, C., Leodolter, U., Moser, E., Bauer, H. Co-registration of EEG and MRI data using matching of spline interpolated and MRI-segmented reconstructions of the scalp surface. Brain Topography. 14 (2), 93-100 (2001).
- Schwartz, D., et al. Registration of MEG/EEG data with 3D MRI: Methodology and precision issues. Brain Topography. 9, 101-116 (1996).
- Laeng, B., Sirois, S., Gredebäck, G. Pupillometry: A window to the preconscious? Perspectives on psychological science. Journal of the Association for Psychological Science. 7 (1), 18-27 (2012).
- Vandierendonck, A. A comparison of methods to combine speed and accuracy measures of performance: A rejoinder on the binning procedure. Behavior Research Methods. 49 (2), 653-673 (2017).
- Vandierendonck, A. Further tests of the utility of integrated speed-accuracy measures in task switching. Journal of Cognition. 1 (1), 8 (2018).
- Levene, H., Olkin, I. Robust tests for equality of variances. In Contributions to Probability and Statistics: Essays in Honor of Harold Hotelling. , 278-292 (1960).
- Zimmerman, D. W. A note on preliminary tests of equality of variances. The British Journal of Mathematical and Statistical Psychology. 57, 173-181 (2004).
- D'Agostino, R. B., Belanger, A., D'Agostino, R. B. A suggestion for using powerful and informative tests of normality). The American Statistician. 44 (4), 316 (1990).
- Shapiro, S. S., Wilk, M. B. An analysis of variance test for normality (complete samples). Biometrika. 52 (3-4), 591-611 (1965).
- Wilcoxon, F. Individual comparisons by ranking methods. Biometrics Bulletin. 1 (6), 80 (1945).
- Fay, M. P., Proschan, M. A. Wilcoxon-Mann-Whitney or t-test? On assumptions for hypothesis tests and multiple interpretations of decision rules. Statistics Surveys. 4, 1-39 (2010).
- Delorme, A., Makeig, S. EEGLAB: An open-source toolbox for analysis of single-trial EEG dynamics including independent component analysis. Journal of Neuroscience Methods. 134 (1), 9-21 (2004).
- Dimigen, O., Sommer, W., Hohlfeld, A., Jacobs, A. M., Kliegl, R. Coregistration of eye movements and EEG in natural reading: Analyses and review. Journal of Experimental Psychology. 140 (4), 552-572 (2011).
- Mognon, A., Jovicich, J., Bruzzone, L., Buiatti, M. ADJUST: An automatic EEG artifact detector based on the joint use of spatial and temporal features. Psychophysiology. 48 (2), 229-240 (2011).
- Bell, A. J., Sejnowski, T. J., Leen, T. K., Tesauro, G., Touretsky, D. S. A non-linear information maximization algorithm that performs blind separation. Advances in Neural Information Processing Systems 7. , (1995).
- Plöchl, M., Ossandón, J. P., König, P. Combining EEG and eye tracking: Identification, characterization, and correction of eye movement artifacts in electroencephalographic data. Frontiers in Human Neuroscience. 6, 278 (2012).
- Pion-Tonachini, L., Kreutz-Delgado, K., Makeig, S. ICLabel: An automated electroencephalographic independent component classifier, dataset, and website. NeuroImage. 198, 181-197 (2019).
- Gartner, M., Grimm, S., Bajbouj, M. Frontal midline theta oscillations during mental arithmetic: Effects of stress. Frontiers in Behavioral Neuroscience. 9, 96 (2015).
- Wang, W., Viswanathan, S., Lee, T., Grafton, S. T. Coupling between theta oscillations and cognitive control network during cross-modal visual and auditory attention: Supramodal vs modality-specific mechanisms. PLoS One. 11 (7), 0158465 (2016).
- Maris, E., Oostenveld, R. Nonparametric statistical testing of EEG- and MEG-data. Journal of Neuroscience Methods. 164 (1), 177-190 (2007).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Computational Intelligence and Neuroscience. 2011, 879716 (2011).
- Pascual-Marqui, R. D. Standardized low-resolution brain electromagnetic tomography (sLORETA): Technical details. Methods and Findings in Experimental and Clinical Pharmacology. 24, 5-12 (2002).
- Gramfort, A., Papadopoulo, T., Olivi, E., Clerc, M. OpenMEEG: Opensource software for quasistatic bioelectromagnetics). Biomedical Engineering Online. 9, 45 (2010).
- Destrieux, C., Fischl, B., Dale, A., Halgren, E. Automatic parcellation of human cortical gyri and sulci using standard anatomical nomenclature. Neuroimage. 53 (1), 1-15 (2010).
- Orr, J. M., Weissman, D. H. Anterior cingulate cortex makes 2 contributions to minimizing distraction. Cerebral Cortex. 9 (3), 703-711 (2009).
- Christoff, K., Gabrieli, J. D. E. The frontopolar cortex and human cognition: Evidence for a rostrocaudal hierarchical organization within the human prefrontal cortex. Psychobiology. 28 (2), 168-186 (2000).
- Nitschke, K., Köstering, L., Finkel, L., Weiller, C., Kaller, C. P. A meta-analysis on the neural basis of planning: Activation likelihood estimation of functional brain imaging results in the Tower of London task. Human Brain Mapping. 38 (1), 396-413 (2017).
- Barbey, A. K., Koenigs, M., Grafman, J. Dorsolateral prefrontal contributions to human working memory. Cortex. 49 (5), 1195-1205 (2013).
- Le Van Quyen, M., et al. Comparison of Hilbert transform and wavelet methods for the analysis of neuronal synchrony. Journal of Neuroscience Methods. 111 (2), 83-98 (2001).
- Bokil, H., Andrews, P., Kulkarni, J. E., Mehta, S., Mitra, P. P. Chronux: A platform for analyzing neural signals. Journal of Neuroscience Methods. 192 (1), 146-151 (2010).
- Sato, N., Yamaguchi, Y. EEG theta regulates eye saccade generation during human object-place memory encoding. Advances in Cognitive Neurodynamics ICCN 2007. , 429-434 (2008).
- Zaki, J., Ochsner, K. The need for a cognitive neuroscience of naturalistic social cognition. Annals of the New York Academy of Sciences. 1167, 16-30 (2009).
- Shamay-Tsoory, S. G., Mendelsohn, A. Real-life neuroscience: An ecological approach to brain and behavior research. Perspectives on Psychological Science. 14 (5), 841-859 (2019).
- Diamond, A. Executive functions. Annual Review of Psychology. 64, 135-168 (2013).
- Dudai, Y. . Memory from A to Z: Keywords, Concepts and Beyond. , (2002).
- Kingstone, A., Smilek, D., Ristic, J., Friesen, C. K., Eastwood, J. D. Attention, researchers! It is time to take a look at the real world. Current Directions in Psychological Science. 12 (5), 176-180 (2003).
- Morris, R. G., Ward, G., Morris, R., Ward, G. Introduction to the psychology of planning. The Cognitive Psychology of Planning. , (2005).
- Zwosta, K., Ruge, H., Wolfensteller, U. Neural mechanisms of goal-directed behavior: Outcome-based response selection is associated with increased functional coupling of the angular gyrus. Frontiers in Human Neuroscience. 9, 180 (2015).
- Owen, A. M., Doyon, J., Petrides, M., Evans, A. C. Planning and spatial working memory: A positron emission tomography study in humans. European Journal of Neuroscience. 8 (2), 353-364 (1996).
- Ossandon, T., et al. Efficient "pop-out" visual search elicits sustained broadband gamma activity in the dorsal attention network. Journal of Neuroscience. 32 (10), 3414-3421 (2012).
- Lezak, M. D. . Neuropsychological Assessment., 3rd edition. , (1995).
- Lin, H., Saunders, B., Hutcherson, C. A., Inzlicht, M. Midfrontal theta and pupil dilation parametrically track subjective conflict (but also surprise) during intertemporal choice. NeuroImage. 172, 838-852 (2018).
- Yu, S., Mückschel, M., Beste, C. Superior frontal regions reflect the dynamics of task engagement and theta band-related control processes in time-on task effects. Scientific Reports. 12 (1), 846 (2022).
- Nakatani, H., van Leeuwen, C. Antecedent occipital alpha band activity predicts the impact of oculomotor events in perceptual switching. Frontiers in Systems Neuroscience. 7, 19 (2013).
- Velasques, B., et al. Changes in saccadic eye movement (SEM) and quantitative EEG parameter in bipolar patients. Journal of Affective Disorders. 145 (3), 378-385 (2013).
- Bodala, I. P., Li, J., Thakor, N. V., Al-Nashash, H. EEG and eye tracking demonstrate vigilance enhancement with challenge integration. Frontiers in Human Neuroscience. 10, 273 (2016).
- Dimigen, O. Optimizing the ICA-based removal of ocular EEG artifacts from free viewing experiments. NeuroImage. 207, 116117 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon