Method Article
使用新的微量呼吸测量工具对珊瑚全息进行生理表征
摘要
该协议描述了微呼吸测量系统的设置和运行,该系统可用于研究珊瑚全息的生理特征。
摘要
代谢活动被定义为涉及能量的有机过程的总和,对于理解地球上生命的功能和进化至关重要。因此,测量生物体代谢率是解释生物体生理状态、生态作用以及环境变化对陆地和水生生态系统中物种的影响的核心。在珊瑚礁上,新陈代谢测量已被用于量化珊瑚与其专性藻类共生体(共生藻科)之间的共生功能,以及评估包括气候变化在内的环境压力源将如何影响珊瑚健康。尽管具有这种重要性,但缺乏与珊瑚后代代谢率测量相关的方法和数据,这可能是由于它们的体积小。为了弥补这一差距,本研究旨在开发一种定制装置,用于测量小型(毫米级范围)海洋动物生态的呼吸作用。这种低成本和简单的设置应该可以改善代谢率的测量。这对于利用珊瑚的有性生产进行珊瑚礁恢复的应用生态研究至关重要。
引言
呼吸是一种关键的生物学测量,它标志着生物体的整体代谢活动,但与其他关键性状(生长)一样,很难在小型生物体中测量 1。呼吸可以定义为通过使用氧气氧化有机分子。这个过程产生细胞功能(即新陈代谢)所需的化学能,这对生物体的生存至关重要。或者,厌氧代谢导致氧债务2。呼吸速率可以使用验光仪来确定,该验光仪测量密闭腔室中氧气浓度随时间推移的使用情况(以及因此降低),这种做法通常称为呼吸测量法 3。鉴于大多数生物体不储存氧气,新陈代谢率可以通过呼吸和碳使用之间的直接相关性来推断。正因为如此,呼吸速率可以转换为每日碳使用量,这为关键的代谢功能提供信息,如生长、繁殖和在环境压力时期维持代谢稳态的能力 4,5,包括通常导致压力或珊瑚白化的热浪条件。
全球珊瑚礁正在加速减少。珊瑚动物拥有一个由合作伙伴组成的联盟(包括甲藻共生菌科、真菌、细菌和病毒),统称为"holobiont"6。随着海洋温度的升高,珊瑚和珊瑚礁的生存压力越来越大,因为高温导致甲藻共生体科(以下简称共生体)的丧失,这种现象被称为漂白7。否则,寡营养热带水域中的珊瑚无法获得许多营养物质,包括无机氮和磷8。为了应对这种情况,珊瑚与它们的甲藻共生体(共生体)形成专性营养共生体,它们提供了珊瑚宿主生存和沉积碳酸钙骨架所需的大部分营养物质9。功能共生的特征可能是伴侣之间高水平的碳共享10,11,共生的调节涉及动态稳态12。
在热应激期间,这种动态调节和交流被破坏,导致生态失调和漂白(参考文献13 中已论述)。因此,代谢测量,如光合作用和呼吸作用,有可能阐明珊瑚的健康和不受调节的生态失调状态,准确测量个体发育中的这些过程对于理解生物体功能至关重要。随着大规模漂白事件的频率和幅度的增加,这一点尤为重要,有可能影响共生体营养共享的变化,其中碳转移已发现随着温度升高而减少14。这可能是由于共生体螯合营养物质的定向机制或硬生理权衡(热耐受性增加但宿主存活率降低15,16,17)。共生的破坏可能源于共生体和宿主,尽管一个主要因素可能是共生体的细胞功能障碍18。然而,海水温度升高引起的压力破坏了这种共生关系的稳定性;从共生体到宿主的碳共享减少19,20,珊瑚的饥饿可能会随之而来。这可能反映在珊瑚中的脂质和碳水化合物储存减少,这是由于宿主使用增加("固定碳的分解代谢增加"),可能是由于共生体的共享减少11。除了光合作用和珊瑚共生体呼吸的贡献外,珊瑚动物的呼吸作用是了解珊瑚健康、这些伙伴之间漂白和营养交换的影响以及全息生物的生长的重要措施,全息生物是一种与生存环境变化相关的表型 8,21,22.最后,鉴于许多珊瑚是共生的,除了呼吸作用之外,使用呼吸测量法来表征光合作用对于将 P:R 比率置于上下文中并了解共生是否稳定特别有用(例如,参考文献23)。
因此,环境变化导致珊瑚及其共生体的能量预算发生变化,导致生长差异14.为了应对,珊瑚宿主可能会增加呼吸和脂质的使用,以满足其代谢需求;热应激会使净生产率降低 60%,因为呼吸增加14,通过溶解氧的变化来衡量。共生体科还可以增加氮的同化和碳保留14,24,然后利用这些储备将能量转移到它们自身的修复和保护机制25,26。N和C的平衡对于调节生长很重要,特别是P27,它可能表现为共生体丰度的动态调节。事实上,从大片珊瑚礁(>1,000公里)的珊瑚中收集的证据表明,宿主有能力通过调节磷来限制共生体的生长,尽管这因珊瑚物种而异27。
综上所述,这些研究表明,由于环境变化,耐热性增加,同时减少营养物质的产生或转移(即共生倾向)。因此,应使用强大的单幼方法,例如 通过 微呼吸计量化氧气使用量,以了解与新陈代谢相关的基本机制,然后应用于保护问题,例如了解耐热性获得。这里将其作为用于生理测量的微量呼吸测量工具,旨在查询珊瑚幼体与其藻类共生体之间的营养关系,但适用于其他小型海洋生物。
生物体对氧气的使用或产生可以通过将它们放入单独的、密封的呼吸测量室或"呼吸计"(以下简称腔室)中来测量,其中使用光学极管测量氧气变化 3.光电管是使用光脉冲测量氧浓度的探头,随时间变化的记录测量可以计算呼吸和/或光合作用速率。在实践中,测量呼吸作用类似于测量珊瑚的光合作用,只是珊瑚是在完全黑暗的情况下孵化的。从每日光合作用总量中减去珊瑚和共生体的每日总呼吸量,得出氧差(氧增量)2,3。一般来说,生物体消耗的氧气多于产生的氧气,导致缺氧。这可以转换为碳当量,因为氧气和碳以固定比例消耗 2。多余的碳可以被珊瑚用于生长、粘液合成和繁殖以及其他必要的代谢需求12.
该协议描述了一种微呼吸方法(图1),该方法用于测量单个珊瑚幼体的呼吸速率(R),使用定制的1.5mL玻璃室设计(带有GL25螺纹的小瓶,高20毫米,带有凸块/脊,平地边缘和带孔的螺旋盖;参见材料 表)填充0.5μm过滤海水。光纤光学极管(见 材料表)通过盖子侧面的孔插入每个腔室。每个单独的珊瑚都附着在磁力搅拌棒上方的硬网流通搅拌器板平台上方,以确保腔室内水的充分混合。在这里的代表性示例中,两个对照或"空白"(除了样品存在外相同的腔室)与三个重复的标本腔室同时测量,因为我们同时运行多个控制器。但是,设置示例(图 2)仅显示了四个通道的使用;这可以使用多个控制器和多个流通支架来增加。该系统中的温度也可以通过将每个腔室浸没在具有预设水温的定制水浴中来控制温度(此处示例数据中的高温应力为 27 °C,此处示例数据中的高温应力为 31 °C),使用循环流通(设置为 75 L/h 的连续、平缓流动)系统。搅拌板平台和带齿轮的搅拌板可以是任何尺寸,可以根据需要做成大或小,以适应玻璃室的数量。在这个例子中,平台和板大约是34厘米×26厘米×3厘米(材料表)。在每次运行之前,使用两种标准溶液对光电极进行校准,分别代表在适当的水温和盐度下,该实验设置的氧饱和度为 0% 和 100%。
研究方案
1. 在呼吸室内设置设备和珊瑚
注:2018年10月满月当天,从磁岛(19°6.249'S;146°51.728'E)的珊瑚礁中移走,收集并带入实验室进行珊瑚产卵, 幼年珊瑚被培育和生长的地方。
- 在测量当天,使用蓝色塑料管和连接器连接两个水浴板(见材料表;图1 [5],图2A,B)。在与蓝色塑料管连接到热水器/冷却器后,这些将用作培养箱。当呼吸测量室未就位时,确保可以通过透明水浴板清楚地看到电机板。
- 将两根软管连接到热水器/冷水机组(参见 材料表)。打开热水器/冷水机组,然后设置所需的实验温度(27°C或31°C)。
- 用磁齿轮将水浴底座(步骤1.1)连接到底座电机板(图1 [6,7]和 图3A),然后将该组件连接到电源(图3B)。打开电源以激活齿轮,这将激活腔室中的搅拌杆。
- 根据需要调节水流(例如,设置为 75 L/h 的连续、温和的流量,以 30 rpm 的速度缓慢搅拌)(图 3C)。
- 要组装呼吸测量室,将磁珠(图1 [1.5])添加到玻璃室(图1 [1.6])中,然后将不透明的塑料流通支架底座(图1 [1.4])添加到玻璃室中(图4A)。腔室和磁珠的大小将取决于感兴趣的生物体和研究系统。
注意: 塑料底座上有孔,允许水从底部磁珠的运动中流动和循环。 - 使用水族箱胶水(见材料表)将珊瑚粘在放置在塑料底座中的黑色扎带上(图 4B-D)。为此,首先将珊瑚幼体粘在一块黑色塑料上,然后将这块粘在塑料底座上。一旦珊瑚牢固地固定(胶水的固化几乎是瞬间的),将带有O形圈(图4A)的盖子拧到玻璃室上。在单独的水池中在水下执行这些操作,以确保呼吸测量室内没有空气。
注意:呼吸计中的水量(即有效体积 = 1.5 ml)是通过将腔室完全浸没在水下来确定的。假设是,相对于水量,非常小的珊瑚的质量/密度的位移可以忽略不计。此处显示了 1.5 mL 微量离心管的规模(图 4A)。 - 将腔室牢固地放入水浴中(图5A)。确保玻璃室与实验的温控水接触。
- 将 O2 光纤电缆(参见 材料表)插入钻入盖室侧面的孔中,使它们与氧传感器光斑(以下简称光斑;参见 材料表)接触。这些小光点对氧敏感,将通过光纤电缆检测和传输来自腔室内的信号。
- 添加管道胶带(白色薄自密封胶带)以使电缆紧贴并使其牢固地保持在水室内。确保可以看到单个珊瑚(如 图5B所示),棕色触手朝上,在房间内(图5B,视频1)。
注: 表1中提供了设备中组件的成本估算。
- 添加管道胶带(白色薄自密封胶带)以使电缆紧贴并使其牢固地保持在水室内。确保可以看到单个珊瑚(如 图5B所示),棕色触手朝上,在房间内(图5B,视频1)。
2. 使用 O2 系统测量呼吸的标准操作程序
- 打开氧气测量软件(参见 材料表)。
- 测量将要执行校准的房间的温度。稍后的校准阶段(步骤2.8)将需要此操作。
- 组装光学传感器和盖子。为此,请将所有光纤连接到 O2 模块中的匹配端口。确保将盖子 1 与传感器 1 匹配,将盖子 2 与传感器 2 匹配,依此类推。
- 要设置用于校准的腔室,请先用少许反渗透 (RO) 水润湿一块干净的海绵,然后将其插入每个腔室。
注意:海绵不应滴水,只能湿润。它可能会滴落在光纤斑点上。在继续下一步之前,请确保该点没有弄湿。 - 用匹配的光纤将腔室倒置放置(图 6)。这将允许在不接触光纤的情况下拧下腔室并添加亚硫酸钠进行 0% 校准。
- 在校准开始之前检查每个传感器的信号。浏览软件界面中的所有选项卡并检查信号值(左上角)(图 7A),确保它们没有显着变化。查看 O2 手册,了解实验设置的可接受值(取决于生物体和感兴趣的条件)。对于这种特定设置,在 25.3 °C 的室温下,FTC(氧传感器通过电池正常范围的光斑流量)为 20.59,信号为 179.5 是可以接受的。
- 打开 程序 并检查软件中的设置以确认它们正确无误,如下所述。如果打开程序后没有立即显示弹出窗口,可以通过单击软件界面左下角的 "设置 "按钮来完成。
- 检查外部温度传感器是否已激活(图 7B)。将设置更改为 固定温度 (图7C)。然后,添加室温值并单击 复制设置到所有其他通道。
- 将设置更改为 降低信号漂移 (图7C)。然后,选择 传感器设置 并选择 级别 2。否则,如果使用小体积,漂移会非常高,难以校准。
- 检查频道的常规设置。如果足够,按 确定 。单击 "将设置复制到所有通道",然后单击 "确定"。
- 校准传感器。对于通道 1 校准,请转到 通道 1 选项卡并按 校准按钮。 在水或潮湿空气中选择 2 点。
- 对于"空气"校准,将一块泡沫浸入水中,将其放入腔室内,然后等待信号稳定(参见空气校准前后的图像)。稳定后,按"定空"。单击 空气>校准>设置空气。
- 设置0%和100%校准(图7D)。从盖子上取下腔室并将其放入下一个盖子中,以便在第一个传感器的 0% 校准完成时空气校准信号准备就绪。使用移液管并用 2% 亚硫酸钠填充盖子。等待信号稳定。
注意: 与空气校准相比,信号通常需要更多时间才能稳定下来。如果出现警告消息,指出"值超出典型范围",请确保亚硫酸钠是新鲜的。对所有通道重复相同的校准过程。通过在 100 mL RO 水中加入 2 g 来制备亚硫酸钠。 - 校准完成后,冲洗呼吸室并擦干呼吸室和盖子。确保光纤孔中没有水。
- 将生物体(在本例中为单珊瑚幼体)放入呼吸室内并用盖子关闭。放置盖子时,请确保在腔室完全浸没且内部绝对没有空气的情况下进行。
- 将腔室牢固地放在搅拌板中并连接光纤。
- 打开电源。确保腔室内的水完全混合。将冷却器/加热器中的温度设置为所选的实验温度。
- 打开泵和加热器(步骤 1.2 和 1.4)。
- 在 O2 测量软件界面上按 log 开始记录。
结果
数据处理与分析
虽然有许多方法可以处理呼吸测量实验的原始数据,但建议使用 R 包 respR28。为了与上述倡导开放科学和可重复性的协议的共享保持一致,该软件包允许以易于复制的形式共享数据处理和分析,并在设计时考虑到了这一点。它是一个免费的开源平台,与探针系统无关,可以从 CRAN 或 GitHub 轻松安装。 维护了 respR 的完整代码和示例,可以在 https://github.com/januarharianto/respR 中找到。
respR 软件包具有导入、可视化和执行呼吸测量数据质量控制的功能,以及自动或从手动选择的区域计算呼吸速率的功能。它还可以调整背景呼吸的速率和常用输出单位的转换速率。下面详细介绍了处理来自微呼吸计系统的数据的步骤。在这项研究中,以呼吸计系统的数据为例,但该软件包也接受来自大多数市售氧探头系统以及通用 R 数据对象的输入。有关该软件包的更多详细信息,包括完整的文档和教程,可以在软件包网站上找到,网址为 https://januarharianto.github.io/respR/index.html。
导入原始数据
导入原始输出文件 (.txt)。 respR 识别格式并将其分析为可在后续函数中使用的泛型 R 数据帧。但是,需要注意的是,这是可选的;任何具有 R 基本知识的人也可以使用基本函数(如下所示)导入这些文件和几乎任何氧气时间序列数据。
#load respR
库(respR)
#Import ---
数据<- import_file("file.txt")
检测到 #Firesting-Pryo 文件
检查和可视化数据
任何数据分析任务的一个重要部分是绘制和检查数据以寻找明显的异常或模式,甚至只是帮助理解它。这里使用 检查 功能(图8A),它检查呼吸测量数据的常见问题,例如非数字或缺失值。
#inspect 单个氧气柱
Insp <-inspect(数据,时间 = 3,氧气 = 8,宽度 = 0.2)
该函数还绘制氧气时间序列并计算滚动速率(底部面板),以帮助阐明该速率在实验过程中如何变化。这些滚动速率图有助于告知应提取这些速率曲线的哪些区域。在标准或常规代谢率的情况下,所需的区域是速率显示稳定的区域(例如,在大约 3,000 个时间点之后; 图8B)。
在这里,只有在完整时间序列面板中的第 200 行左右之后才能检测到氧气下降。这样的模式在呼吸测量数据中很常见;在实验开始时,随着系统稳定并且样品适应实验条件,通常会有一段较长的不稳定期。建议仅在这种初始不稳定之后才从时间序列中提取速率,这也突出了可视化的重要性。
提取率
respR 有两个用于提取呼吸速率的功能。第一个是 calc_rate() 函数,它允许通过指定时间、行或氧气水平区域来手动提取速率。这在呼吸测量分析中很常见,并且只要确定并始终如一地应用选择标准,就是一种完全可以接受的确定速率的方法28.
一种更强大、更客观的方法是使用 auto_rate() 函数,该函数标识数据的线性区域。这些区域是那些持续呼吸速率的区域,使用机器学习自动分配。此功能也可用于检测低信号(如当前研究中使用的样品,因为该年龄的生物量较低)。此功能允许使用独立、客观和统计稳健的方法识别最线性、最小和最大速率28。此处的示例标识了在 3,000 到 5,000 时间点附近发生的线性区域。应该注意的是,可以识别多个线性区域,但该部分是排名最高或最线性的区域(图8C)。
#Determine 最线性(即一致)的速率
费率 <-auto_rate(INSP)
背景调整
对照实验的背景速率可以采用与上述示例类似的方式确定,并且可用于使用 adjust_rate()函数调整样本速率(图9A;请注意,此处未显示完整分析,仅显示调整)。完整的例子详见 respR 网站。
#Adjust 背景费率
rate_adj <-adjust_rate(rate, by = bg) #saved bg 对象
打印(rate_adj)
汇率转换
最后一步是使用原始数据的原始单位、呼吸计的有效容积和其他实验数据(包括归一化为空白测量值)将速率转换为所需的输出单位(图 9B)。输出可以是绝对呼吸速率,即整个样本的呼吸速率,也可以是质量或表面积特定的速率。表面积比速率是此处使用的输出,具体而言是绝对速率除以试样的表面积(图9C)。
如上所述,该系统是为测量非常小的标本而开发的。因此,我们预计低值和潜在重叠与空白测量值重叠。预计在空白内会有一定程度的信号,当检查时,这些值在一般实验噪声的预期范围内,可能是由于探头漂移、轻微的温度变化或探头上的气泡造成的。根据设计,由于试样尺寸小,因此使用的有效体积小,因此使用坯料在这里尤为重要,尤其是在每次运行时。此处已将代表性值作为示例(图 10)。鉴于试样尺寸较小,我们建议在每次运行时使用空白,以标准化每次运行的测量。
然后,这些空白值用于标准化治疗测量值。鉴于珊瑚除了产生氧气外还会呼吸,代谢率可以从负值到正值不等。这里给出了从微呼吸工具检测到的呼吸值范围的代表性结果的示例。这些结果是从对单个珊瑚幼体的成功实验中确定的(图10)。总体而言,鉴于样本量较小,预计在此示例数据集中很难检测到呼吸(根据设计);这凸显了这种方法在捕获这种低信号阈值方面的价值。这些具有代表性的结果显示了在测试的最小样本尺寸下在黑暗中的呼吸,强调了该系统的最小检测阈值。我们还在两种条件下(控制应力和高温应力)下进行了测量。在对每次运行测量的空白进行标准化后,应力处理的值范围从接近零(对照)到中位数 ~-5e-5 。不出所料,呼吸很低。这些结果清楚地显示了坯料的代表性值,以及这些非常小的样品的对照与高温比较。

图 1:用于珊瑚全息(珊瑚动物 + 共生体)或任何小型生物 (<1 mm) 生理表征的新型微量呼吸测量工具的示意图。 制作了定制的呼吸测量室(编号1;1.1-1.6)。其中包括带有氧传感器点(1.2)的盖子(1.1),以及将单个幼体(1.3)放置在设置在磁力搅拌器(1.5)顶部的流通支架(1.4)上,所有这些都适合玻璃室(1.6)。控制器 (2) 通过适合盖子 (1) 并连接到计算机 (3) 的光纤电缆连接到点上。加热器/冷却器 (4) 通过流过的水(用 V 形箭头表示方向)连接到呼吸测量板 (5),该水位于搅拌器板 (6) 的顶部,带有齿轮 (7),由电机 (8) 和电源 (9) 提供动力。 请点击这里查看此图的较大版本.

图 2:微量呼吸计设置。 有多种选择,包括 (A) 一个呼吸测量板,或 (B) 连接到多个板。 请点击这里查看此图的较大版本.

图 3:呼吸测量板顶部的定制磁力搅拌器板。 每个腔室都有 (A) 下方的磁力搅拌器齿轮,(B) 由电机驱动,(C) 呼吸计板通过管道连接到加热器/冷却器。 请点击这里查看此图的较大版本.

图 4:自定义呼吸测量室设置。 (A) 组件(从左到右:盖子、玻璃瓶、支架、1.5 ml 刻度管和搅拌棒)。(B) 试样所在的单个流通架。(C) 流通式支架的自上而下视图。(D) 并将支架放在玻璃瓶内,并拧上盖子。 请点击这里查看此图的较大版本.

图 5:放置在搅拌板内的玻璃瓶。 (A) 定制搅拌器板,带有 (B) 带有盖子设置的完整玻璃瓶的特写。通过这里的盖子(棕色点)可以看到幼年珊瑚,在扎带的顶部,光纤放置在盖子开口处。 请点击这里查看此图的较大版本.

图 6:腔室倒置放置,准备校准。 请点击这里查看此图的较大版本.
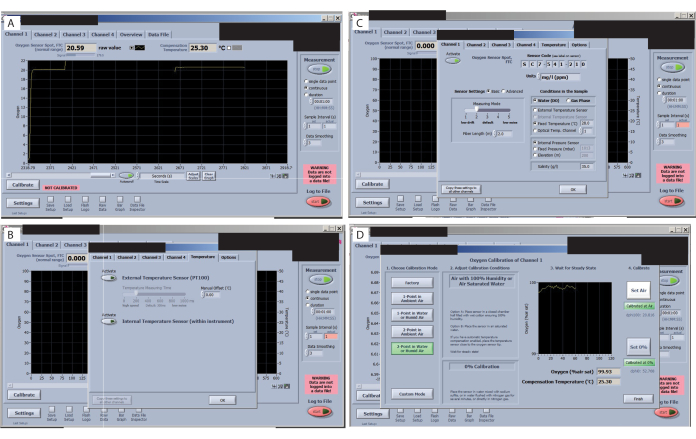
图 7:氧气测量软件中的关键步骤。 (A) 检查每个传感器的信号。本研究和传感器的最佳信号显示在氧传感器点 FTC(正常范围)中。(B) 检查信号漂移。(C) 设置并检查处理温度。(D) 设置并检查 0% 和 100% 校准。 请点击这里查看此图的较大版本.

图 8: respR 分析输出步骤 I. (A) 检查命令和输出。(二)检查费率稳定性。(C) 确定最线性速率。 请点击这里查看此图的较大版本.
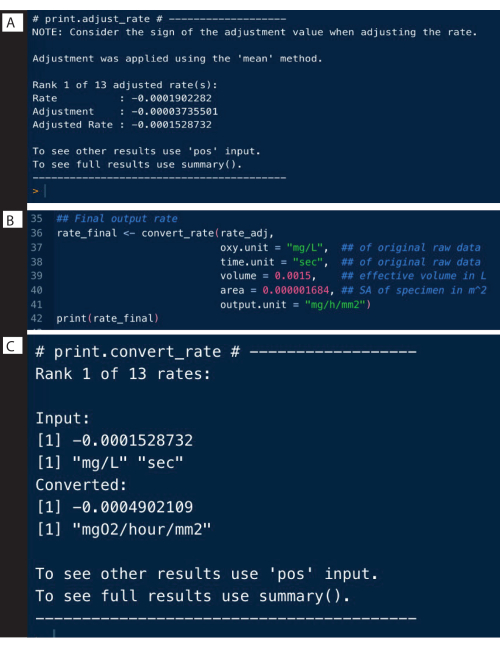
图 9: respR 分析输出步骤 II. (A) 调整背景速率,(B) 转换和 (C) 检查速率。 请点击这里查看此图的较大版本.
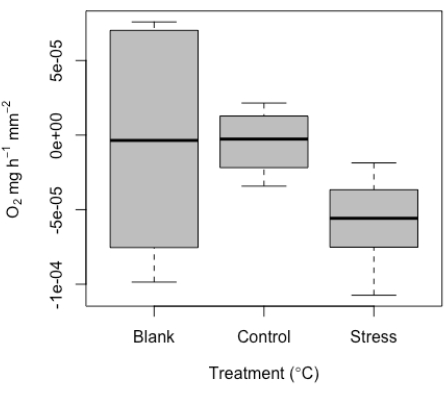
图 10:显微呼吸测量工具产生的代表性结果。 复制个体珊瑚幼体的中位呼吸(O2 ±标准误差),包括空白值以及受控和高温胁迫条件下个体的呼吸。 请点击这里查看此图的较大版本.
视频 1:在测量过程中呼吸测量室的自上而下视图,里面有幼年珊瑚。请按此下载此影片。
表1:呼吸测量仪组件的成本估算。请按此下载此表格。
讨论
这项工作概述了定制微呼吸测量装置的构建,该装置可用于量化小型无柄水生生物消耗和产生的氧气量。该协议的关键组件包括腔室的设置,包括光斑,以及使用 respR 软件包校准低信号,其中低信号可以定义为以浅或嘈杂斜率为特征的速率。定制腔室及其设置允许检测低信号,而 R 包的使用有助于防止出现浅或嘈杂的斜率可能导致结果误读(例如,假阳性)的问题。
其他用户可能需要进行的潜在修改包括将感兴趣的生物体固定在定制的腔室内。在这种情况下,使用一个小的刚性扎带和水族箱胶水将单个幼鱼固定在塑料底座上,然后将其粘在领带上。应该注意的是,在这个实验中,珊瑚幼体被安置在黑色塑料布上。这种塑料可以很容易地去除珊瑚幼体,这些幼体有效地从塑料上滑落,以免在去除过程中对它们造成身体伤害。珊瑚幼体附着在它们定居的基质上,因此建议将它们沉降在类似的塑料材料上,使用人造肽16 ,以方便它们在粘合过程中去除。为了进一步减少处理压力和对呼吸反应的影响,建议让安装在扎带上的珊瑚适应 1-2 周,这在许多成年珊瑚压力实验中很常见。可能需要进行其他修改,以将生物体固定在盖子上的斑点上方并允许水循环。另一个关键的故障排除步骤涉及信号检测,特别是在应确定速率的氧气时间序列的斜率上。归根结底,这归结为使用良好的判断来排除明显不稳定的数据,以及 respR 中的函数,允许从一致选择的区域或通过识别数据的线性区域自动提取速率。有关如何执行此操作的更多示例,请访问 respR 网站。
开发这种方法是为了将呼吸下限的测量扩展到极小的无柄海洋无脊椎动物。明显的局限性是,与为较大生物质设计的方案相比,该方案可能更容易出现假阳性。然而,鉴于这是设计的目的 - 测量这些下限 - 这已被考虑在设计中,并且该过程可以与 respR 软件包一起使用,以更好地防止误报。同样重要的是要承认存在其他系统来测量呼吸30,以及测量小型生物体,包括对体积小于此的单个桡足类动物31 的呼吸测量(~0.5-1 mL),但要么昂贵,要么缺乏特定成分(搅拌能力)。然而,与商业系统(例如,Core Microplate系统)相比,该系统是开源的,成本相对较低。该系统还包含其他系统可能缺乏的关键方法考虑因素,例如搅拌。内部搅拌棒功能对于复制许多海洋生物(例如, 通过 游泳的桡足类动物)的自然水混合至关重要,这通常是不可能的,并且可能使数据在很大程度上无法使用。相比之下,其他可用的混合方法包括将整个呼吸计放置在一个巨大的摇杆工作台上,这需要额外的设备,并且混合或 通过 振动混合的成功有限,这可能会对生物体造成干扰。出于这个原因,这是唯一可以对幼年珊瑚或其他非常小的无柄生物进行呼吸测量的系统。作为参考,这里包括的标本的大小范围为 2.1 至 3.6 个息肉(仅相当于几个月大),最小到最大平均面积为 1.3 至 4.5 mm2。
呼吸测量法是生态学研究中的一项基本措施,为此目的存在许多方法。然而,这些现有方法中的大多数都针对高生物量样品,包括整条鱼、珊瑚碎片或海草32,33,34。这种方法是第一个使用个体珊瑚幼体的方法。此外,这种方法还有许多潜在的应用,因为它提供了有关生物体功能的关键生理信息。这对于希望表征基线健康估计的研究可能很重要35,了解急性或长期压力在珊瑚个体发育过程中的作用,例如热应激36,或提供管理人员可以设置的阈值以帮助保护和改善珊瑚礁的健康 37.鉴于珊瑚是一个整体,而共生体群落在这个阶段和整个生命的第一年相对灵活38,将呼吸测量数据与群落随时间的变化配对,以充分了解整个生物体的功能。重要的是,这种方法有助于"开放科学"技术,有助于为创建可以公开共享、改进和标准化的自定义实验设置提供大纲。
披露声明
作者没有什么可透露的。
致谢
作者要感谢 Sam Noonan 的帮助和建议,感谢 Sven Uthicke 使用初始呼吸测量室,感谢 Ben Shelab 的工程插图,感谢澳大利亚海洋科学研究所的呼吸测量室适配器和支架的定制加工研讨会。这些珊瑚是根据以下大堡礁海洋公园许可证收集的,编号为 AIMS G12/35236.1。珊瑚不需要道德许可。
材料
| Name | Company | Catalog Number | Comments |
| Cost | |||
| (1.1 – 1.6) Custom respirometry chambers | LabGlass Party Ldt. | 1.5 ml | $407.26 |
| 1.1 lids | AIMS workshop | Vial GL25 thread | ~$10 |
| 1.2 fiber-optics spots (FireStingO2 II fiberoptic optodes) | PyroScience | Oxygen sensor spots, 125 µm PET foil, Ø5 mm, with optical isolation, SN: 183801947 | $41.25 AUD each |
| 1.3 individual organism | NA | NA | NA |
| 1.4 flow-through stand | AIMS workshop | Custom | included in points 5 and 6 price (the workshop gave me an estimate of the lids, stand with gears, motor, incubation flow through |
| 1.5 magnetic stirrer | Any manufactuer is suitable | NA | ~$2? |
| 1.6 glass chamber (vial GL25 thread x 20 mm high, with bump/ridge, flat-ground rim, screw cap with hole, Labglass Pty Ltd, Stafford QLD) | Labglass Pty Ltd, Stafford QLD | Vial GL25 thread x 20 mm high, with bump/ridge, flat-ground rim, screw cap with hole | $50.9 AUD |
| 2 FireSting controller (2) | PyroSciences | NA | 4 sensors is 4000 Euros. 8 sensors used here. |
| 3 computer | NA | NA | NA |
| 4 heater/chiller | VWR International | NA | Small models around $4,000 AUD |
| 5 respirometry plate platform | AIMS workshop | 34 cm x 26 cm x 3 cm (although any dimensions are adequate to fit desired number of chambers) | $1250 AUD |
| 6 stirrer plate with gears (7) | AIMS workshop | 34 cm x 26 cm x 3 cm | $1250 AUD |
| 8 powered by the motor | AIMS workshop | Custom | $700 AUD |
| 9 power supply | Non-specific | NA | ~$300 AUD |
| Aquarium glue | Seachem reef glue | 20g | $14 |
| Oxygen Logger Software | PyroScience | NA | NA |
| Polypipe and connectors | John Guest | NA | $20 |
| Sodium Sulfite | Sigma | S0505-250G (CAS number 7757-83-7) | $54 |
参考文献
- Quigley, K. M. A fast, precise, in-vivo method for micron-level 3D models of corals using dental scanners. Methods in Ecology and Evolution. 13 (10), 2159-2166 (2022).
- Svendsen, M. B. S., Bushnell, P. G., Steffensen, J. F. Design and setup of intermittent-flow respirometry system for aquatic organisms. Journal of Fish Biology. 88 (1), 26-50 (2016).
- Lighton, J. R. B. Measuring Metabolic Rates: a Manual for Scientists. , Oxford University Press. (2018).
- Carey, N., Harianto, J., Byrne, M. Sea urchins in a high-CO2 world: partitioned effects of body size, ocean warming and acidification on metabolic rate. The Journal of Experimental Biology. 219 (Pt 8), 1178-1186 (2016).
- Clark, T. D., Sandblom, E., Jutfelt, F. Aerobic scope measurements of fishes in an era of climate change: respirometry, relevance and recommendations. The Journal of Experimental Biology. 216 (Pt 15), 2771-2782 (2013).
- Voolstra, C. R., et al. Extending the natural adaptive capacity of coral holobionts. Nature Reviews Earth & Environment. 2 (11), 747-762 (2021).
- Hoegh-Guldberg, O. Climate change, coral bleaching and the future of the world's coral reefs. Marine and Freshwater Research. 50 (8), 839-866 (1999).
- Morris, L. A., Voolstra, C. R., Quigley, K. M., Bourne, D. G., Bay, L. K. Nutrient availability and metabolism affect the stability of coral-symbiodiniaceae symbioses. Trends in Microbiology. 27 (8), 678-689 (2019).
- Yellowlees, D., Rees, T. A. V., Leggat, W. Metabolic interactions between algal symbionts and invertebrate hosts. Plant, Cell & Environment. 31 (5), 679-694 (2008).
- Rädecker, N., et al. Using Aiptasia as a model to study metabolic interactions in cnidarian-Symbiodinium symbioses. Frontiers in Physiology. 9, 214(2018).
- Matthews, J. L., et al. Optimal nutrient exchange and immune responses operate in partner specificity in the cnidarian-dinoflagellate symbiosis. Proceedings of the National Academy of Sciences. 114 (50), 13194-13199 (2017).
- Davy, S. K., Allemand, D., Weis, V. M. Cell biology of cnidarian-dinoflagellate symbiosis. Microbiology and Molecular Biology Reviews. 76 (2), 229-261 (2012).
- Weis, V. M. Cellular mechanisms of Cnidarian bleaching: stress causes the collapse of symbiosis. The Journal of Experimental Biology. 211 (Pt 19), 3059-3066 (2008).
- Baker, D. M., Freeman, C. J., Wong, J. C. Y., Fogel, M. L., Knowlton, N. Climate change promotes parasitism in a coral symbiosis. The ISME Journal. 12 (3), 921-930 (2018).
- Chakravarti, L. J., van Oppen, M. J. H. Experimental evolution in coral photosymbionts as a tool to increase thermal tolerance. Frontiers in Marine Science. 5, 227(2018).
- Quigley, K. M., Alvarez Roa, C., Beltran, V. H., Leggat, B., Willis, B. L. Experimental evolution of the coral algal endosymbiont, Cladocopium goreaui: lessons learnt across a decade of stress experiments to enhance coral heat tolerance. Restoration Ecology. 29 (3), e13342(2021).
- Buerger, P., et al. Heat-evolved microalgal symbionts increase coral bleaching tolerance. Science Advances. 6 (20), eaba2498(2020).
- Bieri, T., Onishi, M., Xiang, T., Grossman, A. R., Pringle, J. R. Relative contributions of various cellular mechanisms to loss of algae during cnidarian bleaching. PLoS One. 11 (4), e0152693(2016).
- Tremblay, P., Gori, A., Maguer, J. F., Hoogenboom, M., Ferrier-Pagès, C. Heterotrophy promotes the re-establishment of photosynthate translocation in a symbiotic coral after heat stress. Scientific Reports. 6, 38112(2016).
- Tremblay, P., Grover, R., Maguer, J. F., Hoogenboom, M., Ferrier-Pagès, C. Carbon translocation from symbiont to host depends on irradiance and food availability in the tropical coral Stylophora pistillata. Coral Reefs. 33 (1), 1-13 (2014).
- Wooldridge, S. A. Is the coral-algae symbiosis really 'mutually beneficial' for the partners. Bioessays. 32 (7), 615-625 (2010).
- Wooldridge, S. A. Breakdown of the coral-algae symbiosis: towards formalising a linkage between warm-water bleaching thresholds and the growth rate of the intracellular zooxanthellae. Biogeosciences. 10 (3), 1647-1658 (2013).
- Coles, S. L., Jokiel, P. L. Effects of temperature on photosynthesis and respiration in hermatypic corals. Marine Biology. 43, 209-216 (1977).
- Marubini, F., Davies, P. S. Nitrate increases zooxanthellae population density and reduces skeletogenesis in corals. Marine Biology. 127, 319-328 (1996).
- Iglesias-Prieto, R., Matta, J. L., Robins, W. A., Trench, R. K. Photosynthetic response to elevated temperature in the symbiotic dinoflagellate Symbiodinium microadriaticum in culture. Proceedings of the National Academy of Sciences. 89 (21), 10302-10305 (1992).
- Karako-Lampert, S., Katcoff, D. J., Achituv, Y., Dubinsky, Z., Stambler, N. Responses of Symbiodinium microadriaticum clade B to different environmental conditions. Journal of Experimental Marine Biology and Ecology. 318 (1), 11-20 (2005).
- Blanckaert, A. C. A., Reef, R., Pandolfi, J. M., Lovelock, C. E. Variation in the elemental stoichiometry of the coral-zooxanthellae symbiosis. Coral Reefs. 39, 1071-1079 (2020).
- Harianto, J., Carey, N., Byrne, M. respR-An R package for the manipulation and analysis of respirometry data. Methods in Ecology and Evolution. 10 (6), 912-920 (2019).
- Gamble, S., Carton, A. G., Pirozzi, I. Open-top static respirometry is a reliable method to determine the routine metabolic rate of barramundi. Lates calcarifer. Marine and Freshwater Behaviour and Physiology. 47 (1), 19-28 (2014).
- Burford, B. P., et al. Rapid range expansion of a marine ectotherm reveals the demographic and ecological consequences of short-term variability in seawater temperature and dissolved oxygen. The American Naturalist. 199 (4), 523-550 (2022).
- Morozov, S., McCairns, R. J. S., Merilä, J. FishResp: R package and GUI application for analysis of aquatic respirometry data. Conservation Physiology. 7 (1), coz003(2019).
- Leclercq, N., Gattuso, J. -P., Jaubert, J. Primary production, respiration, and calcification of a coral reef mesocosm under increased CO2 partial pressure. Limnology and Oceanography. 47 (2), 558-564 (2002).
- Anthony, K. R. N., Hoegh-Guldberg, O. Variation in coral photosynthesis, respiration and growth characteristics in contrasting light microhabitats: an analogue to plants in forest gaps and understoreys. Functional Ecology. 17, 246-259 (2003).
- Moulin, L., et al. Long-term mesocosms study of the effects of ocean acidification on growth and physiology of the sea urchin Echinometra mathaei. Marine Environmental Research. 103, 103-114 (2015).
- Quigley, K. M., Bay, L. K., van Oppen, M. J. H. Genome-wide SNP analysis reveals an increase in adaptive genetic variation through selective breeding of coral. Molecular Ecology. 29 (12), 2176-2188 (2020).
- Brunner, C. A., Ricardo, G. F., Uthicke, S., Negri, A. P., Hoogenboom, M. O. Effects of climate change and light limitation on coral recruits. Marine Ecology Progress Series. 690, 65-82 (2022).
- Quigley, K. M., Alvarez Roa, C., Torda, G., Bourne, D., Willis, B. L. Co-dynamics of Symbiodiniaceae and bacterial populations during the first year of symbiosis with Acropora tenuis juveniles. MicrobiologyOpen. 9 (2), e959(2020).
- Quigley, K. M., Bay, L. K., Torda, G., Willis, B. L. Leveraging new knowledge of Symbiodinium community regulation in corals for conservation and reef restoration. Marine Ecology Progress Series, 600. , 245-253 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。