Method Article
Caractérisation physiologique de l’holobionte corallien à l’aide d’un nouvel outil de micro-respirométrie
Dans cet article
Résumé
Ce protocole décrit la mise en place et le fonctionnement d’un système de micro-respirométrie qui peut être utilisé pour étudier les caractéristiques physiologiques de l’holobionte corallien.
Résumé
L’activité métabolique, définie comme la somme des processus de l’organisme qui impliquent de l’énergie, est d’une importance cruciale pour comprendre la fonction et l’évolution de la vie sur terre. La mesure des taux métaboliques des organismes est donc au centre de l’explication des états physiologiques des organismes, de leurs rôles écologiques et de l’impact des changements environnementaux sur les espèces au sein des écosystèmes terrestres et aquatiques. Sur les récifs coralliens, des mesures du métabolisme ont été utilisées pour quantifier le fonctionnement de la symbiose entre les coraux et leurs symbiotes d’algues obligatoires (Symbiodiniaceae), ainsi que pour évaluer l’impact des facteurs de stress environnementaux, y compris le changement climatique, sur la santé des coraux. Malgré cette importance, il y a un manque de méthodes, et donc de données, relatives aux mesures du taux métabolique chez la progéniture corallienne, probablement en raison de leur petite taille. Pour combler cette lacune, cette étude visait à développer une configuration personnalisée pour mesurer la respiration des écologies des animaux marins de petite taille (gamme de tailles millimétriques). Cette configuration facile et peu coûteuse devrait permettre d’améliorer la mesure du taux métabolique. Cela sera essentiel pour la recherche écologique appliquée utilisant la production sexuée de coraux pour la restauration des récifs.
Introduction
La respiration est une mesure biologique critique qui signale l’activité métabolique globale d’un organisme, mais comme d’autres traits critiques (croissance), elle est difficile à mesurer chez les petits organismes1. La respiration peut être définie comme l’oxydation de molécules organiques par l’utilisation d’oxygène. Ce processus génère l’énergie chimique nécessaire à la fonction cellulaire (c’est-à-dire au métabolisme), qui est essentielle à la survie des organismes. Alternativement, le métabolisme anaérobie entraîne une dette d’oxygène2. Les taux de respiration peuvent être déterminés à l’aide d’optodes qui mesurent l’utilisation (et donc la diminution) de la concentration d’oxygène au fil du temps dans une chambre fermée, une pratique généralement connue sous le nom de respirométrie3. Étant donné que la majorité des organismes ne stockent pas d’oxygène, le taux de métabolisme peut être déduit de la corrélation directe entre la respiration et l’utilisation du carbone. Pour cette raison, les taux de respiration peuvent être convertis en consommation quotidienne de carbone, qui informe les fonctions métaboliques essentielles telles que la croissance, la reproduction et la capacité à maintenir l’homéostasie métabolique pendant les périodes de stress environnemental 4,5, y compris les conditions de canicule qui entraînent généralement un stress ou un blanchissement chez les coraux.
Les récifs coralliens déclinent à un rythme accéléré dans le monde. L’animal corallien abrite un consortium de partenaires (comprenant des dinoflagellés Symbiodiniaceae, des champignons, des bactéries et des virus), collectivement appelés « holobionte »6. À mesure que les températures des océans augmentent, les coraux, et donc les récifs coralliens, subissent une pression croissante pour survivre, car les températures élevées entraînent la perte des dinoflagellés Symbiodiniaceae (ci-après symbiotes), un phénomène connu sous le nom de blanchissement7. De nombreux nutriments ne sont pas disponibles pour les coraux dans les eaux tropicales oligotrophes, notamment l’azote inorganique et le phosphore8. Pour y faire face, les coraux forment une symbiose nutritionnelle obligatoire avec leurs symbiotes dinoflagellés (Symbiodiniaceae), qui fournissent la majorité des nutriments nécessaires à l’hôte corallien pour survivre et déposer leurs squelettes de carbonate de calcium9. Une symbiose fonctionnelle peut être caractérisée par des niveaux élevés de partage du carbone entre les partenaires10,11, et la régulation de la symbiose implique une homéostasie dynamique12.
Pendant le stress thermique, cette régulation dynamique et cette communication sont perturbées, ce qui entraîne une dysbiose et un blanchissement (examiné dans la référence13). Les mesures métaboliques, telles que la photosynthèse et la respiration, ont donc le potentiel d’élucider à la fois les états dysbiotiques sains et non régulés des coraux, et la mesure précise de ces processus à travers l’ontogenèse est essentielle pour comprendre le fonctionnement des organismes. Ceci est particulièrement important car la fréquence et l’ampleur des événements de blanchissement de masse augmentent, avec le potentiel d’influencer les changements dans le partage des nutriments des symbiotes, où le transfert de carbone diminue à mesure que les températures augmentent14. Cela pourrait être dû à des mécanismes dirigés par le symbiote séquestrant les nutriments ou à des compromis physiologiques difficiles (tolérance thermique accrue mais diminution de la survie de l’hôte 15,16,17). Les perturbations de la symbiose peuvent provenir à la fois du symbiote et de l’hôte, bien qu’un facteur majeur soit probablement le dysfonctionnement cellulaire du symbiote18. Cependant, le stress causé par l’augmentation de la température de l’eau de mer déstabilise cette symbiose ; Le partage du carbone entre le symbiote et l’hôte est diminué19,20, et la famine du corail peut s’ensuivre. Cela peut se traduire par une diminution des réserves de lipides et de glucides dans les coraux en raison de l’utilisation accrue de l’hôte (« catabolisme accru du carbone fixe »), probablement en raison d’une diminution du partage par les symbiotes11. Parallèlement à la contribution de la photosynthèse et de la respiration des symbiotes des coraux, la respiration de l’animal corallien est une mesure importante pour comprendre la santé des coraux, les impacts du blanchissement et de l’échange de nutriments entre ces partenaires, et la croissance de l’holobionte, un phénotype pertinent pour survivre aux changements environnementaux 8,21,22. Enfin, étant donné que de nombreux coraux sont symbiotiques, l’utilisation de la respirométrie pour caractériser la photosynthèse en plus de la respiration est particulièrement utile pour contextualiser les rapports P :R et comprendre si la symbiose est stable ou non (e.g., référence23).
Les changements environnementaux provoquent donc des changements dans les bilans énergétiques du corail et de ses symbiotes, entraînant des différences de croissance14. Pour y faire face, l’hôte corallien peut augmenter sa respiration et son utilisation des lipides pour répondre à ses besoins métaboliques ; Le stress thermique peut réduire la productivité nette de 60 % en raison de cette respiration accrue14, mesurée par une modification de l’oxygène dissous. Les symbiodiniacées peuvent également augmenter l’assimilation de l’azote et la rétention du carbone14,24, puis utiliser ces réserves pour déplacer l’énergie vers leurs propres mécanismes de réparation et de protection25,26. L’équilibre de N et C est important pour réguler la croissance, et P en particulier27, qui peut se manifester par une régulation dynamique de l’abondance des symbiotes. En effet, les preuves recueillies sur les coraux de grandes étendues récifales (>1 000 km) suggèrent que les hôtes ont la capacité de limiter la croissance des symbiotes par la régulation du P, bien que cela varie selon les espèces de coraux27.
Prises ensemble, ces études suggèrent un gain de tolérance à la chaleur avec une diminution concomitante de la production ou de la translocation des nutriments (c’est-à-dire la propension à la symbiose) en raison des changements environnementaux. Des méthodes puissantes sur un seul juvénile, telles que la quantification de l’utilisation de l’oxygène par micro-respirométrie, devraient donc être utilisées pour comprendre les mécanismes fondamentaux liés au métabolisme, puis appliquées à des questions de conservation telles que la compréhension de l’acquisition de la tolérance à la chaleur. Il est présenté ici comme un outil de micro-respirométrie pour les mesures physiologiques, destiné à interroger la relation nutritionnelle entre les juvéniles coralliens et leurs symbiotes algals, mais adapté à d’autres petits organismes marins.
L’utilisation ou la production d’oxygène par les organismes peut être mesurée en les plaçant dans des chambres de respirométrie individuelles hermétiquement fermées ou des « respiromètres » (ci-après dénommés « chambres »), où la variation d’oxygène est mesurée à l’aide d’optodes3. Les optodes sont des sondes qui mesurent la concentration en oxygène à l’aide d’impulsions lumineuses, et l’enregistrement des mesures dans le temps permet de calculer les taux de respiration et/ou de photosynthèse. En pratique, la mesure de la respiration est similaire à la mesure de la photosynthèse chez les coraux, sauf que les coraux sont incubés dans l’obscurité totale. En soustrayant la respiration quotidienne totale du corail et des symbiotes de la photosynthèse quotidienne totale, on obtient un différentiel d’oxygène (delta d’oxygène)2,3. En général, les organismes utilisent plus d’oxygène qu’ils n’en produisent, ce qui entraîne un déficit. Cela peut être converti en équivalents carbone puisque l’oxygène et le carbone sont consommés dans un rapport fixe2. L’excédent de carbone peut être utilisé par le corail pour la croissance, la synthèse et la reproduction du mucus, et d’autres besoins métaboliques essentiels12.
Ce protocole décrit une méthode de micro-respiration (figure 1) qui a été utilisée pour mesurer les taux de respiration (R) pour des juvéniles de corail individuels à l’aide d’une chambre en verre de 1,5 mL sur mesure (flacon avec filetage GL25 et 20 mm de haut, avec bosse/crête, rebord plat et bouchon à vis avec trou ; voir le tableau des matériaux) rempli d’eau de mer filtrée de 0,5 μm. Des optodes à fibre optique (voir Tableau des matériaux) ont été insérés dans chaque chambre par un trou sur le côté du couvercle. Chaque corail individuel était attaché au-dessus d’une plate-forme d’agitateur à mailles dures et à circulation au-dessus d’un agitateur magnétique pour assurer un mélange adéquat de l’eau dans la chambre. Dans l’exemple représentatif ici, deux témoins ou « blancs » (chambres identiques à l’exception de la présence de l’échantillon) ont été mesurés simultanément aux trois chambres d’échantillons répétés, car nous avions plusieurs contrôleurs fonctionnant simultanément. Cependant, l’exemple de configuration (Figure 2) ne montre que l’utilisation de quatre canaux ; Cela peut être augmenté en utilisant plusieurs contrôleurs et plusieurs supports à flux continu. La température peut également être contrôlée dans ce système en immergeant chaque chambre dans un bain-marie sur mesure avec des températures d’eau prédéfinies (27 °C pour le contrôle ou 31 °C pour la contrainte thermique élevée dans les exemples de données ici) à l’aide d’un système de recirculation (débit continu et doux réglé à 75 L/h). La plate-forme de plaque d’agitation et la plaque d’agitation avec engrenages peuvent être de n’importe quelle taille et peuvent être aussi grandes ou aussi petites que nécessaire pour accueillir le nombre de chambres en verre. Dans cet exemple, la plate-forme et la plaque mesuraient environ 34 cm x 26 cm x 3 cm (Table des matériaux). L’étalonnage des optodes a été effectué avant chaque essai à l’aide de deux solutions étalons représentant une saturation en oxygène de 0 % et 100 % à la température et à la salinité de l’eau appropriées pour ce cadre expérimental.
Protocole
1. Mise en place de l’équipement et des coraux dans les chambres respiratoires
REMARQUE : Des coraux prêts à se reproduire (c’est-à-dire ceux qui avaient des faisceaux d’œufs et de spermatozoïdes pigmentés de rose visibles à partir de rameaux fragmentés des colonies de l’espèce Acropora tenuis ) ont été délogés du récif de l’île Magnetic (19° 6,249'S ; 146° 51,728'E) le jour d’une pleine lune en octobre 2018 (numéro de permis : G12/35236.1), collectés et amenés au laboratoire pour le frai des coraux. où les coraux juvéniles étaient élevés et cultivés.
- Le jour des mesures, connectez les deux plaques de bain-marie à l’aide d’un polytuyau bleu et de connecteurs (voir tableau des matériaux ; Figure 1 [5], Figure 2A,B). Ceux-ci serviront d’incubateurs après le raccordement du polytude bleu au chauffe-eau/refroidisseur. Assurez-vous que la plaque du moteur est clairement visible à travers les plaques transparentes du bain-marie lorsque les chambres de respirométrie ne sont pas en place.
- Connectez les deux tuyaux au chauffe-eau/refroidisseur (voir tableau des matériaux). Allumez le chauffe-eau/refroidisseur puis réglez la température expérimentale souhaitée (27 °C ou 31 °C).
- Connectez la base du bain-marie (étape 1.1) à la plaque du moteur de base avec les engrenages magnétiques (Figure 1 [6, 7] et Figure 3A), puis connectez cet ensemble à une source d’alimentation (Figure 3B). Allumez la source d’alimentation pour activer les engrenages, ce qui activera les barres d’agitation dans les chambres.
- Moduler le débit d’eau au besoin (p. ex., débit continu et doux réglé à 75 L/h avec agitation lente à 30 tr/min) à l’aide des boutons du connecteur de la vanne (figure 3C).
- Pour assembler la chambre de respirométrie, ajoutez la bille magnétique (Figure 1 [1.5]) dans la chambre en verre (Figure 1 [1.6]), puis la base du support en plastique opaque (Figure 1 [1.4]) dans la chambre en verre (Figure 4A). La taille de la chambre et de la perle magnétique dépendra de l’organisme et du système d’étude d’intérêt.
REMARQUE : Il y a des trous dans la base en plastique pour permettre à l’eau de s’écouler et de circuler grâce au mouvement de la perle magnétique dans le fond. - Collez le corail à l’aide de colle d’aquarium (voir le tableau des matériaux) sur l’attache zippée noire placée dans la base en plastique (Figure 4B-D). Pour ce faire, collez d’abord le corail juvénile sur un morceau de plastique noir, puis collez ce morceau sur la base en plastique. Une fois le corail solidement fixé (le durcissement de la colle est presque instantané), vissez le couvercle avec le joint torique (Figure 4A) sur la chambre en verre. Effectuez ces actions sous l’eau dans un bassin séparé pour vous assurer qu’il n’y a pas d’air dans la chambre de respirométrie.
REMARQUE : Le volume d’eau dans le respiromètre (c.-à-d. volume efficace = 1,5 ml) a été déterminé par immersion complète de la chambre sous l’eau. L’hypothèse est que, par rapport au volume d’eau, le déplacement dû à la masse/densité du très petit corail est négligeable. Le tube de microcentrifugation de 1,5 mL est illustré ici à l’échelle (Figure 4A). - Placez fermement les chambres dans les bains-marie (Figure 5A). Assurez-vous que les chambres en verre sont en contact avec l’eau à température contrôlée pour l’expérience.
- Connectez les câbles à fibre optique Ø2 (voir tableau des matériaux) de manière à ce qu’ils soient en contact avec les points du capteur d’oxygène (ci-après dénommés points ; voir tableau des matériaux) en les insérant dans le trou percé sur le côté des chambres du couvercle. Ces petits points sont sensibles à l’oxygène et détectent et transmettent le signal de l’intérieur de la chambre à travers le câble à fibre optique.
- Ajoutez du ruban de plomberie (ruban auto-obturant blanc fin) pour que le câble soit bien ajusté et pour le laisser rester fermement à l’intérieur de la chambre à eau. Assurez-vous que le corail individuel peut être vu (comme on le voit sur la figure 5B), avec les tentacules bruns vers le haut, à l’intérieur de la chambre (Figure 5B, vidéo 1).
REMARQUE : Les estimations du coût des composants de l’appareil sont fournies dans le tableau 1.
- Ajoutez du ruban de plomberie (ruban auto-obturant blanc fin) pour que le câble soit bien ajusté et pour le laisser rester fermement à l’intérieur de la chambre à eau. Assurez-vous que le corail individuel peut être vu (comme on le voit sur la figure 5B), avec les tentacules bruns vers le haut, à l’intérieur de la chambre (Figure 5B, vidéo 1).
2. Mode opératoire normalisé pour la mesure de la respiration à l’aide du système O2
- Ouvrez le logiciel de mesure de l’oxygène (voir Tableau des matériaux).
- Mesurez la température de la pièce où l’étalonnage sera effectué. Cela sera nécessaire plus tard pour l’étape d’étalonnage (étape 2.8).
- Assemblez les capteurs optiques et les capuchons. Pour ce faire, connectez toutes les fibres optiques au port correspondant du module O2 . Assurez-vous de faire correspondre le capuchon 1 avec le capteur 1, le capuchon 2 avec le capteur 2, et ainsi de suite.
- Pour configurer les chambres pour l’étalonnage, humidifiez d’abord un morceau d’éponge propre avec un peu d’eau osmosée (OI) et insérez-le dans chaque chambre.
REMARQUE : L’éponge ne doit pas couler, seulement être humide. Il peut couler sur le point de fibre optique. Assurez-vous que la tache n’est pas mouillée avant de passer à l’étape suivante. - Placez les chambres à l’envers avec la fibre optique correspondante (Figure 6). Cela permettra de dévisser la chambre sans toucher la fibre optique et d’ajouter le sulfite de sodium pour l’étalonnage à 0%.
- Vérifiez le signal de chaque capteur avant le début de l’étalonnage. Parcourez tous les onglets de l’interface du logiciel et vérifiez la valeur du signal (coin supérieur gauche) (Figure 7A), en vous assurant qu’ils ne varient pas de manière significative. Consultez le manuel O2 pour connaître les valeurs acceptables pour le dispositif expérimental (selon l’organisme et les conditions d’intérêt). Pour cette configuration spécifique, à une température ambiante de 25,3 °C, un FTC (débit ponctuel du capteur d’oxygène à travers la plage normale de la cellule) de 20,59 avec un signal à 179,5 est acceptable.
- Ouvrez Programme et vérifiez les paramètres du logiciel pour confirmer qu’ils sont corrects, comme indiqué ci-dessous. Si la fenêtre contextuelle ne s’affiche pas immédiatement après l’ouverture du programme, cela peut être fait en cliquant sur le bouton Paramètres dans le coin inférieur gauche de l’interface du logiciel.
- Vérifiez que le capteur de température externe est activé (Figure 7B). Définissez le réglage sur Température fixe (Figure 7C). Ensuite, ajoutez la valeur de température ambiante et cliquez sur copier le paramètre sur tous les autres canaux.
- Définissez le paramètre sur Réduire la dérive du signal (Figure 7C). Ensuite, sélectionnez Paramètres du capteur et sélectionnez le niveau 2. Sinon, si vous utilisez de petits volumes, la dérive sera si élevée qu’il sera difficile de calibrer.
- Vérifiez les paramètres généraux des chaînes. Appuyez sur OK si cela est adéquat. Cliquez sur Copier les paramètres sur tous les canaux, puis cliquez sur OK.
- Calibrez les capteurs. Pour l’étalonnage du canal 1, accédez à l’onglet Canal 1 et appuyez sur le bouton Calibrer . Sélectionnez 2 points dans l’eau ou l’air humide.
- Pour l’étalonnage de l’air, trempez un morceau de mousse dans l’eau, placez-le à l’intérieur de la chambre et attendez que le signal se stabilise (voir les images avant et après l’étalonnage de l’air). Lorsqu’il est stable, appuyez sur « set air ». Cliquez sur l’air > Calibrez > réglez l’air.
- Réglez l’étalonnage à 0 % et à 100 % (Figure 7D). Retirez la chambre du capuchon et placez-la dans le capuchon suivant afin que le signal d’étalonnage de l’air soit prêt lorsque l’étalonnage à 0 % dans le premier capteur est terminé. Utilisez une pipette de transfert et remplissez le bouchon de sulfite de sodium à 2 %. Attendez que le signal se stabilise.
REMARQUE : Le signal prend généralement plus de temps à se stabiliser par rapport à l’étalonnage de l’air. Si un message d’avertissement apparaît indiquant que les « valeurs sont hors de la plage typique », assurez-vous que le sulfite de sodium est frais. Répétez le même processus d’étalonnage pour tous les canaux. Préparez le sulfite de sodium en ajoutant 2 g dans 100 mL d’eau osmosée. - Une fois le calibrage terminé, rincez bien les chambres de respiration et séchez les chambres et les bouchons. Assurez-vous qu’il n’y a pas d’eau dans le trou de la fibre optique.
- Placez l’organisme (juvéniles de corail isolés, dans cet exemple) à l’intérieur des chambres de respiration et fermez-les avec des couvercles. Lorsque vous placez les couvercles, assurez-vous de le faire lorsque les chambres sont complètement immergées et qu’il n’y a absolument pas d’air à l’intérieur.
- Placez fermement les chambres dans la plaque d’agitation et connectez la fibre optique.
- Mettez l’alimentation sous tension. Assurez-vous que l’eau à l’intérieur des chambres est complètement mélangée. Réglez la température dans le refroidisseur/réchauffeur sur les températures expérimentales choisies.
- Allumez la pompe et le chauffage (étapes 1.2 et 1.4).
- Appuyez sur log sur l’interface du logiciel de mesure O2 pour démarrer l’enregistrement.
Résultats
Traitement et analyse des données
Bien qu’il existe de nombreuses méthodes pour traiter les données brutes des expériences de respirométrie, il est recommandé d’utiliser le package R respR28. Conformément au partage des protocoles ci-dessus, qui prônent la science ouverte et la reproductibilité, ce package permet de partager le traitement et l’analyse des données sous une forme facilement reproductible et a été conçu dans cet esprit. Il s’agit d’une plate-forme gratuite, open-source et agnostique du système de sonde, et facilement installable à partir de CRAN ou de GitHub. Le code complet et les exemples de respR sont maintenus et peuvent être trouvés à https://github.com/januarharianto/respR.
Le package respR dispose de fonctions permettant d’importer, de visualiser et d’effectuer un contrôle qualité sur les données de respirométrie, et de calculer les taux de respiration automatiquement ou à partir de régions choisies manuellement. Il peut également ajuster les taux de respiration de fond et les taux de conversion en unités de sortie couramment utilisées. Les étapes de traitement des données du système de micro-respirométrie sont détaillées ci-dessous. Dans cette étude, les données du système de respirométrie ont été utilisées comme exemple, mais le package accepte également les entrées de la majorité des systèmes de sondes d’oxygène disponibles dans le commerce ainsi que des objets de données R génériques. Plus de détails sur le package, y compris la documentation complète et les tutoriels, peuvent être trouvés sur le site Web du package à l’adresse https://januarharianto.github.io/respR/index.html.
Importation de données brutes
Le fichier de sortie brut (.txt) est importé. respR reconnaît le format et l’analyse en une trame de données R générique qui peut être utilisée dans les fonctions suivantes. Cependant, il est important de noter que cela est facultatif ; ces fichiers et pratiquement toutes les données de séries chronologiques sur l’oxygène peuvent également être importés à l’aide des fonctions de base (données ci-dessous) par toute personne ayant une connaissance de base de R.
#load respR
Bibliothèque(respR)
#Import ---
Données <- import_file (« file.txt »)
Fichier #Firesting-Pryo détecté
Inspection et visualisation des données
Une partie essentielle de toute tâche d’analyse de données consiste à tracer et à inspecter les données pour rechercher des anomalies ou des modèles évidents, ou même simplement pour aider à les comprendre. La fonction d’inspection est utilisée ici (Figure 8A), qui vérifie les problèmes communs aux données de respirométrie, tels que les valeurs non numériques ou manquantes.
#inspect une seule colonne d’oxygène
Insp <-inspecter(données, temps = 3, oxygène = 8, largeur = 0,2)
Cette fonction trace également la série temporelle de l’oxygène et calcule une vitesse mobile (panneau inférieur) pour aider à élucider comment cette vitesse peut changer au cours de l’expérience. Ces graphiques de taux glissants permettent d’indiquer les régions de ces courbes de taux à extraire. Dans le cas des taux métaboliques standard ou de routine, les régions souhaitées sont celles où le taux montre une stabilité (par exemple, après environ 3 000 ; Figure 8B).
Ici, la baisse de l’oxygène ne devient détectable qu’après environ la ligne 200 dans le panneau complet de la série temporelle. De tels modèles sont très courants dans les données de respirométrie ; Il y a souvent une longue période d’instabilité au début d’une expérience lorsque le système se stabilise et que le spécimen s’acclimate aux conditions expérimentales. Il est recommandé de ne sortir des taux de la série temporelle qu’après cette instabilité initiale, ce qui souligne également l’importance des visualisations.
Taux d’extraction
respR a deux fonctions pour extraire les fréquences respiratoires. La première est la fonction calc_rate(), qui permet d’extraire manuellement un débit en spécifiant une région de temps, une ligne ou un niveau d’oxygène. C’est une méthode très courante dans les analyses de respirométrie et une méthode parfaitement acceptable pour déterminer un taux tant que les critères de sélection sont décidés et appliqués de manière cohérente28.
Une méthode plus robuste et objective consiste à utiliser la fonction auto_rate(), qui identifie les régions linéaires des données. Ces régions sont celles dont le rythme respiratoire est maintenu de manière constante, attribué automatiquement à l’aide de l’apprentissage automatique. Cette fonction est également utile pour la détection de signaux faibles (comme dans les échantillons utilisés dans cette étude, en raison de la faible biomasse à cet âge). Cette fonction permet d’identifier les taux les plus linéaires, les plus minimaux et les plus maximaux à l’aide de méthodes indépendantes, objectives et statistiquement robustes28. L’exemple ici identifie une région linéaire se produisant autour des points temporels 3 000 à 5 000. Il convient de noter que plusieurs régions linéaires peuvent être identifiées, mais cette section est la région la mieux classée ou la plus linéaire (figure 8C).
#Determine taux le plus linéaire (c.-à-d. constant)
Tarif <-auto_rate(INSP)
Réglage de l’arrière-plan
Les taux de fond des expériences de contrôle peuvent être déterminés de la même manière que dans l’exemple ci-dessus, et peuvent être utilisés pour ajuster les taux d’échantillons à l’aide de la fonction adjust_rate() (Figure 9A ; notez que l’analyse complète n’est pas montrée ici, seulement l’ajustement). Des exemples complets sont détaillés sur le site Web de respR .
#Adjust taux pour le fond
rate_adj <-adjust_rate(taux, par = bg) #saved objet bg
imprimer(rate_adj)
Taux de conversion
La dernière étape consiste à convertir les débits en unités de sortie souhaitées, en utilisant les unités originales des données brutes, le volume effectif du respiromètre et d’autres données expérimentales, y compris la normalisation en mesures à blanc (figure 9B). Le résultat peut être un taux de respiration absolu, c’est-à-dire de l’ensemble de l’échantillon, ou un taux spécifique à la masse ou à la surface. Le taux spécifique à la surface était le résultat utilisé ici, qui est spécifiquement le taux absolu divisé par la surface de l’échantillon (figure 9C).
Comme nous l’avons vu plus haut, ce système a été mis au point pour mesurer de très petits échantillons. Par conséquent, nous nous attendions à des valeurs faibles et à un chevauchement potentiel avec des mesures à blanc. Un certain niveau de signal est attendu dans les blanks, et lorsqu’ils sont examinés, ces valeurs se situent dans la plage attendue du bruit expérimental général, peut-être en raison de la dérive de la sonde, de légers changements de température ou de bulles sur les sondes. De par leur conception et en raison de la petite taille de l’éprouvette, et donc du petit volume effectif utilisé, l’utilisation de flans est particulièrement importante ici, en particulier pour chaque tirage. Des valeurs représentatives ont été incluses ici à titre d’exemple (figure 10). Compte tenu de la petite taille de l’échantillon, nous recommandons l’utilisation des ébauches à chaque essai pour normaliser les mesures par essai.
Ces valeurs à blanc sont ensuite utilisées pour normaliser les valeurs de mesure de traitement. Étant donné que les coraux respirent en plus de produire de l’oxygène, le taux métabolique peut varier de valeurs négatives à positives. Un exemple de résultats représentatifs de la gamme de valeurs de respiration détectées à l’aide de l’outil de micro-respiration est donné ici. Ces résultats ont été déterminés à partir d’une expérience réussie sur des juvéniles de corail (Figure 10). Dans l’ensemble, on s’attendait à ce que la respiration soit difficile à détecter dans cet exemple d’ensemble de données (par conception), étant donné la petite taille des échantillons ; Cela souligne la valeur de cette méthode pour capturer ce seuil de signal faible. Ces résultats représentatifs montrent une respiration dans l’obscurité aux plus petites tailles d’échantillons testées, soulignant le seuil de détection minimum de ce système. Nous avons également mesuré dans deux conditions (contrôle et stress à haute température). Après normalisation des blancs mesurés par cycle, les valeurs variaient de près de zéro (contrôle) à une médiane de ~-5e-5 pour le traitement du stress. Comme prévu, la respiration était faible. Ces résultats montrent clairement des valeurs représentatives pour les blancs, ainsi qu’une comparaison de contrôle par rapport à des températures élevées pour ces très petits échantillons.

Figure 1 : Représentation schématique du nouvel outil de micro-respirométrie pour la caractérisation physiologique de l’holobionte corallien (animal corallien + symbiotes) ou de tout petit organisme (<1 mm). Des chambres de respirométrie sur mesure ont été fabriquées (numéro 1 ; 1.1-1.6). Il s’agit notamment de couvercles (1.1) avec des spots de capteur d’oxygène (1.2), et le juvénile individuel (1.3) est placé sur un support à circulation (1.4) placé au-dessus d’un agitateur magnétique (1.5), qui s’insèrent tous dans la chambre en verre (1.6). Le contrôleur (2) est fixé au spot avec un câble à fibre optique qui s’insère dans le couvercle (1) et connecté à l’ordinateur (3). Le réchauffeur/refroidisseur (4) se connecte à la plaque de respirométrie (5) avec l’eau d’écoulement (indiquée par des flèches en chevron pour la direction), qui se trouve au-dessus de la plaque d’agitation (6) avec des engrenages (7), alimentée par le moteur (8) et l’alimentation électrique (9). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Configuration de la micro-respirométrie. Plusieurs options sont disponibles, y compris (A) une plaque de respirométrie ou (B) connectée à plusieurs plaques. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Plaque d’agitation magnétique sur mesure sur le dessus de la plaque de respirométrie. Chaque chambre a (A) un engrenage d’agitation magnétique en dessous, (B) alimenté par un moteur, avec (C) la plaque de respirométrie reliée par un tube au réchauffeur/refroidisseur. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Configuration personnalisée de la chambre de respirométrie. (A) Composants (de gauche à droite : couvercle, flacon en verre, support, tube de 1,5 ml pour la balance et barre d’agitation). (B) Support à écoulement continu individuel dans lequel se trouve l’échantillon. (C) Vue de haut en bas du support à flux continu. (D) et avec le support placé à l’intérieur du flacon en verre avec le couvercle vissé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Flacons en verre placés dans la plaque d’agitation. (A) Plaque d’agitation sur mesure avec (B) un gros plan de la fiole en verre complète avec la configuration du couvercle. Le corail juvénile peut être vu à travers le couvercle ici (point brun), au-dessus de l’attache zippée, avec la fibre optique placée dans l’ouverture du couvercle. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Chambres placées à l’envers, prêtes pour l’étalonnage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
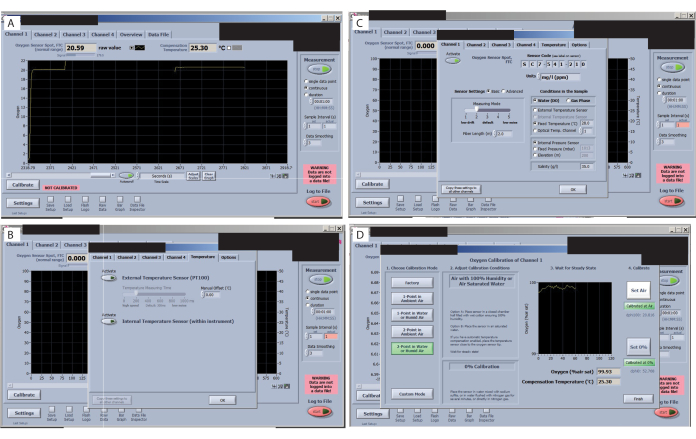
Figure 7 : Étapes clés du logiciel de mesure de l’oxygène. (A) Vérifiez le signal de chaque capteur. Un signal optimal pour cette étude et les capteurs est affiché dans le spot du capteur d’oxygène FTC (plage normale). (B) Vérifier la dérive du signal. (C) Régler et vérifier les températures de traitement. (D) Réglez et vérifiez les étalonnages 0 % et 100 %. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : étapes de sortie de l’analyse respR I. (A) Inspectez la commande et la sortie. (B) Vérifiez la stabilité du taux. (C) Déterminez le taux le plus linéaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
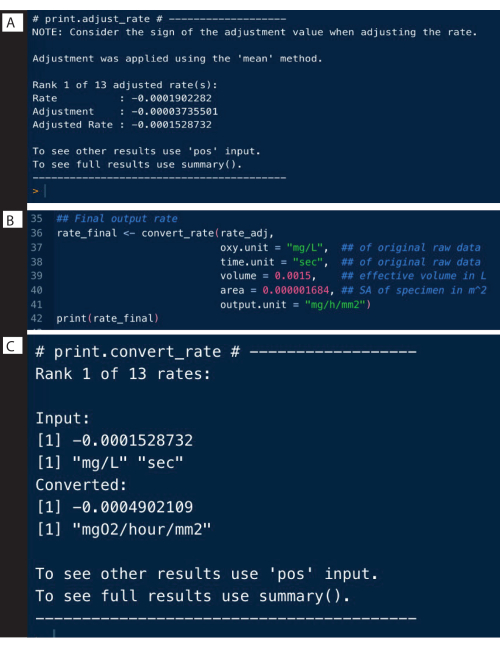
Figure 9 : Étapes II de la sortie de l’analyse respR. (A) Ajustez le taux pour l’arrière-plan, (B) Convertissez et (C) Vérifiez les taux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
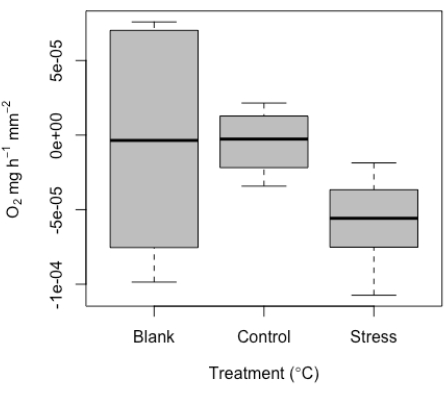
Figure 10 : Résultats représentatifs produits à partir de l’outil de micro-respirométrie. Respiration médiane (O2 ± erreur type) des juvéniles de corail répliqués, y compris les valeurs vides ainsi que la respiration des individus dans des conditions de contrôle et de stress à haute température. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo 1 : Vue de haut en bas de la chambre de respirométrie avec le corail juvénile à l’intérieur lors d’une séance de mesure. Veuillez cliquer ici pour télécharger cette vidéo.
Tableau 1 : Estimation des coûts des composants de l’appareil de respirométrie. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Ce travail décrit la construction d’un dispositif de micro-respirométrie sur mesure qui peut être utilisé pour quantifier la quantité d’oxygène consommée et produite par les petits organismes aquatiques sessiles. Les composants critiques de ce protocole comprennent la mise en place des chambres, y compris les spots, et l’étalonnage du signal faible à l’aide du package respR , dans lequel un signal faible peut être défini comme des taux caractérisés par des pentes peu profondes ou bruyantes. La chambre personnalisée et sa configuration permettent de détecter même les signaux faibles, tandis que l’utilisation du package R permet de se prémunir contre les problèmes dans lesquels l’apparition de pentes peu profondes ou bruyantes pourrait entraîner une mauvaise interprétation des résultats (par exemple, des faux positifs).
Les modifications potentielles qui seront nécessaires pour d’autres utilisateurs comprennent la sécurisation de l’organisme d’intérêt dans la chambre sur mesure. Dans ce cas, une petite attache rigide et de la colle d’aquarium ont été utilisées pour fixer le juvénile à la base en plastique, qui a ensuite été collée à l’attache. Il est à noter que, pour cette expérience, les juvéniles de corail ont été installés sur des bâches en plastique noir. Ce plastique a permis de retirer facilement les juvéniles de corail, qui ont effectivement glissé du plastique, afin de ne pas les blesser physiquement pendant le retrait. Les juvéniles de corail se fixent sur le substrat sur lequel ils s’installent, il est donc recommandé de les déposer sur une matière plastique similaire, en utilisant un peptideartificiel 16 pour faciliter leur élimination pour le processus de collage. Pour minimiser davantage le stress lié à la manipulation et l’impact sur la réponse respiratoire, il est recommandé de laisser les coraux montés sur des attaches zippées s’acclimater pendant 1 à 2 semaines, comme c’est souvent le cas dans de nombreuses expériences de stress sur les coraux adultes. D’autres modifications peuvent être nécessaires pour fixer l’organisme au-dessus de l’endroit dans le couvercle et pour permettre la circulation de l’eau. Une autre étape clé du dépannage consiste à détecter les signaux, en particulier sur la pente de la série temporelle d’oxygène où les taux doivent être déterminés. En fin de compte, cela se résume à une combinaison de l’utilisation d’un bon jugement pour exclure les données manifestement instables, et des fonctions de respR pour permettre d’extraire les taux des régions choisies de manière cohérente ou automatiquement en identifiant les régions linéaires des données. D’autres exemples de la façon de procéder sont disponibles sur le site Web du respR .
Cette méthode a été développée pour étendre les mesures de la limite inférieure de la respiration à des invertébrés marins sessiles extrêmement petits. La limite évidente est que ce protocole peut être plus sujet aux faux positifs que les protocoles conçus pour des biomasses plus importantes. Cependant, étant donné que c’était le but de la conception - mesurer ces limites inférieures - cela a été pris en compte dans la conception, et la procédure peut être utilisée avec le package respR pour mieux se prémunir contre les faux positifs. Il est également important de reconnaître qu’il existe d’autres systèmes pour mesurer la respiration30 et la mesure de petits organismes, y compris la respirométrie sur des copépodes individuels31 dans des volumes plus petits que celui-ci (~0,5-1 mL), mais qu’ils sont soit coûteux, soit dépourvus de composants spécifiques (capacité d’agitation). Cependant, ce système est open source et relativement peu coûteux par rapport aux systèmes commerciaux (par exemple, le système Core Microplate). Ce système intègre également des considérations méthodologiques clés telles que l’agitation, ce qui peut manquer à d’autres systèmes. La fonction de barre d’agitation interne est essentielle pour reproduire le mélange naturel de l’eau de nombreux organismes marins (par exemple, les copépodes par la nage), ce qui n’est souvent pas possible et peut rendre les données largement inutilisables. En revanche, d’autres méthodes de mélange disponibles consistent à placer l’ensemble du respiromètre sur un banc à bascule géant, ce qui nécessite un équipement supplémentaire et a un succès limité dans le mélange, ou le mélange par vibration, ce qui peut perturber l’organisme. Pour cette raison, c’est le seul système capable d’effectuer une respirométrie sur des coraux juvéniles ou d’autres très petits organismes sessiles. À titre de référence, la gamme de tailles des spécimens inclus ici variait de 2,1 à 3,6 polypes (correspondant à seulement quelques mois), avec une surface moyenne minimale à maximale de 1,3 à 4,5 mm2.
La respirométrie est une mesure fondamentale dans les études écologiques, et de nombreuses méthodes existent à cette fin. La plupart de ces méthodes existantes ciblent cependant des échantillons à forte biomasse, y compris des poissons entiers, des fragments de corail ou des herbiers marins 32,33,34. Cette méthode est la première à utiliser des juvéniles de corail individuels. De plus, il existe de nombreuses applications potentielles pour cette méthode, car elle fournit des informations physiologiques clés sur le fonctionnement de l’organisme. Cela peut être important pour les études visant à caractériser les estimations de base de la santé35, à comprendre le rôle du stress aigu ou à long terme pendant l’ontogenèse corallienne comme le stress thermique36, ou à fournir des seuils que les gestionnaires peuvent fixer pour aider à protéger et à améliorer la santé des récifs coralliens37. Étant donné que le corail est un holobionte et que la communauté symbiotique est relativement flexible à ce stade et tout au long de la première année de vie38, il serait intéressant de coupler les données de respirométrie avec les changements dans les communautés au fil du temps, afin de contextualiser pleinement le fonctionnement de l’organisme dans son ensemble. Il est important de noter que cette méthode contribue aux techniques de « science ouverte » qui aident à fournir un aperçu pour la création de configurations expérimentales personnalisées qui peuvent être partagées, améliorées et standardisées ouvertement.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à remercier Sam Noonan pour son aide et ses conseils, Sven Uthicke pour l’utilisation des chambres de respirométrie initiales, Ben Shelab pour son illustration d’ingénierie et l’atelier de l’Institut australien des sciences de la mer pour l’usinage sur mesure des adaptateurs et des supports de chambre de respirométrie. Les coraux ont été collectés en vertu du permis suivant du parc marin de la Grande Barrière de corail à AIMS G12/ 35236.1. Les coraux ne nécessitent pas de permis éthiques.
matériels
| Name | Company | Catalog Number | Comments |
| Cost | |||
| (1.1 – 1.6) Custom respirometry chambers | LabGlass Party Ldt. | 1.5 ml | $407.26 |
| 1.1 lids | AIMS workshop | Vial GL25 thread | ~$10 |
| 1.2 fiber-optics spots (FireStingO2 II fiberoptic optodes) | PyroScience | Oxygen sensor spots, 125 µm PET foil, Ø5 mm, with optical isolation, SN: 183801947 | $41.25 AUD each |
| 1.3 individual organism | NA | NA | NA |
| 1.4 flow-through stand | AIMS workshop | Custom | included in points 5 and 6 price (the workshop gave me an estimate of the lids, stand with gears, motor, incubation flow through |
| 1.5 magnetic stirrer | Any manufactuer is suitable | NA | ~$2? |
| 1.6 glass chamber (vial GL25 thread x 20 mm high, with bump/ridge, flat-ground rim, screw cap with hole, Labglass Pty Ltd, Stafford QLD) | Labglass Pty Ltd, Stafford QLD | Vial GL25 thread x 20 mm high, with bump/ridge, flat-ground rim, screw cap with hole | $50.9 AUD |
| 2 FireSting controller (2) | PyroSciences | NA | 4 sensors is 4000 Euros. 8 sensors used here. |
| 3 computer | NA | NA | NA |
| 4 heater/chiller | VWR International | NA | Small models around $4,000 AUD |
| 5 respirometry plate platform | AIMS workshop | 34 cm x 26 cm x 3 cm (although any dimensions are adequate to fit desired number of chambers) | $1250 AUD |
| 6 stirrer plate with gears (7) | AIMS workshop | 34 cm x 26 cm x 3 cm | $1250 AUD |
| 8 powered by the motor | AIMS workshop | Custom | $700 AUD |
| 9 power supply | Non-specific | NA | ~$300 AUD |
| Aquarium glue | Seachem reef glue | 20g | $14 |
| Oxygen Logger Software | PyroScience | NA | NA |
| Polypipe and connectors | John Guest | NA | $20 |
| Sodium Sulfite | Sigma | S0505-250G (CAS number 7757-83-7) | $54 |
Références
- Quigley, K. M. A fast, precise, in-vivo method for micron-level 3D models of corals using dental scanners. Methods in Ecology and Evolution. 13 (10), 2159-2166 (2022).
- Svendsen, M. B. S., Bushnell, P. G., Steffensen, J. F. Design and setup of intermittent-flow respirometry system for aquatic organisms. Journal of Fish Biology. 88 (1), 26-50 (2016).
- Lighton, J. R. B. Measuring Metabolic Rates: a Manual for Scientists. , Oxford University Press. (2018).
- Carey, N., Harianto, J., Byrne, M. Sea urchins in a high-CO2 world: partitioned effects of body size, ocean warming and acidification on metabolic rate. The Journal of Experimental Biology. 219 (Pt 8), 1178-1186 (2016).
- Clark, T. D., Sandblom, E., Jutfelt, F. Aerobic scope measurements of fishes in an era of climate change: respirometry, relevance and recommendations. The Journal of Experimental Biology. 216 (Pt 15), 2771-2782 (2013).
- Voolstra, C. R., et al. Extending the natural adaptive capacity of coral holobionts. Nature Reviews Earth & Environment. 2 (11), 747-762 (2021).
- Hoegh-Guldberg, O. Climate change, coral bleaching and the future of the world's coral reefs. Marine and Freshwater Research. 50 (8), 839-866 (1999).
- Morris, L. A., Voolstra, C. R., Quigley, K. M., Bourne, D. G., Bay, L. K. Nutrient availability and metabolism affect the stability of coral-symbiodiniaceae symbioses. Trends in Microbiology. 27 (8), 678-689 (2019).
- Yellowlees, D., Rees, T. A. V., Leggat, W. Metabolic interactions between algal symbionts and invertebrate hosts. Plant, Cell & Environment. 31 (5), 679-694 (2008).
- Rädecker, N., et al. Using Aiptasia as a model to study metabolic interactions in cnidarian-Symbiodinium symbioses. Frontiers in Physiology. 9, 214(2018).
- Matthews, J. L., et al. Optimal nutrient exchange and immune responses operate in partner specificity in the cnidarian-dinoflagellate symbiosis. Proceedings of the National Academy of Sciences. 114 (50), 13194-13199 (2017).
- Davy, S. K., Allemand, D., Weis, V. M. Cell biology of cnidarian-dinoflagellate symbiosis. Microbiology and Molecular Biology Reviews. 76 (2), 229-261 (2012).
- Weis, V. M. Cellular mechanisms of Cnidarian bleaching: stress causes the collapse of symbiosis. The Journal of Experimental Biology. 211 (Pt 19), 3059-3066 (2008).
- Baker, D. M., Freeman, C. J., Wong, J. C. Y., Fogel, M. L., Knowlton, N. Climate change promotes parasitism in a coral symbiosis. The ISME Journal. 12 (3), 921-930 (2018).
- Chakravarti, L. J., van Oppen, M. J. H. Experimental evolution in coral photosymbionts as a tool to increase thermal tolerance. Frontiers in Marine Science. 5, 227(2018).
- Quigley, K. M., Alvarez Roa, C., Beltran, V. H., Leggat, B., Willis, B. L. Experimental evolution of the coral algal endosymbiont, Cladocopium goreaui: lessons learnt across a decade of stress experiments to enhance coral heat tolerance. Restoration Ecology. 29 (3), e13342(2021).
- Buerger, P., et al. Heat-evolved microalgal symbionts increase coral bleaching tolerance. Science Advances. 6 (20), eaba2498(2020).
- Bieri, T., Onishi, M., Xiang, T., Grossman, A. R., Pringle, J. R. Relative contributions of various cellular mechanisms to loss of algae during cnidarian bleaching. PLoS One. 11 (4), e0152693(2016).
- Tremblay, P., Gori, A., Maguer, J. F., Hoogenboom, M., Ferrier-Pagès, C. Heterotrophy promotes the re-establishment of photosynthate translocation in a symbiotic coral after heat stress. Scientific Reports. 6, 38112(2016).
- Tremblay, P., Grover, R., Maguer, J. F., Hoogenboom, M., Ferrier-Pagès, C. Carbon translocation from symbiont to host depends on irradiance and food availability in the tropical coral Stylophora pistillata. Coral Reefs. 33 (1), 1-13 (2014).
- Wooldridge, S. A. Is the coral-algae symbiosis really 'mutually beneficial' for the partners. Bioessays. 32 (7), 615-625 (2010).
- Wooldridge, S. A. Breakdown of the coral-algae symbiosis: towards formalising a linkage between warm-water bleaching thresholds and the growth rate of the intracellular zooxanthellae. Biogeosciences. 10 (3), 1647-1658 (2013).
- Coles, S. L., Jokiel, P. L. Effects of temperature on photosynthesis and respiration in hermatypic corals. Marine Biology. 43, 209-216 (1977).
- Marubini, F., Davies, P. S. Nitrate increases zooxanthellae population density and reduces skeletogenesis in corals. Marine Biology. 127, 319-328 (1996).
- Iglesias-Prieto, R., Matta, J. L., Robins, W. A., Trench, R. K. Photosynthetic response to elevated temperature in the symbiotic dinoflagellate Symbiodinium microadriaticum in culture. Proceedings of the National Academy of Sciences. 89 (21), 10302-10305 (1992).
- Karako-Lampert, S., Katcoff, D. J., Achituv, Y., Dubinsky, Z., Stambler, N. Responses of Symbiodinium microadriaticum clade B to different environmental conditions. Journal of Experimental Marine Biology and Ecology. 318 (1), 11-20 (2005).
- Blanckaert, A. C. A., Reef, R., Pandolfi, J. M., Lovelock, C. E. Variation in the elemental stoichiometry of the coral-zooxanthellae symbiosis. Coral Reefs. 39, 1071-1079 (2020).
- Harianto, J., Carey, N., Byrne, M. respR-An R package for the manipulation and analysis of respirometry data. Methods in Ecology and Evolution. 10 (6), 912-920 (2019).
- Gamble, S., Carton, A. G., Pirozzi, I. Open-top static respirometry is a reliable method to determine the routine metabolic rate of barramundi. Lates calcarifer. Marine and Freshwater Behaviour and Physiology. 47 (1), 19-28 (2014).
- Burford, B. P., et al. Rapid range expansion of a marine ectotherm reveals the demographic and ecological consequences of short-term variability in seawater temperature and dissolved oxygen. The American Naturalist. 199 (4), 523-550 (2022).
- Morozov, S., McCairns, R. J. S., Merilä, J. FishResp: R package and GUI application for analysis of aquatic respirometry data. Conservation Physiology. 7 (1), coz003(2019).
- Leclercq, N., Gattuso, J. -P., Jaubert, J. Primary production, respiration, and calcification of a coral reef mesocosm under increased CO2 partial pressure. Limnology and Oceanography. 47 (2), 558-564 (2002).
- Anthony, K. R. N., Hoegh-Guldberg, O. Variation in coral photosynthesis, respiration and growth characteristics in contrasting light microhabitats: an analogue to plants in forest gaps and understoreys. Functional Ecology. 17, 246-259 (2003).
- Moulin, L., et al. Long-term mesocosms study of the effects of ocean acidification on growth and physiology of the sea urchin Echinometra mathaei. Marine Environmental Research. 103, 103-114 (2015).
- Quigley, K. M., Bay, L. K., van Oppen, M. J. H. Genome-wide SNP analysis reveals an increase in adaptive genetic variation through selective breeding of coral. Molecular Ecology. 29 (12), 2176-2188 (2020).
- Brunner, C. A., Ricardo, G. F., Uthicke, S., Negri, A. P., Hoogenboom, M. O. Effects of climate change and light limitation on coral recruits. Marine Ecology Progress Series. 690, 65-82 (2022).
- Quigley, K. M., Alvarez Roa, C., Torda, G., Bourne, D., Willis, B. L. Co-dynamics of Symbiodiniaceae and bacterial populations during the first year of symbiosis with Acropora tenuis juveniles. MicrobiologyOpen. 9 (2), e959(2020).
- Quigley, K. M., Bay, L. K., Torda, G., Willis, B. L. Leveraging new knowledge of Symbiodinium community regulation in corals for conservation and reef restoration. Marine Ecology Progress Series, 600. , 245-253 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon