Method Article
새로운 미세 호흡 측정 도구를 사용한 산호 홀로비온트의 생리학적 특성 분석
요약
이 프로토콜은 산호 홀로비온트의 생리학적 특징을 조사하는 데 사용할 수 있는 미세 호흡 측정 시스템의 설정 및 실행에 대해 설명합니다.
초록
에너지와 관련된 유기체 과정의 총합으로 정의되는 신진대사 활동은 지구상 생명체의 기능과 진화를 이해하는 데 매우 중요합니다. 따라서 유기체의 대사율을 측정하는 것은 유기체의 생리학적 상태, 생태학적 역할, 육상 및 수생 생태계 내 종에 대한 환경 변화의 영향을 설명하는 데 중요합니다. 산호초에서는 산호와 조류 공생체(Symbiodiniaceae) 사이의 공생 기능을 정량화하고 기후 변화를 포함한 환경 스트레스 요인이 산호 건강에 어떤 영향을 미치는지 평가하기 위해 신진대사 측정이 사용되었습니다. 이러한 중요성에도 불구하고, 산호 자손의 대사율 측정과 관련된 방법과 데이터가 부족하며, 이는 산호의 크기가 작기 때문일 수 있습니다. 이 격차를 해소하기 위해 이 연구는 작은(밀리미터 크기 범위) 해양 동물 생태의 호흡을 측정하기 위한 맞춤형 설정을 개발하는 것을 목표로 했습니다. 이 저렴한 비용과 쉬운 설정을 통해 신진대사율 측정을 개선할 수 있습니다. 이것은 산호초 복원을 위해 산호의 유성 생산을 활용하는 응용 생태 연구에 필수적입니다.
서문
호흡은 유기체의 전반적인 대사 활동을 나타내는 중요한 생물학적 측정이지만, 다른 중요한 형질(성장)과 마찬가지로 작은 유기체에서는 측정하기 어렵다1. 호흡은 산소를 사용하여 유기 분자를 산화시키는 것으로 정의할 수 있습니다. 이 과정은 유기체의 생존에 필수적인 세포 기능(즉, 신진대사)에 필요한 화학 에너지를 생성합니다. 또는 혐기성 대사로 인해 산소 빚이 생긴다2. 호흡수는 밀폐된 챔버에서 시간 경과에 따른 산소 농도의 사용(및 그에 따른 감소)을 측정하는 옵토드(optode)를 사용하여 측정할 수 있으며, 이는 일반적으로 호흡 측정법(respirometry)3으로 알려져 있다. 대부분의 유기체가 산소를 저장하지 않는다는 점을 감안할 때, 신진대사 속도는 호흡과 탄소 사용 사이의 직접적인 상관 관계를 통해 추론할 수 있습니다. 이 때문에 호흡수는 일일 탄소 사용량으로 전환될 수 있으며, 이는 일반적으로 산호의 스트레스 또는 백화로 이어지는 열파 조건을 포함하여 환경 스트레스 4,5 기간 동안 성장, 번식 및 대사 항상성을 유지하는 능력과 같은 중요한 대사 기능을 알려줍니다.
산호초는 전 세계적으로 빠른 속도로 감소하고 있습니다. 산호 동물은 파트너(와편모충 공생동물과, 균류, 박테리아 및 바이러스 포함)의 컨소시엄을 보유하고 있으며, 총칭하여 "홀로비온트(holobiont)"라고 합니다.6 해수 온도가 상승함에 따라 산호와 산호초는 생존에 대한 압박을 받고 있으며, 높은 온도로 인해 와편모충 공생충(이하 공생체)이 손실되는데, 이러한 현상을 백화 현상으로 알려져 있다7. 올리고영양 열대 해역의 산호는 무기 질소와 인을 포함한 많은 영양소를 이용할 수 없다8. 이에 대처하기 위해 산호는 와편모충 공생체(Symbiodiniaceae)와 영양 공생을 이루는데, 이 공생충은 산호 숙주가 생존하고 탄산칼슘 골격을 축적하는 데 필요한 영양분의 대부분을 제공한다9. 기능적 공생은 파트너들 사이의 높은 수준의 탄소 공유(carbon sharing)10,11에 의해 특징지어질 수 있으며, 공생의 조절은 역동적인 항상성(dynamic homeostasis)12을 포함한다.
열 스트레스 동안에는 이러한 동적 조절과 통신이 중단되어 미생물 불균형과 표백이 발생합니다(참고 문헌13에서 검토). 따라서 광합성 및 호흡과 같은 대사 측정은 산호의 건강한 상태와 조절되지 않은 불균형 상태를 모두 설명할 수 있는 잠재력을 가지고 있으며, 온토제니 전반에 걸쳐 이러한 과정을 정확하게 측정하는 것은 유기체 기능을 이해하는 데 매우 중요합니다. 이는 대량 백화 현상의 빈도와 규모가 증가함에 따라 특히 중요하며, 기온이 상승함에 따라 탄소 전달이 감소하는 것으로 밝혀진 공생체의 영양분 공유 변화에 영향을 미칠 가능성이 있습니다14. 이는 영양소를 격리하는 공생체에 의한 지시된 메커니즘 또는 경생리학적 트레이드오프(열내성은 증가하지만 숙주 생존율은 감소)에 기인할 수 있다 15,16,17). 공생의 붕괴는 공생체와 숙주 모두에 의해 기인할 수 있지만, 주된 요인은 공생체(18)의 세포 오작동일 가능성이 높다. 그러나 해수 온도 상승으로 인한 스트레스는 이러한 공생을 불안정하게 만듭니다. 공생체에서 숙주로의 탄소 공유는 감소하고19,20 산호의 굶주림이 뒤따를 수 있습니다. 이는 숙주 사용의 증가("고정 탄소의 이화작용 증가")로 인해 산호의 지질 및 탄수화물 저장량이 감소한 것으로 나타날 수 있으며, 이는 공생체에 의한 공유의 감소로 인한 것일 수 있다11. 산호 공생체의 광합성 및 호흡의 기여와 함께 산호 동물의 호흡은 산호의 건강, 이러한 파트너 간의 표백 및 영양 교환의 영향, 환경 변화에서 살아남는 것과 관련된 표현형인 홀로비온트의 성장을 이해하는 데 중요한 척도입니다 8,21,22. 마지막으로, 많은 산호가 공생한다는 점을 감안할 때, 호흡 외에 광합성을 특성화하기 위해 호흡 측정법을 사용하는 것은 P:R 비율을 맥락화하고 공생이 안정적인지 여부를 이해하는 데 특히 유용합니다(예: 참고 문헌23).
따라서 환경 변화는 산호와 그 공생체의 에너지 예산에 변화를 일으켜 성장의 차이를 초래한다14. 이에 대처하기 위해 산호 숙주는 신진대사 요구를 충족시키기 위해 호흡과 지질 사용을 증가시킬 수 있습니다. 열 스트레스는 용존 산소의 변화로 측정되는 호흡 증가로 인해 순 생산성을 60%까지 감소시킬 수 있다.14 Symbiodiniaceae는 또한 질소 동화 작용과 탄소 보유를 증가시킬 수 있습니다14,24 그리고 나서 이러한 예비량을 사용하여 에너지를 자신의 복구 및 보호 메커니즘으로 전환 할 수 있습니다25,26. N과 C의 균형은 성장을 조절하는 데 중요하며, 특히 P는 공생 풍부도의 동적 조절로 나타날 수 있습니다27. 실제로, 광활한 산호초(>1,000km)에 걸쳐 있는 산호에서 수집된 증거는 숙주가 P의 조절을 통해 공생 성장을 제한할 수 있는 능력을 가지고 있음을 시사하지만, 이는 산호 종에 따라 다르다27.
종합하면, 이러한 연구는 환경 변화로 인해 영양소의 생산 또는 전위(즉, 공생 성향)의 감소와 함께 내열성이 증가한다는 것을 시사합니다. 따라서 미세 호흡 측정법을 통해 산소 사용량을 정량화하는 것과 같은 강력한 단일 청소년 방법을 사용하여 신진대사와 관련된 기본 메커니즘을 이해한 다음 내열성 획득을 이해하는 것과 같은 보존 문제에 적용해야 합니다. 이것은 생리학적 측정을 위한 미세 호흡 측정 도구로 제시되며, 어린 산호와 조류 공생체 사이의 영양 관계를 조사하기 위한 것이지만 다른 작은 해양 생물에 적합합니다.
유기체에 의한 산소의 사용 또는 생산은 산소를 개별적이고 밀폐된 호흡측정기 챔버 또는 '호흡측정기'(이하 챔버)에 배치하여 측정할 수 있으며, 여기서 산소 변화는 옵토드(optodes)3를 사용하여 측정된다. 옵토드는 광 펄스를 사용하여 산소 농도를 측정하는 프로브이며, 시간 경과에 따른 측정값을 기록하면 호흡 및/또는 광합성 속도를 계산할 수 있습니다. 실제로 호흡을 측정하는 것은 산호가 완전한 어둠 속에서 부화된다는 점을 제외하고는 산호의 광합성을 측정하는 것과 유사합니다. 매일 총 광합성에서 산호와 공생체의 총 일일 호흡을 빼면 산소 차이(산소 델타)가 발생합니다.2,3. 일반적으로 유기체는 생산하는 것보다 더 많은 산소를 사용하기 때문에 산소가 부족합니다. 이것은 산소와 탄소가 고정된 비율로 소비되기 때문에 탄소 당량으로 전환될 수 있다2. 잉여 탄소는 산호의 성장, 점액 합성 및 번식, 기타 필수 대사 요구에 사용될 수 있다12.
이 프로토콜은 0.5μm 여과된 해수로 채워진 맞춤형 1.5mL 유리 챔버 설계(GL25 나사산이 있고 높이 20mm가 있는 바이알, 범프/융기, 평평한 접지 테두리 및 구멍이 있는 나사 캡, 재료 표 참조)를 사용하여 개별 산호 새끼의 호흡수(R)를 측정하는 데 사용된 미세 호흡 방법(그림 1)을 설명합니다. 광섬유 옵토드(재료 표 참조)는 뚜껑 측면의 구멍을 통해 각 챔버에 삽입되었습니다. 각 개별 산호는 챔버 내에서 물이 적절하게 혼합되도록 하기 위해 마그네틱 교반봉 위의 단단한 메쉬, 플로우 스루 교반기 플레이트 플랫폼 위에 부착되었습니다. 대표적인 예시에서는 여러 컨트롤러가 동시에 실행되었기 때문에 두 개의 대조군 또는 "블랭크"(시편의 존재를 제외하고는 동일한 챔버)가 세 개의 복제 시편 챔버에 동시에 측정되었습니다. 그러나 설정 예(그림 2)는 4개의 채널 사용만 보여줍니다. 이것은 여러 컨트롤러와 여러 개의 플로우 스루 스탠드를 사용하여 증가시킬 수 있습니다. 또한 재순환 플로우 스루(75L/h로 설정된 연속적이고 완만한 유량) 시스템을 사용하여 사전 설정된 수온(제어의 경우 27°C 또는 여기 예제 데이터의 고온 응력의 경우 31°C)이 있는 맞춤형 수조에 각 챔버를 담그면 이 시스템에서 온도를 제어할 수 있습니다. 교반기 플레이트 플랫폼과 기어가 있는 교반기 플레이트는 모든 크기가 될 수 있으며 유리 챔버의 수를 수용하기 위해 필요에 따라 크거나 작게 만들 수 있습니다. 이 예에서 플랫폼과 플레이트는 약 34cm x 26cm x 3cm입니다(재료 표). 옵토드의 보정은 이 실험 설정에 적합한 수온 및 염도에서 0% 및 100% 산소 포화도를 나타내는 두 가지 표준 용액을 사용하여 각 실행 전에 수행되었습니다.
프로토콜
1. 호흡실 내 장비 및 산호 설치
참고: 2018년 10월 보름달이 뜬 날에 자성 섬(19° 6.249'S; 146° 51.728'E)의 산호초에서 번식 준비가 된 산호(즉, Acropora tenuis 군집의 조각난 가지에서 볼 수 있는 분홍빛이 도는 색소 난자/정자 다발을 가진 산호)를 채취하여 산호 산란을 위해 실험실로 가져왔습니다. 어린 산호가 사육되고 자란 곳.
- 측정 당일에는 파란색 폴리파이프와 커넥터를 사용하여 두 개의 수조판을 연결합니다(재료 표 참조; 그림 1 [5], 그림 2A,B). 이들은 파란색 폴리 파이프를 온수기 / 냉각기에 연결 한 후 인큐베이터 역할을합니다. 호흡 측정 챔버가 제자리에 있지 않을 때 투명한 수조 플레이트를 통해 모터 플레이트가 명확하게 보이는지 확인하십시오.
- 두 개의 호스를 온수기/냉각기에 연결합니다( 재료 표 참조). 온수기/냉각기를 켠 다음 원하는 실험 온도(27°C 또는 31°C)를 설정합니다.
- 자기 기어(그림 1 [6, 7 ] 및 그림 3A)를 사용하여 수조 베이스(1.1단계)를 베이스 모터 플레이트에 연결한 다음 이 어셈블리를 전원에 연결합니다(그림 3B). 전원을 켜서 기어를 활성화하면 챔버의 교반기 막대가 활성화됩니다.
- 밸브 커넥터 손잡이를 사용하여 필요에 따라 물의 흐름을 조절합니다(예: 75rpm에서 천천히 교반하면서 30L/h로 설정된 연속적이고 완만한 흐름).
- 호흡 측정 챔버를 조립하려면 마그네틱 비드(그림 1 [1.5])를 유리 챔버(그림 1 [1.6])에 추가한 다음 불투명 플라스틱 플로우 스루 스탠드 베이스(그림 1 [1.4])를 유리 챔버(그림 4A)에 추가합니다. 챔버와 마그네틱 비드의 크기는 관심 있는 유기체와 연구 시스템에 따라 다릅니다.
알림: 플라스틱 바닥에는 바닥에 있는 마그네틱 비드의 움직임으로 인한 물의 흐름과 순환을 허용하는 구멍이 있습니다. - 수족관 접착제(재료 표 참조)를 사용하여 플라스틱 베이스에 놓인 검은색 지퍼 타이에 산호를 붙입니다(그림 4B-D). 이렇게하려면 먼저 산호 새끼를 검은 색 플라스틱 조각에 붙인 다음이 조각을 플라스틱베이스에 붙입니다. 산호가 단단히 부착되면(접착제 경화는 거의 즉각적임) O-링(그림 4A)이 있는 뚜껑을 유리 챔버에 나사로 고정합니다. 호흡 측정 챔버 내에 공기가 없는지 확인하기 위해 별도의 수조에서 수중에서 이러한 작업을 수행하십시오.
알림: 호흡계의 수분량(즉, 유효 부피 = 1.5ml)은 챔버를 수중에 완전히 담그면 결정됩니다. 물의 양에 비해 매우 작은 산호의 질량/밀도에서 변위는 무시할 수 있다는 가정입니다. 1.5mL 마이크로 원심분리기 튜브는 스케일에 대해 다음과 같이 표시됩니다(그림 4A). - 챔버를 수조에 단단히 놓습니다(그림 5A). 유리 챔버가 실험을 위해 온도 제어된 물과 접촉하는지 확인하십시오.
- O2 광섬유 케이블( 재료 표 참조)을 뚜껑 챔버 측면에 뚫린 구멍에 삽입하여 산소 센서 스폿(이하 스폿이라고 함, 재료 표 참조)과 접촉하도록 연결합니다. 이 작은 지점은 산소에 민감하며 광섬유 케이블을 통해 챔버 내에서 신호를 감지하고 전송합니다.
- 배관 테이프(흰색의 얇은 자체 밀봉 테이프)를 추가하여 케이블이 꼭 맞도록 하고 수실 내부에 단단히 고정되도록 합니다. 챔버 내부에서 갈색 촉수가 위를 향하도록 개별 산호가 보이는지( 그림 5B 참조) 확인합니다(그림 5B, 비디오 1).
알림: 장치의 구성 요소에 대한 예상 비용은 표 1에 나와 있습니다.
- 배관 테이프(흰색의 얇은 자체 밀봉 테이프)를 추가하여 케이블이 꼭 맞도록 하고 수실 내부에 단단히 고정되도록 합니다. 챔버 내부에서 갈색 촉수가 위를 향하도록 개별 산호가 보이는지( 그림 5B 참조) 확인합니다(그림 5B, 비디오 1).
2.O2 시스템을 사용하여 호흡을 측정하기 위한 표준 작업 절차
- 산소 측정 소프트웨어를 엽니다( 재료 표 참조).
- 교정이 수행될 방의 온도를 측정합니다. 이것은 나중에 보정 단계(2.8단계)에 필요합니다.
- 광학 센서와 캡을 조립합니다. 이렇게 하려면 모든 광섬유를 O2 모듈의 일치하는 포트에 연결합니다. 캡 1을 센서 1과 일치시키고 캡 2를 센서 2와 일치시켜야 합니다.
- 보정을 위해 챔버를 설정하려면 먼저 깨끗한 스폰지 조각에 약간의 역삼투압(RO) 물을 적셔 각 챔버에 삽입합니다.
알림: 스펀지는 떨어지지 않아야 하며 촉촉하기만 해야 합니다. 광섬유 스폿에 떨어질 수 있습니다. 다음 단계로 진행하기 전에 해당 부위가 젖지 않았는지 확인하십시오. - 일치하는 광섬유로 챔버를 거꾸로 놓습니다(그림 6). 이렇게 하면 광섬유를 건드리지 않고 챔버의 나사를 풀고 0% 보정을 위해 아황산나트륨을 추가할 수 있습니다.
- 교정을 시작하기 전에 각 센서의 신호를 확인하십시오. 소프트웨어 인터페이스의 모든 탭을 살펴보고 신호 값(왼쪽 상단 모서리)(그림 7A)을 확인하여 크게 다르지 않은지 확인합니다. 실험 설정에 허용되는 값에 대해서는 O2 매뉴얼을 확인하십시오(관심 있는 유기체 및 조건에 따라 다름). 이 특정 설정의 경우 25.3°C의 실온에서 신호가 179.5인 상태에서 20.59의 FTC(셀 정상 범위를 통한 산소 센서 스폿 흐름)가 허용됩니다.
- 프로그램을 열고 소프트웨어의 설정을 확인하여 아래 설명된 대로 올바른지 확인합니다. 프로그램을 연 직후 팝업 창이 나타나지 않으면 소프트웨어 인터페이스의 왼쪽 하단 모서리에 있는 설정 버튼을 클릭하여 수행할 수 있습니다.
- 외부 온도 센서가 활성화되어 있는지 확인합니다(그림 7B). 설정을 고정 온도 로 변경합니다(그림 7C). 그런 다음 실내 온도 값을 추가하고 다른 모든 채널에 설정 복사를 클릭합니다.
- 설정을 Reduce Signal Drift(신호 드리프트 감소)로 변경합니다(그림 7C). 그런 다음 센서 설정을 선택하고 레벨 2를 선택합니다. 그렇지 않으면 작은 부피를 사용하는 경우 드리프트가 너무 높아 보정하기 어려울 수 있습니다.
- 채널의 일반 설정을 확인하십시오. 적절한 경우 확인을 누릅니다. Copy settings to all channels(모든 채널에 설정 복사)를 클릭한 다음 OK(확인)를 클릭합니다.
- 센서를 보정합니다. 채널 1 보정의 경우 채널 1 탭으로 이동하여 보정 버튼을 누릅니다. 물 또는 습한 공기에서 2점을 선택합니다.
- "공기" 보정을 위해 거품 조각을 물에 담그고 챔버 내부에 놓고 신호가 안정화될 때까지 기다립니다(공기 보정 전후 이미지 참조). 안정되면 "set air"를 누릅니다. 공기 > 보정을 클릭하여 공기를 설정>.
- 0% 및 100% 보정을 설정합니다(그림 7D). 캡에서 챔버를 제거하고 다음 캡에 넣어 첫 번째 센서의 0% 보정이 완료되면 공기 보정 신호가 준비되도록 합니다. 이송 피펫을 사용하고 캡에 2% 아황산나트륨을 채웁니다. 신호가 안정화될 때까지 기다리십시오.
알림: 신호는 일반적으로 공기 보정에 비해 안정화되는 데 더 많은 시간이 걸립니다. "값이 일반적인 범위를 벗어났습니다"라는 경고 메시지가 나타나면 아황산나트륨이 신선한지 확인하십시오. 모든 채널에 대해 동일한 보정 프로세스를 반복합니다. RO 물 2mL에 100g을 첨가하여 아황산나트륨을 준비합니다. - 보정이 완료되면 호흡실을 잘 헹구고 챔버와 캡을 건조시킵니다. 광섬유 구멍에 물이 없는지 확인하십시오.
- 유기체(이 예에서는 단일 산호 새끼)를 호흡실 안에 넣고 뚜껑으로 닫습니다. 뚜껑을 놓을 때 챔버가 완전히 잠기고 내부에 공기가 전혀 없을 때 하십시오.
- 챔버를 교반 플레이트에 단단히 놓고 광섬유를 연결합니다.
- 전원 공급 장치를 켭니다. 챔버 내부의 물이 완전히 혼합되었는지 확인하십시오. 냉각기/히터의 온도를 선택한 실험 온도로 설정합니다.
- 펌프와 히터를 켭니다(1.2 및 1.4단계).
- O2 측정 소프트웨어 인터페이스에서 log를 눌러 기록을 시작합니다.
결과
데이터 처리 및 분석
호흡 측정 실험의 원시 데이터를 처리하는 방법에는 여러 가지가 있지만 R 패키지 respR28을 사용하는 것이 좋습니다. 오픈 사이언스와 재현성을 옹호하는 위의 프로토콜의 공유에 따라 이 패키지는 데이터 처리 및 분석을 쉽게 재현할 수 있는 형태로 공유할 수 있도록 하며 이를 염두에 두고 설계되었습니다. 무료 오픈 소스 플랫폼이며 프로브 시스템에 구애받지 않으며 CRAN 또는 GitHub에서 쉽게 설치할 수 있습니다. respR 에 대한 전체 코드 및 예제가 유지 관리되며 https://github.com/januarharianto/respR 에서 찾을 수 있습니다.
respR 패키지에는 호흡 측정 데이터를 가져오고, 시각화하고, 품질 관리를 수행하고, 자동으로 또는 수동으로 선택한 영역에서 호흡수를 계산하는 기능이 있습니다. 또한 배경 호흡 속도 및 일반적으로 사용되는 출력 단위로의 변환 속도를 조정할 수 있습니다. 미세 호흡 측정 시스템의 데이터를 처리하는 단계는 아래에 자세히 설명되어 있습니다. 이 연구에서는 호흡 측정 시스템의 데이터가 예로 사용되었지만 패키지는 대부분의 상용 산소 프로브 시스템과 일반 R 데이터 개체의 입력도 허용합니다. 전체 문서 및 자습서를 포함하여 패키지에 대한 자세한 내용은 패키지 웹 사이트(https://januarharianto.github.io/respR/index.html)에서 확인할 수 있습니다.
원시 데이터 가져오기
원시 출력 파일(.txt)을 가져옵니다. respR 은 형식을 인식하고 후속 함수에서 사용할 수 있는 일반 R 데이터 프레임으로 구문 분석합니다. 그러나 이것은 선택 사항이라는 점에 유의해야 합니다. 이 파일과 거의 모든 산소 시계열 데이터는 R에 대한 기본 지식이 있는 사람이라면 누구나 기본 함수(아래 참조)를 사용하여 가져올 수도 있습니다.
#load respR
라이브러리(respR)
#Import ---
데이터 <- import_file("file.txt")
#Firesting-Pryo 파일이 감지됨
데이터 검사 및 시각화
모든 데이터 분석 작업의 중요한 부분은 데이터를 플롯하고 검사하여 명백한 이상 또는 패턴을 찾거나 이해하는 데 도움을 주는 것입니다. 여기서는 inspect 기능(그림 8A)이 사용되며, 수치가 아니거나 누락된 값과 같은 호흡 측정 데이터에 공통적인 문제를 확인합니다.
단일 산소 컬럼 #inspect
Insp <-inspect(데이터, 시간 = 3, 산소 = 8, 너비 = 0.2)
또한 이 함수는 산소 시계열을 플로팅하고 롤링 속도(하단 패널)를 계산하여 실험 과정에서 이 속도가 어떻게 변할 수 있는지 설명하는 데 도움이 됩니다. 이러한 롤링 레이트 플롯은 이러한 레이트 곡선의 어느 영역을 추출해야 하는지 알려주는 데 도움이 됩니다. 표준 또는 일상 대사율의 경우, 원하는 영역은 비율이 안정성을 보이는 영역입니다(예: 약 3,000 시점 이후; 그림 8B).
여기서 산소 감소는 전체 시계열 패널에서 약 200행 이후에만 감지할 수 있습니다. 이와 같은 패턴은 호흡 측정 데이터에서 매우 일반적입니다. 시스템이 안정화되고 시편이 실험 조건에 적응함에 따라 실험 시작 시 불안정한 기간이 길어지는 경우가 많습니다. 속도는 이 초기 불안정 이후의 시계열에서만 추출하는 것이 좋으며, 이는 시각화의 중요성도 강조합니다.
추출 속도
respR 에는 호흡수를 추출하는 두 가지 기능이 있습니다. 첫 번째는 calc_rate() 함수로, 시간 영역, 행 또는 산소 수준을 지정하여 속도를 수동으로 추출할 수 있습니다. 이것은 호흡 측정 분석에서 매우 일반적이며, 선택 기준이 결정되고 일관되게 적용되는 한 비율을 결정하는 데 완벽하게 수용 가능한 방법이다28.
보다 강력하고 객관적인 방법은 데이터의 선형 영역을 식별하는 auto_rate() 함수를 사용하는 것입니다. 이 영역은 기계 학습을 사용하여 자동으로 할당되는 호흡 속도가 일관되게 유지되는 영역입니다. 이 기능은 낮은 신호를 감지하는 데에도 유용합니다(이 연구에서 사용된 샘플에서와 같이, 이 연령의 낮은 바이오매스로 인해). 이 기능은 독립적이고 객관적이며 통계적으로 견고한 방법(28)을 사용하여 가장 선형적, 최소, 최대 비율을 식별할 수 있게 한다. 이 예제에서는 3,000에서 5,000 사이의 시점 주변에서 발생하는 선형 영역을 식별합니다. 여러 선형 영역이 식별될 수 있지만 이 섹션이 가장 높은 순위 또는 가장 선형적인 영역이라는 점에 유의해야 합니다(그림 8C).
#Determine 가장 선형적인(즉, 일관된) 속도
비율 <-auto_rate (insp)
배경 조정
대조군 실험의 백그라운드 속도는 위의 예와 유사한 방식으로 측정할 수 있으며 adjust_rate() 함수를 사용하여 표본 속도를 조정하는 데 사용할 수 있습니다(그림 9A, 전체 분석은 여기에 표시되지 않고 조정만 표시됨). 전체 예제는 respR 웹 사이트에 자세히 설명되어 있습니다.
배경에 대한 #Adjust 비율
rate_adj <-adjust_rate(rate, by = bg) #saved bg 객체
인쇄(rate_adj)
환율
마지막 단계는 원시 데이터의 원래 단위, 호흡계의 유효 부피 및 블랭크 측정으로 정규화하는 것을 포함한 기타 실험 데이터를 사용하여 속도를 원하는 출력 단위로 변환하는 것입니다(그림 9B). 출력은 전체 표본의 절대 호흡수 또는 질량 또는 표면적별 속도일 수 있습니다. 표면적별 속도는 여기에 사용된 출력이며, 특히 절대 속도를 표본의 표면적으로 나눈 값입니다(그림 9C).
위에서 논의한 바와 같이 이 시스템은 매우 작은 표본을 측정하기 위해 개발되었습니다. 따라서 낮은 값과 공백 측정값과 겹칠 가능성이 있을 것으로 예상했습니다. 블랭크 내에서 일정 수준의 신호가 예상되며, 검사할 때 이러한 값은 프로브 드리프트, 약간의 온도 변화 또는 프로브의 기포로 인해 일반적인 실험 노이즈의 예상 범위 내에 있습니다. 설계상 시편 크기가 작기 때문에 사용되는 유효 부피가 작기 때문에 블랭크를 사용하는 것이 특히 중요하며, 특히 각 실행에 중요합니다. 대표 값이 여기에 예제로 포함되었습니다(그림 10). 시편 크기가 작기 때문에 실행당 측정을 표준화하기 위해 각 실행에서 블랭크를 사용하는 것이 좋습니다.
이러한 빈 값은 처리 측정 값을 표준화하는 데 사용됩니다. 산호가 산소를 생산하는 것 외에도 호흡을 한다는 점을 감안할 때 신진대사율은 음수에서 양수까지 다양할 수 있습니다. 미세 호흡 도구에서 검출된 호흡 값 범위의 대표적인 결과의 예가 여기에 나와 있습니다. 이러한 결과는 단일 산호 새끼를 대상으로 한 성공적인 실험에서 결정되었습니다(그림 10). 전반적으로, 호흡은 샘플의 크기가 작기 때문에 이 예제 데이터 세트(설계에 따라)에서 감지하기 어려울 것으로 예상되었습니다. 이는 이 낮은 신호 임계값을 캡처하는 데 있어 이 방법의 가치를 강조합니다. 이러한 대표적인 결과는 테스트된 가장 작은 표본 크기에서 어둠 속에서의 호흡을 보여주며, 이 시스템의 최소 검출 임계값을 강조합니다. 또한 두 가지 조건(제어 및 고온 스트레스)에서 측정했습니다. 실행당 측정된 블랭크로 표준화한 후 값은 0에 가까운(대조군)에서 응력 처리에 대한 ~-5e-5 의 중앙값까지 다양했습니다. 예상대로 호흡이 가빴다. 이 결과는 블랭크에 대한 대표 값뿐만 아니라 이러한 매우 작은 샘플에 대한 대조군과 고온 비교를 명확하게 보여줍니다.

그림 1: 산호 홀로비온트(산호 동물 + 공생체) 또는 작은 유기체(<1mm)의 생리학적 특성 분석을 위한 새로운 미세 호흡 측정 도구의 개략도. 맞춤형 호흡 측정 챔버가 만들어졌습니다(1번; 1.1-1.6). 여기에는 산소 센서 스폿(1.2)이 있는 뚜껑(1.1)과 개별 청소년(1.3)이 자석 교반기(1.5) 위에 놓인 플로우 스루 스탠드(1.4)에 배치되며, 모두 유리 챔버(1.6) 내에 맞습니다. 컨트롤러(2)는 덮개(1)에 맞고 컴퓨터(3)에 연결되는 광섬유 케이블로 스폿에 부착됩니다. 히터/냉각기(4)는 모터(5) 및 전원 공급 장치(8)로 구동되는 기어(6)가 있는 교반기 플레이트(7) 상단에 있는 흐름 통과 물(방향은 갈매기 화살표로 표시)로 호흡 측정 플레이트(9)에 연결됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 미세 호흡 측정 설정. (A) 하나의 호흡 측정 플레이트 또는 (B) 여러 플레이트에 연결된 것을 포함하여 여러 옵션을 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 호흡 측정 플레이트 위에 맞춤 제작된 마그네틱 교반기 플레이트. 각 챔버에는 (A) 아래에 자석 교반기 기어가 있고, (B) 모터로 구동되며, (C) 튜브로 히터/냉각기에 연결된 호흡 측정 플레이트가 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 맞춤형 호흡 측정 챔버 설정. (A) 구성품(왼쪽에서 오른쪽으로: 뚜껑, 유리 바이알, 스탠드, 스케일용 1.5ml 튜브 및 교반기 막대). (B) 시편이 안착되는 개별 플로우 스루 스탠드. (C) 하향식 view 플로우 스루 스탠드의 모습. (D) 뚜껑이 조여진 유리 바이알 내부에 스탠드를 놓은 상태에서. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 교반기 플레이트 내에 배치된 유리 바이알. (A) (B) 뚜껑이 설정된 전체 유리 바이알의 클로즈업이 있는 맞춤형 교반기 플레이트. 어린 산호는 여기 뚜껑(갈색 점)을 통해 볼 수 있으며, 지퍼 타이 위에 광섬유가 뚜껑 입구에 배치되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 교정 준비가 완료된 챔버를 거꾸로 배치한 모습. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
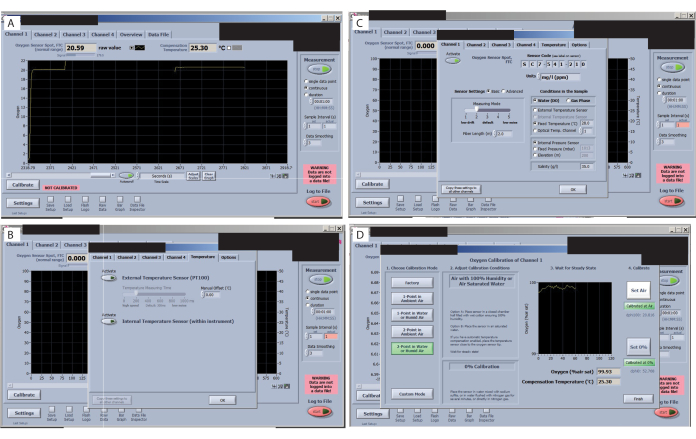
그림 7: 산소 측정 소프트웨어의 주요 단계. (A) 각 센서의 신호를 확인합니다. 이 연구 및 센서에 대한 최적의 신호는 산소 센서 스폿 FTC(정상 범위)에 표시됩니다. (B) 신호 드리프트를 확인합니다. (C) 처리 온도를 설정하고 확인합니다. (D) 0% 및 100% 보정을 설정하고 확인합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: respR 분석 출력 단계 I. (A) 명령 및 출력을 검사합니다. (B) 속도 안정성을 확인하십시오. (C) 가장 선형적인 비율을 결정합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
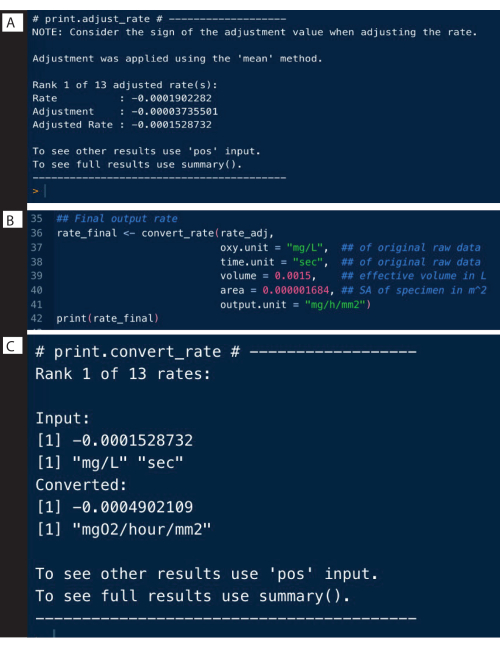
그림 9: respR 분석 출력 단계 II. (A) 배경에 대한 비율을 조정하고, (B) 변환 및 (C) 속도를 확인합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
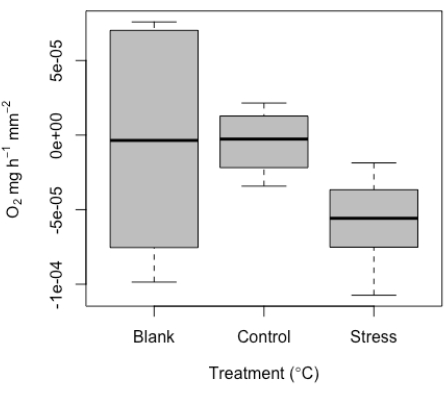
그림 10: 미세 호흡 측정 도구에서 생성된 대표적인 결과. 복제된 개별 산호 새끼의 중간 호흡(O2 ± 표준 오차)은 공백 값뿐만 아니라 통제 하에 있는 개체의 호흡 및 고온 스트레스 조건을 포함합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
비디오 1: 측정 세션 중 어린 산호가 내부에 있는 호흡 측정 챔버의 하향식 보기. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
표 1: 호흡 측정 장치의 구성 요소에 대한 비용 추정치. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
이 작업은 작은 고착성 수생 생물이 소비하고 생성하는 산소의 양을 정량화하는 데 사용할 수 있는 맞춤형 미세 호흡 측정 설정의 구성을 간략하게 설명합니다. 이 프로토콜의 중요한 구성 요소에는 스폿을 포함한 챔버 설정과 respR 패키지를 사용한 낮은 신호 교정이 포함되며, 여기서 낮은 신호는 얕거나 잡음이 많은 기울기로 대표되는 속도로 정의될 수 있습니다. 맞춤형 챔버와 그 설정을 통해 낮은 신호도 감지할 수 있으며, R 패키지를 사용하면 얕거나 시끄러운 슬로프의 발생으로 인해 결과를 잘못 해석할 수 있는 문제(예: 위양성)로부터 보호할 수 있습니다.
다른 사용자를 위해 필요한 잠재적인 수정에는 맞춤형 챔버 내에서 관심 유기체를 확보하는 것이 포함됩니다. 이 경우 작고 단단한 지퍼 타이와 수족관 접착제를 사용하여 한 마리의 청소년을 플라스틱 받침대에 고정 한 다음 넥타이에 붙였습니다. 이 실험을 위해 산호 새끼는 검은 색 플라스틱 시트에 정착했습니다. 이 플라스틱을 사용하면 어린 산호를 쉽게 제거할 수 있었고, 플라스틱에서 효과적으로 미끄러져 제거 중에 물리적으로 해를 입지 않았습니다. 산호 새끼는 그들이 정착하는 기질에 부착되므로, 접착 공정을 위한 제거를 용이하게 하기 위해 인공 펩타이드(16 )를 사용하여 유사한 플라스틱 재료에 정착시키는 것이 좋습니다. 취급 스트레스와 호흡 반응에 미치는 영향을 최소화하기 위해 많은 성체 산호 스트레스 실험에서 흔히 볼 수 있듯이 지퍼 타이에 장착된 산호가 1-2주 동안 적응하도록 하는 것이 좋습니다. 뚜껑의 지점 위에 유기체를 고정하고 물 순환을 허용하기 위해 다른 수정이 필요할 수 있습니다. 또 다른 주요 문제 해결 단계는 특히 속도를 결정해야 하는 산소 시계열의 기울기에 대한 신호 감지와 관련이 있습니다. 궁극적으로, 이것은 명백히 불안정한 데이터를 배제하기 위해 올바른 판단을 사용하는 것과 일관되게 선택된 영역에서 또는 데이터의 선형 영역을 식별하여 자동으로 속도를 추출할 수 있도록 하는 respR 내의 함수의 조합으로 귀결됩니다. 이 작업을 수행하는 방법에 대한 추가 예는 respR 웹 사이트에서 확인할 수 있습니다.
이 방법은 호흡의 하한 측정을 극도로 작고 고착된 해양 무척추 동물로 확장하기 위해 개발되었습니다. 명백한 한계는 이 프로토콜이 더 큰 바이오매스를 위해 설계된 프로토콜에 비해 위양성(false-positive)이 발생하기 쉽다는 것입니다. 그러나 이것이 설계의 요점(이러한 하한을 측정하는 것)이라는 점을 감안할 때 이는 설계에 고려되었으며 이 절차를 respR 패키지와 함께 사용하여 오탐을 더 잘 방지할 수 있습니다. 또한, 호흡(30)을 측정하기 위한 다른 시스템들이 존재하고, 이보다 더 작은 부피(~0.5-1 mL)의 개별 요각류(31 )에 대한 호흡측정법을 포함한 작은 유기체의 측정이 존재하지만, 비용이 많이 들거나 특정 성분(교반 능력)이 부족하다는 것을 인정하는 것이 중요하다. 그러나 이 시스템은 오픈 소스이며 상용 시스템(예: Core Microplate 시스템)에 비해 상대적으로 저렴합니다. 이 시스템은 또한 다른 시스템에는 부족할 수 있는 교반과 같은 주요 방법론적 고려 사항을 통합합니다. 내부 교반 막대 기능은 많은 해양 생물(예: 수영 을 통한 요각류)의 자연적인 물 혼합을 복제하는 데 필수적이며, 이는 종종 불가능하고 데이터를 거의 사용할 수 없게 만들 수 있습니다. 대조적으로, 사용 가능한 다른 혼합 방법에는 전체 호흡계를 거대한 로커 벤치에 배치하는 것이 포함되는데, 이는 추가 장비가 필요하고 혼합 성공이 제한적이거나 유기체에 교란을 일으킬 수 있는 진동을 통한 혼합입니다. 이러한 이유로, 이것은 어린 산호 또는 기타 매우 작은 고착 유기체에 대한 호흡 측정을 수행할 수 있는 유일한 시스템입니다. 참고로, 여기에 포함된 표본의 크기 범위는 2.1 - 3.6 폴립(단지 몇 개월 된 것에 해당)이었고, 최소 평균 면적은 1.3 내지 4.5 mm였다2.
호흡 측정은 생태 연구의 기본 척도이며 이를 위한 많은 방법이 있습니다. 그러나 이러한 기존 방법의 대부분은 전체 어류, 산호 조각 또는 해초를 포함한 높은 바이오매스 샘플을 대상으로 합니다 32,33,34. 이 방법은 개별 산호 새끼를 사용하는 최초의 방법입니다. 또한 이 방법은 유기체의 기능에 대한 주요 생리학적 정보를 제공하기 때문에 많은 잠재적인 응용 분야가 있습니다. 이는 기준선 건강 추정치35를 특성화하고, 열 스트레스36와 같은 산호 발생 기간 동안 급성 또는 장기 스트레스의 역할을 이해하거나, 관리자가 산호초의 건강을 보호하고 개선하기 위해 설정할 수 있는 임계값을 제공하려는 연구에 중요할 수 있다(37). 산호가 홀로비온트이고 공생체 군집이 이 단계와 생후 1년 동안 비교적 유연하다는 점을 감안할 때(38), 호흡 측정 데이터를 시간 경과에 따른 군집의 변화와 짝을 이루어 유기체 전체의 기능을 완전히 맥락화하는 것은 흥미로울 것입니다. 중요한 것은 이 방법이 공개적으로 공유, 개선 및 표준화할 수 있는 맞춤형 실험 설정을 만들기 위한 개요를 제공하는 데 도움이 되는 '오픈 사이언스' 기술에 기여한다는 것입니다.
공개
저자는 공개할 것이 없습니다.
감사의 말
저자는 도움과 조언을 해준 Sam Noonan, 초기 호흡 측정 챔버를 사용한 Sven Uthicke, 엔지니어링 일러스트레이션을 제공한 Ben Shelab, 호흡 측정 챔버 어댑터 및 홀더의 맞춤형 가공을 위한 Australian Institute of Marine Science 워크샵에 감사의 뜻을 전합니다. 산호는 AIMS G12/35236.1에 대한 다음 그레이트 배리어 리프 해양 공원 허가에 따라 수집되었습니다. 산호는 윤리 허가가 필요하지 않습니다.
자료
| Name | Company | Catalog Number | Comments |
| Cost | |||
| (1.1 – 1.6) Custom respirometry chambers | LabGlass Party Ldt. | 1.5 ml | $407.26 |
| 1.1 lids | AIMS workshop | Vial GL25 thread | ~$10 |
| 1.2 fiber-optics spots (FireStingO2 II fiberoptic optodes) | PyroScience | Oxygen sensor spots, 125 µm PET foil, Ø5 mm, with optical isolation, SN: 183801947 | $41.25 AUD each |
| 1.3 individual organism | NA | NA | NA |
| 1.4 flow-through stand | AIMS workshop | Custom | included in points 5 and 6 price (the workshop gave me an estimate of the lids, stand with gears, motor, incubation flow through |
| 1.5 magnetic stirrer | Any manufactuer is suitable | NA | ~$2? |
| 1.6 glass chamber (vial GL25 thread x 20 mm high, with bump/ridge, flat-ground rim, screw cap with hole, Labglass Pty Ltd, Stafford QLD) | Labglass Pty Ltd, Stafford QLD | Vial GL25 thread x 20 mm high, with bump/ridge, flat-ground rim, screw cap with hole | $50.9 AUD |
| 2 FireSting controller (2) | PyroSciences | NA | 4 sensors is 4000 Euros. 8 sensors used here. |
| 3 computer | NA | NA | NA |
| 4 heater/chiller | VWR International | NA | Small models around $4,000 AUD |
| 5 respirometry plate platform | AIMS workshop | 34 cm x 26 cm x 3 cm (although any dimensions are adequate to fit desired number of chambers) | $1250 AUD |
| 6 stirrer plate with gears (7) | AIMS workshop | 34 cm x 26 cm x 3 cm | $1250 AUD |
| 8 powered by the motor | AIMS workshop | Custom | $700 AUD |
| 9 power supply | Non-specific | NA | ~$300 AUD |
| Aquarium glue | Seachem reef glue | 20g | $14 |
| Oxygen Logger Software | PyroScience | NA | NA |
| Polypipe and connectors | John Guest | NA | $20 |
| Sodium Sulfite | Sigma | S0505-250G (CAS number 7757-83-7) | $54 |
참고문헌
- Quigley, K. M. A fast, precise, in-vivo method for micron-level 3D models of corals using dental scanners. Methods in Ecology and Evolution. 13 (10), 2159-2166 (2022).
- Svendsen, M. B. S., Bushnell, P. G., Steffensen, J. F. Design and setup of intermittent-flow respirometry system for aquatic organisms. Journal of Fish Biology. 88 (1), 26-50 (2016).
- Lighton, J. R. B. . Measuring Metabolic Rates: a Manual for Scientists. , (2018).
- Carey, N., Harianto, J., Byrne, M. Sea urchins in a high-CO2 world: partitioned effects of body size, ocean warming and acidification on metabolic rate. The Journal of Experimental Biology. 219 (Pt 8), 1178-1186 (2016).
- Clark, T. D., Sandblom, E., Jutfelt, F. Aerobic scope measurements of fishes in an era of climate change: respirometry, relevance and recommendations. The Journal of Experimental Biology. 216 (Pt 15), 2771-2782 (2013).
- Voolstra, C. R., et al. Extending the natural adaptive capacity of coral holobionts. Nature Reviews Earth & Environment. 2 (11), 747-762 (2021).
- Hoegh-Guldberg, O. Climate change, coral bleaching and the future of the world's coral reefs. Marine and Freshwater Research. 50 (8), 839-866 (1999).
- Morris, L. A., Voolstra, C. R., Quigley, K. M., Bourne, D. G., Bay, L. K. Nutrient availability and metabolism affect the stability of coral-symbiodiniaceae symbioses. Trends in Microbiology. 27 (8), 678-689 (2019).
- Yellowlees, D., Rees, T. A. V., Leggat, W. Metabolic interactions between algal symbionts and invertebrate hosts. Plant, Cell & Environment. 31 (5), 679-694 (2008).
- Rädecker, N., et al. Using Aiptasia as a model to study metabolic interactions in cnidarian-Symbiodinium symbioses. Frontiers in Physiology. 9, 214 (2018).
- Matthews, J. L., et al. Optimal nutrient exchange and immune responses operate in partner specificity in the cnidarian-dinoflagellate symbiosis. Proceedings of the National Academy of Sciences. 114 (50), 13194-13199 (2017).
- Davy, S. K., Allemand, D., Weis, V. M. Cell biology of cnidarian-dinoflagellate symbiosis. Microbiology and Molecular Biology Reviews. 76 (2), 229-261 (2012).
- Weis, V. M. Cellular mechanisms of Cnidarian bleaching: stress causes the collapse of symbiosis. The Journal of Experimental Biology. 211 (Pt 19), 3059-3066 (2008).
- Baker, D. M., Freeman, C. J., Wong, J. C. Y., Fogel, M. L., Knowlton, N. Climate change promotes parasitism in a coral symbiosis. The ISME Journal. 12 (3), 921-930 (2018).
- Chakravarti, L. J., van Oppen, M. J. H. Experimental evolution in coral photosymbionts as a tool to increase thermal tolerance. Frontiers in Marine Science. 5, 227 (2018).
- Quigley, K. M., Alvarez Roa, C., Beltran, V. H., Leggat, B., Willis, B. L. Experimental evolution of the coral algal endosymbiont, Cladocopium goreaui: lessons learnt across a decade of stress experiments to enhance coral heat tolerance. Restoration Ecology. 29 (3), e13342 (2021).
- Buerger, P., et al. Heat-evolved microalgal symbionts increase coral bleaching tolerance. Science Advances. 6 (20), eaba2498 (2020).
- Bieri, T., Onishi, M., Xiang, T., Grossman, A. R., Pringle, J. R. Relative contributions of various cellular mechanisms to loss of algae during cnidarian bleaching. PLoS One. 11 (4), e0152693 (2016).
- Tremblay, P., Gori, A., Maguer, J. F., Hoogenboom, M., Ferrier-Pagès, C. Heterotrophy promotes the re-establishment of photosynthate translocation in a symbiotic coral after heat stress. Scientific Reports. 6, 38112 (2016).
- Tremblay, P., Grover, R., Maguer, J. F., Hoogenboom, M., Ferrier-Pagès, C. Carbon translocation from symbiont to host depends on irradiance and food availability in the tropical coral Stylophora pistillata. Coral Reefs. 33 (1), 1-13 (2014).
- Wooldridge, S. A. Is the coral-algae symbiosis really 'mutually beneficial' for the partners. Bioessays. 32 (7), 615-625 (2010).
- Wooldridge, S. A. Breakdown of the coral-algae symbiosis: towards formalising a linkage between warm-water bleaching thresholds and the growth rate of the intracellular zooxanthellae. Biogeosciences. 10 (3), 1647-1658 (2013).
- Coles, S. L., Jokiel, P. L. Effects of temperature on photosynthesis and respiration in hermatypic corals. Marine Biology. 43, 209-216 (1977).
- Marubini, F., Davies, P. S. Nitrate increases zooxanthellae population density and reduces skeletogenesis in corals. Marine Biology. 127, 319-328 (1996).
- Iglesias-Prieto, R., Matta, J. L., Robins, W. A., Trench, R. K. Photosynthetic response to elevated temperature in the symbiotic dinoflagellate Symbiodinium microadriaticum in culture. Proceedings of the National Academy of Sciences. 89 (21), 10302-10305 (1992).
- Karako-Lampert, S., Katcoff, D. J., Achituv, Y., Dubinsky, Z., Stambler, N. Responses of Symbiodinium microadriaticum clade B to different environmental conditions. Journal of Experimental Marine Biology and Ecology. 318 (1), 11-20 (2005).
- Blanckaert, A. C. A., Reef, R., Pandolfi, J. M., Lovelock, C. E. Variation in the elemental stoichiometry of the coral-zooxanthellae symbiosis. Coral Reefs. 39, 1071-1079 (2020).
- Harianto, J., Carey, N., Byrne, M. respR-An R package for the manipulation and analysis of respirometry data. Methods in Ecology and Evolution. 10 (6), 912-920 (2019).
- Gamble, S., Carton, A. G., Pirozzi, I. Open-top static respirometry is a reliable method to determine the routine metabolic rate of barramundi. Lates calcarifer. Marine and Freshwater Behaviour and Physiology. 47 (1), 19-28 (2014).
- Burford, B. P., et al. Rapid range expansion of a marine ectotherm reveals the demographic and ecological consequences of short-term variability in seawater temperature and dissolved oxygen. The American Naturalist. 199 (4), 523-550 (2022).
- Morozov, S., McCairns, R. J. S., Merilä, J. FishResp: R package and GUI application for analysis of aquatic respirometry data. Conservation Physiology. 7 (1), coz003 (2019).
- Leclercq, N., Gattuso, J. -. P., Jaubert, J. Primary production, respiration, and calcification of a coral reef mesocosm under increased CO2 partial pressure. Limnology and Oceanography. 47 (2), 558-564 (2002).
- Anthony, K. R. N., Hoegh-Guldberg, O. Variation in coral photosynthesis, respiration and growth characteristics in contrasting light microhabitats: an analogue to plants in forest gaps and understoreys. Functional Ecology. 17, 246-259 (2003).
- Moulin, L., et al. Long-term mesocosms study of the effects of ocean acidification on growth and physiology of the sea urchin Echinometra mathaei. Marine Environmental Research. 103, 103-114 (2015).
- Quigley, K. M., Bay, L. K., van Oppen, M. J. H. Genome-wide SNP analysis reveals an increase in adaptive genetic variation through selective breeding of coral. Molecular Ecology. 29 (12), 2176-2188 (2020).
- Brunner, C. A., Ricardo, G. F., Uthicke, S., Negri, A. P., Hoogenboom, M. O. Effects of climate change and light limitation on coral recruits. Marine Ecology Progress Series. 690, 65-82 (2022).
- Quigley, K. M., Alvarez Roa, C., Torda, G., Bourne, D., Willis, B. L. Co-dynamics of Symbiodiniaceae and bacterial populations during the first year of symbiosis with Acropora tenuis juveniles. MicrobiologyOpen. 9 (2), e959 (2020).
- Quigley, K. M., Bay, L. K., Torda, G., Willis, B. L. Leveraging new knowledge of Symbiodinium community regulation in corals for conservation and reef restoration. Marine Ecology Progress Series, 600. , 245-253 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유