需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
腹膜内移植在小鼠中产生急性髓系白血病
摘要
在这里,腹膜内注射白血病细胞用于在小鼠中建立和繁殖急性髓性白血病(AML)。这种新方法在AML细胞的连续移植中是有效的,并且可以作为那些可能在小鼠静脉注射中遇到困难和不一致的人的替代方案。
摘要
治疗急性髓系白血病(AML)和涉及持续性白血病干细胞(LSCs)的相关复发的新疗法的需求尚未得到满足。一种实验性AML啮齿动物模型测试基于通过眶后注射在受体小鼠中成功移植这些细胞的疗法,充满了挑战。本研究的目的是开发一种简单、可靠和一致的方法,使用腹膜内途径生成强大的 AML 小鼠模型。在本协议中,骨髓细胞用表达人MLL-AF9融合癌蛋白的逆转录病毒转导。测试了谱系阴性(Lin-)和Lin-Sca-1 + c-Kit+(LSK)群体作为供体LSC在原发性AML发展中的效率,并采用腹膜内注射作为产生AML的新方法。在连续移植中对腹膜内和眶后注射进行比较,以比较和对比两种方法。用人MLL-AF9病毒转导的Lin细胞和LSK细胞都很好地移植在受体的骨髓和脾脏中,导致全面的AML。连续移植时腹膜内注射供体细胞在受者中建立AML,并通过流式细胞术、qPCR和组织学分析在受者的血液、骨髓、脾脏和肝脏中检测到AML细胞浸润。因此,腹膜内注射是一种使用供体白血病细胞连续移植诱导AML的有效方法。
引言
急性髓系白血病(AML)是一种病因多样的血液系统恶性肿瘤,预后不良1。AML动物模型的产生为理解其复杂的变异和病理生物学奠定了基础,以努力发现新的疗法2。小鼠的白血病发生涉及表达融合癌蛋白的供体细胞的移植,包括涉及混合谱系白血病(MLL)基因的融合,以有效诱导AML,以模拟人类的疾病3。在MLL基因相关AML4的移植中,已经报道了供体细胞的各种细胞起源,对导致疾病起源的细胞知之甚少。
已经开发了多种途径用于小鼠移植;与将突变供体细胞直接引入骨髓5 的股内注射不同,利用静脉窦丛、尾静脉和颈静脉的静脉注射已被广泛用于生成鼠 AML 模型6,7,8,9。在眶后(r.o.)注射的情况下,各种固有的缺点,如体积限制、高技术要求、重复尝试或错误的机会很少以及潜在的眼部损伤,一直是主要的绊脚石,有限的或没有可行的替代方案7。除了局部损伤外,尾静脉注射还可能存在类似的问题;为了促进手术,小鼠通常需要加热以扩张尾静脉10。如果没有额外的光源,也很难找到尾静脉,特别是在小鼠的C57BL / 6品系中。对于颈静脉注射,研究人员需要足够的培训来定位静脉并限制可能的并发症。此外,静脉窦和颈静脉注射都需要在麻醉下进行,这增加了另一个层次的复杂性。因此,探索新的移植途径以促进AML小鼠模型的建立是很诱人的。
腹膜内(ip)注射通常用于施用药物,染料和麻醉剂11,12,13,14,15;它还被用于引入异位造血的造血细胞16,并在各种小鼠模型中移植骨髓来源的间充质干细胞17,18,19,20,21。然而,它很少用于建立小鼠的造血恶性肿瘤,特别是研究AML疾病的进展。
除了比较谱系阴性(Lin-)和Lin-Sca-1 + c-Kit+(LSK)群体作为供体细胞的移植效率外,本研究还描述了腹腔注射在AML小鼠模型生成中的可行性。这些发现为生成AML和相关髓系白血病的实验模型提供了一种简单有效的方法。这种方法有可能进一步了解疾病机制,并提供一个相对容易的模型来测试实验性疗法。
研究方案
所有实验均由宾夕法尼亚州立大学机构动物护理和使用委员会预先批准。
1. 缓冲液和试剂的制备
- 准备氨苄青霉素补充(AP)LB琼脂平板(无菌10厘米平板)。为此,将 10 克 LB 肉汤与琼脂溶解在 400 mL 蒸馏水中,搅拌,使体积达到 500 mL。通过高压灭菌对溶液进行灭菌,然后让溶液冷却,向溶液中加入0.5mL氨苄西林(库存:150mg / mL),摇晃混合。立即将18mL溶液加入酒精灯附近的无菌10cm板中,在室温下固化,并将板倒置储存在4°C直至进一步使用。
- 通过将 10 g 不含琼脂的 LB 溶解在 500 mL 蒸馏水中来制备 LB 培养基。高压灭菌溶液,让溶液冷却,向溶液中加入0.5mL氨苄西林(库存:150mg/mL),摇匀。
- 通过将 5 mL 青霉素/链霉素和 10 mL 热灭活胎牛血清 (hiFBS) 加入 485 mL 的 1x Dulbecco 磷酸盐缓冲盐水 (DPBS) 中来制备流动缓冲液。
注意:要通过加热灭活FBS,请将解冻的FBS瓶放入56°C水浴中。确保瓶子不会翻倒或以其他方式浸没在水浴中。温度对于完全降解至关重要;为确保这一点,请在将瓶子放入水浴后等到温度稳定在56°C。每10分钟轻轻旋转一次瓶子三次。不要让血清孵育超过30分钟。 - 通过将 50 mL hiFBS、5 mL L-谷氨酰胺和 5 mL 青霉素/链霉素添加到 440 mL Dulbecco 的改良鹰培养基 (DMEM) 中来制备维持培养基。通过将 50 mL hiFBS 和 5 mL L-谷氨酰胺加入 445 mL DMEM 培养基中来制备转染培养基。
- 通过将 4.145 g NH4Cl、0.504 g NaHCO3 和 16.81 mg 乙二胺四乙酸 (EDTA) 加入 500 mL 蒸馏水中来制备红细胞 (RBC) 裂解缓冲液。通过将 75 mL hiFBS、5 g 牛血清白蛋白 (BSA)、0.5 mL 10 mg/mL 胰岛素、2.5 mL 4 mg/mL 全转铁蛋白、3.5 μL β-巯基乙醇、5 mL L-谷氨酰胺和 0.5 mL 环丙沙星添加到 416.5 mL IMDM 培养基中,制备不完整的 Ico 改良 Dulbecco 培养基 (IMDM)。
- 通过加入 10 μL 50 ng/μL mr-SCF、20 μL 25 ng/μL mr-Flt3L、20 μL 10 ng/μL mr-IL-6、20 μL 10 ng/μL mr-IL-3、10 μL 10 mg/mL 胰岛素,制备 10 mL 2x IMDM 培养基,其中细胞因子浓度是 1x IMDM 培养基中的两倍, 以及将 50 μL 的 4 mg/mL 全转铁蛋白倒入 9.87 mL 不完整的 IMDM 培养基中。
注意:确保流动缓冲液、红细胞裂解缓冲液、维持培养基、转染培养基和不完整的IMDM培养基在使用前进行过滤灭菌。
2. 质粒转化
- 在冰上解冻 20 μL α-选择感受态细胞。向解冻的感受态细胞中加入 1 μL (~2 ng) MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC3 质粒22 ,并通过敲击试管轻轻混合。将反应在冰上孵育30分钟。
- 通过在42°C加热块中孵育40秒来热冲击混合物。立即将管子在冰上转移2分钟。
- 向管中加入1mLLB培养基(不含氨苄青霉素),并在37°C和200rpm下摇动1小时。
- 将管在室温下以500× g 离心4分钟,弃去0.9mL上清液。将沉淀物重悬于剩余的 0.1 mL LB 培养基中。
- 将转化的感受态细胞散布在预热(37°C)AP LB琼脂平板上。将板在37°C下倒置孵育12-16小时。
- 选择一个菌落,并将转化的细胞在10mL的AP LB培养基中以37°C和200rpm消耗过夜。
- 将 5 mL 消耗转化的感受态细胞加入烧瓶中的 500 mL AP LB 培养基中,并将烧瓶在 37 °C 和 200 rpm 下孵育过夜。
- 根据制造商的说明使用质粒提取试剂盒提取质粒,并重悬于0.5 mL高压灭菌的超纯水中。使用分光光度计定量质粒。
3. 凤凰生态(pECO)细胞的转染
- 在37°C的加湿5%CO 2培养箱中的10cm板中在维持培养基中培养2 x 106 pECO细胞/板。 确保pECO细胞维持在指数生长期并在传代前积极分裂。
- 当细胞汇合80%时,用5mL DPBS洗涤板两次,向板中加入1mL胰蛋白酶,并在37°C的加湿5%CO 2培养箱中孵育2 分钟。在无菌15mL管中用5mL维持培养基收获细胞,并在4°C和400× g 下离心3分钟。将细胞沉淀重悬于 5 mL 维持培养基中。
- 混合 10 μL 细胞悬液和 10 μL 台盼蓝,将 10 μL 上样到血细胞计数器上以计数细胞。
总细胞数/mL = (计数细胞总数 x 稀释因子 x 104 个 细胞/mL)/ 计数的平方数)
使用5 mL维持培养基将2 x 106 个细胞/培养皿接种到6cm培养皿中,并在37°C的加湿的5%CO2 培养箱中培养细胞。 - 当细胞在培养18小时后融合50%-60%时,用5mL转染培养基替换维持培养基。
- 转染前将转染试剂在室温下保持至少30分钟。
- 在无菌 1.5 mL 管中加入 5.5 μg MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC3 质粒22 至 0.5 mL 普通 DMEM 培养基。通过敲击管轻轻混合,让它静置 10 分钟。
- 向试管中加入 14.6 μL(质粒量的 3 倍;v/w)转染试剂,每 10 分钟轻轻敲击试管 3 次。
- 将混合物均匀地滴加到培养皿的所有区域,并在转染培养基中使用pECO细胞。轻轻地前后移动盘子 10 次,侧向移动 10 次。将培养皿在37°C的加湿5%CO2 培养箱中孵育48小时。
- 如22中所述,通过荧光显微镜和流式细胞术测量绿色荧光蛋白(GFP)的转染效率。细胞首先在FSC-A / FSC-H和FSC-A和SSC-A上设门以获得单线态。通过将GFP+ 群体与非转染细胞进行比较,在FL1图上对GFP +群体进行门控。
- 通过0.45μm注射器过滤器收集上清液并将其过滤到无菌50mL管中。立即使用上清液进行转导或将其快速冷冻在液氮中并储存在-80°C直至进一步使用。
注意:pECO细胞必须正确混合并均匀接种在培养皿中。接种时,通过将培养皿向前和向后移动 10 次和侧向移动 10 次来让细胞扩散。要接种的细胞数可能因计数的变化而异。为了找到培养18小时后可以实现50%-60%汇合的最佳接种细胞数量,使用连续稀释液接种细胞是有帮助的。
4. 慢病毒转导
- 在CO2 室中对8-10周龄的CD45.1雌性C57BL6 / J小鼠(每只受体小鼠两到三只供体小鼠)实施安乐死。
- 用70%乙醇对小鼠的全身进行灭菌。将小鼠放在聚苯乙烯泡沫塑料板上的无菌手术垫上,并将腿固定在鼠标爪垫上。
- 在中线切开腹腔上方的皮肤,并用锋利的无菌剪刀将皮下空间扩大到后腿。
- 将切口从腹部中线向下延伸到脚踝。用锋利的无菌剪刀刀片扩大后腿下方的皮下空间。
- 用锋利的无菌剪刀剪断跟腱。用带齿的镊子握住肌腱,切开附着在股骨上的另一端以去除腓肠肌。
- 用锋利的无菌剪刀剪断附着在膝盖上的股四头肌肌腱。用带牙的镊子握住肌腱,切开附着在股骨上的肌肉头,去除腓肠肌。
- 用锋利的无菌剪刀切割连接到胫骨末端的股骨周围的其他肌肉。
- 用锋利的无菌剪刀剪断脚踝,确保胫骨保持完整。用带牙的镊子固定股骨远端,用锋利的无菌剪刀剪断髋关节,确保股骨头保持完整。
- 将胫骨和股骨转移到无菌 15 mL 管中的流动缓冲液中。
- 用手打破膝盖来分开胫骨和股骨。用手切除髌骨、软骨和股骨髁,露出胫骨平台和股骨远端。使用无菌纱布去除肌肉,然后将骨头浸泡在流动缓冲液中。
- 切开股骨颈,并使用带有 23 G 针头的 10 mL 注射器从股骨两端用流动缓冲液冲洗骨髓细胞。
- 切开胫踝,并使用带有23G针头的10mL注射器从胫骨两端用流动缓冲液冲洗骨髓细胞。
- 通过使用带有 18 G 针头的 10 mL 注射器上下移液来分散细胞。将单细胞悬液在4°C和400× g 下离心3分钟。
- 弃去上清液并将细胞重悬于5mL红细胞裂解缓冲液中以裂解红细胞3分钟。
- 加入5mL流动缓冲液以停止裂解,并将细胞悬液在4°C和400× g 下离心3分钟。
- 将 70 μm 细胞过滤器放在无菌 50 mL 管上。用 5 mL 流动缓冲液悬浮沉淀,混合并通过细胞过滤器以收集细胞。
- 在圆底聚丙烯管中用流动缓冲液将细胞浓度调节至 1 x 108/mL。
- 根据制造商的说明,使用小鼠造血细胞分离试剂盒选择Lin- 细胞。
- 在 100 μL 缓冲液中留出三管 1 x 104 细胞,用于一个未染色的对照和两个用于 APC 偶联抗小鼠 CD117 (c-Kit) 和 PE-Cy7 偶联抗小鼠 Ly-6A/E (Sca-1) 的单抗体染色对照。对每个抗体染色的对照使用 1 μL 抗体(来自 0.2 mg/mL 储备液)。
- 在 400 μL 中用两种抗体(来自 0.2 mg/mL 储备液的每种抗体各 4 μL)对其余细胞进行染色。 将试管在黑暗中的冰上孵育0.5-1小时。
- 染色后,通过加入1mL流动缓冲液并在4°C和400× g 下离心3分钟来洗涤细胞。
- 将未染色对照和单抗体染色对照的细胞重悬于100 μL流动缓冲液中。将双抗体染色的细胞重悬于 1 mL 流动缓冲液中进行分选。
- 如23,24中所述,使用细胞分选仪将造血干细胞(HSC)分类为LSK群体。
- 染色时,按如下方式在无菌 6 cm 培养皿上涂上 retronectin:在 PBS 中制备 100 μg/mL 的再连接蛋白原液,并在 6 cm 培养皿中加入 0.9 mL PBS 和 0.1 mL 再连蛋白。将培养皿在室温下涂在无菌罩中2小时。然后,取出再连蛋白并用 0.5 mL 过滤的 2% BSA(PBS)封闭培养皿 30 分钟。用 5 mL PBS 清洗培养皿两次,培养皿即可进行转导。
- 将分选的HSC或未分选的Lin- 细胞在4°C和400× g 下离心3分钟,并在3mL的2x(细胞因子)IMDM培养基和3mL病毒上清液(从步骤3.10产生)中重悬于retron连蛋白包被的培养皿中。将培养皿在37°C的加湿5%CO2 培养箱中孵育6或24小时。
注意:在本研究中,Lin- 细胞根据实验设计进行分选或未分选。
5.连续移植(图1)
注意:主要受体小鼠是8-10周龄的雄性C57BL6 / J小鼠(CD45.2)。从移植前3天到移植后7天,随意向他们 提供含有抗生素 的水,以防止机会性消化系统感染。在移植前3小时对原受者小鼠进行亚致死性照射(4.75Gy)25。异氟醚不应用于腹膜内注射的小鼠。
- 转导6或24小时后,通过在室温和400× g 下离心3分钟来收获细胞。如果需要,使用胰蛋白酶收集附着在培养皿底部的细胞。弃去上清液并将细胞重悬于预热的PBS中。根据受者数量确定PBS的体积(即,眶后和腹膜内注射的受者分别为0.1 mL /小鼠和0.5 mL /小鼠)。
- 将亚致死辐照的受体小鼠置于异氟烷室中(氧气流速设置为1.0L / min,异氟醚蒸发器设置为5%)。在麻醉下将湿软膏涂抹在眼睛上以防止干燥。当心跳降至每分钟60次时,小鼠已准备好进行进一步的手术。
- 用27 G1 / 2针将细胞眶后(0.1mL /小鼠)7 或腹膜内(0.5mL /小鼠)26 注射到主要受体小鼠中。连续观察小鼠,直到它们获得足够的意识以维持胸骨卧位。每天监测小鼠移植后的健康状况。
- 1 个月后,每周通过眶后出血采集血液,通过评估血红细胞全血细胞计数 (CBC) 来监测白细胞增多,如下所述。
- 用异氟醚麻醉后横向放置小鼠(氧气流速设置为1.0L / min,等氟蒸发器设置为5%)。当心跳降至每分钟60次时,小鼠已准备好进行进一步的手术。
- 用拇指和食指撑起眼睛。用星状半肌毛细管穿过内眦穿透静脉窦丛。
- 将 20-25 μL 血液收集到 EDTA 采血管中并关闭眼睑以止血。将一滴硫酸庆大霉素眼用溶液涂抹在眼睛上。
- 在终点,当白细胞(WBC)达到4 x 10 4个细胞/ μL时,在CO2室中对小鼠实施安乐死,并通过用流动缓冲液冲洗股骨和胫骨来分离骨髓细胞,然后如步骤4中所述进行红细胞裂解。
- 在终点,如下所述收获脾细胞。
- 在CO2 室中对小鼠实施安乐死。将小鼠放在聚苯乙烯泡沫塑料板上的无菌手术垫上,并将腿固定在鼠标爪垫上。用70%乙醇对小鼠的全身进行灭菌。
- 用锋利的无菌剪刀切开中线的皮肤和肌肉,露出腹腔。用锋利的无菌剪刀分离脾脏,并将其放入无菌 15 mL 管中的流动缓冲液中。
- 在 6 cm 培养皿中用 3 mL 流动缓冲液将脾脏啮合到 6 cm 培养皿中。将细胞从培养皿转移到无菌的15mL管中,并在4°C和400× g 下离心单细胞悬液3分钟。
- 弃去上清液并将细胞重悬于5mL红细胞裂解缓冲液中以裂解红细胞3分钟。加入5mL流动缓冲液以停止裂解,并将细胞悬液在4°C和400× g 下离心3分钟。
- 将 70 μm 细胞过滤器放在无菌 50 mL 管上。用 5 mL 流动缓冲液悬浮沉淀,混合并通过细胞过滤器收集细胞。
- 通过用FITC偶联的抗小鼠CD45.1抗体染色脾细胞和骨髓细胞并在流式细胞仪上进行检测来鉴定原代(1°)AML细胞。细胞首先在FSC-A / FSC-H和FSC-A和SSC-A上设门以获得单线态。通过将其与未染色的细胞进行比较,在FL1图上对CD45.1 +群体进行门控。
- 对于二次(2°)移植,将来自1°r.o.受体的CD45.1 AML脾细胞重悬于PBS(0.1mL /小鼠)中,并将其眶后注射到CD45.2雄性C57BL6 / J小鼠中。同时,将来自 1° ip. 受体的 AML 脾细胞重悬于 PBS(0.5 mL/小鼠)中,并将其腹膜内注射到 8-12 周龄的表达 Ai14TdTomato 雄性小鼠27 的红荧光蛋白 (RFP) 中。
- 对于三级(3°)移植,重悬从2°腹腔受者的骨髓或腹膜腔分离的AML细胞,并分别将其腹膜内注射到 Ai14TdTomato (RFP +)或CD45.2小鼠中。重悬从 2° r.o. 受体腹腔分离的 AML 细胞,并通过 r.o. 注射将它们移植到 Ai14TdTomato (RFP+) 小鼠中。
注意:对于2°移植,我们通过监测外周血中的CBC来确定2°受者的疾病进展。为了进一步确认AML的成立,我们通过心脏穿刺收集了全外周血以及骨髓,脾脏和肝脏。此外,我们进行了腹腔灌洗以收集腹膜外细胞。如上所述,从骨髓、脾脏和腹腔灌洗中获得单细胞悬浮液。红细胞裂解后,在流式细胞仪上分析来自这些位点的细胞。AML细胞被认为是RFP阴性(RFP-)细胞。对于3°移植,我们在终点取样血液,骨髓,脾脏,肝脏和腹腔内细胞;RFP或 CD45.1+ 细胞被鉴定为AML细胞,并通过流式细胞术检查。没有对2°和3°受体小鼠给予照射或抗生素水。
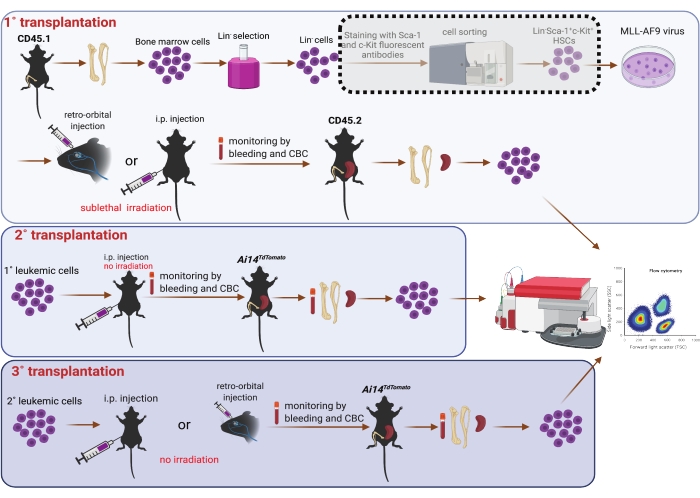
图 1:骨髓造血干细胞和连续移植(1°、2° 和 3°)中 MLL-AF9 病毒转导示意图。 如果资源允许,使用虚线阴影框中显示的细胞分选器对 Sca-1 和 c-Kit 双阳性群体进行分选被认为是可选的。该图是使用BioRender(https://biorender.com/)创建的。 请点击此处查看此图的大图。
6. 腹膜内灌洗
- 将 5 mL 不完整的 IMDM 培养基注入腹膜腔两次,以将细胞收集在 15 mL 无菌管中。在室温和400×g下离心细胞悬液3分钟。通过腹腔注射将AML细胞(4 x 105细胞/小鼠)从2°受体的腹膜腔移植到3°CD45.2受体小鼠(n = 3)中。
7. 组织学分析 28
- 安乐死后从小鼠中分离出脾脏、肝脏和股骨。将它们固定在 5 mL 的 10% (v/v) 缓冲福尔马林中。从健康同行中抽取脾脏和肝脏进行比较。
- 将固定组织嵌入石蜡中并将它们切成部分。用苏木精和伊红(H&E)染料染色切片。
- 在显微镜下以20倍放大倍率获取图像,并安装有兼容的软件进行组织学分析。
8. 进行半定量 PCR (qPCR)
- 根据制造商的说明在RNA试剂中制备RNA。
- 根据制造商的说明,使用0.5-1.0μgRNA使用cDNA逆转录试剂盒合成cDNA。
- 使用 cDNA 使用 qPCR 试剂盒进行 qPCR 操作,并在 qPCR 系统中运行样品。使用以下预先验证的 TaqMan 探针: KMT2A (MLL;参考序列:NM_001197104(2),IDT)29 和 18S 核糖体RNA(Hs99999901_s1)。
- 将 KMT2A 和 18S 扩增子加载到2%琼脂糖凝胶上以可视化表达。在与兼容软件程序一起安装的成像仪中采集图像。
9. 数据处理
- 使用统计分析软件分析结果,并将结果显示为SEM±平均值。 使用商业插画工具生成图形。
结果
使用r.o.和ip.移植途径的小鼠AML细胞移植效率的比较
以前,在用MLL-AF9转导的LSK细胞进行眶后移植的受体小鼠中报告了1°AML的建立,并且通过连续移植证明了1°AML细胞的可移植性30。本研究首次评估使用骨髓林细胞 进行移植的可能性。异常白细胞增多(图2A)的存在和骨髓和脾脏中白血病细胞(CD45.1+)浸润增加(
讨论
这些上述研究提供了支持性证据,证明Lin- 细胞的移植在1°鼠AML的产生中与LSK细胞相当。此外,目前的数据还表明,与静脉内(或r.o.)注射相比,腹腔注射是建立鼠AML的一种有效便捷的方法。
除LSK细胞外,据报道,其他群体(如粒细胞-单核细胞祖细胞(GMP)、淋巴总祖细胞(CLP)和髓系总祖细胞(CMP))在产生1° MLL-AF9诱导的AML时被取代为供体细胞,具有不同的孵育...
披露声明
作者声明不存在利益冲突。
致谢
作者感谢哈克研究所的流式细胞术核心设施和宾夕法尼亚州立大学兽医和生物医学科学系动物诊断实验室的组织病理学核心设施提供及时的技术支持。这项工作得到了美国癌症研究所(KSP),宾夕法尼亚州立大学农业科学学院,宾夕法尼亚州癌症研究所,USDA-NIFA项目4771,KSP和RFP的入藏号00000005的资助。
材料
| Name | Company | Catalog Number | Comments |
| a-Select competent cells | Bioline | BIO-85027 | |
| Ammonium chloride (NH4Cl) | Sigma Aldrich | Cat# A-9434 | |
| Ampicillin | Sigma Aldrich | Cat# A0797 | |
| Bovine Serum Albumin (BSA), Fraction V—Low-Endotoxin Grade | Gemini bio-products | Cat# 700-102P | |
| Ciprofloxacin HCl | GoldBio.com | Cat# C-861-100 | |
| DMEM, high glucose, no glutamine | Gibco | Cat# 11960-044 | |
| Dulbecco’s Phosphate-Buffered Saline (PBS) | Corning | Cat# 21-031-CV | |
| EDTA, Disodium Salt (EDTA-2Na), Dihydrate, Molecular Biology Grade | Calbiochem | Cat# 324503 | |
| Fetal Bovine Serum - Premium Select | Atlanta Biologicals | Cat# S11550 | |
| Holo-transferrin, bovine | Sigma Aldrich | Cat# T1283 | |
| Insulin solution human | Sigma | Cat# I-9278 | |
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | Cat# 12440-053 | |
| L-glutamine 200 mM (100×) solution | HyClone, Gelifesciences | Cat# SH30034.01 | |
| LB broth, Lennox | NEOGEN | Cat #: 7290A | |
| LB Broth with agar (Miller) | Sigma Aldrich | Cat# L-3147 | |
| Mouse anti-mouse CD45.1 (FITC) | Miltenyi Biotec | Cat# 130-124-211 | |
| Mouse Interleukin-3 (IL-3) | Gemini bio-products | Cat# 300-324P | |
| Mouse Interleukin-6 (IL-6) | Gemini bio-products | Cat# 300-327P | |
| Mouse Stem Cell Factor (SCF) | Gemini bio-products | Cat# 300-348P | |
| Penicillin-Streptomycin Solution, 100x | Corning | Cat# 30-002-CI | |
| Phenix-Eco (pECO) cells | ATCC | CRL-3214 | |
| Potassium Bicarbonate (KHCO3), Granular | JT. Baker | Cat# 2940-01 | |
| Rat anti-mouse CD117 (c-kit) (APC) | BioLegend | Cat # 105812 | |
| Rat anti-mouse Ly-6A/E (Sca-1) (PE-Cy7) | BD Pharmingen | Cat# 558162 | |
| Recombinant Murine Flt3-Ligand | Pepro Tech, INC. | Cat# 250-31L | |
| RetroNectin Recombinant Human Fibronectin Fragment | TaKaRa | Cat# T100A | |
| TransIT-293 Reagent | MirusBio | Cat# MIR 2705 | |
| TRI Reagent | Sigma Aldrich | Cat# T9424 | |
| Trypan Blue Solution, 0.4% | Gibco | Cat # 15250061 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | Cat# 25200-056 | |
| β-Mercaptoethanol (BME) | Sigma Aldrich | Cat# M3148 | |
| Commercial Assays | |||
| EasySep Mouse Hematopoietic Progenitor Cell Isolation Kit | StemCell technologies | Cat# 19856A | |
| High-Capacity cDNA Reverse Transcription Kit | Thermo Fisher | Cat# 4368813 | |
| PerfeCTa qPCR SuperMix | Quanta Bio | Cat# 95051-500 | |
| Plasmid Maxi Kit (25) | Qiagen | Cat#:12163 | |
| Animals | |||
| Ai14TdTomato mice | Jackson Laboratory | Strain # 007914 | |
| CD45.1 C57BL6/J mice | Jackson Laboratory | Strain # 002014 | |
| CD45.2 C57BL6/J mice | Jackson Laboratory | Strain # 000664 | |
| Instruments and Softwares | |||
| Adobe illustrator | Version 25.2.3 | ||
| BD accuri C6 flow cytometer | BD Biosciences | ||
| FlowJo 10.8.0 | BD | ||
| GeneSys software program | Version 1.5.7.0 | ||
| GraphPad Prism version 6 | GraphPad | ||
| Hemavet 950FS | Drew Scientific | ||
| 7300 Real time PCR system | Applied Biosystems | ||
| Syngene G:BOX Chemi XR5 Chemiluminescence Fluorescence Imaging | G:Box Chemi |
参考文献
- Dohner, H., Weisdorf, D. J., Bloomfield, C. D. Acute myeloid leukemia. The New England Journal of Medicine. 373 (12), 1136-1152 (2015).
- Fortier, J. M., Graubert, T. A. Murine models of human acute myeloid leukemia. Cancer Treatment and Research. 145, 183-196 (2010).
- Ernst, P., et al. Definitive hematopoiesis requires the mixed-lineage leukemia gene. Developmental Cell. 6 (3), 437-443 (2004).
- Fisher, J. N., Kalleda, N., Stavropoulou, V., Schwaller, J. The Impact of the cellular origin in acute myeloid leukemia: learning from mouse models. Hemasphere. 3 (1), 152 (2019).
- Zhan, Y., Zhao, Y. Hematopoietic stem cell transplant in mice by intra-femoral injection. Methods in Molecular Biology. 430, 161-169 (2008).
- Price, J. E., Barth, R. F., Johnson, C. W., Staubus, A. E. Injection of cells and monoclonal antibodies into mice: comparison of tail vein and retroorbital routes. Proceedings of the Society for Experimental Biology. 177 (2), 347-353 (1984).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animal. 40 (5), 155-160 (2011).
- Suckow, M. A., Danneman, P., Brayton, C. . The Laboratory Mouse. , (2001).
- Barr, J. E., Holmes, D. B., Ryan, L. J., Sharpless, S. K. Techniques for the chronic cannulation of the jugular vein in mice. Pharmacology, Biochemistry, and Behavior. 11 (1), 115-118 (1979).
- Kang, Y. Analysis of cancer stem cell metastasis in xenograft animal models. Methods in Molecular Biology. 568, 7-19 (2009).
- Nungestee, W., Wolf, A., Jourdonais, L. Effect of gastric mucin on virulence of bacteria in intraperitoneal injections in the mouse. Proceedings of the Society for Experimental Biology and Medicine. 30 (2), 120-121 (1932).
- Gargiulo, S., et al. Mice anesthesia, analgesia, and part I: anesthetic considerations in preclinical research. ILAR journal. 53 (1), 55-69 (2012).
- Leong, S. -. K., Ling, E. -. A. Labelling neurons with fluorescent dyes administered via intravenous, subcutaneous or intraperitoneal route. Journal of Neuroscience Methods. 32 (1), 15-23 (1990).
- Ma, P., et al. Intraperitoneal injection of magnetic Fe3O4-nanoparticle induces hepatic and renal tissue injury via oxidative stress in mice. International Journal of Nanomedicine. 7, 4809-4918 (2012).
- Schwarze, S. R., Ho, A., Vocero-Akbani, A., Dowdy, S. F. In vivo protein transduction: delivery of a biologically active protein into the mouse. Science. 285 (5433), 1569-1572 (1999).
- Muench, M. O., Chen, J. C., Beyer, A. I., Fomin, M. E. Cellular therapies supplement: the peritoneum as an ectopic site of hematopoiesis following in utero transplantation. Transfusion. 51, 106-117 (2011).
- Zhao, W., et al. Intravenous injection of mesenchymal stem cells is effective in treating liver fibrosis. World Journal of Gastroenterology. 18 (10), 1048 (2012).
- Yousefi, F., Ebtekar, M., Soleimani, M., Soudi, S., Hashemi, S. M. Comparison of in vivo immunomodulatory effects of intravenous and intraperitoneal administration of adipose-tissue mesenchymal stem cells in experimental autoimmune encephalomyelitis (EAE). International Immunopharmacol. 17 (3), 608-616 (2013).
- Cheng, K., et al. Transplantation of bone marrow-derived MSCs improves cisplatinum-induced renal injury through paracrine mechanisms. Experimental and Molecular Pathology. 94 (3), 466-473 (2013).
- Castelo-Branco, M., et al. Intraperitoneal but not intravenous cryopreserved mesenchymal stromal cells home to the inflamed colon and ameliorate experimental colitis. PLoS One. 7 (3), 33360 (2012).
- Bazhanov, N., et al. Intraperitoneally infused human mesenchymal stem cells form aggregates with mouse immune cells and attach to peritoneal organs. Stem Cell Research & Therapy. 7, 27 (2016).
- Liu, Q., Chen, L., Atkinson, J. M., Claxton, D. F., Wang, H. G. Atg5-dependent autophagy contributes to the development of acute myeloid leukemia in an MLL-AF9-driven mouse model. Cell Death & Disease. 7 (9), 2361 (2016).
- Wognum, A. W., Eaves, A. C., Thomas, T. E. Identification and isolation of hematopoietic stem cells. Archives of Medical Research. 34 (6), 461-475 (2003).
- Randall, T. D., Weissman, I. L. Characterization of a population of cells in the bone marrow that phenotypically mimics hematopoietic stem cells: resting stem cells or mystery population. Stem Cells. 16 (1), 38-48 (1998).
- Gott, K. M., et al. A comparison of Cs-137 gamma rays and 320-kV X-rays in a mouse bone marrow transplantation model. Dose Response. 18 (2), 1559325820916572 (2020).
- Miner, N. A., Koehler, J., Greenaway, L. Intraperitoneal injection of mice. Applied Microbiology. 17 (2), 250-251 (1969).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor Protocols. 2014 (6), 655-658 (2014).
- Ronan, J. L., Wu, W., Crabtree, G. R. From neural development to cognition: unexpected roles for chromatin. Nature Review Genetics. 14 (5), 347-359 (2013).
- Qian, F., et al. Interleukin-4 treatment reduces leukemia burden in acute myeloid leukemia. FASEB Journal. 36 (5), 22328 (2022).
- Krivtsov, A. V., et al. Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature. 442 (7104), 818-822 (2006).
- Chen, W., et al. Malignant transformation initiated by Mll-AF9: gene dosage and critical target cells. Cancer Cell. 13 (5), 432-440 (2008).
- Somervaille, T. C. P., Cleary, M. L. Identification and characterization of leukemia stem cells in murine MLL-AF9 acute myeloid leukemia. Cancer Cell. 10 (4), 257-268 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。